Сапожников С.З. Китанин Э.Л. Техническая термодинамика и теплопередача
Подождите немного. Документ загружается.

91
Работа цикла ГТУ
()
()
.
1
11
1
1
11
⎟
⎠
⎞
⎜
⎝
⎛
ε
−−ρβ=η=
−
−
k
kk
p
G
t
G
t
Tcql
(1.103
Из формул (1.102) и (1.103) видно, что значения
G
t
G
t
lиη тем
выше, чем больше значение k. Это приводит к мысли использовать
в качестве рабочего тела одноатомные гелий или аргон. Такой цикл
обязательно будет замкнутым, поэтому давление р
4
= р
1
можно
поднять значительно выше атмосферного; это сделает ГТУ гораздо
компактнее, что для транспортных систем немаловажно. Однако
замена рабочего тела потребует установить теплообменники как
для подвода теплоты q
1
, так и для отвода теплоты q
2
что неизбежно
усложнит конструкцию ГТУ.
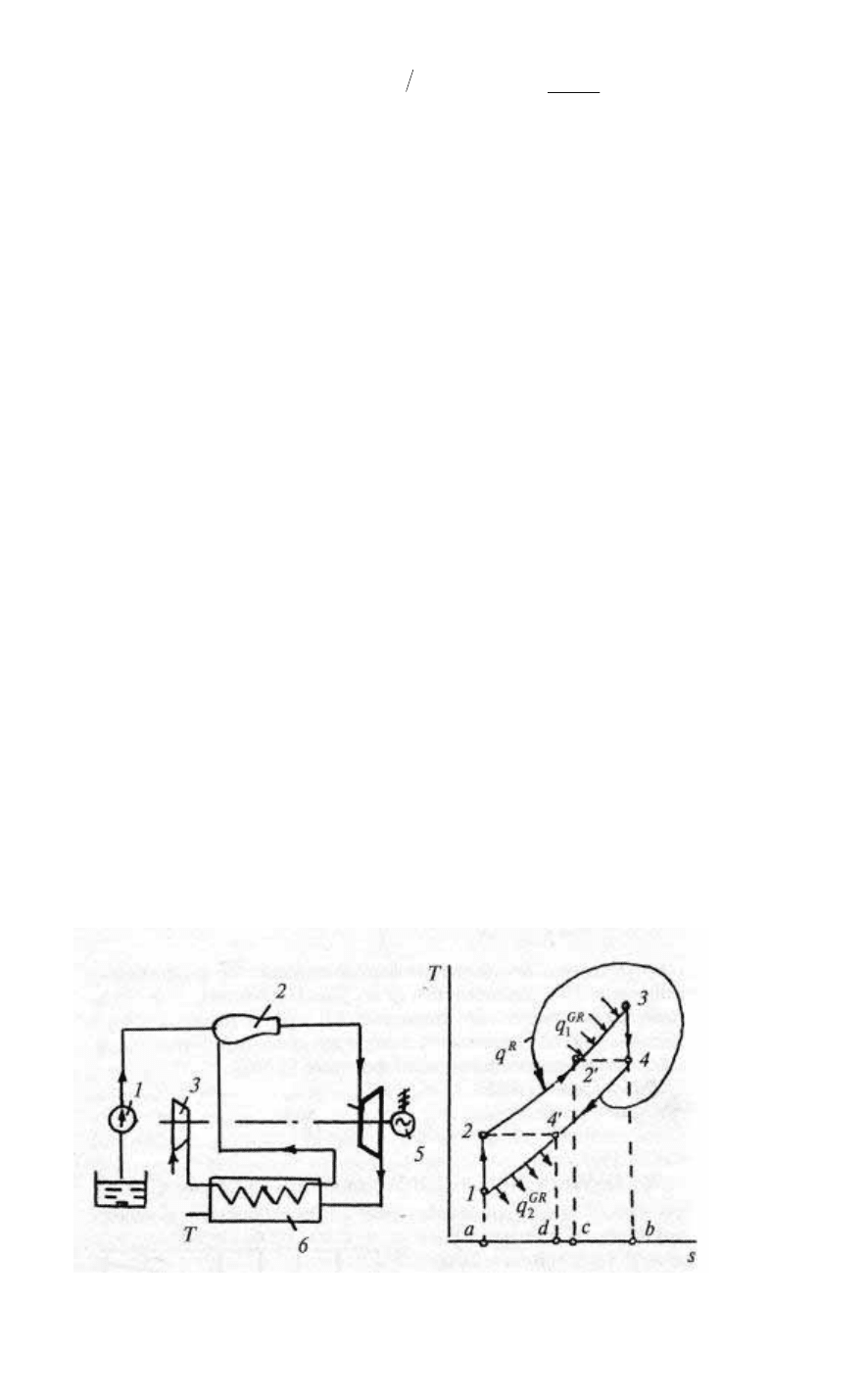
1.7.3. Регенеративный цикл ГТУ
На лопатках турбины ГТУ газ расширяется полнее, чем в
цилиндре поршневого ДВС, однако его температура на выходе из
турбины Т
4
все еще заметно превышает температуру Т
1
окружающей среды (см. рис. 53). Если поток продуктов сгорания
привести в соприкосновение (без смешения) с потоком воздуха,
сжатого в компрессоре, то эффективность ГТУ повысится; такой
цикл ГТУ называют регенеративным. Схема ГТУ с регенерацией
теплоты (рис. 55) включает теплообменник
Рис. 55 Рис. 56
92
(регенератор) 6, в котором продукты сгорания отдают
теплоту
R
q сжатому воздуху (все прочие обозначения
соответствуют рис. 52).
Рассмотрим регенеративный цикл ГТУ, считая, что теплота
выхлопных газов полностью передается сжатому воздуху (рис. 56).
Без регенерации подведенная теплота
1
q
определялась бы
площадью под кривой 2–3 (пл. а23б), а отведенная q
2
— площадью
под кривой 2–3 (пл. а14б). В регенеративном цикле газ после
компрессора нагревается от температуры Т
2
до
2
T
′
= Т
4
. Выхлопные
газы из турбины, отдавая теплоту сжатому воздуху, охлаждаются,
но при этом, в соответствии со вторым началом, их температура не
может опуститься ниже
2
T
′
= Т
4
. В регенеративном цикле для
камера сгорания
топливо
воздух
компрессор
турбина
эл.генератор
выхлоп
1
2
3
4
5
6
2
3
2
1
T
s
4
5
6
2д
4д
a
b
c
d
T
4д
-Т
5
>0
Т
6
-T
2д
-
>0
T
3

93
подогрева газа до температуры Т
4
потребуется подвести теплоту
GR
q
1
, эквивалентную пл. с2'Зб, которая, конечно, меньше, чем
теплота
1
q в цикле без регенерации. Меньше теплоты отдается и в
окружающую среду: эта величина
GR
q
2
эквивалентна пл. а14'd и
ниже, чем q
2
Термический КПД регенеративного цикла ГТУ
(
)
()
.111
23
14
23
14
1
2
TT
TT
TTc
TTc
q
q
p
p
GR
GR
GR
t
′
−
−
′
−=
′
−
−
′
−=−=η
(1.104)
В случае полной регенерации теплоты
2
T
′
= Т
4
,
4
T
′
= Т
2
.
Подставим в уравнение (1.104) значения температур Т
2
и Т
4
,
вычисленные по формулам, указанным в разд. 1.7.2; получим
(
)
()
.
1
1
1
43
12
4
1
43
12
−
−
⋅=
−
−
−=η
TT
TT
T
T
TT
TT
GR
t
Но в адиабатных процессах 1–2 и 3–4
,;
1
1
1
2
1
2
1
4
3
4
3
k
k
k
k
k
k
p
p
T
T
p
p
T
T
−
−
−
β=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=
а в изобарных процессах 2–3 и 4–1 р
3
=р
2
, p
4
=p
1
, поэтому Т
2
/Т
1
=
Т
3
/Т
4
, и
,
1
1
1
1
1
11
1
max
1
2
2
4
1
4
2
1
k
k
GR
t
T
T
T
T
T
T
T
T
−
βγ
−=
⋅
−=−=−=η
(1.105)
где 1
14max
>=γ TT — степень подогрева воздуха за счет
регенерации (индекс “mах” означает, что теплота продуктов
сгорания используется полностью).
Сравнение формул (1.105) и (1.102) показывает, что
регенерация повышает термический КПД ГТУ:
,
G
t
GR
t
η>η
что вполне объяснимо: при регенерации среднеинтегральная
температура подвода теплоты повышается, среднеинтегральная
температура отвода понижается, поэтому эквивалентный цикл
Карно совершается в большем интервале температур.

94
При анализе мы предполагали, что теплота выхлопных газов
полностью возвращается в цикл, а сжатый воздух может быть
нагрет до температуры газов, выходящих из турбины. В
действительности нагреть воздух до максимальной температуры
выхлопных газов не удается. Это несколько снижает прирост
термического КПД; тем не менее, регенерация теплоты в цикле
Брайтона заметно повышает эффективность ГТУ.
1.7.4. Эффективность реальных циклов
Эффективность реальных циклов поршневых ДВС и ГТУ
существенно меньше, чем определенная через их термические КПД,
поскольку циклы состоят из реальных, а значит, необратимых
процессов.
Причиной необратимости может быть рассеяние энергии за
счет трения при течении рабочего тела в межлопаточных каналах
ГТУ, в коллекторах, клапанах и цилиндрах ДВС, в подшипниках,
трансмиссии и т. д. В КПД таких циклов правильнее вводить не
физическую работу l, а действительную
r
l
(от англ. rеаl —
действительная). Вычисленный таким образом КПД называют
внутренним КПД цикла
i
η (от англ. intеrnal):
.
1
q
l
r
i
=η
Однако если, например, 4,0
=
η
i
, то невозможно сказать,
“хороший” это цикл или “плохой”: неясно ведь, в какой мере
связана величина
i
η с необратимыми потерями в цикле, а в
какой — с уровнем температур горячей и холодной сред.
Представим величину
i
η
, по-другому:
.
1
toit
rr
i
l
l
lq
ll
ηη=η==η
(1.106)

95
Здесь
l
l
r
oi
=η — внутренний относительный КПД, он
характеризует влияние необратимости процессов на эффективность
преобразования теплоты в работу и численно равен отношению
действительной работы цикла к теоретически возможной.
Поскольку в любом цикле, согласно первому началу,
,dd
т
lpvvpl =−==
∫
∫
(1.107)
значение
oi
η можно определить как через физическую работу l, так
и через работу техническую l
т
. Выбор определяется только
удобством расчетов: для циклов ГТУ удобнее использовать l
т
, а для
циклов ДВС — l.
Ясно, что в цикле ГТУ (см. рис. 53) действительная
техническая работа
,
2-т14-т3т
rrr
lll −=
(1.108)
где
rr
ll
2-т14-т3
, — действительная техническая работа турбины и
компрессора, соответственно.
Поскольку 0,0
2-т14-т3
<>
rr
ll , равенство (1.108) следовало бы
представить в форме
;
2-т14-т3т
rrr
lll −=
знак модуля далее опускаем исключительно в силу традиции.
Величины
rr
ll
2-т14-т3
и свяжем с технической работой обратимых
процессов расширения и сжатия
2-т14-т3
и ll
:
(
)
;
43430
4-т3
4304-т3
hhll
ii
r
−η=⋅η=
−−
(1.109)
,
210
12
210
2-т1
2-т1
−−
η
−
=
η
=
ii
r
hh
l
l
(1.110)
где
210430
,
−
−
ηη
ii
— относительные внутренние КПД турбины и
компрессора, соответственно.

96
Значения
210430
и
−
−
ηη
ii
определяют теоретически или
экспериментально; оба способа сложны и выходят за пределы
нашего курса. Далее полагаем, что эти величины заранее заданы.
Поскольку в любом случае 1,1
210430
<
η
<
η
−
−
ii
из формул
(1.109) и (1.110) следует, что
:,
2-т1
2-т1
4-т3
4-т3
llll
rr
><
необратимость
уменьшает техническую работу расширения и увеличивает
техническую работу сжатия.
Вычислим теперь
G
i0
η , для всего цикла ГТУ, используя
равенства (1.108)-(1.110):
()
()()
()
()()
.
1243
210
12
43430
1243
210
12
43430
0
TTTT
TT
TT
hhhh
hh
hh
i
i
i
i
G
i
−−−
η
−
−−η
=
−−−
η
−
−−η
=η
−
−
−
−
(1.111)
Для современных турбин и компрессоров
90,0...86,0,92,0...88,0
210430
=
η=η
−− ii
. Положим
9,0
210430
≈η=η
−− ii
и рассчитаем значение
G
i0
η . Для цикла со
степенью повышения давления β = 8. По формуле (1.102) найдем,
что 448,0
0
=η
G
i
, а расчет по формуле (1.111) даст 665,0
0
=η
G
i
,
поэтому .298,0665,0448,0 =⋅=η
G
i
Однако значение
G
i0
η не учитывает потерь энергии на трение в
подшипниках, элементах трансмиссии и т. д. Если каждый из n
элементов ГТУ имеет КПД
j
η
то эффективный КПД установки
∏∏
==
ηη=ηηη=η
n
j
j
G
i
n
j
j
G
t
G
i
G
e
11
0
(1.112)
(символ
∏
=
n
j 1
означает произведение всех
j
η
от j = 1 до j =n).
Полученному выше значению
G
i
η и реальным
j
η
соответствует 27,0=η
G
i
т. е. только 27 % теплоты сгорания
топлива преобразуется в полезную работу ГТУ.
Аналогично рассчитывают значение
e
η
для циклов ДВС. Так,
например, для ДВС, работающего по циклу Отто (см. рис. 44),

97
()
()()
()
()()
,
1243
210
12
43430
1243
210
12
43430
0
TTTT
TT
TT
eeee
ee
ee
i
i
i
i
O
i
−−−
η
−
−−η
=
−−−
η
−
−−η
=η
−
−
−
−
(1.113)
где
210430
,
−
−
ηη
ii
— относительные внутренние КПД процессов
расширения и сжатия рабочего тела в цилиндре, соответственно.
Методика расчета не меняется. Для ДВС со степенью сжатия ε
= 8 при
85,0
210430
≈η≈η
−− ii
получаем 62,0
0
=η
O
i
, 565,0=η
O
t
,
откуда 35,0=η
O
i
. Эффективный КПД будет еще ниже:
.31,0...28,0=η
O
e
Эффективный КПД цикла Дизеля определяют по сходной,
хотя и более громоздкой формуле; при ε = 14 получаем
.34,0...30,0≈η
D
e
Необратимость меняет ход процессов расширения и сжатия на
диаграммах состояний (как уже отмечалось, необратимые процессы
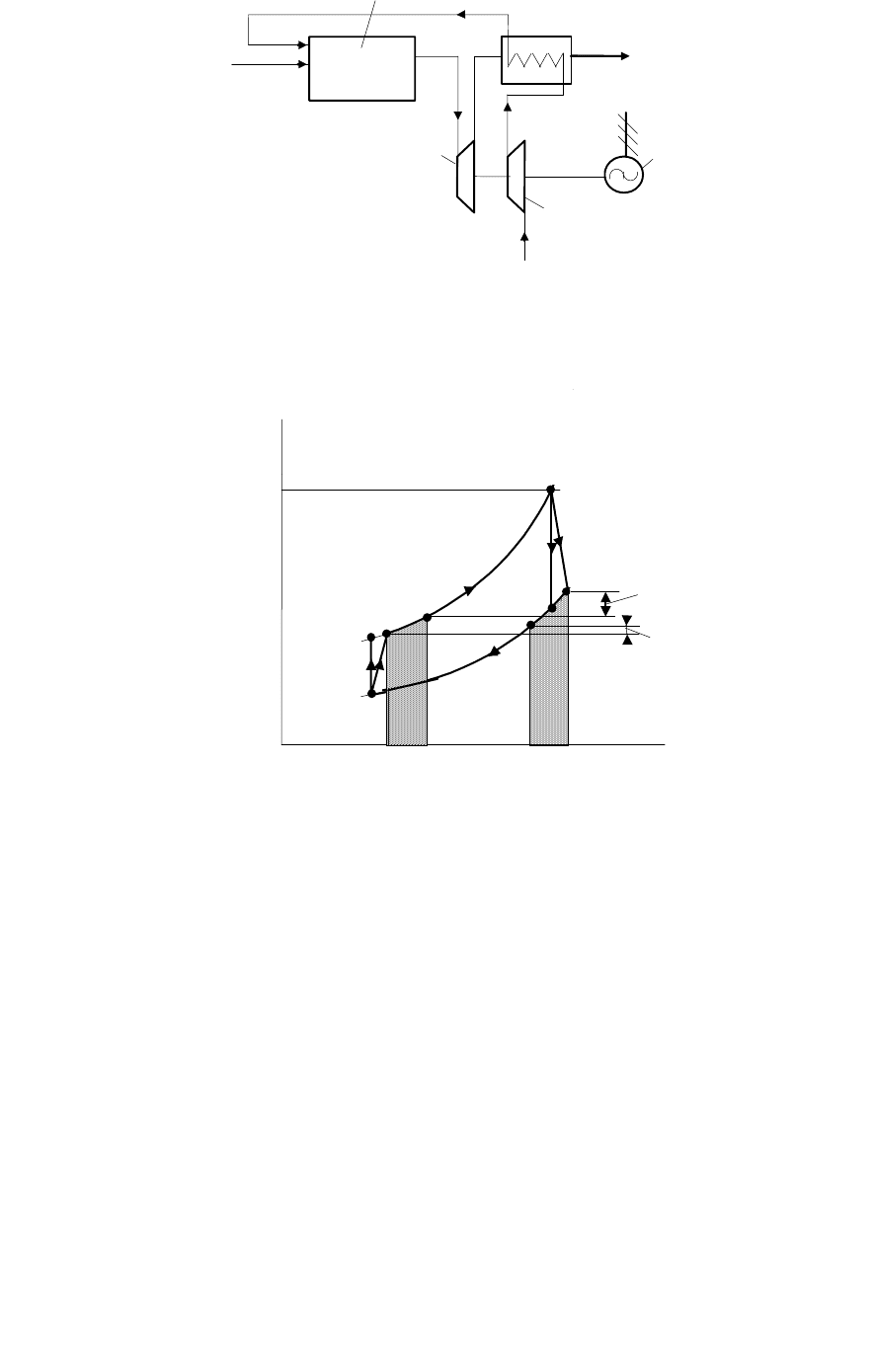
можно изображать на этих диаграммах только условно). На рис. 57
показаны циклы ГТУ: обратимый 12341 и необратимый (реальный)
12
R
34
R
1. В реальном цикле кривые расширения и сжатия
отклоняются от изоэнтропийных вертикалей: в соответствии со
вторым началом, энтропия в необратимых адиабатных процессах 1–
2
R
и 3–4
R
возрастает. Площади криволинейных трапеций пл. a13
R
b и
пл. c34
R
d эквивалентны потерям теплоты на трение. Поскольку
процессы1–2
R
и 3–4
R
адиабатны, теплота трения в окружающую
среду не отводится, а целиком возвращается в поток рабочего тела.
Аналогично “деформируются” необратимые циклы ДВС: адиабаты
расширения и сжатия отклоняются от линий s = const.
98
T
s
1
2
3
4
2
д
4
д
p
1
=p
oc
p
2
p
3
p
4
T
3
Рис. 57.
Полученные выше зависимости носят универсальный
характер и могут быть, в частности, использованы для оценки
эффективности циклов паросиловых установок (см. разд. 1.9). При
этом, правда, в формулах вида (1.111) и (1.113) должны стоять
только значения энтальпии и внутренней энергии: замена
TceTch
vp
∆=∆∆=∆ , справедлива лишь для совершенного газа.
1.8. ТЕРМОДИНАМИКА РЕАЛЬНЫХ РАБОЧИХ ТЕЛ
1.8.1. Уравнение состояния реальных газов
При относительно невысоких давлениях и не слишком низких
температурах уравнение Клапейрона-Менделеева удовлетвори-
тельно описывает состояние большинства газов. Однако с
повышением давления или при снижении температуры расчет по
уравнению (1.5) дает существенные отклонения от действительных
термических параметров. Жидкое и парообразное состояние
вещества вообще не может быть описано уравнением этого типа.
В 1873 году голландский физик И. Ван-дер-Ваальс предложил
термическое уравнение состояния, в котором попытался учесть
99
отличия реальных газов от модели, заложенной в уравнение
Клапейрона-Менделеева:
()
RTbv
v
a
p =−
⎟
⎠
⎞
⎜
⎝
⎛
+
2
(1.114)
Здесь поправка b учитывает, что молекулы имеют
собственный объем, а сжатие или расширение газа может идти
только за счет изменения межмолекулярных расстояний. Величина
a/v
2
учитывает дальние взаимодействия молекул, т. е. некоторое
“внутреннее” давление в термодинамической системе.
Коэффициенты а и b для каждого вещества Ван-дер-Ваальс считал
постоянным.
Рис. 58 Рис. 59
p
v
v
кр
p
кр
t<t
кр
t=t
кр
a
b
c
кр
t>t
кр
t
2
t
1

100
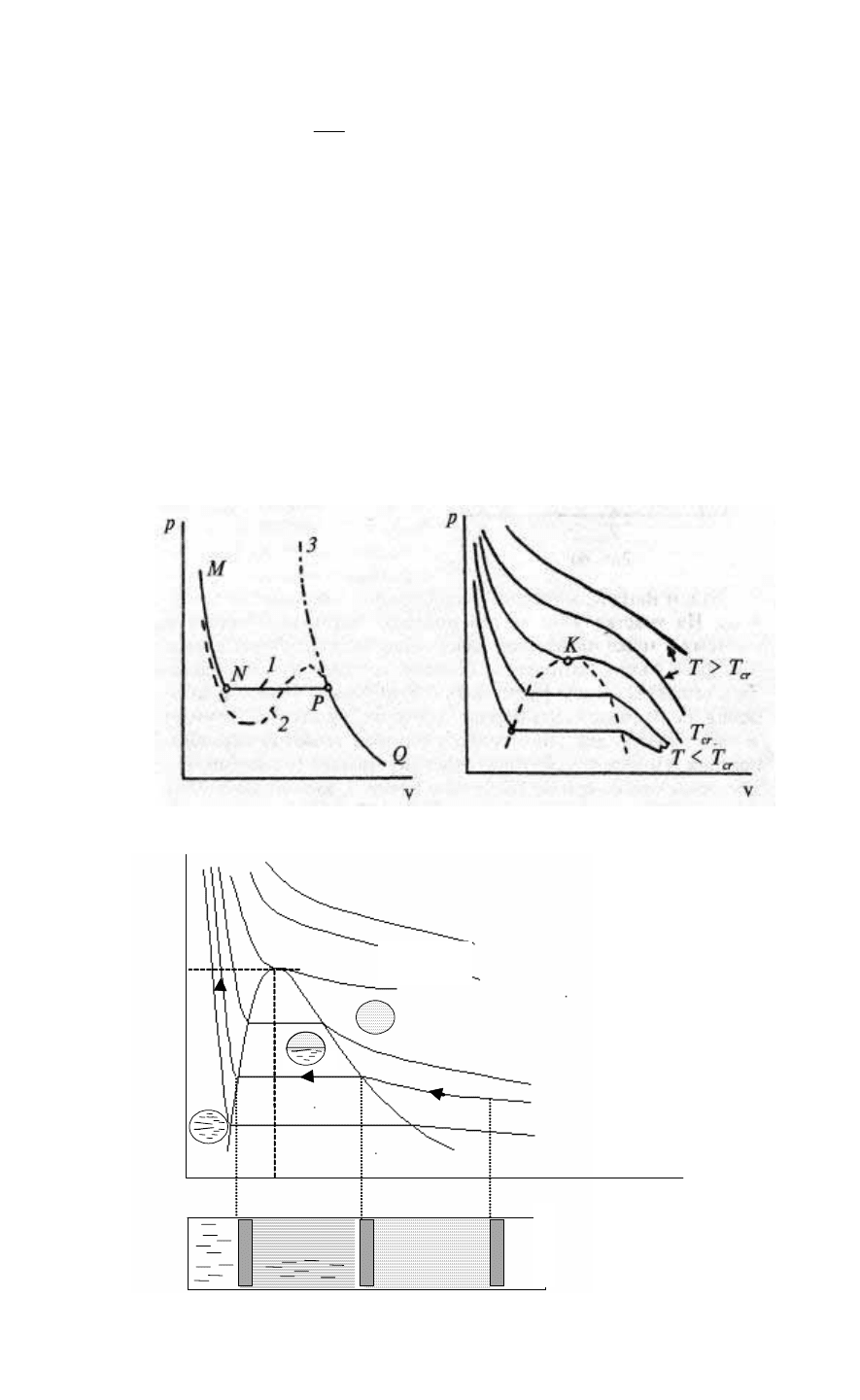
Сравним изотермы, рассчитанные по уравнениям (1.5) и
(1.114), с изотермами одного из реальных веществ, например, воды
(рис. 58). Изотерма идеального газа 3 совпадает с
экспериментальной кривой MNPQ только при больших значениях v
и малых р. Изотерма Ван-дер-Ваальса 2 дает лучшее совпадение, но
на среднем участке имеет “волну”, не подтверждаемую
экспериментом. Отметим, что отрезок MN реального
изотермического процесса 1 находится в области жидкого
состояния вещества, отрезок Р–Q — парообразного, а отрезок
NP — в области, где одновременно присутствуют как жидкость, так
и пар.
Уравнение Ван-дер-Ваальса для точных оценок непригодно,
но, в отличие от уравнения Клапейрона–Менделеева,
94
может описать поведение веществ, находящихся в жидком
или парообразном состоянии. Существуют и другие уравнения
состояния (Бертло, Дитеричи, Камерлинг–Оннеса, Боголюбова и
Майера, Вукаловича и Новикова), однако ни одно из них не
является “всеобщим”. Диаграммы состояний и расчетные таблицы
строят по экспериментальным данным и уравнениям состояния для
реальных веществ.
Для большинства реальных рабочих тел диаграмма состояний
р–v имеет вид, представленный на рис. 59. На ней выделяется точка
К, в которой изотерма имеет перегиб. Точку К впервые обнаружил
Д.И. Менделеев, сейчас ее называют критической точкой, а
Рис.9.3
р
v
T
кр
T
1
T
2
T>T
кр
3
1
p
кр
кр
a
c
b
2
d
