Петров А.А., Бальян X.В., Трощенко А.Т. Органическая химия: Учебник для вузов
Подождите немного. Документ загружается.

Схе
м
11
1,
ПромышлеНllое
иt'пользоваllие
MeTalla
IIJIH~:TMH~~c.:I"
"УI'ИII'"II"t""'''''''Ш
<:11;:')11
t
СО+
II~
~IIIIТ~'.'·I·H.'.
1111;Шlюi·1
'·н;'
~'HiК}I
(1)'-';tI'IЮlltl~1
1IIIС'МI"III.rt~'lllюс.:1"I.)
IIC==<:II
+
II~
HI1'-'·ГlI:ll'll
Il/flИJ.lJ'1:I
N()~(:ICI11(>II);:~CII;IN()~
IIII'M~'
J
11)1111111"1
РIIМ~'ТiШ
~
f~:fr'f.IiI·IX
/"1,11.'
/I~·Щt·С·IIIН
"
""""'!
:;,.
(<:11::
I~SiCI~
:UIM'-'ТII.'I:UIXJIIЧIt'IIJIНII
'·IIJJIIKOllld
(1·.11.
Н
.
.о1)
IIIIТ!ИII\НIIII,-'
:\:11;,
11:-\0.1
CI12C1~
Х.'IIIIIItС"ГI,IЙ
M'-'TII.'I'-'II
(:t~
х.'LIIIШIЮlli'lllll~'
СIЮ::
Х!IIII"lфl'РМ
II<:N
111::=':11.
lIi:=<:II-СN
,-'Ш11
IJII.mНl
ЮI4.:JICI1"Н
""IIIIJ"'l'ПfIl'"
CIIIIT<.'TII',,-'('КII,-'IIIIJIIIКIIII,
IIIПI)lIЛ.
1IIIТjIlULl.IIIJЙ
КitY'IYK
CCI
1
'll'll,lp'-'хXJlCIl'щ··'
....
Н
YI·Jll'I'HjL
!"I.'
(T~CI~
ФI''-'1I11·11
(
XJI/ЩНI\'IП
I
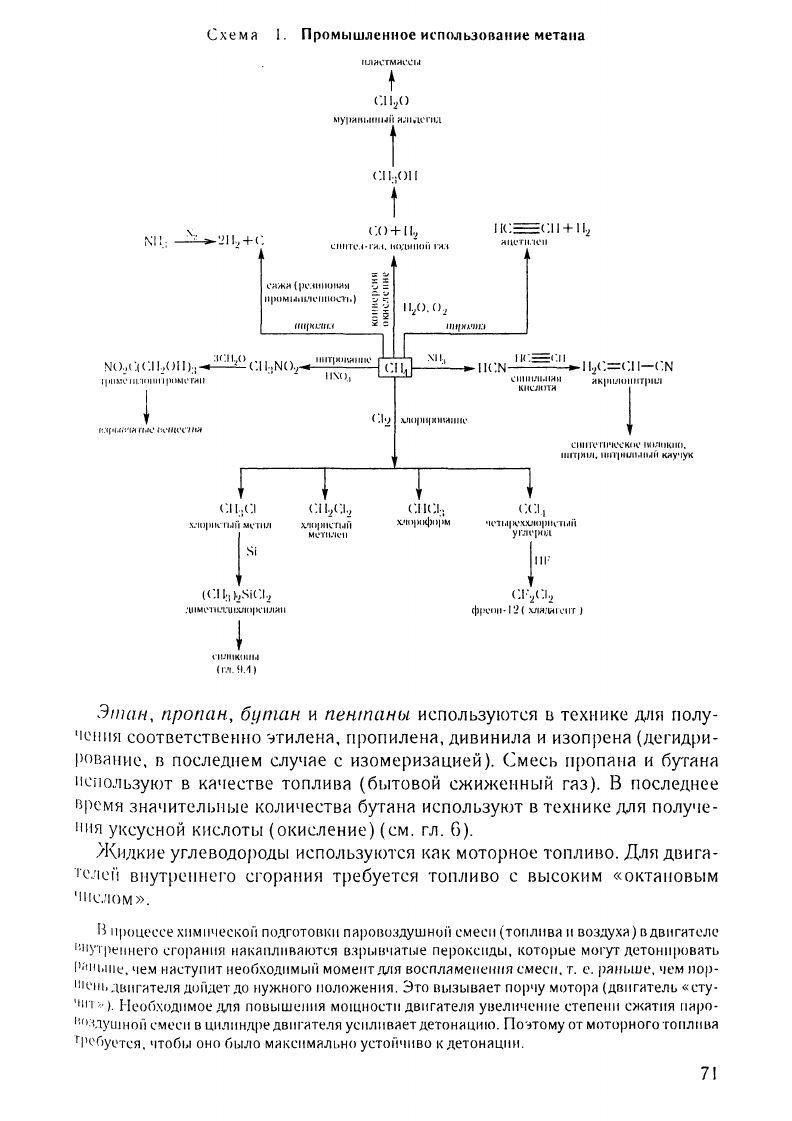
Эll1ан,
nропан,
6уm.ан
и
nенmаны
испо.лЬЗУIOТбl
в
технике
ДJЩ
полу
'1('111151
соответственно
'Jтилеш\,
пропилеНR,
ДИВИНИJIR
и
изопреНR
(дегидри
РОВi1f1ие,
в
последнем
с.лУЧRе
с
изомеризацией),
Смесь
ПРОПRна
и
БУТЯНR
IIСПОJlЬЗУЮТ
В
KR'lecTBe
ТОПЛИВR
(бытовой
сжиженный
гяз),
в
последнее
Время
значитеЛЫlые
КОJlичества
БУТRНR
используют
в
технике
ДJlЯ
ПОЛУ'lе-
111151
УI<СУСНОЙ
кислоты
(окисление)
(см,
гл,
6),
>Кидкие
углеводороды
ИСПОJlЬЗУЮТСЯ
как
моторное
топливо,
Д,flЯ
ДI3ИГR
T(',;leii
внутреllнего
сгорнния
требуется
ТОПJlИВО
с
высоким
«ОКТНIЮВЫМ
'1I1l'.!IOM»,
в
11роцессе
XIIMII'IeCJ{oi'l
ПОДГОТОВЮI
ПИРОlIuздушнui'1
CMeCII
(ТОflЛIIВИ
11
воздухи)
ВДВIIГЮСЛС
ВIIУТРСlIнего
СI'ОР1IIШЯ
Н1I1\1Il1ЛНR1IIOТСЯ
B:iPblB'I<!Tble
перОJ\СI1ДЫ,
I{оторые
могут
детонщювитu
Р,'IЩllе,
чем
Н<!СТУI111Т
неоfiХОДIIМulii
момент
Д/IЯ
ВОСПJlЯМСllеlНfЯ
CMeClI,
Т,
е,
pilllblur,
'!ем
1101'-
IlIl'III';ШIIГilТСJ1Я
доi'щет
дО
НУЖIIОГО
lIоложеНllЯ,
Это
lIЫЗЫВllет
пор'lУ
мотор<!
(ДВIIГilтелu
"сту·
'IIIT>,),
НеО()ХUДlIмое
ДЛЯ
повышеllНЯ
МОЩНОСТII
ДВllг,пеJIЯ
Уl!еЛII'lСlше
cтenellll
СЖ1lТIIЯ
l'IilРО
В<>:Цушноi'll'МСCJI
в
Цllmlндре
ДВIIП1ТСЛЯ
УСIIЛlIВ1Iет
деТОН<!IЩЮ,
Поэтому
от
моторного
ТОI1Л1\l111
'ГРС('Уl'ТСЯ,
IITO()I,I
ОНО
fiыло
МiН(СIIМ1IЛL,НО
YCToii
1
l11BO
I{
деТОН1IЦIНI,
71

Наиболее
легко
детоиируют
углеводороды
с
нормальным
строением.
Дnя
того
чтобы
сравнить
способность
к
детонации
различных горючих
материалов,
построили
специальную
шкалу.
За
нуль
в
этой
шкале
принят
н-гептан,
за
100
-
изооктан.
Если
исследуемое
топли
во
детонирует
так же, как
смесь
76%
изооктана
и
24%
н-гептана,
то
топливу
присванвают
октановое
число
76.
В
настоящее
время
в
качестве
топлива
для
легковых
автомобилей
испо
льзуется
бензин
с
октановыми
числами
72, 76, 93, 95.
Дnя
получения
высокооктановых
бензинов
в
технике
про
водят
крекинг
нефтяных
фрак
ций
в
присутствии
катализаторов.
Изооктан
может
быть
получен
из
изобутана.
Высшие жидкие
и
твердые
парафины
используются
как
топливо
(ди
зельное),
смазочный
материал,
в
виде твердого
парафина,
озокерита
и
т.
д.
2.
ЭТИЛЕНОВblЕ
УГЛЕВОДОРОДbI
(дЛКЕНЫ,
ОЛЕФИНbI)
Этиленовыми
углеводородами
(алкенами
или
олефинами)
называют
такие
углеводороды,
в
молекуле
которых
содержатся
углеродные
атомы,
затрачивающие
на
соединение
с
соседним
углеродным
атомом
две
валент
ности,
т.
е.
образующие
двойную
связь
между
соседними
sр2_
ги
бридизо
ванными
атомами
углерода.
Этиленовые
углеводороды
образуют
гомологический
ряд
с
общей
фор
мулой
СпН
2п
,
родоначальником
которого
является
этилен
СН
2
=СН
2
.
Строение
молекулы
этилена
изображено
на
рис.
19.
Изомерия.
Номенклатура
Структурная
изомерия
начинается
в
этом
ряду,
как
и
в
ряду
предельных
углеводородов,
с
члена
ряда
С
4
,
однако
число
изомеров
значительно
больше.
Таблица
4.
Зависи
мость числа
CTPYK1YpllbIX
изомеров
олефИIIОВ
от
числа
углеродных
атомов
ЧИСJ10
УГJ1СРОДIIЫХ
72
атомов
1
2
3
4
5
6
7
8
9
Число
изомсров
ОJ1ефИНОII
3
5
13
27
66
154
Данные
о
числе
структурных
изомеров
ДlJЯ
первых
девяти
членов
ряда
приведены
в
табл.
4.
Наряду
с
изомерией,
связанной
со
строением
углеродной
цепи,
в
ряду
олефинов
наблюдается
структурная
изомерия,
обусловленная
положени
ем
двойной
связи
в
цепи.
Кроме
того,
в
ряду
оле
финов
имеет
место
пространственная
(геометри
ческая),
так
называемая
цuс-транс-изомерия,
цuс-Изомеры
содержат определенные
(в
частном
случае
одинаковые)
атомы
или
группы
атомов
при
углеродах
с
двойной
связью
по
одну
сторону
от
плоскости
этой
связи,
транс-изомеры
-
по
разные
стороны:
нзс"с=~Н:!
H:1c"c=c(H
Н/
"Н Н/
СН
з
цuс-2-бутен
mранс-2-бутен
Существование
геометрической
цис-транс
изомерии
в
ряду
олефинов
связано
с
тем,
что
7t-СВЯЗЬ
не
допускает
свободного
вращения
во
круг
оси
О'-связи
между
двумя
углеродными
ато-

мами.
Переход
одного
геометрического
изомера
в
другой
возможен
лишь
при
высоких
температурах,
когда
энергия
теплового
движения
достаточна
ДJlя
разрыва
1t-связи,
при
освещении
благодаря
поглощению
световой
энергии
или
при
действии
катализаторов,
также
ослабляющих
1t-СВЯЗЬ.
Обозначение
геометрических
изомеров
как цис-
и
транс-форм
в
более
сложных
случаях
встречает
затруднение.
Примером
может
служить
геометрическая
изомерия
I·бром,
l·хлор·2.фтор·2,иодэтена:
Br"c=c(F
CI/
I
Е-изомер
Z-изомер
Для
таких
случаев
пред.nожена
номенклатура,
включающая
понятие
старшинства
заме
щающиХ
групп.
В
зависимости
от
расположения
старших
групп
один
из
изомеров
обознача
ется
Kal<
Е
(от
нем.
Entgegen -
напротив),
а
другой
-
Kal<
Z
(от
нем,
Zuzammen
-
вмес
те).
В
Z,изомере
старшие
замесппели расположены
по
одну
сторону
от
плоскости
п-связи,
В
Е·изомере
-
по
разные.
СтаРШl1НСТВО
групп
определяется
атомным
номером
элемента,
атом
которого
связан
с
атомом
углерода
ДВОiiНОl1
СВЯЗI1.
а
пр"
одном
11
том
же
элементе
атомными
номерами
следую·
щих
элементов
вдоль
цеПl1
заместителя.
Ниже
приведен
ряд
заместителей
в
порядке
возрас
таШ1Я
старшинства:
Н
<
СНа
<
СН
2
-сн
з
<
СН=СН
2
<
С$СН
<
СНН"
<
CsN
<
СН
2
ОН
<
<
СНО
<
СО
ОН
<
NH
2
< ОН <
ОСН
З
< F <
СI
<
Вг
<
1.
По
этой
номенклатуре
Цllс·2-бутеlJ
является
Z,изомером,
а
транс-2-бутен
-
Е,изомером.
Названия
олефинов
по
систематической
номенклатуре
образуют
из
на
званий
аналогично
построенных
парафинов,
заменяя
суффиксы
-ан-
на
ен.-,
причем
цифрой
показывают
положение
двойной
связи
(после
какого
атома
идет
двойная
связь).
За
главную
цепь
принимают
самую
длинную
цепь
с
двойной
связью.
Нумерацию
углеродных атомов
начинают
с
того
конца
цепи,
к
которому
двойная
связь
ближе.
Для
первого
члена
ряда
со
храняется
и
тривиальное
название
-
этилен.
В
разговорной
речи
иногда
употребляются
тривиальные
и
старые
рациональные
названия
олефинов,
Так,
например,
олефины
часто
называют
как
алкилзамещенные
родонача
льника
ряда
-
этилена
или
по
соответствующему
парафину,
меняя
окон
чание
-ан
на
-uлен.
Приведем
названия
нескольких
углеводородов:
СН
2
=СН
2
этен,
этилен
CH
2
=CH-СН
з
пропен,
метилэтилен,
пропилен
СН
2
=СН-СН
2
-СН:
1
l-бутен,
этилэтилен,
бутилен
CH:1-CH=CH-CH:
1
2-бутен,
CUAlAt-ДlIмеТИЛЭТlIлен,
псевдобутилен
CI·1
2
=C-CII.\
I .
СН
З
2,меТJlлпропен,
heCU.llAt-ДI1меТlIлэтилен,
изобутилен
СН2=СН-СН2-СН2-СН:I
СНз-СН=СН-СН~-СНз
СНгСН
-уН-П
1:\
СН
з
I·пентен,
пропилэтилен,
амилен
2·
пентен,
CIl.lI.4t -
метилэтилэтилен
З-метил·l-бутен,И30пропилэтилен
73

CH:1-СН=r-
СНз
2-метил-2-бутен,
триметилэтилен
СНз
СН
З
-СН
2
-С=СН
2
2-метил-l-бутен,
I
heCU,lLlI-метилэтилэтилен
СН
з
I
~
~
i '
Ji.
7
J!.
СН
LH
ё
LH
СН
LH
СН
LH
3-mреm-бутил-7-метил-2-0ктен
:1
=
1-
2-
2
2-1
-
з
НзС-С-СН
з
СНЗ
tн
з
Следует
заметить,
что
в
русской
литературе
до
последнего
времени
цифру,
укззываюшую
положение
двойной
связи,
ставили
после
окончания
-ен,
что
создавало
неудобства
при
склонении
названий
углеводородов.
Непредельные
углеводородные
радикалы
называют,
добавляя
к
корню
суффикс
-енил:
этенил
СН
2
=СН-,
1-пропенил
СНз-СН=СН-,
2-пропенил
СН
2
=СН-СН
2
-.
Укоренились
некоторые
эмпирические
названия:
винил
СН
2
=СН-,
аллил
СН
2
=СН-СН
2
-,
изопропенил
CH
2
=C-СН
з
,
кротил
СН
з
-СН=СН-СН
2
-.
I
Способы
получения
Олефины
встречаются
в
некоторых
нефтях.
Особенно
велико
их
содер
жание
в
канадской
нефти.
В
чистом
виде
из
нефти
вьщелены
углеводороды
от
C
6
H
I2
до
С
1з
Н
26
.
1.
Первые
четыре
члена
ряда
олефинов
получают
в
технике
в
чистом
состоянии
разгонкой
под
давлением
или
при
пониженной
температуре
га
зообразной
части
продуктов
крекинга
нефтяных
дистиллятов,
а
также
из
газов
коксования
(этилен,
пропилен
).
Некоторые
олефины
для
технических
целей
нужны
в
больших
количе
ствах,
чем
их
может
быть
выделено
из
газов
крекинга
и
других
промыш
ленных
источников.
Поэтому
в
технике
все
шире
применяется
получение
их
дегидрогенизацией
предельных
углеводородов.
Катализатором
этого
процесса
обычно
является
специальным
образом
приготовленный
оксид
хрома
(III):
СН,.....СН
-СН -СН
":1
~
cг
01
CH
2
=CH-СН
2
-СН
з
+
Н
2
.1
2 2 3
СНз-СН=СН-СН
з
+
Н
2
2.
Наиболее
распространенным
способом
получения
олефинов
в
лабо
раторных
УСЛО'13иях
является
дегидратация
(отщепление
воды)
спиртов:
СН
СН
Квтanизаmр~
СН
2
=СН
2
+
Н
2
О.
1
Г
1
2
[f.C~J?Hj
в
качестве
катализаторов
дегидратации
используют
различные
кисло
ты
(серную,
фосфорную),
кислые
соли
(KHS0
4
),
оксид
фосфора
(У),
ок
сид
алюминия,
соли
алюминия
и
др.
74
условия
дегидратации
зависят
от
природы
спирта.
Особенно
легко
де
гидратирУЮТСЯ
третичные
спирты:
часто
они
отщепляют
воду
уже
при
перегонке.
Порядок
отщепления
воды
в
большинстве
случаев
определяется
nра-
ВUЛО.Аt
Зайцева:
при
образовании
воды
наиболее
легко
отщепляется
во
дород
от
наименее
гидрогенизированного
атома
углерода:
4
э
2 I
~
СНэ-СН=С-СН
з
+
Н
2
О.
tн
з
2-метил-2-бутен
СН
-снон-сн-сн.
3 I
э
СНэ
в
процессе
дегидратации
двойная
связь часто
перемещается
и
строение
полученного
углеводорода
не
соответствует
строению
исходного
спирта.
Так,
например,
при
дегидратации
изоамилового
спирта
обычно
получает
ся
смесь
трех
углеводородов:
СН
э1
Н-СН
2
-СНРН
СНз
снэ-rн-сн
СН
2
СНз
СН-С=СН-СН
З
I
з
СН;I
СН:Г-Т-СН2-СНЭ
СНз
Об
изомеризации
углеродного
скелета
при
дегидратации
см.
гл.
3.
Ме
ханизм
дегидратации
спиртов
приведен
там
же.
3.
Удобным
методом
получения
алкенов
является
пиролиз
эфиров
(ацетатов)
карбоновых
кислот:
Н
OCOR
-~-~-
300-550·C~
"С=С/
+
R-COOH
I I
/"
.
Естественно,
могут
быть
использованы
только
эфиры,
имеющие
в
Р-положении
водородные
атомы.
Для
получения
высших
олефинов
испо
Льзуется
пиролиз
спиртов
в
присутствии
уксусного
ангидрида.
4.
Олефины
часто
получают
отщеплением
галогеноводородов
от
гало
генопроизводных.
Моногалогенопроизводные
дают
олефины
при
дейст
вии
щелочей
(дегидрогалогенирование):
СН
2
-СН
2
+
КОН
~CH2-CH2
+
КСI
+
Н
2
О.
I I
н
СI
Обычно
для
этих
целей
применяется
спиртовой
раствор
КОН
или
NaOH.
Однако
в
этом
случае
может
пойти
побочная
реакция
-
образо
ваНие
простого
эфира:
С
2
Н
5
ОН
+
КОН
;::t
С
2
Н
5
ОК
+
Н
2
О;
С
2
Н
5
С1
+
КОС
2
Н
5
---+
С
2
Н
5
ОС
2
Н
5
+
KCI.
75

Поэтому
иногда
отщепляют
гялогеноводород
с
помощью
твердой
из.!
мель',енной
щелочи
или
органических
основяний
-
диметилянилиня
иJl":
хинолина.
Напрявление
дегидрогалогенировяния
при
этом
соответствует
УЖе
рассмотренному
правилу
Зайцева:
CH:
1
CHBrCH
2
CH:
1
-НВг)
CH:1CH
= CHCH:
1
.
:,.
Механизм
дегидрогалогенирования
приведен
на
с.
118,
119.
5.
Для
полу',ения
олефинов
иногдя
используют
метод
отщепления
га.
логенов
от
дигалогенопроизводных
с
ятомами
галогена
у
с о
с
ед
н и х
уг
леродных
атомов.
Ранее
для
этих
цеJlей
ИСПО.llьзовяш\сь
цинковая
пыль
(или
стружки)
в
водно-спиртовой
среде:
CH~--Bг
CH~
I + ZIl
~
I + ZIlBr
2
CH~--Bг
СН
2
Однако
вероятность
изомеризяции
обрязующегося
алкеня
под
влияни
ем
галоген
ида
цинка
застави.llЯ
искать
другие
реагенты.
Среди
них
приме
няются
иодид
натрия
в
метаноле
ИJJИ
ацетоне,
соли
хрома
(II),
тиосульфат
натрия
в
диметилсульфоксиде,
алюмогидрид
лития.
Реакция
зтя
важна
как
метод,
позволяющий
временно
«защищать»
двойную
связь:
алкен
может
быть
переведен
в
дибромид,
а
затем
регенерирован.
6.
В
некоторых
слу',аях
ацетиленовые
углеводороды
с
определенным
строением
получаются
легче,
чем
отвечающие
им
по
строению
олефины.
В
таких
случаях
последние
получают
частичным
«.селективным»
гидриро
ванием
ацетиленовых
углеводородов,
например
над
паллядиевым
катализатором:
7.
В
последнее
время
ДЛЯ
синтеза
олефинов
с
концевой
двойной
свя
зью
очень
',асто
используется
реакция
Виттига:
+6
-6
(C1jH:i):ICH:1]Br + C.,H!)Li
~(CljH:i):1
р
=
СН2+
С
4
Н'II
+ Li8r
liP"MI1CTIoIH MCTIiJITpll-
фС11
ИJl(IЮСфOlll1
ii
+11
-11
-8
+8
МСТIIJll'IIТРIIФСIIIIJI
фllСфllРИl1
(CJjH;i):\
Р
=
С
Н
2
+
О
=CHC4H!)~(CljH:i):\P
=О+СН
2
=СНС
4
Н!)
IIKCII}!
ТРllфСIIIiJI-
фllСфШIИ
Физические
свойства
Первые
',етыре
',лена
гомологического
ряда
этиленовых
углеводорО
дов
-
газы.
Олефины
с
числом
углеродных
атомов
от
5
до
17
-
жидкО
сти.
Далее
идут
твердые
тела.
76

олефИНbI
с
нормялыюй
цепью
углеродных
ятомов.кипят
при
более
вы
.
кой
темперятуре,
"ем
их
изомеры
с
рязветвленнои
цепью.
Перемеще
со
двойной
связи
в
центр
молекулы
вызывяет
повышение
темперятуры
ние
еНИЯ
олефиня.
цuс-Изомеры
обычно
кипят
при
более
высокой
темпе-
кип
П.
•
IIтуре.
"ем
транс-изомеры.
еремещение
двоинои
связи
в
центр
моле-
р
лы
ПОВblшяет
темперятуру
плавления.
транс-Изомеры
плявятся при
ку.
.
более
высокои
темперятуре.
чем
цuс-изомеры.
плотность
олефинов
меньше
единицы.
но
больше,
чем
плотность
соот
ветствУЮЩИХ
пяряфинов.
В
гомологическом
ряду
оня
увеличивается.
Для
олефинов
Хllряктерны
более
высокие
покязатели
преломления
света.
чем
для
ПIlРЯфИНОВ.
РIIСТВОРИМОСТЬ
олефинов
в
воде
весьмя
маля. но
выше.
чем
Ilарафинов.
Следует
знметить. что
олефины
растворяются
в
рястворях
некоторых
со
лей
тяжелых
металлов,
обрязуя
с
ними
комплексные
соединения
(няпри
мер.
в
растворях
ClI
2
C1
2
)·
Для
олефинов
хяряктерно
избирательное
поглощение
инфрякрасных
лучей.
поэтому
инфрякрясные
спектры
с
успехом
используются
для
устя
новления
их
строения.
Тяк,
няпример,
для
винильной
группы
вялентным
колебяниям
двойной
связи
отве'lt'Iет
полося
около
1650
CM-
1
•
я
деформа
ционным
колебяниям
связей
С-Н
-
интенсивные
полосы
920
и
980
CM-
1
.
АНЯ.1l0ГИЧНЫМ
колебяниям
в
группировке
СН=СН
соответству
ют
полосы
1660
и
965
см-
1
(транс)
или
670
см-
1
(цис)
,
а в
группировке
СI-I
2
=С
-
полосы
1660
и
890
CM-
1
.
Вялентным
и
деформяционным
колебяниям
связи
с-
н
у
двойной
свя
зи
также
отвечают
иные
колебяния,
чем
в
случае
ялкянов,
я
именно
3100-3000
и
около
1420
см-
1
соответственно.
В
ультряфиолетовой
облясти
спектра
олефины
поглощяют
при
180-200
нм.
Спектры
ядерного
магнитного
резонанся
также
весьмя
хяряктерны
для
олефиновых
протонов.
Эти
протоны
щ\ют
химические
сдвиги
около
4,5-6
м.
д.,
т. е.
в
более
слябом
поле,
чем
протоны
у
НЯСl;>lщенных
атомов
углеродя.
В
тябл.
5
приводятся
важнейшие
константы
первых
представителей
рвдя
О.1lефинов.
т
я
(j
л
1I
Ц
<1
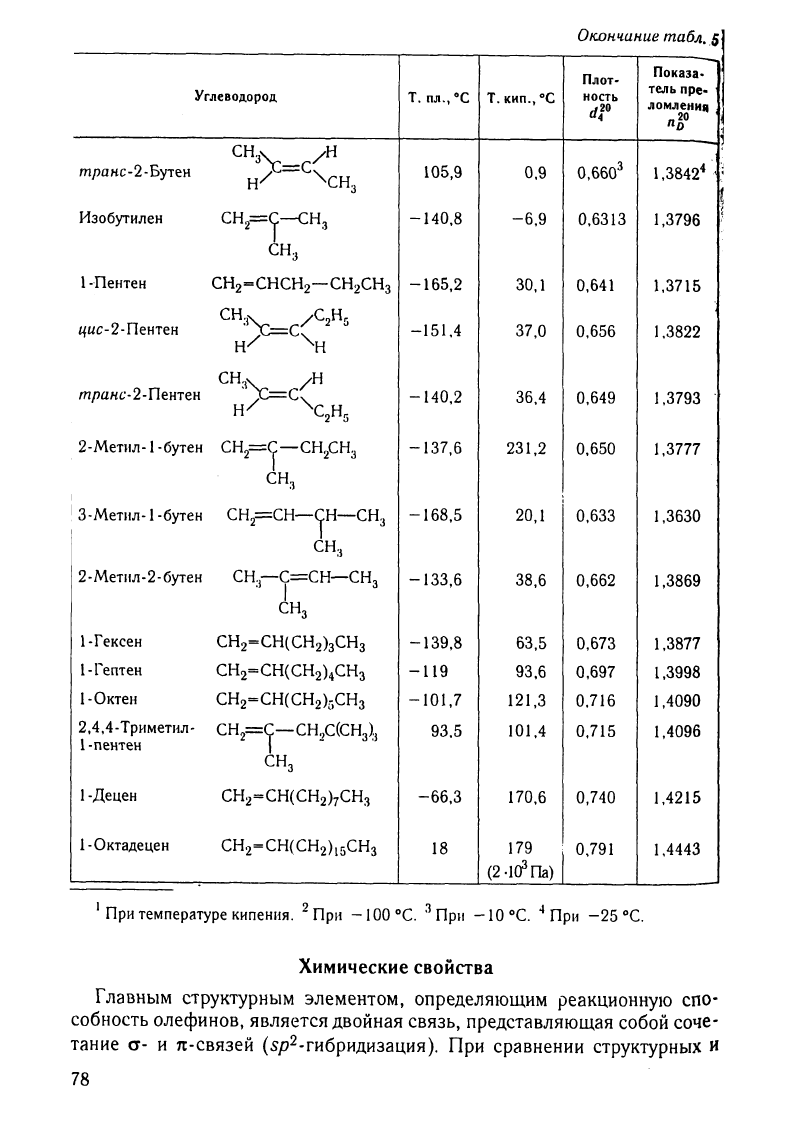
5.
Физические
свойства
IleKoTopbfX
этилеlЮВЫХ
углеводородов
г
Плот-
Покаэа·
I
тель
пре·
Углеводород
т.
пл.,
ос
т.
кип
.•
·С
ность
I
d!O
ломлеllИА
20
ПО
ЭТllлен
СН
2
=СН
2
-169.2
-10:3.8
0.5701
1.36:з2
ПРОГlllлен
СН
2
=СН-СН:\
-185.2
-47,7
0,6701
Ц62:з
l
I·БУТ~II
СН
2
=СН-С
2
Н"
-185.3
-6.3
.
0.6:301
1.377i
l
ЦЩ··2·Бутен
CH
1
\
/СН
1
~/:=C"H
.
-138.9
3.5
0.6442
1.39924
77
Ок.ончанuе
mабл.s
Плот-
Покаэа-
Углеводород
т.
пл.,·С
т.
КИП.,·С
НОСТЬ
тель
пре.
dl°
ЛОМJlеННII
nl/
,
СНз':с
/Н
1
-с
;
mранс-2-Бутен
н/
-
"СН
з
105,9 0,9
О,660
З
1,38424
~
Изо
бутилен
СН
2
T-CH~
-140,8
-6,9
0,6313
1,3796
11
СН
з
I-Пентен
сн
2
=снсн
2
-сн
2
сн
з
-165,2
30,1
0,641
1,3715
цuс-2-Пентен
CH;~c/C2H5
Н/
"н
-151,4
37,0
0,656
1,3822
mранс-2-Пентен
С
Н;\':с:=
С/Н
-140,2
36,4
0,649
1,3793
Н/
"с
Н
2 5
2-МеТlfл-l-бутен
СН2=Т-СН2СНЗ
-137,6
231,2 0,650
1,3777
СН;!
:
3-МеТlfл-1-бутен
СН
2
ch-тн-сн
з
-168,5
20,1
0,633
1,3630
СН
!
2-МеТllл-2-бутен
сн!-т=сн-сн
з
-133,6
38,6 0,662
1,3869
СН
з
I-Гексен
СН
2
=СН(
сн
2
)з
сн
з
-139,8
63,Б
0,673 1,3877
I-Гептен
СН
2
=СН(СН
2
)4
СН
З
-119
93,6
0,697
1,3998
I-Октен
сн
2
=сн(сн
2
)"СН
з
-101,7
121,3 0,716
1,4090
2,4,4-
Трнметил-
СН
2
=т-
СН
2
С(СН
з
):\
93,5
101,4
0,715
1,4096
I-пентен
СН
З
1-Децен
СН
2
=СН(СН
2
)7
СН
З
-66,3
170,6
0,740
1,4215
1
-Октадецен
СН
2
=СН(СН
2
)15
СН
З
18
179
I 0,791
1,4443
(2.lifПа)
I
При
температуре
кипения.
2
При
-100
ос
з
ПРII
-1
О
ос
4
При
-25
ос
Химические
свойства
Главным
структурным
элементом,
определяющим
реакционную
спо
собность
олефинов,
является
двойная
связь,
представляющая
собой
соче
тание
0'-
и
7t-связей
(sр2_
ги
бридизация)_
При
сравнении
структурных
и
78

ер
гетических
параметров
молекул
алканов
и
алкенов
видно,
что
двой-
3Н
u
О
.
ная
связь
значительно
короче
и
прочнее
ординарнои
связи.
днако
энер-
ия
двойной
связи
меньше,
чем
энергия
двух
ординарных,
на
~2
1
кДж/моль.
Поэтому
двойная
связь
легко
переходит
в
две
ординарные
G-~вязи
путем
присоединения
по
месту
двойной
связи
двух
атомов
или
атомных
групп.
Скорость
такого
присоединения
определяется
характером
присоединения
молекулы
и
характером
заместителей
у
двойной
связи.
H-CH
2
-CH
2
R
H-CH2-CH~CH-H
Длинасвязи,нм
0,110 0,1535 0,100 0,150 0,134 0,108
Энергия
связи,
кДЖ/моль
427,1 349,6 322,4 360 607,1 435,5
Таким
образом,
для
олефинов
наиболее
типичны
реакции
nрисоеди
ненuя.
Однако
следует
иметь
в
виду,
что
олефины
способны
и
к
реакциям
замещения,
причем
некоторые
из
них
идут
значительно
легче,
чем у
пара
фи
нов.
Наиболее
легко
замещается
водород
у
а.-углеродного
атома
по
от
ношению
к
двойной
связи
благодаря
(1,
n-сопряжению
(сверхсопряже
нию
):
орбитали
СВ
-связей
в
а.-положении
к
двойной
в
не
которой
степени
перекрываются
с
негибридизованными
орбиталями
n-связеЙ.
При
разры
ве
таких
СН-связей
образуется
радикал,
стабилизированный
сопряжени
ем
(ср.
с.
47).
В
реакциях
при
соединения
двойная
связь
обычно
выступает
как
донор
электронов.
Поэтому
для
олефинов
характерна
реакция
электрофильного
присоединения
(АЕ)'
1.
Гидрирован.не.
Алкены
непосредственно
молекулярный
водород
не
присоединяют.
Эту
реакцию
можно
осуществить
только
в
присутствии
ге
терогенных
(Pd, Pt,
Ni)
или
гомогенных
(например,
хлортрис-трифенил
фосфин-родия
RhСl(РhзРЫ
катализаторов.
Наиболее
часто
проводят
ка
талитическое
гидрирование
на
гетерогенных
катализаторах:
СН
2
=СН
2
+
Н
2
---+
СН
з
-СН
з
:
ыi
= -137,3
кДж/моль.
Поскольку
для
гидрирования
необходима
адсорбция
молекулы
олефина
на
катализаторе
по
двойной
связи,
олефины
гидрируются
тем
легче,
чем
меньше
заместителей
имеется
у
двойной
связи,
-
правило
С.
В.
Лебедева.
Известен
также
метод
химического
гидрирования
с
помощью
сильных
восстановителей,
например
ДIfИМИда
NH
=
NH,
образующегося
при
действии
на
гидразин
окислителей:
R-CH=CH
2
+ N
2
H
2
---+
R-СI-I
2
-СН
з
+ N
2
·
2.
ГалогенирО!sанне.
ОлефИНbl
легко
присоединяют
галогены:
СН
2
=СI-l
2
+
ВГ2
---+
сн
2
вг-сн
2
вг.
Скорость
реакции
зависит
от
природы
галогена
и
строения
олефина.
Фтор
реагирует
с
воспламенением
.,
иод
-
медленно
на
солнечном
свету.
-------
•
Присоединение
двух
атомов
фтора
сопрово
ется
выделеиием
452,2
кДж/моль,
тогда
КаК
дпЯ
разрыва
С-С-связи
требуется
350
моль.
При
соединение
двух
атомов
хлора
СОпровождается
выделением
всего
138,2
моль.
79

Реакция
присоединения
облегчается
при
увеличении
числа
заместителей,
у
двойной
связи.
Это
объясняют
большей
поляризацией
этиленовой
связи:
под
влиянием
замещающих
радикалов
и
увеличением
устойчивости
про-·
межуточных
радикалов
или
ионов
благодаря
сверхсопряжению.
.1
Галогены
могут
присоединяться
к
олефинам
по
радикальному
или
ион.
ному
механизму.
При
р
а
Д
и
к
а
л
ь
н о
м
присоединении
атомы
галогена
(обычно
получа
...
ются
по
схеме
ВГ2
~2Bг)
присоединяются
к
наиболее
доступному
иэ
атомов
углерода
с
образованием
наиболее
стабильного
из
возможных
ра
дикалов,
в
случае,
например,
пропилена
возможно
образование
двух
ра
дикалов:
КС
'
снз-ёН-СН2ВГ
(1)
СН
2
-СН-СН
2
•
СН
З
-СНВГ-СН
2
(Ш
Легче
образуется
и
более
стабилен
радикал
(1).
В
этой
радикале
сво
бодный
электрон
сопряжен
с
электронами
пяти
СН-связей,
тогда
как
в
радикале
(11)
он
сопряжен
только
с
электронами
СН-связи.
К
тому
же
крайний
углеродный
атом
более
доступен
для
атаки.
Радикал
(1)
далее
ре
агирует
с
молекулой
галогена
с
генерацией
нового
атома
галогена:
. .
СН
з
СНСН
2
Вг
+
ВГ2
_
СН
з
СНВгСН
2
Вг
+
Вг.
1.2·диБРОМlI(юпаll
Чаще
происходит
при
соединение
по
ионному
электрофильному
механиз
му.
Молекула
галогена атакует
двойную
связь,
захватывая
электроны
и
об
разуя
так
называемый
1t-комnлекс.
Затем
отделяется
отрицательный
ион
галогена.
К
возникающему
карбениевому
или
бромониевому
катиону
(ср.
а-комплекс,
гл.
15)
присоединяется
отрицательный
ион
галогена:
+I1r-Dr + -
Н
2
С=СН
2
-Н
2
С
~
СН
2
-
СТ2-
СН
2
+
Вг
-iН2--iН2
Вг-
Вг Вг Вг Вг
или
1,2
-
дибромзтан
Jt·комплекс
Относительно
природы
промежуточного
катиона
можно
сделать
за
ключение
по
стереохимическим
результатам
реакции.
Свободный
карбе
lIиевый
катион
-
плоский
и,
следовательно,
присоединение
к
нему
не
бу
дет
стереоспецифическим.
Бромониевый
катион,
наоборот,
должен
при
водить
к
образованию
толы<О
mpaHC-aдJJYKTa
(аддукт
-
продукт
присоединеIlИЯ).
По-видимому,
рассматриваемые
реакции
могут
идти
с
образованием
обоих типов
катионов,
так
как
известны
случаи как
стерео
специфического,
так
и
нестереоспецифического
галогенирования.
Присоединение,
по-видимому,
идет
через
бромониевый
катион,
так
как
в
тех
случаях,
где
может
быть
доказана
конфигурация,
были
получены
продукты
присоединения
транс-конфигурации.
80
