Петров А.А., Бальян X.В., Трощенко А.Т. Органическая химия: Учебник для вузов
Подождите немного. Документ загружается.


МОЛОI'И.
С
повышением
температуры
кипения
фракций
нефти
повыши-
ro _
ется
содержиние
непредельных
соединении.
Выделение
индивидуальных
углеводородов
возможно
только
из
НИЗШИХ
фрикций
нефти.
Высшие
фракции
имеют
слишком
СJIOЖН~IЙ
состав
при
незначитеЛl,НОМ
раЗЛИ'IИИ
в
физических
и
химических
своиствах
отдеJlЬ
ных
компонентов.
основным
способом
переработки
нефтяных
фракций
являются
ризлич
ные
виды
крекинга.
Впервые
крекинг
нефти
БЫJI
осуществлен
в
лабора
TOPIIOM
и
полупромышленном
масштабе
сотрудником
Петербургского
теХllологического
института
А.
А.
Летним
(1871-1878).
Первый
патент
на
усти
новку
ДJlЯ
крекинга
заявлен
В.
r
Шуховым
( 1891).
В
ПРОМЫШJlен
ности
крикинг
ПОЛУЧИJl
распространение
с
20-х
годов
ХХ
в.
Крикинг
-
"то
термическое
разложение
УГJlеводородов
и
других
со
ставных
частей
нефти.
Чем
выше
температура,
тем
больше
скорость
I<pe-
кинга
и
БОJlьше
выход
газов
и
аромитических
углеводородов.
Крикинг
нефтяных
фракций
кроме
жидких
продуктов
дает
первосте
ПСIIНОЙ
важности
сырье
-
гизы,
содержищие
непредельные
УГJlеводоро
ды
(ОJlефины).
РИ:JЛII'11IЮТ
c.nедУЮЩllе
основные
BIIAbl
l<pel<llHra
нефтепродУКТОВ:
Жm)К(lфU:lныli
крекинг
(2-6
МПа.
IIЛII
20-60
атм.
430-550
'С)дает
беll:illlI.
содер
жаЩlll1
25-:Ю%
олефlllЮВ,
60-70%
паРllфИНОВ
и
5-
Н)%
аромltТII'IеСЮIХ
углеводородов.
Выход
fieH31111a
порядка
50%.
га:юв
-
10%.
в
ГIIЗООUРlIзноii
'lаСТII
продУКТОВ
l(реКНIIГil
так
же
Ilрео(jЛilДilЮТ
Ilределыlеe
углеводороды
(MCTillllI
его
UJlижаiiШl-lе
ГОМОЛОI'I-I).
Пщюфи:/Ный
крекинг
(оБЫ'lное
или
пониженное
давление.
600
'С)
Дilет
беН31111,
содер'
жаЩllii
40-50%
олефllНОВ.
40-60%
ilРОМilТI1'lеСIШХ
углеводородов
11
до
10%
ПИРllфШIOВ.
Выход
(je1l311HII
обы'IНО
меllьше,
чем прн
ЖИДКОфllЗНОМ
Kpel<llHre.
ОБРllзуется
uольшое
коли
'leCTBO
rlI~OB,
содеРЖilЩIIХ
40-50%
олефинов.
ПrrР()ДU:1
нефти
(оuычное
ИЛII
ПОНllженное
ДIIвлеl1ие.
650-700
'С)
диет
смесь
аРОМilТН
'IeCКlIX
углеводородов
(Шlробензол).
Выход
ПОРЯДl{iI
15%.
Более
ПОЛОВIIНЫ
сырья
преВРllща,
ется
в
газы
(паРllфllНЫII
олефины).
Д('стРУКllllIllН()('
гur)РUР()/lUние
(ДllвлеНllе
BOДOPOДII
2-2.5'
107
ПII.
11Л11
200-250IlТМ.
300-400
'С)
в
П/1I1СУТСТВIШ
каТilЛИЗIIТОРОВ
-
желеЗil.
никеля.
ВОЛЬФРilМiI
I1
др.
-
Дilет
пре,
деЛl.нщi
(jеНЗIIН
с
выходом
до
90%.
Прео(jЛIIДIIЮТ
углеводороды
изостроеНIIЯ.
Каf//иЛUlllи'lеСКllli
крекинг
(:ЮО-500
'С
в
П)JIIСУТСТВI1Ii
1{IIТIIЛИ3I1ТОРII
АICI:
1
.IIЛЮМОСIIЛII'
'{IIТОВ.
MoS:
1
•
СГ20:1
11
др.}
ДIIeT
НIIРЯдУ
с
ГllзооБРIIЗНЫМli
ПРОдУl<ТilМИ
ВЫСОКОСОРПlыii
(jеНЗIIН
<:
преОUЛilДIIНllем
аl>омаТII'IеСIШХ
11
предельных
углеводородов
сизостроением.
В
теХНИl<е
(jольшую
роль
IlrpileT
так
lIаЗЫВilемыii
КlIlIlllлиlll/l'lескиri
РllфЩ/,l/lIнг
-
пре
ВРllщеllllе
Hli3KOCOPTHblX
(jeH3I1HoB
в
высокосортные
BblCOKOOI<TIIHOBble
беllЗllliЫ
1IЛ11
apOMaTII'
'le<:l\Ile
углеводороды.
Основными
реаlЩIIЯМII
ПРII
креКlIнге
являются
реlllщltll
расщепления
углеводородных
I\eneii.
IlзомеР"311lЩIIII
ЦIIКЛlI3I1ЦIIII.
Огромную
роль
В
~ПНХ
процессах
1II'рают
СВОUОДllые
уг,
леводородные
раДIIКIIЛЫ.
МехаНIIЗМ
l,реКlIнга
будет
рассмотрен
Нllже
(гл.
1.1).
Каменный
уголь
и
другие
виды
ископаемых
углей.
Записы
кименного
угля
в
природе
значительно
превышают
зиписы
l1ефти.
Поэтому
каменный
yrOJlb
-
важнейший
вид
сырья
ДJlЯ
химической
промышленности.
В
настоящее
время
в
промышленности
используется
неСl<ОЛЬКО
путей
перерtiботки
каменного
угля:
сухая
перегонка
(коксование,
полукоксова
lIие),
гидрировиние,
неполное
сгорание,
получение
карбида
кильция.
11

Сухая
перегонка
угля
применяется
для
получения
KOKCil
или
бытового
Гilза.
При
КОКСОВilНИИ
угля
получаются
кокс,
камеННОУГОЛЫlilЯ
смола,
над
смольная
вода
и
газы
КОI{сования.
Г
iI
зык
о к
с
о
в
iI
Н И
Я
содержат
аммиак,
водород,
оксид
и
диоксид
уг
лерода,
метан,
этилен
и
другие
углеводороды,
в
том
'Iисле
аромаТИ'lеские.
От
аММИilка
ГilЗ
освобождают
промыванием
водой.
Ароматические
углево
дороды
поглощаются
при
промывании
газа
тяжеJIЫМ
маслом.
Очищенный
таким
образом
ГilЗ
при
меняется
KilK
горючее
для
поддержания
высокой
температуры
в
реакторах.
Выход
к
iI
М
е
н н
о
у
г
о
л
1,
Н
О
Й
с
м
о
л
ы
невеJlИК
-
всего
около
:З(}{).
Однако
OHiI
ВЫРilбатывается
в
огромных
количеСТВilХ,
TilK
l{ilK
МilСШНlбы
коксохимического
производства,
обслуживающего
меТilЛЛУРГИЮ,
очень
велики.
КilмеННОУГОЛЬНilН
смола
представляет
собой
СJlОЖНУЮ
смесь
многих,
преимущественно
ilроматических,
углеводородов,
кислород-
и
ilзотсодер
ЖilЩИХ
веществ.
COCTilB
ее
до
КОНЦil
еще
не
изучен.
КамеННОУГОЛЫlilЯ
смола
разделяется
перегонкой
на
пять
фракций:
1)
до
170·С
-
легкое
масло,
состоит
преимущественно
из
углево
дородов;
2)
170-230·С
-
среднее
масло,
содержит
в
больших
КОJlичеСТВilХ
фенолы;
3)
230-270·С
-
тяжелое
масло,
из
него
выделяют
нафталин;
4)
270-340·С
-
антраценовое
масло;
5)
остаток
-
пек.
Каждую
из
этих
фракций
обрабаТЫВilЮТ
щеЛО'IЬЮ
для
удаления
кислых
составных
частей
(преимущественно
феНОJlОВ)
и
кислотой
для
выделения
азотистых
оснований.
После
этого
очищенные
фракции
вновь
перегоня
ют.
Твердые
УГJlеводороды
(нафталин,
антрацен)
отжимают
от
масла.
Из
КlIменноугольной
смолы
получают
кроме
ароматических
углеводо
родов
гидроксисоединения
(фенолы)
и
гетеРОЦИКЛИ'lеские
азотсодеРЖil
щие
оргаНИ'lеские
основания
(пиридин,
хинолин
И
т.
д.).
Г
и
д
р
и р
о
в а
11
и
е
у
г
JI
Я
осуществляют
при
400-600
·С
под
ДIIВJlеIlИ
ем
водорода
до
2,5·
107
Па
(250
атм)
в
присутствии
катализатора
-
ок
сидов
железа.
При
этом
образуется
жидкая
смесь
углеводородов,
которую
подвергают
оБЫ'IНО
деструктивному
гидрированию
на
никеле или
других
каТilлизаторах.
Гидрировать
можно
и
низкосортные
бурые
УГJlИ.
Н
е
11
о л
Н
о
е
с
г'о
р
iI
Н И
е
у
г
л
я
дает
оксид
углерода.
В
технике
ис
пользуют
три
ТИШt
газообразных
смесей,
содержащих
СО:
генеРilТОРНЫЙ
газ,
водяной
газ
и
синтез-газ
-
продукты
конверсии
MeTilHa
и
его
гомологов.
Основной
процесс
при получении
генераторного
гаЗil
-
BOCCTilHOBJlC-
ние
диоксида
углерода
до
оксида
при
прохождении
его
через
слой
pilcKa-
ленного
угля.
Диоксид
образуется
в
том
же
генераторе
БШ'lгодаря
частич
ному сгоранию
угля
в
токе
воздуха.
12

ВОДЯНОЙ
гяз
получяют
пропускянием
ВОДЯНОГО
пяра
через
раскаJlеllНЫЙ
Н
2
О
+
с
+2
Н
2
+
СО.
I-Iниболее
экономичный
современный
метод
получения
смесей
оксида
УГJlеродя
и
водородя
(синтез-газа)
основан
на
каталитическом
взаимодей
ствии
природного
газа
(метана)
с
ВОДЯНЫМ
паром,
диоксидом
углерода
или
кислородом
(при
800-900
·С,
кятализатор
NiO
на
AI20:~):
СН
4
+
Н
2
О
--+
СО
+
3Н
2
СН
4
+
С0
2
--+
2СО
+
2Н
2
2СН
4
+
02
--+
2СО
+
4Н
2
Ою.:ид
углерода
используют
в
технике для
получения
смесей
углеводо
родов
(при
обычном
дявлении)
или
спиртов
(при
повышенном
давлении),
;:t
Т(lкже
в
«оксосинтезе»
(см.
гл.
5.1
и
6.1).
д
НlIкелевым
нли
кобilЛL.ТОВЫМ
КilТilлизtlТОРОМ
ВОССТilновлеНllе
nplI
обычном
или
110-
вышенном
д,шлеННli
0.7-1.2
10';
Па.
IIЛII
7-12
ilТМ.
IlДeT
по
схеме:
со
+
(2
+
1
)Н
Ni.
Со
С
I-I
+
Н О
11
ГI
2 • " ')"
+')
ГI.,.
ItЮ-200
·С
- - -
НiI
железном
КilТilЛl13i1торе
реilКЦНЯ
IIдет
с
выделеlшем
ЩIOКСI1дil
углерОДil:
2nСО
+ (n + 1
)Н
2
F~
~
C
II
H
211
+
2
+
Г/Н
2
О.
190-250
·С
Добявками
раЗЛИ'IНЫХ
веществ
к
катализатору
можно
регулировять
длину
цепи
образующихся
углеводородов
и
количество
соединений
с
изостроением.
Карбид
кальция
получают
из
угля
(кокса,
антряцита)
и
извести.
В
даЛЬ
нейшем
он
перерабятывается
в
ацетилен.
который
используется
в
мировой
химической
промышленности
во
все
возрастяющих
масштабах.
Сланцы.
Различные
виды
природных
сланцев
перерабатывают
в
BbICO-
I(ОЮiJIОРИЙНЫЙ
бытовой
газ
(Эстония).
Образующяяся
при
пиролизе
слан
цев
смоля
может
СЛУЖИТЬ
источником
фенолов.
Оргяническую
составля-
11JlI.I.УЮ
слянцев
-
кероген
-
перерябатывают
в
двухосновные
кислоты
(Оl(исление)
и
другие
ценные
продукты.
Окислением
торфяной
массы
получают
щавелевую
кислоту.
Продукты
сельского
и
лесного
хозяйства.
Некоторые
химические
Производства
используют
в
качестве
сырья
продукты
сельского
и
лесного
ХОзяЙствя.
Так,
например.
в
нашей
стране
этиловый
спирт
ПОJlучают
Сбряживанием
глюкозы.
образующейся
при
гидролитическом
расщепле
IIИи
клетчатки
(из
древесины)
или
крахмяла
(из
хлебных
злаков
и
карто
феJIЯ).
Из
глюкозы
синтезируют
витамин
С
И
лимонную
кислоту.
Скипи
д<tр
и
канифоль
производят
из
живицы
или
древесины
хвойных
пород;
ви
тамин
А,
цитраль
и
другие
душистые
веществя
-
из
эфирных
мясел.
Эфирные
MHCJla
растений
содержят
наряду
с
терпенами
(гл.
3.5)
аро
М<tТИ'lеские
оксисоединения,
аJlьдегиды'
кетоны,
кислоты
и
их
':Jфиры.
1:3

Некоторые
(\ром(\тические
соединения
выделяют
из
эфирных
м(\сел и
при
меняют
д.ля
получения
душистых
веществ.
При
родные
эфирные
м(\сл(\
применяют
т(\кже
без
выделения
отдельных
компонентов
в
парфюмерной
промышленности.
Некоторые
ТРОПИ'lеСКltе
ристенltя,
нипрнмер,
МОЛО'lюi
маСЛJt'lныii,
MOryr
ItСПОЛЬЗОВИТЬСЯ
в
КИ'lестве
прllродных
нефтеносов.
С
гектари
плинтиции
нефтеносов
можно
ПОЛУ'lить
около
4
т
жидкого
ТОПЛltви.
Предполагиется,
что
методами
reHHoii
IIнженеРliИ
можно
будет
создить
н
более
продуктивные
и
YCTOI"I'IItBbIe
к
холоду
ристенltя,нефтеносы.
в
н(\стоящее
время
имеется
тенденция
резко
уменьшить
использов(\ние
пищевого
сырья
в
химической
промышленности
н(\
основе
применения
новых
синтетических
методов
орг(\нической
химии.
3.
АНАЛИЗ
И
ОПРЕДЕЛЕНИЕ
СТРОЕНИЯ
ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
ИССJlедов(\ние
орг(\нического
веществ(\
н(\чинается
с
его
очистки
обычно
перегонкой,
перекристаллизацией
или
хроматографическими
ме
тод(\ми.
Подробное
описнние
этих
методов
можно
н(\йти
в
руководств(\х
К
пр(\ктическим
работ(\м
по
орг(\нической
химии.
Очищенное
органическое
вещество
подвергнется
качественному
и
количественному
аН(\JlИЗУ.
НаиБОJlее
часто
в
органических
соединеflИ
ях
кроме
углерода
и
водорода
содержатся
КИСJlОРОД,
азот,
серн,
г(\логены,
фосфор.
Кичественныii
11
IШЛИ'lествеIIНL.IЙ
инилиз
oРГИНII'IеСКlIХ
соедllненltй
основан
на
ItX
ризру·
шеНllI1
(сожжеНIIII)
с
последующим
определением
обычнымlt
методимlt
СО
2
,
Н
2
О.
N
2
И
т.
д.
ПРlt
разрушеНlШ
oРГИНlt'lеСКIIХ
веществ
С
помощью
серной
КlIСЛОТЫ
oРГИIIН'Iескlt
связин,
ныi'lизот
преврищается
в
иммltак.
ПослеДНllii
может
быть
выделен
действием
щело'lИ
и
опре
делен
обычным
способом.
Сери
11
фосфор
nplt
оюtслеНlIl1
ОРГИНltчеСКlIХ
веществ,
например,
изотноt"ll<ltСЛОТОli,
пере
ходят
соответственно
в
серную
IIJIII
фосфорную
кислоту.
Серная
кислоти
определяется
в
ВI1Де
бирневоii
СОЛI'I,
фосфорния
-
В
виде
NH4MgP04'
Гitлогены
(F, CI,
Вг,
1)
обризуют
npll
cropaHlll1
ЩJГИИllческltх
веществ
гилогеноводороды.
которые
также
определяются
обы'lНЫМИ
способимlt.
РИЗЛlI'lные
КИ'lественные
11
КОЛII'lествеlIНые
методы
анаЛIIЗИ
ОРГИН'lеСКlIХ
соеДllнеНllii
ОПlIСИНЫ
в
спеЩIИЛЫIЫХ
руководствих
по
оргаНИ'lескому
анилизу.
даJlее
определяют
м
о
л
е
к
у
JI
Я Р
Н
У
ю
м
а
с
с
у
веществ(\
КРИОСКОПИ'lе
ским,
эбулиоскопическим
методом
ИJlИ
с
помощью
масс-спектрометра.
Все
эти
методы
рассм(\триваются
в
курсах
общей
и
физической
химии
•
Зная
к(\чествеНliЫЙ
и
колиtlественный
состав
вещества,
при
известной
МОJlекулярной
массе
можно
придать
оргаНИ'lескому
веществу
определен
ную
молекулярную
брутто-формулу
••
•
ОпредеЛltть
молеl\УJIЩJl1УЮ
миссу
газообризных
IIЛlI
ЖIIДКltх
вещеСТIJ
с неВI.IСОЮIМII
теМllеРl1ТУРИМlt
КllпеllИЯ
не
всегдit
IlеоБХОДIIМО.
ТИI( КИI(
nplt
известной
простеiiшеii
формуле
(СХНIJА,
... )"
'Iисто
можно
сделitть
ОДНОЗН1I'Iное
заКЛЮ'lеНI·lе
о
веЛII'lнне
11
путем
сравнеllllЯ
темперитуры
КlшеllllЯ
его
с
темпераТУРИМl1
Iшпеltltя
Itзвестных
веществ
с
той
же
простеiiшеii
фОРМУJlOii.
*.
Брутто-формулit
может
Тill(же
быт!.
устиновлени
с
помощью
МИСС-Сllеl<тромеТРlllt
ВЫСОIШГО
рit:iрешеНIIЯ.
14

Затем
определяют
с
т р о
е н
и е
оргаНИ'Iеского
веществя.
Это
осущест
вляется
в
современных
условиях
кяк
химическими,
тяк
и
физическими
ме
тодами.
Возможны
два
СЛУ'IaЯ.
Если
предполагают,
что
исследуемое
ве
щество
уже
известно,
то
сравнивают
константы
и
спектры
исследуемого
веществя
с
теми
же
данными
для
уже
известного
вещества
и
убеждяются
в
ИХ
идентичности
или
раЗЛИ'IИИ.
Если
исследуемое
вещество
не
известно
или
еСJlИ
в
литературе
не
при
ведены для
него
нядежные
константы
ИJlИ
спектральные
дянные,
то
тогда
химическими
и
физическими
методами
пытютсяя
выяснить
возможно
nOJI-
нее
няличие
в
нем
определенных
фрагментов,
функционяльных
групп
или
связей
и
на
этом
основании
делают
вывод
о
строении
вещества.
Рассмотрим.
н;!пример.
определеНl1е
строения
вещества.
11меющего
молекулярную
фор
мулу
с
1
н,;О.
С
,той
формулой
могут
существов;!ть
дв;!
(11
только
дв;!)
ОРГ;!НИ'lеских
coeДl1He-
111111:
н н
I I
н-с-с-он
I I
н
н
'ПВJЮНl,IЙ
t.:llИрТ
(А)
н н
I I
Н-(-О-(-Н
I I
н
н
JU'МСТIiJ'ШII,'Й
·.фир
(Б)
МеТ;!ЛЛI1'lеский
НIIТРИЙ
ЗlIмещает
только
один
ИЗ
6
IITOMOB
ВОДОРОДII
исследуемого
вещеСТВII:
2С
2
НБО
+ 2N;! -+ 2C
2
H"ONII
+
Н
2
.
В
ре;!КЦliИ
с
хлороводородом
хлор
ЗlIмеЩllет
по
одному
IITOMY
ВОДОРОДII
И
IШСЛОрОДII:
C
2
H
I
;O
+
НСI
<2
С
2
Н"СI
+
НОН.
Это
СВlщетельствует
о
том.
"ТО
один
I1ЗIIТОМОВ
ВОДОРОДII
НIIХОДИТСЯ
В
особом
положении
отно
Сlпел"но
ПЯТl1
ДРУГИХ,
ПР11"ем
это
положеНI1е
IIнаЛОГИ'IНО
положению
атомов
водорода
в
воде.
111')0
вода
ТlIкже
реагирует
с
меТllлли"еским
н;!трием
с
ВblделеНI1ем
водорода:
2Н
2
О
+ 2N!! -+ 2N;!OH +
Н
2
.
Следов;!тельно.
формул!!
димеТI1ЛОВОГО
эфира
(6)
для
IIсс.ледуемого
веществ;!
непр"ем
лема.
Совершенно
о"евидн;!
для
него
формул;!
(А).
Строение
вещества
С
2
Н,;0
можно
опредеЛИТI,
и
физи"еСКИМII
методами,
НIIПР'1мер.
по
его
инфракрасному
спеl(ТРУ.
Взятое
нами
для
11сс.ледования
вещество
поглощ;!ет
иltфРIIК
расное
11злучение
именно
в
::lТОЙ
обл;!сти,
где
наблюдается
поглощение
для
ВОДblИ
орг;!ни"е
Сl<l1Х
веществ.
содерж;!щих
ГИДРОКСИЛЬНblе
ГРУППbl
(около
3
мкм).
Соединения
ТlШ;!
(6)
в
'ПОЙ
оБЛ;!СТl1
не
поглощ;!ют
T;!KIIM
обр;!зом.
н;!ше
вещество
на
основ;!нии
,Т11хдаННblХ
мо
Жет
иметь
толы(о
формулу
(А).
Для
большей
убедитеЛЬНОСТl1
можно
Сl1нтеЗИРОВIIТЬ
11зомер
(6)
(в
нашем
слу"ае
димеТI1-
JIOВыи
,фир)
ДPYГl1M
н;!деЖНblМ
методом
и
показать.
"то
он
"меет
другие
свойства
и
"то
для
Него
возможна
толыоo
формула
(6),
Из
физических
методов
определения
строения
оргаНИ'Iеских
соедине
ний
используются
спектроскопия
в
видимой
области,
УЛI>трафиолетовая,
I1Нфрякрасняя
и
комбинационного
рассеяния,
масс-спектрометрия,
опре
Л,еление
дипольных
моментов,
ядерный
магнитный
резонанс
и
др.
Подроб
НОе
описание
всех
этих
методов
можно
найти
в
специальных
руководствях
и в
У'Iебникях
по
физике
и
физической
химии.
15
В
настоящее
время
при
исследовании
строения
органических
веществ
особенно
широко
используются
электромагнитные
колебания
с
длиной
волны
от
миллиардных
долей
санти
метра
до нескольких
метров.
Рентгенострук1УРНЫЙ
анализ.
Дифракция
рентгеновских
лучей
(л=
10-2
-
10-3
нм)
В
кристаллах
используется
для
определения
межатомных
расстояний,
углов
мещцу
связями
и
других
параметров
кристаллической
решетки.
Внедрению
в
СТРУК1Урные
исследования
в
об
ласти
органической
химии
рентгенострук1УРНОГО
анализа
способствовало
широкое
приме
нение
в
приборостроении
ЭВМ.
В
настоящее
время
этот
метод
применяется
как
наиболее
надежный
и
информативный
метод
определения
строения
твердых
(кристаллических)
орга
нических
соединений
и к
нему
прибегают
в
наиболее
сложных
и
принципиальных
случаях.
Спектры
веществ
в
ультрафиолетовой
и
видимой
области.
Электромагнитные
колеба
ния
в
ультрафиолетовой (л
=
(1
- 4) .
102
нм)
И
видимой
(л
= (4 -
8)·
102
нм)
областях
спектра
используются
для
определения
тонкого
строения
молекул.
Если
видимый
свет
или
ультрафиолетовое
излучение
пропускать
через
кюве1У
с
веществом,
а
затем
зафиксировать
с
помощью
специального
спектрометра
и
самописца
изменение
l<Оличества
поглощенной
энергии
с
данной длиной
волны.
то
на
бумаге
получится
кривая
линия
-
спектр
вещества
(рис.
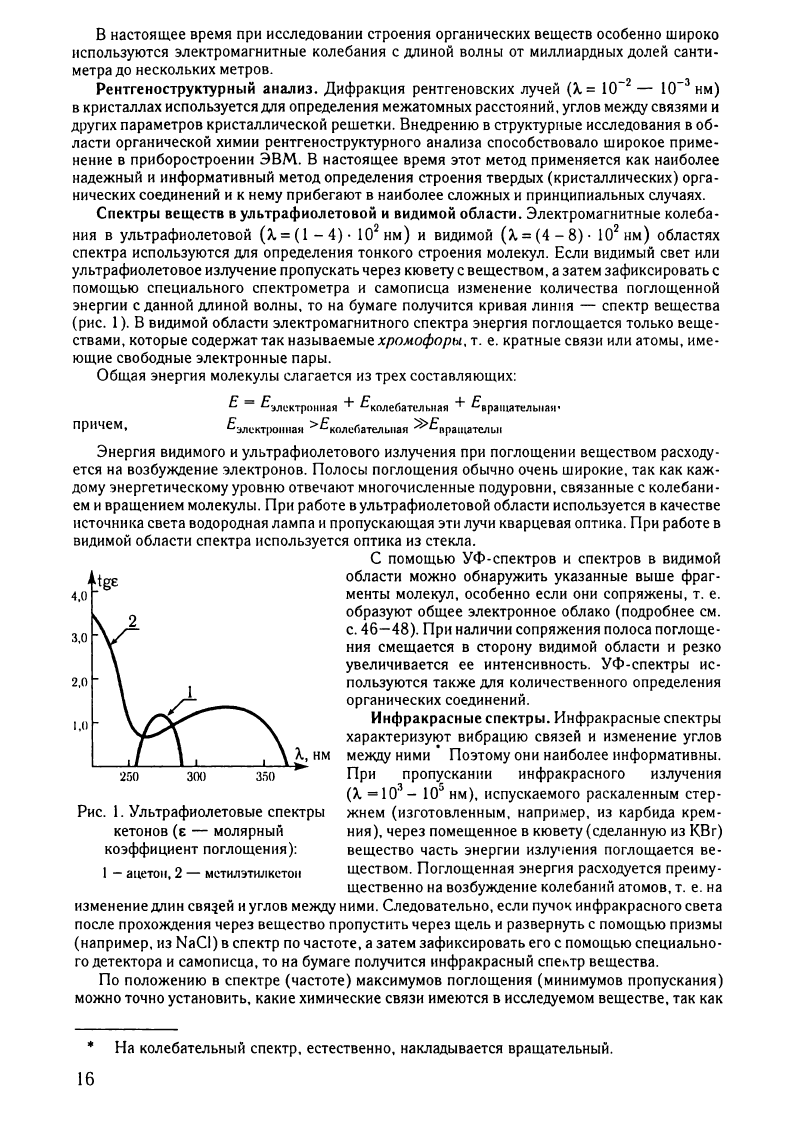
1).
В
видимой
области
электромагнитного
спектра энергия
поглощается
только
веще
ствами,
которые
содержат
так
называемые
хромофоры.,
т. е.
кратные
связи
или атомы,
име·
ющие
свободные
электронные
пары.
Общая
энергия
молекулы
слагается
из
трех
составляющих:
причем,
Е
=
ЕЭnСКТРOlШ8Я
+
ЕкмебатеnЫl8Я
+
ЕираШ,3nЛЫlаllt
ЕЭnСКТJЮIШ8fl
>ЕколебателЫlая
»ЕвращателЫI
Энергия
виднмого
и
ультрафиолетового
излучения
при
поглощении
веществом
расходу·
ется
на
возбуждение
электронов.
Полосы
поглощения
обычно
очень
широкие,
так
как
каж
дому
энергетическому
уровню
отвечают
многочисленные
подуровни,
связанные
сколебани
-
ем
и
вращением
молекулы.
При
работе
в
ультрафиолетовой
области
используется
в
качестве
ИСТОЧНlша
света
водородная
лампа
и
пропускающая
ЭТII
лучи
кварцевая
оптика.
При
работе
в
видимой
области
спектра
используется
оптика
из
стекла.
С
помощью
УФ-спектров
и
спектров
в
видимой
tge
области
можно
обнаружить
указанные
выше
фраг-
4,0
меиты
молекул,
особенно
если
они
сопряжены,
т.
е.
1,0
Рис.
1.
Ультрафиолетовые
спектры
кетоиов
(Е
-
молярный
коэффициент
поглощеНIIЯ):
I -
31\eТOII,
2 -
МСТИЛЭТИJIКСТOII
образуют
общее
электронное
облако
(подробнее
см.
с.
46-48).
При
наличии
сопряжения
полоса
поглоще
ния
смещается
в
сторону
видимой
области
и
резко
увеличивается
ее
интенсивность.
УФ-спектры
ис
пользуются
также
для
КОЛИ'lественного
определения
органических
соединений.
Инфракрасные
спектры,
Инфракрасные
спектры
характеризуют
вибрацию
связей
и
изменение
углов
мещцу
ними'
Поэтому
они
наиболее
информативны.
При
пропускании
инфракрасного
излучения
(л
=
103
-
105
нм),
ИСПУСI(аемого
раскаленным
стер
жнем
(изготовленным,
например,
из
карбида
крем
ния),
через
помещенное
в
кювету
(сделанную
из
КВг)
вещество
часть
энергии
ИЗЛУ'lения
поглощается
ве
ществом.
Поглощенная
энергия
расходуется
преиму
щественно
на
возбуждение
колебаний
атомов,
т.
е.
на
изменение
длин
свя~ей
11
углов
мещцу
ними.
Следовательно,
если
ПУЧОI(
инфракрасного
света
после
прохождеНIIЯ
через
вещество
пропустить
через
щель
и
развернуть
с
помощью
призмы
(например,
IIЗ
NaCI)
в
спектр
по
частоте,
а
затем
зафиксировать
его
с
помощью
специально
го
детектора
и
самописца,
то
на
бумаге
получится
инфракрасный
спеl\ТР
вещества.
По
положению
в
спектре
(частоте)
максимумов
поглощения
(минимумов
пропускания)
можно
точно
установить,
какие
химические
связи
имеются
в
исследуемом
веществе,
так
как
*
На
колебательный
спектр,
естественно,
накладывается
вращательный.
16
)!(дая
связь
характеризуется
вполне
определенной
полосой
поглощення:
на
возбужденне
ее
:~6рационных
или
деформационных
колебаний
расходуется
вполне
определенная
энергия
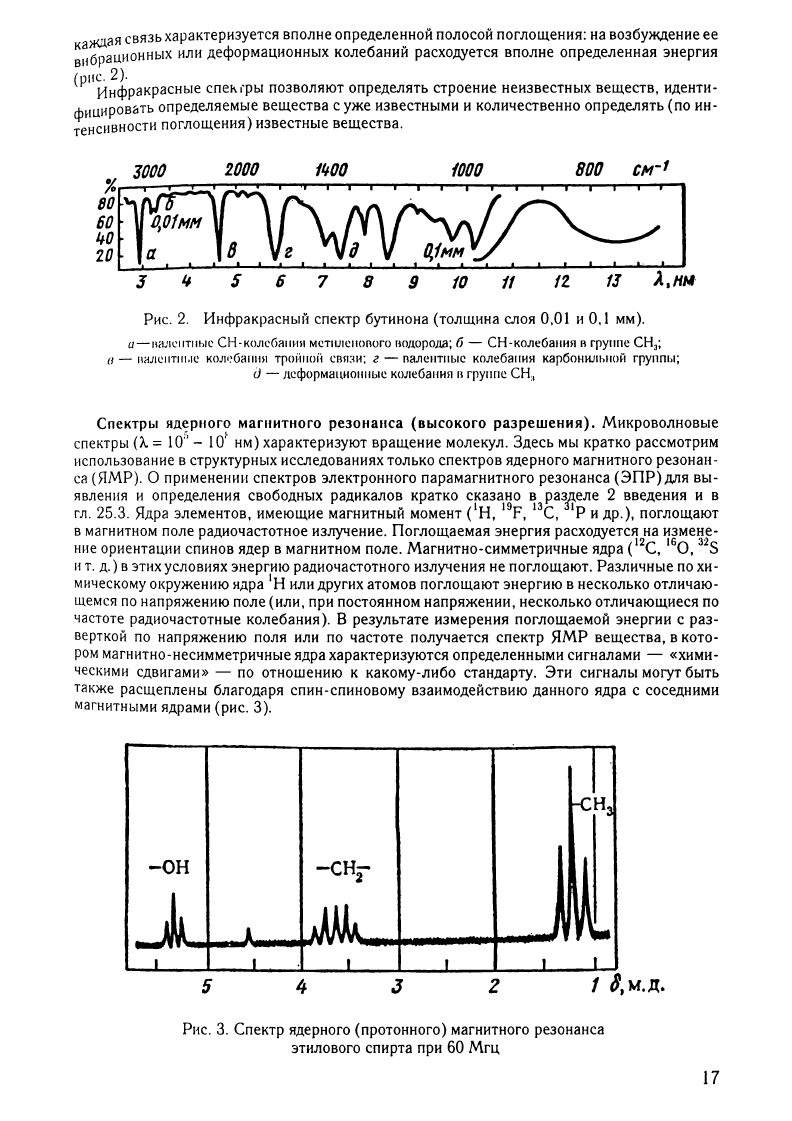
(риС.
2).
Инфракрасные
спеl\СРЫ
позволяют
определять
строенне
нензвестных
веществ,
иденти-
фицировать
определяемые
вещества
с
уже
известными
и
количественно
определять
(по
ин
тенсИВНОСТИ
поглощения)
известные
вещества.
fi
~
I
s
~
5 6 7 8 9
10
fI
12.
11
А,нtI
Рис.
2.
Инфракрасный
спектр
бутинона
(толщина
слоя
0,01
и
0,1
мм).
a-ВНJlОllТIIhIС
СН-колrба",,,,
MCTIUICII"BOCO
B"ДOPOдll;
б
-
CH-колебаllИЯ
R
грунпе
СН
з
;
(j
-
IШJlСIIТIII.IС
КОJl'~баIlШI
ТРОНIIОЙ
связи:
г
-
BaJleHTllbIe
колебания
карБОНИJlhlЮЙ
группы;
iJ
-
дсформаЩЮНIIЫС
К()Jlебания
11
ГРУШIС
СН"
Спектры
ядерного
магнитного
резонанса
(высокого
разрешения).
Микроволновые
спектры
(л.
=
10"
-
10}
нм)
характеризуют
вращение
молекул.
Здесь
мы
кратко
рассмотрим
использование
в
структурных
исследованиях
только
спектров
ядерного
магнитного
резонан
са
(ЯМР).
о
применении
спектров
электронного
парамагнитного
резонанса
(ЭПР)для
вы
явления
И
определения
свободных
радикалов
кратко
сказано
в
рашеле
2
введения
и в
гл.
25.3.
Ядра
элементов,
имеющие
магнитный
момент
ен,
19
F
,
13
с
,
l
р
и
др.),
поглощают
в
магнитном
поле
радиочастотное
излучение.
Поглощаемая
энергия
расходуется
на
измене
ние
ориентации
спинов
ядер
в
магнитном
поле.
Магнитно-симметричные
ядра
е
2
с.
160,325
И
т.
д.)
В
этих
условиях
энергию
радиочастотного
излучения
не
поглощают.
Различные
по
хи
MичecKoMy
окружению
ядра
l
н
или
других
атомов
поглощают
энергию
в
несколько
отличаю
щемся
по
напряжению
поле
(или,
при
постоянном
напряжении,
несколько
отличающиеся
по
частоте
радиочастотные
колебания).
В
результате
измерения
поглощаемой
энергии
с
раз
верткой
по
напряжению
поля
или
по
частоте
получается
спектр
ямр
вещества,
в
кото
ром
магнитно-несимметричные
ядра
характеризуются
определенными
сигналами
-
«хими
ческими
сдвигами»
-
по
отношению
к
какому-либо
стандарту.
Эти
сигналы
могут
быть
также
расщеплены
благодаря
спин-спиновому
взаимодействию
данного
ядра
с
соседними
магнитными
ядрами
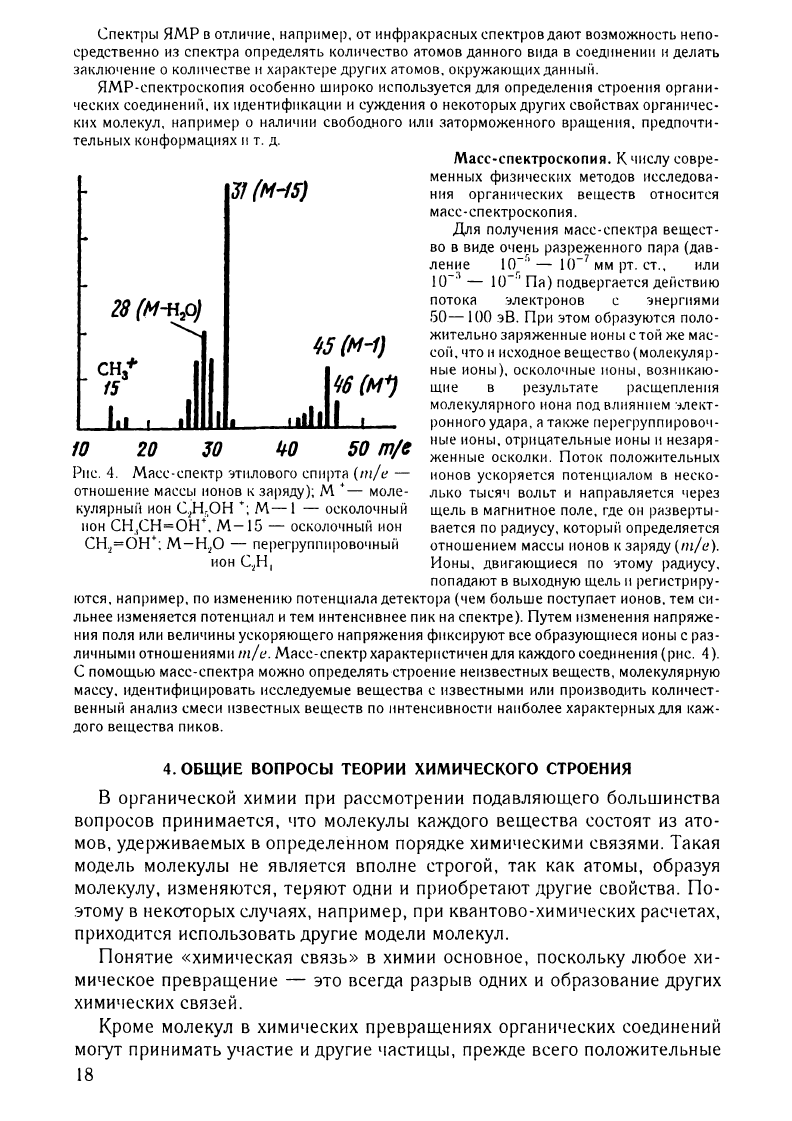
(рис.
3).
-он
Рис.
3.
Спектр
ядерного (протонного)
магнитного
резонанса
этилового
спирта
при
60
Мгц
17
Спектры
ЯМР
в
ОТЛИ'lие,
наПРlIмер,
от
инфракрасных
спектров
дяют
возможность
непо
средственно
из
спектря
определять
I<ОЛlI'lество
атомов
данного
Вllда
в
соеДIIнеНl1lt
11
деJlать
заКЛЮ'lение
о
КОЛlI'lестве
11
ХRрюпере
ДРУГIIХ
атомов,
окружающих
данный.
ЯМР-спектроскопия
особенно
ШIIРОКО
11спользуется
для
определеНllЯ
строеНIIЯ
оргаllИ
'Iеских
соединений,
11Х
IIдеНТИФllкаЦI1И
и
суждения
о
некоторых
других
свойствах
оргаНИ'lес
ЮIХ
МОJlекул,
наПРl1мер
о
наJlИ'lIШ
свободного
11Л11
заторможенного
вращеНIIЯ,
предпочти
тельных
I<онформациях
11
т.
д.
Jl
(M-I5)
28
(М-ИР)
,О
20
10
"'О
50
т/е
РIIС.4.
Масс·спеlПР
"'JТllЛового
спирта
(т/е
-
отношение
массы
IЮНОВ
к
заряду);
М
+ -
моле
КУJlЯРНЫЙ
ион
С;Н"ОН
+;
М-1
-
ОСI<ОЛО'lНЫИ
IIOH
СН.,СН=ОН+,
М-15
-
ОСКОЛО'lный
ион
СН,=ОН+;
М-Н,О
-
переГРУПI1I1РОВО'lНЫЙ
I10H
С,Н,
Масс-спектроскопия.
К
'Iислу
совре
менных
физических
методов
исслеДОВR
НIIЯ
opraHll'lecKllx
веществ
ОТНОСIIТСЯ
масс-спектроскопия.
Для
ПОJlучеНllЯ
масс-спектра
вещест
во
в
виде
очень
разреженного
пара
(дав
ленне
10-" - 1 0-7
ММ
рт.
ст..
ИJlИ
10-:1
-
10-"
Пя)
подвергается
деiiСТВllЮ
потока
электронов
с
-~неРГIIЯМИ
50-100
эВ.
При
этом
образуются
поло
жительно
зяряженные
ионы
с
той
же
мяс
coii,
'lТО
11
исходное
вещество
(молеl<УЛЯР
ные
ионы),
ОСКОЛО'lные
IIОНЫ.
В03НlIкаю
Щl1е в
результате
расщеПJlеНIIЯ
молеl<УЛЯРНОГО
иона под
ВJlИЯНllем
:iлект
ронного
удяра.
а
также
11ереГРУППlIРОВО'l
lIые
ионы,
отрицятельные
IlOны
11
незяря
жеНllые
ОСКОЛЮI.
ПОТОI<
ПОЛОЖllТельных
ионов
УСI<оряется
110теНЦllаJlОМ
в
неско
лы<о
тыся'l
BOJll.T
и
напраВJlяется
через
щель
в
магнитное
поле.
где
он
Рilзверты
вается
по
радиусу,
который
опредеJlяется
отношением
массы
ионов
1<
заряду
(т/е).
Ионы,
двигающиеся
по
,тому
радиусу.
попядяют
в
выходную
щель
11
реГИСТРI1РУ
ются,
няпример.
по
изменеНlIЮ
потенцияля
детеlПОРЯ
(чем
больше
поступяет
ионов,
тем
си
льнее
изменяется
потеНЦl1ЯЛ
и
тем
интенсивнее
ПИI<
ня
спектре).
Путем
IIзменеЮIЯ
напряже
ния
поля
или
веЛИ'lИНЫ
ускоряющего
няпряжения
фиксируют
все
обраЗУЮЩllеся
ионы
с
ряз
ли'lными
отношениями
т/е.
Мясе-спектр
характеРИСТИ'Iен
для
каждого
соединения
(pIIC.
4).
С
помощью
масс-спектра
можно
определять-строение
неllзвестных
веществ,
молекулярную
массу.
Iщентифицировать
исследуемые
вещества
с
11звестными
или
ПРОИЗВОДI1ТЬ
КОЛII'lест
венный
янализ
смеси
известных
веществ
по
Ilнтенсивности
наllболее
хярактерныхдля
каж-
дого
вещества
ПIIКОВ.
4.
ОБЩИЕ
ВОПРОСЫ
ТЕОРИИ
ХИМИЧЕСКОГО
СТРОЕНИЯ
В
органической
химии
при
рассмотрении
подавляющего
БОЛl>шинства
вопросов
принимается,
что
молекулы
каждого
веществ(!
состоят
из
(!то
мов,
удержив(!емых
в
определенном
порядке
химическими
связями.
Такая
модель
молекулы
не
является
вполне
строгой,
т(!к к(!к
атомы,
образуя
молекулу,
изменяются,
теряют
одни
и
приобретают
другие
свойства.
По
этому
в
некO'fОРЫХ
случ(!ях,
н(!пример,
при
кв(!нтово-химических
расчетнх,
приходится
использовнть
другие
модели
молекул.
Понятие
«химическня
связь»
В
химии
основное,
поскольку
любое
хи
мическое
превращение
-
это
всегда
рнзрыв
одних
и
обрнзовнние
других
химических
связей.
Кроме
молекул
в
химических
превращениях
ОРГННИ'lеских
соединений
могут
принимнть
учнстие
и
другие
чнстицы,
прежде
всего
положительные
18

и
отрицательные
ионы
и
оргаНИ'lеские
радикалы.
Современные
представ
ления
о
строении
молекул,
ионов
и
радикалов
будут
рассмотрены
в
этом
разделе.
Другие
У'lаствующие
в
реакциях
частицы,
например,
карбены,
будуТ
рассмотрены
в
последующих
главах.
Основы
теории
ковалентной
химической
связи
Особенности
ковалентной
связи.
Химическое
поведение,
реакционная
способность
молекулы
зависят
от
природы
составляющих
ее
атомов
и
от
их
взаимного
расположения.
Образуя
молекулу,
атомы,
изменяя
свое
со
стояние,
влияют
друг
на
друга.
Естественно,
няиболее
сильно
взяимодей
ствуют
атомы,
обрязующие
между
собой
химическую
связь.
Однако
и
в
том
случае,
когда
атомы
не
связяны
непосредственно
между
собой,
они
испытывают
взаимное
влияние.
Оно
передается
через
другие
атомы,
связанные
между
собой
(1l0лярицазия
молекулы),
или
через
окру
жнющее
IlРОСТРЯНСТВО
(эффект
поля).
Взяимное
ВJlияние
непосредственно
связанных
между
собой
нтомов
зя
висит
В
первую
очередь
от их
flрИрОДЫ
И
хяряктера
связи
между
ними.
РЯЗ.llичяют
два
основных
вида
ХИМИ'lеской
связи
-
коваленmнуlO
и
элекmРОВllленmнуlO.
Ковялентная
связь
возникяет
в
реЗУJlьтяте
обобще
IIИН
неспярешiыx
валентных
электронов
с
противоположными
спинями,
':IJlектровале~lТная
-
за
C'leT
передачи
неспаренного
электроня
одного
ilTOMa
другому
с
образованием
разноименно
заряженных
ионов,
которые
ВЗilИМНО
flРИТЯГИВЯЮТСЯ.
Схемятически
это
можно
1l0КЯЗЯТЬ
следующим
оБРilЗОМ:
КОВilлеНТНilЯ
связь
электровялеНТНilЯ
связь
В
оргянической
химии
мы
встречаемся
главным
образом
сковалентной
СВЯЗI,Ю.
РЯЗIIOВИДНОСТЬЮ
ковалентной
связи
является
связь
координационная.
При
ее
возникновении
пару
электронов,
связывяющую
двя
ядря,
пред
СТilвляет
только
один
из
ятомов
(донор),
тогда
кяк
другой
ятом
(акцептор)
предостявляет
только
свою
незяполненную
орбиталь.
Так
возникяет,
ня
пример,
ион
яммония
или
ион
BF4":
F
[Р]-
F-+
t-
F
-
F-t-F
РilЗНОВИДНОСТЬЮ
координяционной
связи
ЯВJlяется
:емun.олярная
свя"ь.
При
возникновении
ее
ятом-донор
зяряжается
положитеJlЬНО,
а
ilTum-акцептор
-
отрицательно:
А:+В
.....
А+:В-
(IIЛIIА-+В)
19

I(овалентная
химическая
связь
характеризуется
длиной,
наnравленно
стыо,
полярностью,
поляризуемостью
и
энергией.
Определения
всех
этих
понятий
можно
найти
в
любом
курсе
общей
и
неорганической
химии.
Дл
и н а
и
н
а
п р
а в
л
е н
н
о
с
т
ь с
в я
з
е
й
определяются
электро
нографическим
(для
газов),
рентгенографическим
(для
твердых
веществ)
или
спектральными
методами.
Расстояния
между
ядрами
во
времени
не
сколько
изменяются,
однако
средние
значения
сохраняются.
Точно
так
же
сохраняются
средние
значения
валентных
углов.
Длина
и
направленность
ковалентной
связи
между
двумя
определенны
ми
атомами
зависят
от
того,
с
какими
другими
атомами
они
связаны.
Так,
например,
длина
связи
С-С
в
зависимости
от
окружения
изменяется
в
пределах
0,154-0,140
нм.
В
а
л
е
н
т н
ы
й
у
г
о
л
С
-
С
-
Х
должен
быть
равен
1090
28'.
Одна
ко
он
может
быть
больше
или
меньше
на
несколько
градусов.
Знание
длин
связей
и
валентных
углов
необходимо
для
построения
пра
вильной
пространственной
модели
молекулы.
Кроме
того,
оно
дает
пред
ставление
о
распределении
в
молекуле
электронной
плотности
и
исполь
зуется
в
KB8htobo-химических
расчетах.
П
о
л
я р
н
о
с
т
ь с в я
з е
й
можно
определить
по
значению
дипольнога
момента
молекул или
из
спектральных
данных.
Ее
можно
также
рассчи
тать
kbaHTOBQ'-химическими
методами.
Эта
величина
зависит
от
природы
окружающих
атомов,
и
в
таблицах
приводятся
только
средние
значения.
Знание
полярности
связи
необходимо
для
сужедения
о
распределении
электронной
плотности
в
молекуле
и,
следовательно,
о
характере
ее
реак
ционной
способности.
П
о
л
я
риз
у
е
м
о
с
т
ь
с
в
я
з е
й
-
способность
изменять
полярность
в
поле
различных
фрагментов
или
других
частиц,
обычно
характеризуется
величиной
молекулярной
рефракции
(с.
95).
Э
н
е
р
г
и
я
с
в
я
з
и
определяется,
исходя
из
термохимических
(по
теп
лотам
образования,
сгорания,
гидрирования
и
т.
д.)
или
из
спектральных
данных.
Знание
энергии
связей
необходимо
для
суждения
об
их
прочности,
а
следовательно,
и
о
возможности
той
или
иной
реакции.
Следует
заме
тить,
что
прочность
связей
(термодинамичес"ий
фа"тор)
определяет
направление
реакций
только
в
состоянии
равновесия.
При
удалении
от
состояния
равновесия
прочность
связей
уже
не
является
решающим
фак
тором
в
определении
направления
реакции.
Оно
зависит
от
"инетиче
с"ого
фа"тора
-
энергии
активации.
Энергетические
уровни
в
атоме.
Орбитали.
В
современной
органической
химии
при
объяснении
реакционной
способности
оргаиических
соединений
широко
используются
кваllтово-механические
представлеиия
о
строении
атомов
и
молекул.
Из
квантовой
механики
известно,
что
электроны
в
атоме
располагаются
преимущественно
в
пределах
некоторых
стационаРflЫХ
орбиталей,
раЗЛII'lающихся
запасом
энергии.
Положение
электрона
не
мо
жет
быть
точно
определено.
Квантовая
механика
позволяет
находить
только
вероятность
пребывания
электрона
в
том
или
11НОМ
положении
относительно
ядра
(плотность
«электрои
ного
облака»).
20
