Петров А.А., Бальян X.В., Трощенко А.Т. Органическая химия: Учебник для вузов
Подождите немного. Документ загружается.


5
формальдегид
способен
вступать
в
раЗЛИЧНblе
реакции
конденсации
с
.
ванием
синтетических
смол,
широко
применяеМblХ
в
ПРОМblшленно-
образО
u
ф.
ф ф
Та
К
поликонденсациеи
ормальдегида
с
енолом
получают
фенол
ор-
ети.
' u 6
д
альдегидные
СМОЛbl,
с
мочевинои или
меламином
-
кар
aAtu
Н,ые
см,олы.
м
б
Продуктом
конденсации
формальдегида
с
изобутиленом
(в
присут
~и
H2S04)
является
4,4-диметил-l,3-диоксан,
КОТОРblЙ
при
нагрева
~::
до
200-240
ОС
в
присутствии
катализаторов
(Si0
2
+Н4Р207)
разла
гаетсЯ
с
образованием
изопрена
(гл.
1.3).
7.
О
раЗЛИЧНblХ
синтезах
на
основе
формальдегида
сказано
Вblше,
на
пример
о
производстве
глицерина
и
его
промеЖУТОЧНblХ
продуктах.
О
не
которых
других
синтезах,
например
нитро-
и
аминоспиртов,
см.
гл.
12.
Формалин
широко
применяется
в
качестве
дезинфицирующего
веще
-ства
ДЛЯ
дезинфекции
зерно-
и
овощехранилищ,
парников,
теплиц,
ДIIЯ
протравливания
семян
и
т.
д.
Уксусный
альдегид,
ацетальдегид
СНзСНО,
-
жидкость
с
резким
не
прятным
запахом.
Т.
кип.
21
Ос.
ПаРbl
ацетальдегида
ВblЗblвают
раздра
жение
СЛИЗИСТblХ
оболочек,
удушье,
головную
боль.
Ацетальдегид
хорошо
растворим
в
воде
и
во
многих
органических
растворителях.
ПРОМblшленные
методЬ!
ПОЛУ'lения
ацетальдегида
уже
бblЛИ
рассмот
рены:
гидратация
ацетилена,
дегидрирование
этилового
спирта,
изомери
зация
окиси
этилена
(см.
схему
5),
каталитическое
окисление
воздухом
предельных
углеводородов.
В
последнее
время
ацетальдегид
получают
окислением
этилена
кисло
родом
воздуха
в
присутствии
катализатора
по
схеме:
СН
2
=СН
2
+Н
2
О
+
PdCI
2
---.
CH:1-CHO
+
2НСI
+
Р{I
Pd
+
2CLICl
2
---.
2CuCI
+
PdCI
2
2CLICI
+
2НСI
+
1/202
---.
2CuCI
2
+ H:tO
2СН
2
=СН
2
+02
PdCI
2
12СНаСНО
CIICI
2
другие
1
-алкеНbI
образуют
в
этой
реакции
метилкеТОНbI.
Из
ацетальдегида
в
ПРОМblшлеННblХ
масштабах
получают
уксусную
кис
лоту,
УКСУСНblЙ
ангидрид, ЭТИЛОВblЙ
спирт,
альдоль,
бутиловый
спирт,
аце
тали,
этилацетат
,
пентаэритрит
и
ряд
других
веществ.
Подобно
формальдегиду,
он
конденсируется
с
фенолом,
аминами
и
дру
ГИми
веществами,
образуя синтетические
смолы,
которые
используются
в
Производстве
раЗЛИ'lНblХ
полимеРНblХ
материалов.
I10ддействием
небольшого
количества
серной
КИСЛОТbI
ацетальдегид
по
Лимеризуется
в
nаральдегuд
(С
2
Н
4
ОЗ)3
И
м,етальдегид
(С
2
Н
4
0)4;
количе
CTB<t
последнего
возрастают
с
понижением
температуры
(до
-10
ОС):
Г
I J
l~-CH:I
ЗСН:гСН=О
~
З~НгСН-О-
~
I t _
CH:гC~/
Н-СН:\
О
IIIII»LIII.JIСГJЩ
181

Паральдегид
-
жидкость
с
т.
кип.
124,5
ОС,
метальдегид
-
КРИстал_
лическое
вещество.
При
нагревании
со
следами
кислоты
оба
эти
вещестВа
деполимеризуются,
образуя
ацетальдегид.
Из
паральдегида
и
аммиака
по
лучают
2-метил-5-винилпиридин
(гл.
30.1),
используемый
при
СИНтезе
сополимеров
-
синтетических
каучуков.
Трихлоруксусный
альдегид,
хлораль
ССlзСНО,
получается
ХЛОРИро_
ванием
этилового
спирта
(гл.
3.1).
Хлораль
-
бесцветная
жидкость
с
резким
запахом;
с
водой
образует
кристаллический
гидрат
-
хлоральгидрат.
Устойчивость
хлораЛЬГидра_
та
объясняется
усилением
ЭJ\ектроноакцепторных
свойств
карбонильного
углерода
под
влиянием
сильного
индукционного
эффекта
хлора:
Cl,
а.
нон
CI-C-CH
--
ССl
э
-СН(ОН)2
Cl'
ga-
Обладает
снотворным
действием.
Конденсацией
хлораля
с
хлорбензо
лом
получают
в
промышленных
масштабах
инсектициды
(с.
441).
При
действии
на
хлораль
щелочей
образуется
хлороформ:
(J
СCI,\СНО+ОН-
Е
,.
CCI,\t-н
МС;VIСIIIЮ"
CCI~+HCOOH?CHCI'I+HCOO-
•
filACТlIll'
• •
Ацетон
СНзСОСН
з
-
бесцветная
жидкость
с
характерным
запахом;
т.
кип.
56,1
ОС,
пл.
0,798.
Хорошо
растворим
в
воде
и
во
многих
органиче
ских
растворителях.
Ацетон
получают:
1)
из
ИЗОПРОПИJIОВОГО
спирта
-
ОКИСJIением
или дегидрированием;
2)
ОКИСJlением
изопропилбензола,
получаемого
алкилировянием
бен
зола,
наряду
с
фенолом
(гл.
20.1);
3)
ацетон-бутянольным
брожением
углеводов
(гл.
33.1).
Ацетон
в
кячестве
растворителя
применяется
в
очень
больших
количе
ствах
в
лакокрясочной
промышленности,
в
производствах
ацетятного
шелка,
кинопленки,
бездымного
пороха
(пироксилина),
для
растворения
ацетилена
(в
баллонах)
и
т.
д.
Он
служит
исходным
продуктом при
произ
водстве
небьющегося
оргаНИ'lеского
стекла,
кетеня
и
т.
д.
2.
Н
ЕПРfДEJ1ЬНЫЕ
АЛЬДЕГИДЫ
И
КЕТОНЫ
Важнейшие
свойства
непредельных
альдегидов
рассмотрим
на
примере
только
акролеиня
и
кротонового
альдегида.
Акролеин.
Существует
несколько
методов
ПОЛУ'lения
якролеина.
1.
Альдольная
конденсация
формальдегида
с
уксусным
альдегидом
приводит
к
гидроксипропионовому
альдегиду,
который
далее
подвергается
дегидратации:
CH~=O
+
HCH~CHO
~
CH~OH-CH~-CHO
~
H~O
+CH~=CH-CHO.
182

Прямое
каталитическое
окисление
пропилена
2.
СН
1
=
СНСН:!
+ 02
~CH1
=
СНСНО
+
Н
1
О.
260-270·С
3
Дегидратация
глицерина
(гл.
3.4).
д'кролеин
-
бесцветная
жидкость
с
т.
кип.
52,5
ос,
пл.
0,841,
очень
Р
ы
м
запахом,
раздражающим
слизистые
оболочки.
ост
u
Акролеину
присущи
реакции,
своиственные
этиленовым
углеводоро-
дам
и
альдегидам.
Взаимное
влияние
двойной
этиленовой
связи
и
карбо
нильной
группы
находит
отражение
в
некоторых
особенностях
акролеина.
1.
Порядок
присоединения
НВг
не
соответствует
правилу
МаРКОВIIИ-
кова:
r---~--i,
CHz=CH-С=О
+
HBr
I . I
~
н'
I
L
_________
J,
~-бромпроПиОН08
..
iI
uьдеl'ИД,
Э-6ромпропаналь
в
случае
акролеина,
кротонового
альдегида
и
других
непредельных
сое
динений
с
сопряженными
двойной
и
карбонильной
связями
присоединение
галогеноводородов
происходит
по
концам
сопряженной
системы,
ПРИ'lем
ПОJlожительно
поляризованный
водород направляется
к
отрицатеJlЬНО
по
ляризованному
кислороду,
а
отрицательно
поляризованный
галоген
-
к
положительно
поляризованному
углероду
карбонильного
соединения:
3+
а
",,4- 1+1-
CH
2
=CH-СН=о
+
HBr---+-
CH
2
Br-СН=GН-ОН
~СН
2
Вr-СН
2
-СНО
Образующаяся
енольная
форма
альдегида
немедленно
превращается
в
более
устойчивую
карбонильную
форму.
Таким
образом,
хотя
водород
и
не
направляется
к
наиболее
гидрогени
зированному
атому
углерода,
как
этого
требует
правило
Марковникова,
тем
не
менее
присоединение
происходит
в
соответствии
с
электронной
по
ляризацией
реагирующих
частиц,
т. е.
по
существу
в
соответствии
с
той
БОJlее
общей
закономерностью,
которая
проявляется
и
в
реакциях
присо
еДинения
по
правилу
Марковникова
галогеноводородов
к
несимметрич
ным
олефинам.
2.
СИНИJlьная
кислота
присоединяется
к
акролеину
по
карбонильной
ГРУПпе:
.
СН
2
=СН-СНО
+HCN
--+
CH
2
=CH-CHOH-CN.
3.
ГИДРОСУЛЬфит
натрия
присоединяется
не
только
по
карбонильной
ГРУПпе,
но
и
по
этиленовой
связи:
,
он
I
СНг=сн-сн=о
+
2NaHSO;j
~
NaO:IS-СНгСНгСН-SО:INIt
183

4.
При
хранении акролеин
очень
легко полимеризуется.
В
ПРИСУТСТВIfЦ
незначительных
количеств
гидрохинона
он
более
стоек.
.
Акролеин
используется
для
получения
пластмасс,
отличающихся
боль_
шой
твердостью.
При
конденсации
акролеина
с
пентаэритритом
получают
полимеры,
по
внешнему
виду
похожие
на
обычное
стекло.
Предложено
использовать
акролеин.
в
качестве
исходного
вещеСТва
в
синтезе
глицерина,
а
также
меmион.ин.а
(с.
219).
Кроmон.О8ЫЙ
альдегид
снз-сн=сн-сно
(2-бутеналь)
-
жид
кость
с
резким
запахом;
т.
кип.
105
ос.
Получается
кротоновой
конденса_
lщей
ацетальдегида.
Применяется
дlIя
получения
масляного
альдегида
бутанола,
масляной
кислоты,
а
также
малеинового
ангидрида
(гл.
6.5). '
МеmUЛ8ин.uлкеmон.,
3-бутен-2-0Н
СН
з
-СО-Cl-I=СН
2
,
-
про
стейший
представитель
не
насыщенных
кетонов.
Получается
преимущест
венно
двумя
способами:
1)
гидратацией
винилацетилена:
,
Н
2
О
не
==
с
-
сн
=
СН
2
---тн;;~снз
-
СО
-
сн
=
сн
2
:
2)
конденсацией
формальдегида
с
ацетоном
и
последующей
дегидрата
цией
(при
нагревании)
образовавшегося
кетоспирта:
---)
сн
2
=сн-со-сн
з
+
н
2
о.
Метилвинилкетон
-
жидкость
с
т.
Кип.
81
ос.
Проявляет
свойства
как
кетона,
так
и
этиленовых
соединений.
В
отличие
от
акролеина
метил
ВlIнилкетон
присоединяет
HCN
не
по
карбонильной
группе,
а
по
двойной
связи:
Метилвинилкетон
легко
полимеризуется
в
бесцветную
стекловидНУЮ
массу,
применяемую
в
производстве
изделий
из
полимерных
материалов.
3.
КЕТЕНЫ
Кетены
-
своеобразные
соединения,
напоминающие
по
строению
не
предеЛЫ1Ь1е
кетоны
и
аллены.
Кеmен.
-
первый
представитель
ряда
кетенов.
Это
газ
с
резким
запа
хом.
Его
в
больших
количествах
получают
пиролизом
ацетона:
600-700
ос
снз-со-сн
з
---
__
СН
4
+СН
2
=С=О.
Кетен
не
проявляет
обычных
свойств
кетонов
-
не
дает
оксима,
фе
нилгидразона,
отличается
большой
СКЛОНностью
к
реакциям
присоедии
е
-
ния
(обычно
по
связи
с=о).
При
хранении
образует
димер
-
диKeгn
eH
.
184
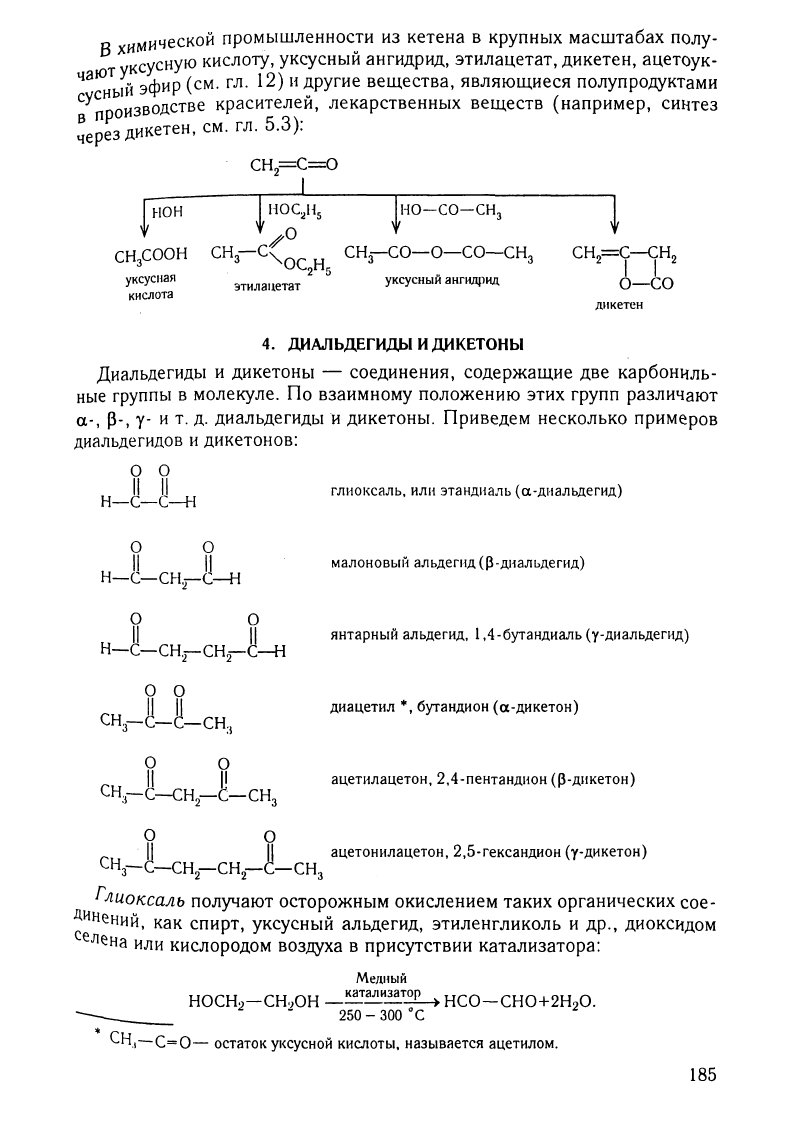
В
..
иуескоЙ
промышленности
из
кете
на
в
крупных
масштабах
полу-
хи
..
· u
ксусную
кислоту,
уксусныи
ангидрид,
этилацетат,
дикетен, ацетоук-
уа~нть;й
эфир
(см.
гл.
12)
и
~ругие
вещества,
являющиеся
полупродуктами
су
изводстве
красителеи,
лекарственных
веществ
(например,
СИlпез
в
про
5 3)
черездикетен,
см.
гл
..
:
УКСУСlJая
кислота
сн
2
=с=о
1
зтилацетат
Jно-со-сн
з
сн:гсо-о-со-снз
уксусный
аНГНЩJIIД
4.
ДИAJ1ЬДЕГИДЫ
И
ДИКЕТОНЫ
днкетен
Диальдегиды
и
дикетоны
-
соединения,
содержащие
две
карбоюlЛЬ
ные
группы
в
молекуле.
ПО
взаимному
положению
этих
групп
различают
а-,
Р-,
у-
и
т.
д.
диальдегиды
и
дикетоны.
Приведем
несколько
примеров
диальдегидов
и
дикетонов:
О
О
11 11
Н-С-С-+!
ГЛИОl\саль,
или
этандиаль
(ct-диальдегид)
о
о
11
11
H-С-Cl-lгС-+!
малоновый
альдеГlЩ
(!3-диальдегид)
о о
11
11
н-с-снгснгс-+!
янтарный
альдегид,
1,4-6утандиаль
(у-диальдегид)
о
о
11 11
Снз-с-с-сн:!
диацетил
*,
6угандион
(ct-дикетон)
ацетилацетон
,
2,4
-
пентандион
(!3-Дlfкетон)
о
о
с
11
11
ацеТОНlfлацетон,
2,5-гександион
(у-дикетон)
Н
з
-ё-сн
2
-сн
2
-с-сн
з
Глuоксаль
получают
осторожным
окислением
таких
органических
сое
Динений,
как
спирт,
уксусный
альдегид,
этиленгликоль
и
др.,
ДИОКСI1ДОМ
селена
или
кислородом
воздуха
в
присутствии
катализатора:
МеДIJЫЙ
носн
2
-сн,он
_
катаJlиза~
НСО-СНО+2Н
2
О.
____
-
250-300
ОС
•
СН,-с=о-
остаток
УКСУСНОЙ
кислоты,
называется
ацетилом.
185

Это
твердое
вещество
желтого
цвета
с
т.
пл.
15
ос
и
т.
кип.
50,4
OC~
в
расплавленном
состоянии
очень
бblСТРО
полимеризуется
в
твердый
бet
цвеТНblЙ
полимер
(тример
).
Глиоксаль
обладает
всеми
свойствами
альдегидов.
В
реакции
МОЖет
участвовать
как
одна,
так
и
две
карБОНИЛЬНblе
ГРУППbl,
например:
NII.oII
NOH
11
сн-сно
11
МШltЮКl,;llМ
"JlИОК!.:iШSl
NOH NOH
11
11
нс-сн
l".ПIЮКI.:IiМ,
сно-сно
J\ИОКСИМ
I"JIИIIКСНJISI
11.
N-NII-C
.11,
сн-сно
11
N-NH-C(;H"
фСllНJll'Нltl1itЖНI
CH-CH=N-NH-C
Н
11
6 5
N-NH-C!;H"
При
воздействии
концентрированного
раствора
гидроксида
калия
гли
оксаль
превращается
в
оксиуксусную
(г
ликолевую)
кислоту
(внутримоле
кулярное
окисление
-
восстановление,
реакция
Канниццаро):
сно
-
CHO~
HOCH~
-
соон.
(КОН)
Дuацеmuл
получают
из
метилэтилкетона
обработкой
азотистой
кисло
той
или
ее
аМИЛОВblМ
эфиром:
CH:I-~-CH2-CH:\
О
IIONO
<:,,11
ONO
-С)
11101
1
cн.-~-CH-CH
.
. \
11
1
.1
О
NO
СН:ГП-ТН-СН:I
О
NO
Образующийся
нumрозокеmон
изомеризуется
в
монооксим
дикетона:
CH.\-~-CH-Cн.\
~
Cн.\-~-(."'-CH.\
.
11
1 . .
11
11
.
О
NO
О
NOH
При
кипячении
последнего
с
разбавленной
серной
кислотой
получают
ся
диацетил
и
гидроксиламин:
cн.-~-~"'-cн.
(II,SO,)
~
сн.-с-(."'-сн
+
NH
он
.\
11
11
.\
11,0
.\
11
11
з
2
О
NOH
О
О
Диацетил
-
желтая
жидкость
с
острым
запахом,
т.
кип.
88
0
с.
ПарЫ
диацетила
имеют
жеЛТblЙ
цвет.
Диацетил
обладает
свойствами
кетонов,
причем
в
реакцию
может
ВСТУ
пать
или
одна,
или
обе
карБОНИЛЬНblе
ГРУППbl.
Например,
диацетил
с
гид-
186
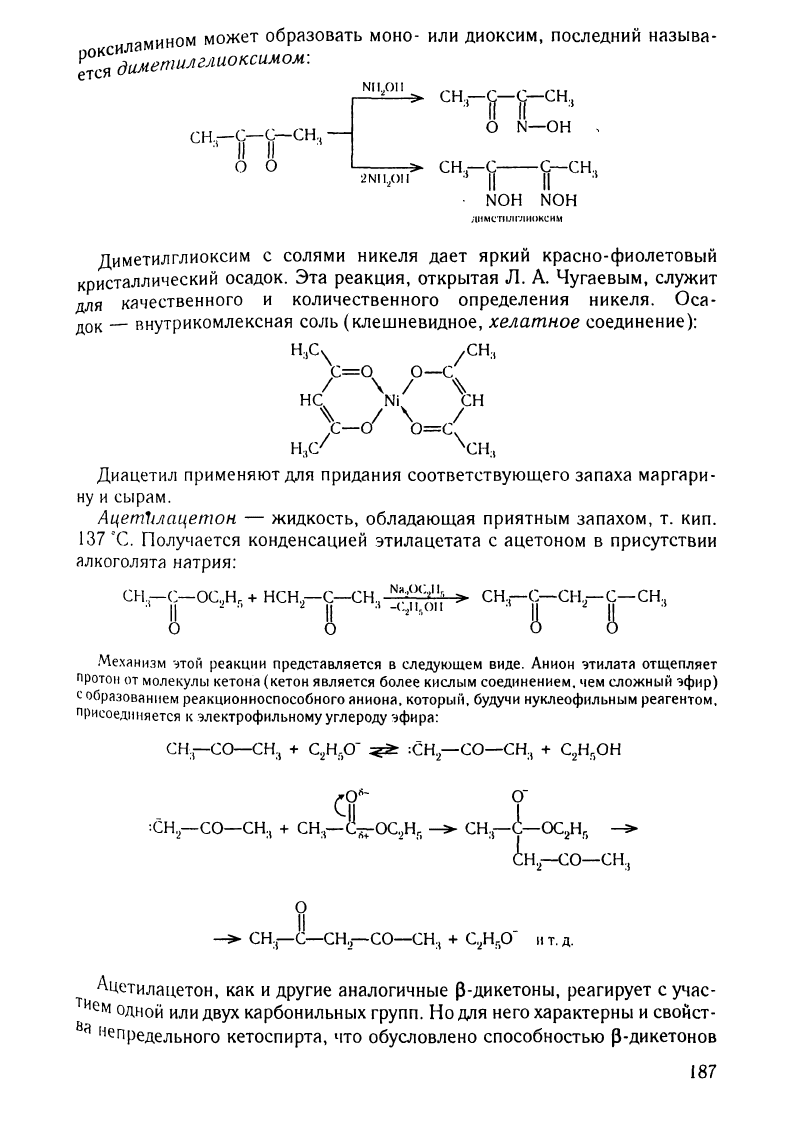
Р
оксила
М
ином
может
образовать
моно-
или
диоксим,
последний
наЗblва-
дu
.меmuлглuоксu.мом:
ется
Nllpll
сн·гс-с-сн!
-с
. "" .
о о
2Nllpll
CH-~-~-CH
.1
11
11
.1
О
N-OH
С
Н:I-п--п-СН:
1
NOH NOH
illiМСТIIJII"JIШ,КСНМ
Диметилглиоксим
с
солями
никеля
дает
яркий
kpacho-фиолеТОВblЙ
кристаллический
осадок.
Эта
реакция,
ОТКРblтая
Л.
А.
ЧугаеВblМ,
служит
ДЛЯ
качественного
и
количественного
определения
никеля.
Оса
ДОК
-
внутрикомлексная
COJlb
(клешневидное,
хелаmн.ое
соединение):
H:1C\
/СН:!
С=О О-С
Н<
\N/
\Н
'с-с!
'0=/
НаС/
\СН:!
ДиацеТИJJ
применяют
д.ля
придания
соответствующего
запаха
маргари
ну
и
сырам.
АцеmТlЛацеmон.
-
жидкость,
обладающая
ПРИЯТНblМ
запахом,
т.
кип.
137
0
с.
Получается
конденсацией
этилацетата
с
ацетоном
в
присутствии
аЛКОголята
натрия:
сн-с-ос.
Н"
+
нсн.-с-ен
N~.,OC211r,
~
СН-С-СН-С-СН
.!
~
l.,
2
~
.1
-С,IIr,ОIl
.1
~
2
~
.1
Механизм
этоl1
реаКЦliИ
представляется
в
следУющем
виде.
Анион
'пилата
отщепляет
протон
от
молекулы
кетона
(кетон
является
более
кислым
соединением.
'leM
сложный
эфир)
с
ОбразоваНllем
реакционноспособного
аниона,
которыl1.
будучи
нуклеофильным
реагентом.
ПрнсоеДlIняется
1(
электрофильному
углеродУ
~1фира:
СНгСО-СНа
+
с
2
н,р-
~
:ёН
2
-СО-СНа
+ C
2
Hr,OH
О
~
CH:I-~-CH2-CO-CH:1
+
с
2
н,р-
IIТ.Д.
АЦСТИJlацетон,
как
и
другие
анаЛОГИЧНblе
Р-дикетоны,
реагирует
с
учас
TlieM
одной
или
двух
карбонильных
групп.
Но
д.ля
него
характернЬ!
и
свойст
Ва
liепредельного
кетоспирта,
что
оБУCJIовлено
способностью
Р-дикетонов
187

к
таутомерному
превращению
-
самопроизвольной
обратимой
paBHQ.1
весной
изомеризации
-
кето-енольноu
таутО'м'ерuu:
':
СНЗ-С-
С
НZ-С-
СН
З
11
11
о о
диксmlll1311
форма
(15')(,)
Н
з
С,
С=СН
if
'C-СНз
\
...
/
kcto-еlЮJll>llаll
форма
(85')(,)*
.,
в
свободном
виде
ацетил
ацетон
представляет
собой
равновесную
смесь
дикетона
инепредельного
кетоспирта
с
сильным
преобладанием
по
следнего.
Большая
устойчивость
енольной
формы
(в
отличие
от
монокето.
нов,
гл.
5.1)
обусловлена
возможностью
образования
внутримолекуляр
ной
водородной
связи.
В
химические
превращения
ацетилацетон
вступает
и
как
дикетон
и
как
непредельный
кетоспирт.
ТIIК.
наПРllмер.
при
взаllмодействии
с
избытком
анилина
ацетилацетон
реагирует
какди·
кетон:
в
реакцию
ВСТУПIIЮТ
обе
карбонильные
группы:
СН.
-С-СН.-С-СН.
21·I,NCI;II,.
ЭI
С"Н
С
("Н
С
СН
\
, I
I()
'\-
- -
2-
-
.\
'о"
-
11
'-1,
'11
11
'
б
N-C,;H"
N-С';Нfi
J1И~ШIUI
fII~СПlJlаЦСnJIIi1
Сдругоil
стороны.
при
взаимодействии
с
металлическим
натрием
ацетилацетон
реагирует
как
непредельный
спирт.
образуя
енолят.
С
раствором
хлорида
железа
FeCl
a
он
дает
интен
сивную
окраску.
специфическуюД/lЯ
соединений.
содержащих
ГИЩJOКСIIЛЬНУЮ
группуу
атома
углерода
СДВОЙНОII
связью
11
т.
п.
НаТРl1ltенолят
aцeТl1JlaцeTOHa
npll
ВЗlIlIмодеЙСТВIIИ
с
галогеналкилами
превращается
валкилзамещенный
ацетилацетон.
т.
е.
наблюдается
замещение
не у
атома
KIICJlOpOдa.
11
у
атома
углерода:
·СН-С-СН=С-СН
+
С
2
Н.<,Вг
~
.\
" 1
,\
О
ONa
I
2:\
-1
5
СН-С-СН-С-СН
+ NaBr
,\
"1
"
.\
О
С
2
Н"
О
~11tJlаltСТИJlаII.tVn)II.
:4·'iTIIJI-2,4-IIСllТаIIЛIЮII
Это
ПРОЯВJIеНllе
двойственной
реакционной
способlЮСТlI
-
ШlбlliJенmносmu
-
аниО·
на
аЛКОГOJlЯТII
aцeТl1JlaцeToHa:
СН\-С-СН=С-СН\
~CH\-C-CH-C-CH\
•
'"
1_'
'"
".
о
6
о о
ДрУГllе
меТIIЛЛЫ
-
железо.
медь.
IIЛЮМИНl1It.
хром
и
т.
Д.
-
ТlIкже
образуют
енолятbI.
Эти
еноляты
11меют
строеиие
вунтрикомплеl<СНЫХ
хелаmНI>lХ
солей
ТI1Па:
..
Непредельные
CnltpTbI
этиленового
ряда
по
системаТИ'lеской
номенклатуре
имеJ01
окончание
-ен(}л.
188
MHOrl
1e
из
них
перегоняются
или
возгоняются
без
разложения,
'по
было
I1спользовано
Д/IЯ
•
ого
определения
валентности
некоторых
металлов
(HanpllMep,
аЛЮМllНI1Я
11
беРIIЛЛI1Я).
то
'н
•
•••
б
Подробнее
о
I(ето-енольнои
таутомерии
J.J
двоиствеННОl1
реаКЦIЮННОII
спосо
НОСТI1
см.
гл.
11.
АцетиЛ
ацетон
быстро
ГI1ДРОЛllзуется
теплыми
едкими
щелочами
с
образованием
СОЛI1
УК-
сусной
кислоты
и
ацетона:
CH:I-CO-CH~-CO-CH:I
+NaOH_CH:1COONa
+
CH:1-CO-CH:
1
·
Процесс
IIдет
по
следующей
схеме:
СН, СН,
1 . .. 1 .
н-о
..
: +
С-СН.-С-СН
--
H~O-CQH-C-CH
--
\\
2
11"
..
1 2
11
.,
Со
О
<";Q:
О
СН:,
..
1
-Н-О-С
-,
..
~
~y.Oy.
NaO-С-СН
11
3
О
..
11
О
+
:Сн
..
-С-СН,
•
11
.
О
СН,-С-СН,
.
11
.
О
ГЛАВА
6
одно.
И
МНОГООСНОВНЫЕ
КАРБОНОВЫЕ
КИСЛОТЫ
И
ИХ
ПРОИЗВОДНЫЕ
Органические
карбоновые
кислоты
характеризуются
наЛИ'lием
кар-
-
~O
ОО/(СUЛЬ/iОЙ
группы
-с"
.
По
числу
этих
групп
различают
ОДНО-,
дв
ОН
М
УХ-.
Трех-
и
вообще
многоосновные
кислоты.
Органические
кислоты
JI
oryт
быть
предельными
(насыщенными)
-
карбоксил
связан
с
алки
r
ОМ
-
и
непредельными
(ненасыщенными)
-
карбоксил
связан
с
не
'рел.еm,ным
радикалом.
189

1.
ОДНООСНО8НЫЕ
ПРЕдЕЛЬНЫЕ
КДРБОНО8ЫЕ
КИСЛОТЫ
С?дноосновные
предель~ые
карбоновые
кислоты
имеют
общую
ФОРМУ.I
лу
С//Н
2
//О
2
ИЛИ
С//Н
2
//
+
1СООН.
'
Изомерия.
Номенклатура
Кислоты
с
числом
углеродных
атомов
меньше
'lетырех не
имеют
ИЗОМе.
ров,
кислота
с
четырьмя
aтOMaMII
углерода
имеет
два
изомера,
для
кислот
общей
формулы
С
5
Н
I()O:Z
известно
четыре
изомера.
Число
изомеров,
как
и
следовало
ожидать,
увеличивается
110
мере
возрастания
длины
углерод.
ной
цепи.
Кислоты
от
С
1
дО
С
3
имеют
следующие
формулы
и
названия
(тривиаль,
ная
и
систематическая
номенклатура):
н-соон
СН:!-СООН
CH:!-ClI~-СООIl
CI-I:!-CI-I~-CH~-COOH
:,
:.!
I
СI-I.\-СН-(ООН
, 1
СН,
мураВЫIная,
метановая
кислота
УI{сусная.
,тановая
ЮIслота
ПРОПl10новая.
пропановая
Кllслота
масляная.
бутаНОВilЯ
l<ltслота
\\З0масляная.
ДllмеТI\ЛУI{сусная.
2-меПlлпропа-
новая кислота
CH:!-CH~-CB~-CH~-COOH
валериановая.
l1ентановая
ЮIслота
1 :,
~
I
CB:г~B-CНrCOOH
СН:,
'\
:,
~
\
СI-I.,-СН:,СВ-СООН
, - 1
св:,
св"
:,
21'
\
СI-I.,-С-СООI-I
, 1
СН:,
IIЗОПРОПIIлуксусная,
З,меТl\лбутановая
Юlслота
меПIЛ'НItЛУI{сусная.
2,меТI\лбутановая
ЮICJ\ота
тримеТИЛУКСУСI1ая.
2,2-диметltлпропановая
ЮIслота
По
систематической
номенклатуре
кислоты
ннзывают
по
соответстВУ
ющим
предельным
углеводородам
с
добавлением
окончания
-овая
и
слова
кислота,
г.ричем
счет
цепи
начинается
от
карбоксильной
гру"пы.
Тривиальные
название
некоторых
других
кислот:
CI-I:!-(CI-I~)4-COOI-I
I{апроновая
кислота
CI-I:
1
-(CI-I
2
);;-COOI-I
CHa-{
СН2)\lГСООН
CH:I-(CH2)14-COOH
CI-I:I-(СН2)lli-СООI-I
190
энантовая
кислота
лаурииовая
кислота
паЛЬМIПllновая
Юlслота
стеариновая
Кllслота
