Петров А.А., Бальян X.В., Трощенко А.Т. Органическая химия: Учебник для вузов
Подождите немного. Документ загружается.


ы
составляет
226,9
кДж/моль,
в
то
время
как
для этиленя
оня
рявия
;2.4
кдж/моль,
я
для
этяня
- 84,6
кДж/моль.
Поэтому
сжятый
яцети
лен
хранят
в
баллонах,
няполненных
адсорбентом,
пропитянным
подходя
lЦИМ
рястворителем
(обычно
ацетоном)
под
давлением
до
2,5
МПа
(25ЯТМ).
При
горении
ацетиленя
в
кислороде
рязвивяется
очень
высокяя
темпе
ратура
(до
3000
·С),
поэтому
он
широко
применяется
для
тяк
нязываемой
ацетилеllОВОЙ
свярки
и
резки
метяллов.
В
последнее
десятилетие
яцети
леll
получил
большое
применение
в
химической
промышленности,
преи
мущественно
для
получения
плястмасс,
каучука,
рястворителей.
Про
мышленное
использовяние
яцетилена
показано
на
схеме
4.
Вuнuлацеmuлен.
Значительная
часть
яцетилена
в
промышленности
перерябатывяется
на
виниляцетилен.
Кроме
того,
винилацетилен
образу
ется
в
I<ячестве
побочного
продуктя
при
получении ацетиленя
электрокре
кингом
из
метяня.
Виниляцетилен
-
при
обычных
условиях
газ.
Т.
кип.
+5·с.
Подобно
дивинилу
он
присоединяет
гялогены
в
3,4-
(по
яцетиленовой
связи)
и
в
1,4-положения.
Аналогично присоединяются
и
гялогеноводороды:
1,4-IIРШ:ОС-
{.i\
:\
~]
.
JtII\]~]II]~
СН~=С=СН-СН1:l
HC=C.:LCH~CH~
11<.1
~CIIP~
'-"'-==;':""';~
CH~=CCI-CH=CH~
)(JЮIЮ]]I'Ш
в
присутствии
кятялизяторов
(Cll;!Cl
2
И
др.)
1,4-яддукты
легко
изоме
ризуются
в
Э,4-я,ддукты.
Этя
реакция
используется
в
синтезе
хлоропрено
вага
I<ЯУЧУКЯ
из
винилацетиленя
(гл.
2.3).
Дuацеmuлен.
Диацетилен
(т.
кип.
1
О
·С,
взрывается
выше
60
·С)
полу
чяется
в
технике
в
кячестве
побочного
продуктя
в
производстве
яцетилена
ПИРОJlИЗОМ
метаня.
В
ляборятории
он
может
быть
ПОЛУ'lен
из
бутиндиоля:
Появление
в
соединении
двух
тройных
связей
сильно
увеличивяет
СКЛонность
его
к
реякциям
с
нуклеофильными
реягентями.
Дияцетилен
.lIегко
присоединяет
спирты
в
IlрИСУТСТВИИ
щелочей:
HC"'CC"'CH+ROH~HC"'CCH=CHOR.
ЛМИIIЫ
присоединнются
к
нему
на
холоду
с
выделением
тепла:
ди-
и
полиацетиленовые
соединения
встречяются
в
природе
преиму
ЩеСТвенно
в
высших
растениях
(Ф.
Больман).
111
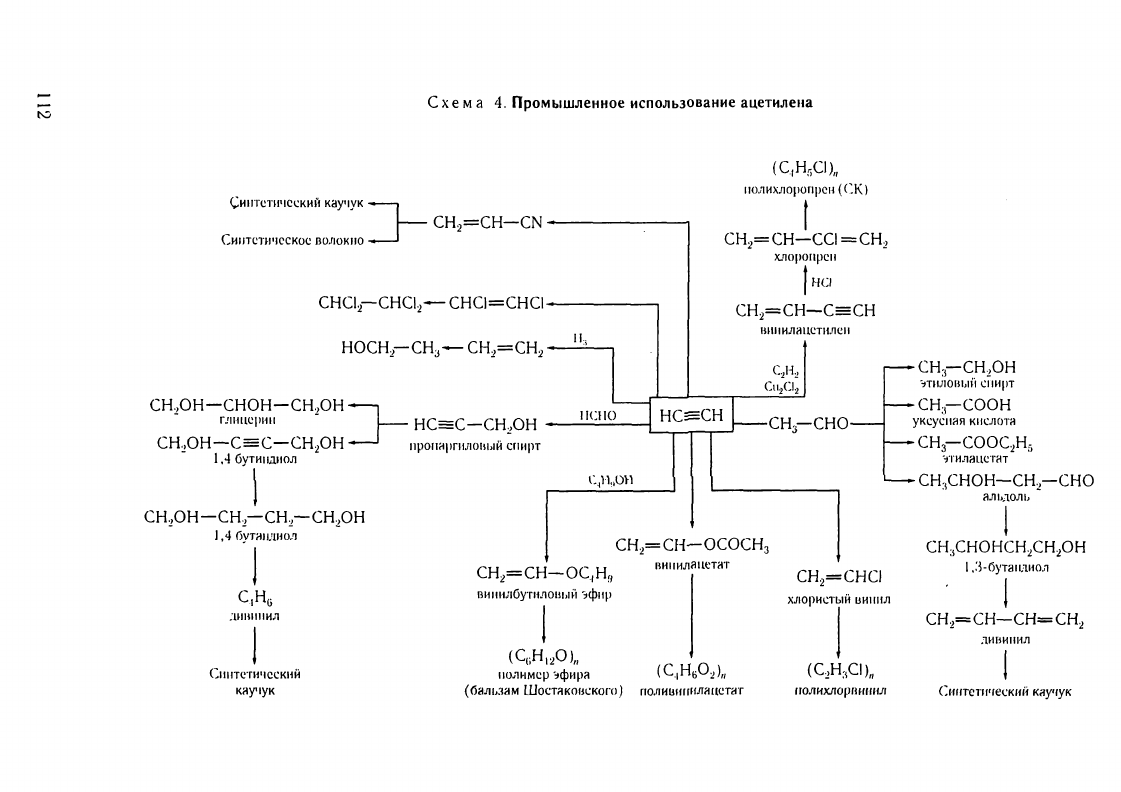
t-.:.
С
х е
м
а
4.
Промышленное
использоваиие
ацетилеllа
(,:юrтспr'rсский
KaY'rYK
J--
CH
2
=CH-CN
СиrJТСТИ'rсскос
BO.IIOKrro
СНСlгСНCl2-
CHCI=CHC
CI-c
.....,
с
11"
"шЬ
HCSCH
HOCH
2
-СН
з
-
СН
2
=СН
2
сн
2
он-снон-снрн
J--
г!rrщсриrr
нс=с-сн.,он
CH~OH-C=C-CH20H
IlРOlIИРПIJIOIIЫЙ
CllltpT
1,4
бут1иrr;uюn
CH~OH
-CH~-CH2-CHPH
1,4
БУТИllдио
..
1
J
C,H
G
:lИШlllн
..
1
СIIIПСТl1'IССКИЙ
КИУ'Iук
С,I-1"ОН
CH
2
=CH-ОС,Н
r
,
виrrИJlБУГИnОllыii
,фrrр
J
(С{;Н{2
0
)"
rю,щмср ,фира
(6вnr.13М
Шостаковского)
Rнrrиnаllстат
(C.
r
H
6
0
2
)"
по.nИUlllrllШЩСтат
(C,HoCI)"
rlOЛИХnОРОПРСН
(СК)
I
=СН
2
=СН
rr
- -
СНз-LН
{
СН:Г
СН
2
0Н
'jПIЛОИЫЙ
СIIИI'Т
СНгСООН
О
уксусrrИR
~rrсnоти
СН
з
-СООС
2
Н
5
~ти.ааНСТttТ
СН:,СНОН-СН
2
-СНО
I
СН
2
=СНCI
МОР"ст
,"шм
(C
2
H:,CI)"
ПМИXJIОРВIllIИJ'
аЛI
..
ДОЛI
..
I
CH:
r
CHOHCH
2
CHPH
1,:j-6утаr~1ИОn
I
СН
2
=СН-СН=
СН
2
дивиrrиn
СиrrТСШ'rескltii
KBY'rYK

ГЛАВА
2
моно·
и
ПОЛИГ
АЛОГЕНОПРОИЗВОДНЫЕ
УГЛЕВОДОРОДОВ
Гялогенопроизводные
можно
раССМ~lТривать
как
продукты
замещения
в
углеводородах
одного
или
нескольких
атомов
водорода
атомами
гялоге
нов.
В
соответствии
с
этим
могут
существовать
предельные
и
непредель
ные
моно-
и
полигалогенопроизводные.
'.
МОНОГдЛОГЕНОПРОИ3ВОДНЫЕ
ПРfДЕЛЬНЫХ
УГЛЕВОДОРОДОВ
Моногалогенопроизовдные
предельных
углеводородов
носят
название
галогеналкuлов.
Их
общая
формула
C
n
H
211
+,Hlg.
В
зависимости
от
поло
жения
атома
галогена,
характера
атома
углерода,
с
которым
атомы
гало
геня
СВЯЗRНЫ,
различают
первичные,
вторичные
и
третичные
галогено
производные:
RCH
2
-C1,
R
2
CH-CI
и
RзС-СI.
Изомерия.
Номенклатура
Изомерия
галогенопроизводных
зависит
от
строения
углеводородного
скеJlетн
и
положения
атома
ГRлогена
в
цепи.
Следовательно,
ГRлогенопро
изводные
имеют
большее
число
изомеров,
чем
предельные
углеводороды.
Изомерия
наЧИНRется
с
третьего
члена
ряда.
НRЗВRНИЯ
галогенопроизводных
по
систеМRтической
номенклатуре
обрязуют
из
нязваний
соответствующих
им
предельных
углеводородов,
добавляя
НRзвание
галогена
с
цифрой,
указывающей
его
положение
в
цепи.
Простейшие
галогенопроизводные
называют
по
входящим
в
них
радикалам:
СН:\-CI
СН:\-СН
2
С1
Cli:\-CH
2
-CH
2
C1
CH:j-СНCI-СН:!
СН:\-СН
2
-СН
2
-СН
2
-СI
CH:\-CHCI-CH2-CH~
CH:!-СН(СН
а
)-СН
2
С1
CH:\-CCI-CH:\
I
СН:
!
хлормеТ1IН.
ХЛОРltСТЫI-t
метил
(plic.39)
ХЛОР3Т1II1.
ХЛОРIIСТЫЙ
зтltл
l-ХЛОРПРОП1lН.
хлористый
ПРОПltЛ
2-ХЛОРПРОП1lН.
ХЛОРltСТЫЙ
изопропил.
IIЛИ
ХЛОРIIСТ"lii
ВТОРИ'lныii
пропил
l-хлорБУТIlН.
ХЛОРИСТЫЙ
БУТIIЛ
2-хлорБУТ1IН.
хлорltСТЫЙ
ВТОРИ'lныii
бутил
2-меПlл-l-хлорпропан.
ХЛОРllстыil
изоБУТItЛ
2-метил-2-ХЛОРПРОПIlН.
хлорltСТЫЙ
TpeTII'IHbIii
бутltл
Способы
получения
Моногалогенопроизводные
получают
из
предельных
углеводородов
ре
<I!Щией
ЗRмещения,
из
олефинов
-
присоединением
галогеноводородов,
ИЗ
спиртов
-
реакцией
с
галогеноводородами
и
галогенидами
фосфора.
J I:i

1.
Получение
моногалогенопроизводных
из
предель
ных
углеводородов
реакцией
замещения
атомов
водо
рода
галогенами
-
наиболее
важный
технический
ме
тод.
Особенности
реакции
замещения
водорода
ато
мами
галогена
были
подробно
рассмотрены
выше·.
Рис.
39.
Модель
мо-
2.
Присоединение
галогеноводородов
колефинам
лекулы
хлористого
идет
обычно
на
холоду
(гл.
1.2).
Этот
способ
особенно
метила
удобен
для
получения
моногалогенопроизводных,
так
как
реакция
не
сопровождается
образованием
побочных
продуктов
-
по~
лигалогенопроизводных,
как
это
происходит
при
использовании
первого
метода.
3.
Очень
часто
галогенопроизводные
получают
замещением
гидрокси
льной
группы
спиртов
галогеном:
а)
действием
галогеноводородов
R-OH+HCI
~
R-CI+H
2
0
или
R-ОН+КВг+Н
2
SО
4
--+
R-Вг+КНSО
4
+Н
2
О;
б)
галогенидов
фосфора
R-OH+PCI
5
--+
R-СI+НСI+РОСl
з
,
3R-ОН+РОСl
з
--+
3R-СI+РО(ОН)з:
в)
хлористого
тионила
R-OH+SOCI
2
--+
RO-SO-CI+HCI,
RO-SO-CI
--+
R-CI+S0
2
.
При
работе
с
РСl
з
в
качестве
побочного
продукта
образуется
сложный
эфир
Р(ОR)з.
Галогениды
фосфора
иногда
получают
непосредственно
в
реакционной
системе
взаимодействием
красного
фосфора
с
бромом
или
иодом.
Легче
всего
замещается
галогеном
гидроксил
у
третичного
атома
угле
рода.
В
этом
случае
часто
достаточно
взболтать
спирт
с
концентрирован
ной
галогеноводородной
кислотой.
В
первичных
спиртах
гидроксил
при
действии
галогеноводородов
замещается
только
в
присутствии
катализа
торов:
кислот,
галогенидов
цинка
и
т.
д.
Применение
хлористого
тионила
SOCl
2
для
получения
хлоралкилов
особенно
удобно,
так
как
все
побочные
продукты
этой
реакции
-
раство
римые
в
воде
газы,
которые
легко
отделяются
от
полученного
гало
геналкила.
4.
МОНОГf\логенопроизводные
получают
действием
галогенов
на
сухие
серебряные
соли
карбоновых
кислот.
При
этом
углеродная
цепь
укорачи
вается на
один
углеродный
атом:
HIg
2
R-СООАg
-~
R-СООНlg
-_~
R-Hlg.
•
Следует
отметить,
что
в
органической
химии
ярко
выражена
взаимосвязь
и
взаимная
обусловленность
различных
ее
разделов.
Одни
и
те
же
реакции
на
протяжении
всего
курса
приводятся
в
одних
случаях
как
характеризуюuцие
свойства
данного
класса'
соединений,
а
в
других
-
как
метод
получения
другого
класса
BeuцecTB.
114

5.
Фтористые
алкилы
получают
обменной
реакцией
из
хлористых,
бромиСТЫХ
или
иодистых
алкилов
действием
фторидов
Hg,
Ag,
Со,
Sb
и
др.
Например:
2С
2
Н
5
Вг+
HgF
2
--+
2C
2
H
s
F +
Hg
Br
2·
Реакции
между
хлористыми
и
бромистыми
алкилами
и
KF
в
обычных
условиях
не
проходят.
Однако
их
можно
провести
взаимодействием
KF
с
галогеналкилами
в
бензоле
в
присутствии
краун-эфира
-
8-краун-6
(гл.
4.2).
С
хорошим
выходом
и в
мягких
условиях
обменные
реакции
можно
проводить
с
помощью
ионообменных
смол
(гл.
1.2).
Физические
свойства
Физические
свойства
галогенопроизводных
зависят
от
природы
галоге
на,
состава
и
строения
углеводородного
радикала.
При
обычных
условиях
фтористые
метил,
этил,
пропил
и
бутил,
хлори
стые
метил
и
этил,
бромистый
метил
являются
газами.
Все
остальные
га
логеналкилы
-
жидкости,
высшие
представители
-
твердые
вещества.
Температура
кипения
галогеналкилов
с
одинаковым
углеродным
скеле
том
возрастает
от
фтористых
к
иодистым
алкилам;
при
одном
и
том
же
числе
углеродных
атомов
температура
кипения
ниже
всего
у
третичных
галогеналкилов.
Плотность
галогеналкилов
возрастает
при
переходе
от
фтористых
к
иодистым.
Низшие
галогеналкилы
обладают
сладковатым
запахом.
Они
практи
чески
нерастворимы
в
воде,
но
хорошо
растворяются
в
органических
рас
творителях
и
сами
являются
растворителями.
Галогеналкилы
обладают
значительной
полярностью.
В
ИК-спектрах
полоса
валентных
колебаний
связи
C-F
находнтся
в
об
ласти
длин
волн
1000-1350
CM-
1
,
связи
С-С!
-
около
600-800
CM-
1
.
Химические
свойства
Галогеналкилы
-
один
из
наиболее
реакционноспособных
классов
ор
гаНических
соединений.
С
их
помощью
вводят
в
различные
органические
Соединения
алкильные
радикалы,
т. е.
они
являются
алкuлирующuми
ре
агентами.
Наиболее
характерны
для них
реакции
нуклеофильного
заме
щения
(SN),
а
также
отщепления
(Е).
При
нуклеофильном
замещении
нуклеофил
атакует
молекулу,
предо
ставляя
для
образования
новой
связи
свои
электроны.
Электроны
разры
ваЮщейся
связи
уходят
вместе
с
освобождающимся
ионом.
Такие
реакции
ИДУт
только
в
жидкой
фазе,
обычно
в
растворах.
В
газовой
фазе
они
идти
Не
могут,
так как
диссоциация,
например,
связи
С-С!
требует
затраты
более
921,1·
кДж/моль.
В
жидкой
фазе
затрата
энергии
на
диссоциацию
115

значительно
ниже
(около
251,2
кДж/моль)
благодаря
выделению
тепло_
ты
гидратации
(сольватации)
ионов.
Скорость
замещения
атомов
галогенов
в
галогеналкилах
весьма
раз
лична
и
в
зна'lительной
степени
зависит
от
строения
радикалов,
с
которы_
ми
связан
атом
галогена,
а
также
от
при
роды
галогена,
нуклеофила
и
рас
творителя.
Заключение
о
влиянии
строения
радикала
на
скорость
нуклео_
фильного
замещения
можно
сделать,
сравнивая
относительные
скорости
гидролиза
галогеналкилов
в
присутствии
гидроксильных
ионов
(80%-ный
этанол
при
55
ОС):
Бромистый
аЛl<ltл
........
.
СН,Вг
С,Н,Вг
(СН,),СНВг
(СН,),СВг
Относительная
скорость
гидролиза
................
.
2140
171
5
1010
в
случае
бромистого
метила
и
бромистого
этила
скорость
гидролиза
пропорциональная
концентрации
как
гидроксильных
ионов, так
и
гало
генаJlкила
(реакция
нуклеофильного
замещения
второго
порядка
SN2).
ДЛЯ
бромистого
изопропила
нельзя
установить
простого
математичес
кого
соотношения
между
концентрацией
реагентов
и
скоростью
peaK~
ции.
В
случае
третичного
бромистого
БУТИJlа
скорость
реакции
зависит
только
от
концентрации
галогеналкила
и
не
зависит
от
концентрации
гидроксильных ионов
(реакция
нуклеофильного
замещения
первого
по
рядка
SN
{).
Это
можно
объяснить,
допустив,
что
замещение
при
углеродном
атоме
может
происходить
двумя
раЗJlИЧНЫМИ
путями,
причем
в
определенных
условиях
могут
иметь
место
одновременно
оба
процесса.
Гидролиз
третичного
бромистого
бутила
проходит
по
механизму
SN
{.
Это
-
двухстадийный
процесс.
Первая
стадия
-
обратимая
диссоциация
галогеналкила
на
ионы
(мономолекулярная
реакция):
(CH;j);jCBг
;::t
(CH;j);jC+ +
Вг-.
Диссоциация
идет
MeДТIeHHo
с
образованием
интермедиата
-
карбени
евого
катионн,
который
далее
быстро
реагирует
с
молекулами
раствори
теля
или
реагентн,
способными
давать
пару
электронов
для
знполнениЯ
внкантной
орбитали
углеродного
атома:
(CH;j);jC+
+ОН-
--+
(CH;j);tC-ОН
(быстро)
Скорость
реакции
в
целом
определяется
скоростью
нниболее
MeДТIeH
ного
процесса,
т. е.
скоростью
диссоциации,
и
потому
весь
процесс
заме
щения
проходит
в
соответствии
с
кинетическим
уравнением
ренкции
пер
вого
порядка.
В
случне
бромистого
метила
реакция
имеет
совершенно
другой
одно
стадийный
механизм
-
SN2.
116

Гидроксильный
ион
атакует
молекулу
бромистого
метила,
вытесняя
броМ
в
виде
иона,
причем
разрыв
связи
углерод
-
галоген
и
образование
новой
связи
углерод
-
кислород
происходит
одновременно:
[
Н
J
H,,~+
iI-
6-
l6+
6-
/н
НО-
+
/С-Вг
~
но
...
с.
..
Вг
~
НО-С,Н
+
Вг-
Н
I
/"
'н
Н
Н Н
РеакцИЯ
идет
через
переходное
состояние,
в
котором
связь
углерод
-
га
логен
удлинена
и
ослаблена,
в
то
время
как
связь
углерод
-
кислород
об
разовалась
только
частично.
В
представлеНllЯХ
теории
МО
переходное
СОСТОЯНllе
при
бимолекулярном
НУl\леОфIIЛЬ
ном
замещеНИl1
ВОЗНlIкает
в
результате
перекрывания
высшеl1
занятоli
орбиталн
нуклеофила
11
Нllзшеii
BaKaHTHoii
орбнтали
реагирующей
молекулы.
В
переходном
состоянии
орБИТl!Л1I
нуклеофила
и
уходящей
группы
перекрываются
с
про
ТlIВОПОЛОЖНЫМII
долями
одно
2
й
1I
той
же
p-орбllТаЛIl
углеродного
атома
реаlЩИОННОГО
центра,
находящегося
в
СОСТОЯНIНI
sp
·гиБРI1дllзации.
Такое
состояние
возможно
только
на
ма"симу,
ме
I<pllBoii
потенциальной
энеРГl1l1
и
ни
в
коем
случае
на
может
рассматриваться
l<aK
проме·
жуточное
соединеНllе
-
IlНтермедиат.
ПРfl
переходе
с
потереl1
энеРГIШ
"химичеСI<ОМУ
соеди
HeНlllO
ОДllа
113
групп
должна
УЙПI,
тю< как
атом
углерода
не
может
11ме'ГЬ
более
четырех
замеСТlпелеJI
11,
следовательно,
удерживать
более
8
злеIПРОНОВ.
Атака
в
принципе
может
осуществляться
тремя
способами:
с
TblJla,
с
фронта
и
латеральная
(боковая).
Вычисления,
основанные
на
физиче
ской
теории,
показывают,
что
энергия
образования
переходного
состоя
ния
является
наименьшей,
когда
нуклеофильный
ион
(или
MOJ\eКYJ\a)
ата
кует
реагирующую
молекулу
с
противоположной
стороны
(с
тыла)
по
от
ношению
к
замещаемой
группе
(галогену).
В
реакциях
гидролиза,
проходящих
по
этому
механизму,
скорость
про
ПОрциональна
концентрации
галогеналкила
и
реагента,
вызывающего
ГИдролиз.
Весь
процесс
хорошо
описывается
уравнением
второго
порядка
и
обозначается
SN2
(замещение
нуклеофильное,
бимолекулярное).
По
мономолекулярному
механизму
наиболее
легко
реагируют
третич
ные,
по
бимолекулярному
-
первичные
галогенопроизводные.
По
способности
к
замещению
галогены
рnсполагаются
в
ряд
I>Bг>CI,
СОВГlnДnЮЩИЙ
с
рядом
увеличения
основности.
Нуклеофильная
nктивность
реагентов
увеличивается
в
ря.11У
Н20<CI-<Вг-<НО-.
Этот
ряд
не
совпадает
с
ростом
основности
соот
ветствующих
реагентов'_
По
отношению
к
изменению
природы
растворителя
особенно
чувстви
тельны
реакции
типа
SN
1,
так как
сама
возможность
подобных
реакций
ОПределяется
ионизирующей
способностыо
растворителей.
В
реакциях,
протекающих
по
механизму
SN
1,
при
нейтральном
субстра
Те
Скорость возрастает
с
увеличением
полярности
растворителя.
В
про
Тонных
растворителях
они
и.11УТ
быстрее,
'leM
в
аПРОТОIIНЫХ.
В
реакциях,
-------
•
Основность
определяется
константой
ЮIСЛОТНО-ОСНОВНОГО
равновесия
(см.
гл.
1.4).
Это
теРМОДllнаМflчеСКltii
фактор.
Нуклеофильность
определяется
I<OHcTaHToii
CI<OPOCТlt
соот-
8еТСТВУlOЩIIХ
реаКЦIIЙ,
следовате,nьно,
это
КlшетичеСЮIJt
фактор.
117

протекающих
по
механизму
SN2,
увеличение полярности
растворителей
ведет
к
уменьшению
скорости
реакции,
за
ИСКЛЮ'lением
реакций
нейтра.,
льных
веществ
с
нейтральными
нуклеофилами,
когда
скорость
сильно
возрастает.
Механизмы
замещения
SN
1
и
SN2
в
жирном
ряду
преобладают,
однако
известны
и
другие
механизмы,
например
тетраэдрический,
отщепления
-,
присоединения.
Они
рассмотрены
в
других
разделах
(с.
127).
В
каждом
отдельном
случае
в
зависимости
от
природы
субстрата,
нук
леофила,
уходящей
группы
и
условий
реакции
осуществляется
тот
меха.
низм,
который
требует
меньшей
энергии
активации,
т. е.
обусловливает
большую
скорость
реакции.
Галогеllопроизводные
способны
также
отщеплять
галогеноводороды
с
образованием
олефинов,
т. е.
выступать
в
реакции
P-элиминироваННR.
Наиболее
часто
элиминирование
в
растворах
проходит
по
ионным
Mexa~
низмам
Еl
и
Е2.
Реакции,
протекающие
по
ЕI-механизму,
не
требуют
присутствия
ка
КИХ-Jlибо
реагентов,
но
необходим
ионизирующий
растворитеJlЬ.
Стадией,
определяющей
скорость
реакции,
ЯВJlяется
образование
интермедиата
-
карбениевого
иона,
который
переходит
в
стабильное
соединение
(оле
фив),
отщеПJlЯЯ
протон:
+11.,0
)
Er.tC:L1I~1111O
С!уН
CH
a
-{++
Н
2
О
СНа
СН
1
I .
CH1-C+
+
сг
. l
СНа
Реакции
отщепления
типа
Еl
обычно
сопровождаются
реакциями
за
мещения
SN
1.
Разветвленность
алкилыюй
группы
БJlагоприятствует
уве
личению
выхода
олефина.
Реакции
отщепления,
протекающие
по
бимолекулярному
механизму
Е2,
требуют
присутствия
основания.
Отрыв
протона
и
потеря
галогена
происходят
одновременно
(без
образования
промеЖУТО'lНОГО
соединения)
через
переходное
состояние,
в
котором
нуклеофильный
реагент
образует
связь
с
протоном
в
той
мере,
в
какой
происходит
отщепление
галогена,
например:
С
2
НД-
+
Н-СН
2
-СН-Вг
~
.,
I
СН:
1
118
[
C2Hr.O"'H"'CH2-1Н-ВГ]
~
СН:
1
111..'PCXOДlIOC
СОСТШIIIIiС
~
С
2
Н,-,ОН
+
СНР1Н
+
Br
СНа

скорость
такой
реакции
пропорционаю,на
концентрации
обоих
реаген
тов.
ОбычНО
одновременно
с
отщеплением
происходит
и
нуклеофильное
замещение
по
механизму
SN2.
Если
имеется
ВОЗМОЖНОСТЬ
дЛя
отщепления
галогеноводорода
в
двух
направлениях,
образуется
преимущественно
более
разветвленный
(энер
геТllчески
более
выгодный)
олефин
-
правило
Зайцева.
OAHal(O
направление
ЭЛИМliНllрования
зависит
от
природы
галогена.
Так.
пр"
дегидрога
логеНllроваНIIII
2-галогенпентанов
выход
l-пентена
IIзменяется
сле.дуЮЩliМ
образом:
C~H"F
8:3%.
C:jH1,CI
37%.
с"н"Вг
25%.
С"Н,,!
20% .
• 1
Пр"
термическом
ЭЛIIМllllllроваНIIИ
ре3lЩIШ
большей
частью
li.дyT
через
Цl1I(Лliческое
переходное
состояние
с
ГIРОТIIВОПОЛОЖНЫМ
направлеНllем
ЭЩiМliНllроваНIIЯ.
посколы(у
liX
CKOPOCТL,
заВИСIIТ
от
стаТИСТII'IеСI<ОГО
фактора
('Iliсла
атомов
вqдорода.
способных
к
отщеплеНIIЮ).
Кроме
указанных
механизмов
отщеплеНIIЯ
галогеноводородов
существует
еще
особыii
Elcl)
мехаНIIЗМ
(мономолеКУЛЯРllое
отщеплеНllе
сопряженным
oCHoBaHlleM).
при
котором
от
рыв
IlpOTOlla
предшествует
потере
уходящеil
группы:
Н
Х
Х
_~_~_
~
"C:'-(~-
+
Н:В
-х·
эо
"С-С/
I I
(il.юро
/ I
~CJUIt·"I()
/
,-
"
в
·;ТОМ
случае
CI(OPOCTb
реаlЩlI1I
ограНИ'l'lвается
наиболее
MeДJIeHHOl1
BTOPOI~I
cTaДlleil.
CKOPOCТU
реаlЩИII
"а
этой
стаДИII.
I(al(
и
в
случае
бllмолекулярного
отщеплеНIIЯ.
зависит
от
КОI1ltefПРЮ(IIII
aHllolla.
Активность
оснований
в
реакциях,
протекающих
по
механизму
Е2,
из
меняется
в
том
же
направлении,
'!ТО
и
их
сила:
NH~
>
ОС
2
Н;;
>
ОН-
> CH:1COO-.
При
обоих
механизмах
скорость
отщепления
гаJIогеноводородов
убы
вает
в
ряду:
третичные>
вторичные>
первичные
и
I>Br>CI.
Р(lССМОТРИМ
отдельные
реакции
галогенопроизводных.
1.
При
катаЛИТИ'lеском
гидрировании
галогеналкилов
ИJIИ
действии
на
liИХ
водорода
в
момент
выделения,
а
также
иодоводорода
происходит
за
мещение
атома
галогена
водородом:
R!
~R-H+НI
I
Кат.
I
С
2
Н
г.!+Ю
~
C
2
H
1j
+!2·
2.
действуя
раствором
соли
галогеноводородной
кислоты
в
спирте
или
~цeTOHe
на
галогенопроизводные,
можно
заменить
один
галоген другим.
ЕСЛIi
заменяют
хлор
бромом
ИJIИ
иодом,
то
следует
вести
реакцию
с
соля
Ми
щелочных
металлов,
хлориды
которых
хуже
растворимы,
чем
бромиды
11
11ОJtиды.
При
замещении
галогена
с
БОJlЬШОЙ
атомной
массой
raJIoreHOM
с
МеНыuей
атомной
массой
следует
применять
соли
серебра,
так
как
иодид
Се
б
Ре
)ра
менее
растворим,
чем
бромид
и
особенно
хлорид:
R-СI+Nа!;::::t
R-!+NаСI
R-I+АgСI;::::t
R-CI+A~!.
119

3.
Большое
значение
(для
получения
спиртов
из
углеводородов)
имеет
реакция
галогеналкилов
с
водой
(гидролиз).
Гидролиз
ведут
в
ПРИСУТСТВИИ
едких
щелочей
или
карбонатов
щелочных
металлов
при
нагревании,
ино.
гда
при
температуре
выше
температуры
кипения
воды
(в
автоклаве):
R-CI+H~O
+2
R-OH+HCI
R-CI+N~OH
~
R-ОН+NаСI.
BOJtIII,II:j
раСТIIОР
4.
При
действии
IНI
галогеналкилы
алкоголятов
образуются
ПРОСТые
эфиры:
C~H,jB'r+N~OC2H;;
~
С~Н,j-О-С~Нг.+NаВг.
1I11·.TIIJIOIII,lii
:.фltр
Кроме
того,
в
БОJIЬШИХ
или
меньших
количествах
образуются
непреде
льные
уг
леводороды.
5.
При
взаимодействии
с
аммиаком
и
аминами
галогеналкилы
алкили
руют
их
с
образованием
соответствующих
первичных,
вторичных
или
тре
тичных
аминов,
а
также
СОJ\ей
аммониевых
оснований
(гл.
3.2).
Приведем
здесь
только
реакцию
образования
первичного
амина:
CH:!I+NH:!
~
[СНаNН:!)+Г
~
CH:!NH
2
+NH
4
!.
6.
Реакцией
галогеналкилов
с
солями
синильной
кислоты
получают
цианистые
алкилы
(нитрилы)
и
изонитрилы.
ПОJ\ЬЗУЯСЬ
этой
реакцией,
можно
перейти
от
предеJ\ЬНЫХ
углеводородов
к
карбоновым
кислотам
(гл.
6):
CH4+CI~
~
СН:!CI
~
CH:!CN.
НI\СТОIIИТf1IIJI
7.
При
нагревании
с
солями
органических
кислот
галогеналкилы
дают
сложные
эфиры:
О
С
2
Н)
+
AgO-Со-СН;j
----+-
CH;j-~-ОС2Нfi
+
Ag!
HI\CTHT
серебрн
УКСУСlю·.ТIIJЮllыii
,фщ'
8.
При
нагревании
с
нитритом
серебра
они
образуют
нитросоединения
и
эфиры
азотистой
кислоты:
-с
C2H,jN02
+
AgI
С
2
Н,-,I
+ AgN0
2
IIIПIЮ·..,НII
C
2
H"ONO +
AgI
,.ТИJII
IIITpllT
Атакующая
в
этой
реакции
нуклеофильная
частица
-
ион
N02"-
ПРОНВJ\яет
двойственную
реакционную
способность
(амбидентные
свойСТ'
ва),
т. е.
может
присоединять
радикаJ\
по
азоту
(механизм
SN2)
или
КИСЛО'
роду
(механизм
SN
1
):
120
