Марголин В.И. Основы нанотехнологии
Подождите немного. Документ загружается.


6
ствованный вариант метода, названный "левитационно-струйным", использует бес-
контактное удерживание и нагрев испаряющейся капли металла полем высокочас-
тотного индуктора в потоке инертного газа. Метод позволяет, изменяя давление
инертного газа и скорость его потока, регулировать размер получаемых наночастиц
металла. Огромным преимуществом также является отсутствие контакта капли с
какими-либо примесями, благодаря
чему получаемые наночастицы металла не со-
держат лишних загрязнений.
Технологически более сложным являются способы получения наночастиц хи-
мическими методами, такими, как осаждение, восстановление металлов из оксидов
и других соединений, термическое разложение веществ
. При этом основными ус-
ловиями являются протекание реакции вдали от равновесия и высокая скорость об-
разования зародышей новой фазы в сочетании с малой скоростью их роста. Это
обеспечивается подбором температуры, при которой химическая реакция идет дос-
таточно интенсивно, а перенос через газовую фазу еще заторможен. Процесс осаж-
дения проводят в
растворе, газовом потоке или плазме. При восстановлении окси-
дов и галогенидов обычно используют водород или оксид углерода. При 750 − 1600
К этим способом получают порошки железа, ванадия, ниобия, тантала, хрома, мо-
либдена и вольфрама со средним размером частиц 0,1 мкм.
Одним из наиболее широко применяемых методов является химическое восста-
новление в жидкой фазе
, в водных и неводных средах. Химическое восстановление
является многофакторным процессом. Оно зависит от подбора пары окислитель-
восстановитель и их концентраций, температуры и рН среды, диффузионных и
сорбционных характеристик. В качестве соединений металлов обычно используют
их соли, в качестве восстановителей - алюмогидриды, борогидриды, гипофосфиты,
формальдегид, соли щавелевой и винной кислот. Широкое распространение
метода
связано с его простотой и доступностью. Поведение металлической частицы в рас-
творе в общем случае определяется разностью ∆Е =Е - Е
редокс
, где Е - равновесный
окислительно-восстановительный потенциал частицы, Е
редокс
- соответствующий
потенциал раствора. При ∆Е > 0 наблюдается рост частиц, при ∆Е <0 — их раство-
рение. При ∆Е = 0 имеет место состояние неустойчивого равновесия. Окислитель-
но-восстановительный потенциал частицы металла зависит от числа атомов и хи-
мическое восстановление осуществляется в термодинамически и кинетически не-
стабильных системах.
Наиболее часто для восстановления ионов металла используют тетрагидробо-
раты щелочных металлов (МВН
4
), которые осуществляют восстановление в ки-
слой, нейтральной и щелочной водной среде. Тетрагидроборатами щелочных ме-
таллов восстанавливается большинство катионов переходных и тяжелых металлов,
что связано с высоким редокс-потенциалом МВН
4
(в щелочной среде это 1,24 В), в
то время как стандартные редокс-потенциалы многих ионов металлов лежат в ин-
тервале -0,5 В < -Е < -1,0 В.
7
Особенности кинетики и механизма сложных и многофакторных процессов, та-
ких, как окислительно-восстановительное получение, рост и стабилизация наноча-
стиц металлов, нуждаются в дальнейшем изучении. Химическое взаимодействие в
системе восстанавливаемый ион металла - восстановитель может быть связано с
переносом электрона от восстановителя к иону металла через образование проме-
жуточного комплекса, которое снижает
энергию переноса электрона. Возможен и
механизм, также связанный с переносом электрона, но имеющий место при непо-
средственном участии поверхностного слоя растущей частицы металла.
Использование эмульсий и мицелл позволяет получать такие оригинальные
структуры, как наночастицы, заключенные в полимерную оболочку. Это позволяет
получать наночастицы с небольшим разбросом размеров и использовать их, к
при-
меру, в качестве наноконтейнеров. Такие частицы весьма своеобразно ведут себя
под воздействием температуры. Если частицы меди, образовавшиеся при 11 °С, на-
греть до 30 °С, то защитная функция полимерной оболочки теряется; при этом уве-
личивается агрегация и ускоряется окисление частиц металла. К противоположно-
му результату приводит понижение до 11 °С температуры системы, полученной
при 30 °С: агрегации частиц не происходит, их размер сохраняется неизменным, а
устойчивость к окислению повышается. Конкуренция различных процессов, свя-
занная с изменением температуры, отражается не только на устойчивости получен-
ных частиц, но и на их распределении по размерам.
Некоторой смесью физических и химических методов, ярко иллюстрирующей
междисциплинарный характер нанотехнологии являются
методы радиолиза и фо-
толиза - получения наночастиц в условиях воздействия на химическую систему
высоких энергий, что связано с генерацией высокоактивных сильных восстанови-
телей типа электронов, радикалов, возбужденных частиц. Фотохимическое (фото-
лиз) и радиационно-химическое (радиолиз) восстановление различаются по вели-
чине подводимой к системе энергии. Для фотосинтеза типичны энергии меньше 60
эВ, а
для радиолиза — 103-104 эВ. К основным особенностям химических процес-
сов под влиянием излучений высокой энергии относят: неравновесность в распре-
делении частиц по энергиям, перекрывание характерных времен физических и хи-
мических процессов, определяющее значение для химических превращений актив-
ных частиц, многоканальность и нестационарность процессов в реагирующих сис-
темах.
Фото- и радиационно-химическое
восстановление по сравнению с чисто хими-
ческим имеет определенные преимущества. Оно отличается большей чистотой об-
разуемых наночастиц, так как отсутствуют примеси, получающиеся при использо-
вании химических восстановителей и позволяет осуществлять синтез наночастиц в
твердых средах и при низких температурах. К достоинствам метода следует отне-
сти его доступность и воспроизводимость. В жидкой
фазе при получении наноча-
стиц значение имеют стадии, связанные с пространственным распределением пер-
8
вичных промежуточных продуктов. При радиолизе, в отличие от фотолиза, распре-
деление получаемых промежуточных частиц происходит равномернее и способст-
вует синтезу более узкодисперсных по размеру частиц.
Наличие одного электрона на внешней орбитали атома или иона в случае ме-
таллических наночастиц ведет к их высокой реакционной способности. Времена
жизни подобных частиц в
воде составляют микро- или миллисекунды, их оптиче-
ские свойства определяются их восстановительным потенциалом. Длина волны,
отвечающая максимуму оптического поглощения, при этом обычно сдвигается в
коротковолновую область спектра. Если находящиеся в начале периода атомы се-
ребра и золота обладают восстановительными свойствами, то их изоэлектронные
аналоги в конце периода - трехвалентные олово и
свинец - сильные окислители. В
пределах одной подгруппы для изозарядных ионов величина потенциала увеличи-
вается с возрастанием номера периода.
Применение в процессах синтеза низких температур (криохимия) открывает
новые перспективы для создания наночастиц, поскольку высокая активность ато-
мов и малых кластеров металлов в отсутствие стабилизаторов приводит к агрега-
ции в более крупные частицы
и процесс агрегации атомов идет без энергии актива-
ции. Стабилизацию активных атомов практически всех элементов таблицы Менде-
леева удалось осуществить при низких (77 К) и сверхнизких (4-10 К) температурах
методом матричной изоляции путем применения инертных газов при сверхнизких
температурах. Наиболее широко в качестве матриц используются аргон и ксенон.
Пары атомов конденсируют с
большим, обычно тысячекратным, избытком инерт-
ного газа на поверхность, охлаждаемую до 4-12 К. Сильное разбавление инертным
газом и низкие температуры практически исключают возможность диффузии ато-
мов металлов, и в конденсате происходит их стабилизация. Для осуществления хи-
мических реакций при низких температурах необходима подвижность стабилизи-
рованных в конденсате активных частиц. В принципе, матричная
изоляция и хими-
ческие превращения - взаимоисключающие процессы. Стабилизация активных час-
тиц ведет к отсутствию реакций, и наоборот, если имеет место химическая реакция,
то нет стабилизации. Поэтому для получения желаемого результата после криооб-
работки систему следует нагревать. При исследовании образцов, полученных ме-
тодом матричной изоляции, в процессе нагревания осуществлен ряд новых
и не-
обычных химических реакций атомов различных веществ со специально вводимы-
ми в низкотемпературные конденсаты химическими соединениями.
Процессы в низкотемпературных конденсатах являются неравновесными и за-
висят от многих факторов, в том числе от соотношения металл-лиганд, температу-
ры охлаждаемой поверхности, скорости конденсации, давления паров реагентов в
криостате, скорости нагрева образца. На
формирование наночастиц в процессе
криоконденсации наиболее сильно влияют: скорость достижения атомами охлаж-
даемой поверхности, скорость потери атомами избыточной энергии через взаимо-
9
действие с конденсатом и скорость удаления кластеров из области повышенной
концентрации атомов. Получение наночастиц путем соконденсации на холодной
поверхности позволяет легко вводить в их состав различные добавки, которые мо-
гут изменять физико-химические свойства системы.
Процессы соконденсации при низких температурах имеют массу своих особен-
ностей. Чаще всего синтез наночастиц осуществляется
в жидкой фазе, поэтому
приходится иметь дело с сольватированными частицами и процесс развивается по-
стадийно. Первой стадией является процесс соконденсации при 77 К с образовани-
ем слабосольватированного комплекса. В криохимии подобные комплексы имеют
огромное значение, т.к. превращают двухкомпонентную систему в однокомпо-
нентную и снимают диффузионные ограничения. Во многих случаях без
комплек-
сов нет химических реакций при низких температурах.
Вторая стадия - нагревание, ведущее к образованию системы М(металл)-
раствор. Третья стадия - дальнейшее нагревание, ведущее к формированию класте-
ров М
n
, находящихся в вязкой слипшейся среде типа жидкой глины. Наконец, по-
следняя, четвертая стадия - удаление избытка растворителя и получение системы
типа М
n
-растворитель. Это могут быть и кристаллические и аморфные состояния.
Процесс стадий 1-3 часто сопровождается не только формированием кластеров ме-
таллов, но и их реакциями с растворителем.
Окончательный, конечный размер частицы и ее состояние, например кристал-
личность, зависят от концентрации металла, активности растворителя и условий
нагрева, фактически во время роста кластеров могут
иметь место необычные и не-
ожиданные реакции с растворителем при низких температурах. С использованием
растворителей и сольватационных процессов получены необычные частицы, со-
держащие два различных металла, что имеет значение для создания промышлен-
ных катализаторов. Возможно образование нестабильных соединений из двух ме-
таллов, ранее считывшихся несмешивающимися. Предсказать свойства получаемой
пара практически невозможно
, т.к. морфология одной пары может очень сильно
отличаться от морфологии другой пары. В биметаллических кластерах очень вели-
ко влияние одного элемента на свойства другого.
С использованием коллоидных наночастиц металлов в качестве катализаторов
осуществлено получение полупроводниковых нанопроволок определенного диа-
метра. Проволоки получают лазерным распылением твердой мишени из GaP и зо-
лота (
катализатор). Раствор с частицами золота наносят на мишень, которую по-
мещают в кварцевую трубку, содержащую твердую мишень из GaP и находящуюся
в обдуваемом конце печи. Печь нагревают до 700 °С, и мишень распыляют в тече-
ние 10 минут с помощью эксимерного лазера. Лазерное распыление твердой мише-
ни используется для одновременной генерации наноразмерных каталитических
кластеров
металла и реагирующих атомов полупроводника, которые и образуют
полупроводниковую нанопроволоку. Размер катализирующей наночастицы опре-
10
деляет размер получаемой проволоки, причем в отсутствие частиц золота полупро-
водниковые проволоки не образуются.
Глава V. Раздел 4. Золь-гель технологии
Золь − гель технологии являются неким синтезом последних достижений нано-
технологии и коллоидной химии. Их суть заключается в получении в активной
среде (растворе или расплаве, содержащем растворитель и некую связующую суб-
станцию) крайне мелкодисперсной (до единиц нанометров размером) взвеси нано-
симого материала, нанесения этой взвеси на
поверхность подложки и удаления
растворителя и связующей субстанции. В результате на поверхности подложки ос-
тается тонкая пленка наносимого вещества, имеющая совершенно необычную
структуру и обладающая особыми свойствами.
Для начала рассмотрим некоторые основные, но не простые понятия, лежащие
в фундаменте золь − гель технологии. Дисперсными называют микрогетерогенные,
состоящие из двух и
более фаз системы, состоящие из множества малых частиц,
распределенных в непрерывной жидкой, твердой или газообразной среде, называе-
мой дисперсионной. Коллоидными системами называют дисперсные системы с
наиболее высокой степенью раздробленности вещества дисперсной фазы. Очевид-
но, что понятие дисперсной системы значительно шире, чем коллоидной системы.
Высокая дисперсность придает веществам новые качественные признаки. Свойства
вещества меняются, в зависимости от степени его раздробленности, и чем выше
соотношение поверхность/объем, тем больше и существеннее отличия. Частицы
дисперсной фазы имеют размер от нескольких нанометров до сотен микрон, что
уже несколько выходит за пределы наномира в своей верхней границе.
Большая поверхность раздела создает в коллоидных системах большой запас
поверхностной энергии Гиббса, что делает коллоидные системы термодинамически
неустойчивыми и чрезвычайно реакционноспособными. Классификацию дисперс-
ных систем проводят на основе различных признаков: по размеру частиц, по агре-
гатному состоянию дисперсной фазы и дисперсионной среды, по характеру взаи-
модействия частиц дисперсной фазы между собой и со средой.
Наиболее распространена классификация дисперсных систем по
агрегатному
состоянию дисперсной фазы и дисперсионной среды. Возможно существование
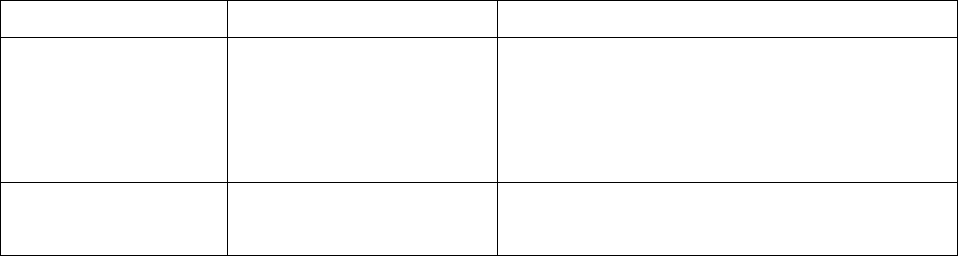
восьми типов коллоидных систем, для удобства ленивого читателя сведенных в
таблицу 5.4.1. Система ″газ в газе″ является гомогенной и поэтому в число рас-
сматриваемых в данной таблице случаев не входит.
Таблица 5.4.1
Дисперсная среда Дисперсионная среда Примеры дисперсионных систем
Газ
Жидкость
Твердое тело
Газ
Газ
Газ
Не существует
Туман, облака, аэрозоли
Дым, пыль, порошки, аэрозоли твер-
дых веществ
Газ
Жидкость
Жидкость
Жидкость
Пена, газовая эмульсия
Эмульсии, молоко

2
Твердое тело Жидкость Суспензии, коллоидные растворы
Газ
Жидкость
Твердое тело
Твердое тело
Твердое тело
Твердое тело
Твердые пены, хлеб, пемза, силика-
гель, активные угли
Жемчуг, гели, капиллярные системы
Минералы, сплавы, цветные стекла
Термин суспензия происходит от латинского слова "suspensio" (подвешивание),
то есть это дисперсии, в которых частицы дисперсной фазы находятся во взвешен-
ном состоянии в жидкой дисперсионной среде. Под термином ″золь − гель″ техно-
логия подразумевается совокупность процессов приготовления неорганических ма-
териалов, общими признаками которых являются гомогенизация исходных состав-
ляющих в виде
раствора, их перевод в золь, а затем в гель. Научное определение
золя звучит следующим образом. Золи - это высокодисперсные коллоидные систе-
мы, представленные мельчайшими частицами коллоидных размеров, равномерно
распределенными в дисперсионных средах. Наглядным примером золя является
сваренный, но горячий и еще не застывший студень, а геля − уже застывший и го-
товый к употреблению в качестве закуски. Стадия золь − гель перехода приводит к
формированию структурной сетки и протекает в жидкости, обычно в коллоидном
растворе, при нужной температуре.
Общими для всех дисперсных систем фундаментальными физико-химическими
признаками являются: гетерогенность, то есть наличие поверхности раздела между
фазами, и дисперсность - (раздробленность). Роль этих факторов
в проявлении раз-
нообразных свойств дисперсных систем и прежде всего их агрегативной и седи-
ментационной устойчивостей становится более существенной по мере увеличения
дисперсности и соответствующего уменьшения размера частиц и их концентрации
в жидкой и газовой дисперсионных средах. Агрегативная устойчивость - это ус-
тойчивость к коагуляции, т.е. слипанию частиц дисперсных фаз,
а седиментацион-
ная устойчивость - это устойчивость к их осаждению из дисперсионной среды. Со-
ответственно увеличивается и свободная (избыточная) межфазная энергия, а эта
энергия, как следует из принципа Гиббса—Гельмгольца, в дисперсных системах
стремится самопроизвольно уменьшиться.
Процесс уменьшения межфазной энергии реализуется в результате коагуляции
- укрупнения, слипания частиц, сопровождающейся снижением свободной поверх-
ностной энергии ∆F за счет уменьшения удельной поверхности дисперсных фаз
при возникновении контактов между частицами в соответствии с соотношением:
*
SNUSF ∆−∆=∆δ=∆
(1)
где δ - поверхностное натяжение, S— удельная поверхность системы. ∆U - из-
менение полной поверхностной энергии системы. Т- абсолютная температура, S* -
энтропия системы.
3
Процесс коагуляции особенно интенсивно протекает в гидрофобных агрегатив-
но неустойчивых дисперсных системах и при достижении некоторой критической
концентрации частиц дисперсных фаз в жидкой или газовой дисперсионных средах
приводит к спонтанному возникновению объемной пространственной структурной
сетки, которая и является гелем. Главными элементами такой структурной сетки
являются контакты между частицами и сами
частицы, в совокупности образующие
пространственные ячейки во всем объеме дисперсной системы. Дисперсная систе-
ма при этом становится структурированной, то есть переходит в совершенно новое
состояние.
Возникновение пространственных структур и переход от свободно - дисперс-
ных к связанно-дисперсным (агрегированным) системам кардинальным образом
изменяет их основные структурно-механические свойства. Они полностью утрачи-
вают агрегативную устойчивость, но при этом становятся седиментационно-
устойчивыми, так как наличие структурной сетки удерживает частицы дисперсных
фаз, зафиксированные в ней, от осаждения. Вместе с тем такие системы утрачива-
ют текучесть и подвижность, Вязкость непрерывно растет с ростом дисперсности и
соответствующим уменьшением размера частиц и их концентрации в дисперсион-
ных средах
. В числе многих факторов, определяющих сложную совокупность
свойств структурированных дисперсных систем, можно выделить две группы ос-
новных фундаментальных параметров. К ним относятся сила и энергия сцепления
(взаимодействия) в контактах между частицами дисперсных фаз и число контактов
между ними в единице объема.
В свою очередь сила и энергия взаимодействия в контактах
между частицами
зависят от природы контактов:
1. Непосредственных (атомных), возникающих в высокодисперсных порошках
с энергией сцепления порядка 10
-17
- 10
-16
Дж.
2. Коагуляционных, возникающих в пастах (суспензиях) или эмульсиях через
тонкую прослойку жидкости с энергией сцепления 10
-19
- 10
-18
Дж.
3. Прочных, так называемых фазовых контактов, характерных для конденсаци-
онных структур дисперсных материалов с энергией сцепления свыше 10
-17
- 10
-16
Дж.
Особенностью относительно малопрочных структур с контактами первого и
второго видов является их полная обратимость по прочности. Будучи разрушены,
они при прекращении внешних механических воздействий на структуру способны
самопроизвольно восстанавливаться до первоначального уровня. Это свойство, на-
зываемое тиксотропией, характерно для многих видов порошко- и пастообразных
дисперсий. Этого свойства полностью лишены
структуры с прочными фазовыми
контактами. Такие структуры, называемые конденсационными, получаются из
дисперсных систем с обратимыми по прочности контактами в результате фазовых
или/и химических превращений: путем кристаллизации из пересыщенных раство-

4
ров или расплавов (при их охлаждении), полимеризации, спекания, пластической
деформации при прессовании, удалении жидкой дисперсионной среды и т.д.
Минимальное значение площадки фазового контакта соответствует -10
2
меж-
атомных связей. По существу при такой минимальной площади фазовый контакт
не отличается от атомного, характерного для высокодисперсных порошков. По-
скольку на такой площадке (ее величина составляет примерно 10
-16
м
2
) вероятность
появления дефекта весьма мала, то прочность контакта приближается к теоретиче-
ской прочности идеального твердого тела. Можно сказать, что прочность таких
структур весьма высока, что следует взять на заметку и запомнить.
При образовании сетчатой структуры число коагуляционных контактов между
частицами дисперсных фаз резко спонтанно возрастает, и соответственно растут
прочность и
вязкость образующейся структуры. Тем не менее в начальной стадии
этого процесса структура еще сохраняет способность к тиксотропному восстанов-
лению после прекращения механических воздействий. Далее на фоне коагуляцион-
ных структур образуется структура нового типа, основным элементом которой ста-
новится сросток, то есть прочный фазовый контакт. Прочность структуры при этом
резко возрастает.
Вместе
с тем разрушение таких фазовых контактов (в отличие от первоначаль-
но возникающих коагуляционных) носит уже необратимый характер и поэтому со-
провождается необратимым понижением прочности образовавшейся структуры.
При этом она полностью утрачивает способность к тиксотропному восстановлению
после разрушения. Такой непрерывный переход одного типа структур в другой, их
сосуществование, а затем на
завершающей стадии процесса превалирование струк-
тур с необратимо разрушающимися фазовыми контактами характерен для получе-
ния многочисленных дисперсных материалов с различными видами связующих,
типа цементов. Естественно, что этому переходу соответствует также и непрерыв-
ное изменение вязкости, модуля упругости и прочности дисперсных структур.
Основными параметрами, определяющими возникновение таких структур и
возможность их существования
являются критический характерный размер частиц,
начиная с которого становится возможным возникновение дисперсных структур в
дисперсных системах и критическая концентрация частиц дисперсной фазы, при
достижении которой такие структуры возникают. Можно предположить, что коа-
гуляционная структура в дисперсных системах может возникнуть в том случае, ес-
ли молекулярные силы сцепления между частицами (f
с
) становятся соизмеримыми
с весом (или превышающими вес) частиц дисперсных фаз в данной среде (Р).
Тогда для характерного среднего диаметра частицы d для систем с непосредст-
венными атомными контактами (порошков) можно записать:
3/1
c
g
f
d
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
ρ
≈

5
где ρ - приведенная плотность частицы в данной дисперсионной среде, g— ус-
корение силы тяжести.
Для дисперсий с жидкой дисперсионной средой (пасты, суспензии) в случае
лиофобных взаимодействий (ближняя коагуляция') критический размер частиц d
может быть получен из соотношения:
2/1
1
g
A
h
k
d
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
ρ
≈
а для структур, образуемых слабыми коагуляционными контактами:
2/1
22
gh3
B
h
1
d
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
ρ
π
≈
где h
1
и h
2
- расстояния между поверхностями контактирующих частиц (факти-
чески толщина прослойки жидкости между частицами), k=0,2 - безразмерный ко-
эффициент, A - константа молекулярных взаимодействий (константа Гамакера,
∼10
-19
- 10
-20
Дж), B - константа, учитывающая электромагнитное запаздывание
дисперсионных сил на дальнем расстоянии - свыше 10 нм, и равная 10-28 Дж⋅м.
Золь − гель технология подразделяется на две группы принципиально разных
способов − получения ″химического геля″ (гидролиз и поликонденсация алкоокси-
дов) и ″физического геля″ (гелирование неорганических золей). При технологии
″химического геля″ исходными
материалами являются алкоксиды металлов или
неметаллов, из которых приготовляется гомогенный спиртовой раствор, из которо-
го методами гидролиза и поликонденсации получают мономеры оксидов. Эти мо-
номеры переводятся в гомогенный некристаллический гель, из которого за счет
термообработки получают так называемый ксерогель. Технология ″физического
геля″ заключается в приготовлении гомогенного водного, а не
спиртового (увы),
раствора солей металлов или неметаллов, из которого методом гидролиза получают
аква−, гидроксо− и оксо−комплексы. Эти комплексы переводят затем в гомогенный
коллоидный золь, из которого получают некристаллический гель и аналогично ксе-
рогель.
Вдумчивый и внимательный читатель безусловно заметит, что в обоих случаях
технологические процессы начинаются с приготовления растворов
, после чего идут
операции гидролиза и поликонденсации. (Для невдумчивого читателя напомним,
что гидролизом называется реакция разложения вещества под действием воды. Так,
к примеру гидролиз целлюлозы под действием минеральных кислот позволяет по-
лучать популярный в массах гидролизный спирт). Однако, только в технологии по-
лучения ″физического геля″ требуется приготовление устойчивого золя.
Алкокси-
ды также позволяют синтезировать золи, но, как правило, гели получают, минуя
явно выраженное состояние золя.
