Лесникова Н.П. Физическая химия. Самостоятельное решение задач по химической термодинамике, электрохимии и кинетике
Подождите немного. Документ загружается.


211
всего времени протекания реакции, то можно считать, что вы-
полняются условия
.0;
max
dt
Bd
constBB
"
Принцип квазистационарных концентраций имеет большое
значение для составления кинетических уравнений при описании
сложных реакций, протекающих в три и более стадий. Применение
этого принципа позволяет путем частичной замены дифференциаль-
ных уравнений алгебраическими, выразить концентрации неустой-
чивых промежуточных соединений через концентрации аналитиче-
ски определяемых исходных веществ и конечных продуктов.
Метод основан на том, что при определенном соотношении
констант (k
2
>> k
1
) устанавливается некая стационарная концен-
трация промежуточного продукта, которая сохраняется в тече-
ние длительного периода времени. В этом состоянии (стационар-
ном) скорость образования промежуточного продукта равна ско-
рости его разложения, что позволяет принять общую скорость
изменения концентрации промежуточного продукта равной нулю –
условие стационарности.
В методе стационарных концентраций используется также
принцип независимости протекания реакции. Известно, что число
элементарных актов химического превращения намного меньше
числа столкновений молекул в единице объема. Время одного акта
химического превращения ≈ 10
-13
с. В течение такого короткого
промежутка времени можно считать, что каждый из них протекает
независимо друг от друга. Если в системе несколько элементарных
реакций (стадий), то каждая из них протекает по тем же законам, с
той же скоростью, как и в отсутствии других реакций при тех же
концентрациях и температуре.
Из этого принципа независимости вытекает важное следствие:
"если в системе протекает несколько элементарных реакций или
стадий одной сложной реакции с участием одного и того же веще-
ства, то изменение концентрации последнего равно алгебраической
сумме скоростей каждой стадии, умноженной на стехиометриче-
ский коэффициент этого вещества в данной реакции".
.
,
1
, si
s
si
i
W
dt
dc
(3.106)

212
Рассмотрим применение метода стационарных концентраций
Боденштейна для решения кинетических задач на примере сложных
реакций.
Пусть необходимо вывести уравнение скорости реакции проте-
кающей в газовой фазе по предполагаемому механизму:
.
2
2
2
2
2
22
4
3
2
1
цепиобрывBrBrBr
цепиростBrHBrBrH
цепиростHHBrHBr
цепиеобразованиBrBrBr
HBrHBr
k
k
k
k
(3.107)
В данной реакции конечным продуктом является HBr; неус-
тойчивым промежуточным продуктом являются радикалы
Br
и
H
.
Конечный продукт реакции образуется во второй и третьей
стадии, поэтому уравнение скорости его образования имеет вид:
.
2
3
2
2
BrHkHBrkW
(3.108)
В уравнение скорости входят концентрации неустойчивых
промежуточных радикалов. Из условия стационарности и принципа
независимости протекания реакция получим
.
0
0
2
3
2
2
2322
2
4
2
32221
BrHkHBrk
BrHkHBrk
dt
Hd
dt
dc
BrkBrHkHBrkBrk
dt
Brd
dt
dc
H
Br
(3.109)
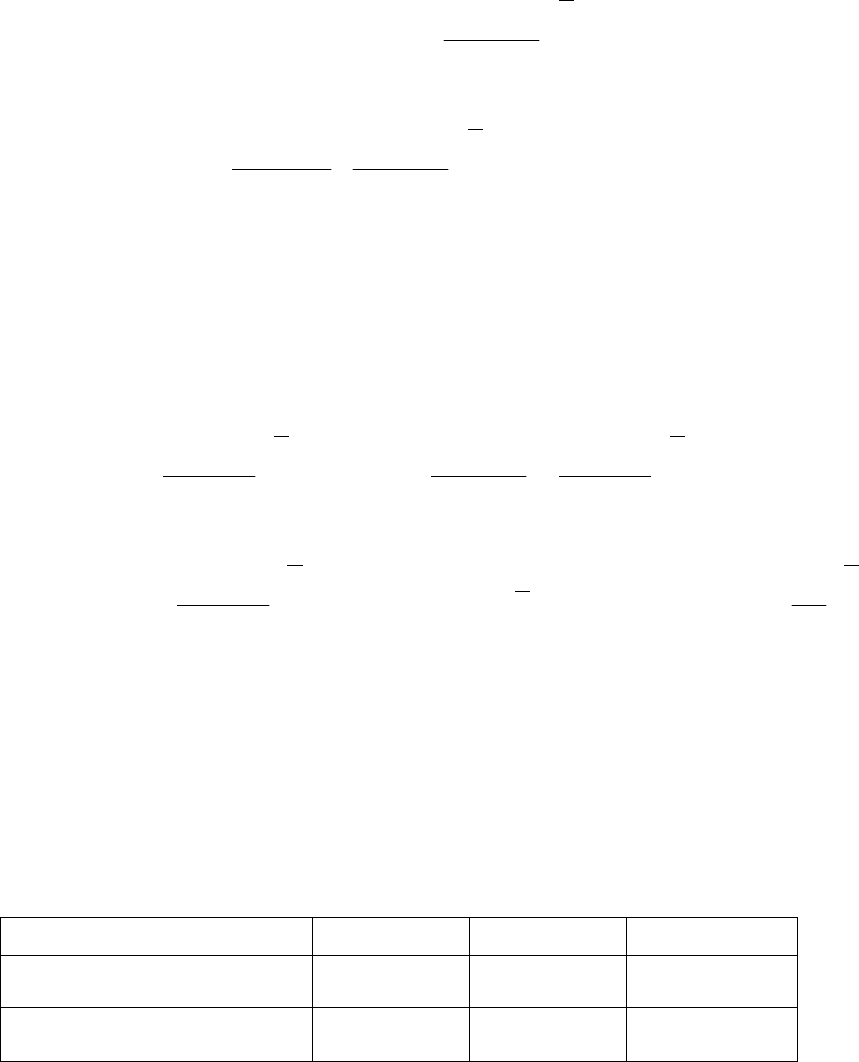
Подставим последнее соотношение в уравнение скорости образова-
ния и расходования радикала брома, тогда после математических
преобразований получим выражение, позволяющее определить кон-
центрацию этого радикала:
.
0
2
1
4
21
21
2
4
2
4232321
k
Brk
BrBrkBrk
BrkBrHkBrHkBrk
(3.110)
213
Подставим полученное выражение концентрации радикала брома в
уравнение (3.109) и выразим концентрацию радикала водорода:
.
2
1
4
21
23
22
2
1
4
21
2223
k
Brk
Brk
Hk
H
k
Brk
HkBrHk
(3.111)
Таким образом, получены выражения концентраций неустой-
чивых промежуточных продуктов через концентрации определяе-
мых реагентов. Подстановка значений концентрации радикалов
(3.110), (3.111) в уравнение скорости образования конечного про-
дукта (3.108) позволяет представить это уравнение в виде
.2,2
2
1
4
1
2
2
1
22
2
1
4
21
22
2
1
4
21
23
22
23
2
1
4
21
22
k
k
kkгдеBrHk
k
Brk
Hk
k
Brk
Brk
Hk
Brk
k
Brk
HkW
эфэф
Пример 80. Для газофазной мономолекулярной обратимой ре-
акции первого порядка
В
А
тепловой эффект
Н
реакции ра-
вен 47,3 кДж/моль. Измерения давления реакционной среды при
различных температурах в зависимости от времени дали следующие
результаты:
время, мин 0 10 58
ПаРТ
2
10;623
133,33 111,20 46,66
ПаРТ
2
10;723
133,33 49,86
Определить энергию активации прямой и обратной реакции.
Решение. Обозначим константу скорости прямой реакции как
1
k , а константу скорости обратной реакции как
1
k .
Определим сумму константы скорости прямой и обратной ре-
акции и, соответственно, значение каждой константы скорости при
температуре 623 Κ . Реакция имеет первый порядок, значит
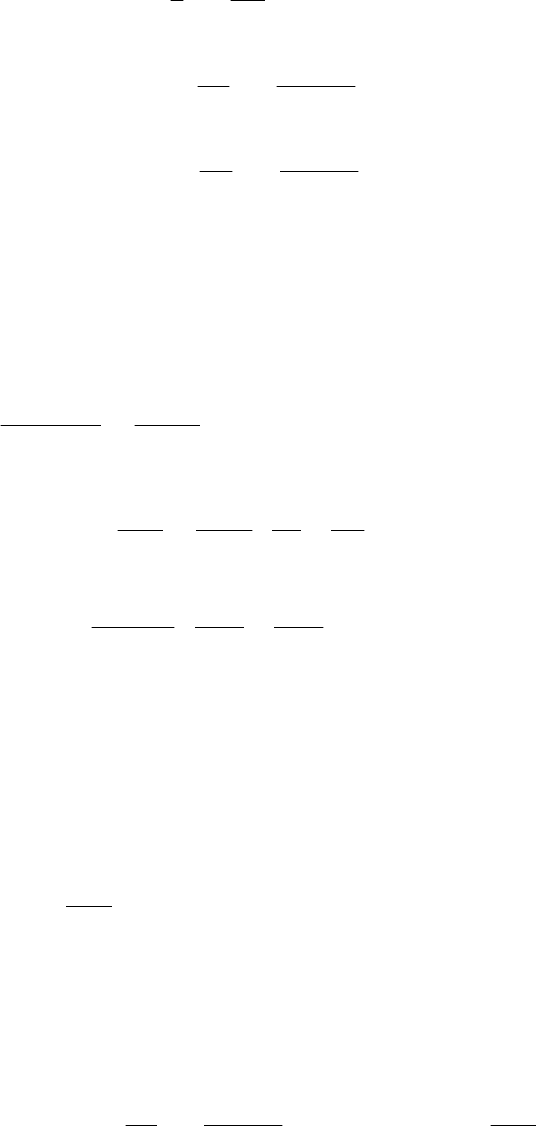
214
.018,0
;018,0
4666
13333
ln
58
1
;0181,0
11120
13333
ln
10
1
;ln
1
1
1
1
1
58
11
1
10
11
0
11
минkk
минkk
минkk
P
P
t
kk
Чтобы определить значение каждой константы, определим из
уравнения изобары константу равновесия, которая по физическому
смыслу равна соотношению констант прямой и обратной реакции.
.54,3;26,1
723
1
623
1
31.8
47300
11
lnln
;
ln
211
1
2
K
TTR
H
k
k
K
TR
H
dT
Kd
p
Таким образом, при температуре 623 Κ найдены значения сум-
мы констант скорости реакции и соотношение констант. Решением
системы двух уравнений определяем значение каждой константы
скорости реакции.
.0051,0;013,0
;54,354,3
;018,0
1
1
1
1
11
1
1
11
минkминk
kk
k
k
kk
Аналогично определяем значение констант скорости прямой и
обратной реакций при 723 Κ.
.022,0;076,0
;54,3;098,0
4986
13333
ln
10
1
1
1
1
1
1
1
10
11
минkминk
k
k
kk
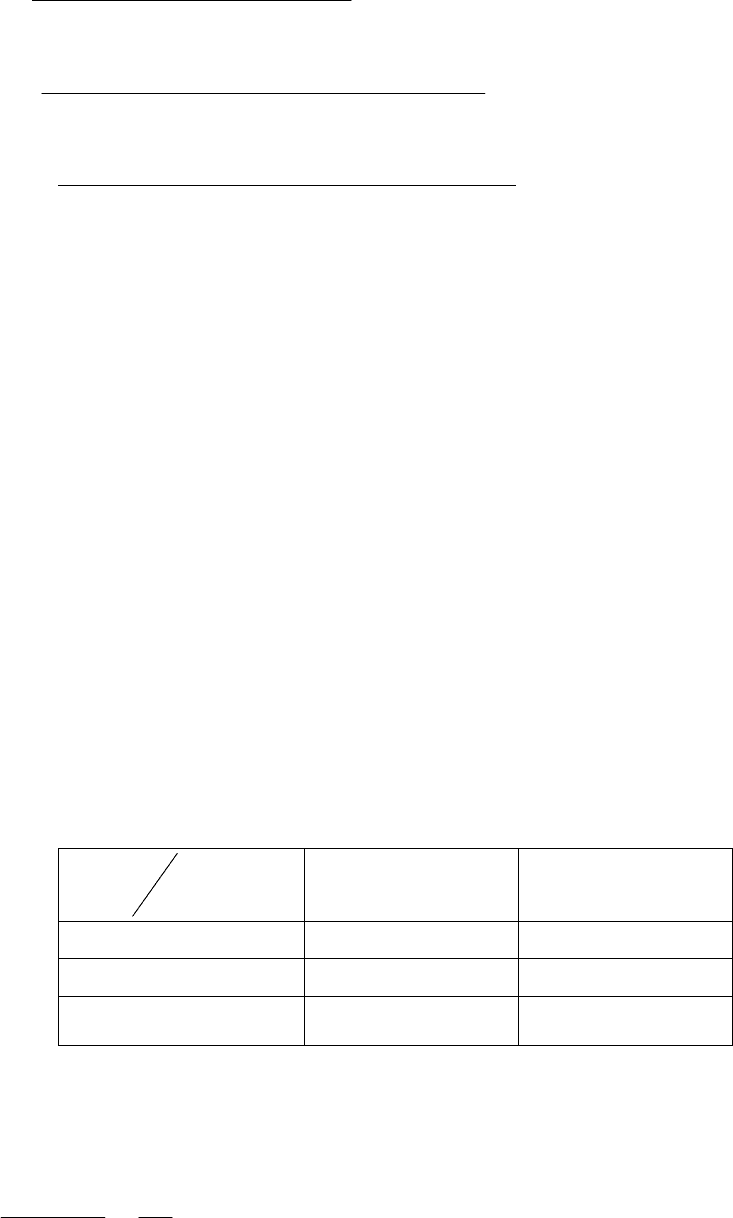
Найденные значения константы скорости прямой и обратной
реакций при различных температурах, позволяют определить энер-
гию активации прямой реакции и обратной реакции из уравнения
Аррениуса:
215
./54648
623723
72362331,80051,0ln022,0ln
;/65983
623723
72362331,8013,0ln076,0ln
;
lnln
1
1
12
21
12
мольДжЕ
мольДжE
TT
TTRkk
E
TT
Пример 81. Кинетика реакции этерификации этанола (избыток
этанола и воды) муравьиной кислотой
ОНННСООСНСООНОННС
25252
отвечает реакции первого порядка в обоих направлениях. Начальная
концентрация муравьиной кислоты равна 1,0 М. При температуре
25
0
С константы скорости реакции в прямом и обратном направле-
нии соответственно равны:
.1076,1;1085,1
13
1
13
1
минkминk
Определить процентное содержание образующего продукта
(этилформиата) при достижении равновесия в системе; а также рас-
считать время, необходимое для протекания реакции этерификации
на 80 % от равновесного состояния.
Решение. Выразим концентрации реагентов до начала реакции,
в течение реакции и при достижении равновесия следующим обра-
зом:
Запишем кинетическое уравнение, с помощью которого выра-
зим и определим концентрацию этилформиата при достижении рав-
новесия:
;,0
;
11
11
xkxakxxwtпри
xkxak
dt
dx
dt
xad
равн
Выразим
х и после подстановки всех величин, получим:
вещества
время
НСООН
52
ННСООС
0
t
а
0
t
х
а
х
равн
t
ха
х

216
.1012,5
1076,11085,1
1,01085,1
12
33
3
11
1
лмоль
kk
ak
x
Процентное содержание этилформиата (или % превращенной
муравьиной кислоты) будет равен:
%.2,51100
1,0
1012,5
100
2
с
х
Для ответа на другие вопросы задачи, выразим константу об-
ратной реакции как:
.
1
1
x
xak
k
Это выражение подставим в кинетическое уравнение скорости; вве-
дем дополнительную величину
x
a
k
1
, ввиду постоянства вели-
чин
а
и
х ; разделим переменные и проинтегрируем с учетом на-
чальных условий (х = 0 при t = 0), получим
.ln
;
;
00
11
txx
dt
xx
xxd
xx
dt
dx
x
a
kxx
x
a
k
dt
dx
tx
Выразим из полученного выражения время, необходимое для
протекания реакции на 80 %
.lnln
1
1
xx
x
ak
x
xx
x
t
По условию задачи реакция этерификации протекает на 80%, т.
е. достигаемая концентрация продукта равна
.10096,41012,58,08,0
122
лмольхх
После подстановки в уравнение времени всех числовых значе-
ний, найдем искомое время:
.4,445
10096,412,5
1012,5
ln
1,01085,1
1012,5
2
2
3
2
минt

217
Пример 82. Реакция этерификации этилового спирта уксусной
кислотой является обратимой и отвечает кинетике второго порядка в
обоих направлениях.
.
2523352
ОННСООССНСООНСНОННС
При определенной температуре было установлено, что при на-
чальной концентрации обоих реагентов равной 1 М, концентрация
образующегося эфира равна 0,25 М через 65 суток, и 2/3 М при ус-
тановлении равновесия.
Определить время, необходимое для уменьшения концентра-
ции спирта на 50 %.
Решение. Обозначим через
х
концентрацию образующегося
эфира и воды; через
х
1 концентрацию каждого из реагентов к
моменту времени
t
. Запишем кинетическое уравнение обратимой
реакции второго порядка:
,1
2
1
2
1
2
1
2
1
xkxkxkxak
dt
dx
dt
xad
w
где
1
1
, kk константы скорости прямой и, соответственно, обрат-
ной реакции.
При
t
равновесная концентрация эфира будет равна
x .
Тогда кинетическое уравнения второго порядка получим:
.
1
010
2
2
1
1
2
1
2
1
x
x
k
k
xkxk
dt
dx
w
По условию задачи
3
2
х , следовательно, из соотношения
констант можно выразить
1
k и подставить его значение в кинети-
ческое уравнение для реакции второго порядка:
.
4
1
4
4
3
2
1
3
2
2
1
2
1
1
1
2
2
1
1
x
k
xk
dt
dx
k
k
k
k

218
Разделим переменные и преобразуем полученное выражение,
которое после интегрирования с учетом начальных условий
0,0
xt приведет к соотношению:
.
323
21
ln,
4
3
)32(2
11
x
x
tkdtk
xx
dx
Из этого уравнения определим время, когда концентрация эфи-
ра уменьшится на 50 %. Рассуждаем следующим образом: при
25
,
0
65
х
суток
t
по условию задачи; при неизвестном време-
ни
50
,
0
x
t
; значение
1
k в обоих случаях одинаковое, следова-
тельно:
.2,212
3365,0
0986,1
65
5,0323
5,021
ln
1
25,0323
25,021
ln
65
1
323
21
ln
1
1
сутокt
t
x
x
t
k
Пример 83. Вещество
А
разлагается одновременно согласно
двум уравнениям первого порядка:
.
,
22
11
,
,
E
D
A
CBA
xk
xk
При начальной концентрации вещества
А
, равной
а
, ко време-
ни
t
уменьшение концентрации вещества
А
по реакции (1) состав-
ляет
1
х , а по реакции (2) к этому же времени уменьшение концен-
трации
А
составляет
2
х .
Выразить сумму констант скоростей
2
1
kk
через
1
х и
2
х ; а
также определить численные значения констант, если известно, что
через 20 минут от начала реакции
074,0;092,0;1
2
1
ххМа .
Решение. Обозначим общее уменьшение концентрации веще-
ства
А
по двум реакциям как
2
1
ххх
, тогда общую скорость
процесса можно записать в виде уравнения:
.
21
xakk
dt
dx
w
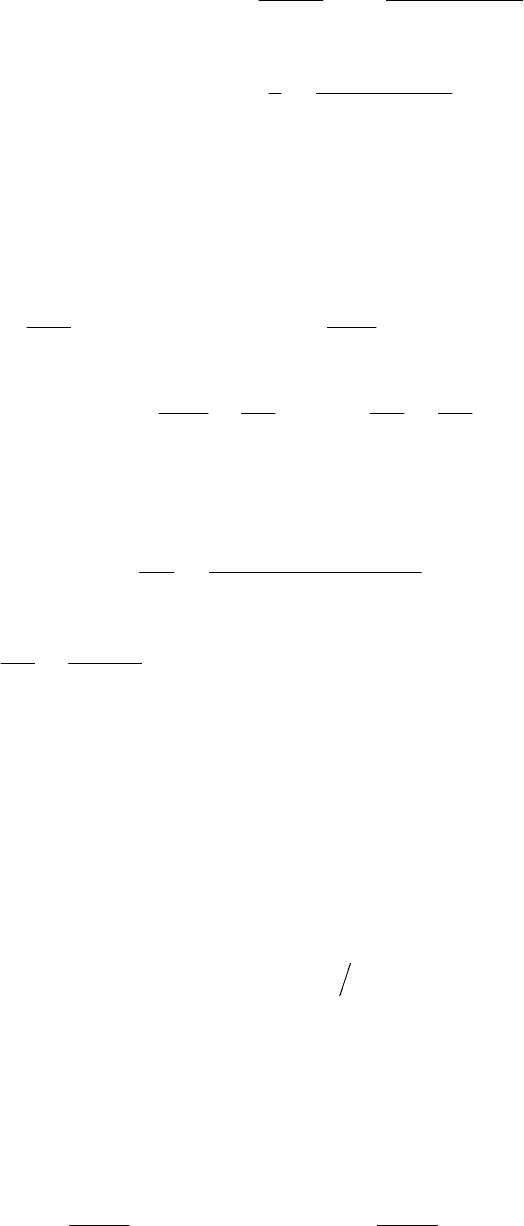
219
Разделим переменные и проинтегрируем это уравнение с уче-
том начальных условий при
0
,
0
x
t
:
.ln
1
lnln
2
1
21
21
21
xxa
a
t
kk
xxa
a
xa
a
tkk
Последнее уравнение выражает сумму констант через степени пре-
вращения по двум реакциям.
Запишем кинетические уравнения для каждой реакции в виде
следующих выражений и разделим одно на другое:
.
;;
2
1
2
1
2
1
2
1
212
2
211
1
k
k
x
x
k
k
dx
dx
xxak
dt
dx
xxak
dt
dx
Подставим из условия задачи численные значения соответст-
вующих величин и найдем константы скоростей реакций:
.10046,4;10030,5
;243,1
074,0
092,0
;10076,9
074,0092,01
1
ln
20
1
13
2
13
1
2
1
13
21
минkминk
k
k
минkk
Пример 84. В системе протекают две параллельные реакции:
.2
;2
2
1
2
1
РСА
РВА
k
k
Отношение констант скоростей
5
2
1
kk . Начальные концентра-
ции
B
и
C
одинаковые. К моменту времени
t
прореагировало 50 %
вещества
B
. Какая часть вещества
C
прореагировала к этому мо-
менту времени?
Решение. Запишем кинетические уравнения для первой и вто-
рой реакций:
.2;2
2
2
2
1
CAk
dt
Cd
BAk
dt
Bd
220
Разделим одно уравнение на другое, избавимся от временной
зависимости и получим дифференциальное уравнение, выражающее
зависимость концентрации одного из веществ от концентрации дру-
гого:
.5
2
2
2
2
2
1
C
B
Ck
Bk
Cd
Bd
Это уравнение решается методом разделения переменных и
взятием неопределенного интеграла, тогда, из начальных условий
0
0
СВ
определяется
const
:
.
4514
;
51
;
00
22
BCBB
const
const
CB
C
Cd
B
Bd
Подставим в это уравнение
2
0
ВВ
и получим:
.
6
5
6
5
452
00
0
0
СВ
С
ВСВ
Это означает, что к моменту времени
t
прореагировала
61
часть вещества
С
.
Пример 85. Изопропанол в присутствии окисного катализатора
разлагается по первому порядку в двух направлениях с образовани-
ем ацетона и пропилена:
.
2
6
3
7
3
23373
2
1
OHHCOHHC
HCOCHCHOHHC
k
k
В одном из опытов были получены следующие данные:
температура,
Κ
время опыта,
с
выход аце-
тона, х
1
, %
выход про-
пилена, х
2
,%
579 13,1 11,2 3,15
618 8,9 33,8 9,18
Определить энергию активации дегидрирования и дегидратации.
