Лесникова Н.П. Физическая химия. Самостоятельное решение задач по химической термодинамике, электрохимии и кинетике
Подождите немного. Документ загружается.

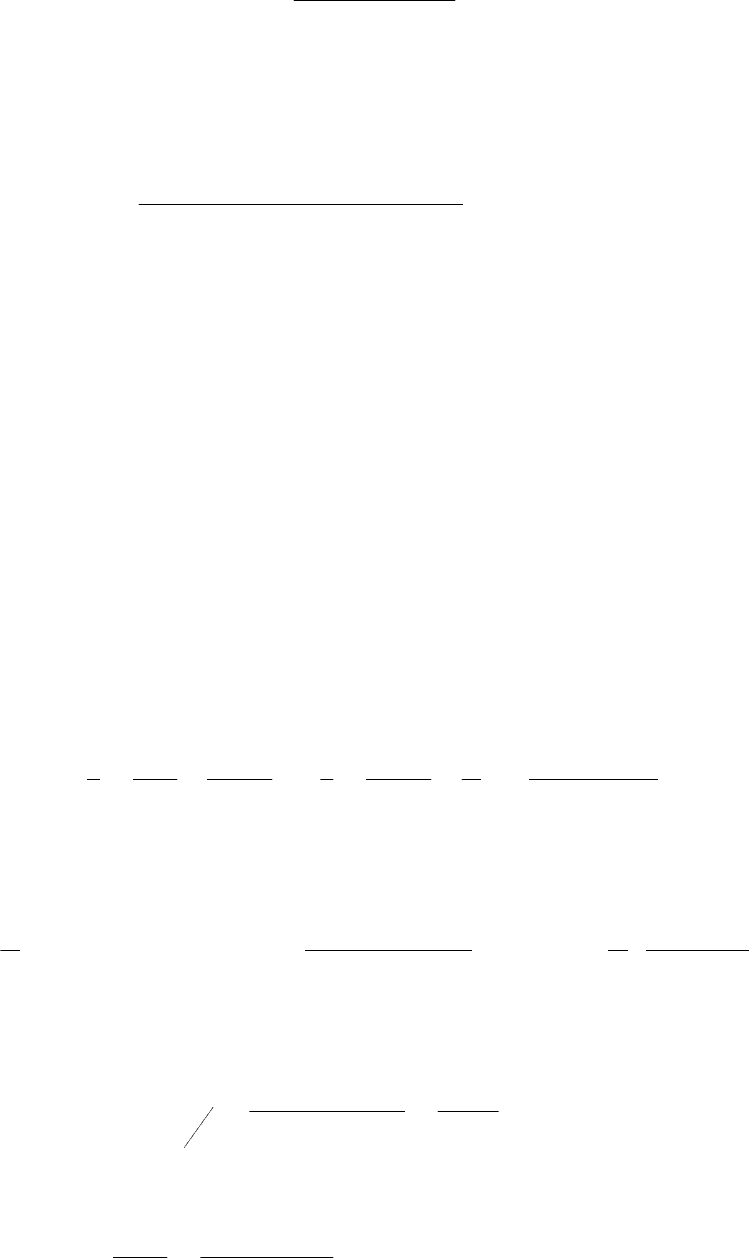
191
.
330,31ln
11067
k
T
Поскольку скорость реакции удваивается, необходимо в этом
уравнении использовать
298
2kk
. После подстановки всех чисел,
получим
.82,303
330,31)1006,32ln(
11067
3
KT
Пример 77. На основании опытных данных установлено, что
реакция омыления эфира имеет второй порядок:
.
3333
OHCHCOONaCHNaOHCOOCHCH
Через 10 минут при одинаковых исходных концентрациях реа-
гентов
МС
2
0
10
прореагировало 20 % эфира.
Определить сколько времени необходимо, чтобы омыление
эфира прошло на 50 %.
Определить концентрацию спирта ОНСН
3
, полученного через
30 минут протекания реакции.
Решение. Выражение константы скорости реакции второго по-
рядка при одинаковых концентрациях реагентов имеет вид:
.
111111
,0
xaat
x
axatCCt
k
AA
Введем в это уравнение вместо
х
, мольную долю
прореаги-
ровавшего реагента (эфира), по условию
2
,
0
; тогда:
.
1
1
,
ak
t
aaat
a
kax
a
x
Подставим в полученное выражение времени для реакции вто-
рого порядка известные величины:
.10
4
1
2,01
2,0
5
1%20
мин
akak
tt
Определим константу скорости реакции, если МСа
А
2
,0
10
.
.5,2
01,0104
1
4
1
11
минмольл
at
k
Время, необходимое для омыления эфира на 50 %, т.е.
5,0
, на-
ходим из уравнения:
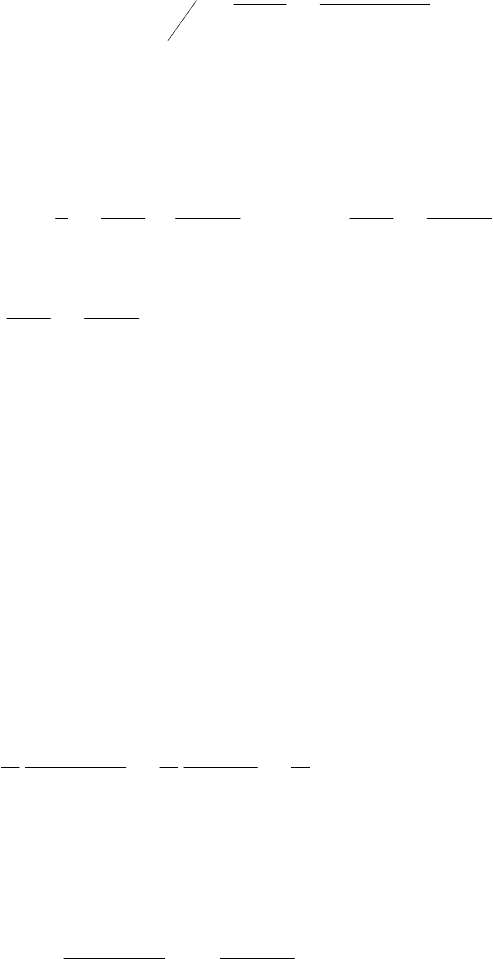
192
.40
01,05,2
11
2
1
мин
ak
t
Для определения концентрации спирта ОНСН
3
, полученного
через 30 минут омыления эфира, определим концентрацию эфира к
этому времени реакции:
./0043,00057,001,0
;/0057,0175305,2
01,0
11
;
11111
,0
,0,0
3
лмольCCC
лмольC
C
tk
CCCCt
k
AAOHCH
A
A
AAAA
Пример 78. Скорость образования
NO
в реакции
ггг
BrNONOBr
22
равна 1,6·10
-4
моль·л
-1
·с
-1
. Чему равна скорость реакции и скорость
расходования
NOBr
?
Решение. Из определения скорости реакции следует, что ско-
рость реакции можно выразить по изменению концентрации любого
из веществ, участвующих в реакции, следовательно:
.108,0106,1
2
1
2
1
2
1
1144
слмоль
dt
dc
dt
dc
w
NONOBr
Из этого же определения и уравнения следует, что скорость
расходования
NOBr
равна скорости образования
NO
с обратным
знаком:
.106,1
114
слмоль
dt
dc
dt
dc
NONOBr
Пример 79. В реакции второго порядка
D
B
A
начальные
концентрации веществ равны:
.3;0,2
1
0
1
0
лмольВлмольА
Скорость реакции при текущей концентрации
1
5,1
лмольА рав-
на 1,2·10
-3
моль·л
-1
·с
-1
.
Определить константу скорости и скорость реакции при теку-
щей концентрации
.5,1
1
лмольВ

193
Решение. По условию задачи рассматриваемая реакция являет-
ся реакцией второго порядка. Поэтому, по закону действия масс, в
любой момент времени скорость реакции равна:
.BAkw
К моменту времени, когда
1
5,1
лмольА , прореагировало
по
1
5,0
лмоль веществ А и В, так как из уравнения реакции сте-
хиометрические коэффициенты этих веществ равны и:
.5,25,035,0
;5,05,12
0
1
0
лмольВВ
лмольАА
Подставим полученные значения концентраций в уравнение
скорости и найдем константу скорости реакции:
.102,3
5,25,1
102,1
114
3
смольл
BA
w
k
К моменту времени, когда концентрация
1
5,1
лмольВ , то
его прореагировало
.5,05,12
,5,15,13
1
1
0
лмольА
лмольВВ
Скорость реакции станет в этот момент времени равной:
.104,25,15,0102,3
1144
слмольBAkw
ЗАДАЧИ
3.1. При проведении гидролиза алкилбромида в водноспирто-
вом растворе
,
BrROHOHRBr
Было найдено, что при начальных концентрациях обоих реа-
гентов 0,01 моль/л для выделения 0,005 моль/л свободного броми-
диона потребуется 47 · 10
3
с. Определить константу скорости реак-
ции гидролиза алкилбромида.
3.2. В результате термического разложения закиси азота ON
2
при двух различных начальных концентрациях ON
2
получены сле-
дующие зависимости изменения концентрации ON
2
от времени:

194
,22
2
2
2
ONON
время, с 3 5 10 15 20 25
лмольC
лмоль
C
ONt
ON
/,
/
0225,0
2
2
0
0,016 0,0132 0,0093 0,0072 0,0059 0,0050
лмольC
лмоль
C
ONt
ON
/,
,/
0162,0
2
2
0
0,012
0,0107 0,0080 0,0064 0,0053 0,0046
Определить порядок реакции различными методами.
3.3. Монохлоруксусная кислота реагирует с водой по уравне-
нию:
.
222
HClCOOHOHCHOHClCOOHCH
избыток
В таблице представлены результаты титрования одинакового объема
проб щелочью:
Время, с 0 600 780 2070
3
,10
3
смV
щел
12,9 15,8 16,4 20,5
Определить константу скорости этой реакции. Через какое
время от начала реакции все три кислоты будут присутствовать в
эквивалентных количествах.
3.4. При температуре 583 Κ протекает реакция разложения
.22
2
HAsAsH
газтв
Во время реакции при постоянном объеме и температуре общее дав-
ление в системе изменялось следующим образом:
время, час 0 5,6 6,5 8,0
ПаР ,10
3
97,75 107,41 109,05 111,35
195
Показать, что эта реакция разложения является реакцией пер-
вого порядка и определить константу скорости реакции.
3.5. Кинетическая зависимость константы скорости реакции
разложения фосфина
3
РН от температуры выражается уравнением:
.130,12ln2
18963
ln T
T
k
Определить энергию активации этой реакции при 800 Κ.
3.6. Константа скорости разложения
52
ON в газовой фазе рав-
на 0,292 мин
-1
при температуре 338 Κ. Энергия активации этой реак-
ции составляет 103,4 кДж/моль. Определить время полупревраще-
ния при температуре 353 Κ.
3.7. Изменение общего давления от времени в реакционной
смеси
2
2
22 ONONO
при двух температурах составило:
время, с 0 60 120 150
ПаР
Т
,10
631
3
5,246 5,690 6,005 6,130
ПаР
Т
,10
656
3
5,464 6,316 6,764 6,916
Определить порядок реакции и энергию активации.
3.8. Кинетика гетерогенного окисления этилового спирта под-
чиняется уравнению первого порядка:
.
2
1
252252
ОНОНСООННС
При различных температурах опыта в течение 2,12 с получены
следующие выходы ацетальдегида:
Т, Κ 498 510 523
выход ОНС
52
, %
30,8 43,4 56,6
Определить энергию активации этой реакции.

196
3.9. Газообразный циклобутен при температуре 423 Κ изомери-
зуется в бутадиен по реакции первого порядка с константой скоро-
сти .103,3
14
ck Определить время, необходимое для изомериза-
ции циклобутена на 40 % при этой температуре.
3.10. Гидролиз метилацетата в щелочной среде при 298 Κ
ОНСНСООСНОНСООСНСН
3333
протекает как реакция второго порядка с константой скорости
.137,0
11
смольлk Рассчитать время, в течение которого 5 %
метилацетата гидролизуется при этой температуре.
3.11. Атомная батарейка для часов использует в качестве ис-
точника энергии
– излучение
Рт
147
с периодом полураспада 2,62
г.Через какой промежуток времени скорость
– излучения умень-
шится до 10 % от ее начальной величины?
3.12. Реактор содержит 0,025 г радона, период полураспада ко-
торого равен 3,82 суток. Определить содержание радона (%) в реак-
торе через 14 суток.
3.13. Определить значение энергии активации, при которой
температурный коэффициент скорости в интервале температур от
27
0
С до 37
0
С равен 2,5.
3.14. Изучение кинетики реакции изомеризации циклопропана
в пропен проводили при 500
0
С в газовой фазе, измеряя конечное
давление циклопропана в зависимости от времени при различных
начальных давлениях. Результаты представлены ниже:
время, с 100 200 100 200 100 200
Р
0
, торр 200 200 400 400 600 600
Р, торр 186 173 373 347 559 520
Определить порядок реакции и значение константы скорости
реакции в этих условиях.
197
3.15. При изучении разложения некоторого вещества установ-
лено, что константа скорости реакции равна 2,8·10
-3
л·моль
-1
·с
-1
при
температуре 30
0
С и 1,38·10
-2
при 50
0
С. Определить параметры
уравнения Аррениуса для этой реакции.
3.16. Реакция разложения
2
2
2 IHHI
имеет второй порядок
с константой скорости
116
1095,5
смольлk . Определить ско-
рость реакции при давлении иодоводорода 1 бар и температуре 600
Κ.
3.17. Скорость реакции второго порядка
D
В
А
равна
2,7·10
-7
моль·л
-1
·с
-1
при концентрациях веществ А и В, соответствен-
но, 3,0·10
-3
моль·л
-1
и 2,0·10
-3
моль·л
-1
. Определить константу скоро-
сти реакции.
3.6. Кинетические уравнения константы скорости
сложных реакций
Сложными называются реакции, протекающие в несколько
стадий, которые определенным образом связаны между собой через
реагенты (исходные вещества) и промежуточные соединения.
Признаки сложных реакций: несовпадение порядка реакций и
стехиометрических коэффициентов; возможное изменение состава
продуктов в зависимости от температуры, начальных концентраций
и др. условий; ускорение или замедление процесса при добавлении в
реакционную смесь небольших количеств веществ; влияние мате-
риала и размеров реакционного сосуда на скорость реакции; суще-
ственное влияние незначительного изменения условий проведения
эксперимента, в результате чего реакция либо останавливается, либо
протекает со взрывом.
Для изучения сложных реакций используются следующие по-
стулаты: принцип независимости, "если в системе протекает не-
сколько элементарных реакций, то каждая из них протекает незави-
симо от других, подчиняясь основному постулату химической кине-
тики".
Принцип лимитирующей стадии, "если процесс состоит из
нескольких стадий, то стадия, константа скорости которой наи-
меньшая, является лимитирующей, т.е. определяющей скорость
процесса в целом".

198
Принцип микрообратимости или детального равновесия,
"если в сложном процессе устанавливается химическое равновесие,
то скорости прямой и обратной реакций должны быть равны для
каждой из элементарных стадий".
Обратимые реакции.
Обратимые реакции – это реакции, в которых превращение
реагентов в продукты сопровождается обратным процессом
превращения продуктов в исходные вещества. С течением вре-
мени в таких реакциях устанавливается химическое равновесие.
Примерами таких реакций могут быть мутаротация глюкозы
(α↔β), енолизация кетонов (R
1
CH
2
COR
2
↔R
1
CHC(OH)R
2
), превра-
щение тиоцианата в тиомочевину (NH
4
NCS↔(NH
2
)
2
CS).
Рассмотрим обратимую реакцию А↔В, где прямая и обратная
реакции имеют первый порядок.
Предположим, что в начале данной реакции концентрация
реагента А равна
V
n
a
0
; концентрация продукта реакции В = 0.
В любой момент времени протекания реакции концентрации
реагентов стали равны:
,;
0
x
V
Bxa
V
n
A
где х – изменение концентрации реагента к моменту времени t.
Запишем выражение для скорости обратимой реакции с учетом
принципа независимости скоростей, согласно которому: общая ско-
рость реакции равна сумме скоростей независимых стадий:
),()(
.)(
.
,
1
,
11
11111
1111
1
0
1
kkxak
dt
dx
kxak
dt
dx
xkxakWWWW
dt
dx
dt
Bd
dt
Ad
W
dt
dx
dt
d
Vdt
Bd
W
dt
dx
dt
d
Vdt
n
d
Vdt
Ad
W
i
(3.55)

199
где k
1
, k
-1
– константы скоростей прямой и обратной реакций. Разде-
лим в последнем уравнении (3.55) переменные и проинтегрируем
полученное выражение в пределах от 0 до х, и от 0 до t.
(3.56)
Предположим, что в какой–то момент времени скорости пря-
мой и обратной реакций будут равны, т.е. реакционная система на-
ходится в состоянии равновесия. Общая скорость реакции равна 0;
изменение концентрации в момент равновесия соответствует х
∞
, ее
значение можно выразить следующим образом:
.0
,0
1
1
1
11
1111
kk
ak
xxkxak
xkxak
dt
dx
xkxak
dt
dx
(3.57)
В то же время из условия достижения равновесия, с учетом равно-
весных концентраций реагентов и продуктов реакции, получим:
,
,0
1
1
11
11
C
K
xa
x
k
k
xkxak
BkAk
dt
Bd
dt
Ad
W
(3.58)
где константа равновесия K
C
равна соотношению констант скоро-
стей прямой и обратной реакций. Причем, речь идет о концентраци-
онной константе K
C
, которая обычно отличается от термодинами-
.
1
1
ln
1
ln
1
ln
1
1
11
11
111
1
11
11
111
1
0
11
0
111
111
111
111
11
ak
kk
x
t
kk
или
kkxak
ak
t
kk
tkk
kkxak
ak
dtkk
kkxak
kkxakd
dt
kkxak
kkxakd
kk
tx
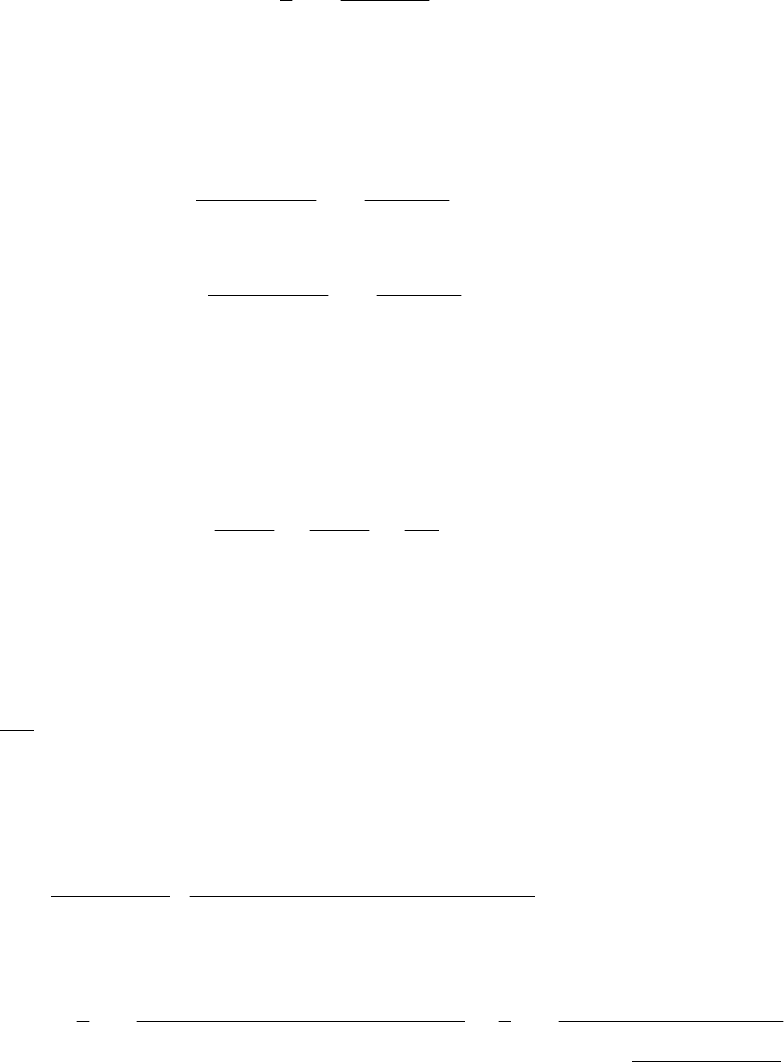
200
ческой константы K
0
, не имеющей размерности. Для реакций пер-
вого порядка K
C
также величина безразмерная, но для реакций типа
А + В ↔С константа K
C
имеет размерность.
Если реакция достигает состояния равновесия, то с учетом вы-
водов (3.56) и (3.57) сумма констант скоростей прямой и обратной
реакций может быть представлена как:
.ln
1
11
xx
x
t
kk
(3.59)
Совместное решение этого уравнения (3.59) и уравнения (3.58)
позволяет выразить через равновесную степень превращения кон-
станту скорости прямой и обратной реакций:
.ln
1
1
,ln
1
1
1
xx
x
Kt
k
xx
x
Kt
K
k
C
C
C
(3.60)
Если в обратимой реакции первого порядка в начальный мо-
мент времени концентрации реагента А и продукта реакции В были
равны (а – х) и (b – x), то скорость реакции в любой момент времени
следует представить выражением:
.
1
1
1
1
xbkxakWW
dt
dx
dt
Bd
dt
Ad
W
(3.61)
Преобразуем полученное уравнение в выражение, которое можно
проинтегрировать:
.
1111
111111
kkxbkak
xkbkxkakxbkxak
dt
dx
(3.62)
Расставим границы интегрирования:
.
1
00
1111
1111
11
tx
dt
kkxbkak
kkxbkakd
kk
(3.63)
Сумма констант скоростей прямой и обратной реакций будет равна:
.
1
1
ln
1
ln
1
1
1
11
1111
11
11
bkak
kk
x
tkkxbkak
bkak
t
kk
(3.64)
