Лесникова Н.П. Физическая химия. Самостоятельное решение задач по химической термодинамике, электрохимии и кинетике
Подождите немного. Документ загружается.


151
2.32. Определить стандартный электродный потенциал полу-
элемента
0
3
AuAu
E
, если известны стандартные потенциалы пар:
.41,1,
;68.1,
0
2
3
0
1
BEAuAu
BEAuAu
Ответ: 1,50 В.
2.33. Определите ЭДС электрохимической цепи при темпера-
туре 298 Κ
MM
AgAgCrCrAg
035,01025,1
,
6
3
используя справочные данные о стандартных потенциалах и коэф-
фициентах активности ионов, ионная сила раствора равна 0,100.
Ответ: 1,58 В.
2.34. В гальваническом элементе при 298 Κ значение ЭДС
равно 0,0185 В
005,005,0
.
21
44
mm
ZnZnSOZnSOZn
Определить средний ионный коэффициент активности в кон-
центрированном растворе, если в более разбавленном растворе
.477,0
Ответ: 0,202.
2.35. В электрохимической цепи при 298 Κ значение ЭДС рав-
но 0,768 В, электродный потенциал хлорсеребряного электрода ра-
вен 0,222 В. Определить рН раствора.
атмР
AgAgClKClрастворHPt
Н
1
.,,
2
2
Ответ: 9,25.
2.36. Цинковый электрод погружен в 0,1 моляльный раствор
4
ZnSO . Определить, на сколько изменится электродный потенциал
цинкового электрода, если раствор соли разбавить в 10 раз. Учесть,

152
что средний ионный коэффициент активности для 0,1 моляльного
раствора
4
ZnSO равен 0,110, а для разбавленного раствора 0,387.
Ответ: – 0,0167 В.
2.37. Вычислите растворимость и произведение растворимости
2
ОНСа при 298 Κ, по значениям стандартных потенциалов элек-
тродов
2
Са первого и второго рода.
Ответ:
20,5
2
OHCa
L
.
2.38. Вычислите растворимость и произведение растворимости
AgOH
по справочным данным, используя реакцию
.
2
1
2
1
22
OHAgOHOAg
т
Ответ: s = 1,46·10
-4
, L
s
= 7,67.
2.39. По термодинамическим данным для протекающей в топ-
ливном элементе при 25
0
С реакции
ж
ОНСООСН
2224
22
определите стандартное значение ЭДС,
р
Т
Е
0
и коэффициент по-
лезного действия.
Ответ:
.79,0;1015,3;06,1
4
0
0
В
Т
Е
ВЕ
р
2.40. Электродвижущая сила элемента равна 0,7540 В, если
,05,0
42
SOH
m и Е = 0,6959 В, если .5,0
42
SOH
m
HgSOHgSOHHPt
твp
42422
,,
1
При 05,0
42
SOH
m средний ионный коэффициент активности
)(
4
2
SOH
равен 0,340. Определить средний ионный коэффициент
активности )(
4
2
SOH
при ,5,0
42
SOH
m не пользуясь таблицей
стандартных потенциалов.
Ответ: 0,1542.
153
Глава 3. КИНЕТИКА
Химическая термодинамика отвечает на вопрос о возможности
протекания реакции и равновесном состоянии реакционной смеси.
Химическая кинетика дает ответ – как быстро это состояние будет
достигнуто, какие необходимо соблюдать условия, чтобы это со-
стояние (равновесное) можно было достичь быстрее.
Вместе химическая термодинамика и химическая кинетика по-
зволяют не только обоснованно управлять технологическими про-
цессами, но и теоретически предсказать, рассчитать необходимые
величины в общей химической технологии.
3.1. Общие понятия и определения в химической кинетике
Реакция называется элементарной, если она протекает путем
прямого превращения молекул исходных веществ в молекулы про-
дуктов реакции. Элементарная реакция является совокупностью
большого числа однотипных элементарных актов химического
превращения (t = 10
-13
c).
Большинство химических реакций не являются элементарны-
ми, а состоят из нескольких элементарных стадий, обеспечиваю-
щих протекание данного химического превращения и составляющих
механизм сложной химической реакции. При этом конечные веще-
ства одной стадии могут быть исходными веществами другой.
Для кинетических выводов необходимо точно определить, в
какой части реакционной системы осуществляются превращения.
Если химическая реакция протекает в пределах одной фазы, то она
называется гомогенной, а реакционным пространством является
жидкая, твердая или газообразная часть системы. Если химическая
реакция протекает на границе раздела фаз, то она называется гете-
рогенной, а реакционным пространством является граница раздела
фаз.
Количество вещества, реагирующего за единицу времени, все-
гда пропорционально величине реакционного пространства: объему
фазы или площади поверхности раздела фаз и имеет размерность
скорости (моль/м
3
с; моль/м
2
с).
Скорость химической реакции

154
Скорость элементарной реакции (W), это число однотип-
ных элементарных актов химического превращения, совершаю-
щихся в единицу времени в единице объема или на единице по-
верхности реакционного пространства.
Непосредственно определить число элементарных актов, со-
вершающихся при протекании химической реакции невозможно.
Поэтому, скорость реакции выражают через величину пропорцио-
нальную числу элементарных актов - количество вещества, реаги-
рующего или образующегося за счет реакции в единицу времени в
единице объема реакционного пространства.
Следует учитывать, что изменение количества вещества в ре-
акционном пространстве может быть обусловлено как протеканием
реакции, так и обменом веществом с окружающей средой. Поэтому
следует рассматривать закрытые и открытые системы.
В закрытых системах изменение количества вещества с тече-
нием времени происходит только за счет протекания в ней химиче-
ской реакции. Изменения количеств каждого из реагентов связаны
стехиометрическими коэффициентами. Увеличение или уменьшение
количества i-го реагента за единицу времени в единице объема ре-
акционного пространства закрытой системой можно считать скоро-
стью образования или скоростью расходования.
Покажем различные способы выражения скорости реакции в
закрытой системе.
.
1
,
0
0
dt
dn
Vdt
dc
где
dt
dV
V
c
dt
dc
W (3.1)
В данном уравнении первое слагаемое означает изменение скорости
за счет реакции, а второе – за счет объема. При постоянном объеме
реакционного пространства выражение скорости принимает вид:
.
1
dt
dc
dt
dn
V
W (3.2)
Учитывая, что все вещества в реакционном пространстве свя-
заны определенным образом через стехиометрические коэффициен-
ты, выразим скорость реакции через глубину превращения:
.0
3
2
0
,
3
2
DCBA
или
D
C
B
A
D
C
B
A
D
C
B
A
155
Обозначим исходное число молей i-го компонента как
i
n
,0
, те-
кущее (в ходе реакции) число молей i-го компонента как
i
n , глубину
превращения как
. Тогда, после соответствующих математических
преобразований и дифференцирования по времени получим:
.
1
,
,,
,0
,0,0
dt
d
dt
dn
или
dt
d
dt
dn
difconstn
nnnn
i
i
i
i
i
iiiiii
(3.3)
Разделим полученное равенство на объем реакционного про-
странства V и получим выражение скорости по любому компоненту
реакции:
.
1111
1111
dt
dc
dt
dn
Vdt
d
V
W
W
dt
d
Vdt
dc
или
dt
d
VVdt
dn
i
i
i
i
i
i
i
i
i
i
(3.4)
Таким образом, в закрытой системе скорость реакции может
быть определена по изменению концентрации любого из участвую-
щих в реакции веществ. Скорость всегда величина положитель-
ная. Поэтому, для исходных веществ при 0
dt
dn
i
, стехиометриче-
ские коэффициенты надо брать со знаком (–), а для продуктов реак-
ции при 0
dt
dn
i
, стехиометрические коэффициенты следует брать
со знаком (+). Например, для представленной ниже реакции синтеза
аммиака, выражение скорости реакции по различным компонентам
имеет вид:
.
2
1
3
1
,23
3
22
322
dt
dc
dt
dc
dt
dc
W
NHHN
NH
HN
i
Разделим выражение (3.4) на стехиометрические коэффициен-
ты и получим истинную скорость реакции, определенную как ско-
рость изменения степени превращения во времени, т.е.
.
1
,
dt
dx
dt
d
V
кактак
dt
dx
dt
dcW
W
i
i
i
(3.5 )
156
Поясним полученные выводы на примере реакции:
.PBA
P
B
A
Введем обозначения: в начальный момент времени (t = 0), кон-
центрации участников реакции равны [A] = a, [B] = b, [P] = 0. То-
гда, изменение концентрации реагирующих веществ в любой мо-
мент времени t соответствует: (a – v
A
x), (b – v
B
x), v
P
х.
Из определения скорости по компонентам реакции следует:
.
:;;;
.;
)(
;
)(
dt
dx
W
W
наразделим
dt
dx
W
dt
dx
W
dt
dx
W
dt
xd
dt
Pd
W
dt
xbd
dt
Bd
W
dt
xad
dt
Ad
W
i
i
iPPBBAA
P
P
B
B
A
A
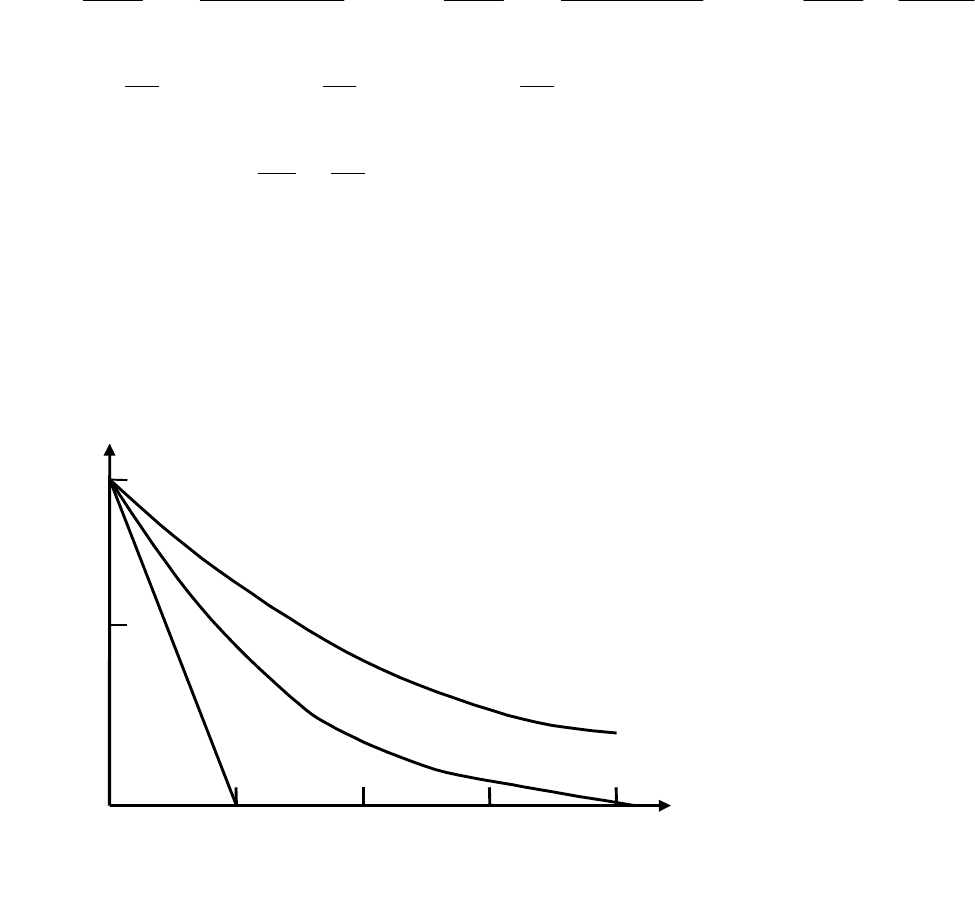
Графическое изображение зависимости изменения концентра-
ции c
i
(ось ординат) от времени t (ось абсцисс) называется кинети-
ческой кривой (рис.3.1). По касательной, через тангенс угла можно
также определить скорость реакции в любой момент времени.
Экспериментальные данные показали, что скорость простой
элементарной химической реакции пропорциональна произведению
x
a
2
n
1
n
0
n
0
t
Рис.3.1. Кинетические кривые реакций разных порядков (n )

157
концентрации реагентов в степенях равных стехиометрическим ко-
эффициентам в уравнении реакции PBA
P
B
A
.
Для элементарной реакции, протекающей по такой схеме,
сумма молекул реагентов равна числу соударений (ч.с.) в элемен-
тарном акте химического превращения, т.е.
..сч
B
A
, то-
гда, из понятия о скорости превращения и закона действия масс бу-
дет верным равенство
.
BA
B
A
cckW
(3.6)
Для реальных химических реакций, которые в основном состо-
ят из нескольких элементарных реакций, выражение скорости имеет
вид
,
BA
n
B
n
A
cckW (3.7)
где
B
A
nn , - частные порядки реакции, показывающие зависимость
скорости реакции от концентрации реагирующих веществ.
Из полученных уравнений (3.6), (3.7) следует, что "скорость
реакции в каждый момент времени пропорциональна произведе-
нию текущих концентраций взаимодействующих веществ, воз-
веденных в соответствующие степени". Этот кинетический закон
получил название основного постулата химической кинетики.
Сумма частных порядков реакции равна общему порядку реак-
ции. Порядок реакции может быть числом целым, дробным и рав-
ным нулю. Порядок реакции определяется только опытным путем.
Дробный порядок реакции позволяет предположить о сложном ме-
ханизме протекания реакции.
Необходимо отметить, что основной постулат химической ки-
нетики соблюдается только при определенных условиях, а также с
учетом принципа независимости протекания реакции. Из принципа
независимости протекания реакции следует: если в системе имеет
место несколько элементарных стадий, то каждая из них протекает
по тем же законам, с той же скоростью, как и в отсутствие других
реакций при тех же температурах и концентрациях. Поэтому, если в
системе протекает несколько элементарных реакций или стадий с
участием одного и того вещества, то изменение концентрации по-
следнего равно алгебраической сумме скоростей каждой стадии,
умноженной на стехиометрический коэффициент этого вещества
в данной стадии: .
1
,,
S
ii
i
SS
W
dt
dc

158
Из постулата химической кинетики (3.7) и выражения скорости
через степень превращения (3.4) можно получить кинетические
уравнения скорости. Рассмотрим вывод для приведенной выше ре-
акции.
Выразим концентрации всех реагирующих веществ через одно
вещество (А). В начальный момент реакции при t = 0 можно запи-
сать:
.0;; P
a
BaA
B
A
Тогда в любой момент времени t концентрации реагирующих ве-
ществ можно выразить в виде следующих соотношений:
.;; xPx
a
x
a
Bx
a
xaA
P
A
BBB
AA
AA
Подставим эти соотношения в уравнение скорости (3.3; 3.4)
.)(
)(
n
экс
nn
A
n
B
n
A
n
B
B
n
A
A
nn
xakx
a
k
x
a
xkBAk
dt
dx
W
BA
BA
B
A
BA
Таким образом, для скорости химической реакции кинетиче-
ское уравнение имеет вид:
.
n
экс
xak
dt
dx
W (3.8)
Необходимо отметить, что основными факторами, влияющими
на скорость химической реакции, являются: концентрация реаги-
рующих веществ, давление, температура, природа растворителя,
присутствие или отсутствие катализатора. Скорость реакции зависит
от воздействия излучения (фотохимическое, магнитное, радиацион-
ное). Если реакция электрохимическая, то на скорость влияют при-
рода электрода, электродный потенциал, состав электролита и т.д.
Входящая в выражение скорости (3.8) величина k является
константой скорости, которая зависит от всех тех же факторов,
что и скорость химической реакции за исключением концентрации.
Константа скорости не зависит от концентрации реагирующих
веществ. Константа скорости является коэффициентом про-
порциональности в уравнении скорости химической реакции и по

159
физическому смыслу соответствует скорости реакции при еди-
ничной концентрации реагирующих веществ.
3.2. Кинетические уравнения константы скорости
химических реакций различных порядков.
Кинетические уравнения связывают изменение скорости реак-
ции с изменением концентрации реагирующих веществ. Измерить
начальную скорость реакции достаточно трудно, поэтому предпоч-
тительно интегрировать соответствующее кинетическое уравнение.
Интегральное кинетическое уравнение дает соотношение между
константой скорости и скоростью химического превращения. Вид
уравнения зависит от порядка реакции, а константа скорости имеет
размерность
.
11
tck
n
(3.9)
Реакции нулевого порядка. Закономерностями реакций нуле-
вого порядка обладают некоторые каталитические реакции, реакции
изомеризации и фотохимических превращений, в которых воздейст-
вие света проявляется сильнее, чем изменение концентрации реаген-
тов, а также реакции, в которых концентрации реагирующих ве-
ществ поддерживаются const.
Схему реакции нулевого порядка можно изобразить как А →
Р, при n = 0 из уравнения (3.8) получим
.0,
0
kxak
dt
dx
nприxak
dt
dx
n
Разделим переменные и проинтегрируем в соответствующих
пределах:
,,,
,0
0
0
t
cc
t
x
kktxkdtdx
AA
tx
(3.10)
где с
0,А
и с
А
– начальная и текущая концентрации вещества А. Из по-
лученного уравнения (3.10) текущая концентрация вещества А равна
.
,0
ktaktcc
AA
Графическое изображение функциональной зависимости изме-
нения концентрации во времени для реакции нулевого порядка (n =
0) соответствует рис.3.2. (а):

160
Тангенс угла наклона позволяет определить константу скорости ре-
акции: k =- tg a.
Если предположить, что за некоторый промежуток времени
2
1
t , (время полупревращения) концентрация исходного вещества
уменьшиться вдвое т.е.
2
2
,0 A
c
a
xaA
, кинетическое урав-
нение (3.10) принимает вид
.
2
,
2
2
2
1
2
1
2
1
k
a
t
t
a
t
a
a
k
(3.11)
Реакции первого порядка. Эти реакции протекают по схеме
А → Р, что соответствует множеству элементарных реакций типа
,24252
2
1
OONON реакциям изомеризации в газовой фазе, ра-
диоактивного распада.
Выразим для данного типа реакций концентрации реагирую-
щих веществ в разные моменты времени через концентрацию веще-
ства А:
.,,
00
0
x
V
кактакxa
V
n
Aa
V
n
A
t
Если подставить полученные выражения в уравнение скорости
реакции по изменению концентрации вещества А. то получим
.
dt
dx
dt
xad
dt
Ad
W
(3.12)
Из уравнения основного постулата кинетики (3.8) скорость реакции
первого порядка равна
xakW
. (3.13)
Следовательно, справедливо равенство
.xak
dt
dx
(3.14)
Разделим переменные и преобразуем полученное уравнение в
соотношение, удобное для интегрирования
., dtk
xa
xad
илиdtk
xa
dx
(3.15)
