Лесникова Н.П. Физическая химия. Самостоятельное решение задач по химической термодинамике, электрохимии и кинетике
Подождите немного. Документ загружается.


141
.lnln
,
0
,
0
,
ClTlTlClCl
Cl
Tl
TlCl
TlTlClCl
a
F
RT
E
aa
a
zF
RT
EE
ClTleTlCl
(1)
Активность ионов хлора в растворе можно определить в при-
сутствии ионов таллия, зная произведение растворимости соли
:
,TlCls
L
.
,TlCls
TlCl
Laa
Тогда уравнение (1) можно преобразовать к виду:
.ln
lnlnln
0
,
0
,
,
0
,
TlTlTl
Tl
TlCls
TlTlClCl
Tl
TlCls
TlTlClCl
a
F
RT
E
a
F
RT
L
F
RT
E
a
L
F
RT
EE
(2)
Сравнение уравнений (1) и (2) приводит к важному соотноше-
нию между стандартными потенциалами электродов первого и вто-
рого рода, составленных из идентичных материалов:
.ln
,
00
,
TlCls
TlTlTlTlClCl
L
F
RT
EE
(3)
Соотношение (3) позволяет определить произведение раство-
римости малорастворимого соединения только из значений стан-
дартных потенциалов электродов первого (
0
1
Е ) и второго (
0
2
Е ) рода.
.1084,1336,0557,0
29831,8
965001
exp
exp
4
0
1
0
2
EE
RT
zF
L
S
Полученное значение произведения растворимости
TlCl
хорошо со-
гласуется со справочными данными: .108,1
4
S
L
Растворимость
TlCls можно найти по формуле:
./1036,11084,1
2
2
1
4
2
1
лмольLs
s
Пример 58. Определить величину произведения растворимости
PbSO
4
, если известны стандартные потенциалы электродов первого
и второго рода:
BEBE
PbPbSOSOPbPb
359,0;126,0
0
,
0
4
2
4
2
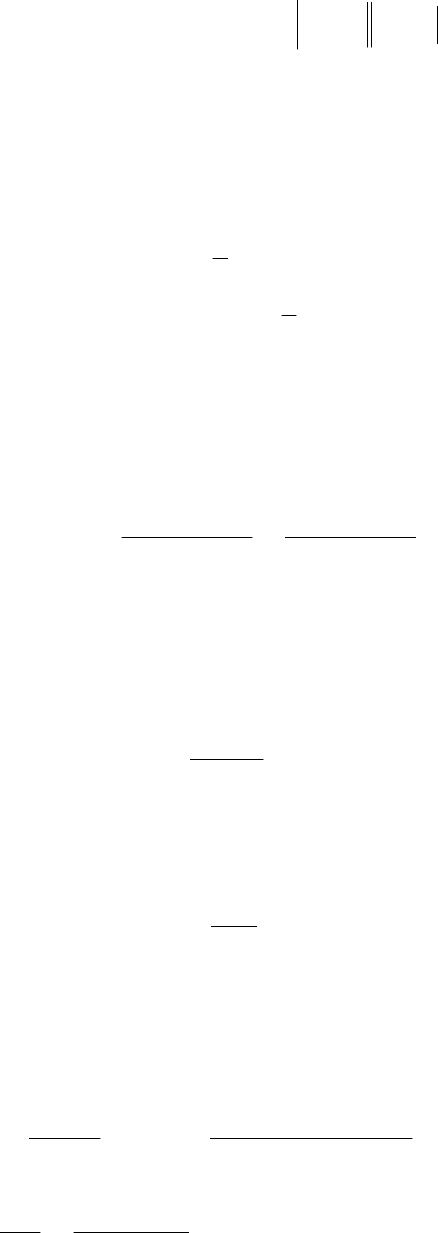
142
в гальваническом элементе:
.,
22
44
PbPbSOPbSOPb
Решение. Гальванический элемент состоит из электродов пер-
вого и второго рода. Согласно значениям стандартных потенциалов
и указанной полярности элемента, запишем уравнения реакций,
протекающих на каждом электроде и суммарную реакцию в гальва-
ническом элементе:
.
2
2
4
2
4
2
4
2
4
2
PbSOSOPb
PbSOeSOPb
PbePb
Уравнение константы равновесия суммарной реакции с учетом,
что
,1
4
PbSO
a
имеет вид:
.
1
2
4
22
4
2
4
SOPbSOPb
PbSO
a
aaaa
a
K
Произведение растворимости связано с константой равновесия
следующим соотношением:
.
1
,
4
2
4
2
4
PbSO
a
SOPb
PbSO
L
K
aaL
Из термодинамики гальванического элемента известно уравне-
ние связи константы равновесия и стандартной ЭДС:
.ln
0
a
K
zF
RT
E
Значения стандартных электродных потенциалов даны в усло-
вии задачи, поэтому:
.1027,1
1083,7
11
;1083,7
23831,8
239,0965002
expexp
;239,0359,0126,0
8
7
7
0
000
4
a
PbSO
a
K
L
RT
zFE
K
BEEE
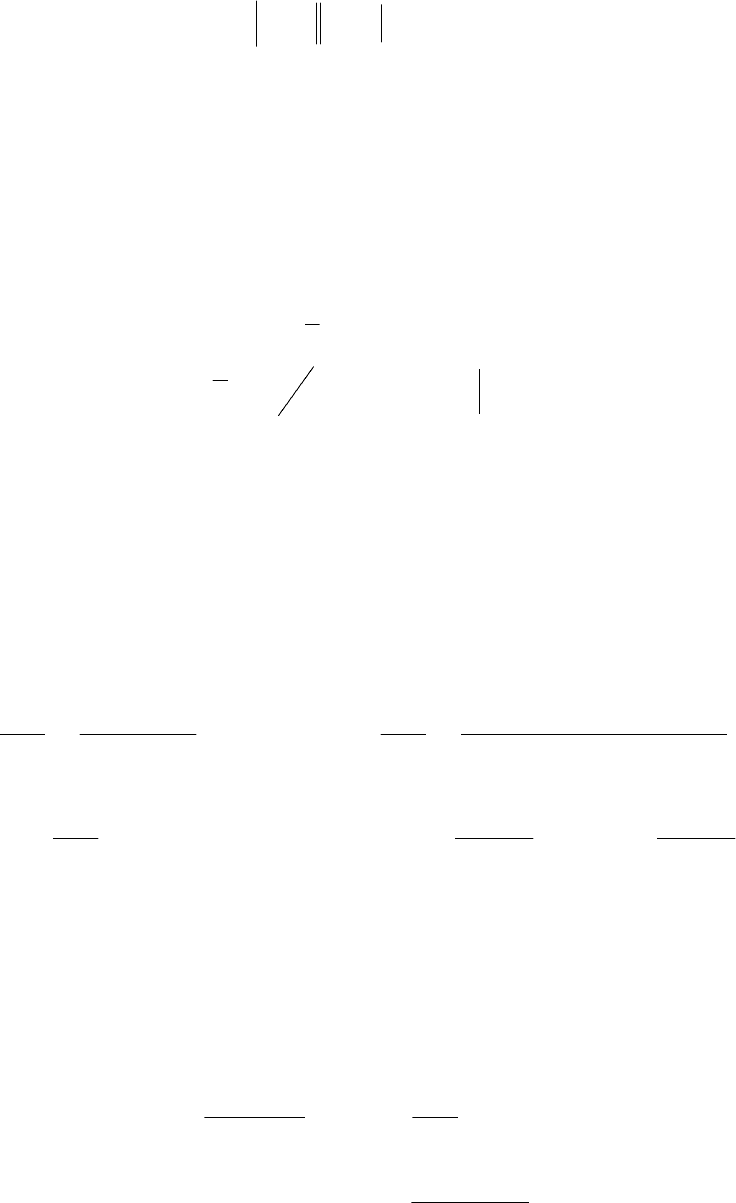
Пример 59. Определить рН соляной кислоты (m = 0,1 моль/кг),
если при 298 Κ в гальваническом элементе, состоящем из кало-
мельного и хингидронного электродов, ЭДС равна 0,301 В:
143
.,,
24644622
OHHCOHCHClKClClHgHg
Решение. Гальванический элемент состоит из электрода второ-
го рода (каломельный), он является электродом сравнения и индика-
торного окислительно-восстановительного (хингидронного) элек-
трода. Согласно значениям стандартных потенциалов и указанной
полярности элемента, запишем уравнения реакций, протекающих на
каждом электроде и суммарную реакцию в гальваническом элемен-
те:
.222
26,0,2
2
1
699,0,22
22246246
0
.22
0
..246246
ClHgOHHCClHgHOHC
BEClHgeClHg
BEOHHCeHOHC
кал
гх
Запишем уравнение Нернста для полученной суммарной реак-
ции, при этом учтем, что активности чистых твердых соединений
являются постоянными и равными единице:
ClH
ClH
ClHgхг
Cl
Hg
H
x
a
a
a
F
RT
a
F
RT
EEaa
F
RT
EE
aa
aaaa
F
RT
EE
zF
RT
EE
продi
исхi
ln
2
2
ln
2
2
ln
2
ln
2
ln
002200
222
.
000
22
В полученном выражении ЭДС гальванического элемента, по-
сле небольших математических преобразований, заменим:
.;lg
HCl
ClH
maapH
Выведем окончательное уравнение для определения .
HCl
рН
.25,1
052,037,0301,0
301
,0796,01,0ln
96500
29831,8
0552,0268,0699,0
lnlg
3,2
00
HCl
HCl
H
pH
pH
pH
m
F
RT
a
F
RT
EEE
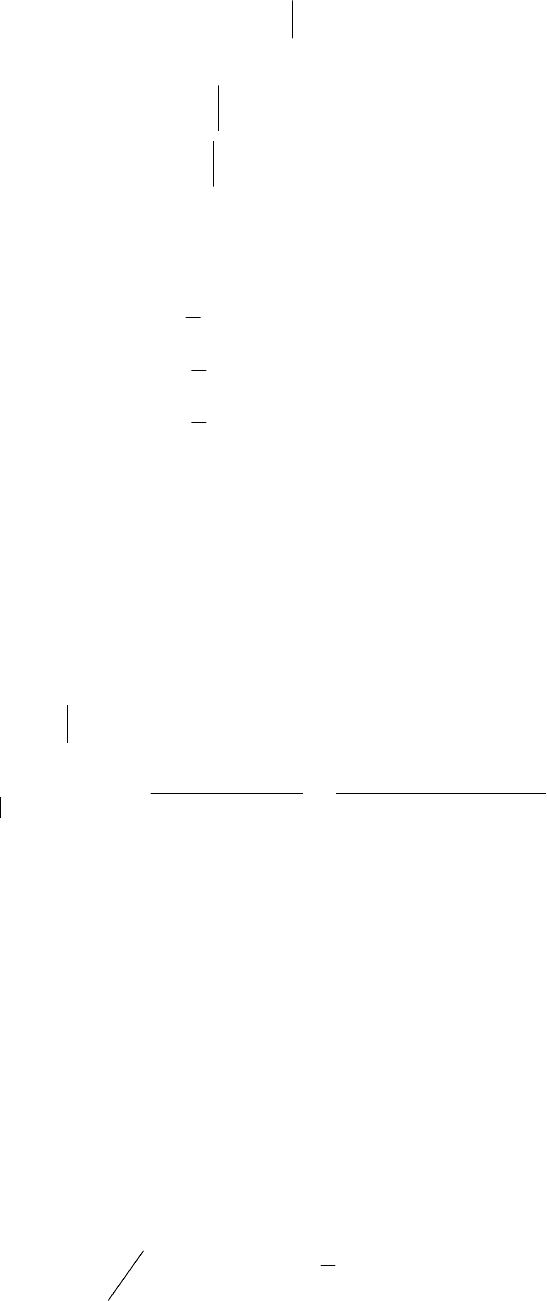
144
Пример 60. Определить стандартный электродный потенциал
электрохимической системы
24
MnOMnO
по стандартным потен-
циалам систем:
BEMnMnO 51,1
0
1
2
4
.23,1
0
2
2
2
BEMnMnO
Решение. Напишем для трех систем стехиометрические урав-
нения полуреакций восстановления с указанием изменения энергии
Гиббса и электродных потенциалов:
.32343
;22242
;54581
0
3
0
3224
0
2
0
22
2
2
0
1
0
12
2
4
FEGOHMnOeHMnO
FEGOHMneHMnO
FEGOHMneHMnO
Согласно полученным уравнениям, видно, что уравнение (3),
относящиеся к искомому потенциалу, получается в результате вы-
читания уравнения (2) из (1), аналогичное действие следует произ-
вести с величинами :
0
G
.
0
2
0
1
0
3
GGG
Тогда стандартный электродный потенциал электрохимиче-
ской системы
24
MnOMnO
будет равен:
.70,1
3
23,1251,15
3
25
0
2
0
1
0
3
0
24
B
EE
EE
MnOMnO
Пример 61. Для топливного элемента, в котором при 25
0
С про-
текает химическая реакция
,435
22283 жггг
ОНСООНС
определить: число электронов, участвующих в суммарной реакции;
стандартное значение ЭДС и температурный коэффициент ЭДС;
константу равновесия химической реакции; коэффициент полезного
действия данного элемента. Использовать справочные термодина-
мические данные.
Решение. Количество участвующих в реакции электронов
можно найти из реакции образования воды:
.22
2
1
22 ж
ОНеНО
Из этой реакции видно, что на каждый вступающий в реакцию атом
кислорода приходится два электрона. Для топливного элемента, со-
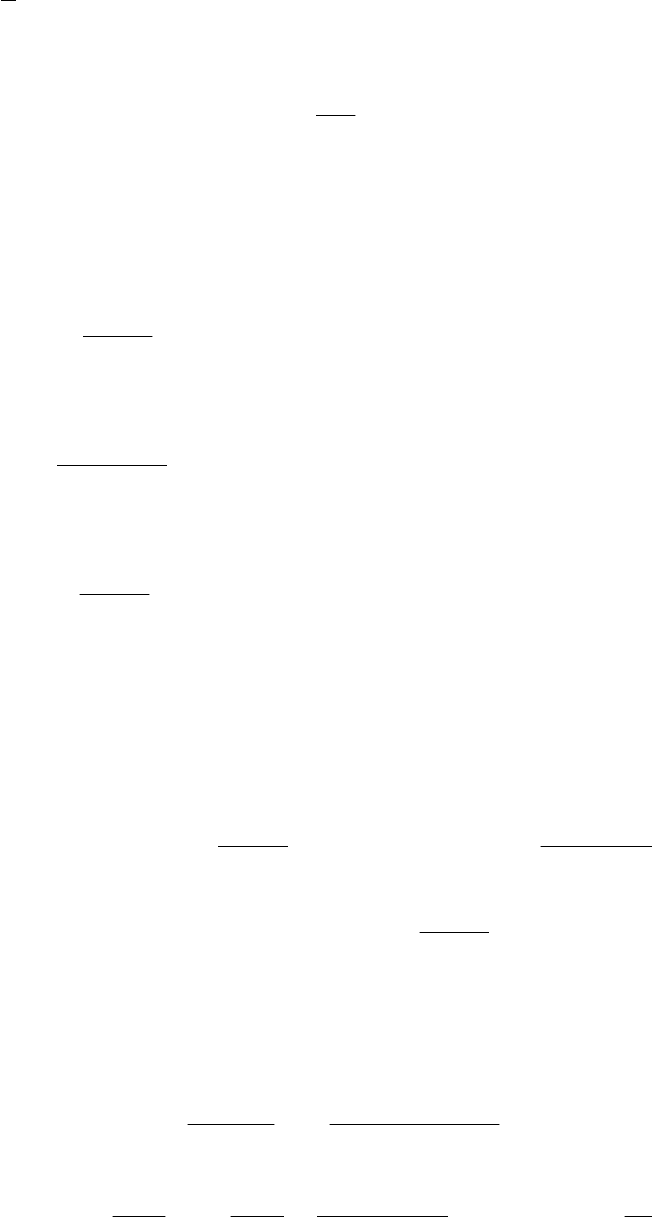
145
гласно протекающей химической реакции число электронов равно
.
20
10
2
е
Используя справочные данные, следует найти значения
0
G
r
и
0
S
r
, а затем определить
0
Е
и .
р
Т
Е
вещество
г
НС
83
г
О
2
5
г
СО
2
3
ж
ОН
2
4
моль
кДж
H
f
,
0
298
–103,85 0 3(–393,51) 4(–285,83)
моль
Дж
S ,
0
298
269,1 5·205,04 3·213,66 4·69,95
моль
кДж
G
f
,
0
298
–22,31 0 3(–394,37) 4(–237,23)
Значения
0
G
r
и
0
S
r
, согласно основным уравнениям термодина-
мики, равны:
.0,2220
;33,374;5,2108
0
298
0
298
0
298
моль
кДж
H
моль
Дж
S
моль
кДж
G
r
r
Из термодинамики электрохимических цепей находим по
уравнениям (2.58; 2.61) значения стандартной ЭДС и температурно-
го коэффициента ЭДС:
.1094,1
9650020
33,374
;093,1
9650020
105,2108
4
0
30
298
0
B
zF
S
T
E
B
zF
G
E
r
p
r
Следует напомнить – отрицательные значения температурного
коэффициента и энтропии означают, что в изотермических условиях

146
гальванический элемент отдает часть теплоты окружающей среде. В
адиабатических условиях такой элемент нагревается.
Коэффициент полезного действия (η) гальванического элемен-
та определяется отношением полезной работы к тепловому эффекту
протекающей в нем реакции, поэтому, в данном примере
.95,0
0,2220
5,2108
0
0
H
G
r
r
Константа равновесия химической реакции, протекающей в
гальваническом элементе, равна:
.10
29831,8
093,19650020
expexp
3,369
0
0
RT
zFE
K
Такое высокое значение константы равновесия и коэффициен-
та полезного действия указывает на полное завершение реакции в
топливном элементе.
Пример 62. Определить изменения энергии Гиббса, энтальпии
и энтропии для реакции, протекающей при 293 Κ в элементе Весто-
на, если зависимость ЭДС от температуры выражается уравнением:
.2931006,40183,1
5
ТЕ
Решение. Элементу Вестона соответствует схематическая за-
пись: CdHgSOHgCdSOCd ,
424
.
Из схематической записи видно, что элемент Вестона состав-
ляют кадмиевый электрод – первого рода и каломельный – электрод
второго рода. Суммарная реакция, протекающая в элементе, полу-
чается в результате сложения соответствующих реакций окисления
– восстановления:
.2;018,12
403,0;2
615,0;22
0
298
2
4
2
42
02
0
,
2
442
2
24
2
4
zBESOCdHgSOHgCd
BECdeCd
BESOHgeSOHg
CdCd
HgHgSOSO
Значение ЭДС при 293 Κ определим после подстановки этой
температуры в температурный ряд ЭДС, тогда
.0183,1
0
293
ВЕ
147
Найденное значение ЭДС подставим в соответствующее урав-
нение (2.58) и определим изменение энергии Гиббса:
./183,2030183,1965002
0
293
0
293
молькДжEFzG
r
Для определения температурного коэффициента ЭДС, про-
дифференцируем уравнение температурного ряда по
p
T
, тогда
.1006,4
5
K
B
T
E
p
Изменения энтропии и энтальпии определим по уравнениям
(2.59 – 2.61):
./142,226
10836,7293183,203
;/836,71006,4965002
30
293
0
293
5
молькДж
STGH
мольДж
T
E
FzS
rrr
p
r
Пример 63. Определить ЭДС гальванического элемента при
298 Κ, имеющего схематическую запись:
.5,0;1
;1
,,
21
1
232
222
МсМс
атмРP
PtHCOOHCHHCOOHHPt
НH
Константа диссоциации муравьиной кислоты равна 1,27·10
-3
; а ук-
сусной кислоты – 1,8·10
-5
.
Решение. Рассматриваемый гальванический элемент является
концентрационным; состоит из двух газовых электродов – водород-
ных. Эти электроды имеют одинаковые давления водорода, но раз-
личные концентрации кислот. Различные концентрации кислот, а
главное, различная степень диссоциации, являются основными при-
чинами разного содержания ионов водорода в растворах. Поэтому,
входящие в уравнение ЭДС активности ионов водорода будут раз-
личными.
Схема водородного электрода, протекающая на нем реакция
восстановления и уравнение Нернста для определения электродного
потенциала, имеют следующий вид:
;
2
1
,
22
HeHPtHH
148
2
1
2
2
2
,
2
1
1
1
1
,
0
,
2
1
0
,,
2
2
2
2
2
2
22
~
ln;
~
ln
,0;
~
ln
H
H
HH
H
H
HH
HH
H
H
HHHH
P
a
Fz
RT
EE
P
a
Fz
RT
EE
E
P
a
Fz
RT
EE
Для слабых электролитов часто принимают
H
H
ca . Концен-
трацию ионов водорода можно определить из выражения для кон-
станты диссоциации соответствующей кислоты:
.;,
;;,
3
3
3
2
3
3
2
3
1
1
2
2
2
1
СООНСН
Н
СООНСНд
СООСНН
СООНСН
СООСНН
СООНСНд
НСООН
Н
НСООНд
НСООН
НСООН
НСООН
НСООНд
с
с
сс
с
сс
с
с
сс
с
сс
Искомые концентрации ионов водорода будут равны:
.2,0042,01108,1
;1,025,05,01027,1
3
5
22
2
3
11
1
СООНСНсс
НСООНсс
д
Н
д
Н
Определим электродные потенциалы положительного и отри-
цательного электродов:
.1402,00042,0ln
96500
29831,8
;0945,0025,0ln
96500
29831,8
2
1
BEE
BЕЕ
ЭДС концентрационного гальванического элемента равно:
.045,01402,00945,0 ВЕЕЕ
ЗАДАЧИ
2.21. Написать электронно-ионные полуреакции в водных рас-
творах и уравнение Нернста для расчета значений потенциалов сле-
дующих электродов:
.,,;,
2
4
2
32
2
64
PtMnMnOHPtOSOS
149
2.22. Изобразить схематически электрохимические элементы, в
которых самопроизвольно протекают следующие реакции:
.222;2
22
2
AgBrSnAgBrSnClMnClMn
2.23. Для схематически представленных электрохимических
элементов, работающих в режиме источника тока, написать полуре-
акции протекающие на каждом электроде, и суммарную (полную)
реакцию в элементе; выразить ЭДС гальванического элемента через
активности ионов и среднюю ионную активность электролита:
.,,;,
2224242
PtHClOHClOHClClHgHgPtAgSOAgSONaNaAg
2.24. На основании значений стандартных электродных потен-
циалов (Е
0
): -0,136 В (Sn
2+
|Sn); 0.337 B (Cu
2+
|Cu), определить на-
правление и константу равновесия реакции в водном растворе при
298 Κ:
.
4
4
SnSOCuCuSOSn
Ответ: 9,7·10
5
.
2.25. В элементе Вестона обратимо и изотермически протекает
реакция:
.2
2
4
2
4
2
HgSOCdSOHgCd
Определить ЭДС элемента, изменение энергии Гиббса, изме-
нение энтропии и энтальпии при 303 Κ, если температурный коэф-
фициент ЭДС равен (-) 4,06·10
-5
В/Κ.
Ответ: 1,0179 В; -196,4 кДж/моль; -199,0 кДж/моль;
-7,83 Дж/(моль·Κ).
2.26. Определить ЭДС гальванического элемента при 298 Κ и
давлении водорода 1 атм.:
11,0
,,
2422
mm
PtHSOHNaOHHPt
Ответ: 0,722 В.
2.27. Электродвижущая сила гальванического элемента при
298 Κ равна 0,0183 В.
150
05,0005,0
21
44
mm
ZnZnSOZnSOZn
Определить значение среднего коэффициента активности в бо-
лее концентрированном растворе, если в менее концентрированном
растворе его значение 0,48.
Ответ: 0,20.
2.28. Определить изменения стандартных значений энергии
Гиббса, энтальпии и энтропии, если ЭДС гальванического элемента,
в котором протекает химическая реакция
,
2
1
22
HgAgClClHgAg
равна 0,456 В при 298,2 Κ и 0,439 В при 293,2Κ.
Ответ: -55,005 кДж/моль; 53,835 кДж/моль; 328,1 Дж/(моль·Κ).
2.29. Найти, используя справочные данные, константу равнове-
сия реакции, протекающей в элементе:
.
22
NiNiZnZn
Ответ: 2,3·10
17
.
2.30. Определить ЭДС гальванического элемента при 298 Κ
3
2
3
1
2422
1010
.,,
mm
PtHKOHSOHHPt
В данном элементе давление водорода в левом электроде равно
1,01·10
5
Па, а в правом электроде равно 9,57·10
4
Па.
Ответ: 0,00236 В.
2.31. Используя справочные данные, определить ЭДС гальва-
нического элемента двумя основными способами:
05,03,0
2,05,0
.,,
22
43
2423
SnCr
SnCr
aa
aa
PtSnSnCrCrPt
Ответ: 0,563 В.
