Лесникова Н.П. Физическая химия. Самостоятельное решение задач по химической термодинамике, электрохимии и кинетике
Подождите немного. Документ загружается.

161
Интегрирование уравнения (3.15) в соответствующих преде-
лах, позволяет получить выражение константы скорости для реак-
ции первого порядка:
.ln
1
,lnln
,ln,
0
00
x
a
a
t
ktkxaa
tkxadtk
xa
xad
x
tx
(3.16)
Из уравнения константы скорости для реакции первого поряд-
ка получим зависимость концентрации реагентов и продуктов реак-
ции от времени:
.
,exp1,exp
,0
tk
AA
ecc
ktaxPktaxaA
(3.17)
Следует отметить, что константа скорости реакции первого по-
рядка может быть определена и в том случае, если вместо концен-
трации реагента измерять какое либо свойство системы. например,
оптическую плотность.
Из закона Бугера-Ламберта-Беера оптическую плотность (Е) и,
соответственно, концентрацию реагента в различные моменты вре-
мени можно представить
..,
,
0
,000
t
E
c
t
E
cclEclE
t
AtAtt
Подставим полученные значения концентрации вещества А в
уравнение константы скорости реакции первого порядка (3.16).
.ln
1
ln
1
ln
1
ln
1
0
,
,0
,0
,0
tAt
A
A
A
E
E
tc
c
txc
c
txa
a
t
k
(3.18)
Если предположить, что за некоторый промежуток времени
2
1
t концентрация реагентов уменьшилась в два раза, то выраже-
ние константы скорости реакции (3.16) после соответствующих пре-
образований принимает вид:
.
2ln
;
2ln
2
ln
1
;ln
1
;
2
2
1
2
1
2
1
2
1
k
t
t
a
a
t
ktt
xa
a
t
k
a
xa
(3.19)
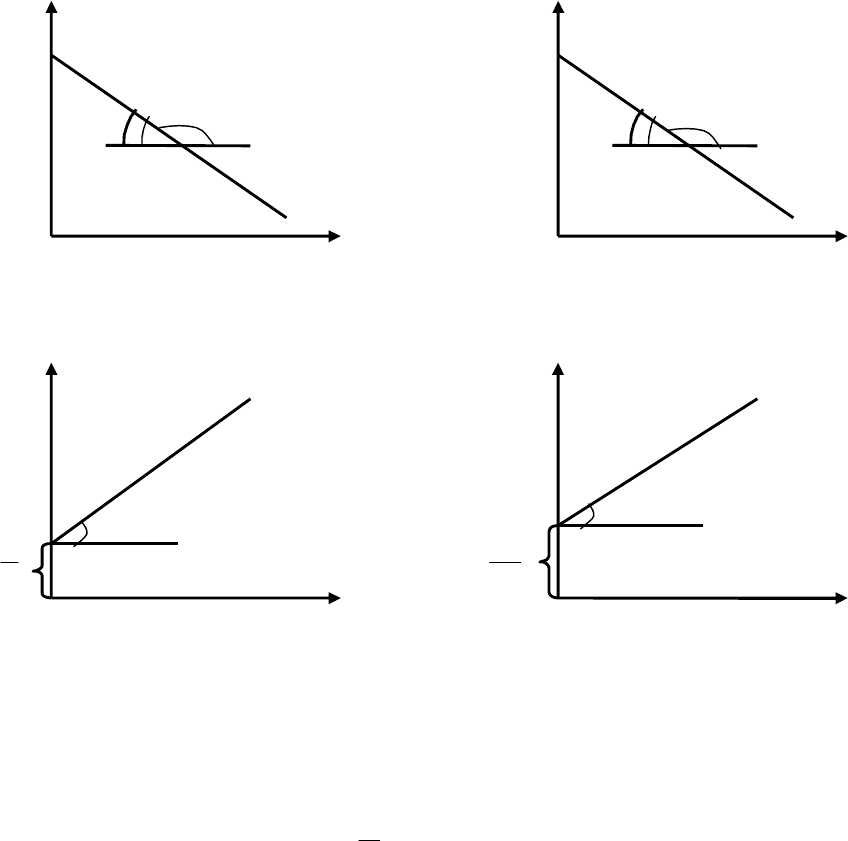
162
Графическое изображение функциональной зависимости
xaC
ln от времени соответствует рис. 3.2.(б).
Тангенс угла наклона прямой (а, б) позволяет определить кон-
станту скорости: .
x
y
tgk
Реакции второго порядка. Многие бимолекулярные реакции
являются реакциями второго порядка, для которых возможны три
следующие схемы элементарного механизма превращения реагентов
в продукты реакции:
.)
,2)
,)
BAPBAc
PAb
BAPBAa
(3.20)
Выведем кинетические уравнения для всех типов реакций вто-
рого порядка. Предположим, что реакция протекает по механизму,
представленному первой схемой с равными концентрациями реаген-
x
a
tgtgk
0
t
a
xa
ln
tgtgk
1
t
б
1
xa
a
1
2
ktg
t
в
t
2
xa
3
2ktg
2
1
a
г
Рис. 3.2. Графический способ определения порядка реакции:
а – при n = 0; б – при n = 1; в – при n = 2; г – при n = 3

163
тов. Тогда, в любой момент времени протекания реакции, концен-
трации реагентов соответствуют значениям:
.
,
,0
00
xacBA
acBA
A
t
t
A
Подставим эти выражения в уравнение скорости реакции (3.8), ко-
торое для реакций второго порядка принимает вид:
.
2
xak
dt
dx
W
Разделим переменные в полученном уравнении и проинтегрируем
его в соответствующих пределах:
,
1
,
,
0
0
0
22
tk
xa
dtk
xa
xad
dtk
xa
xad
илиdtk
xa
dx
x
tx
Тогда,
.
111111
,0
AA
cctaxat
k (3.21)
Если в какой-то промежуток времени протекания реакции
2
1
t концентрация любого из реагентов уменьшится в два раза, т.е.
,
2
2
,0
,
a
c
c
A
At
то уравнение константы скорости (3.21) принимает
вид
.
1
,
11
2
11
2
1
2
1
2
1
ak
t
ata
a
t
k
(3.22)
Графическое изображение функциональной зависимости 1/с от вре-
мени показано на рис. 3.2.(в), из которого следует, что
tg
k
.
Если реакция второго порядка протекает по второй схеме, то
концентрация реагента А в любой момент времени равна (а – 2х).
После подстановки этого значения в уравнение основного закона
кинетики (3.8) и его интегрирования в соответствующих пределах,
получим:
164
.
1
2
1
2
1
,2
1
2
1
2
2
2
1
,
2
2
00
22
2
axat
ktk
axa
dtk
xa
xad
dtk
xa
dx
xak
dt
dx
tx
(3.23)
Если концентрация вещества А равна
A
cxaA
2 , т.е.
текущей концентрации, то уравнение константы скорости (3.23)
становится аналогичным уравнению (3.21). Но на графике функцио-
нальной зависимости 1/с от времени
.
2
k
tg
При протекании реакции по третьей схеме концентрации реа-
гентов не равны между собой. Выразим концентрации реагентов
следующим образом:
.;);(
,0,0
xPxcxbBxcxaA
BA
Подставим в уравнение основного постулата кинетики (3.8) эти
выражения и разделим переменные:
.
,0,0
,0,0
dtk
xcxc
dx
xcxck
dt
dx
BA
BA
(3.24)
Для дальнейшего вывода используем разложение сложной дроби на
две простые, что можно представить следующим образом:
.
1111
xbxaabxbxa
Тогда уравнение (3.24) принимает вид
.
1
,
11
,0,0,0,0
,0
,0
,0,0
dtk
xc
dx
xc
dx
cc
dtk
xc
xc
cc
dx
BAAB
B
A
AB
(3.25)
Интегрирование этого выражения в пределах от х = 0 до х и от
t = 0 до t с последующим преобразованием полученного логарифми-
ческого уравнения
,lnlnlnln
1
,0,0.0,0
,0,0
tkcxccxc
cc
BBAA
AB
(3.26)
позволяет получить выражение константы скорости реакции второго
порядка, когда концентрации реагентов не равны между собой:

165
.ln
1
,0,0
,0,0
,0,0
xcc
xcc
cct
k
AB
BA
AB
(3.27)
Реакции n-порядка. Для вывода кинетического уравнения кон-
станты скорости реакции любого порядка, кроме п = 1, разделим в
уравнении (3.8) переменные и проинтегрируем полученное выраже-
ние в соответствующих пределах:
.
11
1
1
1
11
0
1
00
tk
a
xa
n
tk
n
xa
dtk
xa
xad
dtk
xa
xad
dtk
xa
dx
xak
dt
dx
nn
x
n
tx
nn
n
n
Математические преобразования позволяют получить уравне-
ние, которое является общим для реакций любого порядка, кроме
п = 1 и которое справедливо, если концентрации реагентов равны
между собой:
.
11
1
1
11
nn
a
xa
nt
k (3.28)
Предположим, что к моменту времени
2
1
t
концентрация реа-
гентов уменьшится вдвое, тогда константа скорости будет равна:
.
12
1
11
2
1
1
1
1
1
2
1
11
2
1
n
n
nn
a
nt
a
a
nt
k (3.29)
Из этого уравнения (3.29) выражение времени
2
1
t
для реакций раз-
личных порядков, кроме первого имеет вид:
.
12
1
11
1
1
2
1
n
n
a
nk
t (3.30)
3.3. Способы определения порядка реакции
Основными способами определения порядка реакции являют-
ся: интегральный, дифференциальный и метод изолирования Ост-
вальда.
166
Интегральные методы определения порядков реакций осно-
ваны на применении интегрального кинетического уравнения для
обработки первичных экспериментальных результатов концентра-
ция – время.
Метод подстановки. Позволяет установить соответствие
опытных данных одному из интегральных кинетических уравнений.
Соответствие установлено, если после подстановки опытных дан-
ных об изменении концентрации от времени в очередные кинетиче-
ские уравнения, рассчитанные значения константы скорости колеб-
лются около постоянной величины. Этот способ дает надежные ре-
зультаты для реакций, степень превращения в которых достигает 70
– 90%.
Несовпадающие значения константы указывают, что реакция
сложная, а порядок может быть дробным или отрицательным. Сле-
довательно, надо искать другой способ определения порядка реак-
ции.
Вариантом метода подстановки является графический способ.
В этом случае порядок соответствует той величине, на каком из гра-
фиков наблюдается линейная функциональная зависимость концен-
трации от времени.
Определение порядка реакции по времени полупревращения. По
этому способу можно определить любой порядок реакции, если
имеются для различных опытов данные о начальных значениях кон-
центрации реагентов и времени, когда их концентрация уменьши-
лась вдвое. Уравнение для определения порядка реакции выводится
после соответствующего преобразования соотношения (3.30).
Прологарифмируем уравнение (3.30), при этом предположим,
что для данной реакции порядок реакции и константа скорости яв-
ляются величинами постоянными:
.,,
1
12
,ln1lnln
,ln1
1
12
lnln
12
1
11
1
2
1
1
2
1
1
1
2
1
constknесли
nk
AгдеanAt
an
nk
t
a
nk
t
n
n
n
n
(3.31)

167
Пусть из опытных данных значение
12
1
t соответствует на-
чальной концентрации
10
c
, а значение
22
1
t соответствует началь-
ной концентрации
20
c
, тогда
.ln1lnln
,ln1lnln
20
22
1
10
12
1
cnAt
cnAt
(3.32)
Приравняем из обоих уравнений выражение ln A и преобразуем по-
лученное соотношение:
,ln1lnln1ln
20
22
110
12
1
cntcnt
.lnlnlnln1
12
1
22
12010
ttccn
Тогда порядок реакции можно определить из уравнения:
.1
lnln
lnln
2010
12
1
22
1
cc
tt
n (3.33)
Разновидностью этого способа является графическое изобра-
жение ln t
1/2
от ln c
0
. Если соблюдается линейная зависимость этих
величин, то угол наклона позволяет также определить порядок реак-
ции:
1
ntg
.
Метод Оствальда – Нойесса. Этот метод основан на зависи-
мости времени превращения
x
t
1
исходного вещества на определен-
ную долю от начальной концентрации. Из уравнения (3.30) для ре-
акций п – порядка при любом значении х можно получить следую-
щие уравнения:
.
1
11/112
1
11
1
1
1
1
1
2
1
n
n
x
n
n
an
xx
k
t
a
nk
t (3.34)
Если в уравнение (3.34) подставить вместо х величины
4
;
3
;
2
aaa
,
то получим ряд выражений времени превращения
x
t
1
для реакций
различных порядков:

168
Время превращения
x
t
1
порядок
реакции
t
1/2
t
1/3
t
1/4
0
k
a
2
k
a
3
k
a
4
1
k
2
ln
k
2
3
ln
k
3
4
ln
2
ka
1
ka
2
1
ka
3
1
3
2
2
3
ka
2
8
5
ka
2
18
7
ka
n
1
1
1
121
n
n
an
k
1
1
1
1
2
3
1
n
n
an
k
1
1
1
1
3
4
1
n
n
an
k
Достоинство всех интегральных способов определения порядка
реакции в том, что они позволяют использовать первичные данные:
концентрация – время.
Дифференциальный метод определения порядка реакции.
Этот метод, который иногда называют методом Вант – Гоффа, осно-
ван на использовании основного кинетического уравнения
n
ckW . Метод позволяет достаточно точно определить порядок
реакции, если имеются достоверные значения скорости реакции при
различных концентрациях c
i
.
Уравнение для определения порядка реакции может быть по-
лучено следующим образом:
.lnlnln;lnlnln
,,lnlnln
2
2
1
1
cnkWcnkW
тогдаcnkWckW
n
Так как константа скорости в этих реакциях имеет одинаковое зна-
чение, то из полученного равенства скоростей порядок реакции
можно определить по уравнению
.
lnln
lnln
,lnlnlnln
1
2
12
2211
cc
WW
n
cnWcnW
(3.35)

169
Графическое решение уравнения (3.35) в координатах
W
ln
от
C
ln
имеет вид прямой, где n
x
y
tg
.
Метод изолирования Оствальда. Определяется частный по-
рядок реакции по каждому веществу, участвующему в реакции. Об-
щий порядок реакции равен сумме частных порядков. Для опреде-
ления частного порядка реакции все реагенты берутся в избытке, а
то вещество, по которому определяется порядок реакции – в недос-
татке. Выражение скорости реакции при [B] >> [A] соответствует
выражению (3.36), при этом, величина кажущейся константы скоро-
сти, зависит от концентрации вещества В. Порядок реакции по ве-
ществу А находят одним из рассмотренных выше способов.
.,
..
BA
n
B
каж
n
A
каж
ckkгдеckW (3.36)
Затем при постоянной температуре и различных значениях [B]
0
причем,{[B]
0
>> [A]
0
, определяется численное значение k
каж
. Гра-
фическим или алгебраическим путем рассчитывается порядок реак-
ции по веществу В (n
B
) и константа скорости k по уравнению ln
k
каж
= ln k + n
B
[B]. Зная порядки реакции по отдельным веществам
(частные порядки реакции), находят общий порядок реакции (n = n
A
+ n
B
).
3.4. Зависимость скорости реакции от температуры.
Вывод и анализ уравнения Аррениуса.
Для большинства химических реакций (исключая тримолеку-
лярные и ферментативные) скорость реакции с ростом температуры
увеличивается. Изменение скорости от температуры возможно в ре-
зультате изменения трех величин: константы скорости, концентра-
ции и порядка реакции. Обычно концентрация реагентов (особенно
для реакций в жидкой фазе) изменяется с температурой незначи-
тельно. Изменение порядка реакции под влиянием температуры –
явление редкое. Поэтому, в химической кинетике изменение скоро-
сти реакции под влиянием температуры связано, в первую очередь, с
изменением константы скорости.
Для многих реакций, особенно для реакций в растворах, дли-
тельное время было справедливым правило Вант – Гоффа, из ко-
торого следовало: "При повышении температуры на десять гра-
дусов скорость реакции увеличивается в два – четыре раза".

170
.
,,42
10
1010
12
1
2
1
2
TT
T
T
m
T
mT
T
T
T
T
k
k
тогда
k
k
W
W
или
k
k
(3.37)
По физическому смыслу величину γ считают температурным
коэффициентом Вант – Гоффа. На практике в значениях этого ко-
эффициента имелись значительные отклонения от предела два – че-
тыре раза.
Аррениус внес соответствующие допущения, которые допол-
нили правило Вант – Гоффа и позволили более точно установить за-
висимость скорости реакции от температуры.
Реагировать могут не все молекулы, но лишь те, которые
находятся в особой таутомерной форме или активной модифи-
кации. Эта активная, способная к реакции форма молекул, образу-
ется из обычных нормальных молекул при поглощении теплоты
молькДжE /
. Тогда, схему элементарной реакции следует пред-
ставить в виде:
P
A
A
constE
.
Лимитирующей стадией, определяющей скорость реакции, яв-
ляется первая, которая протекает значительно медленнее второй ста-
дии.
Образование активной модификации является обратимой ре-
акцией. Это позволяет концентрацию активной модификации выра-
зить через константу равновесия K
с
.
Введем соответствующие обозначения:
A
A
cc , – концентра-
ции исходного реагента А и его активной модификации. Тогда из
основного постулата кинетики, скорость реакции представим в виде
(согласно схеме реакции):
.3
2,
1,
AC
A
P
Ac
A
A
A
C
A
AP
cKconstcconst
dt
dc
W
cKc
c
c
K
ck
dt
dc
dt
dc
W
(3.38)
