Лесникова Н.П. Физическая химия. Самостоятельное решение задач по химической термодинамике, электрохимии и кинетике
Подождите немного. Документ загружается.


171
Приравняем в этом выводе уравнения (1) и (3), прологарифмируем и
продифференцируем по температуре, тогда:
.5
ln
ln
,lnlnln.
4
dT
Kd
dT
kd
difKconstkKconstk
cKconstck
C
CC
ACA
(3.39)
Так как, для рассматриваемой схемы реакции реакционный
объем постоянный, а первая стадия реакции является обратимой, то
к полученной зависимости константы равновесия от температуры
можно применить уравнение изохоры:
.
ln
2
RT
U
dT
Kd
C
(3.40)
При этом учитываем, что концентрация активной модификации все-
гда мала и ее образование практически не влияет на концентрацию
исходных реагентов.
Первая стадия реакции, как уже отмечалось, является обрати-
мой реакцией. При постоянном объеме и равновесном состоянии
для этой части системы будут вполне приемлемыми известные со-
отношения термодинамики, в частности, константа равновесия со-
ответствует выражению:
.
b
B
a
A
d
D
c
C
C
cc
cc
KdDcCbBaA
С учетом основного постулата кинетики, выражение константы
равновесия имеет вид:
,,,
1
1
1111
k
k
KcckcckWW
C
d
D
c
C
b
B
a
A
(3.41)
где k
1
, k
-1
– константы скорости прямой и обратной реакций.
Активные модификации (активированный комплекс) превра-
щаются в конечный продукт со скоростью, не зависящей от тем-
пературы. Это означает, что роль температуры сводится только к
сдвигу равновесия между нормальными и активными частицами, в
результате чего концентрация последних увеличивается.
Прологарифмируем выражение константы равновесия из урав-
нения (3.41), а затем продифференцируем его по температуре и под-
ставим полученное соотношение в уравнение (3.40):

172
.
lnln
;
ln
ln
;lnlnln
2
11
2
2
1
11
RT
U
dT
kd
dT
kd
RT
U
dT
k
k
d
dT
Kd
kkK
C
C
(
3.42)
Представим изменение внутренней энергии как разность двух
энергетических величин: Е
1
и Е
-1
. То есть, как разность энергетиче-
ских величин характеризующих прямую и обратную реакции. Тогда,
,
lnln
lnln
,
2
11
2
11
2
1
2
111
11
B
RT
E
dT
kd
RT
E
dT
kd
или
RT
E
RT
E
dT
kd
dT
kd
E
E
U
(3.43)
где полученное соотношение выполняется в том случае, если B =
const или В = 0. В то же время выражение (3.43) можно представить
как разность двух уравнений:
.
ln
,
ln
2
11
2
11
B
RT
E
dT
kd
B
RT
E
dT
kd
(3.44)
Аррениус, анализируя эти выражения и опытные данные при-
шел к выводу, что для всех реакций В = 0. Тогда, отбрасывая индек-
сы, выражение (3.44) в общем виде можно представить как
.
ln
2
RT
E
dT
kd
(3.45)
Это выражение является дифференциальной формой уравнения
Аррениуса.
Значение величины Е соответствует значению энергии актива-
ции. Энергия активации – это та избыточная энергия, которую
нужно добавить к реагентам, чтобы они вступили во взаимо-
действие. Приближенно она равна средней энергии активированно-
го комплекса над средним уровнем энергии исходных веществ, т.е.
чтобы прореагировать в данной реакции, молекула должна обладать
внутренней энергией, превышающей некоторую пороговую величи-
ну, т.е. энергетический барьер.
Энергия активации есть некоторое избыточное количество
внутренней энергии, и она может представлять собой: повышенную
кинетическую энергию поступательного движения молекул; повы-
шенную кинетическую энергию вращательного движения молекул;

173
повышенную энергию колебательного движения атомов или от-
дельных групп; повышенную энергию электронов в молекуле, атоме
или радикалах.
Способы активации молекул разделяются на термические и не-
термические. При термическом возбуждении молекул активация
происходит за счет обмена энергией в результате столкновения. При
нетермическом возбуждении молекул активация происходит под
воздействием излучения (фотохимическое), под воздействием час-
тот радиоактивного распада и др.
Величина энергии активации зависит от энергетического со-
стояния молекул, вступающих в химическую реакцию.
Необходимо отметить, что представленная Аррениусом зави-
симость константы скорости реакции от температуры для сложных
реакций выполняется только в том случае, если константу скорости
реакции можно выразить через константы скоростей отдельных ста-
дий в виде произведения или соотношения.
В целом, чем выше значение энергии активации, тем сильнее
зависимость константы скорости реакции от температуры. Для
большинства реакций значение E > 0, т.е. с увеличением температу-
ры увеличивается константа скорости и, соответственно, скорость
реакции в целом. Однако, могут быть реакции для которых Е ≈ 0 или
E < 0, в этом случае правило Вант – Гоффа не применимо и требует-
ся другое обоснование и решение уравнения Аррениуса.
Решение уравнения Аррениуса.
Уравнение Аррениуса можно решить неопределенным ин-
тегрированием; с указанием границ интегрирования и графиче-
ским способом.
Разделим переменные в уравнении зависимости константы
скорости реакции от температуры (3.45) и возьмем неопределенный
интеграл:
.lnlnln
,lnln
22
RT
E
Akилиconst
RT
E
k
dT
RT
E
kddT
RT
E
kd
(3.46)
Для определения константы интегрирования предположим, что если
температура стремится к бесконечно большой величине, т.е.
174
.lnln0
1
, constAk
T
тогдаT
Т
Это означает, что по физическому смыслу величина А соответствует
константе скорости при бесконечно большой температуре и равна
предэкспоненциальному множителю в уравнении
.
,lnln,
RT
E
RT
E
T
eAke
A
k
RT
E
AkAk
(3.47)
Полученное выражение является уравнением Аррениуса в ин-
тегральной форме. Величина А очень слабо зависит от температуры.
Графическое решение уравнения Аррениуса предполагает по-
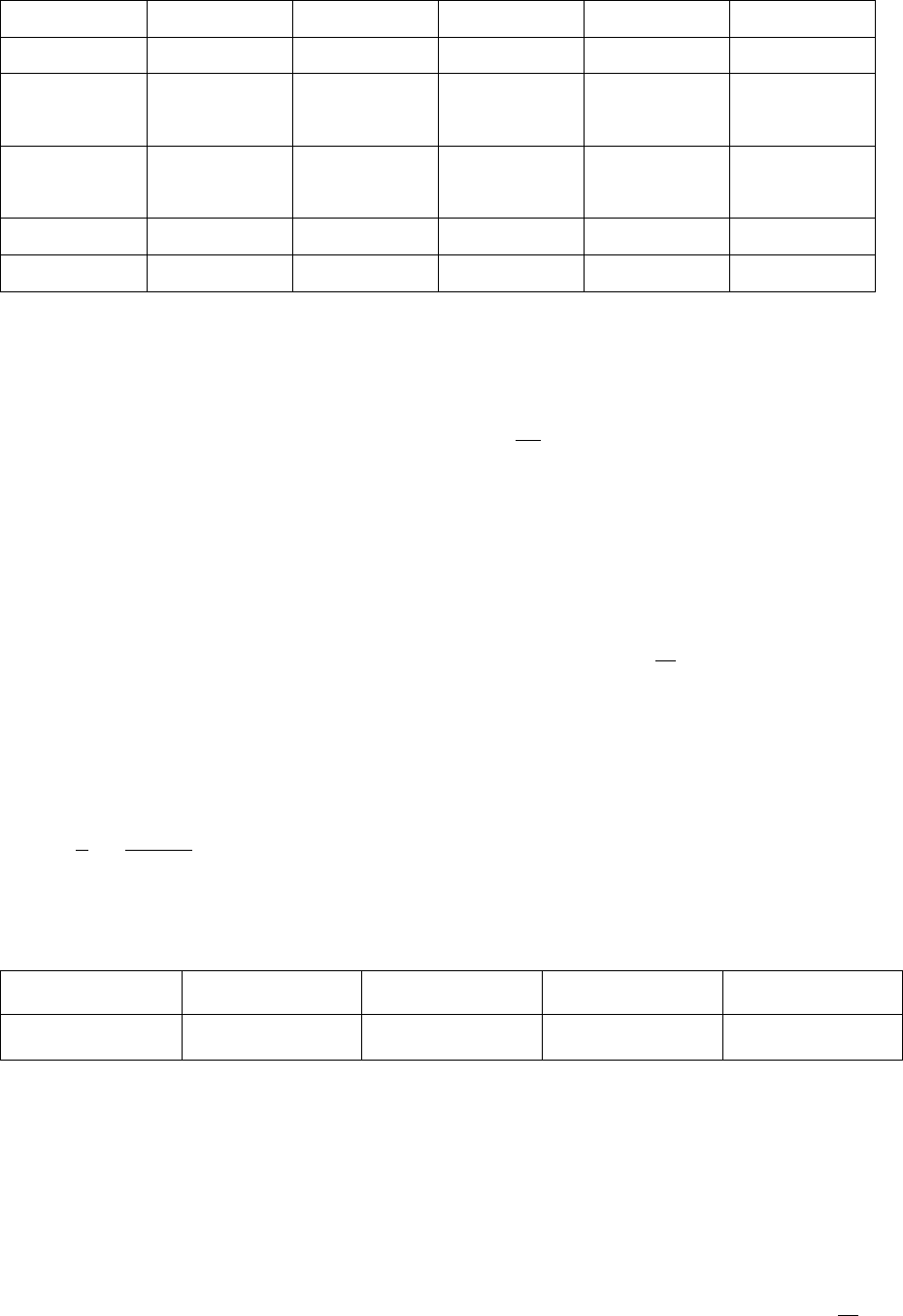
строение зависимости ln k от 1/Т, рис.3.3. Из данного рисунка следу-
ет, что
.,
11
lnln
12
12
tgRE
R
E
TT
kk
tg
(3.48)
Если экстраполировать зависимость ln k = f(1/T) до оси ординат (ln
k), то отсекаемый на оси ординат отрезок равен ln A. Это позволяет
выразить предэкспоненту в виде уравнения
.
1
lnln
T
R
E
kA (3.49)
k
ln
A
ln
R
E
tgtg
0
2
1 T
1
1 T T1
Рис.3.3. Определение параметров Аррениуса в координатах lnk, 1/T

175
Вычисленная по уравнению (3.49) энергия активации называ-
ется эффективной энергией активации.
Если располагаем значениями константы скорости реакции при
различных температурах, то после интегрирования в пределах от Т
1
до Т
2
получим:
.
11
lnln
211
2
2
2
1
2
1
TTR
E
k
k
dT
RT
E
kd
T
T
k
k
(3.50)
Данное выражение (3.50) позволяет определить константу скорости
при соответствующей температуре, а также рассчитать энергию ак-
тивации:
.
lnln
ln
1
2
2112
1
2
21
1
2
TT
TTRkk
TT
TTR
k
k
E
(3.51)
Если предположить, что Т
1
= Т, а Т
2
= Т + ∆ Т, то после под-
становки этих величин в уравнение (3.50), получим
.exp
11
ln
1
2
TTT
T
R
E
k
k
TTTR
E
k
k
T
TT
(3.52)
Полученное выражение (3.52) можно упростить, если допустить,
что
10,
2
ТTTTT , тогда соотношение констант скоро-
стей равно:
.
10
exp
2
10
RT
E
k
k
T
T
(3.53)
В практических расчетах часто используют упрощенную фор-
му записи последнего уравнения (3.53):
.,
10
exp
2
10
2
10
RT
E
T
T
eтогда
RT
E
k
k
(3.54)
Следует еще раз отметить, что линейную зависимость ln k от
T
1
, представленную на рис.3.3, а также уравнения (3.50), (3.51) по-
зволяющие определить энергию активации, можно использовать
только для простых (элементарных) реакций. Для более сложных
реакций определить энергию активации по уравнению Аррениуса
нельзя.
Пример 64. Определение константы скорости реакции.
Реакция типа А → 2В + С протекает в газовой фазе, при по-
стоянном объеме и температуре 420К. Для этой реакции дана за-

176
висимость общего давления смеси от времени t. Определить среднее
значение константы скорости реакции; время, когда прореагирует
50% исходного вещества А; общее давление реакционной смеси
через 40 минут, если:
t, мин 0 5 10 20 30
Р 10
-9
, Па 250 272 293 332 368 .
Исследуемая реакция протекает в газовой фазе, поэтому, кон-
троль над данной реакцией удобно вести по изменению парциально-
го давления исходного вещества А.
Давление вещества А в ходе реакции должно уменьшаться, а
давление продуктов реакции – возрастать. Введем величину Х, как
убыль давления вещества А в ходе реакции. Покажем изменение
давления реагирующих веществ в любой момент времени исследуе-
мой реакции.
Давление А → 2В + С
в начале реакции: Р
общ
= Р
0,А
0 0
в момент времени t: Р
А,t
= (Р
0,А
– х) 2х х
Общее давление в системе (Р
общ
), согласно представленной
схеме, будет равно Р
общ
= ∑Р
i
= (Р
0,А
– х) + 2х + х = Р
0,А
+ 2х.
Из этого соотношения можно получить убыль давления веще-
ства А в любой момент реакции:
2
,0 Аобщ
t
РP
x
.
Давление вещества А в различные интервалы времени (Р
А,t
)
определим из уравнения
tAtA
xPP
,0,
.
Чтобы ответить на вопросы, поставленные в задаче, необходи-
мо определить концентрацию вещества А в различные моменты
времени реакции (С
А,t
). Для этого из уравнения Менделеева-
Клапейрона PV = nRT выразим значение Р и, соответственно, С
А,t
:
,;
,
,
RT
P
CRTC
V
nRT
P
tA
tAi
где С
А,t
– концентрация (моль/дм
3
) вещества А в различные момен-
ты времени реакции.
После расчета были получены следующие значения давления и
концентрации вещества А в различные моменты реакции:
177
t, мин 0 5 10 20 30
x
t
10
-9
, Па 0 12 21.5 41 59
Р
А,t
10
-9
,
Па
250 239 228 209 191
С
А,t
10
-6
,
моль/дм
3
71,6 68 65 60 55
ln C
A,t
18,06 18,03 17,98 17,89 17,80
1/ C
A,t
10
9
14,3 14,7 15,4 16,7 18,2
Полученные значения различной функциональной зависимости
концентрации от времени позволяют определить порядок реакции.
Построим графики в координатах C,
С
1
и ln C от времени t (рис3.2).
Для данной реакции линейная зависимость будет наблюдаться
в координатах ln C от времени t. Это позволит предположить, что
данная реакция является реакцией первого порядка (п = 1).
Из графической зависимости ln C от времени t определим
константу скорости реакции по формуле
tg
x
y
k . Найденное
значение константы скорости равно k
гр
= 9,8 10
-3
мин
-1
.
Окончательный ответ о порядке реакции можно получить по-
сле расчета константы скорости реакции по формуле
tA
A
t
C
C
t
k
,
,0
ln
1
. Рассчитанные по этому уравнению в различные мо-
менты реакции константы скорости имеют значения:
t, мин 5 10 20 30
k
t
10
3
, мин
-1
12 10 10 9,1
Среднее значение константы скорости k
ср
= 1,027 10
-3
мин
-1
.
Близкие значения константы скорости, определенной из графика и
рассчитанной по формуле подтверждают первый порядок реакции.
Порядок реакции можно определить также дифференциаль-
ным методом. Для этого на графике зависимости концентрации от
времени проведем касательные. Из соотношения
x
y
tgW
ii
оп-
178
ределим скорость в различные моменты реакции. Построим график
A
CfW lnln
.
Определим порядок реакции по уравнению
1;lnlnln
x
y
tgnCnkW
A
.
Примем для рассматриваемой реакции первого порядка значе-
ние константы скорости равным 1,027 10
-3
мин
-1
. Определим время
t
1/2
, при котором прореагирует 50% вещества А. По формуле
.76
10027,1
693,02ln
3
2/1
мин
k
t
Чтобы определить общее давление реакции (Р
общ
) через 40 ми-
нут, необходимо предварительно определить давление исходного
вещества А через 40 минут из уравнения
.ln
1
ln
1
,
,0
,0
,0
tA
A
t
A
P
P
tC
C
t
k
Следовательно, через 40 мин давления вещества А равно:
.10174
72,204010027,110250lnlnln
9
40,
39
,040,
ПаP
tkPP
A
AA
.
Тогда, через 40 мин. убыль давления вещества А составит
х
40
= Р
0,А
- Р
40,А
= 250¶10
9
– 174¶10
9
= 76¶10
9
Па.
Так как нам известно уравнения связи между общим давлением
реагирующих веществ и давлением исходного вещества А, то через
40 минут общее давление в системе равно:
Р
общ,40
= Р
0,А
+ 2х
40
= 250¶10
9
+ 2 76¶10
9
= 409¶10
9
Па.
Пример 65. Влияние температуры на скорость реакции
Реакция типа А → 2В + С в газовой фазе при температуре 420
К имеет константу скорости 1,027 10
-3
мин
-1
. При температуре 455
К константа скорости равна 1,2 10
-1
мин
-1
. Определить известными
способами значение энергии активации, предэкспоненциальный
множитель в уравнении Аррениуса для данной реакции, а также
температурный коэффициент скорости реакции γ в интервале тем-
ператур 420 – 455 К.
Значение энергии активации можно определить из уравнения
Аррениуса (3.47):

179
Дж
TT
kkTTR
E
216024
420
455
10027,1ln102,1ln45542031,8
lnln
31
12
1221
Предэкспоненциальный множитель А в уравнении Аррениуса
определяем после логарифмирования выражения
RT
E
eAk
и со-
ответствующего преобразования его:
.1077,7
01,5589,6188,6
42031,8
216024
10027,1lnlnln
,lnln
23
3
A
RT
E
kA
RT
E
Ak
Температурный коэффициент скорости γ определим из соот-
ношения скоростей (констант скоростей):
9,35,116
5,3
10
420455
,84,116
10027,1
102,1
,
5,3
3
1
10
1
2
1
2
1
2
1
2
m
k
k
k
k
k
k
ck
ck
W
W
m
m
T
mT
T
T
n
A
n
A
Температурный коэффициент скорости показывает, что с
увеличением температуры реакции на 10 градусов, скорость реак-
ции увеличивается в 3,9 раза.
С повышением температуры на 35
0
скорость увеличивается в
5,3
420
455
9,3
k
k
раз.
Графическое решение уравнения Аррениуса (см. вывод 3.48), в
координатах ln k - f(1/T) также позволяет определить значение
энергии активации и величину предэкспоненциального множителя
в уравнении Аррениуса.
Пример 66. Установлено, что 0,01 М раствор уксусноэтилового
эфира омыляется 0,002 М раствором
NaOH
на 10 % за 23 мин. За

180
сколько минут пройдет омыление на 10 %, если концентрация
NaOH
будет равной 0,005 М?
Решение. Из опытных данных реакция омыления эфира щело-
чью
OHHCCOONaCHNaOHHCOOCCH
523523
имеет второй порядок. Концентрации реагентов (эфира и щелочи) не
равны между собой. В этом случае уравнение для определения кон-
станты скорости реакции второго порядка имеет вид:
,ln
11
,0
,0
,0,0 BA
AB
BA
cc
cc
cct
k
где С
0,i
.- начальные концентрации реагентов; С
і
– концентрации
реагентов в любой момент времени t.
Определим концентрации реагентов, через 23 минуты от нача-
ла реакции. Из соотношения пропорций получим, что
.0018,00002,0002,0;0099,0001,001,0
;0002,0;001,0
%,10%,10
%
100
002
,
0
%
100
01
,
0
В
А
ВА
ВА
сс
хх
хх
Найденные концентрации реагентов подставим в уравнение
константы скорости и определим значение последней:
.51.0
0018.001.0
0099.0002.0
ln
002.001.0
1
23
1
минл
моль
k
Если концентрация
NaOH
будет равной 0,005 М, то концен-
трации реагентов при омылении эфира на 10 % будут иметь значе-
ния из аналогичной выше пропорции:
.0045,0;0099,0
В
А
сс
Определим время, за которое произойдет омыление эфира на
10 %, если концентрация щелочи будет 0,005 М.
.7,36
0045.001.0
0099.0005.0
ln
005.001.0
1
51.0
1
ln
11
,0
,0
,0,0
мин
cc
cc
cck
t
BA
AB
BA
x
