Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.


В этом отношении интересна также реакция Na + C1CN [682, 745,
923, 924]. Здесь возможны следующие первичные процессы: Na + C1CN =
= NaCl + CN и Na + C1CN - NaCN + CI. Изучение этой реакции по-
казывает, что первый процесс идет с энергией активации, равной 2 ккал;
скорость второго, также инерционного процесса, не зависит от температу-
ры. В соответствии с различными причинами инертности обоих процессов
при повышении температуры вероятность осуществления первого процес-
са возрастает по сравнению с вероятностью второго, что обнаруживается
по изменению состава продуктов реакции.
RX-
Рис. 17. Схема эксперимента
с диффузионными пламенами
Газ-перено очик\^
парами натрия^
Ш////////Щ
RX-
Ш
)Шднйй rttfrrtpad
На-резонансная
лампа
Данные, относящиеся к реакциям типа Na + ИХ, будут рассмотрены
в главе VII, § 25, поэтому здесь ограничимся упоминанием лишь некоторых
важнейших закономерностей этих реакций. Энергия активации процесса
уменьшается по мере удлинения органической цепочки. Интересно так-
же влияние двойной углерод-углеродной связи на реакционную способ-
ность соединений RX. Оказывается, что атом хлора, присоединенный к
винильному атому углерода, реагирует с натрием труднее, чем атом хло-
ра, присоединенный к атому углерода, связанному простой связью.
Инерционность реакции уменьшается, если атом хлора связан с аллиль-
ным атомом углерода, а также при введении кислородсодержащих заме-
стителей к атому углерода, с которым связан атом хлора. Наконец, ука-
жем, что скорость реакции атома натрия с различными галогеновыми про-
изводными возрастает в направлении от фтора к иоду.
Модификацией метода диффузионных пламен, названной его автора-
Mi. [673, 755, 804, 1650) методом продолжительности жизни, является
метод, в котором константа скорости реакции (например, реакции Na +
+ RX = NaX + R) выражается формулой: k = NJNc, где N
0
— число
атомов натрия, ежесекундно поступающих в реакционный сосуд; N —
число атомов натрия в последнем и с — концентрация RX. Величина
N/N
0
— среднее время жизни атома в зоне реакции (отсюда название ме-
тода).
Дальнейшее использование и развитие метода диффузионных пламен,
а также теории этого метода см., например, в работах [147, 270, 671, 683,
685, 815, 816, 1045].
Здесь следует еще упомянуть разработанный Тальрозе с сотр. [98; 99,
333] метод диффузионного облака в потоке. В этом методе использован
жасс-спектрометрический анализ распределения концентраций реагирую-
щих частиц в зоне реакции. При помощи этого метода были измерены
константы скорости реакции присоединения атомов Нк молекулам оле-
финов, реакции
Н + Оа + Не=Н0
2
+ Не, Н + СН
3
+ Ие=СН
4
+ Не,
Н + Н0
2
—20Н, НаО + 0=На + Оа, Н + F
2
:= HF + F и др.

Реакции атомов водорода
Один из наиболее употребительных методов получения атомов Н —
это метод электроразряда. Как было показано Вудом [1690], в тлеющем
разряде в водороде при давлении
0,1 — 1
мм. рт. ст. получается высокий
процент атомарного водорода. Метод Вуда в настоящее время широко
применяется для получения атомных газов. Для изучения химических
свойств атомов водорода этот метод впервые был применен Бонгеффером
[525]. Электроразрядный метод получения атомарного водорода обычно
применяется таким образом: струя водорода, пропускаемая через разряд-
ную трубку, где происходит образование атомов Н, направляется затем
в реакционный сосуд и смешивается в нем с тем или иным реагентом.
Рекомбинация атомов Н на стенках либо в результате тройных соударений
идет достаточно медленно и поэтому концентрация атомарного водорода на
входе в реакционный сосуд достаточно велика.
Покрытие или промывание стенок реактора и трубок, соединяющих
его с разрядной трубкой, соответствующими веществами (например, HF)
значительно уменьшает адсорбцию атомов Н на стенках, т. е. снижает
скорость гибели атомарного водорода. С целью максимального сокращения
объемной рекомбинации атомов Н, приводящей к образованию активных,
колебательно-возбужденных молекул Н
2
, которые могут исказить кине-
тику исследуемых химических процессов, разряд проводят в водороде,
сильно разбавленном благородным газом.
Другой, также широко распространенный метод получения атомарно-
го водорода основан на фотохимической сенсибилизации. Насыщая пара-
ми ртути водород или смесь водорода с тем или иным газом и освещая эту
смесь кварцевой ртутной лампой, получают возбужденные атомы ртути
H'g'(
3
Pi}, возникающие в результате поглощения ртутным паром резонанс-
ной линии 2537 А. Возбужденные атомы Hg, взаимодействуя с молекула-
ми Н
2
, расщепляют их на атомы.
При низких давлениях выход атомарного водорода значительно повы-
шается в присутствии азота или паров воды. Это связано с появлением дол-
гоживущих метастабильных атомов ртути, вследствие чего вероятность
взаимодействия с водородом увеличивается. Метастабильные атомы воз-
никают в результате процесса:
Hg' (
3
Pi) + M=Hg' (
3
Р
0
) + М
(М = N
2
или Н
2
0). Гавиола [818] показал, что этот процесс в присут-
ствии азота идет при каждом столкновении. По измерениям этого автора,
продолжительность жизни метастабильных атомов Hg'(
3
P
0
) составляет
3 *10~
3
сек (продолжительность жизни атомов Hg'(
3
jPi) равна 1,55 X
X 10~
7
сек [561]).
В качестве источника атомарного водорода используются также веще-
ства, отщепляющие при облучении атомы Н. Так, при облучении УФ-
светом (X < 3100 А) иодистый водород разлагается по схеме: HJ +
+ hv = Н + J. Атомы иода, значительно менее активные, чем атомы
водорода, мало искажают механизм реакции.
Главный недостаток метода получения активных частиц — атомов и
радикалов, подобного указанному методу получения атомов Н путем об-
лучения HJ, состоит в том, что обычно при этом получают частицы с энер-
гией, значительно превышающей среднюю тепловую энергию. Так, при
облучении HJ светом длины волны 2537 А (сплошной спектр поглощения
HJ простирается от X = 3600 А в область вакуумного ультрафиолета и
имеет максимум вблизи X ~ 2080 А) избыточная энергия составляет
42 ккал. Эта энергия распределяется между образующимися атомами Н

и J так, что на долю атома Н приходится 127/128, т. е. практически вся
избыточная энергия, если атом J возникает в основном электронном со-
стоянии
2
Рз
/з
, либо 20 ккал, если атом J находится в состоянии
2
Ру
2
[709].
Таким образом, в данном случае атомы Н имеют энергию 20—42 ккал,
которая при комнатной температуре в десятки раз превышает их среднюю
тепловую энергию. Атомы с избыточной энергией, превышающей их теп-
ловую энергию, получили название горячих атомов (см. § 26).
Ряд авторов получали атомы водорода путем разложения молекул
Н
2
на раскаленной вольфрамовой проволоке. См., например, работу
[1461].
Простейшей реакцией атомарного водорода является реакция с моле-
кулярным водородом, изучение которой возможно при замене обычного
водорода, представляющего собой смесь его пара- и о/>то-модификаций,
7га/?а-водородом или при использовании дейтерия. Как уже указывалось
выше, при столкновении атомов Н с молекулами пара-водорода происхо-
дит превращение последнего в орто-водород согласно схеме:
Н + пара-Н
2
= орто-Н
2
+ Н
(при накоплении орто-водорода с этим процессом начинает конкуриро-
вать обратный ему процесс — превращение о/эттго-водорода в пара-моди-
фикацию). Измерение концентраций пара- и орттго-водорода по мере хода
превращения пара орто позволяют определить эффективность соуда-
рений атомов Н с молекулами Н
2
и, следовательно, измерить константу
скорости этой реакции. В настоящее время известны достаточно надежные
данные для констант скорости следующих реакций:
Н + Н
2
=Н
2
+Н, H + HD=H
a
+ D, H + DH=HD + H, H+D
2
=HD + D,
D + H
2
= HD + H, D + HD=DH + D, D+HD=D2+H И D + D
2
=D
2
+ D [178].
Переходя далее к реакции атомов водорода с кислородом, укажем,
что, согласно имеющимся экспериментальным данным, взаимодействие
Не 0
2
осуществляется как по реакции второго порядка:
Н + О
а
=-ОН + О — 16,7 ккал,
идущей с энергией активации Е = 16,7 ккал, так и по реакции третьего
порядка:!
Н + 0
2
+ М=НОг + М + 47 ккал
(М — любая частица); скорость последнего процесса зависит от природы
третьей частицы (М). Взаимодействие радикала Н0
2
с молекулой Ы
2
приводит к образованию Н
2
0
2
и Н или Н
2
0 и ОН. Как увидим ниже,'обе*
реакции атома Н с молекулой 0
2
играют основную роль в механизме го-
рения водорода.
Атомы водорода легко реагируют со всеми углеводородами. Еще в
1928 г. Бонхеффер и Хартек [526] путем анализа продуктов взаимодействия
атомов Н с различными углеводородами установили, что в этом случае
возможны как процессы гидрирования и дегидрирования, так и расщеп-
ление молекул по углеродным связям. В настоящее время изучено боль-
шое число реакций атомов Н с различными углеводородами и их производ-
ными. Для большой части этих реакций установлены значения соответ-
ствующих констант скорости и энергий активации [178]. В большинстве*
опытов атомы Н получали в электрическом разряде или фотохимическим
путем.
Тихомирова и Воеводский [54] разработали и применили метод изуче-
ния реакций атомов водорода, основанный на измерении смещения обла-
сти воспламенения смеси водорода с кислородом под влиянием небольших

добавок исследуемого вещества. Этот метод в настоящее время широко
применяется Азатяном с сотрудниками (см., например, [6, 7, 9]). См. также
[432].
Вся совокупность наших сведений о реакциях атомов Н с молекулами
углеводородов и их производных приводит к заключению о том, что глав-
ной реакцией является отщепление атома водорода от молекулы исход-
ного углеводорода (дегидрирование), приводящее к образованию моле-
кулы Н
2
и радикала R:
Н+ RH=H
2
+ R
и осуществляющееся с энергией активации, редко превышающей 10 ккал.
В случае непредельных углеводородов (в частности, олефинов), наря-
ду с указанной реакцией, происходит также присоединение атома Н по
кратной связи к молекуле углеводорода (гидрирование), в результате чего
образуется радикал (в случае олефина — алкильный), например:
Н + C
n
H
2n
= C
n
H
2n+1
(R).
Этот процесс в большинстве случаев идет с энергией активации 2—
3 ккал. Атомы способны также легко присоединяться к молекулам арома-
тических соединений. Так, энергия активации реакции Н + С
6
Н
в
= С
6
Н
7
равна —3 ккал [178]. Заметим, что присоединение атома Н к молекуле
С
2
Н
4
служит источником радикалов С
2
Н
5
, что имеет важное значение для
изучения химических свойств этих радикалов.
Что касается реакций разрыва углерод-углеродной связи при взаимо-
действии молекулы углеводорода с атомом Н, то реакции этого типа изу-
чены еще недостаточно. На основании имеющегося экспериментального
материала можно заключить, что скорость этих реакций сравнительно не-
велика (см. Стеси [1533, глава V)]. В отличие от этих реакций аналогичные
реакции атомов Н с радикалами, т. е. реакции типа
Н + С
2
Н
5
=2СНЗ ИЛИ н + СзН
7
=СНз + С
2
Н
5
идут с большой легкостью. Так, константа скорости первой из этих реак-
ций при 290 + 3°К, согласно данным [905], равна 5 -10
13
сж
3
-моль ^-секГ
1
.
Из других реакций атомарного водорода коснемся реакций с галоге-
нами и галогеноводородами. Реакции с галогенами протекают очень бы-
стро. Первичным процессом в этих реакциях является процесс:
Н + Х
2
=НХ + X.
На основании данных различных авторов энергия активации этого процес-
са составляет 2,40 (F
2
), 2,01 (С1
2
), 1,34 (Вг
2
) и 0,55 (J
2
) ккал.
С бромом и иодом реакция не идет до конца, что обусловлено сравни-
тельной легкостью вторичных процессов: Н + НВг = Н
2
+ Вг + 16,7 ккал
и Н + HJ = Н
2
+ J + 32,8 ккал (по сравнению с процессом Н +
+ НС1 = И
2
+ С1 + 1,0 ккал), приводящих к накоплению атомов Вг
и соответственно J, в результате рекомбинации которых образуется ис-
ходный галоген. При равных условиях и температуре 500° К отношению
скоростей этих реакций равно 1 (НС1): 8 (НВг) : 34 (HJ).
Большая эффективность реакций Н + НВг и Н + HJ по сравнению с
реакцией Н + НС1 и является причиной того, что продукты первых двух
реакций содержат небольшое количество галогена.
По малой инерционности (выражающейся в малых значениях энергии
активации и соответственно в большой эффективности соударений) ре-
акции атомов Н с галогенами и галогеноводородами приближаются к ре-
акциям щелочных металлов.

Реакции атомов кислорода
Переходя к вопросу о химических свойствах атомарного кислорода,
укажем, что для получения атомов О обычно применяются те же методы,
что и в случае атомов Н, т. е. метод электрического разряда и фотохимиче-
ский метод.
Из ранних работ по исследованию реакций атомов кислорода отметим
работы Хартека и Копша [921], Гейба и Хартека[833], Неуймина и Попо-
ва [1286], Шенка и Яблоновского [1446], Шехтер и Кушнерева [201] и
других, относящиеся к 1930—1941 гг. В этих работах были изучены реак-
ции атомов О с некоторыми простейшими углеводородами, предельными
и непредельными, включая бензол, с метиловым и этиловым спиртами,
с формальдегидом и муравьиной кислотой, а также с водородом.
В настоящее время измерены константы скорости около 200 реакций
атомов кислорода с различными молекулами и радикалами [178]. Рассмот-
рим некоторые из этих реакций.
Простейшая из них — реакция
О + Н
2
=ОН -f II — 1,9 ккал.
Константа скорости этой реакции на основании большого количества
данных различных авторов может быть выражена формулой:
/с
= ю
13
'
39
ехр
(—9840/RT) см
9
-моль
1
-сек
1
.
т. е. при комнатной температуре к = 1,3-10
6
см
3
-моль"
1
-сек"
1
. В работе
[1711] при этой температуре была измерена константа скорости реакции
электронно-возбужденного атома кислорода с водородом О' (
1
Z>) + Н
2
=
= ОН + Н, оказавшаяся равной к = 1Д5-10
14
см
3
-моль"
1
-сек"
1
. Мы
видим, что О' (
X
D) реагирует с Н
2
в 10
8
раз быстрее атома О в основном со-
стоянии (
3
Р). Большая химическая активность О' по сравнению с О ра-
нее обнаружена Неуйминым и Поповым [1286]. Согласно этим авторам,
энергия активации реакции О + Н
2
= ОН + Н меньше 1,4 ккал.
По Хартеку и Копшу [921], первичным процессом в реакции атомов О
с галогеноводородами, в результате которой образуются Н
2
0 и Х
2
, являет-
ся процесс О + НХ = ОН + X. Тепловой эффект этого процесса равен:
—0,8 ккал (IIC1), +14,7 ккал (НВг) и +31,0 ккал (HJ). В соответствии с
различием тепловых эффектов этих процессов различаются и их скорости:
вычисления показывают, что в то время как в случае реакции О + НС1
к реакции ведет приблизительно лишь одно из 10
5
столкновений О и НС1
{при комнатной температуре), в случае НВг и HJ эффективно минимум од-
но из 1000 столкновений атома О и НХ. С большой скоростью реакции свя-
зан сильный разогрев реакционной зоны, наблюдающийся для двух по-
следних галогеноводородов. Отметим, что ни в одной из реакций О + НХ
не наблюдается испускания полос ОН, что объясняется недостаточностью
энергии, выделяющейся в отдельных элементарных процессах (энергия
возбуждения нулевой полосы ОН равна 92,5 ккал).
Реакция атомов кислорода с алифатическими углеводородами, альде-
гидами, спиртами и алкилгалогенидами, согласно данным ряда авторов
(см., например, [424, 921, 1044]), преимущественно следует схеме:
О 4- RH=OH + R,
т. е. приводит к отщеплению атома Н с образованием гидроксила и ради-
кала R.
Авраменко с сотр. [3, 425] на основании обнаруженных в продуктах
реакции веществ, содержащих меньшее количество атомов С, чем исход-
ная молекула, заключают, что при температуре вблизи 100° С наряду с

отщеплением атома водорода идет реакция с разрывом связи С—С. На ос-
новании анализа своих экспериментальных данных Авраменко и Колес-
никова приходят далее к заключению о возможности реакций атомов кис-
лорода с RH с одновременным отщеплением двух атомов Н и образова-
нием молекулы Н
2
0 и второй также валентно-насыщенной молекулы,
1(>
например,
О + С
2
Н
6
=Н
2
0 + С
2
Н
4
, О + СНзСН
2
СНз=Н
2
0 + С
3
Нб. или О + Н
2
С0=Н
2
0 + СО.
Заключение о возможности образования двух валентно-насыщенных мо-
лекул при взаимодействии различных соединений с атомом О встречает-
ся и в работах других авторов. Так, Шехтер и Куши ер ев [201] заключают,
что Н
2
СО является первичным продуктом взаимодействия атома О с моле-
кулой метана:
О + СН
4
=Н
2
СО + Н
2
.
Такой же механизм образования Н
2
СО при взаимодействии атома кисло-
рода с метаном предлагают Авраменко и Колесникова. См. также [786].
Еще раньше Хартек и Копш [921], обнаружившие, что при взаимодей-
ствии атомарного кислорода с четыреххлористым углеродом получаются
равные количества фосгена, СОС1
2
, и хлора, пришли к заключению, что
эта реакция идет в один элементарный акт: О + СС1
4
= СОС1
2
+ С1
2
.
Аналогичные схемы возможны и для реакций:
О + CHaCla=COCl2 + Н
а
И О + СНСЬ=СОС1
2
+ НС1,
также изучавшихся Хартеком и Копшем. Укажем также, что в качестве
возможного механизма взаимодействия атома О с молекулой муравьиной
кислоты Гейб [831, 832] принимает процесс: О + НСООН = С0
2
+ Н
2
0.
Наконец, Авраменко и Колесникова находят, что атом кислорода спо-
собен внедриться в молекулу RH по связи С—Н, в результате чего в один
первичный элементарный акт вз.аимодействия атома О и молекулы С
2
Н
6
,
С
6
Н
6
или СН
3
СНО образуется соответственно этиловый спирт (С
2
Н
5
ОН),
фенол (С
6
Н
5
ОН) или уксусная кислота (СН
3
СООН).
Бенсон [472] также не исключает возможности внедрения по связи
С—Н атома О. Согласно Ямазаки и Светановичу [1699], легко внедряется
по связи С—Н возбужденный атом кислорода, находящийся в синглет-
ном состоянии [в отличие от 0(
3
Р), внедрение которого связано с наруше-
нием правила сохранения спина]. Заметим, что такое же различие в от-
ношении реакции внедрения по связи С—Н, по-видимому, имеет место
также для синглетного и триплетного метилена СН
2
[463].
Реакцию внедрения радикала СИ
2
по связи С—Н нужно считать надеж-
но установленной.
Реакции атомов галогенов
Методы получения атомов F, CI, Вг и J в основном те же, что и в слу-
чае атомов Н и О, т. е. тлеющий электрический разряд и фото диссоциация.
Особенно удобен последний метод, так как молекулы Х
2
обладают сплош-
ными спектрами, лежащими в легко доступной, видимой и близкой УФ-
области спектра. Укажем еще упоминавшийся уже метод, разработанный
10
Отщепление двух атомов водорода наблюдали также Вагнер с сотр. [829] в реакции
атомов кислорода с гидразином, первая стадия которой, согласно их данным, пред-
ставляет процесс:
О -f- N2H4-H2O + N
2
H
2
.
Константа скорости этого процесса к = 8,5-10
13
ехр (— 1200/ R Т)см
3
. моль'
1
* сек~
г
).
Богданди и М. Полани [520], в котором атомы галогена получались по
реакции: Na + Х
2
= NaX + X.
Различные авторы изучали реакции атомов фтора, хлора, брома и
иода с большим числом веществ. Сюда относятся водород, различные уг-
леводороды, алкилгалогениды, альдегиды, кетоны, кислоты (см. [178]).
Исследования этих реакций приводят к следующим заключениям.
С предельными соединениями основные процессы идут по схеме:;
X + RH—R + нх
или по схеме:
X + RX=Xa+ R.
В случае непредельных соединений возможна также реакция присо-
единения:
X + RH=RHX.
Наиболее надежные значения констант скорости в настоящее время
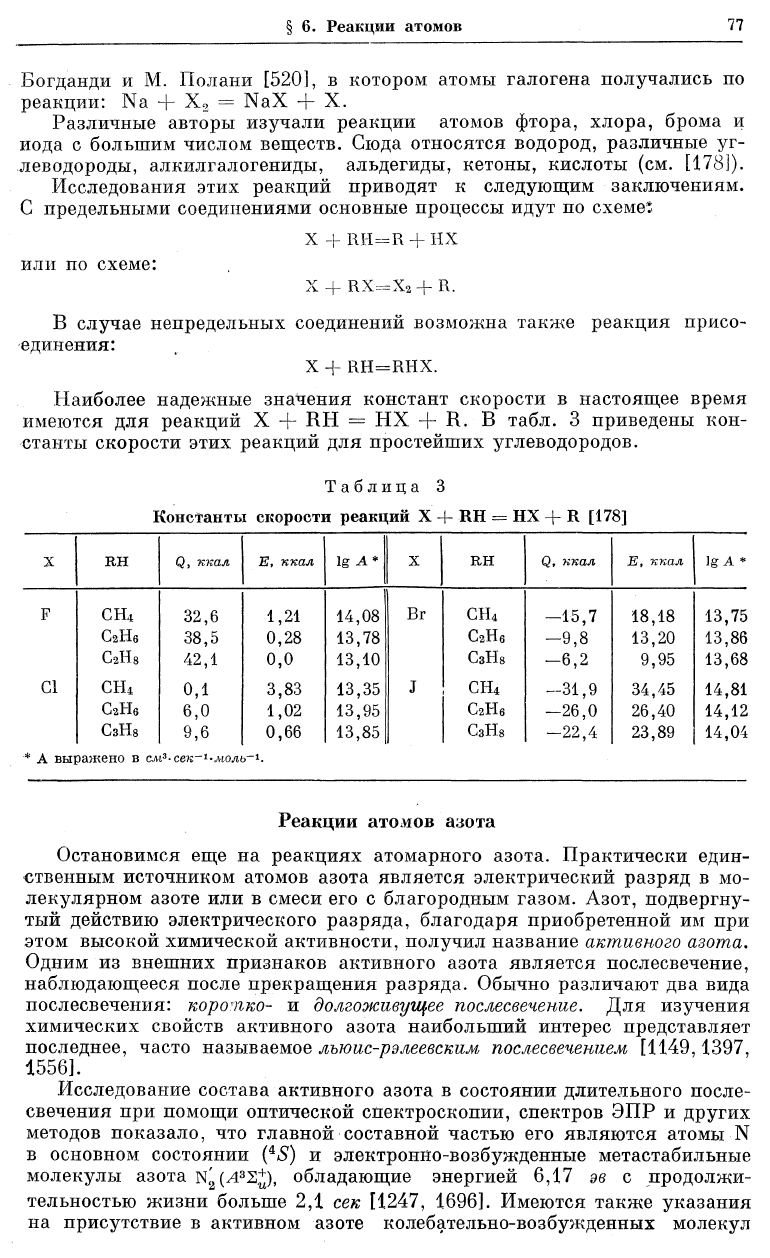
имеются для реакций X + RH = НХ + R. В табл. 3 приведены кон-
станты скорости этих реакций для простейших углеводородов.
Таблица 3
Константы скорости реакций X -1- RH = НХ + R [178]
X
ВН
Q, ккал
Е, ккал
1 g А*
X
RH Q, ккал
Е, ккал
lg А *
F
СН
4
32,6
1,21
14,08
Вг
сн
4
-15,7 18,18 13,75
С
2
Н
6
38,5
0,28
13,78
С
2
Нб
-9,8
13,20 13,86
с
2
н
8
42,1
0,0
13,10
СзН
8
-6,2
9,95
13,68
G1
СН
4
0,1
3,83
13,35
J сн
4
—31,9 34,45
14,81
С
2
Н
6
6,0
1,02
13,95
С
2
Н
6
-26,0
26,40 14,12
СзН
8
9,6
0,66
13,85
1
СзНз
-22,4
23,89 14,04
* А выражено в
см
3
-сек~»«лмш>
_1
.
Реакции атомов азота
Остановимся еще на реакциях атомарного азота. Практически един-
ственным источником атомов азота является электрический разряд в мо-
лекулярном азоте или в смеси его с благородным газом. Азот, подвергну-
тый действию электрического разряда, благодаря приобретенной им при
этом высокой химической активности, получил название активного азота.
Одним из внешних признаков активного азота является послесвечение,
наблюдающееся после прекращения разряда. Обычно различают два вида
послесвечения: коротко- и долгоживущее послесвечение. Для изучения
химических свойств активного азота наибольший интерес представляет
последнее, часто называемое лъюис-рэлеевским послесвечением [1149,1397,
1556].
Исследование состава активного азота в состоянии длительного после-
свечения при помощи оптической спектроскопии, спектров ЭПР и других
методов показало, что главной составной частью его являются атомы N
в основном состоянии (
4
5) И электронно-возбужденные метастабильные
молекулы азота N^H
3
^), обладающие энергией 6,17 эв с продолжи-
тельностью жизни больше 2,1 сек [1247, 1696]. Имеются также указания
на присутствие в активном азоте колебательно-возбужденных молекул

азота в основном состоянии, которые, согласно данным работы [1710]
г
образуются в процессе
N + N;H»2+)= N;(X4S+)+ N.
Константа скорости этого процесса была измерена в работе [1248]
(см. также [1247]); при комнатной температуре эта константа равна
3
•
10
ls
см
ъ
-сек"
1
-моль"
1
.
Косвенным доказательством наличия молекул NJ в активном азоте
является близкое совпадение температуры электронного возбуждения
натрия [1262] и колебательной температуры СО [1138], добавленных к
активному азоту, свидетельствующее о протекании следующих процес-
сов:
N* + Na=N
2
+ Na' и N* + CO=N
2
+ СО*.
Недавно поступающие из разряда колебательно-возбужденные молекулы
азота (г; = 1, 2, 3) были обнаружены при помощи рамановской спектро-
скопии [1281]. См. также [406, 458, 715, 747, 1046].
Имеются указания на то, что химическая активность азота обусловле-
на не заряженными, а нейтральными частицами [1265, 1635] и что реком-
бинация атомов азота является одним из источников свечения [478, 1402]
и ионизации азота (см. также [1070, 1314]). Можно поэтому полагать, что
атомарный азот представляет главную составную часть активного азота
(см. также [429]).
В работе Андерсона, Кавадаша и Мак-Кея 1408], посвященной изуче-
нию кинетики затухания свечения азота, показано, что максимальная ин-
тенсивность свечения (сразу после прекращения разряда) действительно
определяется рекомбинацией атомов азота, находящихся в основном со-
стоянии. Освобождающаяся при рекомбинации энергия (9,6 эв) близка к
энергии возбуждения одиннадцатого колебательного уровня возбужден-
ного состояния N
2
(#
3
n), дающего максимальный вклад в интенсивность
свечения.
В связи с указанным выше сложным составом активного азота инте-
ресно, что Джонс и Винклер [1025]), изучая реакцию активного азота с
этаном, С
2
Н
6
, получили две константы скорости, к = 10
9
>
72
ехр (—1700/RT)
в температурном интервале 0—130° С и к = 10
12
>
36
ехр(—7000/R Т) см
3
X
X моль'
1
-сек"
1
в интервале 130—430°С (рис. 18). Арторы допускают, что
г,ч з,2
//r/o
J
Рис. 18. Температурная зави-
симость константы скорости
реакции активного азота с эта-
ном [1025]
в высокотемпературной области в реакции участвуют атомы N, в то время
как в низкотемпературной области реакция идет через возбужденные мо-
лекулы азота. В первом случае авторы не исключают возможность проте-
кания реакции по цепному механизму.
Высокая химическая активность активного азота проявляется в гро-
мадном числе реакций, участником которых является сам активный азот,
или реакций, стимулируемых последним. В присутствии кислорода в ак-
тивном азоте образуется окись азота; с сероуглеродом активный азот дает

сернистый азот, NS; при взаимодействии с серой, H
2
S или S
2
C1
2
образует-
ся S
4
N
4
; нитриды металлов образуются в реакциях активного азота с раз-
личными металлами и их солями и т. д.; NH
3
, НВг и HJ при взаимодейст-
вии с активным азотом быстро разлагаются. Смесь Н
2
+ С1
2
под действием
активного азота превращается в НС1. Активный азот слабо взаимодейст-
вует с Н
2
, Н
2
0, СО [1069, 16351, что обусловлено эндотермичностью реак-.
ций: N + Н
2
- NH + Н, N + Н
2
0 = NH + ОН, N + СО = N0 + С
или CN + О- Экзотермическая реакция N + NO = N
2
+ О идет с боль-
шой скоростью [178].
Лишь сравнительно недавно появились работы, в которых количест-
венно изучались реакции атомов азота (при допущении о том, что возбуж-
денные молекулы азота не принимают участия в реакции), поступающих
из электрического разряда в азоте, с различными углеводородами (СН
4г
.
С
2
Н
6
, С
3
Н
8
, С
4
Н
10
, С
2
Н
4
, С
3
Н
6
, С
4
Н
8
, С
2
Н
2
И Т. Д.) И другими органиче-
скими соединениями. Почти во всех случаях в продуктах реакции обнару-
жен цианистый водород, HCN, который, согласно предлагаемым механиз-
мам этих реакций, образуется либо в первичном акте (в случае предельных
углеводородов и этилена), либо в результате последующего распада пер-
вично образующегося радикала (например, N -f~ С
3
Н
6
—>
CH
2
N 4-
+ СН
3
СН, CH
2
N ->- HCN + Н или N + С
2
Н
2
C
2
H
2
N ->• HCN 4- СН>
(см. работу Стеси [1533, стр. 640—643], а также [746, 941]).
§ 7. РЕАКЦИИ СВОБОДНЫХ РАДИКАЛОВ
Получение радикалов
Наблюдающаяся высокая химическая активность радикалов обуслов-
лена незаконченностью электронных оболочек соответствующих атомных
групп, благодаря чему свойства этих групп приближаются к свойствам
атомов, обладающих тем же количеством внешних электронов, что и дан-
ная атомная группа. В этом отношении характерна аналогия между хими-
ческими свойствами гидридов углерода, азота, кислорода и фтора и хими-
ческими свойствами атомов с тем же числом электронов. Так, радикал СН
(метин) является химическим аналогом атома N, радикалы СН
2
(метилен)
и NH (имин) — аналогами атома О, радикалы СН
3
(метил), NH
2
(амино-
группа) и ОН (гидроксил) — аналогами атома F и, наконец, молекулы
СН
4
, NH
3
, Н
2
0 и HF в известном смысле (инертность) аналогичны атому
Ne. Благодаря химической ненасыщенности радикалов энергия актива-
ции процессов, протекающих с их участием, имеет порядок величины
энергии активации атомных реакций. Поэтому эти процессы, как правило,
идут приблизительно с такой же скоростью, с какой идут атомные про-
цессы.
Химически активные радикалы в свободном виде наблюдаются лишь
при определенных специфических условиях. Термодинамически высокая
концентрация радикалов соответствует повышенной свободной энергии
системы; поэтому все факторы, повышающие свободную энергию, способ-
ствуют появлению свободных радикалов. В соответствии с этим различно-
го рода радикалы наблюдаются, например, при повышенных темпера-
турах. Так, Бонхеффером и Рейхардтом [527] (см. также [4, 724]) при
нагревании паров воды или смеси Н
2
0 + 0
2
до температуры выше
1000° С был получен радикал ОН в количестве, достаточном для его
обнаружения по спектру поглощения (рис. 19).
Кистяковский и Гершинович [1065] и Уайт [1668] при нагревании па-
ров дициана до 1250° С получили радикал CN, также обнаруженный по
спектру поглощения; Франк и Рейхардт [797] — радикал NH при нагре-

Рис. 19. Спектр поглощения гидроксила при термической диссоциации паров воды
1527]
ванни аммиака NH
3
. Свободные радикалы получаются также при нагре-
вании различных органических соединений. Разложение (пиролиз) орга-
нических веществ при высоких температурах, идущее с образованием
свободных радикалов, представляет собой один из широко применяемых
методов получения различных органических радикалов (см., например
[292, 1563]. См. также [179, стр. 42-43].
?
Одним из источников органических радикалов являются алкилиодиды
RJ, разлагающиеся вследствие относительно малой прочности связи С—J
при сравнительно невысоких температурах и вследствие малой активно-
сти атомов иода дающие радикалы R практически без примеси других
радикалов.
В качестве широко применяемого источника свободных радикалов ука-
жем далее термический распад азосоединений и металлоорганических со-
единений, а также распад перекисных соединений. Так, например, ради-
калы СН
3
получаются при распаде азометана H
3
CN
2
CH
3
или диметилрту-
ти Hg(CH
3
)
2
. Метилен СН
2
получается при термическом распаде диазоме-
тана N
2
CH
2
ИЛИ кетена СОСН
2
. При термическом распаде органических
перекисей получаются алкоксильные радикалы СН
3
0, С
2
Н
5
0 и др.
Большое разнообразие различного типа свободных радикалов наблю-
дается также при пропускании электрического разряда в атмосфере раз-
личных газов. Эти радикалы обнаруживаются как спектроскопически, так
и при помощи масс-спектрометра.
Добавим, что Райе и Уэлей [1405] при помощи метода зеркал обнаружи-
ли большое число радикалов, образующихся в электрическом разряде
в различных органических веществах. Метод электроразряда обладает,
однако, тем существенным недостатком, что практически невозможно по-
лучить данный радикал в достаточной концентрации без существенных
примесей других активных частиц. Например, в разряде в парах воды од-
новременно с гидроксилом получаются также атомы Н и О (см. [205, 993]).
Для получения алифатических радикалов иногда применяется следую-
щий вариант электроразрядного метода [1244]: непосредственно в элект-
рическом разряде (в водороде) получаются атомы Н. Так как при комнат-
ной температуре взаимодействие атомов Н с олефинами сводится практи-
чески исключительно к процессу: Н + С
д
Ц
2п
= С
п
Н
2п+1
, т. е. к образо-
ванию алифатического радикала, то в присутствии олефина можно полу-
чить соответствующий радикал.
