Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.


ся уравнением:
дг = дг
г
+ дг
с
= (
?г
+ д
0
in 4)
•
(4-3)
Рассмотрим такой частный случай, когда в системе идут две параллель-
ные реакции: одна в объеме, другая на стенках реакционного сосуда.
В этом случае, обозначив скорости этих реакций соответственно буквамж
w
r
и w
c
, для суммарной скорости реакции будем иметь w = w
r
+ w
c
.
Количество тепла, выделяемое той и другой реакциями, далее, будет
равно: q
r
= w
r
Q и q
G
= w
c
Q, где Q — молярная теплота реакции. Обо-
значив долю гетерогенной реакции суммарной скорости реакции через а
г
получим:
w
r
=
(1 — a) w
и
w
Q
=
aw
и, далее,
д
г
=
(1
—a)wQ
и
q
c
= awQ.
Подставляя эти значения q
r
и q
c
в формулу (4.3), преобразуем ее к виду:
wQ ( 2г R\
[*-* + * 7+ я
1п
—)
•
(
4
-
4
>
При помощи этой формулы из измеренных значений разогрева ДГ, ско-
рости суммарной реакции w и коэффициента теплопроводности X может
быть вычислена величина а, т. е. доля полной реакции, приходящаяся
на гетерогенную ее часть. Такого рода измерения были осуществлены
Маркевичем [233] и Гурманом и Чайкиным [79] для термической реакции
Н
2
+ С1
2
= 2HG1 в присутствии примеси кислорода и без него. Было
показано, что в отсутствие кислорода реакция представляет собой го-
могенную реакцию (а = 0), идущую во всем объеме реакционного сосуда
с одинаковой скоростью. Полностью гомогенный характер реакции под-
тверждается нечувствительностью скорости реакции к изменению величи-
ны S/V. В присутствии кислорода (15%), сильно тормозящего гомогенную
реакцию, реакция «прижимается» к стенке реактора и становится прак-
тически гетерогенной (а ^ 1). Скорость реакции в этом случае возрастает
с увеличением отношения S/V. Аналогичный гомогенно-гетерогенный
механизм реакции Чайкин [373] установил также для реакции этилена
с хлором в присутствии 0
2
.
Эмануэль, Майзус и Маркевич [225] применили метод Ковальского
к изучению окисления пропана, С
3
Н
8
, в присутствии НВг и N0
2
. В резуль-
тате этого и аналогичных опытов Эмануэль [175, 228] пришел к заключе-
нию о существовании разделенных во времени макроскопических стадий
сложной химической реакции (см. § 37). Уризко и Поляков [354] приме-
нили метод Ковальского к изучению роли стенок в реакции окисления ме-
тана, СН
4
, в формальдегид, НСНО. Они нашли, что в условиях их опытов
формальдегид образуется в газовой фазе и окисляется на стенках. По-
крытие стенок реакционного сосуда тетраборатом калия, К
2
В
4
0
7
, приво-
дит к замедлению гетерогенной реакции расходования формальдегида.
Метод Ковальского представляет особый интерес с точки зрения изу-
чения механизма гетерогенно-каталитических реакций в газах. Модифи-
кация этого метода, специально приспособленная для изучения реакций,
идущих в присутствии гетерогенного катализатора, отличается тем, что
проводятся две серии опытов: в первом опыте катализатор в виде тонкого
слоя наносится на стенки реакционного сосуда, во втором — на капилляр
термопары, помещенной на оси цилиндрического реакционного сосуда.
Если одновременно с реакцией на поверхности катализатора, выделяю-
щей тепло в количестве д
к
, идет объемная реакция с выделением тепла

д
г
, то в первом случае (катализатор на стедках реактора) вследствие того,
;
что при реакции, идущей только на стенках, газ не разогревается, наблю-
даемый разогрев (т. е. разность показаний термопары, расположенной на
оси сосуда, и термопары, помещенной у стенки реакционного сосуда)
будет обусловлен объемной реакцией и, следовательно, выразится форму-
лой
:
АТ
±
= д
г
/4лЛ, тождественной с формулой (4.1). Во второй серии опы-
тов (катализатор на капилляре) разогрев выразится формулой
Я
г
Я
К
Л
аналогичной формуле (4.3). Из этих двух формул, исключая коэффициент
теплопроводности К, для отношения количеств тепла, выделяющегося
на поверхности и в объеме, получаем
А Та А Уз
</
г
"" 2ATiln (Л/г) -
Применяя эту формулу к реакции восстановления сернистого газа окисью
углерода ЗСО + S0
2
= 2С0
2
+ COS, катализируемой окисью алюминия
А1
2
0
3
, Богоявленская и Ковальский [32] нашли, что на катализаторе вы-
деляется только 3—4% тепла реакции (при 570—615° С). Отсюда был
сделан вывод о том, что в условиях опытов реакция представляет собой
гомогенную реакцию, основные стадии которой протекают в газовой
фазе, и лишь инициируемую на поверхности твердого катализатора. Со-
гласно опытам Богоявленской и Ковальского, гомогенной является так-
,же и реакция восстановления сернистого газа водородом, катализируемая
той же окисью алюминия. Однако в отличие от предыдущей реакции, здесь
стадия гетерогенного инициирования реакции эндотермична, что обнару-
живается по охлаждению катализатора в ходе реакции. В отличие от
двух предыдущих реакций, реакция окисления сернистого газа на плати-
не при температуре ~ 500° С и давлении 100 мм рт. ст. целиком про-
текает на поверхности катализатора, т. е. целиком гетерогенна.
Заметим, что наличие гетерогенных стадий в некоторых гомогенных реак-
циях и гомогенных — в гетерогенно-каталитических реакциях или гомо-
генно-гетерогенный характер этих реакций был установлен также в
многочисленных работах Полякова с сотр. [280].
Метод меченых атомов. Мечеными атомами называют радиоактивные
гили стабильные изотопы, позволяющие различать изотопные молекулы
какого-либо соединения, имеющего в своем составе данный элемент.
Так, например, при помощи изотопов водорода, углерода и азота мы раз-
личаем изотопные молекулы цианистого водорода:
x
H
12
C
l4
N,
2
D
12
C
14
N,
i
H
i3
G
i4
N?
X
H
14
C
14
N,
2
D
14
C
14
N,
1
H
12
C
15
N,
2
D
12
C
15
N и т. д. В исследованиях
с применением меченых атомов обычно используются изотопные молеку-
лы, меченные изотопами какого-либо одного элемента, реже—двух.
Из упомянутых выше изотопов только изотоп углерода
14
С радиоак-
тивен, остальные изотопы стабильны. При применении радиоактивных
^изотопов в качестве меченых атомов изотопный состав соединения опреде-
ляется его удельной активностью:
Р =
с/(с
+ с) « с/с, если с с,
где с — концентрация неактивного, с — активного изотопа. Распределе-
ние стабильных изотопов данного элемента между изотопными молеку-
лами соответствующего соединения обычно определяется при помощи
масс-спектрометрического анализа, который позволяет получить непосред-
ственно величину отношения концентраций изотопных молекул. В опы-

тах с изотопами водорода Н и D изотопный состав иногда определяют
сжиганием смеси изотопов и измерением плотности получающейся при этом
воды [232].
Метод меченых атомов нашел применение вначале для изучения подви-
жности или реакционной способности различных атомов в молекуле
данного соединения или в молекулах различных соединений (в частности,
в реакциях изотопного обмена). Первые исследования этих реакций бы-
ли осуществлены Хевеши и Панетом [951], изучавшими обмен изотопов
естественно-радиоактивных элементов. Однако систематические исследо-
вания реакций изотопного обмена и других реакций с использованием
меченых атомов начались с открытием дейтерия и получением искусствен-
но-радиоактивных и стабильных изотодов других элементов.
В качестве одного из простых примеров применения меченных дейте-
рием молекул для изучения подвижности атомов водорода в зависимости
от положения их в молекуле рассмотрим реакцию метильного радикала
СН
3
с молекулой метиламина CH
3
NH
2
. Эта реакция может идти двумя
путями:
СН
8
+ CH8NHa=CH
4
+ GHBNH (1)
и
СНз + CH
8
NHa=CH4 +.GHaNH
a
. (2)
Измерения скорости реакции по исчезновению радикалов СИ
3
или по вы-
ходу метана СН
4
дают лишь суммарную константу скорости, отвечаю-
щую обоим путям реакции. Однако применяя меченные дейтерием мо-
лекулы метиламина CH
3
ND
2
и CD
3
NH
2
и измеряя выходы метана, можно
раздельно определить константы скорости процессов (1) и (2) и тем са-
мым получить представление о подвижности атомов Н в молекуле CH
3
NH
2
(при допущении малости вторичного изотопного эффекта, см. ниже).
Этот метод широко используется в работах Грея и его сотрудников (см.,
например, [871, 875]).
Метод меченых атомов оказался также весьма эффективным методом
изучения механизма химических реакций различных классов.
Исследование распределения данного изотопа в продуктах реакции
и в промежуточных веществах при осуществлении реакции в системах,
содержащих вещества, меченные этим изотопом, позволяет решить ряд
важных вопросов механизма химической реакции. В частности, это вопрос
о том, протекает ли реакция в изолированной молекуле или в молекуляр-
ном комплексе, разрывом каких связей обусловлены те внутри- или меж-
молекулярные перегруппировки, которые лгёжат в основе реакции, ка-
кие соединения являются предшественниками того или иного возникаю-
щего в ходе реакции вещества. Для решения последнего вопроса большое
значение имеет кинетический метод применения меченых атомов, разра-
ботанный Нейманом с сотрудниками [248, 250] применительно к изучению
механизма сложных химических реакций (см. [249]), представляющего
совокупность большого числа стадий, в которых исходные вещества пре-
вращаются в продукты реакции. Как было показано Нейманом с сотрудни-
ками, кинетический метод позволяет не только установить последователь-
ность превращений одних веществ в другие, но и измерить скорости об-
разования и расходования в ходе реакции различных участвующих в ней
веществ.
Сущность кинетического метода применения меченых атомов к изуче-
нию механизма химических реакций состоит в том, что, добавляя в реаги-
рующую систему в начальный или какой-либо другой момент времени то
или иное вещество, меченное соответствующим изотопом, можно по из-
менению концентрации и удельной активности этого вещества и веществ,

являющихся предполагаемыми продуктами химического превращения до-
бавляемого вещества, решить вопрос о том, какова действительная после-
довательность химического превращения веществ в данной реакции, и опре-
делить скорость превращения исследуемых веществ в различные моменты
времени по ходу реакции.
Пусть, например, предполагаемая последовательность отдельных ста-
дий реакции такова: некоторое промежуточное вещество В образуется
двумя путями: из веществ А
х
и А
2
и в свою очередь одним или нескольки-
ми путями превращается в вещество (или вещества) С, как это показано
на следующей схеме:
w
±
. Ai .
•
Аа-
w з
•
в—•
В этой схеме и;
2
-и w
z
— скорости соответствующих стадий реакции.
Если в реагирующую смесь добавить некоторое количество меченного
радиоактивным изотопом вещества А
х
, то изменение удельной активности
вещества В (3 = bib будет описываться дифференциальным уравнением:
Wi
Wi
-I-
W2
= —P' (
4Л
>
где a
x
— удельная активность А
х
. Аналогичное уравнение для изменения
<х
х
имеет вид:
dai / dai \ cti ai
тг —(«+-ЗГ <
4
'
8
>
где WA
t
— скорость образования вещества А
х
из предшественников, % —
концентрация вещества А
х
.
Как видно из уравнения (4.8), удельная актиьность вещества А
х
не-
прерывно падает (падение прекращается лишь с прекращением образова-
ния А
х
). Удельная же активность вещества В
г
как это следует из уравне-
ния (4.7), вначале растет, достигает максимума и дальше уменьшается*
Из условия максимума р (d$/dt = 0) для отношения удельных активно-
стей веществ В и А
г
в момент достижения максимума получаем следующее
выражение:
p/oti==
wi!(wi
+
г£?а).
(4.9>
Если измерены удельные активности аир, формула (4.9) позволяет
проверить предполагаемую схему процесса. Так, например, если удельные-
активности А
х
и В в максимуме р равны, т. е. w
2
— 0, мы заключаем, что
в данной реакции вещество В образуется исключительно в результате
превращения вещества А
х
, которое, таким образом, является единственным
предшественником вещества В. Если же р а
х
, то, следовательно, w
2
=h
=j=
0, и вещество В образуется как из А
х
, так и другими путями.
В качестве одного из примеров применения кинетического метода к
изучению механизма сложных химических реакций приведем результаты,
полученные Луковниковым и Нейманом [222] в случае холоднопламенного
окисления бутана. Был поставлен вопрос о том, получается ли углекислый
газ в этих условиях только в результате окисления окиси углерода или
существуют и другие пути образования С0
2
. Для получения ответа на этот
вопрос в бутано-кислородную смесь добавлялось небольшое количество
СО, меченной изотопом
14
С, и некоторое количество нерадиоактивного СО$
(необходимого для того, чтобы в момент добавления СО удельная актив-
ность предполагаемого продукта окисления СО — углекислого газа —

была равной нулю). Кинетические кривые изменения удельных активно-
стей СО (а
г
) и С0
2
(Р) показаны на рис. 9. Как видно из этого рисунка,
удельная активность С0
2
по всему ходу реакции значительно меньше удель-
ной активности СО. Следовательно, при холодно пламенном окислении бу-
тана лишь незначительное количество С0
2
образуется в результате окис-
ления СО. Измерение суммарной скорости образования С0
2
(2^) и ско-
рости образования С0
2
из СО (м;
х
) показало, что в различные моменты ре-
акции отношечие 2 w\lw
x
изменяется в пределах от 19 до 78, т. е. из СО
получается не более 5,3—1,3% С0
2
. Добавим, что, по мнению Луковни-
кова и Неймана, основной вероятный путь образования С0
2
в данной
реакции связан с распадом ацильных пере-
кисных радикалов RCOOO, образующихся в
ходе окисления бутана, на С0
2
и алкоксиль-
ные радикалы RO.
Другим примером применения кинетическо-
го изотопного метода могут служить результа-
ты, полученные Налбандяном и Нейманом с
сотр. [18] при исследовании механизма терми-
ческого окисления метана. Это исследование
подтвердило сделанный ранее Налбандяном
[243] на основании анализа кинетических кри-
вых накопления формальдегида и окиси угле-
рода при фотохимическом окислении метана
вывод о том, что продукты окисления метана
образуются в последовательности:
о
2
о
2
о
2
СН
4
—- НСНО —> СО —> С0
2
.
В опытах с мечеными атомами в метано-воз-
душную смесь добавляли небольшое количест-
во формальдегида, меченного
14
С (Н
14
СНО), и
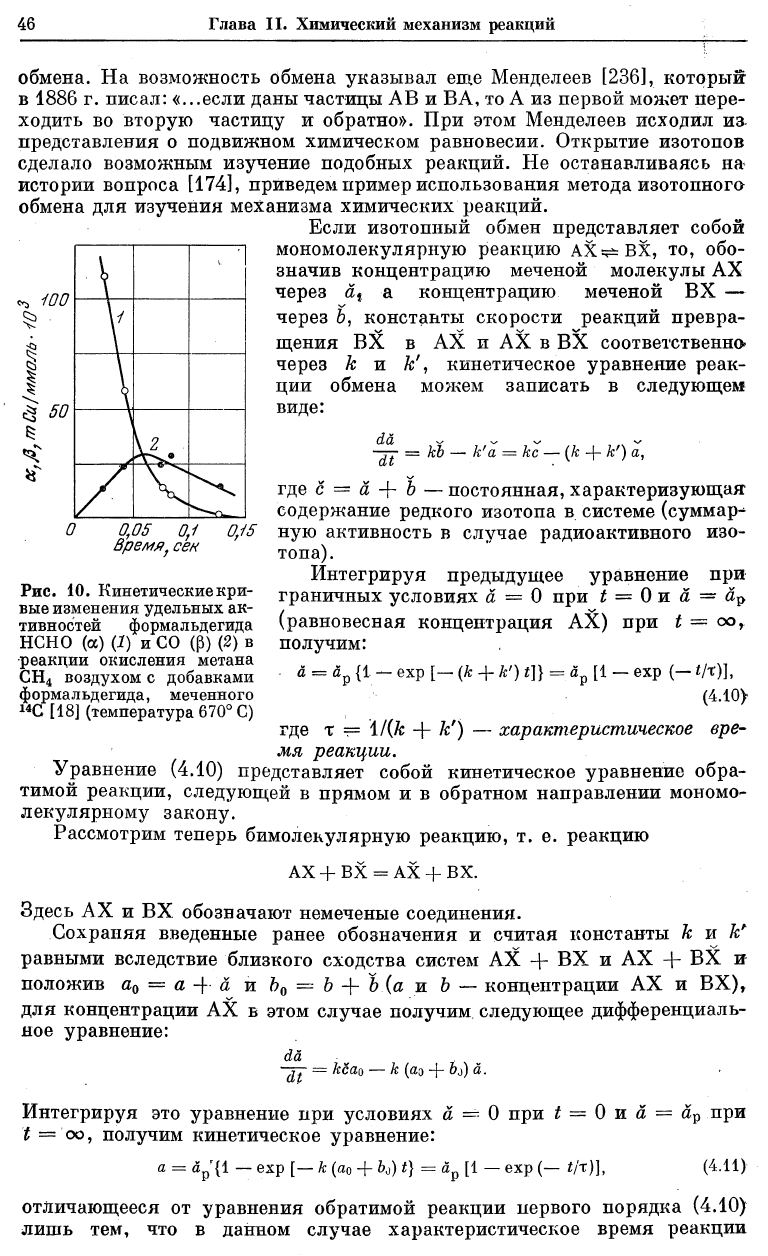
неактивную окись углерода. На рис. 10 при-
ведены зависимости измеренных удельных
активностей формальдегида (а) и окиси углеро-
да (р) от времени пребывания смеси в реакторе
t (опыты велись при непрерывной циркуля-
ции смеси через реактор). Как видно из рис. 10, при t = 0,06 сек кривые
пересекаются. Согласно уравнению (4.9), это является доказательством
того, что в данной реакции СО образуется исключительно в результате
окисления формальдегида.
Однако кинетический метод, в принципе решающий вопрос о последо-
вательности превращений одних веществ в другие в ходе реакции, в том
виде, в каком он применялся до настоящего времени, не дает еще полного
решения вопроса о химическом механизме реакции, т. е. о химической при-
роде тех элементарных процессов, из которых слагается механизм брут-
то-реакции. Действительно, зная, например, что при окислении метана
окись углерода получается из формальдегида, мы еще не можем написать
того химического уравнения, которое отвечает истинному химическому
механизму превращения формальдегида в СО, так же как не знаем, каков
детальный химический механизм превращения метана в формальдегид.
Для решения этой задачи необходимо, в частности, знать природу частиц,
являющихся участниками соответствующих элементарных процессов, а
также природу и местоположение разрываемых при этом химических
связей.
Одним из методов изучения механизма химических реакций при помо-
щи меченых атомов является упоминавшийся уже ранее метод изотопного
1 2 3
Время
7
мин ,
Рис. 9. Кинетические кри-
вые изменения удельных ак-
тивностей СО (ai) (1) и С0
2
ф) (2) в реакции окисления
бутана С
4
Ню с добавками
окиси углерода, меченной
14
С в начале реакции [222]
обмена. На возможность обмена указывал еще Менделеев [236], который
в 1886 г. писал: «...если даны частицы АВ и ВА, то А из первой может пере-
ходить во вторую частицу и обратно». При этом Менделеев исходил из.
представления о подвижном химическом равновесии. Открытие изотопов
сделало возможным изучение подобных реакций. Не останавливаясь на
истории вопроса [174], приведем пример использования метода изотопнога
обмена для изучения механизма химических реакций.
Если изотопный обмен представляет собой
мономолекулярную реакцию АХ^ВХ, то, обо-
значив концентрацию меченой молекулы АХ
через а
%
а концентрацию меченой ВХ —
через &, константы скорости реакций превра-
щения ВХ в АХ и АХ в ВХ соответственна
через к и /с', кинетическое уравнение реак-
ции обмена можем записать в следующем
виде:
da ^ v.
-jjj
—
kb — к'а =
кс — (к
+ а,
где с = а + Ъ
—-
постоянная, характеризующая
содержание редкого изотопа в системе (суммар^
ную активность в случае радиоактивного изо-
топа).
Интегрируя предыдущее уравнение при
граничных условиях а = 0 при t = 0 и а а
р
(равновесная концентрация АХ) при t = оо,
получим:
а = а
р
{1. —
ехр [— (к + к')
*]}
= а
р
[1 —
ехр
(—
t/x)],
(4.10)
где т — 1 /(к + к') — характеристическое вре-
мя реакции.
Уравнение (4.10) представляет собой кинетическое уравнение обра-
тимой реакции, следующей в прямом и в обратном направлении мономо-
лекулярному закону.
Рассмотрим теперь бимолекулярную реакцию, т. е. реакцию
АХ + ВХ = АХ + ВХ.
Здесь АХ и ВХ обозначают немеченые соединения.
Сохраняя введенные ранее обозначения и считая константы к и к
г
равными вследствие близкого сходства систем АХ + ВХ и АХ + ВХ и
положив а
0
— а а и Ь
0
= Ъ +
Ъ
{а и Ъ — концентрации АХ и ВХ),
для концентрации АХ в этом случае получим следующее дифференциаль-
ное уравнение:
da
-rjj = ксао — /с(ао + &о)а.
Интегрируя это уравнение при условиях а = 0 при t = 0 и а = a
v
при
t = оо, получим кинетическое уравнение:
а = a
p
F
{1 — ехр [— к (а
0
+ h) t} = а
р
[1 — ехр (— */т)], (4.11)
отличающееся от уравнения обратимой реакции первого порядка (4.10)
лишь тем, что в данном случае характеристическое время реакции
Рис. 10. Кинетические кри-
вые изменения удельных ак-
тивностей формальдегида
НСНО (а) (1) и СО ф) (2) в
реакции окисления метана
СН
4
воздухом с добавками
формальдегида, меченного
14
С [18] (температура 670° С)

х = 1 /[к (а
0
+ Ь
0
)] зависит от концентраций обменивающихся веществ. Это
различие уравнений кинетики моно- и бимолекулярной реакций и позво-
ляет установить действительный механизм реакции изотопного обмена».
Для изучения механизма химических реакций, в частности природы
элементарного акта, значительный интерес представляет кинетический
изотопный эффект, обусловленный влиянием изотопного состава реаги-
рующей системы на скорость реакции. Мерой изотопного эффекта принято
считать отношение констант скорости реакций молекул с разным изотоп-
ным составом. Теория этого эффекта рассмотрена в [262, § 32]. Здесь же-
мы коснемся в основном лишь феноменологической стороны изотопного
эффекта.
Различают первичный и вторичный кинетические изотопные эффекты.
Рассматривая, например, реакцию отрыва атома водорода каким-либо
атомом или радикалом, первичный изотопный эффект мы будем иметь в тех
случаях, когда в разрываемой или в образующейся новой связи непо-
средственно участвует данный изотоп. Так, в реакциях
CF* + CHD
3
= GF
3
H + CD
3
(1)
ж
CF
3
+ CD
3
H = CF
3
D + CHD
2
(2)
имеет место первичный изотопный эффект в отличие от реакций
CF
3
+ CD
3
H = CF
3
H + CD
3
(1>
и
CF
3
+ CH
4
= CF
3
H + CH
3
, (3}>
которые не затрагивают связей С — D (вторичный изотопный эффект)*
Заранее можно ожидать большего различия в скоростях первых двух
реакций (первичный изотопный эффект) по сравнению со скоростями двух
вторых (вторичный эффект). Действительно, если энергии активации ре-
акций (1) и (3) в пределах погрешности измерений совпадают (10,5 +
+ 0,3 и 10,16 + 0,37 ккал), то между энергиями активации реакций (1) и
(2) имеет место существенное различие (10,5 + 0,3 и 12,75 + 0,3 ккал)\
[178]. На основании подобных фактов обычно принимается, что при вто-
ричном изотопном эффекте различие в скорости реакций изотопных моле-
кул практически отсутствует.
Различие энергий активации в реакциях, протекающих при участии*
различных изотопов, объясняется тем, что, как это следует из теории пере-
ходного состояния (§ 11), разность энергий активации двух реакций может
быть представлена как разность нулевых энергий реагирующих частиц в
исходном состоянии Д2?о» уменьшенная на разность нулевых энергий в про-
межуточном (активированном) состоянии Д-Ejf,
АЕ = АЕО-АЕ^. (4.12)
Поскольку нулевая энергия представляет собой сумму нулевых коле-
бательных энергий компонентов системы, т. е. #0 = 2^/2,
Г
д
е
coi —
частота собственных колебаний г-й компоненты, то вследствие значитель-
ного уменьшения частот колебаний при переходе системы в активирован-
ное состояние, обусловленного ослаблением между атомных связей, ве-
личину AEf нужно считать заметно меньшей АЕ
0
, откуда следует:
АЕ < АЕ
0
. (4.13)
Ввиду того, что нулевая энергия системы, содержащей более легкие
изотопные молекулы, больше нулевой энергии второй системы (что обус-

Таблица 2
Отношение констант скорости и разности энергий активации реакций
стабильных изотопов водорода [178]
(Д2?э = 1,82 ккал)
Реакция
T,
0
К
fc
H
/fc
D
a
H/
a
D
АЕ, ккал
Н + Н
2
, D +D
2
1000
1,9
1,41 0,51
0+ Н
2
, О +D
2
1000
2,5
1,34
1,12
С1+Н
2
, Cl + D
2
500 3,0
1,38
1,77
Br+H
2
, Br+ D
2
1000 1,5
1,40
1,12
J +H
2
, J+D
2
500
3,6
1,41
0,92
ловлеио соответствующим различием частот собственных колебаний),
имеем АЕ > 0.
Это является одной из причин увеличения скорости реакции в более
легкой системе по сравнению с тяжелой (&
н
— Ad) В табл. 2 приводятся
отношения констант скорости и разности энергий активации для пар
реакций, идущих при участии молекул и атомов водорода, а также отно-
шения предэкспонентов (Ал/А в) и вычисленные из нулевой колебательной
энергии значения АЕ
0
. Как видно из табл. 2, во всех случаях величина
АЕ в соответствии с формулой (4.13) оказывается меньше АЕ
0
.
Обратное соотношение может иметь место в случае реакций различных
изотопных атомов с одной и той же молекулой, например, Я + 0
2
=
= ОН + 0 и D -j- 0
2
= OD + О. В этом случае мы имеем 1сц/ k
D
==
= 0,7 (1000° К) и А £ = —1,83 ккал (при А Е
0
= 0). Ввиду того, что нуле-
вая энергия активированного состояния более легкой системы больше
нулевой энергии тяжелой системы, т. е. AEf 0, из (4.13) следует
АЕ <0.
Вычисляя при помощи полуэмпирического метода Полани — Эйрин-
га величины AEf и АЕ
0
для реакций Na + НС1 = NaCl + Н и Na +
+ DC1 — NaCl + D, Боун и Эванс [457] нашли АЕ
0
= 1,20 ккал и AEf =
= 0,75 ккал, откуда следует АЕ = 0,45 ккал в хорошем согласии с изме-
ненной ими разностью энергий активации указанных реакций АЕ — Е
в
—<
— Е
н
— 6,4—6,1 = 0,3 ккал.
Обусловленное изотопным эффектом различие констант скорости ре-
акции изотопных молекул, очевидно, может сказаться на скорости сум-
марной реакции лишь в том случае, когда эта стадия, в которой обра-
зуется или разрывается связь с данным изотопом, является лимитирующей
стадией реакции, т. е. стадией, скорость которой определяет суммарную
скорость реакции. Так, например, известно, что в случае мономолекуляр-
ных реакций при достаточно высоких давлениях лимитирующей стадией
реакции является распад активной молекулы, Б то время как при низких
давлениях скорость реакции определяется скоростью активации молекул
исходного вещества, осуществляющейся по закону второго порядка (см.
главу V, § 19).
Естественно предположить, что изотоп тый эффект должен быть осо-
бенно сильным в случае распада активной молекулы, связанного с разры-
вом одних и образованием новых связей, и должен практически равнять-
ся нулю в случае активационного процесса, связанного с физическим про
«
цессом передачи энергии при соударении молекул [480]. Поэтому нужно
ожидать ослабления изотопного эффекта в реакции мономолекулярного
•превращения при уменьшении давления.

Такой случай, по-видимому, наблюдался Вестоном [1662], изучавшим
изомеризацию неактивного и меченного тритием циклопропана
сн
2
/ V
Н2С СНг
в пропилен Н
3
С—СН==СН
2
. В опытах Вестона заметный изотопный эф-
фект, наблюдавшийся при давлении порядка атмосферного, уменьшался
при уменьшении давления и при давлениях — 0,5 мм рт. ст. полностью
исчезал. На этом примере видна возможность использования изотопного
эффекта для установления лимитирующей стадии сложной химической ре-
акции. Добавим, что наличие значительного изотопного эффекта в этой
реакции можно также рассматривать как указание на то, что превращение
активных молекул здесь сопряжено с разрывом водород-углеродных свя-
зей (наряду со связями С—С). Можно заключить, что Н3С—СИ—СН2
является вероятным первичным продуктом превращения активной моле-
кулы.
Предыдущий пример показывает, что наличие или отсутствие (в более
общем случае — величина) изотопного эффекта зависит от того, с разры-
вом каких связей сопряжена данная химическая реакция. К этому заклю-
чению приводит также и теоретическое рассмотрение кинетического изо-
топного эффекта [491, 492]. В частности, из расчета следует, что отношение
констант скорости распада изотопных молекул бромистого этила
СН
3
12
СН
2
Вг и СН
3
13
СН
2
Вг на этильный радикал и атом брома к/к не мо-
жет быть меньше корня квадратного из отношения приведенных масс этих
молекул, т. е.'к/к = 1,036. Для распада же обеих изотопных молекул
бромистого этила на этилен (СН
2
=
12
СН
2
и СН
2
=
13
СН
2
) и бромистый
водород расчет дает к/к = 1,003.
Таким образом, измеряя величины изотопного эффекта, можно решить
вопрос о том, осуществляется ли распад бромистого этила но радикаль-
ному или по молекулярному механизму, т. е. следует ли реакция схеме
С
2
Н
5
Вг = С
2
Н
5
+ В г или схеме С
2
Н
Б
Вг = С
2
Н
4
+ НВг. Эта возможность
была использована Фридманом, Бернштейном и Ганнингом [800], которые
нашли, что при 400° С к!к = 1,016. Из сопоставления этой] величины с
приведенными выше расчетными значениями отношения к/к для двух
механизмов распада следует, что истинный механизм реакции отвечает мо-
лекулярной схеме С
2
Н
5
Вг = С
2
Н
4
+ НВг.
Макрокинетический закон реакции и ее химический механизм
Одна из главных особенностей сложных химических реакций, идущих,
как правило, через ряд стадий, состоит в том, что в большинстве слу-
чаев в ходе реакции образуются способные к дальнейшим превращениям
высокоактивные промежуточные вещества, которые обычно не наблюдают-
ся в числе конечных продуктов реакции. Правильность этого заключения
подтверждается прямыми исследованиями природы этих промежуточных
веществ, откуда следует, что в большинстве реакций такие промежуточ-
ные вещества представляют свободные атомы и радикалы, весьма актив-
ные и поэтому неустойчивые частицы, наиболее интересные с точки зре-
ния химического механизма реакций.
Эта особенность сложных реакций служит главной причиной практи-
ческой невозможности полного решения вопроса о химическом механизме
реакций на основе одного только измерения концентраций исходных, ко-
нечных или устойчивых промежуточных веществ, а также суммарного
давления реагирующей смеси по ходу реакции, т. е. в зависимости отвре-
4 В. Н. Кондратьев, Е. Е. Никитин

мени (кинетический метод). Включение в кинетический метод данных по
кинетике накопления и расходования лабильных промежуточных ве-
ществ, ставшее возможным с развитием методов обнаружения и измерения
их концентраций, делает его значительно более эффективным в исследова-
нии механизма химических реакций.
Из всего сказанного следует, что одним из первых этапов решения во-
проса о химическом механизме реакции должно быть выяснение природы
тех активных промежуточных веществ, которые принимают участие в
элементарных стадиях реакции. Применяющиеся в настоящее время экс-
периментальные методы обнаружения химически неустойчивых (лабиль-
ных) промежуточных веществ и методы измерения их концентрации будут
рассмотрены в следующем параграфе. Здесь же ограничимся рассмотре-
нием вопроса о связи особенностей химического механизма реакции с
ее макрокинетическим законом.
Этот вопрос частично уже затрагивался в предыдущей главе. Из этого
обсуждения следовало, что связь макрокинетического закона реакции с
ее механизмом, вообще говоря, не однозначна. В частности, мы указыва-
ли, что кинетический закон ряда сложных цепных реакций, идущих с
участием лабильных промежуточных веществ — свободных атомов и ра-
дикалов — при определенных условиях описывается простыми формула-
ми, ни в какой мере не отображающими сложного механизма реакции.
Из этого, однако, не следует, что экспериментальное изучевие макро-
кинетических закономерностей реакции и, в частности, ее макрокинети-
ческого закона не имеет никакого значения для решения вопроса о хими-
ческом механизме реакции. Прежде всего нужно указать, что макроки-
нетический закон есть тот первый пробный камень, на котором проверяется
правильность химического механизма реакции, построенного на основа-
нии тех или иных данных и представлений. Согласие полученного из опы-
та кинетического закона реакции с теоретическим ее законом, получаю-
щимся из механизма реакции, является основным критерием, совершенно
необходимым, хотя и недостаточным условием, которому должен удовлет-
ворять постулируемый механизм химической реакции. Отсутствие этого
согласия служит верным признаком ошибочности или недостаточности
механизма реакции.
Наряду с тем общим значением, которое макрокинетический закон
химической реакции имеет в качестве критерия достоверности ее теоре-
тического механизма, этот закон нередко позволяет вскрыть отдельные
черты химического механизма реакции. Здесь прежде всего можно указать
реакции с дробным порядком, суммарная скорость которых пропорцио-
нальна квадратному корню из концентрации одного из реагирующих ве-
ществ. Если эта зависимость установлена достаточно надежно, она может
рассматриваться как однозначное и прямое указание на то, что одним из
участников реакции являются свободные атомы или радикалы. Из рас-
смотрения возможных механизмов реакций, идущих при участии свобод-
ных атомов и радикалов, следует, что степень V
2
в макрокинетическом
законе реакции появляется тогда, когда гибель этих активных частиц
связана с их рекомбинацией.
Рассмотрим в качестве примера реакцию термического разложения
закиси азота, N
2
0, в присутствии паров иода или брома. Согласно исследо-
ваниям Фольмера и Богдана [1645], макрокинетический закон этой ре-
акции может быть представлен в виде:
d [N2O]
17
=
Л
[N.0] [Ха]*
(X — J или Вг). Допуская, что механизм этой реакции состоит из следую-
