Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.


т. е. в этом случае выполняется соотношение (2.23):
к
==
ко = А ехр (— Я/ЛГ).
Разделив приближенное выражение (2.23) на исходное (более точное)
выражение к
0
= А
0
Т
п
ехр (—EJRT), получим:
к/ко = (Г/Г)" ехр (1 -- f /Т) п. (2.28)
Если среднюю температуру Г выбрать как среднее геометрическое
Т
г
и Г
2
, т. е.
Т = (TIT
2
F
2
,
то при п = 1 и = 2 для отношения (2.28) будем иметь при Т =
значение 0,93 и при Т = Т
2
— 0,95; т. е. в этом случае приближенная
формула (2.23) отличается от более точной
при Г > Т максимум на 5% и при Т ^
Т —
на 7%. При п = 2 ошибка больше и состав-
ляет соответственно 10—13% при TJT
1
= 2
и 12—17% при п=1 и TJ1\ = 3.
Таким образом, в не очень большом тем-
пературном интервале при обычных ошибках
опыта значения константы скорости, вычис-
ляемые по простой формуле Аррениуса (2.23)
и формуле, в которой учитывается зависи-
мость предэкспоненциального множителя от
температуры, могут оказаться неразличи-
мыми.
Зависимость скорости химической реак-
ции от температуры является хорошо из-
вестным экспериментальным фактом. Обыч-
но скорость реакции растет с повышением
температуры. В качестве примера на рис. 2
показана зависимость констант скоростей
прямой и обратной реакций Н
2
+ J
2
^ 2НJ
от температуры в интервале 283—508°С (по
данным Боденштейна [513]). В координатах 1 gk — 1 IT опытные точки
ложатся на прямые, что свидетельствует о соблюдении закона Аррениуса
для обеих реакций. Из наклона прямых
^ * (2.29)
i,4 4,6 1
?
8
<ЦТ-10
3
Рис. 2. Температурная зави-
симость констант скорости ре-
акции образования к (1) и раз-
ложения к' (2) иодистого водо-
рода [513]
d (1 /Г)
R
Боденштейн вычислил следующие значения энергии активации: Е (пря-
мая реакция) = 40 ккал/молъ и Е' (обратная реакция) = 44 ккал/молъ
3
.
Наглядное представление о температурном ходе реакции дает ее тем-
пературный коэффициент г]
т
, определяемый отношением констант ско-
рости реакции при двух температурах, отличающихся одна от другой на
некоторую небольшую величину 2ДТ (например, АТ = 5°)
Г]
т
= k
T+AT
/k
T
_
AT
. (2.30)
Вычисляя температурный коэффициент по формуле (2.23), получим:
Е
2Д7'
ц
т
—
ехр
^
R г2
__
ехр
Е 2АТ
Я Т*
(2.31)
3
В дальнейшем в случае всех энергетических величин, относящихся к молярным
количествам, вместо кал/молъ или ккал/молъ будем писать кал или соответ-
ственно ккал.

Как видно из этой формулы, температурный коэффициент простой реакции
при Е > 0 всегда должен быть больше единицы и должен уменьшаться
с увеличением температуры, стремясь к единице при Т ->- оо. Так, зна-
чения температурного коэффициента реакции Н
2
+ J
2
— 2HJ при 600,
650 и 700° К (вычисленные для
А
Т — 5°) равны соответственно 1,78;
1,65 и 1,51.
При энергии активации, равной нулю, температурный коэффициент
реакции, скорость которой выражается законом Аррениуса (что не всегда
имеет место), очевидно, равен единице.
В общем случае при энергии активации экзотермического направления
реакции Е ;> 0, энергия активации обратной (эндотермической) реакции
jЕ" = # + где Q — тепловой эффект реакции. В случае Е = 0 энергия
активации Е
г
равна эндотермике реакции, E
r
= Q. Энергию активации
экзотермического направления реакции иногда называют истинной энер-
гией активации.
Как увидим ниже, элементарная реакция (при учете активации мо-
лекул, т. е. экспоненциального члена в формуле Аррениуса), Как прави-
ло, осуществляется далеко не при каждом соударении.
Отношение предэкспоненциального множителя в формуле Аррениуса
к частоте столкновений (равной числу столкновений в 1 см
3
в 1 сек, делен-
ному на произведение концентраций сталкивающихся частиц) называется
стерическим.множителем (Р). Как правило, Р является величиной, мень-
шей единицы, и лишь в редких случаях имеет значение, близкое к еди-
нице
.
Кроме реакций, характеризующихся температурным коэффициентом
т]т = 1, известны реакции, для которых эффективный температурный
коэффициент оказывается меньше единицы, что формально отвечает Е <
<С 0. К таким реакциям в основном относятся реакции рекомбинации, ко-
торые будут рассмотрены в главе VI.
Согласно термодинамике, константа равновесия может быть представ-
лена в виде:
К
р
= ехр (ASpR) ехр (- Q°
p
IRT) (2.32)
или соответственно в виде:
К
С
= ехр (AS
Q
JR) ехр (- Qj/ЛГ), (2.33)
где AS
0
— изменение энтропии в результате реакции; 0% и Ql — теплоты
реакции соответственно при постоянном давлении и постоянном объеме
(при Т = 0°К), причем
Q°
p
— Q°
v
=AvRT и —
AS°
C
= AvR In RT (2.34)
(Av — изменение числа молей).
Из (2.33) и выражения К
с
= k/k' следует, что если теплота реакции
связана с разностью энергий активации прямой и обратной реакций
Q0
=
£Г0 __ £0
f
то между предэкспоненциальными множителями А и А' в аррениусов-
ском выражении констант скорости (2.23) и величиной AS
0
имеет место
соотношение:
RLN(A/A') = AS°. (2.35)
Это соотношение часто используется для нахождения величины А/А\
поскольку энтропия газа может быть выражена через суммы состояний,
вычисляемые из спектроскопических и других данных.

Здесь мы рассматриваем закон Аррениуса как выражающий установ-
ленную на опыте зависимость константы скорости реакции от температу-
ры в некотором температурном интервале. Между тем, ряд соображений,
в основном базирующихся на статистической теории, указывают на при-
ближенный характер закона Аррениуса (см., например, [1041]). Этот вопрос
подробно будет рассмотрен в главах III, V и VII.
§ 3. СЛОЖНЫЕ РЕАКЦИИ
Мы различаем простые и сложные химические реакции.
Простыми реакциями мы назвали такие реакции, стехиометрический
порядок которых совпадает с их истинным порядком и скорость которых
выражается законом действующих масс.
Вместе с тем любая простая химическая реакция (т. е. реакция, не
осложненная вторичными процессами) за редкими исключениями пред-
ставляет собой многостадийный процесс. В случае реакций, идущих с энер-
гией активации, какими является подавляющее большинство химических
реакций, эта многостадийность обусловлена тем, что кроме химического
превращения активных молекул в механизм этих реакций входят физиче-
ские процессы активации и дезактивации. В случае реакций присоедине-
ния и рекомбинации свободных радикалов, не требующих предваритель-
ной активации, механизм реакции слагается из процессов образования,
распада и стабилизации квазимолекул.
Как уже отмечалось ранее, совпадение наблюдаемого порядка реак-
ции с.ее стехиометрическим порядком является необходимым, хотя и не-
достаточным критерием того, что данная реакция представляет собой про-
стую реакцию. Всякое отклонение наблюдаемого порядка реакции от
стехиометрического нужно рассматривать как бесспорный признак того,
что данная реакция не принадлежит к числу простых реакций, а является
сложной реакцией. С точки зрения ее внутреннего механизма сложная ре-
акция представляет собой совокупность простых химических реакций
мл и элементарных процессов, следующих один за другим или совершаю-
щихся параллельно.
Реакции с последовательными стадиями
Для кинетики многих сложных реакций характерно наличие двух или
нескольких химических стадий, следующих одна за другой. Такие реак-
ции можно назвать реакциями с последовательными стадиями. Эти реак-
ции, очевидно, представляют собой такие двух- или многостадийные реак-
ции, в первой стадии которых образуется вещество, способное к дальней-
шему химическому превращению, осуществляющемуся в последующие
стадии реакции. Такие вещества называются промежуточными веществами,
В качестве одного из примеров последовательных реакций укажем реак-
цию между парами натрия и парами сулемы HgCl
2
, наблюдающуюся в так
называемых высокоразреженных пламенах (см. § 6), т. е. реакцию
2Na + HgCl
2
=2NaCl + Hg.
Детальное исследование этой реакции (и аналогичных ей реакций) при-
водит к заключению, что механизм ее представляет совокупность двух по-
следовательных стадий:
Na + HgCl
2
=NaCl + HgCl,
HgCl + Na=NaCl + Hg.
Отметим, что двухстадийыость этих реакций наглядно проявляется в су-
ществовании двух зон реакции: зоны максимального выхода продукта
реакции и зоны максимального выхода света (см. § 6). Промежуточным
веществом в рассмотренной реакции является одновалентный радикал
HgCl.
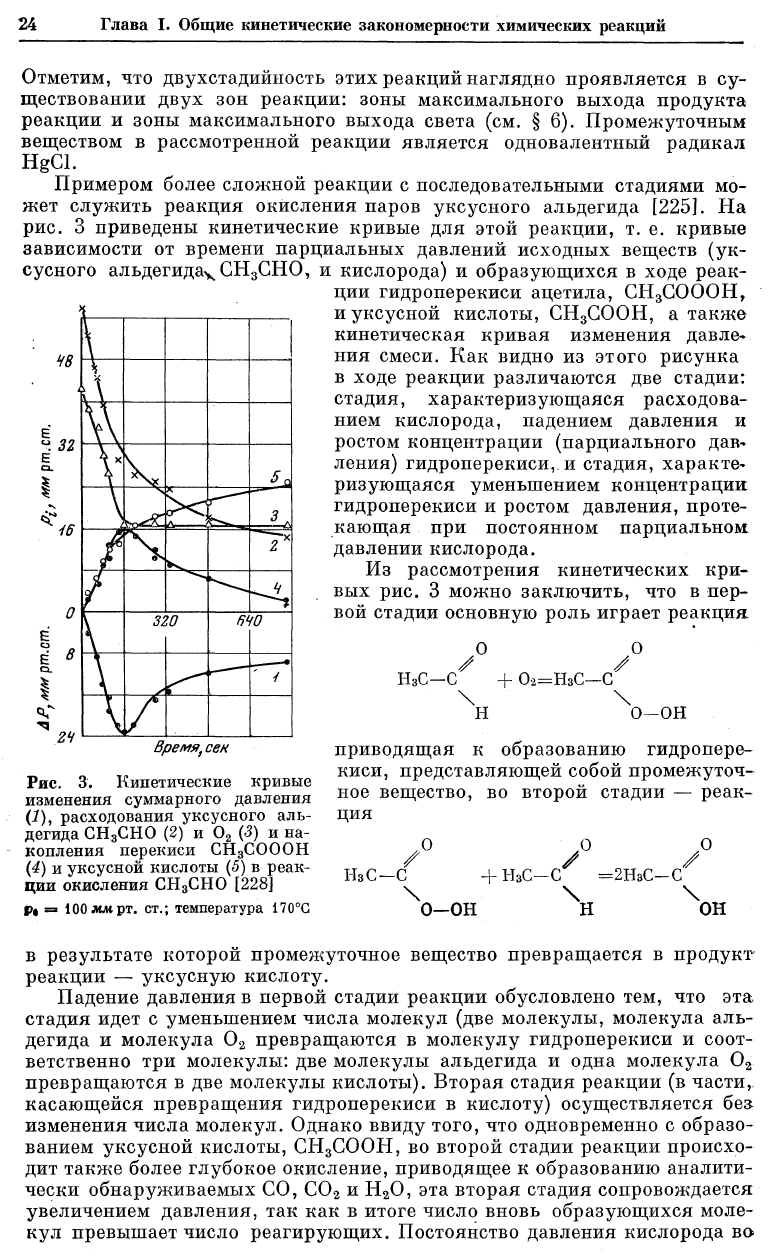
Примером более сложной реакции с последовательными стадиями мо-
жет служить реакция окисления паров уксусного альдегида [225]. На
рис. 3 приведены кинетические кривые для этой реакции, т. е. кривые
зависимости от времени парциальных давлений исходных веществ (ук-
сусного альдегида
ч
СН
3
СНО, и кислорода) и образующихся в ходе реак-
ции гидроперекиси ацетила, СН
3
СОООН,
и уксусной кислоты, СН
3
СООН, а также
кинетическая кривая изменения давле-
ния смеси. Как видно из этого рисунка
в ходе реакции различаются две стадии:
стадия, характеризующаяся расходова-
нием кислорода, падением давления и
ростом концентрации (парциального дав-
ления) гидроперекиси, и стадия, характе-
ризующаяся уменьшением концентрации
гидроперекиси и ростом давления, проте-
кающая при постоянном парциальном,
давлении кислорода.
Из рассмотрения кинетических кри-
вых рис. 3 можно заключить, что в пер-
вой стадии основную роль играет реакция
48
32
46
О
Е
0
£
о.
1
24
\
\
\\
У >
\
х
ч \
X
7*
31
W
fr
L
ю
4
О
/
НзС-С + 0-2=НзС—С
О
\
Н
У
\
о—он
Время,
се и
Рис. 3. Кинетические кривые
изменения суммарного давления
(i), расходования уксусного аль-
дегида СН
3
СНО (2) и 0
2
(3) и на-
копления перекиси СН
3
СОООН
(4) и уксусной кислоты (5) в реак-
ции окисления СН
3
СНО [228]
Pi = ЮОлшрт. ст.; температура 170°С
приводящая к образованию гидропере-
киси, представляющей собой промежуточ-
ное вещество, во второй стадии — реак-
ция
/О О О
/ / /
Из
С —С
+ НзС-С =2НзС—С
\ \ \
о-он н он
в результате которой промежуточное вещество превращается в продукт-
реакции — уксусную кислоту.
Падение давления в первой стадии реакции обусловлено тем, что эта
стадия идет с уменьшением числа молекул (две молекулы, молекула аль-
дегида и молекула 0
2
превращаются в молекулу гидроперекиси и соот-
ветственно три молекулы: две молекулы альдегида и одна молекула 0
2
превращаются в две молекулы кислоты). Вторая стадия реакции (в части,
касающейся превращения гидроперекиси в кислоту) осуществляется без
изменения числа молекул. Однако ввиду того, что одновременно с образо-
ванием уксусной кислоты, СН3СООН, во второй стадии реакции происхо-
дит также более глубокое окисление, приводящее к образованию аналити-
чески обнаруживаемых СО, С0
2
и Н
2
0, эта вторая стадия сопровождается
увеличением давления, так как в итоге число вновь образующихся моле-
кул превышает число реагирующих. Постоянство давления кислорода во

второй стадии реакции свидетельствует о том, что превращение гидро-
перекиси в уксусную кислоту (и продукты глубокого окисления) в этой
стадии реакции происходит без участия свободного кислорода.
Заметим, что написанная выше схема реакции окисления уксусного
альдегида в кислоту формально соответствует одной из схем окисления*
фигурирующих в переписной теории окисления Баха — Энглера (см. [384]).
Согласно этой теории, первая стадия окислительной реакции заключается
в образовании «мольоксида» М0
2
, представляющего собой продукт пря-
мого присоединения молекулы кислорода к молекуле горючего:
О
м + О
а
=М
//
\
о
«Мольоксид» в результате изомеризации превращается в обычную пере-
кись, например,
НзС—С + 0
2
= НзС—СН О—Н
3
С—С
\ \ / \
Н О - о—он
Вторая стадия окислительной реакции, по Энглеру [384], следует схеме:
М0
2
4* М==2МО,
отвечающей в нашем примере реакции
НзС-С + НзС—С = 2Н
3
С-С
\ \ \
О—ОН Н ОН
Что касается действительного механизма реакции окисления уксус-
ного альдегида, то подобно реакциям окисления всех вообще органиче-
ских веществ она протекает по сложному механизму, в котором главную
роль играют свободные радикалы (радикальный механизм) (см. [890
г
891, 1222, 1263]).
Из сложных реакций с ярко выраженной стадийностью укажем еще
реакцию окисления водорода, проводимую в условиях быстрой струи.
Согласно данным анализа, продуктами этой реакции являются вода и пе-
рекись водорода, причем содержание последней в продуктах реакции резко
падает с увеличением времени пребывания смеси в зоне реакции (т), как
это видно, в частности, из рис. 4 [173]. При достаточно малых временах
контакта содержание Н
2
0
2
достигает 85% от общего количества продук-
тов, из чего можно заключить, что первичным продуктом окисления во-
дорода в условиях рассматриваемых опытов является перекись водорода,
превращающаяся в воду в последующие стадии реакции. Механизм окис-
ления водорода будет рассмотрен ниже (§ 43).
Для выяснения кинетических особенностей реакций с последователь-
ными стадиями рассмотрим общий случай последовательной реакции, в ко-
торой вещество А превращается в В, которое в свою очередь превращается
в продукт реакции С,
А —»В С.
Детали кинетики реакций этого типа, естественно, зависят от механизма
каждой из стадий. Однако, имея в виду получение общей кинетической
характеристики реакций, протекающих через последовательные стадии,.

можем ограничиться рассмотрением простейшего случая, когда каждая из
двух стадий реакции представляет собой мономолекулярный про-
цесс. Хороший пример последовательных процессов, каждый из которых
подчиняется мономолекулярному закону, представляют процессы
радиоактивного превращения, наблюдающиеся в радиоактивных
рядах.
Обозначая константы скорости мономолекулярного превращения А
в В и В в С соответственно через к
х
и /с
2
, напишем уравнения реакций в
виде:
d[ А]
dt
d[ В]
dt
d[ С]
dt
= [А],
= A:i [А] — [В], (3.1)
=
/£2
[В].
Вводя, далее, обозначения х= [А]/[А]
0
, у = [В]/[А]
0
и z = [С]/[А]
0
, где
|А]
0
— начальная концентрация исходного вещества А, эти уравнения
перепишем в следующем более простом виде:
dx dy dz
-"1ь=
klX
> ИТ =
klX
- ~Jt = (
3
'
2)
Решая эти уравнения, получим:
х = ехр (— kit),
ki
У
=
къ — кг
^
ехр klt
^
~~
ехр
t
3,3
)
^
1
-
ехр
t-
ы)
+ "л^ЛГ
ехр
ы)
'
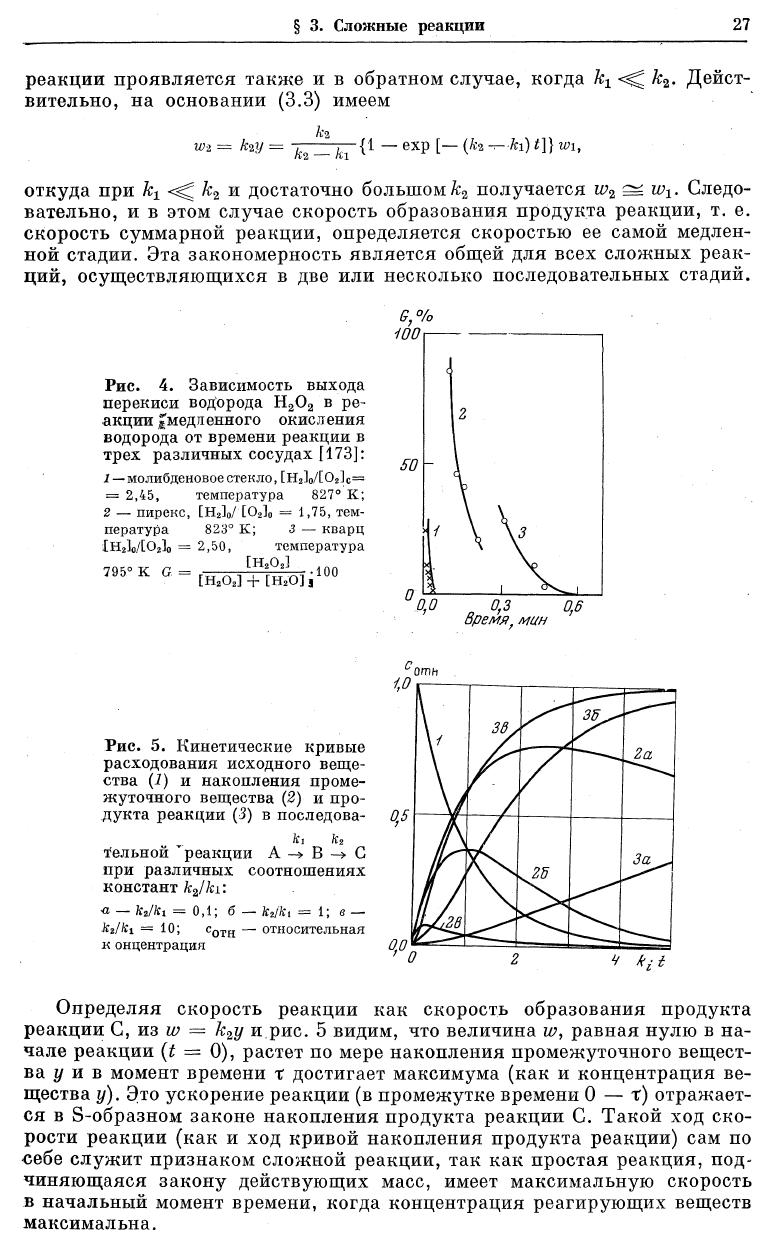
Изменение величин х, у и z во времени, рассчитанное по формулам (3.3)
показано на рис. 5 (для к
2
\к
г
— 0,1; 1 и 10). Нетрудно видеть, что равенст-
во нулю производной dyldt = 0 достигается при том же времени t, что и
равенство нулю d^zldt
2
. Это значит, что кривая у = у (t) имеет максимум
при том же t, при котором кривая z = z (t) имеет точку перегиба. Время
достижения максимума
1
1
Л
а
Подставляя т в выражение для относительной концентрации промежуточ-
ного вещества В, получим
Из анализа этого выражения следует, что величина у
тах
, малая при ма-
лых значениях отношения kjk
2
, растет при увеличении этого отношения,
проходя через значение е"
1
при kjk
2
= 1 и сколь угодно приближаясь
к единице при больших к
1
/к
2
(см. также рис. 6). В этом, последнем случае
вследствие большой скорости первой стадии реакции (А ->- В) и малой ско-
рости второй стадии (В
—>•
С), обе стадии оказываются разделенными во
времени, и реакция протекает так, что сначала все или практически все
исходное вещество А превращается в промежуточное вещество В, после
чего последнее превращается в продукт реакции С.
Таким образом, скорость образования продукта реакции, характери-
зующая скорость суммарной реакции, в этом случае определяется ско-
ростью наиболее медленной второй стадии реакции (лимитирующая ста-
дия), так как к
г
к
2
. Лимитирующая роль наиболее медленной стадии
реакции проявляется также и в обратном случае, когда к
г
к
2
. Дейст-
вительно, на основании (3.3) имеем
w-2
= Ыу =
___
к
{1 — ехр [—
(к* -г-
t]} wi,
откуда при к
2
и достаточно большом fe
2
получается w
2
= щ. Следо-
вательно, и в этом случае скорость образования продукта реакции, т. е.
скорость суммарной реакции, определяется скоростью ее самой медлен-
ной стадии. Эта закономерность является общей для всех сложных реак-
ций, осуществляющихся в две или несколько последовательных стадий.
Рис. 4. Зависимость выхода
перекиси водЪрода Н
2
0
2
в ре-
акции £мед пенного окисления
водорода от времени реакции в
трех различных сосудах [173]:
1 —
молибденовое стекло, [Н
2
]о/[0
2
]с=
= 2,45, температура 827° К;
2 — пирекс, [Н
2
]
0
/ [О
2
]
0
= 1,75, тем-
пература 823° К; 3 — кварц
1Н
2
]о/[0
2
]о = 2,50, температура
[Н
2
0
2
1
795° К G =
[Н
2
0
2
] +
[Н
2
0]
j
100
Л
0,3 0.6
Время, мин
1,0
Рис. 5. Кинетические кривые
расходования исходного веще-
ства (i) и накопления проме-
жуточного вещества (2) и про-
дукта реакции (3) в последова-
ла к
2
тельной 'реакции А В G
при различных соотношениях
констант к
2
/кг.
— кг/кх
= 0,1; б
— kz/ki
=
1; в —
k
2
/ki ==10; с
отн
— относительная
к онцентрация
0,5
0.0*
V
36/
Za
(L&ie
За^.
ч к j t
Определяя скорость реакции как скорость образования продукта
реакции С, из w = к
2
у и рис. 5 видим, что величина w, равная нулю в на-
чале реакции (t = 0), растет по мере накопления промежуточного вещест-
ва у и в момент времени х достигает максимума (как и концентрация ве-
щества у). Это ускорение реакции (в промежутке времени 0 — т) отражает-
ся в S-образном законе накопления продукта реакции С. Такой ход ско-
рости реакции (как и ход кривой накопления продукта реакции) сам по
себе служит признаком сложной реакции, так как простая реакция, под-
чиняющаяся закону действующих масс, имеет максимальную скорость
в начальный момент времени, когда концентрация реагирующих веществ
максимальна.

Нужно, однако, сказать, что при высокой химической активности
промежуточного вещества В (по сравнению с исходным веществом А) и,
следовательно, к
2
к
г
реакции с последовательными стадиями, как пра-
вило, протекают так, что максимум скорости реакции достигается на пер-
вых ее стадиях, т. е. практически в начальный момент времени t = 0.
Поэтому кинетика накопления продукта реакции с последовательными
стадиями в таких случаях отвечает монотонному уменьшению скорости
реакции от максимального значения (при £^0), т. е. отсутствию за-
метного перегиба на кривой z = z (t).
Метод квазистационарных концентраций
Второе слагаемое в выражении для скорости изменения концентрации
промежуточного вещества
dy
чг =
kix
-
равное нулю в начале реакции и увеличивающееся со временем (так как
dyldt 0), в некоторый момент времени становится равным первому сла-
гаемому (уменьшающемуся по мере расходования исходного вещества А).
В этот момент времени (т) будем иметь dyldt = 0. Начиная с этого момента
при достаточно большом к
2
величина dyldt автоматически поддерживается
вблизи нуля. Поэтому можно считать, что при t т приближенно выпол-
няется равенство dyldt
==
0, вследствие чего одно из двух независимых диф-
ференциальных уравнений реакции (3.2) (третье уравнение, ввиду dxldt +
+ dyldt + dzldt = 0, не является независимым), а именно уравнение-
dyldt = к
х
х — к
2
у, мы можем заменить алгебраическим уравнением
к
х
х — к
2
у = 0, что приводит к существенному упрощению математической
задачи вычисления концентраций х, у и z. В рассматриваемом нами слу-
чае приближенные значения концентраций запишутся в виде:
х
—
ехр (— k\t)
y
у = (ki/k*) ехр (— kit), z = 1 — ехр (— kit). (3.5>
Сравнивая уравнения (3.5) и (3.3), легко видеть, что приближенные зна-
чения концентраций тем ближе к их точным значениям (3.3), чем больше
константа к
2
превышает к
г
. При k
2
^>k
t
те и другие совпадают.
Примененный здесь прием, широко используемый в химической кине-
тике, известен под названием метода квазистационарных концентраций.
Этот метод как метод приближенного решения кинетических уравнений
впервые был четко сформулирован Боденштейном [514], хотя в неявном
виде использовался и в более ранних работах других авторов. В дальней-
шем метод квазистационарных концентраций был обобщен Семеновым
[308] и распространен на случай, когда концентрации не всех (обычна
всех, кроме одного) активных центров являются стационарными. Обоб-
щенный метод Семенова иногда называют методом частичных стационарных
концентраций. Метод квазистационарных концентраций оказался осо-
бенно плодотворным при исследовании цепных реакций (см. главу XI).
Отметим также, что часто для реакций, идущих при участии несколь-
ких активных промежуточных веществ, принимаются обладающими ста-
ционарными концентрациями те активные частицы, концентрации кото-
рых малы по сравнению с концентрациями других активных частиц. Этот
вопрос на примере реакции брома с водородом был проанализирован в
работах [1487]. Авторы этих работ показывают, что неправильное в общем
случае заключение о связи стационарности с малостью концентраций в дан-
ной реакции практически всегда выполняется.
Детальное рассмотрение условий применимости метода стационарных
концентраций предпринималось рядом авторов для реакций различных
типов. См., например, работы [305, 365, 846, 958, 1327, 1407]. Были най-
дены случаи, когда условие стационарности заведомо не выполняется
(см., например, [992]).
Представляет интерес найти время установления стационарной концент-
рации (т). Рассмотрим с этой целью реакцию термического распада
озона. Механизм этой реакции слагается из следующих элементарных
процессов [474]:
0з + М^0 + 0
2
+ М (Ал, к-1)
и
0 + 0З = 20
2
(Ла),
где М — любая частица; к
х
, и к
2
— константы скорости соответствую-
щих процессов.
Промежуточным веществом здесь является атомарный кислород,
концентрация которого изменяется согласно уравнению:
=
к± [М]
[0
3
] -
[А-1 [М]
[0
2
] + ft
a
[Оз]] [О].
В начальный период реакции, когда концентрация озона еще мало отли-
чается от начальной концентрации [О
3
]
0
, интегрирование этого уравне-
ния дает:
[О] = [0]
стац
[1-ехр (--*/*)],
где [0]
стац
- ^ШНОзЬт ит- l/(^—i [М][0
2
] + Л
2
[О
8
]
0
).
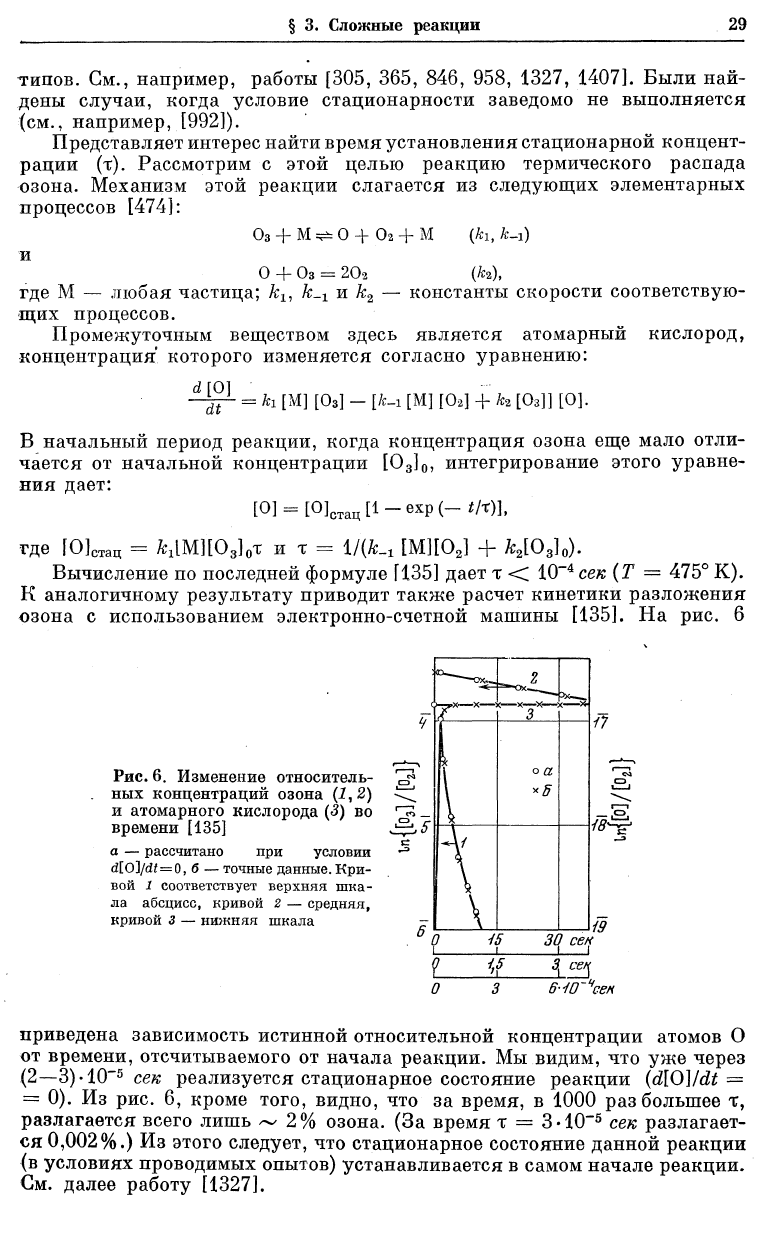
Вычисление по последней формуле [135] дает т < 10сек (Т = 475° К).
К аналогичному результату приводит также расчет кинетики разложения
озона с использованием электронно-счетной машины [135]. На рис. 6
Рис. 6. Изменение относитель-
ных концентраций озона (1,2)
и атомарного кислорода (<?) во
времени [135]
а — рассчитано при условии
d[0]/df = 0, б — точные данные. Кри-
вой 1 соответствует верхняя шка-
ла абсцисс, кривой 2 — средняя,
кривой 3 — нижняя шкала
приведена зависимость истинной относительной концентрации атомов О
от времени, отсчитываемого от начала реакции. Мы видим, что уже через
(2—3)-10~
5
сек реализуется стационарное состояние реакции (d[0]/dt =
= 0). Из рис. 6, кроме того, видно, что за время, в 1000 раз большее т,
разлагается всего лишь ~ 2% озона. (За время т = 3-Ю"
5
сек разлагает-
ся 0,002%.) Из этого следует, что стационарное состояние данной реакции
(в условиях проводимых опытов) устанавливается в самом начале реакции.
См. далее работу [1327].

Параллельные реакции
Наряду с реакциями, протекающими через последовательные стадии,
необходимо различать также параллельные реакции. Простейшим типом
параллельных реакций являются такие реакции, когда одно и то же ис-
ходное вещество А способно реагировать двумя или более независимыми
путями, приводящими к одинаковым или различным продуктам реакции.
Ci
/
А
\
С
2
Параллельно идущие реакции могут быть моно- и бимолекулярными..
Рассмотрим сначала две параллельные мономолекулярные реакции.
Обозначив константы скорости этих реакций через к
х
и будем иметь:
d[ Ci] d[C
2
]
"У"-MA] и = /с
2
[А]. (3.6)
Разделив одно из уравнений на другое и интегрируя, найдем:
[Сз]/[Са] = Ап/Ага, (3.7>
откуда следует, что концентрации (выходы) продуктов параллельно иду-
щих реакций относятся как константы скорости этих реакций. Так как
вещества С
х
и С
2
образуются в результате расходования исходного вещест-
ва А, имеем:
d [A] d [Ci] d ГСа]
- -зг- = + "V = +ш =
к
[ (
3
-
8
>
Следовательно, константа скорости суммарной реакции при параллель-
ном течении двух (или нескольких) реакций равна сумме констант скоро-
сти этих реакций:
к = к\
-f- Аг
2
(^или к = ^ k
i
J .
В качестве примера параллельных мономолекулярных реакций мож-
но указать распад гидроперекиси RCH
2
OOH, который может идти двумя
путями — либо с отщеплением молекулы воды и образованием альдеги-
да, RCH
2
OOH — RCHO + Н
2
0, либо с разрывом связи О — О.
В последнем случае образуются свободный гидроксил и алкоксильный
радикал RCH
2
0, в дальнейшем превращающийся в спирт.
Простейший случай параллельной бимолекулярной реакции может
быть представлен схемой:
Ci
/
А + В
\
С
2
Отношение выходов продуктов в таких реакциях, так же как в рассмотрен-
ном выше примере мономолекулярных параллельных реакций, равно от-
ношению констант скорости параллельных реакций.
Так, для скоростей образования продуктов имеем:
d [Ci] d [С
2
]
= ki [А] [В] И -к_1
=
^
[А
][В], . (3.9)
откуда
£GiI/[Ga] = Ап/Ага. (3.9а)
