Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.


тате взаимодействия активных центров с молекулами, причем акт разветв-
ления представляет собой определенную составную часть цепи реакции.
В реакциях же, относящихся к типу вырожденно-разветвленных, по
Семенову [306], «... основная цепь развивается с обычной скоростью и не
сопровождается разветвлениями в обычно принятом нами смысле... В ре-
зультате реакции в этой первичной цепи образуется не конечный, но
некий промежуточный сравнительно устойчивый продукт реакции, ко-
торый, накопляясь в основном газе, сам далее медленно реагирует неза-
висимым путем, давая конечные продукты. Однако изредка,за счет энер-
гии этой вторичной реакции создаются центры, способные вновь начать
цепь первичной реакции». Эти вторичные цепи Семенов называет цепями
вырожденного разветвления. Вырожденное разветвление иногда называют
также запаздывающим разветвлением.
Представление о вырожденном разветвлении возникло из необходимо-
сти истолкования с позиций цепной теории кинетики многочисленных мед-
ленных реакций, обладающих характерными особенностями разветвлен-
ных цепных реакций. Эти реакции, в частности, подчиняются закону
w ~ ехр ср£ [см. формулу (42.9)], но отличаются необычно медленным раз-
витием цепей.
Отметим, что к числу реакций, следующих цепному механизму с вы-
рожденными разветвлениями, относятся реакции медленного окисления
органических веществ различных классов (в частности, углеводородов)
Предельные явления. Полуостров воспламенения
Характерная особенность разветвленных цепных реакций состоит в
наличии предельных явлений, заключающихся в том, что при незначи-
тельном изменении какого-либо параметра (давления, температуры, со-
става смеси) происходит резкое изменение скорости реакции. Толчком
к открытию разветвленных цепных реакций и послужило изучение одно-
го из таких предельных явлений, а именно явления пределов воспламе-
нения паров фосфора. Сущность этого явления заключается в том, что при
определенном давлении паров фосфора существуют два предела давления
кислорода (верхний и нижний пределы — р
2
и между которыми лежит
область воспламенения фосфора и вне которой, т. е. при р р
2
или при
р < р
г
, пары фосфора не воспламеняются.
Оба предела наблюдались еще в прошлом веке (см. [306, стр. 227]),
однако количественно впервые были изучены Харитоном и Вальта [1056],
Семеновым [1466] и Ковальским [1096]. В результате этих исследований
явления верхнего и нижнего пределов воспламенения паров фосфора
были интерпретированы на основе теории разветвленных цепных реакций
Семенова. В частности, теоретическую интерпретацию [312, глава IX,
§ 2] получила установленная в опытах Ковальского [1096] зависимость
между давлениями кислорода и паров фосфора на нижнем и верхнем пре-
делах, (р
0ш
)
х
= С
1
/(р
р
^)
1
и (р
0
)
2
= (p
P
)JC
2
, (рис. 106), хорошо представ-
ляемая квадратным уравнением С
2
Ро — РрР
02
+ С\ — 0 [312].
Согласно теории Семенова, наличие пределов воспламенения есть
прямое следствие особенностей кинетики и механизма разветвленной цеп-
ной реакции. Выше мы видели, что при еа 1 (простая цепная реакция)
скорость реакции с течением времени стремится к постоянной величине
w —
WQ
а/(1 — еа) (скорость стационарной реакции). В случае разветв-
ленной цепной реакции (еа > 1) выражение для скорости реакции (39.12)
принимает ви#
W = , (ехр — 1), (42.3)
еа
—
1

где
ф =(v
x
+
27а) (все —
1).
(42.4)
При достаточно больших t 1/ф) выражение (42.3) можно представить
в виде:
(42.5)
ехрф£ = ^1ехр фt.
га —
1
ф
Как уже было отмечено, закону w ~ ехр ф£ (закон Семенова) подчиня-
ются также и цепные реакции, протекающие по механизму вырожден-
ных разветвлений. Действительно, обозначив активный центр, ведущий
основную цепь реакции, буквой А и способное изредка давать вырожден-
ные разветвления промежуточное вещество буквой X, в этом случае кроме
кинетического уравнения для концентрации активного центра А (п)
dn
~dt
= Wi)
—
2/2 п
-f-
V3 х
(42.6)
[см. уравнение (39.5)] мы будем иметь уравнение для концентрации про-
межуточного вещества X (х)
dx
_
dt
: =
V\n
—
(V3
+ V4) X,
(42.7)
где v
3
и г;
4
— частоты процессов, приводящих к расходованию вещества X,
причем скорость образования А в результате вырожденного разветвления
принята равной v
3
x.
2,0 1,0 0,0 i
9
0 igp
Q
Рис. 106. Область воспламе-
нения паров фосфора [1096]
Считая концентрацию активного центра А стационарной и пренебре-
гая расходованием исходных веществ, в результате интегрирования урав-
нения для х получим
vi ехр
ф£
— 1
х = w о.
VI
,Ф
(42.8)
где ф = (v
3
vjv
2
) — (г;
3
+ При достаточно больших t для скорости реак-
ции получим
w — vz (—)
2
~ ехр ф£,
/ Ф
(42.9)
формулу, сходную с полученной выше формулой (42.5).
Закон (42.5), установленный теоретическим путем Семеновым, получил
экспериментальное подтверждение в огромном числе опытов, относящихся
к разнообразным химическим реакциям. Вытекающий из этого закона
экспоненциальный рост скорости реакции со временем (автокаталитиче-
ский разгон реакции) служит характерным признаком разветвленных
цепных реакций.
Увеличиваясь по закону w ~ ехр фt, скорость разветвленно-цепной.
реакции по истечении некоторого промежутка времени может стать на-
столько большой, что реакция приобретает характер взрыва
7
. Это, однако,
будет иметь место лишь в том случае, если величина ср (42.4) будет поло-
жительной (еа 1) не только в начальный момент времени, но на протя-
жении всей реакции. Изменение знака ср в процессе реакции может быть
связано с изменением соотношения между скоростями процессов разветв-
ления и обрыва цепей. Подставляя в выражение (42.4) 8=1 б и заме-
чая, что а = У]/(1>1 + v
2
) и р = 1 — а = v
2
/(v! + у
2
), получаем
ф = бг;
х
— 272. (42.10)
Частота процесса, приводящего к разветвлению, т. е. величина бпро-
порциональна концентрации одного из исходных веществ; поэтому в слу-
чае изотермического процесса эта величина должна уменьшаться с тече-
нием времени, т. е. по мере расходования реагирующих веществ. Частота
процессов, приводящих к обрыву цепей, у
а
либо остается без изменения,
либо может расти в результате накопления образующихся в ходе реакции
веществ, способствующих обрыву цепей. Так, например, в реакции горе-
ния водорода вероятность объемного обрыва цепей увеличивается по мере
образования воды, так как молекулы воды являются более эффективным
партнером приводящего к объемному обрыву цепей тройного соударения
Н + 0
2
+ Н
2
0 = Н
2
0 + Н0
2
, нежели молекулы водорода или кислоро-
да. В результате уменьшения величины 8и
г
или уменьшения 8v
1
при
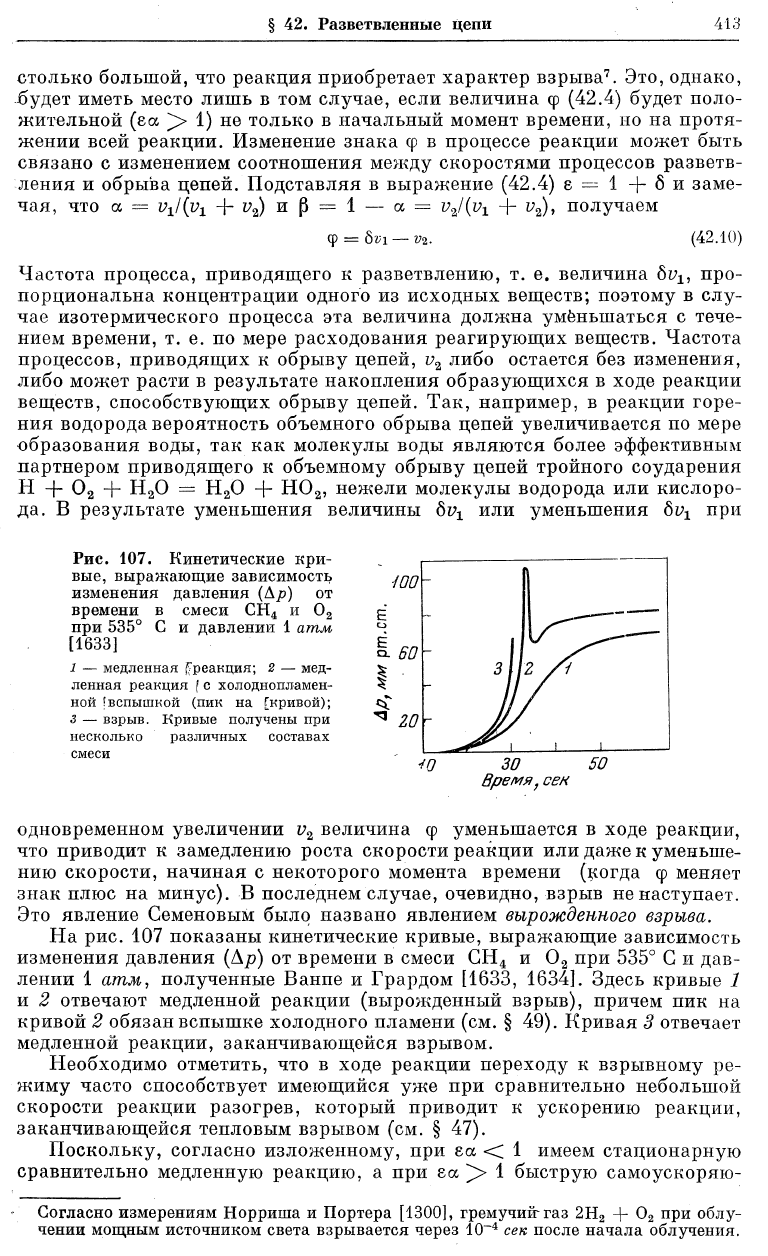
Рис. 107. Кинетические кри-
вые, выражающие зависимость
изменения давления (Ар) от
времени в смеси СН
4
и 0
2
при 535° С и давлении 1 атм
[1633]
1 — медленная ^реакция; 2 — мед-
ленная реакция
f
с холодноплемен-
ной [вспышкой (пик на [кривой);
3 — взрыв. Кривые получены при
несколько различных составах
смеси
одновременном увеличении v
2
величина ср уменьшается в ходе реакции,
что приводит к замедлению роста скорости реакции или даже к уменьше-
нию скорости, начиная с некоторого момента времени (когда ср меняет
знак плюс на минус). В последнем случае, очевидно, взрыв не наступает.
Это явление Семеновым было названо явлением вырожденного взрыва.
На рис. 107 показаны кинетические кривые, выражающие зависимость
изменения давления (Др) от времени в смеси СН
4
и 0
2
при 535° С и дав-
лении 1 атм, полученные Ванпе и Грардом [1633, 1634]. Здесь кривые 1
и 2 отвечают медленной реакции (вырожденный взрыв), причем пик на
кривой 2 обязан вспышке холодного пламени (см. § 49). Кривая 3 отвечает
медленной реакции, заканчивающейся взрывом.
Необходимо отметить, что в ходе реакции переходу к взрывному ре-
жиму часто способствует имеющийся уже при сравнительно небольшой
скорости реакции разогрев, который приводит к ускорению реакции,
заканчивающейся тепловым взрывом (см. § 47).
Поскольку, согласно изложенному, при га < 1 имеем стационарную
сравнительно медленную реакцию, а при га 1 быструю самоускоряю-
Согласно измерениям Норриша и Портера [1300], гремучий газ 2Н
2
+ 0
2
при облу-
чении мощным источником света взрывается через 10"~
4
сек после начала облучения.

щуюся реакцию, переходящую во взрыв, условие перехода от стационар-
ного режима к нестационарному, т. е. условие предела (пределов) воспла-
менения, можем сформулировать в виде:
еа = 1. (42.11 >
Подставляя в эту формулу г = 1 +6, представим ее в следующем виде:
6а = |3,
или, ввиду того что а = vjfa + v
2
) и Р =
v
J{
v
i + ^2)?
в ви
Де:
бг?1
=
V2.
Положив
VI —
ар и
V2
=
bp
2
+
Ь
г
(в выражении для v
2
первый член отвечает объемному обрыву цепей, сле-
дующему механизму тройного соударения, второй член — обрыву цепей
на стенках, причем имеется в виду кинетическая область), приводим фор-
мулу — и
2
к квадратному уравнению
Решая это уравнение, получаем следующие значения давления
(р
г
) и верхнем (р
2
) пределах воспламенения:
Рх
2 b V 4b
2
b
и
P2
= fifl
+
-i/ew __
(42 13J
2b^ V № b
v
'
Приближенные значения давлений на нижнем и верхнем пределах вос-
пламенения можно получить, считая, что вблизи нижнего предела вос-
пламенения преобладает обрыв цепей; на стенках (член Ър
2
мал по сравне-
нию с членом &'), а вблизи верхнего предела цепи обрываются преимуще-
ственно в объеме (bp
2
Ъ'). Таким путем получаем
Р1
~Ъ'1Ъа (42.14)
и
ръ~6а/Ъ. (42.15)
Заметим, что согласно (42.12) и (42.13),
Pi +
P2
=
SaIb.
(42.16)
Величины р
1
и р
2
должны определенным образом зависеть от температу-
ры. Ввиду того что константа а, которую можно назвать константой ско-
рости продолжения цепи, растет с температурой, как и вероятность раз
ветвления б, а константа Ъ, пропорциональная константе скорости три-
молекулярного процесса, от температуры зависит слабо, как и константа
скорости обрыва цепей на стенках V, величина p
t
ж Ь'!Ьа должна умень-
шаться, а величина р
2
ж ба/Ъ увеличиваться с повышением температуры.
Следовательно, при понижении температуры р
г
и р
2
должны все более
и более сближаться и при некоторой температуре, определяемой усло-
вием б
2
а
2
/Ь
2
= Ab'/b, иметь совпадающие значения
Pm = P, = P. = YT-
(42Л7)
Указанный ход величин р
х
и р
2
с температурой показан на рис. 108,
относящемся к реакции горения водорода л взятом из работы Коппа,
Ковальского, Загулина и Семенова [111], являющейся пионерской работой
на нижнем
(42.12)
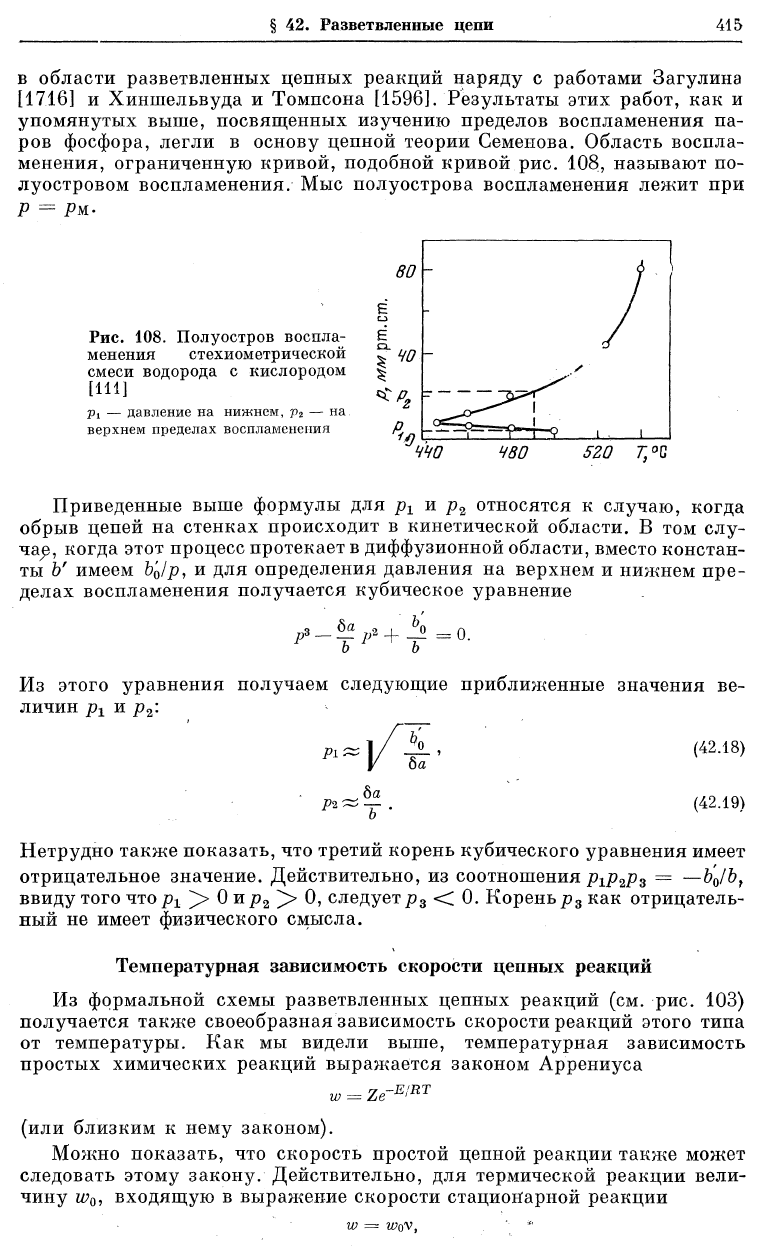
в области разветвленных цепных реакций наряду с работами Загулина
[1716] и Хиншельвуда и Томпсона [1596]. Результаты этих работ, как и
упомянутых выше, посвященных изучению пределов воспламенения па-
ров фосфора, легли в основу цепной теории Семенова. Область воспла-
менения, ограниченную кривой, подобной кривой рис. 108, называют по-
луостровом воспламенения. Мыс полуострова воспламенения лежит при
Р = Рш-
Рис. 108. Полуостров воспла-
менения стехиометрической
смеси водорода с кислородом
[111]
Pi — давление на нижнем, р
2
— на
верхнем пределах воспламенения
ччо
480
5ZQ L°G
Приведенные выше формулы для р
г
и р
2
относятся к случаю, когда
обрыв цепей на стенках происходит в кинетической области. В том слу-
чар, когда этот процесс протекает в диффузионной области, вместо констан-
ты V имеем Ь'
0
/р, и для определения давления на верхнем и нижнем пре-
делах воспламенения получается кубическое уравнение
Р
3
-^
Р*
+ = 0.
Ъ Ъ
Из этого уравнения получаем следующие приближенные значения ве-
личин р
1
и р
2
:
А., (42.18)
б а
' . (42.19)
b
Нетрудно также показать, что третий корень кубического уравнения имеет
отрицательное значение. Действительно, из соотношения Р\РъР
3
= —bjb,
ввиду того что Pi 0 и р
2
0, следует р
3
< 0. Корень р
3
как отрицатель-
ный не имеет физического смысла.
Температурная зависимость скорости цепных реакций
Из формальной схемы разветвленных цепных реакций (см. рис. 103)
получается также своеобразная зависимость скорости реакций этого типа
от температуры. Как мы видели выше, температурная зависимость
простых химических реакций выражается законом Аррениуса
w = Ze~
E
i
RT
(или близким к нему законом).
Можно показать, что скорость простой цепной реакции также может
следовать этому закону. Действительно, для термической реакции вели-
чину w
0
, входящую в выражение скорости стационарной реакции
W = WQV, '

можем положить равной w
0
= Z
0
ехр (—EJRT). Подставляя далее в вы-
ражение для длины цепи v = а/(5 = v
±
/u
2
, v
±
= а
х
ехр (—EJRT) и v
2
=
= а
2
ехр (—EJRT), получаем
V =
Vo
ехр [— (#i - Я
2
)/ЛГ] ,1
где v
0
=-а
1
/а
2
. Заметим, что выражаемая этой формулой температурная
зависимость длины цепи V получается также из опыта, причем разность
Е
х
— Е
2
оказывается больше нуля (или близкой к нулю). Таким образом,
из выражений для w
Q
и v получаем дя скорости простой цепной реакции
формулу
W = ZoVo ехр [— (Ео + Ei — E
2
)/RT] = Z
0
v
0
ехр
(—E/RT)
(Е — EQ -j- Ei — E
2
). Как видно из этой формулы, температурная зави-
симость скорости реакции в данном случае выражается законом Аррениу-
са, как и скорость простой химической реакции.
В отличие от этих двух случаев для разветвленной цепной реакции
нужно ожидать иную зависимость скорости реакции от температуры.
Действительно, воспользовавшись полученными ранее значениями вели-
чин w
0
и v, входящих в выражение скорости стационарной разветвлен-
но-цепной реакции
V
W = Wo —
1 — 6v '
и приняв вероятность разветвления
б = 6э ехр (-A/RT),
получим:
w =
ZoVo
ех
Р ( E/RT)
1 — 5oVo ехр [— (А + Ei — Еъ)ЩГ\ '
т. е. закон, отличный от закона Аррениуса.
Заметим, что иногда при теоретической обработке экспериментальных
данных делаются попытки представить температурную зависимость ско-
рости разветвленной цепной реакции законом Аррениуса. Эти попытки
обычно приводят к возможности применения закона Аррениуса лишь в
сравнительно узком температурном интервале. В широком интервале тем-
пературы «кажущаяся», или «эффективная энергия активации» Е*, вхо-
дящая в эмпирическое выражение скорости реакции
w — Z ехр (—E*/RT),
зависит от температуры, а именно растет с увеличением Т. Скорость реак-
ции при этом также увеличивается и при некотором значении Т = Г
кр
—
критической температуре взрыва — становится равной бесконечности.
' Условием взрыва является равенство нулю знаменателя в выражении
для w, т. е. равенство
б
)Vo
ехр [- (Д -4-El —
E<z)JRT]
= 1. (42.20)
Это равенство вместе с тем определяет критическую температуру взрыва.
Заметим, что в результате измерения концентрации гидроксила в раз-
реженных кислородных пламенах Н
2
и СО для этих реакций установлена
пропорциональная зависимость между суммарной скоростью реакции
и скоростью процесса ОН + Н
2
= Н
2
0 + Н [173, стр. 17]
8
и соответ-
Этот результат находит подтверждение в данных Фенимора и Джонса [765], которые
нашли, что средняя скорость расходования молекулярного кислорода в водородном
пламени равна скорости процесса Н + 0
2
= ОН + О. Приняв концентрации О и
ОН стационарными, можно показать, что скорость этого процесса пропорциональна
скорости процесса ОН +^Н
2
= Н
2
0 + Н.

ственно ОН + СО = С0
2
+ Н [188], которые являются главными (в дан-
ных условиях практически единственными) процессами, приводящими к
образованию продукта реакции. В рамках выполнимости указанного соот-
ношения между скоростями реакций температурная зависимость суммар-
ной скорости реакции, очевидно, должна следовать закону Аррениуса.
Не исключено, что аналогичные соотношения имеют место и в случае ря-
да других реакций (при определенных условиях их протекания).
Роль посторонних примесей в цепных реакциях
Выше (см. § 3) было рассмотрено действие посторонних примесей на
течение химических реакций (<гомогенный катализ). Действие примесей
как ускоряющих (положительный катализ), так и тормозящих реакцию
(отрицательный катализ) особенно велико в случае цепных реакций.
Ускоряющее действие в большинстве случаев заключается в облегчении
зарождения цепей или в появлении разветвлений, не имеющих места или
маловероятных в отсутствие примесей. Таково действие различного рода
инициирующих добавок, обычно представляющих собой вещества, легко
распадающиеся на свободные атомы или радикалы. В случае разветвленных
цепных реакций действие таких добавок приводит к расширению области
воспламенения, как это, например, наблюдается при добавлении неболь-
ших количеств двуокиси азота к гремучей смеси: согласно данным Налбан-
дяна [242], добавление 0,008% N0
2
приблизительно вдвое повышает верх-
ний предел воспламенения (в интервале температур 440—475° С); добавка в
0,24% N0
2
приводит к понижению температуры воспламенения на 100°
(от 470 до 370° С, при давлении смеси ~ 20 мм рт. ст.). Согласно Семено-
ву [312, стр. 560] расширение пределов воспламенения в данном случае,
по-видимому, связано с процессом NO + Н0
2
= N0
2
+ ОН (присутст-
вие NO в' смеси обусловлено равновесием 2N0
2
^ 2NO + 0
2
).
Однако дальнейшее увеличение N0
2
, добавляемого в смесь 2Н
2
+
+ 0
2
, приводит к сужению пределов воспламенения [242], т. е. к замед-
лению реакции, что, возмояшо, нужно приписать быстрой реакции Н +
N0
2
= ОН+ NO, в результате которой атомы водорода заменяются
на не способные к разветвлениям цепей радикалы ОН.
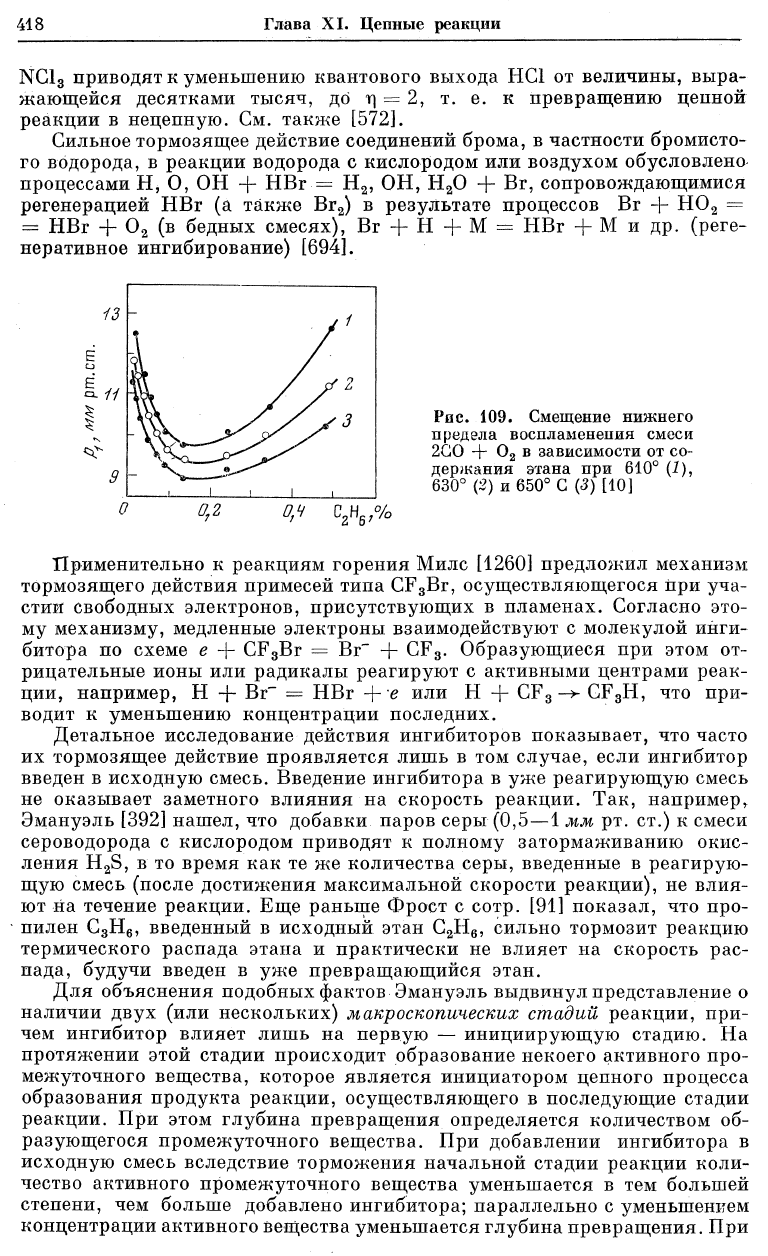
Такое же двойственное действие добавок, зависящее от их концентра-
ции, было установлено при горении окиси углерода в присутствии углево-
дородов [10]. На рис. 109 показан нижний предел воспламенения смеси
2СО + 0
2
при трех температурах в зависимости от содержания добавляемо-
го этана [10]. Это двойственное действие этана можно объяснить наличием
двух конкурирующих процессов — ускоряющего реакцию процесса О +
+ С
2
Н
6
= ОН С
2
Н
5
и замедляющего — Н + С
2
Н
6
— Н
2
+ С
2
Н
б
.
Тормозящее действие примесей (ингибиторов) на цепные реакции в
большом числе случаев сводится к обрыву цепей, обусловленному гибе-
лью активных центров, в результате чего длина цепи может уменьшиться
настолько, что реакция потеряет цепной характер. В качестве одного из
примеров такого именно механизма действия ингибиторов приведем от-
меченное выше (см. § 41) тормозящее действие кислорода на реакцию
хлора с водородом [27]. При изучении действия азота и кислорода на ско-
рость образования НС1 Маркевич [233] показал, что в отличие от азота
примесь кислорода сильно уменьшает скорость реакции, что объясняется
обрывом цепей в результате реакции атомов хлора с молекулами кислоро-
да. По-видимому, таков же (возможно, связанный также с гибелью ато-
мов водорода) механизм действия на эту реакцию треххлористого азота
NC1
3
, являющегося одним из наиболее активных ингибиторов реакции хло-
ра с водородом. Согласно данным работы [888], ничтожные количества
27 В. Н. Кондратьев, Е. Е. Никитин
NC1
3
приводят к уменьшению квантового выхода НС1 от величины, выра-
жающейся десятками тысяч, до г) == 2, т. е. к превращению ценной
реакции в нецепную. См. также [572].
Сильное тормозящее действие соединений брома, в частности бромисто-
го водорода, в реакции водорода с кислородом или воздухом обусловлено
процессами Н, О, ОН + НВг = Н
2
, ОН, Н
2
0 + Вг, сопровождающимися
регенерацией НВг (а также Вг
2
) в результате процессов Вг + Н0
2
=
— НВг + 0
2
(в бедных смесях), Br + Н + М = НВг + М и др. (реге-
неративное ингибирование) [694].
0,4 С
2
н
6
,%
Рос. 109. Смещение нижнего
предела воспламенения смеси
2GO + 0
2
в зависимости от со-
держания этана при 610° (1),
630° (2) и 650° С (3) [10]
Применительно к реакциям горения Миле [1260] предложил механизм
тормозящего действия примесей типа CF
3
Br, осуществляющегося при уча-
стии свободных электронов, присутствующих в пламенах. Согласно это-
му механизму, медленные электроны взаимодействуют с молекулой инги-
битора по схеме е + CF
3
Br = Br" + CF
3
. Образующиеся при этом от-
рицательные ионы или радикалы реагируют с активными центрами реак-
ции, например, Н + Вг*" = НВг +'е или Н + CF
3
CF
3
H, что при-
водит к уменьшению концентрации последних.
Детальное исследование действия ингибиторов показывает, что часто
их тормозящее действие проявляется лишь в том случае, если ингибитор
введен в исходную смесь. Введение ингибитора в уже реагирующую смесь
не оказывает заметного влияния на скорость реакции. Так, например,
Эмануэль [392] нашел, что добавки паров серы (0,5—1 мм рт. ст.) к смеси
сероводорода с кислородом приводят к полному затормаживанию окис-
ления H
2
S, в то время как те же количества серы, введенные в реагирую-
щую смесь (после достижения максимальной скорости реакции), не влия-
ют на течение реакции. Еще раньше Фрост с сотр. [91] показал, что про-
пилен С
3
Н
6
, введенный в исходный этан С
2
Н
6
, сильно тормозит реакцию
термического распада этана и практически не влияет на скорость рас-
пада, будучи введен в уже превращающийся этан.
Для объяснения подобных фактов Эмануэль выдвинул представление о
наличии двух (или нескольких) макроскопических стадий реакции, при-
чем ингибитор влияет лишь на первую — инициирующую стадию. На
протяжении этой стадии происходит образование некоего активного про-
межуточного вещества, которое является инициатором цепного процесса
образования продукта реакции, осуществляющего в последующие стадии
реакции. При этом глубина превращения определяется количеством об-
разующегося промежуточного вещества. При добавлении ингибитора в
исходную смесь вследствие торможения начальной стадии реакции коли-
чество активного промежуточного вещества уменьшается в тем большей
степени, чем больше добавлено ингибитора; параллельно с уменьшением
концентрации активного вещества уменьшается глубина превращения. При
предельной концентрации ингибитора инициирующая стадия реакции
полностью оказывается заторможенной, активное вещество не образуется,
вследствие чего не образуется и конечный продукт реакции.
Представление о наличии инициирующей стадии гомогенно-каталити-
ческих реакций, за которой следуют стадии, приводящие к конечному про-
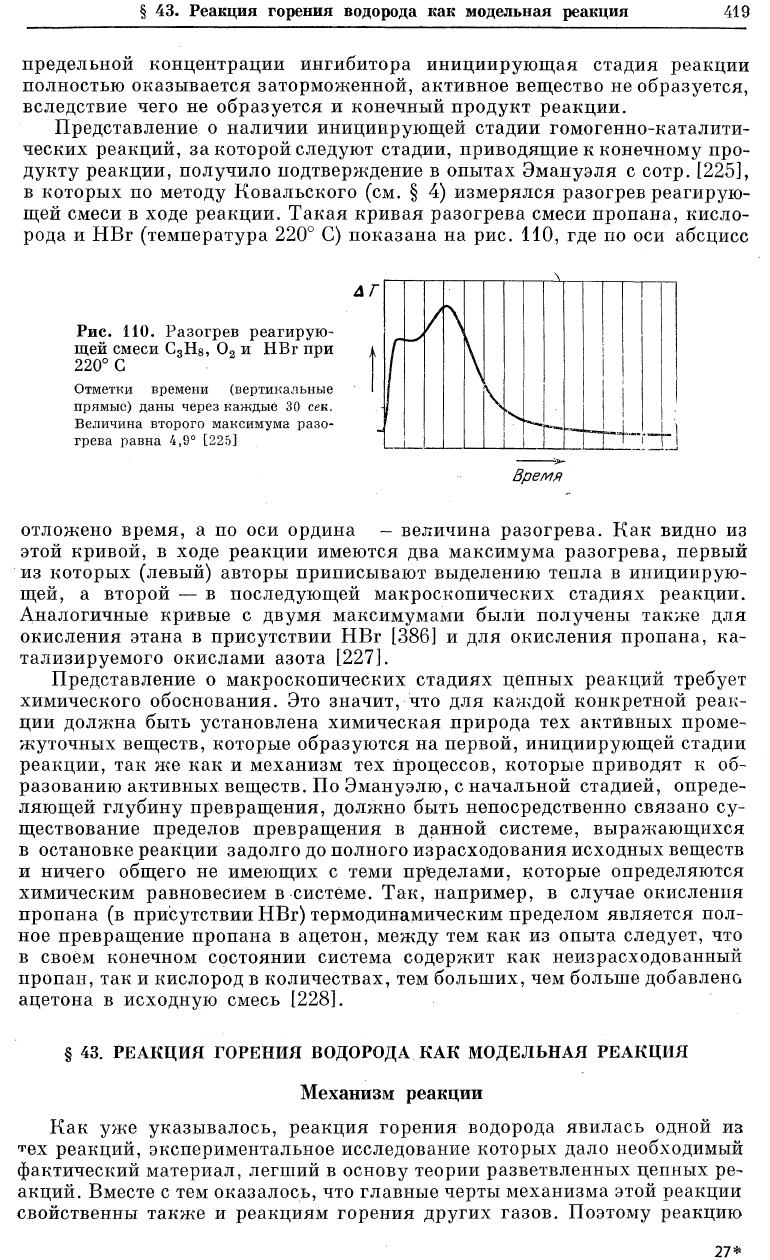
дукту реакции, получило подтверждение в опытах Эмануэля с сотр. [225],
в которых по методу Ковальского (см. § 4) измерялся разогрев реагирую-
щей смеси в ходе реакции. Такая кривая разогрева смеси пропана, кисло-
рода и НВг (температура 220° С) показана на рис. НО, где по оси абсцисс
Л Г
Рис. 110. Разогрев реагирую-
щей смеси С
3
Н
8
, 0
2
и НВг при
ч
220° С
Отметки времени (вертикальные
прямые) даны через каждые 30 сек.
Величина второго максимума разо-
грева равна 4,9° [225]
отложено время, а по оси ордина - величина разогрева. Как видно из
этой кривой, в ходе реакции имеются два максимума разогрева, первый
из которых (левый) авторы приписывают выделению тепла в инициирую-
щей, а второй — в последующей макроскопических стадиях реакции.
Аналогичные кривые с двумя максимумами были получены также для
окисления этана в присутствии НВг [386] и для окисления пропана, ка-
тализируемого окислами азота [227].
Представление о макроскопических стадиях цепных реакций требует
химического обоснования. Это значит, что для каждой конкретной реак-
ции должна быть установлена химическая природа тех активных проме-
жуточных веществ, которые образуются на первой, инициирующей стадии
реакции, так же как и механизм тех процессов, которые приводят к об-
разованию активных веществ. По Эмануэлю, с начальной стадией, опреде-
ляющей глубину превращения, должно быть непосредственно связано су-
ществование пределов превращения в данной системе, выражающихся
в остановке реакции задолго до полного израсходования исходных веществ
и ничего общего не имеющих с теми пределами, которые определяются
химическим равновесием в системе. Так, например, в случае окисления
пропана (в присутствии НВг) термодинамическим пределом является пол-
ное превращение пропана в ацетон, между тем как из опыта следует, что
в своем конечном состоянии система содержит как неизрасходованный
пропан, так и кислород в количествах, тем больших, чем больше добавлена
ацетона в исходную смесь [228].
§ 43. РЕАКЦИЯ ГОРЕНИЯ ВОДОРОДА КАК МОДЕЛЬНАЯ РЕАКЦИЯ
Механизм реакции
Как уже указывалось, реакция горения водорода явилась одной из
тех реакций, экспериментальное исследование которых дало необходимый
фактический материал, легший в основу теории разветвленных цепных ре-
акций. Вместе с тем оказалось, что главные черты механизма этой реакции
свойственны также и реакциям горения других газов. Поэтому реакцию
/
fit
л
\
\
\
4--
Время

горения водорода нужно рассматривать как модельную реакцию, в той или
иной мере представляющую реакцию горения вообще. Это оправдывает
более подробное рассмотрение реакции горения водорода, чему в основ-
ном посвящен этот параграф.
В настоящее время нужно считать наиболее точно представляющими
действительный механизм горения водорода следующие элементарные
зарождение цепей
продолжение цепи
разветвление цепей
гетерогенный обрыв цепей
обрыв цепей в объеме
обрыв цепей в объеме при гибели на стен-
ке радикала НОа
(15)
НОа
+ Н
а
^ Н2О2 + Н - 16,0 ккал,
(16) НСЬ + На Н
2
0 + ОН + 52,5 ккал, продолжение цепи через радикал НОг
(17) Н0
2
+ Н
2
0 ^ Н
2
0
2
+ ОН — 30,7 ккал,
(18) НО-2 + НОа ^ И
2
0
2
+ Оа + 40,4 ккал,
(19) Н + НО2 ОН + ОН + 37,8 ккал, квадратичное разветвление
(20) Н + Н0
2
^ Н
2
0 + О + 54,4 ккал,
(21) Н + Н0
2
=^ Нг + 0
2
+ 56,3 ккал
%
квадратичная гибель Н
(22) О + Н0
2
^ ОН + 0
2
+ 54,4 ккал,
(23) Н + И2О2 ^ Н2О + ОН + 68,4 ккал, замена активных частиц
(24) О + Н2О2 ^ ОН + Н0
2
+ 14,1 ккал. на менее активные
Согласно этому механизму, активными центрами реакции горения
водорода являются атомы водорода и кислорода и радикалы ОН и Н0
2
.
Все четыре активных центра [782, 783, 983, 1001] были обнаружены в зо-
не горения водорода непосредственно, причем измеренная концентрация
атомов водорода [190, 191, 274], атомов кислорода [23] и радикалов
ОН [24, 173, 182] оказалась в сотни и тысячи раз превышающей равно-
весную концентрацию этих частиц, т. е. ту концентрацию, какая имелась
бы, если бы все вещества, присутствующие в пламени, находились между
«собой в равновесии.
Относительно отдельных входящих в механизм реакции элементар-
ных процессов можно сказать следующее. Достоверно неизвестно, проте-
кает ли зарождающий цепь процесс в объеме или на поверхности. Мед-
процессы:
(0) И
2
+• 0
2
^ ОН + ОН — 18,6 ккал,
(1) ОН + Н
3
^ Н
2
0 + Н + 1Ь,Цккал,
(2) Н + 0
2
^ ОН + О — 16,6 ккал,
(3) О + Н
2
^ ОН + Н — 1,9 ккал,
(4) О + НаО ^ ОН + ОН — 16,6 ккал,
(5) Н
(6) о—^Х
(7) он
(8) Н + Н + М^Н
2
>М,
(9) О + О+М^Оа+М,
(10) ОН 4- Н +
М
^
НаО
+ м,
(И) ОН + ОН + м ^ НаОа 4- М,
(12) OHJ+
О
+
М
^ Н0
2
+ м,
(13) Н + Оа+М^НОа + М
(14) НОа™, '
