Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.

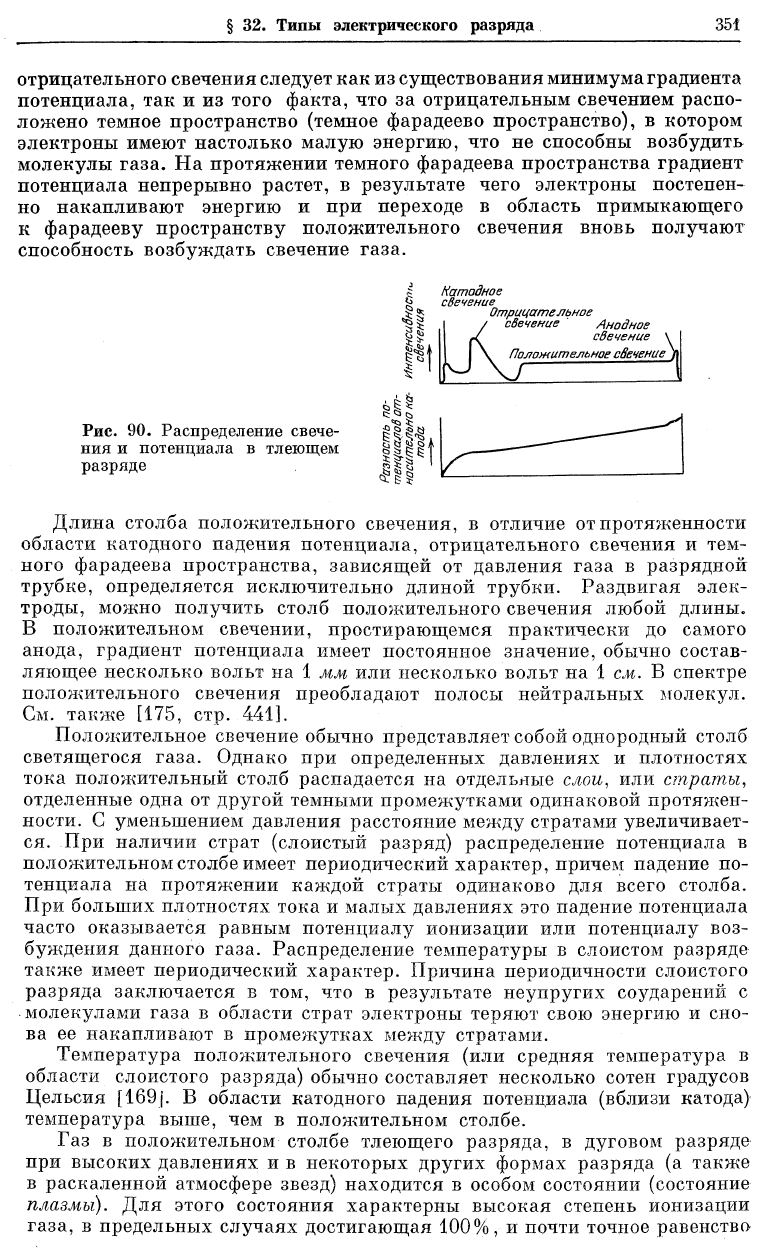
отрицательного свечения следует как из существования минимума градиента
потенциала, так и из того факта, что за отрицательным свечением распо-
ложено темное пространство (темное фарадеево пространство), в котором
электроны имеют настолько малую энергию, что не способны возбудить
молекулы газа. На протяжении темного фарадеева пространства градиент
потенциала непрерывно растет, в результате чего электроны постепен-
но накапливают энергию и при переходе в область примыкающего
к фарадееву пространству положительного свечения вновь получают
способность возбуждать свечение газа.
Длина столба положительного свечения, в отличие от протяженности
области катодного падения потенциала, отрицательного свечения и тем-
ного фарадеева пространства, зависящей от давления газа в разрядной
трубке, определяется исключительно длиной трубки. Раздвигая элек-
троды, можно получить столб положительного свечения любой длины.
В положительном свечении, простирающемся практически до самого
анода, градиент потенциала имеет постоянное значение, обычно состав-
ляющее несколько вольт на 1 мм или несколько вольт на 1 см. В спектре
положительного свечения преобладают полосы нейтральных молекул.
См. также [175, стр. 441].
Положительное свечение обычно представляет собой однородный столб
светящегося газа. Однако при определенных давлениях и плотностях
тока положительный столб распадается на отдельные слои, или страты,
отделенные одна от другой темными промежутками одинаковой протяжен-
ности. С уменьшением давления расстояние между стратами увеличивает-
ся. При наличии страт (слоистый разряд) распределение потенциала в
положительном столбе имеет периодический характер, причем падение по-
тенциала на протяжении каждой страты одинаково для всего столба.
При больших плотностях тока и малых давлениях это падение потенциала
часто оказывается равным потенциалу ионизации или потенциалу воз-
буждения данного газа. Распределение температуры в слоистом разряде
также имеет периодический характер. Причина периодичности слоистого
разряда заключается в том, что в результате иеупругих соударений с
молекулами газа в области страт электроны теряют свою энергию и сно-
ва ее накапливают в промежутках между стратами.
Температура положительного свечения (или средняя температура в
области слоистого разряда) обычно составляет несколько сотен градусов
Цельсия [169j. В области катодного падения потенциала (вблизи катода)
температура выше, чем в положительном столбе.
Газ в положительном столбе тлеющего разряда, в дуговом разряде
при высоких давлениях и в некоторых других формах разряда (а также
в раскаленной атмосфере звезд) находится в особом состоянии (состояние
плазмы). Для этого состояния характерны высокая степень ионизации
газа, в предельных случаях достигающая 100%, и почти точное равенство
4 Катодное
& свечение
£ Ос
Пгг
Рис. 90. Распределение свече-
ния и потенциала в тлеющем
разряде

нулю средней плотности электричества, т. е. равенство средних концент-
раций электронов и ионов. Взаимное притяжение электронов и ионов,
а также поляризационное взаимодействие (притяжение) свободных за-
рядов и нейтральных молекул (при неполной ионизации газа) приводят
к тому, что плазма представляет собой некоторую единую систему взаи-
модействующих частиц, обладающую специфическими свойствами.
Плазма может быть изотермической и неизотермической. В изотерми-
ческой плазме электроны и ионы находятся в термодинамическом равно-
весии. Таково состояние плазмы, возникающей при высоких темпера-
турах газа, например, в атмосфере звезд, а также в электрической дуге
при высоких давлениях и в канале искрового разряда. В неизотерми-
ческой плазме, ввиду затрудненности обмена энергии при соударениях
электронов с молекулами и ионами, средняя энергия электронов значи-
тельно превышает среднюю энергию ионов и молекул газа. Допуская
максвелловское распределение скоростей электронов, можно говорить об
их температуре (электронная температура). Различие в энергии электро-
нов и ионов таково, что если в положительном столбе тлеющего разряда
газ, т. е. молекулы и ионы, имеет температуру порядка нескольких сотен
градусов Цельсия, то электронная температура является величиной по-
рядка тысяч и десятков тысяч градусов и более.
Различаются также высокотемпературная и низкотемпературная
плазмы. Для первой характерны температуры, достигающие сотен тысяч
градусов, и физические процессы ионизации и возбуждения частиц,
практически являющихся атомами и ионами, возникшими в результате
распада молекул. Низкотемпературная плазма характеризует состояние
газа в пламенах, в ударных трубах, в электрическом разряде при высоких
давлениях. Для низкотемпературной плазмы, которая представляет наи-
больший интерес для химической кинетики, характерно протекание в
ней химических процессов. При вызванном последними значительном
нарушении равновесного распределения энергии в газе плазма является
неизотермической.
В положительном столбе тлеющего разряда обычного типа имеем сле-
дующие условия: как правило, низкое давление (обычно порядка
0,1 —
100 мм рт. ст.), среднюю температуру газа (порядка нескольких сотен
градусов Цельсия) и высокую «электронную температуру». Эти условия
близки к условиям протекания фотохимических реакций, где роль быст-
рых электронов играют кванты фотохимически активного света. При этом
по их средней энергии быстрые электроны скорее соответствуют квантам
жесткого излучения (далекий ультрафиолет). Поэтому тлеющий разряд
должен благоприятствовать эндотермическим реакциям, т. е. химическим
реакциям, в которых основную роль играют процессы разложения моле-
кул, как, например, 2СН
4
= С
2
Н
2
+ ЗН
2
(— 86,3 ккал), СН
4
+ С0
2
=
= 2СО + 2Н
2
(-55,6 ккал), СН
4
+ Н
2
0 = СО + ЗН
2
(-45,9 ккал).
Исследования реакций такого рода показывают, что реагирующая система
приходит к некоторому предельному состоянию, характеризующемуся
концентрациями исходных веществ и продуктов реакции, значительно
отличающимися от равновесных концентраций, как это имеет место в
эндотермических фотохимических реакциях или в таких реакциях, в
которых одновременно с прямой реакцией идет обратная ей также фото-
химическая реакция (см. главу VIII).
Заметим, что вблизи катода, т. е. в области катодного падения потен-
циала, химические реакции протекают быстрее, чем в положительном
столбе, что обусловлено большими скоростями электронов и более вы-
сокой температурой в этой области тлеющего разряда. Однако вследст-
вие малых размеров области катодного падения и практически неограни-

ченной протяженности положительного столба суммарная скорость реак-
ции, протекающей в столбе, может значительно превысить скорость
реакции вблизи катода.
Наличие металлических электродов, на которых особенно легко гиб-
нут активные частицы, существенным образом уменьшает их концентра-
цию. В этом отношении значительными преимуществами обладает высо-
кочастотный безэлектродный разряд, в котором, вследствие отсутствия
металлических поверхностей, степень диссоциации газа и соответственно
концентрации атомов оказываются особенно большими. Большие кон-
центрации атомов обнаруживаются по часто наблюдаемому в безэлек-
тродном разряде послесвечению (свечение после прекращения разряда),
обусловленному медленностью объемной рекомбинации атомов (источ-
ником послесвечения служит энергия, выделяющаяся при рекомбинации
атомов).
Одним из типов безэлектродного разряда является микроволновой
разряд, обладающий особенно высоким активирующим действием. Важ-
ное свойство микроволнового разряда заключается в том, что, будучи
зажжен при низком давлении (5—30 мм рт. ст.), он может гореть (как
тлеющий разряд) и при последующем повышении давления (до атмосфер-
ного и выше).
Дуговой разряд
При увеличении плотности тока температура электродов увеличи-
вается, и тлеющий разряд постепенно переходит в дуговой разряд. Вслед-
ствие интенсивного испарения металла с раскаленных электродов в
спектре дугового разряда преобладают линии металла электродов, имею-
щие сравнительно малую интенсивность в спектре тлеющего разряда.
Одновременно с увеличением плотности тока уменьшается разность
потенциалов между электродами. В развившейся дуге эта разность по-
тенциалов обычно составляет всего лишь несколько десятков вольт (для
поддержания тлеющего разряда необходима разность потенциалов в не-
сколько сотен и тысяч вольт). Большая плотность тока и низкое напряже-
ние — основные характеристики электрической дуги постоянного тока.
Дуги могут гореть как при низких, так и при высоких давлениях. При-
мером дуг низкого давления может служить ртутная дуга, горящая в
атмосфере ртутных паров; примером дуги, горящей при атмосферном дав-
лении,— обычная угольная. дуга или дуга с металлическими электро-
дами. Применяются также дуги, горящие при давлениях, значительно
превышающих атмосферное. Благодаря низкому напряжению электроны
в дуговом разряде имеют сравнительно малые скорости. Поэтому в спект-
ре дуги преобладает излучение нейтральных атомов и молекул. В связи
с этим спектры, испускаемые нейтральными частицами, обычно называют
дуговыми спектрами в отличие от искровых спектров, преобладающих в
излучении электрических искр и испускаемых ионами.
Чаще всего имеют дело с дугами с раскаленным катодом, температура
которого составляет несколько тысяч градусов. Наиболее нагретой ча-
стью катода является катодное пятно. Усиленное испускание электронов
(термоэлектронов) катодом есть одно из условий существования элект-
рической дуги. Однако существуют дуги с холодными электродами (на-
пример, ртутная дуга). Дуговой разряд в этом случае поддерживается
автоэлектронной эмиссией катода, обусловленной туннельным прохож-
дением электронов сквозь потенциальный барьер, образованный двой-
ным электрическим слоем на поверхности катода.
Состояние газа в дуговом разряде обычно соответствует состоянию
изотермической цлазмы. Благодаря высокой температуре газа и высокой
23 В. Н. Кондратьев, Е. Е. Никитин

«электронной температуре», достигающей нескольких тысяч градусов
3
,
большой плотности тока и обычно высокому давлению в дуге преобла-
дают химические процессы, характерные для высоких температур, в
частности процессы температурного крекинга и другие эндотермические»
процессы.
§ 33. ХИМИЧЕСКИЕ РЕАКЦИИ В ЭЛЕКТРИЧЕСКОМ РАЗРЯДЕ
И ВЫХОДЫ ЭТИХ РЕАКЦИЙ
Большое многообразие типов и форм электрического разряда, воз-
можность химической активации вещества в широком диапазоне давлений
и температуры являются предпосылкой успешного осуществления хими-
ческих превращений под действием электрического разряда. Нужно,
однако, сказать, что несмотря на огромное число работ, посвященных
исследованию разнообразных химических реакций, электроразрядный
метод осуществления химических реакций не получил широкого практи-
ческого применения, оказавшись в большинстве случаев нерентабельным
и неспособным конкурировать с другими химико-технологическими
методами.
В этом параграфе мы рассмотрим некоторые типичные реакции, осу-
ществляемые в электрическом разряде, с целью выяснения их микро- и
макроскопических особенностей и установления факторов, определяющих
выход продуктов реакции, ее скорость и направление.
Получение озона
Получение озона в тихом разряде (озонатор) является практически
единственным промышленным методом синтеза этого газа, имеющего раз-
нообразные практические применения. В зависимости от содержания
озона в озонированном воздухе, поступающем из озонатора, выход озона
(для определенного типа озонатора) составляет от 30 до 50 г1квт-ч, что
соответствует энергии в 60—36 эв на 1 г-молъ озона [1649]. Так как об-
разование 1 г-моля озона из молекулярного кислорода требует затраты
34,5 ккал, т. е. 1,5 эв, то теоретический выход озона должен составлять
1200 г/квт-ч, т. е. величину, приблизительно в 20—40 раз большую полу-
чаемой в действительности. Одна из причин столь большого различия
практического и теоретического выхода озона, несомненно, связана с
разложением большой части озона в озонаторе. Наличие обратной реак-
ции разложения озона явствует из ряда данных, в частности, из увели-
чения выхода с уменьшением процентного содержания озона.
На основании общих сообрая^ений можно заключить, что наличие
прямой и обратной реакций представляет отличительную особенность
всех реакций, проводимых в электрическом разряде, если только в силу
особых условий проведения реакции (например, при вымораживании
продуктов реакции) она не является необратимой. Поэтому выход про-
дукта здесь, как правило, всегда будет существенно меньше теоретичес-
кого.
Помимо наличия обратной реакции отмеченное выше расхождение
между наблюдаемым и теоретическим выходами озона частично может
быть обусловлено также следующим обстоятельством.
3
Так, например, измеряя температуру газа в дуге с железными электродами по доп-
леровскому смещению спектральных линий и электронную температуру — по аб-
солютной интенсивности сплошного спектра дуги, Бурхорн [579] нашел, что обе тем-
пературы одинаковы и равны 6300° К. Из этого он заключает, что в дуге устанавли-
вается термодинамическое равновесие. См. также [727, 1671].

Если допустить, что механизм образования озона в электрическом
разряде представляется схемой
в + 0
2
О + О + е,
0 + 0
2
^0з
и принять во внимание, что с точки зрения принципа Франка — Кондона
наиболее вероятный переход приводящий к диссоциации
молекулы 0
2
, должен происходить при энергии электронов ~ 8 эб
4
(рис. 91), то энергия, затрачиваемая на образование
1
г-моля 0
3
, будет состав-
лять не 1,5 эв, а 4 эв
5
, т. е. теоретический выход озона должен составлять
приблизительно 1200-1,5/4 ^450 г/квт-ч.
Наибольший выход озона был получен при синтезе озона в тлеющем
разряде [550]. В этом случае максимальный Выход составляет 150 г/квт-ч,
т. е. величину, только в 3 раза меньшую теоретического выхода. Выход
в 150 г/квт-ч удается получить лишь при низких давлениях и при усло-
вии охлаждения разрядной трубки жидким воздухом: на холодных
стенках озон вымораживается, а низкое давление способствует быстрой
диффузии его к стенкам. Таким путем сводится к минимуму обратная
реакция разложения озона, чему и нужно приписать наблюдающийся в
указанных условиях большой выход озона; этот выход получается иск-
лючительно в положительном столбе тлеющего разряда. В области ка-
тодного падения потенциала, в частности в области отрицательного све-
чения, озон не образуется, причем специальными ойытами было показа-
но, что причина этого заключается в быстром разложении озона.
Синтез аммиака из азота и водорода
В отличие от синтеза озона синтез аммиака является экзотермической
реакцией (V
2
N
2
+
3
/
2
Н
2
NH
3
-f 11,0 ккал). Однако вследствие не-
обходимости активации осуществление этой реакции также сопряжено
с затратой энергии, что в равной мере относится как к термической реак-
ции, так и к реакции, проводимой в электрическом разряде. Исследованию
последней реакции посвящено много работ Г378]. Было показано, что в
зависимости от типа разряда и условий проведения реакции устанавли-
вается определенный предел реакции. Так, было найдено, что при про-
ведении этой реакции в искровом разряде пределу реакции отвечает 3%
аммиака, в коронном разряде предельная концентрация аммиака для
стехиометрической смеси составляет 4,1%, в тлеющем разряде ~ 6%.
Далее, в безэлектродном разряде была достигнута предельная концен-
трация аммиака 36%, а в тлеющем разряде при вымораживании аммиака
жидким воздухом —98%. Эти данные свидетельствуют о наличии об-
ратной реакции разложения NH
3
, идущей параллельно с прямой реак-
цией синтеза. Выход аммиака обычно составляет несколько грамм на
киловатт-час, изменяясь с изменением условий и типа разряда в пределах
от десятых долей грамма до величины порядка 10 г. Наибольший выход
был получен в случае тихого разряда (8,2 г/квт-ч), что нужно приписать
более высокому давлению. Был измерен также выход аммиака, получаю-
щегося при бомбардировке смеси азота и водорода электронами заданных
энергий. Так, при энергии электронов 25 эв на пять электронов прихо-
дится одна молекула NH
3
, что отвечает выходу в 5,1 г/квт-ч. Укажем
также, что при проведении рекции в тлеющем разряде было установлено
4
Переход
3
2~ —> является запрещенным.
5
При диссоциации молекулы 0
2
возникают два атома кислорода, из которых каждый
может дать молекулу озона.

Рис. 91. Энергетические уровни 0
2
и Og и наиболее вероятные переходы из основного
состояния молекул Ог с точки зрения принципа Франка-Кондона
Рис. 92. Распределение выхода аммиака вдоль разрядной трубки при синтезе аммиака
из водорода и азота в тлеющем разряде [549]
1 = 40 ма
у
р — 3,5 мм рт. ст.
различное химическое действие отдельных частей разряда. Для иллюст-
рации на рис. 92 показано распределение аммиака вдоль разрядной труб-
ки (по Брюеру и Вестхеверу [549]). Как видно из этого рисунка, макси-
мальное количество аммиака получается в зоне отрицательного свече-
ния, где, согласно измерениям упомянутых авторов, выход оказывается
в 5,4 раза больше, чем в положительном столбе. Как мы видели, при
синтезе озона наблюдается обратная картина.
Выходы аммиака при синтезе его в электрическом разряде еще
очень далеки от промышленного выхода, получаемого при обычном син-
тезе (каталитическая реакция при высоком давлении) и составляющего
1 кг/квт-ч, т. е. на два порядка больше лучших выходов при электро-
разрядном методе.
Несмотря на большое число работ, посвященных исследованию син-
теза аммиака в электрическом разряде, механизм этой реакции изучен
еще очень мало. Из данных по синтезу NH
3
при бомбардировке смеси
азота и водорода электронами заданной энергии следует, что минимальная
энергия электронов, необходимая для образования аммиака, равна 17 эв.
Вследствие близости этого числа к потенциалу ионизации молекулы
азота, равному 15,65 эв, большинством исследователей принимается, что
первичными активными центрами в реакции синтеза аммиака являются
молекулярные ионы азота N
2
. Эти ионы должны легко взаимодействовать
с водородом. Из масс-спектрометрического исследования рассматриваемой
реакции можно заключить, что первичным продуктом этого взаимодей-
ствия являются ионы N
2
H
+
, вероятно, возникающие в результате про-
цесса N2 + Н
2
N
2
H
+
+ Н [45].
Дальнейшие процессы, в конечном счете приводящие к образованию
аммиака, по-видимому, происходят на стенках разрядной трубки, о чем
свидетельствуют наблюдавшаяся многими авторами резкая зависимость^

выхода NH
3
от состояния стенок, установленная в опытах с безэлектрод-
ным разрядом пропорциональность выхода NH
3
площади поверхности
разрядной трубки, а также увеличение выхода при помещении в трубку
стеклянной ваты. О том, что дальнейшие превращения иона N
2
H
+
идут
без участия других ионов или активных частиц, свидетельствует установ-
ленная при исследовании реакции в тлеющем разряде пропорциональ-
ность скорости реакции силе разрядного тока (см., например, [379]).
Нужно, однако, полагать, что ион-радикалы N
2
представляют не един-
ственную форму активных частиц в реакции синтеза аммика в электри-
ческом разряде; это следует из образования аммиака при взаимодействии
активного азота с водородом. Интересно отметить, что при синтезе ам-
миака в активном азоте, т. е. в отсутствие ионов, также наблюдается
резкая зависимость выхода NIi
3
от состояния и природы стенок. Задача
исследования механизма синтеза аммиака в электрическом разряде за-
ключается в выяснении природы активных центров реакции, а также вы-
яснении роли стенок и установлении характера происходящих на стен-
ках химических процессов.
Получение ацетилена из метана
Синтез ацетилена из метана (а также из смеси газов, содержащей ме-
тан) представляет собой один из примеров органического синтеза в элект-
рическом разряде, осуществленного на практике в значительных масшта-
бах и успешно конкурирующего с обычным, карбидным методом получе-
ния ацетилена. Для получения ацетилена из метана применялись раз-
личные формы электрического разряда. Так как, однако, уже первые
исследования показали, что в тихом разряде выход ацетилена ничтожно
мал, то все дальнейшие попытки осуществления этой реакции с выходом
С
2
Н
2
, представляющим практический интерес, в основном были сосредо-
точены на использовании тлеющего и дугового разрядов.
Исследованию синтеза ацетилена в тлеющем и дуговом разрядах пос-
вящено большое число работ (литературу см. в [16]; см. также [106, 157,
256]).
Лучшие выходы ацетилена достигали 120 г/квт-ч. Из теплового эффек-
та процесса 2СН
4
= С
2
Н
2
+ ЗН
2
— 86,3 ккал на 1 моль С
2
Н
2
термоди-
намический выход получается равным 259 г/квт-ч. Следовательно, мак-
симальные выходы составляет 46% от термодинамического. Выход аце-
тилена при карбидном способе его получения (из карбида кальция) сос-
тавляет 105—90 г/квт-ч, т. е. 40—35% от термодинамического. Наиболее
широкое практическое осуществление получил электроразрядный метод,
основанный на применении дуговой формы разряда.
Механизм превращения метана в ацетилен в электрическом разряде
изучен еще совершенно недостаточно. Так как при 1500—2000° К, от-
вечающих обычным температурам дугового разряда в метане или в его
смесях с водородом, термодинамическое равновесие соответствует полно-
му разложению ацетилена на углерод и водород, то из возможности по-
лучения значительных выходов ацетилена при воздействии электричес-
кого разряда на метан заключают, что превращение метана в дуге осу-
ществляется в две стадии. Первая из этих стадий отвечает реакции
2СН
4
= С
2
Н
2
+ ЗН
2
, а вторая — реакции С
2
Н
2
= 2С + Н
2
. Одним из
доводов, свидетельствующих о наличии этих двух брутто-стадий реакции,
может служить тот факт, что энергетический выход ацетилена (выход в
граммах на киловатт-час) возрастает при увеличении скорости газа. Из
сказанного следует, что параллельно с образованием ацетилена из ме-
тана в зоне разряда происходит также и его разложение, которое играет

тем меньшую роль, чем меньше время пребывания ацетилена в зоне раз-
ряда, т. е. чем больше скорость газа. Высказывалось также мнение, что
наблюдающееся при разбавлении метана водородом увеличение выхода
ацетилена (на разложенный метан) связано со смещением равновесия
С
2
Н
2
^ 2С + Н
2
в сторону ацетилена, т. е. в конечном счете с замедле-
нием второй стадии реакции.
Один из основных вопросов механизма превращения метана в элект-
рическом разряде — это вопрос о природе активных центров реакции.
Ввиду того, что в спектре разряда в метане наблюдаются интенсивные
полосы GH, а при больших плотностях разрядного тока также полосы
С
2
, Фишер и Петере [775] (вслед за ними также и другие авторы) пред-
полагают, что в образовании C
2
Ii
2
участвуют как радикалы СН, так и
радикалы С
2
, причем один из путей образования ацетилена в зоне раз-
ряда связан с гидрированием дикарбоновых радикалов атомарным водо-
родом, который также обнаруживается спектроскопически [913, 914].
Развивая представления о радикальном механизме превращения ме-
тана в электрическом разряде, Петере и Вагнер [1351] главную роль в
этой реакции приписывают атомам водорода. При этом они в значитель-
ной мере опираются на результаты работы Бонхеффера и Хартека, изу-
чавших взаимодействие атомов Н с различными углеводородами. В ра-
боте [1351], в частности, было показано, что атомы Н действуют дегид-
рирующим образом на этан и этилен, превращая их в ацетилен, и почти
не действуют на последний. Таким образом, ацетилену нужно приписать
особую устойчивость, чем и объясняется возможность почти полного (при
определенных условиях), превращения метана в ацетилен. Исходя из
этих данных, Петере и Вагнер заключают, что при малых плотностях
тока ацетилен образуется в основном в результате дегидрирующего
действия атомов Н, превращающих метан и радикалы СН
3
в СН
2
и далее
в С
2
Н
4
и С
2
Н
2
. При больших плотностях разряда, по Петерсу и Вагнеру,
ацетилен образуется преимущественно в результате рекомбинации ра-
дикалов СН и гидрирования радикалов С
2
.
Эти представления, приводящие к заключению о сложном (многосту-
пенчатом) характере первой из указанных выше двух макроскопических
стадий реакции (превращение метана в ацетилен), находят подтвержде-
ние как в аналитических данных самих Петерса и Вагнера, так и в дан-
ных других авторов. Так, на основании изучения кинетики процесса и
состава продуктов превращения метана в тихом разряде Сент Оней
[1532] приходит к заключению, что первичным продуктом реакции явля-
ется этан С
2
Н
6
, в результате последующего дегидрирования превращаю-
щийся в этилен С
2
Н
4
, ацетилен С
2
Н
2
и продукты их полимеризации.
Образование этана в первой стадии реакции синтеза ацетилена из метана
(в высокочастотном искровом разряде) наблюдал также Амемия [400].
Добавим, что при определенном режиме реакции в тлеющем разряде уда-
ется количественно превратить метан в этилен и водород [548].
Иная точка зрения на природу и механизм химической активации в
разряде была выдвинута Бёртоном и Маги [583]. Согласно этим авторам,
важную роль в процессе химической активации должны играть медлен-
ные электроны (Е
эл
= 0,5 —4 эв), присутствующие в зоне разряда в зна-
чительных количествах. По мнению авторов, роль этих электронов зак-
лючается в последовательном (ступенчатом) возбуждении различных
электронных уровней молекул и радикалов', в результате чего образу-
ются активные частицы различной степени активности, в частности, та-
кие, энергия которых значительно превышает энергию медленных элект-
ронов и которые не могут быть возбуждены при единичном соударении с
медленным электроном.

Таблица 23
Состав продуктов электрокрекинга в тихом разряде и продуктов
пиролиза паров ацетона (в %) [1198]
Продукт
Электрокрекинг
Пиролиз Продукт
Электрокрекинг Пиролиз
СОа
0,6 0,6
С
2
Н
6
30,0
21,8
со
42,1
36,0
Н
2
24,4
38,3
С2Н4
2,9 3,3
24,4
Во всех предлагавшихся механизмах образования ацетилена из ме-
тана в электрическом разряде цепи играют существенную роль. К пред-
ставлению о значительной вероятности цепного механизма реакций в
разряде приводят как теоретические соображения, основывающиеся на
наличии в зоне разряда свободных атомов и радикалов, в условиях по-
вышенной температуры разряда обладающих высокой химической актив-
ностью, так и экспериментальные факты, получающие наиболее простое
истолкование на основе цепного механизма реакций. Так, например, ис-
следование продуктов электрокрекинга паров различных органических
веществ в тихом разряде показывает, что их состав очень близок к сос-
таву продуктов термического крекинга (пиролиза) этих веществ. В табл. 23
приведены результаты анализа состава продуктов крекинга паров
ацетона в тихом разряде и состава продуктов пиролиза.
Ввиду различия природы первичных активных центров в этих реак-
циях близкий состав продуктов можно ожидать лишь в том случае, если
основная их масса получается в результате вторичных процессов, что мо-
жет иметь место только при цепном механизме,

РАДИАЦИОННО-ХИМИЧЕСКИЕ РЕАКЦИИ
В отличие от фотохимии, которая для воздействия на вещество исполь-
зует только фотоны со сравнительно низкой, порядка 1—10 эв энергией,,
радиационная химия располагает для этого весьма большим набором
высокоэнергетических частиц с энергией 10
2
—10
7
эв. К ним относятся:
у-кванты, быстрые электроны, быстрые ядра — протоны, дейтоны, три-
тоны, а-частицы, осколки деления и нейтроны. Для получения этих частиц
используются ускорители, ядерные реакторы, рентгеновские трубки и
изотопные источники излучения. Подробное описание источников иони-
зирующих излучений и методов их использования в радиационно-химиче-
ских исследованиях можно найти в монографиях [37, 48, 374].
Однако несмотря на такое обилие типов излучений для осуществления
химических реакций, основными агентами радиационной химии являются
быстрые электроны, либо быстрые ядра, взаимодействие которых с элект-
ронными оболочками атомов и молекул аналогично взаимодействию быст-
рых электронов. Действительно, для у-квантов с энергией от 0,1 до 10 Мэ&
при взаимодействии с веществом основную роль играет эффект Комптона,
приводящий к образованию быстрых электронов, а действие быстрых нейт-
ронов связано преимущественно с образованием быстрых ядер, получив-
ших от нейтронов кинетическую энергию или же возникших в результате
ядерной реакции. С другой стороны, движение в веществе быстрой тяжелой
заряженной частицы вновь приводит к образованию электронов, сравни-
тельно более медленных, но все же превосходящих по энергии величины
потенциалов ионизации атомов и молекул. Основные пути возникновения
быстрых электронов в веществе при воздействии на него различных иони-
зирующих частиц показаны на рис. 93.
Свободные электроны могут возникать не только при радиационном,
но и при фотовоздействии на вещество. Однако энергия электронов, обра-
зующихся при облучении светом в области вакуумного ультрафиолета,
мала и составляет величину порядка 1 эв, а средняя энергия электронов
в разрядах, как уже говорилось в предыдущей главе, не превышает обыч-
но 10 эв.
Возникающие же при радиационном воздействии на вещество электро-
ны имеют широкое распределение по энергиям от величин, меньших потен-
циала ионизации (/) молекул среды, до энергии, равной начальной энер-
гии бомбардирующей вещество частицы [1527]. Такое распределение уста-
навливается в результате того, что быстрые первичные электроны при
своем движении в среде создают электроны второго поколения, обладаю-
щие достаточно высокой энергией для дальнейшей ионизации. Эти элект-
роны в свою очередь порождают электроны третьего поколения и т. д., пока,
наконец, не образуются электроны с энергией Е<^1. Последние способ-
ны терять свою энергию уже только в процессах возбуждения и в конце
концов превращаются в тепловые (Е ~ kТ), либо «погибают» путем дис-
