Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.

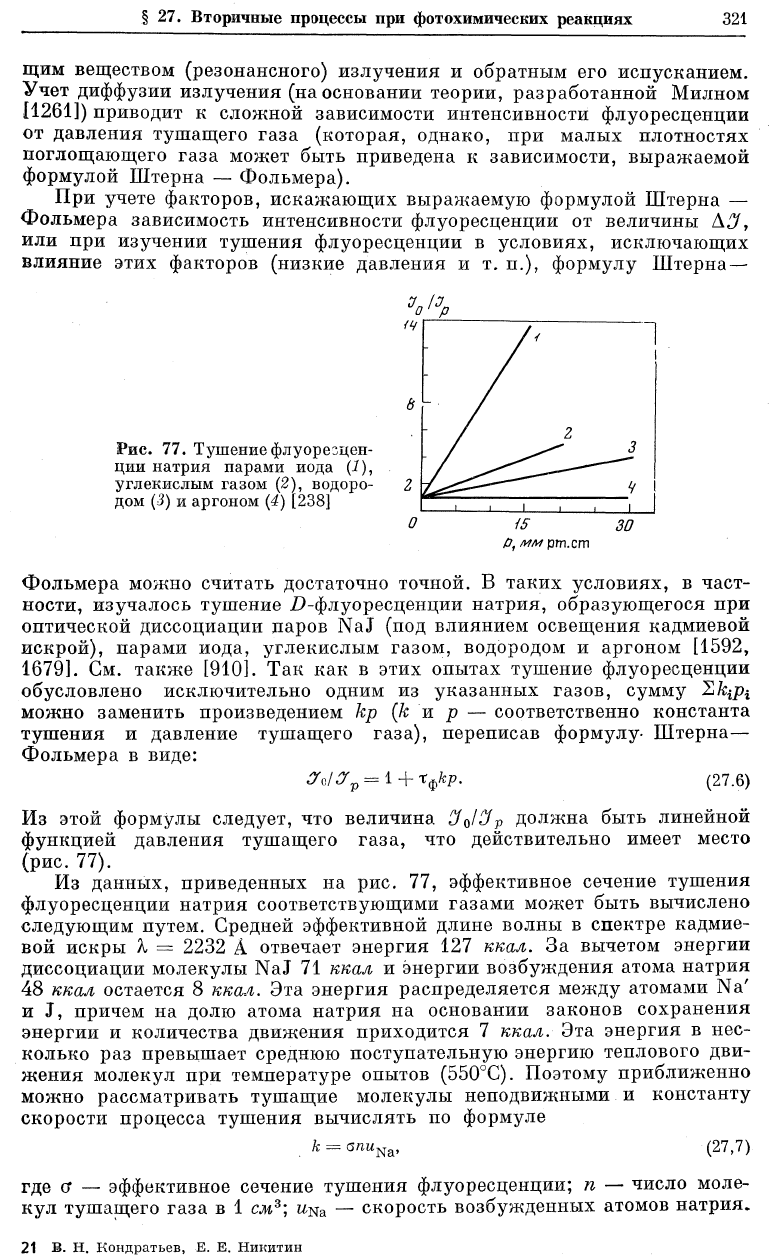
щим веществом (резонансного) излучения и обратным его испусканием.
Учет диффузии излучения (на основании теории, разработанной Милном
11261]) приводит к сложной зависимости интенсивности флуоресценции
от давления тушащего газа (которая, однако, при малых плотностях
поглощающего газа может быть приведена к зависимости, выражаемой
формулой Штерна — Фольмера).
При учете факторов, искажающих выражаемую формулой Штерна —
Фольмера зависимость интенсивности флуоресценции от величины AJ,
или при изучений тушения флуоресценции в условиях, исключающих
влияние этих факторов (низкие давления и т. п.), формулу Штерна
—
р
1
мм рт.ст
Фольмера можно считать достаточно точной. В таких условиях, в част-
ности, изучалось тушение D-флуоресценции натрия, образующегося при
оптической диссоциации паров NaJ (под влиянием освещения кадмиевой
искрой), парами иода, углекислым газом, водородом и аргоном [1592,
1679]. См. также [910]. Так как в этих опытах тушение флуоресценции
обусловлено исключительно одним из указанных газов, сумму 2/qpi
можно заменить произведением кр (к и р — соответственно константа
тушения и давление тушащего газа), переписав формулу- Штерна—
Фольмера в виде:
Jo!J
p
= i + *
ф
Ьр. (27.6)
Из этой формулы следует, что величина CfJOp должна быть линейной
функцией давления тушащего газа, что действительно имеет место
(рис. 77).
Из данных, приведенных на рис. 77, эффективное сечение тушения
флуоресценции натрия соответствующими газами может быть вычислено
следующим путем. Средней эффективной длине волны в спектре кадмие-
вой искры А, = 2232 А отвечает энергия 127 ккал. За вычетом энергии
диссоциации молекулы NaJ 71 ккал и энергии возбуждения атома натрия
48 ккал остается 8 ккал. Эта энергия распределяется между атомами Na'
и J, причем на долю атома натрия на основании законов сохранения
энергии и количества движения приходится 7 ккал. Эта энергия в нес-
колько раз превышает среднюю поступательную энергию теплового дви-
жения молекул при температуре опытов (550°С). Поэтому приближенно
можно рассматривать тушащие молекулы неподвижными и константу
скорости процесса тушения вычислять по формуле
к = впи
ш
, (27,7)
где сг — эффективное сечение тушения флуоресценции; п — число моле-
кул тушахцего газа в 1 см
3
; u
Na
— скорость возбужденных атомов натрия.
21 В. Н. Кондратьев, Е. Е. Никитин

Вычисленные из данных рис. 77 значения эффективного сечения туше-
ния равны (при т
ф
= 1,6-КГ
8
сек): 335-lCT
16
см
2
(J
2
), 75-10"
16
см
2
(С0
2
)
г
25-10"
16
см
2
(Н
2
) и 25-10~
16
см
2
(Аг). Вычисленные из этих значений а
суммы эффективных радиусов атома натрия и соответствующей тушащей
молекулы сопоставлены ниже с суммами газокинетических радиусов этих
частиц:
Тушащая частица
J
2
С0
2
Н
2
Аг
Сумма радиусов, А:
тушение
10,3
4,5
2,7
0,9
газокинетические
3,6
3,0 2,6 2,8
Из этого сопоставления следует, что сечение тушения флуоресценции
натрия парами иода почти на порядок превышает газокинетическое сече-
ние. Так как константа скорости процесса Na + J
2
= NaJ + J такя^е ока-
зывается на порядок больше частоты газокинетических столкновений
Na и J
2
[1368, 1591], то тушение флуоресценции натрия иодом, по-види-
мому, нужно связать с химическим процессом Na' + J
2
= NaJ + J-
Что касается тушения флуоресценции натрия водородом и углекис-
лым газом, то в этих случаях вероятным механизмом тушения нужно счи-
тать превращение энергии электронного возбуждения в колебательную
энергию молекул Н
2
и С0
2
, т. е. процессы Na' + Н
2
= Na' + Н
2
* и
Na' + С0
2
= Na + С0
2
*. Одним из доказательств возможности процес-
са Na' + Н
2
— Na -f- Н
2
* могло бы явиться существование обратного
процесса Н
2
* + Na = Na' + И
2
[1283, 1363]. Малое сечение тушения
флуоресценции натрия аргоном обусловлено малой вероятностью прев-
ращения энергии электронного возбуждения в энергию поступательного*
движения.
Значительный интерес представляет тушение флуоресценции гидрок-
сила (
2
2
+
), наблюдаемого в ряде окислительных реакций в электронно-
возбужденном состоянии. Тушение флуоресценции гидроксила различ-
ными газами (Не, Аг, Н
2
, N
2
, СО, D
2
, 0
2
, Н
2
0, С0
2
) изучалось в работах
[255, 470, 609, 984, 1032, 1589]. Наиболее точными, по-видимому, нужна
считать результаты последней из этих работ [1589]. Согласно данным этой
работы, в которой были измерены константы скорости (к) и поперечные
сечения тушения ^с) гелием, водородом, дейтерием, окисью углерода,
азотом и парами воды, наименьшие значения к
ж
а принадлежат гелию.
Большие значения наблюдаются в случае Н
2
и D
2
. Из того факта, что
предэкспонент в выражении константы скорости процесса ОН + Н
2
—
= Н
2
0 -f- Н, равный2,3-10
13
см
3
-моль"
1
-сек'
1
, близко совпадает со значе-
нием константы скорости тушения флуоресценции кц
2
— 3,6 • 10
13
(кв
2
= 2,4-10
13
) см
3
-моль"
1
-сек'
1
, авторы [1032] заключают, что туше-
ние флуоресценции гидроксила водородом (и дейтерием) связано с про-
цессом ОН'+ Н
2
- Н
а
О + Н.
Константа скорости тушения флуоресценции гидроксила окисью
углерода k
G0
=1,8-10
14
на три порядка превышает значение предэкспо-
нента в выражении константы скорости процесса ОН' + СО = С0
2
+ Н.
Ввиду этого авторы [1032] полагают, что тушение флуоресценции, сечение
которого вдвое превышает газокинетическое сечение, в данном случае
обусловлено дальнодействующими силами и осуществляется по следую-
щему механизму: ОН' + СО СО . . . ОН-> СО + ОН (СО ... ОН — ком-
плекс). С различием этих сил авторы [1031] связывают разницу тушащего
действия СО и N
2
(kc
0
/k^
2
= 7,5). Наибольшим тушащим действием (сог-
ласно результатам всех имеющихся работ) обладает вода, константа
скорости которой /сн
2
о = 3,0• 10
14
см
3
-моль"
1
-сект
1
и сечение Сн
2
о = 57 А
2
.

Авторы предлагают следующий механизм тушения
-,НО
а
+ Н
2
,
ОН' + Н
2
0 — НО . . . ОНа (
^ЮН + Н
2
0.
Образование радикала Н0
2
допускает также Каррингтон [609] в случае
тушения флуоресценции гидроксила кислородом, парами воды и углекис-
лым газом.
В заключение в качестве примера тушения флуоресценции сложного
вещества на рис. 78 приведены данные по тушению флуоресценции паров
Рис. 78. Тушение флуоресцен-
ции р-нафтил амина кислоро-
дом и окисыо азота [716]
Давление 3-нафтиламина 1,2 мм
рт. ст.; температура 150° С; X —
= 3660 А
Z-lQ-^ceH-
1
Р-нафтиламина кислородом и окисыо азота [716]. Как видно из этого
рисунка, тушение флуоресценции в этом случае, как и в случае атомов и
более простых молекул, следует формуле Штерна — Фольмера.
§ 28. ФОТОХИМИЧЕСКАЯ СЕНСИБИЛИЗАЦИЯ
Многие вещества, например, такие, как водород, углеводороды жир-
ного ряда и другие, поглощают свет в труднодоступной далекой УФ-об-
ласти спектра, что затрудняет проведение фотохимических реакций с
этими веществами. Однако, примешивая постороннее вещество — сенси-
билизатор, поглощающее свет в более доступной области спектра, можно
осуществить фотохимическую реакцию веществ, не поглощающих в данной
спектральной области.
Фотосенсибилизация галогенами
В сенсибилизированной фотохимической реакции свет воздействует
непосредственно на молекулу (или атом) сенсибилизатора. При этом фо-
тохимический первичный акт может заключаться либо в распаде моле-
кулы сенсибилизатора на составляющие атомы, либо в ее возбуждении.
В качестве примера протекания процесса по первому пути приведем
фотохимическое разложение иодистого этилена в присутствии иода. Эта
реакция изучалась рядом авторов (см. литературу в работе [1417]); экспе-
риментальные данные приводят к следующему механизму реакции:
J
2
+ hv = 2J, (ко)
J + C2H4J2 = J2 + C2H4J, (KI)
C2H4J == C2H4+ J, (fa)
J + J + M = Ja + M. (k
3
)
Согласно этому механизму, скорость разложения C
2
H
4
J
2
w = kl [C2H4J2] [J].

Это выражение, на основании условий стационарности
d [C2H4J]
DT
= KI [C2H4J2HJ] — АА [C2H4J] = О
LI£L
dt
= 2АУ — ki [C2H4J2] [J] + fta [C2H4J]— 2A:
S
[M] [J]
2
= 0,
преобразуется к виду
w ={к±
2
/кз (M)}^
z
[C2H4J2], У*Л<7,
(28.1)
тождественному с экспериментально установленным кинетическим урав-
нением реакции. Отметим, что величина AJ пропорциональна интенсив-
ности света С/о, откуда следует w ~ в соответствии с тем, что обры-
вающим реакцию процессом является объемная рекомбинация атомов.
Иод и другие галогены широко применяются в качестве сенсибилиза-
торов в различных фотохимических реакциях. Это прежде всего объясня-
ется легкостью активации галогенов, обусловленной тем, что их спектр
поглощения расположен в видимой или в близкой УФ-области. Коэф-
фициент поглощения света парами иода (кривая 1), брома (кривая 2) и
хлора (кривая 3)
8
в зависимости от длины волны приведен на рис. 79
[34]. Существенно отметить, что граница между дискретной и сплош-
ной частями спектра (граница схождения полос) отвечает следующим
длинам волн: 4995 A (J
2
), 5107 А (Вг
а
) и 4785 А (С1
а
) (см. также [1546]).
<5
10
О
Г
\,1'
,2
\
—«'
Рис. 79. Коэффициент погло-
щения света парами иода (i),
брома (2) и хлора (3) в видимой
и УФ-областях спектра
6000 5000 40О О
Л, А
При поглощении длин волн, меньших этих граничных длин волн, моле-
кулы Х
2
распадаются на атомы, Х
2
+ hv = X' (
а
А/„) + Х(
2
Рз
/г
), кото-
рые, таким образом, нужно считать первичными центрами сенсибилизи-
рованной фотохимической реакции. В области больших длин волн сначала
возникают возбужденные молекулы Х
2
, которые могут с испусканием
света вернуться в исходное основное состояние (флуоресценция), расще-
питься на атомы при соударении с другими молекулами (Х
2
+ М = X +
+ X + М) или вступить в химическую реакцию. Химические реакции
возбужденных молекул галогенов с достоверностью неизвестны, хотя
такой механизм реакций и постулировался некоторыми авторами.
Индуцированная предиссоциация представляет собой достаточно под-
робно изученное явление, осуществляющееся с большой легкостью (при
больших по сравнению с газокинетическими сечениями). Весьма вероятно,
что, вступая в реакцию, возбужденная молекула галогена претерпевает
индуцированную предиссоциацию, которую нужно рассматривать как
первую (начальную) стадию данной элементарной реакции [1028]. Поэ-
8
Максимум поглощения фтора приходится на длину волны X ^ 2900 А. Максималь-
ный коэффициент поглощения равен ~ 0,2 см'
1
. *

тому можно считать, что практически во всех случаях первичными актив-
ными центрами фотохимических реакций, сенсибилизированных галоге-
нами, являются атомы галогена.
Правильность этого заключения была подтверждена также спектро-
скопическими данными. Было показано [535, 1400], что в области 5100—
6800 4, т. е. в области дискретного поглощения паров брома, наряду с
переходом
—>
3
П}
П
> с которым связано и возникновение устойчивых
возбужденных молекул Вг
2
, и, следовательно, дискретный характер
спектра поглощения, наблюдается переход
х
2
+
—
3
П
1г/
, приводящий к
диссоциации молекулы брома на невозбужденные атомы. При этом в
случае источника света с непрерывным спектром (какие обычно применя-
ются в фотохимических опытах с галогенами) поглощение света в ука-
занной области спектра приводит преимущественно к возникновению
состояния
3
П
1гм
т. е. к диссоцации молекул брома. В соответствии с
этим находится тот факт, что в области длин волн 4800—6800 А эффектив-
ность действия света в фотохимической реакции бромирования этилена
Вг
2
+ С
2
Н
4
= С
2
Н
4
Вг
2
не зависит от длины волны [1067, 1221]. Интерес-
но отметить, что свет с X = 7150 А, также поглощаемый молекулами бро-
ма, но приводящий к возникновению устойчивых колебательных уровней
состояния
3
П
Х м
, оказывается фотохимически неактивным
9
.
В связи с фотохимической сенсибилизацией галогенами нужно отме-
тить, что, по-видимому, только в случае иода возможны реакции, в ходе
которых сенсибилизатор не расходуется, как это имеет место в приведен-
ном выше примере разложения йодистого этилена. Атомы брома и хлора
обладают большей химической активностью цо сравнению с атомами иода
и практически во всех изученных реакциях наблюдается необратимое в
условиях опыта превращение (связывание) некоторого количества сенси-
билизатора. Так, например, при фотохимическом сенсибилизированном
хлором разложении озона образуются значительные количества С1
2
0
4
[587]. О сенсибилизированных хлором окислительных реакциях см.,
например, в работе [72].
Отметим, что, как было показано в работе [1644], при фотохимической
активации молекул 0
2
в области дискретного поглощения (А, = 1849,61)
в результате предиссоциации в качестве первичных активных центров
образуются атомы О, как и в области сплошного поглощения, подобно
тому, как это имеет место в случае галогенов.
Фотосенсибилизация ртутью
В качестве сенсибилизатора очень часто применяется ртутный пар,
являющийся примером сенсибилизатора, в котором первоначально воз-
никают возбужденные атомы. При облучении смеси реагирующих веществ,
содержащей небольшое количество ртутного пара, светом кварцевой ртут-
ной дуги образуются возбужденные атомы ртути^Н^^
3
.?!)
с энергией возбуждения 112 ккал. Превращение энергии возбуждения
атома ртути в химическую энергию молекулы (или молекул) реагирую-
щих !веществ и является началом собственно химической реакции. Для
J
лучшего использования энергии возбуждения необходимо, чтобы эффек- :
тивность такого столкновения была достаточно большой, так как в про-
тивном случае энергия будет либо излучена (флуоресценция), либо прев-
ратится в тепло (в результате тушения [флуоресценции). Вероятность
9
Длине волны 7150 А отвечает энергия 39,7 ккал, меньшая теплоты диссоциации мо-
лекулы брома (45,4 ккал).

рассеяния энергии особенно велика при низких давлениях. Действитель-
но, число газокинетических соударений Z ~ Ю
7
-/>, где р — давление
(в миллиметрах ртутного столба), откуда следует, что при давлении 1 мм
рт. ст. возбужденный атом ртути за время своей жизни (1,55-10
7
сек) ис-
пытывает в среднем не более одного столкновения; поэтому при р < 1 мм
рт. ст. нужно ожидать большую вероятность флуоресценции и малую ве-
роятность фотохимической активации.
Особенно большое число работ было посвящено изучению фотохими-
ческих сенсибилизированных ртутью реакций веществ, содержащих во-
дород (Н
2
, углеводороды и др.)? главным образом реакций разложения
и окисления. В этих' реакциях вторичный процесс взаимодействия воз-
бужденного атома ртути с молекулой реагента может идти двумя путями:
Hg' + RH = Hg + R + II и Hg' + RH = HgH + R.
Оба пути энергетически возможны, так как энергия возбуждения атома
Hg(
3
jP) во всех случаях больше энергии разрыва связи атома водорода в
молекуле (исключение составляет молекула Н
2
0, распад которой на гид-
роксил и атом Н идет с затратой 118 ккал). Возможность первого пути
явствует далее из существования сенсибилизированной ксеноном (энергия
возбуждения атома ксенона составляет 193 ккал, К = 1469 А) реакции
разложения водорода [604], в которой гидрид не может образоваться и,
следовательно, первый путь, которому и следует вторичный процесс, яв-
ляется единственно возможным
10
.
Что касается второго пути, то, как это показали Каллир и Хеджес
[595], образование HgH и IlgD в первичном акте является главным на- ,
правлением реакции Hg'^i) HHg"(
3
^o) с Н
2
и D
2
. Викис и Ле Рой [1637]
показали, что гидрид ртути явяется также первичным продуктом взаи-
модействия Hg'' (
3
Р
{
) с алканами СН
4
, С
2
Н
6
, С
3
Н
8
и w-C
4
H
10
.
В чистом виде этот второй путь реализуется в реакции разложения,
сенсибилизированной кадмием и цинком [468], см. также [542]. Ввиду
того, что энергия возбуждения атомов кадмия и цинка составляет соот-
ветственно 87 и 92 ккал, разложение молекулы Н
2
на два атома при столк-
новении ее с возбужденным атомом кадмия или цинка энергетически
невозможно, и обнаружение атомов Н при облучении водорода, содержа-
щего примесь паров одного из этих металлов, резонансной линией ме-
талла объясняется процессом
M
/
(
8
Pi) + Ha = MH + H.
Заметим, что вследствие сравнительно большого теплового эффекта
процесса Hg' + Н
2
= HgH ,+ Н, равного 16,3 ккал, и сравнительно ма-
лой энергии диссоциации молекулы HgH (8,5 ккал) образующаяся в этом
процессе молекула HgH имеет большую вероятность распасться. Поэ-
тому можно считать, что оба возможных пути вторичного процесса сен-
сибилизированной ртутью диссоциации водорода в конечном счете ведут
к распаду молекулы Н
2
на два свободных атома.
При фотодиссоциации углеводородов и других содержащих водород
веществ вторичный процесс, очевидно, выражается схемой:
Hg' + RH = HgH + R Hg 4- Н + R.
Возникающие при этом атомы Н и радикалы R являются теми актив-
ными центрами, которые обеспечивают дальнейшее развитие реакции.
10
Аналогичный процесс был установлен Гротом и Ольденбергом [894] для системы
Кг' + N
2
(энергия возбуждения криптона 10,0 эв). Согласно данным этих авто-
ров, обнаруженная ими диссоциация молекул N
2
в присутствии возбужденных ато-
мов криптона обусловлена переходом молекулы N
2
. в неустойчивое электронно-воз -
бужденное состояние, приводящее к распаду ее на нормальные атомы.

В работе [1427] показано, что большинство фотосенсибилизированных
атомами HgX
3
^) реакций могут быть интерпретированы как протекаю-
щие через образование комплекса типа
И—Н, H-0->Hg,
R
2
C
= CR
2
И Т. Д.,
1 I I
Hg II Hg
(см. такя^е [465, 1639, 1709]), распадающегося на HgH+остаток, или —
с испусканием света — на Hg + исходная молекула. Последнее делает
комплексы RHHg', названные благодаря этому свойству эксимерами,
сходными с Hg
2
(см. выше).
В качестве примера из большого числа фотохимических сенсибилизи-
рованных ртутью реакций разложения углеводородов приведем реакцию
разложения этана, изучавшуюся рядом авторов (см. Стеси [1533, глава
V, стр. 35]). Состав продуктов этой реакции и ее кинетика при темпера-
туре, близкой к комнатной, по-видимому, наиболее точно описываются
. следующим механизмом:
Hg
/
+CaHe = Hg + CaH
5
+ H
l
Н + С
2
Нб = На + CaHs,
Н + С2Н5 = 2СНз,
II + СаН
5
— СаНв,
Н + СНз—СН
4
,
СНз + С2Н5 — СзН
8
,
2С2Н5 —» С4Н10,
211 -
>
Н
2
.
Этот механизм в основных чертах сохраняется и при повышенных
температурах (вплоть до 475° С). Есть основания считать, что при этих
температурах заметную роль, наряду с указанными выше процессами,
должны играть процессы
СНз + СаН
в
= СН
4
+ С
2
Н
5
и
С
2
Н
5
= С
2
Н
4
-{- н.
В работе [979] изучено фотосенсибилизированное ртутью Hg'^i)
разложение пропана, изобугана и w-пентана. В частности, было найдено,
что скорости разрыва связи R—Н в случае третичного, вторичного и
первичного атома водорода относятся как 12 : 3 : 1. В отличие от
г
Р
г
для
3
Р
г
имеет место отношение 360 : 65 : 1 [977]. Меньшую селективность
в случае
г
Р
г
авторы [979] объясняют большей экзотермичностью первич-
ного фотохимического акта в этом случае (см. также [141, стр. 79].
Кроме разрыва связи С—Н при фотохимическом сенсибилизированном
ртутью разложении органических веществ, по-видимому, возможен также
разрыв связей С—С. Так, например, масс-спектрометрическое исследо-
вание сенсибилизированного ртутью фотохимического разложения паров
ацетона СН
3
СОСН
3
показывает [761], что в этом случае $ больших коли-
чествах образуются радикалы СН
3
, а также радикалы СН
3
СО, и пол-
ностью отсутствуют радикалы ацетонила СН
3
СОСН
2
. Таким образом,
нужно заключить, что при* фотолизе ацетона первичным процессом явля-
ется процесс Hg'+ СН
3
СОСН
3
- Hg + СН
3
+ СН
3
СО или HgCH
3
+
+ GH3CO. В общем случае эти процессы можно представить как
Hg' + RiRa = Hg + Ri-|-Ra и HgRi + Ra.
Поскольку роль фотохимической сенсибилизации обычно ограничи-
вается созданием начальных центров (главными являются атомы Н),

то основные черты механизма должны сохраниться и при любом другом
способе генерирования начальных активных центров (например, в элект-
рическом разряде), если остальные условия протекания реакции не из-
меняются. Здесь только необходимо иметь в виду, что при различных
способах генерирования начальных активных центров часто оказываются
несравнимыми концентрации этих центров. Это приводит к изменению
соотношений между отдельными элементарными процессами, входящими
в механизм реакции, и, как следствие этого, к изменению соотношения в
состава продуктов реакции (см., например, [1141]).
Рассмотрим далее взаимодействие возбужденных атомов ртути с мо-
лекулой 0
2
, имеющее существенное значение в связи с использованием
ртутной сенсибилизации в фотохимических окислительных реакциях.
При применении ртути в качестве сенсибилизатора фотохимического-
разложения кислорода (обнаруживаемого по образованию озона) воз-
никают трудности интерпретации первичного процесса (идущего с боль-
шой скоростью) в связи с тем, что энергия возбуждения сенсибилизи-
рующего атома (112 ккал) меньше теплоты диссоциации молекулы О
а
(118,0 ккал). По аналогии с процессом Hg + Н
2
= HgH + Н, а также
учитывая факт образования HgO при облучении резона:нсной линией
ртути кислорода, содержащего примесь паров ртути, естественно пред-
ставить взаимодействие возбужденного атома ртути с молекулой 0
2
как
химический процесс Hg' + 0
2
= HgO + О.
К такому именно заключению о механизме взаимодействия возбуж-
денного атома ртути с молекулой кислорода пришли Лейпунский и Загу-
лин [1140] в результате изучения фотохимического сенсибилизированного*
ртутью образования озона (см. также Дарвент [690]). Однако некоторые-
факты заставляют предположить, что окись ртути HgO образуется при
вторичном взаимодействии молекулы озона с нормальным атомом ртути
0
3
+ Hg = HgO + 0
2
, а не в результате процесса, предшествующего
образованию озона (см. [362]).
По Дикинсону и Шериллу [700] механизм рассматриваемой реакции
представляется следующей совокупностью процессов
п
:
Hg' + 0
2
(»2) = Hg + 0a
0
2
+ 0
2
= 0
3
+ О,
О + Оа = Оз.
Фотохимические сенсибилизированные ртутью реакции окисления изу-
чались многими авторами на примере окисления водорода, метана, этана,
пропана и др. По поводу первой из этих реакций отметим, что, согласно»
[449], главным ее продуктом при 14° С является перекись водорода Н
2
0
2
,
содержание которой в продуктах реакции превышает 85%. Этот резуль-
тат подтверждает сделанное выше заключение о том, что атомы кислорода
не являются первичными продуктами взаимодействия возбужденного
атома ртути с молекулой 0
2
, так как в этом случае главным продуктом
реакции должна была бы быть вода.
Детальному исследованию было подвергнуто фотохимическое сенси-
билизированное ртутью (2537 А) окисление окиси углерода в работе
Симонайтиса и Хейклена [1501]. Согласно предлагаемому этими авторами
механизму, начальной стадией реакции является дезактивация Hg' (
г
Рг)
и Hg'(
3
jP
G
) при столкновениях с молекулами 0
2
и СО, приводящая к
11
Не исключена возможность, что в данном случае врзбужденная молекула кислорода
представляет собой колебательно-возбужденную молекулу, находящуюся в основ-
ном электронном состоянии [1643].

образованию электронно-возбужденных (метастабильных) молекул 0
2
и
колебательно-возбужденных молекул СО
12
. Взаимодействие 0
2
и СО*
соответственно с СО и 0
2
и приводит к образованию С0
2
. При этом при-
нимается, что взаимодействие СО* с 0
2
следует схеме
СО*
+ 02 = со* + о,
тогда как взаимодействие 0
2
с СО протекает через промежуточное об-
разование С0
3
:
0'
2
+ СО СОз,
С0з-»С0а-»0.
Коснемся- еще реакций сенсибилизированного ртутью окисления угле-
водородов. Уотсон и Дарвент [1652], изучавшие окисление этана кисло-
родом при 40—200° С, механизм образования главного продукта реак-
ции — гидроперекиси этила С
2
Н
5
ООН — связывают с процессами
СаНь + Оа + М = С2Н5ОО + М
И
СаН
6
00 + Н0а = СаН
5
00Н + 0а,'
которым предшествует образование радикалов С
2
Н
5
и Н0
2
, согласно*
[1652], образующихся по схеме;
Hg' (
3
Pi) + СаНб = С2Н5 + Н + Hg,
0
2
* + С2Н6 = НО2 + С2Н5.
Авторы [1652] нашли, что в изученном температурном интервале-
квантовый выход гидроперекиси близок к единице и не зависит от тем-
пературы, из чего они заключают, что в условиях их опытов радикальных
цепей нет.
Рассмотрим далее окислительную реакцию в смеси Н
2
, С
2
Н
4
и 0
2
,-
изученную Каллиром и Перейра [598]. Эти авторы нашли, -что при 20° С
главными продуктами реакции являются Н
2
0
2
и С
2
Н
5
ООН (вместе с
небольшими количествами НСНО, СН
3
СНО, СО и С0
2
). Образование-
главных продуктов интерпретируется следующей схемой реакции:
I
>
HgH + Н,
Н + С2Н4 + М = С2Н5 + М,
С2Н5 + ОЗ + М = С2Н5ОО + М,
HgH +
Оа
= Hg + НОз,
С2Н5ОО + HOa = CaHsOOH + Оа,
2НОа = НаОа + Оа,
также исключающей цепной механизм.
Однако при повышении температуры реакция окисления углеводо-
родов становится цепной, что, в частности, проявляется в преобладание
12
Колебательная активация СО в процессе Hg' (Hg") + СО = Hg + СО* (v) была изу-
чена Дж. Полани с сотр. [1035], которые получили следующие значения относитель-
ных констант скорости этого процесса = 0, k
v==z9
= 1,00, k
v=zg
= 15, k
v==7
= 35,
k
v==Q
— 43, k
v==5
= 48, = 60, k
v==3
— 70 и k
v=2
= 80. Из этих данных следует, что
только — 50% энергии возбуждения атома ртути превращается в колебательную*
энергию СО.

Рис. 80. Зависимость выхода
продуктов фотохимического
окисления пропана от темпе-
ратуры при времени контакта
30 сек
1—перекись; 2 — СО; 3 — СН
3
НСО;
4 — (СИ
3
)
2
СО; 5 —HGHO [359]
продуктов глубокого окисления. Это можно иллюстрировать рис. 80,
заимствованным из работы Фок и Налбандяна [359]. См. также [175,
стр. 380-381].
В монографии [141] детально рассмотрены первичные процессы в фото-
химических сенсибилизированных ртутью реакциях соединений различ-
ных классов. См. также [684].
§ 29. КВАНТОВЫЙ ВЫХОД ФОТОХИМИЧЕСКИХ РЕАКЦИЙ
Основной фотохимический закон
Согласно фотохимическому закону Штарка — Эйнштейна [734, 1531],
число первичных актов фотохимической реакции должно равняться числу
поглощенных квантов света. Обозначая число первичных актов через AN,
полное количество поглощенной лучистой энергии через А
У
и величину
кванта через hv, этот закон можно представить формулой:
AN = AJJhv(29.1)
В большинстве случаев, вследствие протекания вторичных процессов,
число прореагировавших молекул не совпадает с числом первичных фо-
тохимических актов. В общем случае эффективность фотохимического
действия света можно характеризовать некоторой величиной
Г]
= AN/AN*. (29.2)
Эта величина, называемая квантовым выходом, представляет собой число
прореагировавших молекул, приходящихся на один поглощенный квант.
Измерения квантового выхода различных реакций дают значения,
лежащие в очень широком диапазоне. Здесь достаточно привести значе-
ния г] для таких родственных реакций, как Н
2
+ С1
2
= 2НС1 и Н
2
+ Вг
2
—
= 2НВг. Если квантовый выход первой из этих реакций может достигать
1 000 000 [514], то для второй г\ представляет величину порядка 0,001
(при 160-218° С) [518].
Одна из причин часто наблюдающихся малых квантовых выходов —
это прежде всего малая скорость вторичных процессов, благодаря чему
с этими процессами успешно конкурирует дезактивация первичных актив-
ных центров, заключающаяся в расходовании их помимо реакции (на-
пример, в результате рекомбинации атомов и радикалов) или в потере
энергии возбуждения (путем излучения или при столкновениях с окру-
жающими молекулами).
В ряде случаев малый квантовый выход фотохимической реакции обус-
ловлен наличием обратной, также фотохимической реакции. Наличие
обратной реакции проявляется в кинетическом законе суммарной реак-
ции, в частности, в том, что скорость последней становится равной нулю
при отличной от термодинамически равновесной концентрации реагирую-
щих веществ.
