Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.


в молекулу алкана и молекулу олефина. В том случае, когда в реакцию
диспропорционирования вступают два различных радикала, возможны
следующие два пути реакции:
Г Я ! г TT JT*
C
*
H2n
+
2 + С
т
В
2т
п 2п+1 ' m 2m+l л и I р и
> п
2п "1
m 2тп+2
Константы скорости этих процессов, по-видимому, непосредственно не
измерялись
3
. Обычно для различных радикалов измерялось отношение
константы скорости диспропорционирования к константе скорости реком-
бинации радикалов,
А
=
л
диспр/
л
рек. (24.17)
откуда, если известна константа k
veк
, можно найти &
ДИСЩ
Л
Рекомбинация радикалов при низких давлениях является реакцией
третьего порядка и при высоких следует закону второго порядка (см., на-
пример, [1085]). Однако достоверные и достаточно точные данные для кон-
стант скорости рекомбинации алкильных радикалов отсутствуют (ради-
калы СН
3
являются исключением, см. [177]
5
). Имея в виду высокие дав-
ления (речь идет о давлениях в несколько десятков миллиметров ртутного
столба и выше) и положив константу скорости рекомбинации второго по-
рядка &р*ек равной 10
14
см
3
-моль"
1
-сек"
1
(как это сделали Керр и Тротман-
Диккенсон [1055]), из известных абсолютных значений и температурной
зависимости величин Д вычислим константы скорости реакций диспропор-
ционирования. Результаты таких вычислений для нескольких пар алкиль-
ных радикалов приведены в табл. 19.
Как мы видим, реакции диспропорционирования, как правило, имеют
небольшую энергию активации (см. также [1087])
6
.
Из опыта далее следует, что величина А обычно является величиной
порядка 1—0,1, откуда (а также из низких значений величин E
vei{
) можно
заключить о близких значениях скорости процессов рекомбинации и дис-
пропорционирования. Так как, однако, константа fc
peK
представляет собой
константу скорости реакции второго порядка лишь при высоких давле-
ниях, то при низких давлениях, когда рекомбинация протекает по закону
третьего порядка, из двух реакций реакция диспропорционирования
должна быть преобладающей.
При взаимодействии алкильных радикалов между собой, кроме отщеп-
ления атома Н, т. е. кроме разрыва связи С—Н (реакция диспропорциони-
рования), как и при взаимодействии радикала (или атома) с насыщенной
молекулой, возможен также разрыв связи С—С. В результате возникают
3
Приближенный расчет констант скорости диспропорционирования алкильных ради-
калов см. в работе [1594].
4
Рядом авторов предпринимались попытки установить эмпирическое (см. [874]) или
теоретическое [1087] соотношение между константами &
диспр
и &
рек
. Библиогра-
фию по реакциям диспропорционирования и рекомбинации радикалов см. в рабо-
те [815].
6
Лишь недавно Хиат и Бенсон [952] для констант скорости рекомбинационных про-
цессов 2С
2
Н
б
= к-СШю и 2 изо-С3Н7 =
изо-C
e
Hi4
при 142°С получили ю
12,6
±
0,9
и со-
ответственно Ю
11
'
6
*
1
'
1
см
3
»молъ~
1
»сек~
1
(на основе константы скорости 10
13
>
б
сж
3
Х
Хмолъ~~
г
' секГ
1
процесса 2СН
3
= С
2
Не).
в
Для радикалов С
2
Н
5
в области температур—65 -ь- -f
40°
С получено — ^ек—
= — 0,3 ккал или А ~ 7
7
"
0
'
7
[704]. Так как #
ДИС11р
не может быть меньше #
рек
, то
авторы работы [704] считают более правильным закон Д == А
•
Т~
п
.

Таблица 19
Константы скорости и энергии активации реакций диспропорционирования
алкильных радикалов [178]
Реакция
т, °с
^Кдиспр № С)
•Едиспр
'
ккал
СНз + СаНв = СЩ + СаЩ
22-
-237
12,56
0,96
СНз + н-СзНт = СН
4
+ СзН
6
22--182
12,76
1,16
СНз + изо-С
3
Н
7
= СЩ + СзН
6
22-
-182
13,22
2,60
С2Н5 + С2Н5 = СаН
б
+ СаЩ
22--350
13,11
0
С2Н5 + н-С3Н7 = С
2
Н
6
+ СзНб
22-
-129
12,81
0,55
= СзЩ + СаЩ
22
12,74
—
С2Н5 + изо-С
3
Н
7
= С
2
Н
б
+ С
3
Н
6
22-
-144
13,26
2,35
= С
3
Н
8
+ СаЩ
22--112
13,1
2Н-СЗИ
7
= СзН
8
+ СзНе
18--191
13,16
0
н-С3Н7 + U30-C3H7—СзНв + С
2
Н
в
22
13,61
2мзо-СзН
7
= СзН
8
+ СзНб
22
13,84
0
два новых радикала или две молекулы, например, СН
3
+ С
3
Н
7
= 2С
2
Н
б
или С
2
Н
6
+ С
2
Н
4
.
В отличие от реакции радикала с насыщенной молекулой комплекс,
образующийся при взаимодействии радикала с молекулой непредельного
соединения (например, с молекулой олефина) или при взаимодействии
двух радикалов, обладает большой внутренней энергией, измеряемой де-
сятками килокалорий. Так, например, энергия комплекса СН
3
-С
3
Н
в
, из-
меряемая теплотой реакции СН
3
+ С
3
Н
6
= emop-CJl
9
, составляет
~30 ккал, энергия комплекса СН
3
-^-С
3
Н
7
(теплота реакции СН
3
+ н-С
3
Н
7
=
= ft-C
4
H
10
) — 85 ккал. Так как вероятность перераспределения энергии
между различными степенями свободы комплекса (в основном колебатель-
ными) тем больше, чем больше запас превращающейся энергии (см. § 19), то
нужно ожидать, что распределение энергии по связям в двух указанных
комплексах будет осуществляться с большой легкостью. Поэтому распад
комплекса в этих случаях должен осуществляться с большой вероятностью
независимо от того, разрываются ли при этом связи С—Н или С—С (в от-
личие от комплексов, образующихся при взаимодействии радикала с на-
сыщенной молекулой).
Распад большого числа богатых энергий углеводородных радикалов,
образующихся при взаимодействии атома Н с олефином, был изучен в ра-
ботах Рабиновича с сотрудниками. В частности, было показано, что
радикал втор-С
4
Н
9
, образующийся по реакции Н + zf ис-С
4
Н
8
-2 втор-
-С
4
Н
9
(с энергией активации ~2 ккал), распадается преимущественно на
СН
3
+ С
3
Н
6
, т. е. с разрывом связи С—С [1390].
Вероятность распада радикала по тому или иному каналу, естествен-
но, зависит от необходимой для этого распада энергии. Так, распад ради-
кала
Я
НзС—С—С—СНз на СНз + НаС=С—СНз
I I I
н н н
требует меньшей энергии, чем распад на С
2
Н
б
+ НС—СН
3
, что и находит
отражение в отсутствие распада по второму из этих каналов.

Это следует также из рис. 71, на котором приведена энергия системы
Н + цис-С
4
Н
8
(U) вдоль пути реакции (см. Г1391]). Мы видим, что с наи-
меньшей затратой энергии, составляющей 32,5 ккал (теплота реакции
25 ккал плюс энергия активации 7,5 ккал)
7
, происходит распад на СН
3
+
+ С
3
Н
в
. С большей затратой энергии происходит распад на исходные ча-
стицы, что находит отражение в малой вероятности этого пути распада (см.
[1391]). Относительно малую вероятность нужно ожидать также для рас-
пада emop-CJIv на С
2
Н
3
+ С
2
Н
6
, что, в частности, следует из большой
Рис. 71. Изменение потенци-
альной энергии в системе
Н -Ь цис-CJIe для химического
превращения по разным кана-
лам
I/
НО
30
20
10
Н+цис-С
Ч
Н
6
Н+цис-С
ч
Н
л
1
1
\1втор- С
Ч
Н
Д
Координата реанции
энергии активации этого вида распада вследствие необходимой для этого
слояшой перестройки комплекса, сопровождающейся разрывом двух свя-
зей С—С.
Другим примером может служить реакция Н + С
2
Н
5
— С
2
Н
6
—
= 2СН
3
И ккал, в которой разрыв связи С—С, по-видимому, является
главным процессом распада активированного комплекса С
2
Н
6
[934].
В общем случае константа скорости реакции по тому или иному
каналу (х) может быть выражена формулой
/с = к
0
?
p
i
где к
0
— константа скорости образования промежуточного комплекса и
Pi — вероятность распада по г-му каналу.
§ 25. ЗАВИСИМОСТЬ СКОРОСТИ БИМОЛЕКУЛЯРНЫХ РЕАКЦИЙ
ОТ СТРОЕНИЯ РЕАГИРУЮЩИХ МОЛЕКУЛ
За 100 лет, прошедших с того момента, как Бутлеров высказал идею
о связи между химическими свойствами соединений (реакционной способ-
ностью) и их строением, в химии был накоплен огромный опытный мате-
риал на примере разнообразных соединений и классов реакций, иллюстри-
рующий и подтверждающий правильность идеи Бутлерова. Попытки обоб-
щения этого материала и теоретической интерпретации установленных
на опыте закономерностей предпринимались Вант-Гоффом, Оствальдом,
Дж. Томсоном, Косселем на основе электронных представлений и электри-
ческой теории строения атома и далее Полингом, Коулсоном и другими —
на основе квантовой теории строения атомов и молекул. В результате
этих попыток наметились пути, на которых отдельные вопросы связи реак-
ционной способности и строения химических соединений получили неко-
7
Без учета средней тепловой энергии реагирующих частиц минимальная энергия комп-
лекса С4Н9* равна 40 ккал (38 ккал — теплота реакции Н+^ис-СШв = втор-СШ
9
и
2 ккал — энергия активации).

торое частичное теоретическое освещение; однако задача в целом еще да-
лека от своего разрешения. Одно из главных препятствий на пути решения
этой задачи — это отсутствие достаточно полных данных о механизме ре-
акций, особенно отсутствие достаточно точных и систематических коли-
чественных данных о скоростях отдельных элементарных процессов.
Не имея целью сколько-нибудь подробное рассмотрение проблемы свя-
зи между строением и химическими свойствами соединений, приведем
здесь лишь несколько примеров, относящихся к обменным бимоле-
кулярным реакциям. -
Закономерности реакций атохмов натрия
с галогенсодержащими углеводородами
Наиболее полные экспериментальные данные о зависимости скорости
реакции от строения молекул были получены М. Полани с сотр. [923,
924] для реакций атома натрия с хлорпроизводными углеводородов
Na + RCl=NaCl + R.
Эти реакции оказались весьма удобными для изучения влияния строения
молекул на их реакционную способность и в некотором смысле могут рас-
сматриваться в качестве модельных при исследовании обменных реакций.
Прямые измерения энергии активации этих реакций немногочисленны.
Однако, приписывая предэкспоненциальному множителю в формуле Ар-
рениуса некоторое определенное значение, можно оценить энергию акти-
вации, если известна константа скорости при некоторой температуре. Из
опыта следует, что предэкспоненциальные множители для одинаковых ре-
акций гомологических соединений (различные R) сравнительно мало раз-
личаются между собой; поэтому в первом приближении для всех реакций
типа Na + RC1 — NaCl R можно принять одно и то же значение А.
В приведенных ниже численных данных принято А = Z — 5-10
14
см
3
х
Хмолъ^'сек"
1
. В действительности А — PZ и так как Р может иметь не-
сколько различающиеся значения для различных реакций, то значения
предэкспоненциального множителя А, строго говоря, должны разли-
чаться между собой. Однако это не отразится на последовательности из-
менения Е для данного ряда реакций. Ниже приведены [923, 924, 1651]
величины Z/&, представляющие собой эффективность столкновений (к —
константа скорости реакции), т. е. число столкновений, необходимых для
одного акта превращения. Числа в третьей строке означают полученные
указанным выше путем энергии активации (в килокалориях), а в четвер-
той — теплоты реакции (в килокалориях). Рассматривается влияние сле-
дующих структурных особенностей реагирующих молекул.
1. Увеличение числа атомов хлора при одном атоме углерода:
RC1
СН3С1
GH2CI2
СНСЬ ссц
Z/k
104
9-Ю
2
Ы0
а
25
Е 10,0
7,4
5,0 3,5
29,6
Q
14,5 19,5
24,5
3,5
29,6
2. Увеличение длины углеродной цепи:
RC1 CHsCl CH3CH2CI CH3CH2CH2CI CH3CH2CH2CH2CI
Z/k 10*
7 *10
3
4,4.10» 3,3.10
s
Е 10,0 9,4 9,2 8,6
Q 14,5 17 20 —

3. Увеличение числа метильных групп при ос-атоме углерода:
RC1 CH3CH2CI (СН
3
)аСНС1 (СИз)зСС!
Z/k 7-10
3
3,3.10
3
1,5-Ю
3
Е 9,4 ^8,6 7,8
Q 17 — 22,5
4. Влияние двойной связи в а-положении к атому углерода:
RC1 CHaCHaCl СН
2
=СНС1
Z/k 7-10
3
1,1.1(И
Е 9,4 10,4
Q 17 И
5. Влияние двойной связи в (3-положении к атому углерода:
RC1 CH
s
CHaCH
a
Cl СНа=СНСНаС1
Z/k 4,4.Ю
3
2,5-Ю
2
Е 9,2 6,0
Q 20,0 39,5
6. Замена атома галогена:
RX
CPI3F
CH3C1
СИзВг
CH
3
J
Z/k
108
10
4
50
1
E
>25 10,0
4,3
0
Q
-0
15
19
19
Из приведенных данных следует, что энергия активации монотонно
убывает с увеличением теплоты реакции Q. Эта закономерность впервые
была подмечена М. Полани и Оггом [1310] (см. также [748] и далее [1606,
стр. 228—231]), установившими линейную зависимость величины Е от Q.
Позднее Семенов [312, стр. 42] распространил эту закономерность, которая
получила название правила Полдни — Семенова, на обменные реакции
атомов Н иО и радикалов ОН и СН
3
.
Для ряда 6 это правило, вероятно, не выполняется, так как для этого
ряда к атому натрия переходят различные атомы, хотя и связанные с одним
и тем же радикалом.
Вообще следует указать, что правилу Полдни — Семенова, обычно вы-
ражаемому формулой
E=a-$Q, (25.1)
где аир — постоянные величины, подчиняются лишь отдельные группы
реакций.
Соотношение Полдни — Семенова, по-видимому, может быть обосно-
вано существованием аналогичного вида соотношения между теоретиче-
ской энергией активации Е
а
и теплотой реакции Q, полученного теорети-
ческим путем на основании качественных соображений (см. § 11). Сходство
обоих соотношений можно объяснить наличием приближенной линейной
связи между Е
а
и экспериментальной энергией активации.
На рис. 72 мы приводим соответствующие данные для реакций
Na + RCl=NaCl + R (кривая i),
ОН + RH—ИаО + R (кривая 2),
CF
3
+ RH=CF
8
H +• R (кривая 3),
CI + RH=HC1 + R (кривая 4).

в
?
ии ал
Рис. 72. Линейная зависимость ме-
жду энергией активации Е и тепло-
той реакции Q
С1) Na + RC1 = NaCl + R (R = CH
3
, C
2
H
&
,
СН
2
С1, шо-С
3
Н
7
, СС1
3>
СНС1
2
— слева на-
право) [923]; (2) ОН + RH = Н
2
0 + R
(R = СН
3
, С
2
Н
5
, С
3
Н
7
, изо-С
3
Н
7
— слева
направо); (3) CF
3
+ RH = CF
3
H + R (R =
= CH
3
, (GH
3
)
3
G C
2
H
5
, K-C4H9, C
3
H
T
,
изо-С
4
Н
9
— слева направо); (4) GI + RH =
= HG1 = R (R = (CH
3
)
3
CCH
2
, C
2
H
6)
и-C
4
H
0
, C3H7, изо-С
4
Н
9
— слева направо)
i-178, 1053a]
Из приведенных на рис. 72 данных видно, что значения величин а и
Р различны для разных групп реакций.
Закономерности, наблюдающиеся в рядах 1—5, могут быть сопостав-
лены также с некоторыми другими характеристиками молекул. Эйринг
и др. [754, 1513, 1514] предлояшли приближенный способ расчета эффек-
тивных зарядов атомов в молекулах галогензамещенных предельных уг-
леводородов, исходя из данных о дипольных моментах молекул СН
3
Х,
продольной поляризуемости связей и геометрии молекул RX. Для хлор-
замещенных метана получаются следующие значения эффективных заря-
дов атомов:
Н (0,019е)
I
И—С—С1 (—0,205с)
1\
Н (0,148е)
С1 (— 0,108е)
I
С1—С—Н(0,037е)
К
С1 (0,286в)
С1 (—0,146с)
I
Н— С—Н (0,030е)
С1 (0,232е)
С1
С1-С—С1 (-0,081с)
К
С1 (0,324с)
Приведенные выше эффективные заряды атомов вычислялись в предпо-
ложении, что дипольный момент связи С—Н в метане равен нулю.
Представление об эффективных зарядах атомов приводит к следую-
щей картине реакции атома натрия (в общем случае — атома щелочного
металла) с молекулой RC1 (в общем случае — с молекулой RX, где X —
атом галогена). При приближении атома натрия к молекуле RG1 происхо-
дит смещение электронного облака от атома натрия к атому хлора. Нужно
поэтому ожидать, что чем больше эффективный заряд атома хлора, тем
должно быть более затруднено перераспределение электронной плот-
ности в комплексе RC1—Na и тем больше должна быть энергия акти-
вации.
Для того чтобы учесть изменение энергии активации при неизменном
эффективном заряде, необходимо также учесть различную легкость пере-
распределения заряда в процессе реакции в зависимости от величины по-
ляризуемости а-связи С—X. Смит и Эйринг [1513] предположили, что
энергия активации определяется отношением эффективного заряда атома
галогена к поляризуемости связи С—X. Действительно, если по оси орди-
нат откладывать отношение е
Э
фф/а, а по оси абсцисс свободную энергию
активации, то все точки для галогензамещенных метана попадают на одну
прямую (рис. 73). Однако эта закономерность, по-видимому, не является
общей, см. [1513].
I
V
8-
^ CH
3
CL^
-
Уо
СН
2
С
Ч
/iWfiv
А
'CHClg
•ссц
/со
S
| з
,
1 1 1
048
I
I
1
I
^ 0,36
54
58 62
АЕтал
•Не/
10f
j
/
г
h
1
п
/
°б
¥
ц
г
2с
/
/
/
/
d
Г
+3 +5
-5 -3 -/
О +4
I
дЯ + соп#1
Рис. 73. Зависимость между эффективным зарядом атома галогена, деленным на*
поляризуемость связи С—X, и свободной энергией для реакции СН
П
Х
4
_
П
с атомом
натрия [1514]
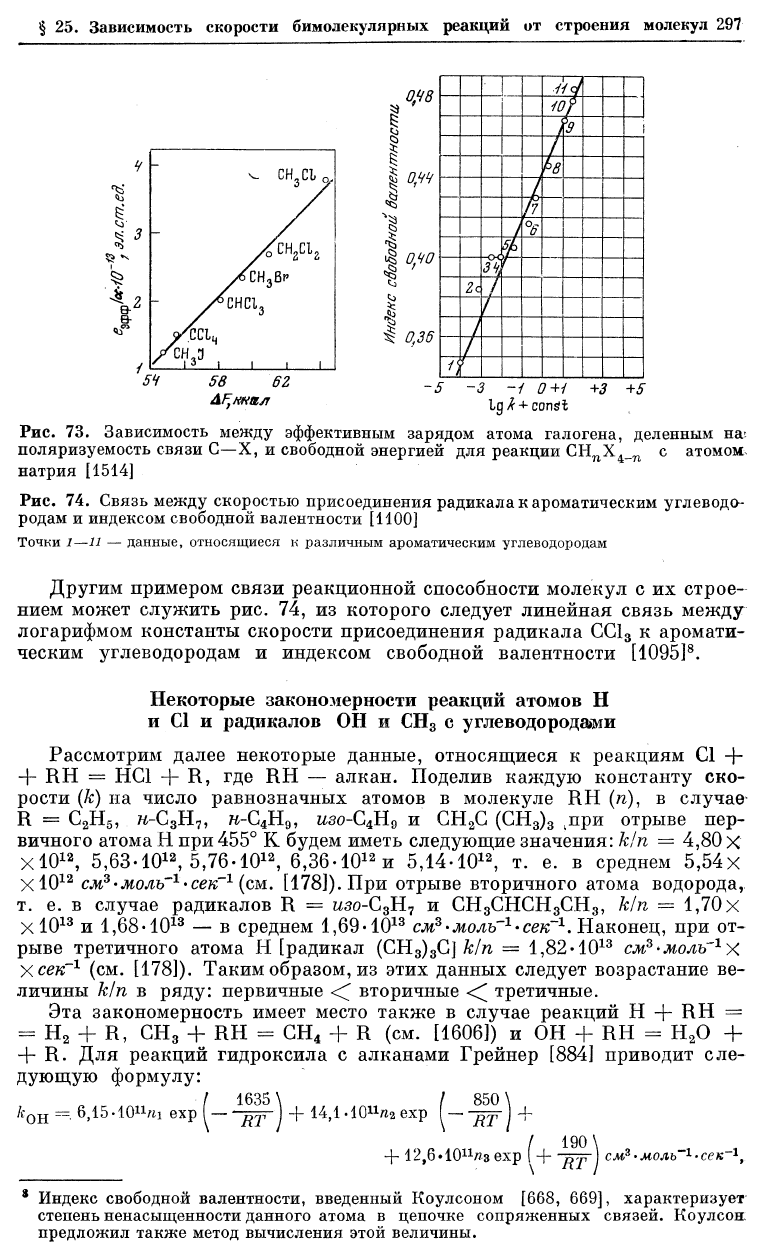
Рис. 74. Связь между скоростью присоединения радикала к ароматическим углеводо-
родам и индексом свободной валентности [1100]
Точки 1—11 — данные, относящиеся к различным ароматическим углеводородам
Другим примером связи реакционной способности молекул с их строе-
нием может служить рис. 74, из которого следует линейная связь между
логарифмом константы скорости присоединения радикала СС1
3
к аромати-
ческим углеводородам и индексом свободной валентности [1095]
8
.
Некоторые закономерности реакций атомов Н
и С1 и радикалов ОН и СН
3
с углеводородами
Рассмотрим далее некоторые данные, относящиеся к реакциям С1 +
+ RH = HG1 + R, где RH — алкан. Поделив каждую константу ско-
рости (к) на число равнозначных атомов в молекуле RH (п), в случае
R = С
2
Н
5
, н-С
3
Н
7
, w-C
4
H
9
, U30-CJ1
9
и СН
2
С (СН
3
)
3 ;
при отрыве пер-
вичного атома Н при 455° К будем иметь следующие значения: kin = 4,80 х
хЮ
12
, 5,63-10
12
, 5,76-10
12
, 6,36-10
12
и 5,14-10
12
, т. е. в среднем 5,54х
хЮ
12
см
3
'моль"
1
•
сек'
1
(см. [178]). При отрыве вторичного атома водорода,
т. е. в случае радикалов R = изо-С
3
Н
7
и СН
3
СНСН
3
СН
3
, kin = 1,70 х
X Ю
13
и 1,68-Ю
13
— в среднем 1,69
•
10
13
см
ъ
-
молъ~
х
* сект
1
.
Наконец, при от-
рыве третичного атома И [радикал (СН
3
)
3
С] kin — 1,82-10
13
см
3
-моль"
1
х
ХсекГ
1
(см. [178]). Таким образом, из этих данных следует возрастание ве-
личины kin в ряду: первичные вторичные <[ третичные.
Эта закономерность имеет место также в случае реакций Н + RH =
— Н
2
+ R, СН
3
+ RH = СН
4
+ R (см. [1606]) и ОН + RH = Н
2
0 +
+ R. Для реакций гидроксила с алканами Грейнер [884] приводит сле-
дующую формулу:
1635 \ I 850
1
-fijT'] + 14,1 -10
u
/i2 ехр
( —
"^jT
[ 190 \
+
12,6*10
U
W3
ехр | + "^jrJ
СМ?-МОЛЪ~
к
оя
—
6,15-10
u
«i ехр
8
Индекс свободной валентности, введенный Коулсоном [668, 669], характеризует
степень ненасыщенности данного атома в цепочке сопряженных связей. Коулсон;
предложил также метод вычисления этой величины.

где &он — суммарная константа скорости; пп
2
и п
3
— число первичных,
вторичных и третичных атомов Н в молекуле RH
9
.
Используя данные по реакциям радикалов СН
3
с различными угле-
водородами [1606], Грейнер [885] приводит также формулу
-
0
[ 9600 \ I '8100 \
к
СИг
/ У 2,24.1(Hni ехр (- -7^7-]!+ 3,16-10^ ехр -jjr-) +
+
9,33 • 10"
9
п
3
ехр ^—
см,3
'
г
'
М0лек
ул'
г
• сек~^*
(&рек — константа скорости рекомбинации радикалов СЫ
3
). Для энер-
гий активации отщепления равнозначных атомов Н от молекул углеводо-
родов радикалами ОН и СН
3
Грейнер далее получает формулу
£
OH
= 0,77£
CH3
-5,7.
Закономерное увеличение скорости отщепления атома Н от первичного
к третичному, по-видимому, нужно связать с уменьшением прочности
связи. Так, например, для СН
3
СН
2
—Н (первичный), (СН
3
)
2
СН—Н (вто-
ричный) и (СН
3
)
3
С—Н (третичный) мы имеем соответственно 97,3; 93,7 и
88,75 ккал. Можно далее предположить, что отрыв атома Н, сопровож-
дающийся перераспределением электронов, происходит тем легче, чем
больше продольная поляризуемость связей, соединяющих атом углерода
с соседними атомами. Согласно 16961, продольная голяризуемосгь связи
С—С, равная 1,68-10~
24
см
3
, в 2 раза превышает продольную поляризу-
емость связи С—Н, равную 0,79-10~
24
см
3
. На основании этих соображений
становится понятным, почему энергия активации и энергия разрыва свя-
зи понижаются по мере увеличения числа атомов углерода, непосредствен-
но связанных с данным, атомом углерода.
На примерах реакций атома G1 с фтористым и хлористым бутилом
CI + СН
2
Х (СН
2
)
2
СН
3
= HG1 + С
4
Н
8
Х (X = F или С1) выясним также
закономерности отщепления атома Н от а-, (3-, 7- и б-углеродов. При 455° К
величины kin в этом случае составляют (в среднем для F- и С1-замещенных):
<(Л/2)
а
= 5,0-10
12
, (&/2)
3
= 8-Ю
12
, (fc/2)
Y
= 16,8-Ю
12
и (й/3)
8
= 5,9х
ХЮ
12
см
3
-моль'
1
-сек'
1
(см. [178]).
Относя эти значения величины kin к (к/3)$, получим:
а (3 у
X—С—с—с—с
0,85 1,35 2,85 1,00
Для объяснения этой закономерности, очевидно, необходимо учесть
действие двух факторов: индукционного эффекта, связанного с наличием
в молекуле атома галогена (X), и влияния поляризуемостей связей. По-
скольку атомы 7 и б находятся достаточно далеко от атома галогена,
здесь, по-видимому, действует только второй фактор: атака атома C
Y
об-
легчена тем, что в отличие от С5 он образует две связи С—С.
Допущение об отсутствии индукционного влияния атома галогена под-
тверждается тем, что отрыв атома водорода от C
Y
и С§ в молекуле «-С
4
Н
10
характеризуется близкими к 2,85 и 1,00 относительными значениями к!п :
: 2,90 и 1,00. Атом С
а
находится под наиболее сильным влиянием гало-
гена и поэтому здесь действует в основном индукционный эффект. Можно
предположить, что уменьшение электронной плотности на атомах водо-
рода, связанных с С
а
, затрудняет их отщепление атомом хлора.
Предположение об уменьшении активности атома водорода под влия-
нием атома галогена находится в согласии с тем, что в молекулах СН
3
С1,
СН
2
С1
2
и СНС1
3
активность атома водорода уменьшается с увеличением
• Этой закономерности не подчиняются реакции ОН с метаном и этаном.

атомов хлора в молекуле, как это видно из относительных значений вели-
чины к/п (п — число атомов водорода) при 455° К: к/3 = 1,00; к/2 —
= 0,85; к/3 = 0,60 (см [178])
10
.
Компенсационный эффект
Коснемся далее закономерности, которая была подмечена в некоторых
группах реакций, известной как компенсационный эффект и выражающей-
ся в том, что предэкспоненциальный множитель в формуле Аррениуса для
константы скорости этих реакций изменяется от реакции к реакции сим-
батно с энергией активации. Из опыта следует, что в то время как в однжх
Рис. 75. Компенсационные
эффект в реакциях атома ки-
слорода с G1GN (i), HCN (2),
BrCN (3) и C
2
N
2
(4) [691]
t
f
и нал
группах реакций этот эффект действительно имеет место, в других он не
наблюдается. Так, например, компенсационный эффект отчетливо выра-
жен в реакциях О + HCN (C1CN, BrCN, C
2
N
2
) = NCO + Н (CI, Вг,
CN) [512, 691], как это явствует из рис. 75. В отличие от этих реакций
в случае реакций Н + НС1 (НВг, HJ) = Н
2
+ CI (Вг, J) компенсацион-
ный эффект отсутствует: при практически одинаковых предэкспоненци-
альных множителях (1пА = 13,47; 13,42; 13,70) энергия активации выра-
жается числами 3,70 (НС1), 1,54 (НВг) и 0,73 (HJ), крайние из которых
различаются в 5 раз.
^Можно предположить, что наличие компенсационного эффекта обус-
ловлено одинаковой структурой переходного комплекса в данной группе
реакций. Так, весьма вероятно, что реакции атома водорода с молекулами
галогеноводородов осуществляются без образования долгоживущего про-
межуточного комплекса (подобно реакции К + НВг = КВг + Н).
Приведем еще следующий пример [178]
(1)
Q
+ N
2
Q = N
2
0 +
О
[ki = Ю
12
'
0
ехр (-4400/ДГ)],
(2) О + NaO - NO + NO [k* = 10
13
'
56
EXP (—27
200/RT)],
(3)
О
+ N
2
0 =
Oa
+ Na [АЗ = 10
12
'
18
exp
(—
22
AOO/RT)].
Мы видим, что в случае первых двух реакций имеет место отчетливо вы-
раженный компенсационный эффект, тогда как третья реакция является
исключением. Это можно связать с тем, что реакция изотопного обмена
(1) и реакция (2), по-видимому, протекают с образованием переходного
комплекса одинакового строения (ONNO), чего нельзя принять для реак-
ции (3).
Вопрос о компенсационном эффекте нуждается в теоретическом рас-
смотрении.
ао
_Однако для реакций CI + СН
4
= НС1 + СН
3
мы имеем к/4 = 0,30.

Бимолекулярные реакции электронно-возбужденных частиц
В последнее время, отчасти в связи с изучением физико-химических
процессов в верхних слоях атмосферы, опубликовано большое число ра-
бот, посвященных реакциям электронно-возбужденных частиц. С точки
зрения физики и химии атмосферы особый интерес представляют химические-
реакции долгоживущих атомов, находящихся в метастабильных электрон-
ных состояниях. Данные по реакциям метастабильных атомов С, N, О, S,
CI, Ge, As, Se, Br, Те, J были опубликованы в обзорной статье Доновена
и Хусейна [711]. См. также [1452].
Кроме реакций атомов значительное число работ посвящено также реак-
циям электронно-возбужденных молекул и радикалов, в частности, ре-
акциям N0, 0
2
, СН
2
(см., например, [178, стр. 257—258]).
Возможны по крайней мере два пути бимолекулярного взаимодей-
ствия электронно-возбужденной частицы с какой-либо молекулой: соб-
ственно химическая реакция и физический процесс дезактивации, в ре-
зультате которого возбужденная частица теряет энергию электронного воз-
буждения и переходит в основное или в одно из более низких электронных
состояний, например:
.—» С
-[
- D
(реакция)
А' + В—
'—» А
+ В (дезактивация)
Соотношение между скоростями химической реакции и процесса де-
зактивации является сложной функцией электронных состояний исход-
ных и конечных частиц, энергии электронного возбуждения частицы А,
запаса и распределения тепловой энергии частиц А и В, вероятности пре-
вращения энергии в процессе дезактивации и т. д. (см., например, [1118]).
Не останавливаясь на теоретической оценке констант скорости указан-
ных процессов, требующей построения поверхностей потенциальной энер-
гии для исходного и конечного состояний системы, знания энергий акти-
вации ит. п., из чего следует, что на современном уровне развития теории
элементарного акта взаимодействия молекул такая оценка практически
во всех случаях не может считаться надежной, здесь мы рассмотрим неко-
торые экспериментальные данные, относящиеся к реакциям электронно-
возбужденного атома иода с молекулами С
2
Н
6
и С
3
Н
8
, а также к реакциям
некоторых других частиц.
Каллир и Вилсон [601] для констант скорости реакций
2
)
+
С
2
Н
6
(C
8
Hs)=H J +
С2Н5 (СН3СНСН3)—5
±
1(2
±
2)
ккал
приводят соответственно следующие значения:
1П19
[ 7000 + 300 \
Л
реак, С
2
Н
6
=
10 ех
Р [- jТГ /
см3
'
Молъ
~
1
*
сек
~
1
И
1П9
- ( §5000 4- 300 \ •
А
реак, С
3
Н
8
= Ю
10
'
25
ехр (- '
Rf
J см
9
-моль'
1
-сек К
Согласно этим авторам, константы скорости процессов дезактивации
атомов У (
2
i\„) при столкновениях с теми же молекулами равны:
Адез,с
2
н
6
= 10
10
'* (60° С) и йдез,с
3
н
8
= Ю
10
>
5
(30° С), увеличиваясь с ро-
стом температуры.
Из приведенных в работе [601] данных следует, что отношение
^дез/^реак
®
случае пропана при 30, 60 и 90° С равно соответственно 6,38-10
3
,
4,07«Ю
3
и 3,05• 10
3
, т. е. /с
дез
более чем на три порядка превышает &
реак
.
Экстраполируя это отношение в предположении, что &дсз? как и &реак»
