Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.


тивная константа скорости реакции
&
Э
фф
= 10
15
>
03
ехр (—73063/i?7") сек'
1
.
При этом установили, что добавки окиси азота тормозят реакцию.
Позднее была измерена истинная константа скорости процесса С
2
Н
6
=
= 2СН
3
, которая вблизи 575° С может быть представлена формулой к
00
=
=
10
16
>
5
ехр (—88
ООО/RТ)
сек"
1
11154]. Таким образом, при 575° С й
эфф
оказывается приблизительно в 20 раз больше Отношение &
э
<мДоо мож-
но, по-видимому, рассматривать как некоторую эффективную длину цепи
(20 звеньев при 575° С). Получающееся при этом уменьшение длины цепи
при повышении температуры может быть обусловлено квадратичным обры-
вом цепи (см. главу XI).
Рис. 57. Два пути изомерного
ц uc-mpanc-wp евращения
1 — без изменения мультиплетности
(I—1)\ 2 — с изменением мульти-
плетности (J—III—I).
U — потенциальная энергия моле-
кулы,
&
— угол поворота
Нередки также случаи, когда мономолекулярная реакция осуществля-
ется двумя или несколькими путями. Одним из простейших примеров такой
реакции является распад иодистого этила,
—ess:?'
Согласно [1702], константы скорости, отвечающие этим путям реакции,
равны: к
г
= Ю
14
'
1
ехр (-52 800/RT) и к
2
= 10
13
>
65
ехр (-50 000/RT) сек'
1
.
Очень часто сложный характер суммарной реакции проявляется в мак-
рокинетическом законе реакции. Так, например, кинетический закон ре-
акции термического распада дииодэтана C
2
H
4
J
2
[415] и втор-бутилиодида
C
4
H
9
J [1309] в определенном интервале давлений и температур описыва-
ется, соответственно, следующими уравнениями:
d [C2H4J2I
Г
-
dt
= Ai[CaH«J
2
] +
Ar
2
[C2H4J
2
]
[J2]
1
'
2
И
d [C4H9J]
dt
••
/ci[C
4
H
9
J] +
A*
[C4H9J] [J
2
]
V2
В этих уравнениях первое слагаемое представляет скорость собственно
мономолекулярного процесса распада соответствующего иодида (т. е. ско-
рости процессов C
2
H
4
J
2
= C
2
H
4
J + J и C
4
H
9
J == С
4
Н
9
+ J); второе сла-
гаемое — скорость вторичного процесса бимолекулярного взаимодействия
исходного иодида с образующимися в первичном процессе (а также при
диссоциации J
2
) атомами иода. Заметим, что при распаде дииодэтана взаи-
модействие атомов иода с C
2
H
4
J
2
представляет собой цепной процесс.
Необходимость тщательного исследования кинетики мономолекуляр-
ных реакций и осторожного подхода к интерпретации экспериментальных
фактов особенно наглядно иллюстрируется на примере разложения пяти-
окиси азота N
2
0
5
. Эта реакция, являющаяся первой известной гомогенной
мономолекулярной реакцией, обладает рядом аномалий, долгое время не
поддававшихся теоретическому истолкованию.

Одна ив аномалий состоит в том, что константа скорости реакции не за-
висит от давления N
2
0
5
вплоть до давлений порядка 0,1 мм рт. ст. С мо-
мента установления гомогенного характера этой реакции (Даниельс и
Джонстон [689]) ее исследованию было посвящено большое число работ, и
только сравнительно недавно была вскрыта причина ее аномального по-
ведения. Огг [1307] предложил механизм термического разложения пяти-
окиси азота, начинающегося с мономолекулярного распада N
2
0
5
по схеме
N
2
0
5
= N0
3
+ N0
2
, за которым следует ряд бимолекулярных процессов
(близкий к этому механизм был предложен Смитом и Даниельсом [1511]
для термического разложения N
2
0
5
в присутствии окиси азота N0). Со-
гласно этому механизму, нашедшему подтверждение в последующих ра-
ботах [964, 965, 1016, 1017, 1020, 1021, 1043, 1259, 1453], наблюдаемая при
низких давлениях константа скорости мономолекулярного распада явля-
ется кажущейся и в действительности представляет собой произведение
константы равновесия N
2
0
5
^ N0
3
+ N0
2
и константы скорости бимо-
лекулярного процесса N0
3
+ N0
2
= N0
2
+ NO + 0
2
, чем и объясняется
постоянство эффективной константы скорости мономолекулярного распада
N
2
0
5
при низких давлениях. На основании принятого механизма реакции
могут быть объяснены и другие аномалии термического разложения N
2
0
5
.
Как следует из теории мономолекулярных реакций, в отличие от вели-
чины
Аоо,
слабо зависящей от температуры, предэкспонент
А
0
в выражении
зависит от температуры в значительно большей степени (см. § 19). Так,
например, нужно ожидать, что для молекул, аппроксимируемых осцил-
ляторной моделью, предэкспонент А
0
при высоких температурах будет
зависеть от температуры, А
0
— y-s+vгде 5 — число степеней свободы
молекулы.
Ввиду неопределенностей, возникающих при построении модели актив-
ной молекулы, однозначное определение
s
теоретическим путем часто оказы-
вается невозможным. Поэтому обычно используется следующая формула:
где п — число, находимое из опыта, a D
0
— энергия разрываемой связи,
равная Е
а
. Вследствие малой точности измерений температурной зависи-
мости константы скорости при высоких температурах, полученные в раз-
личных работах величины п часто значительно расходятся между собой.
Так, по данным различных авторов значения п для константы ско-
рости диссоциации кислорода по реакции 0
2
+ 0
2
= О + О + 0
2
лежат
в пределах 1,5—3,0. Однако все полученные абсолютные значения кон-
станты, по-видимому, близки к истинным.
Можно убедиться в том, что вычисленные по формулам различных ав-
торов значения не более чем в 2 раза отличаются от значений, вычис-
ленных по формуле
в температурном интервале 3000—7000° К, в котором проводились измере-
ния [177].
Число п = 3 превышает максимально возможный для двухатомных мо-
лекул показатель п = 2, получающийся при допущении, что в активации
Предэкспоненциальный множитель в выражении ко
к
0
= А
0
ехр (— E
a
JRT)
(20.2)

молекулы 0
2
в процессе 0
2
+ 0
2
= О + О + 0
2
участвуют оба партнера
соударения. Возможное объяснение большого значения п состоит в следу-
ющем: если в активации молекулы кислорода при столкновениях 0
2
+ 0
2
основной вклад дает обмен колебательной энергии, то диссоциация может
вызвать понижение колебательной температуры. Это нарушение равновес-
ного распределения колебательной энергии на нижних уровнях, которое
отсутствует в случае системы двухатомная молекула — атом инертного
газа, может привести к дополнительной отрицательной температурной за-
висимости предэкспонента [194].
Константа к
0
нередко также выражается простой эмпирической форму-
лой Аррениуса
*о = ^эксп
ех
Р (-
&
эксп!
R
n (20.3)
где^экспИ.Е'эксп — величины, постоянные в определенном температурном
интервале.
Обозначив через Т температуру, при которой константы к
0
, вычисляе-
мые по формулам (20.2) и (20.3), совпадают, можно показать, что при
TjT = 2 эти значения различаются в 1,34^ раза при п = 2, в 1,62 раза при
п = 3 и в 1,97 раза при п — 4; при TIT —
1
/
2
различия составляют соот-
ветственно 1,58; 2,14 и 2,94 раза.
Обмен энергии в мономолекулярных реакциях. Константа скорости ре-
акции второго порядка к
0
зависит от природы партнера соударения, по-
скольку скорость активирующего соударения АВ + М = АВ * + М опре-
деляется взаимодействием частиц АВ и М. Ниже приведены относительные
эффективности активирующих столкновений различных газов в реакции
Н
2
0
2
+ М - 2 ОН + М [178, стр. 316]
М Не Аг 0
2
N2 С0
2
Н
2
0 Н
2
0
2
Относительная эффек-
тивность, а 0,55 0,67 0,75 1,00 1,24 4,8 6,0
Из этих данных следует, что наименьшей эффективностью обладают одно-
атомные гелий и аргон, наибольшей эффективностью — перекись водорода,
содержащая наибольшее число атомов. Однако в отличие от атомов инерт-
ных газов в реакциях типа А
2
+ М = А + А + М эффективность атомов
А превышает эффективность молекул А
2
, насколько об этом можно судить
по данным, относящимся к диссоциации молекул Н
2
, N
2
и 0
2
. Большая эф-
фективность атомов особенно ярко выражена в случае водорода, для кото-
рого в. области температур 3000—4500° К отношение > 20 [813].
Исследования мономолекулярных реакций дают ценные сведения о про-
цессах обмена энергии. В рамках допускаемых приближений теория моно-
молекулярных реакций позволяет оценить порядок величины вероятности
передачи энергии в процессах активации и дезактивации при молекуляр-
ных соударениях. Так, в случае осцилляторной модели мы имеем следую-
щее выражение для эффективной константы скорости к активационного
процесса:
(20.4)
(20.5)
(Р * — вероятность дезактивации при одном столкновении и Z
0
— частота
столкновений).
(Е ГкТ)
8
'
1
к = ko [М] = z
0
[М]
(
7_;
}
, ехр (- Е
а
/кТ),
где
z; = p*z
0

Как видно из приведенных выше формул для вычисления Р*, кроме
константы к
0
нужно знать входящие в выражение для этой константы
параметры Е
а
, s, а также диаметр молекулы d, входящий в выраже-
ние Z
0
.
Вычислим для примера вероятности дезактивации молекул N
2
0
и F
2
0. Согласно Джонстону [1016] , для N
2
Q при 888° К имеем ШМ] =
= 14,0 см
3
-моль"
1
•секПодставляя это число в формулу (20.4) и принимая
d = 3,2 -10~
8
см, Е
а
= 60 ккал, s = 4 и Т = 888 °К, найдем
Р* = 0,01. Что касается F
2
0, то из измеренной константы к [1084]
(Т — 523° К), d = 3,2 -10"
8
см, Е
а
= 40,6 ккал и s = 3 в этом случае по-
лучим Р* — 0,75
Таким образом, вероятность дезактивации активной молекулы F
2
0
оказывается на два порядка больше величины Р* для N
2
0. Это различие,
по-видимому, обусловлено тем, что величина колебательного кванта актив-
ной молекулы N
2
0 вследствие неадиабатического характера распада N
2
0
(см. [262, § 27, рис. 24]) велика, что не имеет места в случае адиабатичес-
кого процесса распада F
2
0.
Предыдущие расчеты основаны на представлении о молекуле как гар-
моническом осцилляторе, что получает некоторое обоснование в следую-
щем. Ввиду того что энергия активной молекулы, т. е. энергия, необхо-
димая для ее мономолекулярного превращения, распределена между не-
сколькими колебательными степенями свободы (имеется в виду молекула,
состоящая более чем из двух атомов), можно предполагать, что колеба-
тельные квантовые числа соответствующих заселенных уровней невелики.
Это позволяет приближенно считать колебания активированной молекулы
гармоническими.
Рассмотрим, например, мономолекулярный распад N
2
0. В предположе-
нии, что энергия активации, составляющая ~ 60 ккал, распределена по-
ровну между всеми четырьмя колебательными степенями свободы, макси-
мальное значение колебательного квантового числа получим, разделив
15 ккал на энергию кванта, отвечающего наименьшей частоте 589 см'
1
(1,68
ккал): £>тах — 15/1,68 = 9. Экстраполируя далее величину
0
[1549,
стр. 211—212] к 900° К (температуре опытов по мономолекулярному раз-
ложению N
2
0), найдем для этой температуры
0
— 2 -10
2
и, следователь-
но, Р1, о
=
5 -10~
3
. Отсюда для вероятности дезактивации активированной
молекулы N
2
0 получим Р
9)8
= 4,5 -10"
2
. Это число по порядку величины
близко к вычисленной выше вероятности дезактивации активированной
молекулы N
2
0, Р* — 0,01.
Энергия активации мономолекулярных реакций
Из обширного опытного материала следует, что все процессы мономо-
лекулярного превращения в зависимости от соотношения между энергией
активации Е«, и тепловым эффектом реакции можно разделить на два клас-
са. К одному из этих классов относятся процессы, энергия активации ко-
торых превышает величину теплового эффекта. Таковы, в частности, ре-
акции цис-транс-изошершаащж, энергия активации которых составляет
десятки килокалорий при тепловом эффекте в несколько килокалорий.
Примером может служить изомеризация 1,2-диметилциклобутана, для ко-
торой константа скорости ^ис-т/?а«с-превращения выражается формулой
к = 10
14
>* ехр (— 60 100IRT) сек"
1
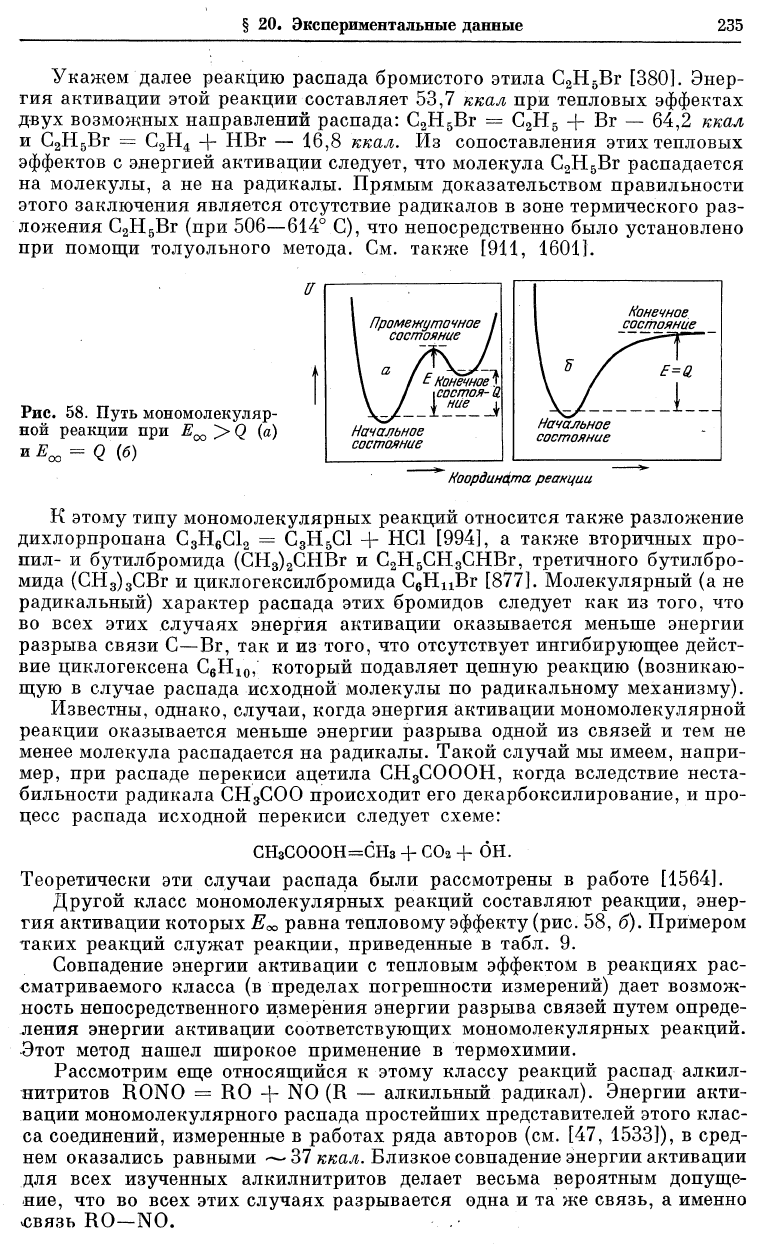
[839]. Путь мономолекулярной реакции
в этом случае может быть представлен рис. 58, а.
Хорошим примером мономолекулярной реакции рассматриваемого ти-
па является распад закиси азота N
2
0 = N
2
+ О — 38,7 ккал, энергия ак-
тивации которого равна 60,0 ккал.
Укажем далее реакцию распада бромистого этила С
2
Н
5
Вг [380]. Энер-
гия активации этой реакции составляет 53,7 ккал при тепловых эффектах
двух возможных направлений распада: С
2
Н
5
Вг = С
2
Н
5
+ Вг — 64,2 ккал
и С
2
Н
5
Вг = С
2
Н
4
+ НВг — 16,8 ккал. Из сопоставления этих тепловых
эффектов с энергией активации следует, что молекула С
2
Н
5
Вг распадается
на молекулы, а не на радикалы. Прямым доказательством правильности
этого заключения является отсутствие радикалов в зоне термического раз-
ложения С
2
Н
5
Вг (при 506—614° С), что непосредственно было установлено
при помощи толуольного метода. См. также [911, 1601].
U
Рис. 58. Путь мономолекул ар-
ной реакции при Е^ > Q (а)
и^
00
= <?'(б)
HoopduHdma реакции
К этому типу мономолекулярных реакций относится также разложение
дихлорпропана С
3
Н
6
С1
2
= С
3
Н
5
С1 + НС1 [994], а также вторичных про-
пил- и бутилбромида (СН
3
)
2
СНВг и С
2
Н
5
СН
3
СНВг, третичного бутилбро-
мида (СН
3
)
3
СВг и циклогексилбромида С
6
НцВг [877]. Молекулярный (а не
радикальный) характер распада этих бромидов следует как из того, что
во всех этих случаях энергия активации оказывается меньше энергии
разрыва связи С—Вг, так и из того, что отсутствует ингибирующее дейст-
вие циклогексена С
6
Н
10
, который подавляет цепную реакцию (возникаю-
щую в случае распада исходной молекулы по радикальному механизму).
Известны, однако, случаи, когда энергия активации мономолекулярной
реакции оказывается меньше энергии разрыва одной из связей и тем не
менее молекула распадается на радикалы. Такой случай мы имеем, напри-
мер, при распаде перекиси ацетила СН
3
СОООН, когда вследствие неста-
бильности радикала СН
3
СОО происходит его декарбоксилирование, и про-
цесс распада исходной перекиси следует схеме:
СНзСОООН=СНз + С0
2
+ ОН.
Теоретически эти случаи распада были рассмотрены в работе [1564].
Другой класс мономолекулярных реакций составляют реакции, энер-
гия активации которых
Е<*>
равна тепловому эффекту (рис. 58, б). Примером
таких реакций служат реакции, приведенные в табл. 9.
Совпадение энергии активации с тепловым эффектом в реакциях рас-
сматриваемого класса (в пределах погрешности измерений) дает возмож-
ность непосредственного измерения энергии разрыва связей путем опреде-
ления энергии активации соответствующих мономолекулярных реакций.
Этот метод нашел широкое применение в термохимии.
Рассмотрим еще относящийся к этому классу реакций распад алкил-
нитритов RONO = RO + NO (R — алкильный радикал). Энергии акти-
вации мономолекулярного распада простейших представителей этого клас-
са соединений, измеренные в работах ряда авторов (см. [47, 1533]), в сред-
нем оказались равными — 37 ккал. Близкое совпадение энергии активации
для всех изученных алкилнитритов делает весьма вероятным допуще-
ние, что во всех этих случаях разрывается одна и та же связь, а именно
етязь RO—NO.

Т а б лица 9
Энергии активации Е^ реакций термического распада и энергии
разрываемых связей Q [47]
Разрываемая
связь
Q
Еоо
1 g А*
Разрываемая
связь
Q
Еоо
1 g А*
Разрываемая
связь
ккал
1 g А*
Разрываемая
связь
ккал
1 g А*
СНз—Н
102,4
103
15
CH3O-NO
37,7
34 12,9
СНз—СНз
" 86,&
88
16,3 NHa—NHa
58,4
54
13
GH
3
CO—ОССНз
<69,6
67,2
16
NF2-NF2
19,1
19,4
15,0
СвНбСНз—•СНз
<72
69,2
14,7
N0
2
—NO2
12,8 13,0 16,0
С2Н5—J <53
50
13,6
5
SF5-F 76
75,9
12,9s
* А выражено в сек-*.
Наряду с распадом на монорадикалы к этому же классу реакций отно-
сятся случаи распада молекул с образованием бирадикала, например, рас-
пад молекулы кетена СН
2
СО на СО и бирадикал СН
2
. Шилов и Сабирова
[381] в результате изучения термического распада СНС1
3
и CDC1
3
пришли к
заключению, что распад этих молекул протекает по схеме СНС1
3
= СС1
2
+
+ НС1. Константа скорости этого процесса выражается формулой к«, —
= 2,6 -10
11
ехр (—47
ООО/RT)
сек"
1
, тепловой эффект равен 53,7 + 10 ккал.
Вследствие отрицательной температурной зависимости предэкспонен-
циального множителя в выражении для константы скорости мономолеку-
лярной реакции второго порядка входящая в формулу Аррениуса,.
экспериментальная энергия активации Е
эксп
обычно оказывается сущест-
венно меньше величины Е
а
. Можно показать, что эти величины связаны
соотношением
Яэксп = (20.6)
где Т — средняя температура в изучаемом температурном интервале. Из
этой формулы следует, что при п = 2, 3 и4 и Т = 3500° К разность
Е
а
— Яэксп составляет соответственно 10,5; 17,5 и 24,5 ккал.
В приведенном выше примере мономолекулярного распада С0
2
(§ 19)
разность Е
а
— £
ЭКС
п в температурном интервале 3000—4000° К составля-
ет — 25 ккал. Как мы видим, этой величине соответствует п — 4. С другой
стороны, из механизма сильных столкновений следует п — s — 1. Под-
ставляя сюда s = 4 (число колебательных степеней свободы С0
2
), полу-
чим п — 3. Это противоречие указывает на то, что активация С0
2
происхо-
дит по ступенчатому механизму.
Граница между областью низких и областью высоких давлений
Выше в качестве условной границы между этими областями было взято
давление /?i/
2
, при котором эффективная константа скорости к равна поло-
вине максимальной (коо).
Предельным случаем мономолекулярных реакций, скорость которых
следует закону второго порядка (константа скорости к
0
) еще при очень
высоких давлениях, является распад двухатомных молекул. Как указано
выше (§ 19), в этом случае состояния активной и активированной молекул

совпадают, так как двухатомная молекула немедленно диссоциирует, как
только ее энергия становится равной теплоте диссоциации; другими слова-
ми, время жизни активной молекулы является величиной порядка периода
колебаний. Давление рц
г
можно оценить, приравняв число столкновений
активной молекулы к обратному времени жизни. Взяв частоту столк-
10
10
см
3
-молекул
сек
и частоту колебаний равной
новении равной
АО
13
сек'
1
, получим LM]I/
2
= 10
23
молекул!см
3
или pv
2
~ 10 000 атм (Т
•= 500° С). Из этого расчета следует, что распад двухатомных молекул прак-
тически всегда является реакцией второго порядка.
Примером здесь может служить реакция 0
2
+ Аг = О + О + Аг,
изученная в температурном интервале 2850—18 000° К [1654, 1694, 1695].
Для температурного интервала 5000—18 000° К Рей [1694] приводит
два возможных выражения константы скорости: к = 2,5 -10
16
T~
l2
X
X
ехр (-118000/ЯГ) и к = 2,4
-10
18
Т'
1
ехр (—118 000/Л
Г)
см
3
-моль'
1
-сек'
1
.
Согласно Уотту и Майерсону [1654], в области температур 2850—5550° К
к = 5,01 -10
19
Г"
3
/* ехр (—118
000/RT).
Обращаясь к теоретической форму-
ле (19.35) и полагая йсо kТ, для температурной зависимости константы
скорости получаем:
к ~ g
r
(Т)
Г-i ехр (—118 000/ЯТ).
Как указывалось ранее, g
r
(Т) ~ Т
7-1
^ — 7
7
-
1
/*. Таким образом, предска-
зываемую теорией отрицательную температурную зависимость предэкспо-
нента константы скорости можно считать удовлетворительно согласующей-
ся с опытом.
В табл. 10 приведены значения
р^
г
,
измеренные для некоторых реакций.
Таблица 10
Измеренные значения p
v
для некоторых реакций
Реакция
Piy
2
, мм рт. ст.
N
2
0 + Аг =
N2
+ О Аг
CF
2
N
2
CF
2
+.N.2
€
2
Нб — СНз + СНз
С2НбС1~,С2Н
4
+
НС1
Циклопропан —»СзН
б
Циклобутан 2G2H4
Метилциклопропан —»бутены
Диметилциклопропаы
—>
пен-
тены
2000
443
839
521
1000
723
763
754
15
000
100
5
4-6
3
0,15
0,2
0,03
Примечание. Литературу см. в работе [47].
Из данных этой таблицы отчетливо видна резкая зависимость величины
ру
2
от степени сложности молекулы: с увеличением числа атомов в молеку-
ле и, соответственно, с увеличением числа колебательных степеней свободы
область давлений, в которой удельная скорость реакции перестает зави-
сать от давления, все больше перемещается к малым давлениям.
Граница между областями высоких и низких давлений, pv
2
, в принципе
может быть получена также теоретическим путем на основании формулы
(19.22). Эту формулу, полученную для высоких температур, можно, одна-
ко, считать приближенно справедливой при любой температуре, если вмес-
то истинного числа колебательных степеней свободы s использовать $
Э
фф
(очевидно,
5
Э
фф
должно быть меньше
s).
Ввиду невозможности получить на-

Т{а^б[л и ц а 11
Значения «
эксп
и s для некоторых реакций [1614]
Реакция
EQQ,
ккал
Т, °К
S
9KCn
s
N
2
O-*N
2
+;О
61,1 888 3
4
ЖШ-*ГЮ
а
+ С1
29,5
500
4,5 6
СН
4
-> СНз + н
102
2000
7,2
9
CHF
3
-*CF
2
+ HF
69
. 1800 9,3
9
GHsNC CH
3
CN
37,9
504 4,6 12
N
2
F
4
-> 2NF
2
19,8 400
7,5 12
N
2
0
5
-* NOa
-4-
N0
3
20,9
300
11,8
8
15
С
2
Н
б
-> C
2
H
4
+ H
40,0
791
11,8
8
15
ципло- СзНб-* GH3CHCH2
65,0
765
13-14 21
дежные значения
£
Э
фф
теоретическим путем при обработке эксперименталь-
ных данных обычно рассматривают 5
э
фф как эмпирический параметр
(^эксп)• В табл. 11 полученные таким путем значения $
ЭК
сп сопоставлены
с числами s. (О сопоставлении $
Э
ксп с $
Э
фф см. в работе [1614].)
Влияние примесей
Примеси могут быть двух сортов: активные примеси, вступающие в хи-
мическое взаимодействие с исходными веществами или с продуктами их
превращения, и примени
пассивные.
Рассмотрим сначала пассивные приме-
си, действие которых прежде всего должно сказаться на процессах актива-
ции и дезактивации. На основании простой схемы Линдемана (где X —
примесь)
М + М^М*+М (Л
м
, /с'
м
),
М + Х^=М*+Х (k
Xt
k'
x
),
М* —>
продукты (к*)
для эффективной константы скорости мономолекулярной реакции получим
выражение (при стационарной концентрации активных молекул М*)
»-г >'»'+> W ,.
(20
,>
<
[М]
+
[X]
+
А:*
которое можно также переписать в виде:
к
=
к
——— г-
>
(20.8)
где к^ = к* {к
м
/к
ж
) = /с* (&
х
/&х)-
В отсутствие примеси уравнение для скорости реакции можно записать
в виде:
1 d [М]
к
оо [М]
~ [М] dt - [М] + [М]
1/2
'
где [M]i/
2
= к^/км — концентрация М, при которой эффективная констан-
та скорости равна половине кИнтегрируя это уравнение, будем иметь
[М]
1/2
А
со*50% -
1П 2
+ [М]
0
'
Здесь [М]о — начальная концентрация и t
b0
o/
0
— время 50%-го превраще-
ния молекул М. Из этой формулы следует, что при малых концентра-
циях LM]о зависимость &оо£
5
о% от [М]
0
представляется гиперболой, а при
lM]
0
^>[M]i/
2
произведение &оо£
5
о% становится равным In 2.
Допустим теперь, что вещество М разбавлено примесью X, концентра-
ция которой удовлетворяет условию &
х
[Х] к*,
к'
ж
[М]. В этом случае
скорость реакции выразится уравнением
1 d [М] k*k
x
~ [М] dt ^ к
х
интегрирование которого дает
*
50
о
/о
= In 2.
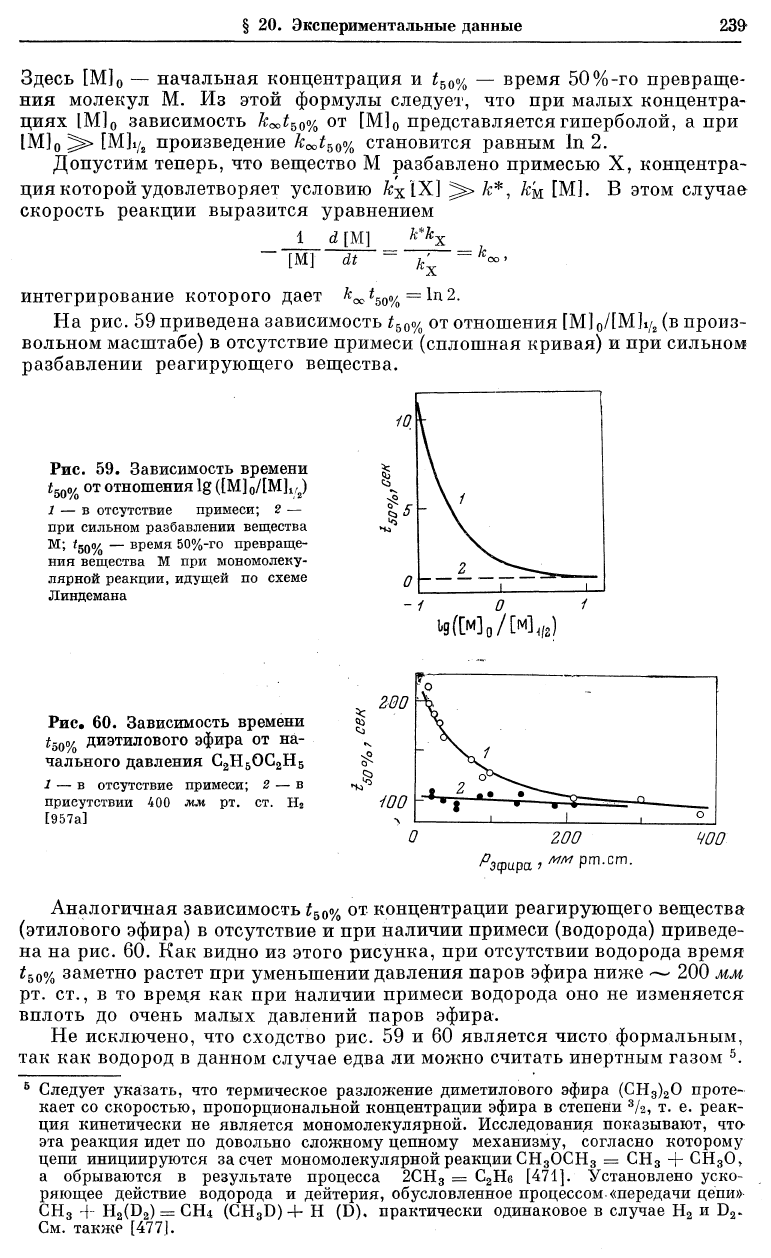
На рис. 59 приведена зависимость
t
b00/о
от отношения [M]
0
/[M]i/
2
(в произ-
вольном масштабе) в отсутствие примеси (сплошная кривая) и при сильном
разбавлении реагирующего вещества.
Рис. 59. Зависимость времени
*5о%
от
отношения lg ([М]
0
/[М]
1/2
)
1 — в отсутствие примеси; 2 —
при сильном разбавлении вещества
М; t
5
Q<y
Q
— время 50%-го превраще-
ния вещества М при мономолеку-
лярной реакции, идущей по схеме
Линдемана
- / 0 1
Ц(М
0
/!ХУ
Рис. 60. Зависимость времени
г
50
О/ диэтилового эфира от на-
чального давления С
2
Н
5
ОС
2
Н
5
1 — в отсутствие примеси; 2 — в
присутствии 400 мм рт. ст. Н
2
[957а]
Аналогичная зависимость t
50
о/
0
от концентрации реагирующего вещества
(этилового эфира) в отсутствие и при наличии примеси (водорода) приведе-
на на рис. 60. Как видно из этого рисунка, при отсутствии водорода время
t
50
o/
o
заметно растет при уменьшении давления паров эфира ниже — 200 мм
рт. ст., в то время как при наличии примеси водорода оно не изменяется
вплоть до очень малых давлений паров эфира.
Не исключено, что сходство рис. 59 и 60 является чисто формальным,
так как водород в данном случае едва ли можно считать инертным газом
5
.
6
Следует указать, что термическое разложение диметилового эфира (СН
3
)
2
0 проте-
кает со скоростью, пропорциональной концентрации эфира в степени
3
/2, т. е. реак-
ция кинетически не является мономолекулярной. Исследования показывают, чта
эта реакция идет по довольно сложному цепному механизму, согласно которому
цепи инициируются за счет мономолекулярной реакции СН
3
ОСН
3
= СН
3
+ СН
3
0,
а обрываются в результате процесса 2СН
3
= С
2
Нб [471]. Установлено уско-
ряющее действие водорода и дейтерия, обусловленное процессом «передачи цепи»
СН
3
+ H
2
(D
2
) = СЩ (CH
3
D)4- Н (D), практически одинаковое в случае Н
2
и D
2
_
См. также [477].

Эффективность активирующего и дезактивирующего действия различ-
ных газов может быть оценена количественно. Если при некоторой кон-
центрации взятого в чистом виде вещества, претерпевающего мономолеку-
лярное превращение, удельная скорость реакции равна величине
^ОО [М]
к
— •
[М]
+ [M]i/
2
•
то, увеличивая концентрацию этого вещества на Д [М], получим:
[М]
+
А
[М]
к + Ак = к
0
[М]
+
А [М]
+[М]
Г
,
Такое же увеличение удельной скорости можно получить, примешивая по-
сторонний газ при соответствующей концентрации, определяемой усло-
вием
[М] + к
х
/к
ж
[X]
rt I Л к* —— If ———————————————•» •
°°[М] +
[М]
1/2
+ й
х
/*
м
[Х]
Из двух последних формул найдем:
(20
.
9)
м t
x
l Рх
Обращаясь к химически активным примесям, заметим, что действие этих
примесей, естественно, не укладывается в рамки теории собственно моно-
молекулярных реакций и в каждом конкретном случае должно рассмат-
риваться особо.
Примеси, непосредственно взаимодействующие с исходным веществом,
обусловливают наложение на мономолекулярный процесс бимолекуляр-
ного взаимодействия этого вещества с молекулами или атомами примеси,
что приводит к искажению кинетического закона реакции. Примеси, взаи-
модействующие с продуктами распада исходного вещества, вообще говоря,
также могут изменить кинетический закон реакции, однако, лишь в тех
случаях, когда первичный процесс распада исходного вещества перестает
быть лимитирующим процессом. Чаще всего этот процесс остается лимити-
рующим и в присутствии примесей.
Ярким примером определяющего кинетику реакций влияния активных
примесей может служить реакция термического распада закиси азота
N
2
0 в присутствии иода и брома.
Согласно измерениям Фольмера PI Богдана [1645], в присутствии этих
веществ реакция идет по уравнению
ЙПЪОГ
lf
- dt -MN2O] [Х
2
]Ч
где [Х
2
] — концентрация галогена, причем скорость реакции в среднем
в 250 раз больше скорости разложения чистой N
2
0. Интересно отметить,
что галоген в этой реакции не расходуется и действие его, таким
образом, нужно рассматривать как чисто каталитическое. Продуктами
каталитической реакции, как и реакции распада чистой N
2
0, являются
N
a
и 0
2
.
Активные примеси могут возникать также в ходе самой мономолеку-
лярной реакции. В качестве примера можно привести рассмотренный выше
распад дииодэтана, скорость которого определяется как скоростью
первичного мономолекулярного распада молекулы C
2
H
4
J
2
по схеме
