Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.


(EJkT s) значения констант к
0
и величина т* равны:
*«,= v* ехр(-Я
а
/кГ),
(Е /кТ)
8
"
1
k
* =
z
l\*-l)\ exp(-^
Q
/k Г), (19.21)
t* = (v-)-i (E
v
/kT)
s
~y(s - 1)!
В промежуточном случае отношение к/к^ выражается безразмерной функ-
цией:
*/*« =
J
S-1 (19.22)
где
оо
о
(5 —
1)!
м
•^(5— 1)!
-1
Я = [М] zy,
табулированной, например, в книге Слейтера [1505].
Когда квантование колебаний существенно (кГ ^ h(d
k
), для прибли-
женного расчета к все еще можно пользоваться выражением (19.22), в ко-
торое вместо истинного числа колебательных степеней свободы s следует
подставлять эффективное число 5
Э
фф. Правила определения $
Э
фф но s и
частотам колебаний молекулы сформулированы в работах [854, 1614].
Интересно сравнить формулу (19.22) с результатом приближенного
рассмотрения кинетики мономолекулярной реакции на основе схемы Лин-
демана (19.4), в которой не учитывается распределение активных молекул
по состояниям, т. е. константа к * не зависит от энергии. В квазистацио-
нарном приближении из этой схемы получаем
к
а
[Ml
к*
к
а
к*
fe __
11 1
J __
а
/Л Q
23\
к_а [М] Ч
-
к*
к
-а i+k*lk-a[M] '
1
' '
откуда следует
к
оо
=
(
к
а1
к
-а) к*
И
к
0
= к
а
. ' (19.24)
Для промежуточной области давлений будем иметь:
к
[М]
z
0
Y
^оо i + [M]Z
0
V '
Z
0
= k_
a
, х =1/к. (19.25)
Из (19.25) видно, что схема Линдемана предсказывает падение констан-
ты скорости в 2 раза от предельного значения при уменьшении параметра
|М] Z
0
т* до единицы независимо от числа степеней свободы молекулы.
В то же время исследование функции /
s
_в (19.22) показывает, что при
s = 3 (трехатомная молекула) к становится равным V
2
k^>
при уменьше-
нии [М] Z
0
x* до 3,33, а при s = 6 (четырехатомная молекула) — до 46.
Отличие этих величин от единицы не может быть устранено за счет какой-
либо вариации констант в схеме Линдемана и ясно указывает на важную
роль зависящего от давления распределения активных молекул по энергиям
в области Е > Е
а
.
Отклонение от формулы теории Линдемана — Хиншельвуда (19.25),
предсказывающей линейную зависимость ilk от 1 !р, проиллюстрировано
на рис. 53.

Перейдем теперь к обсуждению механизма ступенчатой активации.
Кинетическое уравнение для заселенности Х(Е), вытекающее из (19.6),
имеет вид:
дХ(Е)
г
г<(Д£)2> га (х{Е) X(E)i\
-gP (19.26).
В квазистационарном приближении это уравнение сводится к диффе-
ренциальному уравнению второго порядка, решение которого в общем
случае можно получить только численным интегрированием. Однако в
предельных случаях для больших и малых давлений выражения для и
к
0
могут быть найдены в явном виде.
I
f
г
12 5
[мм ргп.сгп.)
-
Рис. 53. Зависимость удель-
ной скорости мономолекуляр-
ной реакции распада азомета-
на CH3NNCH3 = С
2
Н
6
+ N
2
от давления при 290° С [1394а]
При больших давлениях распределение по степеням свободы активной
молекулы поддерживается равновесным независимо от механизма актива-
ции. Поэтому к^ будет определяться выражением (19.16).
При очень малых давлениях скорость реакции равна скорости актива-
ции. Факт существования реакции в этом предельном случае означает пол-
ное исчезновение молекул, достигающих уровня энергии Е = Е
а
. Тогда
задача о расчете неравновесной функции распределения сводится к диф-
фузионной задаче (в энергетическом пространстве) при наличии поглощаю-
щей стенки, а расчет скорости реакции — к расчету диффузионного потока
к стенке.
Решение этой задачи дает следующие выражения для неравновесной
функции распределения X (Е) и константы скорости (см. Г262, § 35]):
Х(Е) =
а
[5
2 dE
<(Л£)
2
>
Х°{Е)
2 dE
<(Д£)2>
ХО
(Е) J
Х°(Е),
(19.27)
ко
2 dE
<(Д Е)*> Х° (Е)
(19.28)
Дальнейшая конкретизация этих выражений возможна после подстановки
в эти интегралы функции <(ЛЕ)
2
} от энергии реагирующей молекулы.
Для оценки к
0
по формуле (19.28) положим число степеней свободы
s 1 и EJkT s. Если дополнительно предположить, что <(ДЕ)
2
у
слабо зависит от энергии вблизи Е — Е
а
, то основная зависимость
подынтегральной функции определяется экспоненциальным множителем
ехр (—Е/кТ), входящим в Х°(Е). Оценка дает
ехр (—EJkT)
ко —
'
>.Zo
— <(А^)2>^г Г,
(19.29)
[М] z ^
' '
Jit
л
АВ
где плотность уровней р и средний квадрат переданной энергии <(АЕ)
2
У
отнесены к уровню энергии, лежащему приблизительно на величину kТ
ниже границы диссоциации.
Это выражение для константы скорости справедливое для механизма
многоступенчатой активации, отличается от (19.18), полученного в пред-
положении сильных столкновений тем, что в первом случае эффективность
активации характеризуется множителемZ
0
<(AZ?)
2
>/2 (кГ)
2
, а во втором —
величиной Z
0
. Поскольку описание активации диффузионным уравнением
(19.26) предполагает выполнение условия ((АЕ)
2
> (кГ)
2
, константа
скорости распада, вычисленная по (19.29) при многоступенчатой актива-
ции, должна быть меньше соответствующей константы, вычисленной на
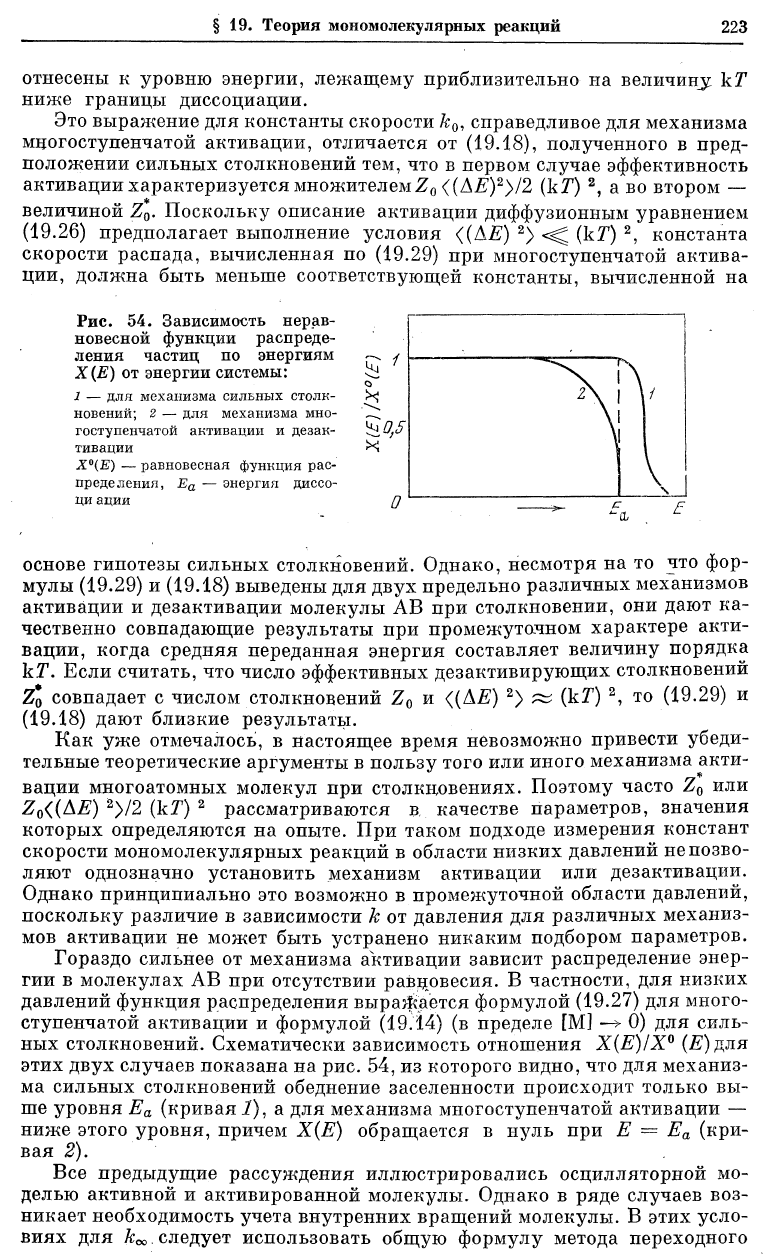
Рис. 54. Зависимость нерав-
новесной функции распреде-
ления частиц по энергиям ^
Х(Е) от энергии системы: oi
1 — для механизма сильных столк- ^
новений; 2 — для механизма мно- ^
гоступенчатой активации и дезак-
тивации ^
Х°(Е) — равновесная функция рас-
пределения, Е
А
— энергия диссо-
ци ации Q
основе гипотезы сильных столкновений. Однако, несмотря на то что фор-
мулы (19.29) и (19.18) выведены для двух предельно различных механизмов
активации и дезактивации молекулы АВ при столкновении, они дают ка-
чественно совпадающие результаты при промежуточном характере акти-
вации, когда средняя переданная энергия составляет величину порядка
кГ. Если считать, что число эффективных дезактивирующих столкновений
ZQ совпадает с числом столкновений Z
0
и ((АЕ)
2
> ж (kТ)
2
, то (19.29) и
(19.18) дают близкие результаты.
Как уже отмечалось, в настоящее время невозможно привести убеди-
тельные теоретические аргументы в пользу того или иного механизма акти-
вации многоатомных молекул при столкновениях. Поэтому часто Z
0
или
Z
0
((AE)
2
>/2 (кГ)
2
рассматриваются в качестве параметров, значения
которых определяются на опыте. При таком подходе измерения констант
скорости мономолекулярных реакций в области низких давлений
не
позво-
ляют однозначно установить механизм активации или дезактивации.
Однако принципиально это возможно в промежуточной области давлений,
поскольку различие в зависимости к от давления для различных механиз-
мов активации не может быть устранено никаким подбором параметров.
Гораздо сильнее от механизма активации зависит распределение энер-
гии в молекулах АВ при отсутствии равновесия. В частности, для низких
давлений функция распределения выражается формулой (19.27) для много-
ступенчатой активации и формулой (19.14) (в пределе [М]
—>
0) для силь-
ных столкновений. Схематически зависимость отношения Х(Е)/Х° (Е)для
этих двух случаев показана на рис. 54, из которого видно, что для механиз-
ма сильных столкновений обеднение заселенности происходргг только вы-
ше уровня Е
а
(кривая I), а для механизма многоступенчатой активации —
ниже этого уровня, причем Х(Е) обращается в нуль при Е = Е
а
(кри-
вая 2).
Все предыдущие рассуждения иллюстрировались осцилляторной мо-
делью активной и активированной молекулы. Однако в ряде случаев воз-
никает необходимость учета внутренних вращений молекулы. В этих усло-
виях для
коо.
следует использовать общую формулу метода переходного

состояния (11.9), а для к
0
— следующее выражение [186], справедливое
для механизма сильных столкновений:
(Е е )
s_1+r
/
2
(кГ)
1-г/2 S
ко
=
Z*
Q
К
'
а1г
z
' ^ Ц [1 - ехр (-
%а
К
/кТ)]
ехр (-
Е
а
/кТ).
(19.30)'
(s
— 1
-)- г/2)! Д ©
fc
к=1
Здесь s и г обозначают число колебательных и вращательных степеней сво-
боды в активной молекуле. Общее выражение для случая промежуточных
давлений см. в работе [262, § 33].
Исследование температурной зависимости выражений для к^ и к
0
пока-
зывает [186], что переход от высоких давлений к низким сопровождается
увеличением отрицательной температурной зависимости предэкспонен-
циального множителя. Это значит, что экспериментальная энергия актива-
ции, определенная соотношением (2.23), падает при переходе от кк к
0
.
Как впервые отметил Ландау [ИЗО], это связано с изменением распреде-
ления активных молекул по энергетическим состояниям: при высоких
давлениях распадаются главным образом те молекулы, внутренняя энер-
гия которых превышает энергию активации на величину средней энергии;
при низких давлениях эти состояния сильно обедняются, и основной вклад
в скорость распада вносят молекулы, энергия которых близка к энергии
активации. Это, как указывалось, является причиной нарушения линей-
ной зависимости i/k' от Ир (см. рис. 53).
В частности, для осцилляториой модели в рамках механизма сильных
столкновений при высоких температурах (кГ Ьщ) справедливо соотно-
шение:
р
|
Е
а
+
1
/zkT
при законе первого порядка, (19 31)
эксп 1 — ^— з/
3
) kf при законе второго порядка
где Т — средняя температура в изучаемом температурном интервале. Для
механизма ступенчатой активации столь простой температурной зависи-
мости получить не удается, поскольку зависимость множителя ((АЕ)
2
>,
входящего в выражение (19.29), от Г в общем случае неизвестна. Если
предположить, что {(АЕ)
2
} не зависит от температуры, то получим:
р | Е
а
-\-
1
1?кТ при законе первого порядка, (19 32)
"эксп у Е
а
— (s
-
1
г
г
/2)кТ при законе второго порядка.
Сравнение выражений (19.31) и (19.32) показывает, что ц|зи малых давле-
ниях Е
эксп
для механизма ступенчатой активации оказывается меньше со-
ответствующей величины для механизма сильных столкновений, и обе они
меньше Е
а
. Неравенство Е
эксп
Е
а
справедливо при малых давлениях
и, в более общем случае, при промежутоном механизме активации [850,
851]. В качестве примера можно указать на термический распад С0
2
, для
которого величина Е
а
(энергия связи СО—О) равна 125,75 ккал, а экспе-
риментальная энергия активации при Т = 3000 4000° К близка к
100 ккал [178]. Механизм сильных столкновений не может объяснить
полученное значение Расчет по (19.31) дает 110 ккал [849]. По-
видимому, низкое значение £
Э
ксп может быть объяснено ступенча-
тым возбуждением, хотя для описания активации необходимо выйти за
пределы диффузионного приближения [849].

Термический распад двухатомных молекул
Особенность этой реакции заключается в том, что если двухатомная
молекула обладает колебательной энергией, большей энергии диссоциа-
ции, то она распадается за время порядка одного периода колебаний
(10"
13
— 10"
14
сек). Поскольку в условиях газофазной кинетики частота
столкновений Z
0
[М] практически никогда не превышает 10
12
— 10
13
сек"
1
,
распад молекул АВ при всех условиях можно считать мгновенным (по
сравнению со временем между последовательными столкновениями). Это
значит, что термический распад двухатомных молекул
к
АВ + М А + В + М (19.33)
(&дисс = К) всегда следует закону второго порядка, а скорость распада
определяется скоростью активации.
В настоящее время нужно считать установленным, что активация двух-
атомных молекул происходит ступенчатым путем. В первых моделях ак-
тивации предполагалось, что возбуждение молекул АВ происходит в ос-
новном за счет превращения относительной поступательной энергии АВ и
М в колебательную энергию АВ (см. [262, § 44]), причем вращение молекул
приводит к понижению энергии диссоциации Е
а
на некоторую величину
Ai? (/), зависящую от углового момента молекулы. В этом приближении
для &
дисс
получается следующее выражение:
< (АЕ)Ь
*дисс =
g
v
(kr
y р ехр (- D/kT) [1 - ехр (- Лю/кГ)], (19.34)
где g
e
— число устойчивых электронных состояний молекулы, имеющих
одинаковый предел диссоциации; g
r
О 1) — множитель, учитывающий в
среднем понижение энергии диссоциации вращающейся молекулы и со —
частота колебаний молекулы. Сравнительно простую оценку величины
<(ДЕ)
2
> можно получить в предположении, что вблизи границы диссоциа-
ции происходят лишь одноквантовые переходы. Это дает для температурной
зависимости &
дисс
выражение:
v
Лдисс
-
Веёт
(Т) [1 - ехр (- Ъсо/kT)] ехр (- D/kT), (19.35)
причем g
r
(T)~
Т-Ч*
— Г-
1
/*.
Более подробное исследование динамики столкновений [304] показы-
вает, что в активации молекулы важную роль играют одновременные ко-
лебательно-вращательные переходы. При таких переходах изменение сум-
марной энергии молекулы может быть малым, однако существенное пере-
распределение энергии между вращением и колебанием может приводить
к увеличению вероятности диссоциаций молекул. Грубую оценку влияния
этого эффекта можно получить, если Считать, что энергия диссоциации
вращающейся молекулы понижается на величину энергии вращения
Е
г
(/) > АЕ (/). В этом случае g
r
(Т) в (19.35) должно быть заменено на
ф/kT), что увеличивает отрицательную температурную зависимость
предэкспонента.
Рекомбинация радикалов и атомов
Рекомбинация радикалов и атомов является процессом, обратным тер-
мической диссоциации молекул. В условиях, когда скорость реакции на-
много меньше скорости релаксации, обеспечивающей установление рав-
новесного распределения, константа скорости рекомбинации &
рек
связана
с константой скорости диссоциации й
дисс
соотношением
W*peK=*. (
19
-
3б)
15 В. Н. Кондратьев, Е. Е. Никитин

в котором К обозначает термодинамическую константу равновесия. При
указанном соотношении между скоростями диссоциации и рекомбинации
эта формула справедлива при любом давлении М. Поскольку К не зави-
сит ни от свойств, ни от давления М, зависимость /с
рек
от М полностью
определяется зависимостью &
дисс
от М.
При высоких давлениях, когда диссоциация следует закону первого
порядка, рекомбинация описывается законом второго порядка. Если К вы-
разить через статистические суммы молекул АВ и образующихся при их
распаде радикалов А и В, и воспользоваться формулой метода переход-
ного состояния (19.16) для &
дисс
, то &
рек
опишется общей формулой (11.9)
для реакции второго порядка. Записанное через число соударении
ZJQ И
сте-
рический фактор Р выражение для константы &
рек
имеет вид:
k% = Z
0
P. (19.37)
Оценка величины Р для активированного комплекса различной струк-
туры обсуждается в § 11. Поскольку активированный комплекс АВ^ имеет
одинаковую структуру для прямой и обратной реакции, величина стери-
ческого фактора в выражении для /с
рек
коррелирует с величиной пред-
экспонента (частотного фактора) в выражении для Аг
ДИС
с- Нормальным ве-
личинам частотного фактора в /£дисс (10
13
—Ю
14
сек
1
) соответствует малая
величина Р (10"~
2
—10~
4
) и, наоборот, большим сферическим факто-
рам (Р — 1) соответствуют аномально высокие частотные факторы. При-
мером последнего случая может служить диссоциация С
2
Н
6
, упоминав-
шаяся в § 11.
ч
При низких давлениях рекомбинация подчиняется закону третьего
порядка. Воспользовавшись связью между /с
диС
с и /с
рек
(19.36) и выраже-
ниями (19.16) и (19.20), найдем
k<*>
K
= ZoPx%. - - ^ (19.38)
В этом выражении произведение Z
0
P%* представляет собой константу
равновесия между свободными радикалами А и В и комплексом АВ *
(активной молекулой АВ*), образованным при парном столкновении
А и В. Из формулы (19.38) следует, что скорость рекомбинации радикалов
пропорциональна среднему времени жизни комплекса, образованного при
их столкновении. Минимальное значение т * — 10"
13
-г- 10"
ы
сек отвечает
столкновению двух атомов. Однако при увеличении числа степеней свобо-
ды комплекса оно быстро растет, достигая для сложных радикалов вели-
чины порядка 10"
6
сек и выше. Таким образом, можно заключить, что
именно вариация т * ответственна за очень широкий интервал возможных
значений констант скорости рекомбинации различных радикалов.
При достаточно низких температурах наряду с процессами
А + В ^ АВ*,
(19.39)
АВ*
+
М АВ
+
М
следует учитывать вклад процесса
А + ВМ ЛАВ + М, (19.40)
протекающего при столкновениях радикала А со стабильным комплексом
ВМ, который образуется при взаимодействии частиц В и Ми концентрацию
которого можно считать равновесной [331]. При этом [ВМ] пропорцио-
нальна [В] и [М], и вклад реакции (19.40) в суммарную константу рекомби-

нации А и В равен
= С
19
-*
1
)
где .Явм — константа равновесия
В + М ^ ВМ.
Таким образом, полная константа скорости рекомбинации в этом случае
будет равна сумме Щк + М>ек- Константа равновесия по порядку вели-
чины равна произведению объема молекулы V
0
на множитель ехр (е/кГ),
где е — энергия связи комплекса ВМ. Полагая, что к' — величина поряд-
ка числа газокинетических столкновений [331], найдем
fcgk ~ ZoFo ехр (в/kГ). (19.42)
Именно быстрое возрастание с убыванием температуры при условии
e/kТ 1 и определяет то, что рекомбинация через стабильный комплекс
ВМ может конкурировать с рекомбинацией через комплекс АВ*
3
.
Выражения (19.37) и (19.38) получены в предположении, что рекомби-
нацию следует считать закончившейся после того, как образуется молекула
АВ с энергией Е, меньшей энергии диссоциации Е
а
. Это предположение
совпадает с основным предположением механизма сильных столкновений и
не позволяет учесть возможность повторной диссоциации молекулы АВ с
энергией Е Е
а
при последующих столкновениях. Эта повторная дис-
социация, составляющая сущность неравновесного эффекта в рекомбина-
ции, трактуется в рамках многоступенчатого механизма дезактивации. От-
клонения от равновесия учитываются заменой (по аналогии с процессами
распада) величины Z\ в (19.38) на Z
0
({АЕ)
2
>/2 (кГ)
2
.
Поскольку дезактивация двухатомных молекул является примером
многоступенчатого процесса, получающееся при этом выражение с учетом
дополнительных поправок на вращение молекулы АВ и существование
нескольких электронных состояний, дает неравновесную константу ско-
рости рекомбинации атомов. Теоретические расчеты &
рек
обычно использу-
ют различного рода упрощающие предположения относительно межатом-
ных взаимодействий и динамики столкновения 1262]. В результате удается
получить порядок величины k
veк
и в качественной форме объяснить отри-
цательную температурную зависимость. Оказывается, в частности, что
при высоких температурах последняя обязана неравновесным эффектам
[в основном учитываемым множителем <(АЕ)
2
}/(кТ)
2
, а при низких —
возрастающему вкладу механизма (19.40). Последовательная теория ре-
комбинации должна одновременно учитывать вклады механизмов (19.39)
и (19.40), дополнительно принимая во внимание нарушение равновесного
распределения по колебательным и вращательным состояниям.
Первоначальный вариант теории, сформулированный Вигнером [16741
и основанный на идеях метода переходного состояния, позволял, в прин-
ципе, путем соответствующего выбора критической поверхности в конфи-
гурационном пространстве трех атомов учесть оба механизма, но игнори-
ровал как неравновесные эффекты, так и возможность сильного отличия*
коэффициента прохождения от единицы.
Дальнейшее развитие этого подхода [1048, 1049], дополненное динами-
ческими расчетами траекторий и учетом неравновесных эффектов [1050],
3
Обычная прочность связи в комплексе ВМ мала, поэтому процесс АВ + М ^ А +-
+ ВМ (обменный процесс) не может дать существенного вклада в механизм диссоциа-
ции при высоких температурах. В ряде случаев, однако, как показывают расчеты!
[1000], например при рекомбинации Н + Н+Н-^Н
2
+ Ни диссоциации Н
2
+ Н —»
—» Н + Н + Н, вклад обменного процесса должен учитываться и при высоких
температурах.
1.5**
позволило сформулировать теорию, учитывающую, по-видимому, все су-
щественные черты процесса рекомбинации атомов [643, 834, 1495, 1496].
К сожалению, для получения конкретных результатов приходится прибе-
гать к численным расчетам; поэтому в общем виде трудно выделить от-
дельные факторы, определяющие величину константы рекомбинации. Од-
нако упомянутый выше качественный вывод об отрицательной температур-
ной зависимости &
рек
и ее происхождении остается неизменным.
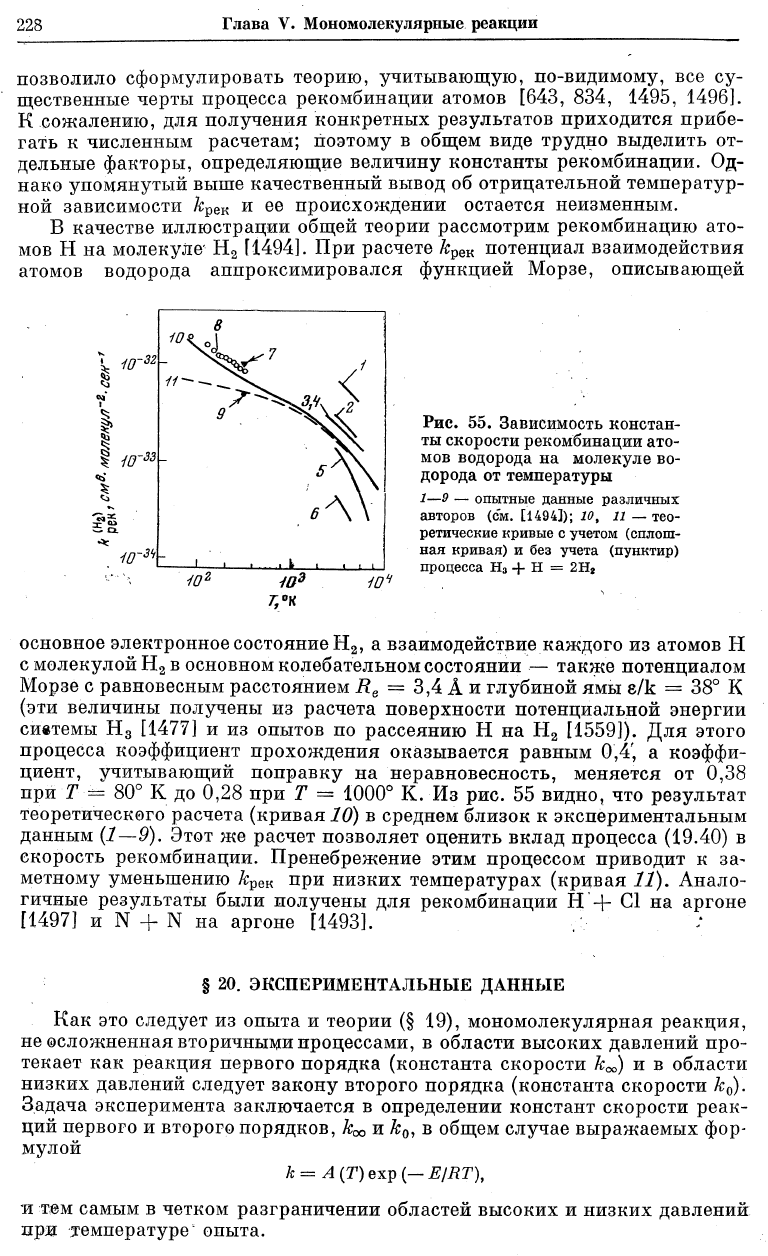
В качестве иллюстрации общей теории рассмотрим рекомбинацию ато-
мов Н на молекуле' Н
2
[1494]. При расчете &
рек
потенциал взаимодействия
атомов водорода аппроксимировался функцией Морзе, описывающей
Рис. 55. Зависимость констан-
ты скорости рекомбинации ато-
мов водорода на молекуле во-
дорода от температуры
1—9 — опытные данные различных
авторов (см. [1494]); 10, и — тео-
ретические кривые с учетом (сплош-
ная кривая) и без учета (пунктир)
процесса Н
3
+ Н = 2Н
2
основное электронное состояние Н
2
, а взаимодействие каждого из атомов Н
с молекулой Н
2
в основном колебательном состоянии — также потенциалом
Морзе с равновесным расстоянием R
e
= 3,4 А и глубиной ямы е/k = 38° К
(эти величины получены из расчета поверхности потенциальной энергии
системы Н
3
[1477] и из опытов по рассеянию Н на Н
2
[1559]). Для этого
процесса коэффициент прохождения оказывается равным 0,4', а коэффи-
циент, учитывающий поправку на неравновесность, меняется от 0,38
при Т
=±=
80° К до 0,28 при Т = 1000° К. Из рис. 55 видно, что результат
теоретического расчета (кривая 10) в среднем близок к экспериментальным
данным (1—9). Этот же расчет позволяет оценить вклад процесса (19.40) в
скорость рекомбинации. Пренебрежение этим процессом приводит к за-
метному уменьшению А:
рек
при низких температурах (кривая 11). Анало-
гичные результаты были получены для рекомбинации Н + С1 на аргоне
[1497] и N + N на аргоне [1493].
§ 20. ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ
Как это следует из опыта и теории (§ 19), мономолекулярная реакция,
не осложненная вторичными процессами, в области высоких давлений про-
текает как реакция первого порядка (константа скорости к^) и в области
низких давлений следует закону второго порядка (константа скорости к
0
).
Задача эксперимента заключается в определении констант скорости реак-
ций первого и второго порядков,
kх>
и к
0
, в общем случае выражаемых фор-
мулой
к = А (Т) ехр (— E/RГ),
и тем самым в четком разграничении областей высоких и низких давлений
щщ температуре
1
опыта.

Как следует из теории мономолекулярных реакций, базирующейся на
концепции об активирующей и дезактивирующей роли молекулярных стол-
кновений, входящая в выражение скорости реакции эффективная констан-
та скорости к в общем случае является функцией давления (19.15). При
низких давлениях, удовлетворяющих условию р
<$g:
к^/к^, к является ве-
личиной, пропорциональной давлению. Непрерывно увеличиваясь с дав-
лением от предельно низких давлений (р й:«До)» эффективная константа
скорости принимает значения от к = к
0
р до максимального значения
к = коо — при предельно высоких давлениях (р к^/к^). В качестве гра-
ницы между областями низких и высоких давлений примем такое давле-
ние /?i/
2
, при котором /с — V2
fcoo.
В теории Линдемана [1157], из которой
следует соотношение Мк = l/ft», + i/k
Q
p, где р — общее давление
4
,
Р
г
!г
~ коо/к
0
.
Обратимся сначала к рассмотрению экспериментальных данных, отно-
сящихся к области предельно высоких, давлений.
Предэкспоненциальный множитель в выражении к
Представив константу к^ формулой
выясним прежде всего вопрос о возможных экспериментальных значениях
предэкспоненциального множителя А оо. Представление о порядке величи-
ны А
оо
можно получить из данных, относящихся к реакциям распада и
изомеризации различных веществ [47]. Наглядное представление о рас-
пределении значений lg Адает рис. 56.
Из этих данных следует, что в 75 случаях из ста lg А^ 12 -г-15, т. е. в
среднем 13,5 (см. рис. 56). Близкое к этому числу значение lg^loo следует
ожидать на основании теоретической формулы к= v^ ехр (— EJRT),
полученной для осцилляторной модели активной молекулы (§19), где
предэкспонент v^ имеет порядок величины частоты молекулярных колеба-
ний, т. е. 10
13
.
Значения предэкспоненциального множителя того же порядка можно
получить также из формулы (19.16)
метода переходного состояния при определенных допущениях о входящих
в нее величинах F^B и ^ав- Отсюда можно заключить, что значения lg.4<x>
порядка 13 или близкого к 13 (часто йазываемые нормальными) получа-
ют теоретическое обоснование (этот результат можно трактовать и как
экспериментальное обоснование теории).
Что касается значений предэкспонентов, на три и больше порядков от-
личающихся от нормального, то в ряде работ делались попытки получить
объяснение больших порядков этих величин (см. L1536]). Одно из часто
привлекавшихся объяснений основано на допущении об увеличении энтро-
пии в ходе элементарного процесса мономолекулярного превращения, при-
водящем к положительной энтропии активации Aв выражении
К
ОО
=
А
ОО
ЕХ
Р (-EJBT),
(20.1)
тождественном приведенному выше.
4
Замена [М] на р в (19.23) предполагает, что константы скорости выражены k соот-
ветствующих единицах.
Аналогичное объяснение, очевидно, не применимо к малым предэкспо-
нентам (порядка 11 и ниже). Действительно, формально возможное допу-
щение об отрицательной энтропии активации не имеет смысла, так как в
этом случае нужно было бы принять структуру активированного комплек-
са более жесткой," чем структура исходной молекулы, что крайне мало-
вероятно. Существование реакций с малыми прёдэкспонентами, по-види-
мому, нужно приписать неадиабатичности этих реакций (см. § 10): опу-
щенный в формуле (20.1) коэффициент прохождения в случае неадиаба-
тических реакций может быть значительно меньше единицы.
Такое объяснение впервые было дано Маги, Шандом и Эйрингом [1183]
применительно к ,^цс-транс-превращениям произ-
водных этилена. Согласно этим авторам, превра-
щение 1рс-изомера в транс-изомер, заключаю-
щееся в повороте одной части молекулы относи-
тельно другой на 180° вокруг углерод-углеродной
связи, в этом случае может осуществляться дву-
мя путями: без изменения мультиплетности, т. е.
путем прямого перехода из одного синглетного
состояния (основное состояние грс-изомера) в дру-
гое синглетное состояние (основное состояние
m/жнс-изомера) и с изменением мультиплетности,
т. е. путем перехода в промежуточное триплет-
ное состояние, являющееся ближайшим к основ-
ному возбужденным состоянием молекулы заме-
щенного этилена (как и самого этилена). Оба пути
реакции (I I и I
—>
III
—>
I) схематически
показаны на рис. 57.
В отличие от пути реакции I
—>
/, характери-
зующегося более высоким потенциальным барье-
ром и большой величиной коэффициента прохож-
дения, второй, неадиабатический путь реакции
I
—>
III
—>
I характеризуется малым значением
предэкспоненциального множителя, обусловлен-
ным малой вероятностью интеркомбинационных
переходов I
—>
III и III
—>
/ (малый коэффици-
ент прохождения).
Выяснение причин значительных отклонений
предэкспоненциального множителя Аот величи-
ны порядка 10
12
—10
15
сек
1
затруднено тем, что
механизм реакции далеко не всегда в достаточной
мере выяснен. Так, не исключена возможность того, что в некоторых
случаях реакция, характеризующаяся особенно большими значениями
А
0
о, в действительности идет по цепному механизму, а мономолекулярный
закон реакции является лишь кажущимся. Такая точка зрения была вы-
сказана Семеновым [311], который на основании рассмотрения механизма
ряда цепных реакций пришел к заключению, что макрокинетический за-
кон цепной реакции очень часто может отвечать закону мономолеку-
лярной реакции.
Наличие вторичных процессов, идущих по цепному механизму, явля-
ется характерным для большого числа мономолекулярных реакций. Поэ-
тому обычно для нахождения константы скорости истинно мономолекуляр-
ной реакции, не осложненной вторичными процессами, измерения прово-
дят в присутствии посторонних газов, таких, как окись азота, толуол или
пропилен, способных полностью подавить цепную реакцию. Примером
может служить термический распад этана. В [1121] была измерена эффек-
Рис. 56. Относительное
распределение (М) пред-
экспонентов
А
^ в выра-
жении для константы
скорости мономолеку-
лярных реакций k
OD
=
= A
oo
ex
V
(—E/RT)
Кривая построена по дан-
ным для ~ 600 реакций [47].
М — выражено в процен-
тах от числа исследованных
реакций
