Кондратьев В.Н., Никитин Е.Е. Кинетика и механизм газофазных реакций
Подождите немного. Документ загружается.


Условие (14.10) может быть использовано применительно к обмену
поступательной и внутренней энергии любой формы — вращательной,
колебательной или электронной. При расчете вероятностей этих процессов
можно рассматривать только прямые, поскольку их скорости связаны со
скоростями обратных процессов соотношением, следующим из принципа
детального равновесия.
Вращательная энергия представляет собой квантованную величину и
выражается в простейшем случае двухатомной молекулы в состоянии
формулой:
E
r
= hBj{j +1), (14.11)
где / — вращательное квантовое число (7 = 0, 1, 2 ... ) и В = /гУ8л
2
/
0
(/
0
— момент инерции, /
0
= |mr|, fx — приведенная масса молекулы и
г
е
— равновесное расстояние).
При больцмановском распределении средняя вращательная энергия
Е==
2J
HBJ + 1)
—Т
Г
—
ЕХР
—ЕГ—]' (
14Л2
)
j=0
где F
r
представляет вращательную сумму состояний при условии
hB <^кТ, равную kT/hB. В этом случае средняя вращательная энергия
выражается формулой:
Е
г
= кТ. (14.13)
Вычисляя на основании спектральных данных [64] величину hB/kT
для ряда молекул, будем иметь:
Молекула Н
2
НС1 N2 Cl
2
J2
hB 8М 15Д ^86 0,347 0,053
ki Г Г 1' Г Г
Таким образом, мы видим, что при комнатной и более высоких тем-
пературах для всех молекул, кроме Н
2
и НС1 (обладающих малыми мо-
ментами инерции), условие hB<^kT выполняется с большой точностью.
При температурах порядка 1000° К это условие можно считать выполняю-
щимся также и для молекул Н
2
и НС1. Следовательно, при достаточно вы-
соких температурах практически для всех двухатомных молекул мы имеем
классическое выражение для средней вращательной энергии молекулы
(14.13). Это позволяет, пренебрегая квантовыми эффектами, трактовать
обмен поступательной и вращательной энергии на основании классиче-
ской механики.
Расчеты величины <(AZ?
r
)
2
>, выполненные в последнее время числен-
ными методами в рамках классического описания, показывают, что сред-
нее число столкновений Z
r
, необходимое для установления равновесного
распределения по вращательным состояниям молекул типа 0
2
или N
2
при
1000° К, составляет — 10 [1346], а для молекулы Н
2
— 200—300 [1168].
Такое различие является следствием большой величины параметра Месси
для Н
2
, поскольку угловая скорость молекулы Н
2
намного больше угло-
вой скорости 0
2
и N
2
.
Остановимся более подробно на трактовке модельной задачи обмена
энергии при столкновении двух одинаковых симметричных двухатомных
молекул, данной Паркером [1331]. См. также [1333]. В тебрии Паркера
принимается, что молекулы, представляющие жесткие ротаторы, могут
вращаться в одной плоскости. Каждая молекула обладает двумя цент-
рами отталкивания, расположенными симметрично на ее оси. Кроме того,
каждая молекула имеет центр притяжения, совпадающий с ее центром
11 В. H. Кондратьев, Е. Е. Никитиь

инерции. Решая уравнение движения, Паркер вычисляет величину
dErldt и время вращательной релаксации, которое он определяет как
"r-щж-
(14Л4>
Полученное им выражение для времени вращательной релаксации имеет-
вид:
г = х (14 15>
г
я
3
'
2
IT* \
1/2
/я
2
\ Т*
с
'
v
'
Ы
+(— +
л
)-т
где
1 / Otr
p
\2
7
о
— 16 v е
и т
с
— среднее время между двумя столкновениями. Входящие в эти
формулы величины a, d, & и Г* имеют следующий смысл. Величина а
представляет собой радиус действия межмолекулярных сил и может быть
вычислена из коэффициента вязкости или второго вириального коэффи-
циента; г
е
— известное из спектроскопических данных равновесное рас-
стояние между атомами в молекуле; е — некоторая функция произведе-
ния аг*, где г* — расстояние между центрами отталкивания в принятой
модели молекулы (см. выше) и Г* = е*/к, где е* — минимальное значение-
потенциала сил взаимодействия молекул. Величина Г*, вычисленная из
коэффициента вязкости и из второго вириального коэффициента, при-
водится в работе [961].
Из формулы (14.15) для числа столкновений, приводящих к установ-
лению вращательного равновесия, получается выражение:
Z =
3/
' .F" ' • (14.16)?
r
V . я
/2
/Г*\<
2
. /л
2
\ Т*
v
•
I
+~\L
R
L 4 T
Как видно из формул (14.15) и (14.16), число столкновений и время
вращательной релаксации растут с температурой, приближаясь при
Т/
Т*
1 к постоянным значениям
= - (14.17)
и
*рел=^с (14.18)
При увеличении Т/Т* от 1 до 1000 обе величины возрастают приблизи-
тельно в 10 раз.
На основании следующих значений констант ос, d* и Г*: 3,51
0,617 А, 300° К (С1
2
), 4,09 А"
1
, 0,557 А, 80° К (N
2
) и 4,10 А"
1
, 0,605 А
г
90° К (0
2
). Паркер вычислил значения величин Z
R
(300° К) и
Z™
для С1
2
^
N
2
И 0
2
, оказавшиеся равными соответственно 4,9 и 47,1 (С1
2
); 4,0 и 15,7
(N
2
); 3,5 и 14,4 (0
2
).
Наибольшее число измерений вращательной релаксации приходится
на азот. При этом в подавляющем большинстве работ, в которых изме-'
рения проводились при комнатной (или близкой к комнатной) темпе-
ратуре, получены значения величины Z
R
с разбросом от 3,3 до 7,2: сред-
нее из них равно 4,8 ± 0,8, что находится в хорошем согласии с теоре-
тическими значениями Z
R
(300° К) = 4,0.
Температурная зависимость вращательной релаксации в азоте была
измерена в работе [1249] в интервале температур 80—260° К и в работе

[608] — в интервале 300—1300° К. В обеих работах установлено умень-
шение вероятности процесса R—Т с повышением температуры прибли-
зительно по закону ЦТ.
В случае кислорода в большинстве работ для температуры, близкой к
комнатной, получены значения Z
T
с разбросом от 2,5 до 4,49 и средним
значением ЗД± 0,6, что также хорошо согласуется с теорией, из кото-
рой следует Z
r
(300° К) = 3,5. Как и в случае азота, вероятность вра-
щательной дезактивации уменьшается с повышением температуры [608].
Приведем также данные для молекул С0
2
и N
2
0. Для первой из них
при температурах, близких к комнатной, получены значения Z
r
= 1,3 -4-
—2,0 [974]; 2,3 [1206] и 2,4 [1317] и при 495° К - значение 2,4 [1193]. Для
N
2
0 В работе [974] при 298° К получено Z
r
= 1,3 ч- 2,0. В малых значе-
ниях величины Z
r
в случае С0
2
и N
2
0 авторы [974] видят подтверждение
получающегося из теории вывода, что вращательные уровни линейных
молекул возбуждаются легче, чем сферических.
Добавим, что, согласно [1312], при столкновениях NH
3
+ NH
3
(NH
3
—
вращательно-возбужденная молекула) преимущественно происходят пе-
реходы Д/ — 0, ±1,. + <-> — . Переходы Д/ > 1 имеют значительно
меньшую вероятность. В случае Н
2
СО, HDCO, HCN, DCN и Н
2
ССО также
преимущественно имеют место переходы, подчиняющиеся указанным
правилам отбора [1311], однако отмечается сравнительно большая ве-
роятность переходов Д; = | 2 | в HCN, DCN и Н
2
ССО. См. также [861].
Согласно [1137], при столкновениях СН
3
ОН* + Не, СН
3
ОН* + Н
2
и
CH
3
NH
2
* + Не также наблюдаются переходы Д/ > 1, причем вероят-
ность этих переходов не уменьшается резко с увеличением Дj.
В работе [975] измерены также величины Z
r
, отвечающие релаксации
заторможенного вращения, этана, пропана и пропилена.
Приведенные выше значения Z
r
характеризуют скорость процессов
R—Т, когда вращательная энергия молекул ВС близка к равновесной.
Если же начальная вращательная энергия ВС сильно отличается от рав-
новесной, величина <(Д^
Г
)
2
>, пропорциональная 1/т
г
, в этом случае не
характеризует скорость превращения поступательной энергии во вра-
щательную. Для полного описания процесса в этом случае необходимо
знать сечения Gjy (и) вращательных переходов.
Укажем два случая, когда теория позволяет сравнительно легко рас-
считать сечение сЦу. Первый отвечает столкновению, когда атом и моле-
кула образуют долгоживущий комплекс, в котором происходит статисти-
ческое перераспределение энергии [501]. Второй случай отвечает малой
асимметрии межмолекулярного взаимодействия, когда изменение угло-
вого момента молекулы Hj может быть вычислено по теории возмущения
[648]. Расчет показывает, что в зависимости от взаимной начальной ори-
ентации собственного и орбитального угловых моментов сталкивающейся
пары величина Дj меняется в некотором- интервале — Д/max А7 Д/
Ш
^х-
В частности, если асимметричную часть V
а
межмолекулярного потен-
циала U (R, у) аппроксимировать первым членом разложения (9.9), то
для симметричной молекулы получается:
где 0)
r
(j) — частота вращения молекулы до столкновения и V
a
асим-
метричная часть потенциала, зависящая от времени вследствие изменения
межмолекулярного расстояния при столкновении.
Оценим величину интервала Д/шах» полагая V
aj 2
= aV
s
и считая,
что время столкновения т ж RJu меньше периода вращения (о)
г
т<^1).
max
ехр
[Uo
r
(/)
t] dt
(14.19)
— ос
Такая оценка дает:
max
(14.20)
где X — длина волны де-Бройля для относительного движения А и ВС.
В случае молекул среднего молекулярного веса %<^R
0
(вблизи комнат-
ной температуры соотношение R
0
/i равно 10—50). Что касается парамет-
ра асимметрии а, то его величина обычно составляет 0,1—0,4 [648].
В этом случае из (14.20) следует, что разность Д/ может быть равной не-
скольким единицам, т. е. при каждом столкновении вероятны переходы с
изменением вращательной энергии на несколько вращательных квантов.
Положение меняется, однако, если со/г 1. При этом за время столк-
новения молекула успевает повернуться несколько раз, так что асиммет-
ричная часть взаимодействия, ответственного за вращательные переходы,
становится очень малой и эффективность превращения поступательной
энергии во вращательную снижается. Строго говоря, в таких условиях
следует решать квантовую задачу. Оказывается, однако, что и здесь можно
приближенно использовать результат классического расчета, интерпре-
тируя малое (меньше Тг) изменение углового момента ротатора как пе-
реходы между ближайшими вращательными состояниями (Дj — + 1
для молекул с разными ядрами и Д; = ± 2 для молекул с одинаковыми
ядрами) с вероятностью, меньшей единицы. Примером процессов такого
типа может служить превращение вращательной энергии молекул водо-
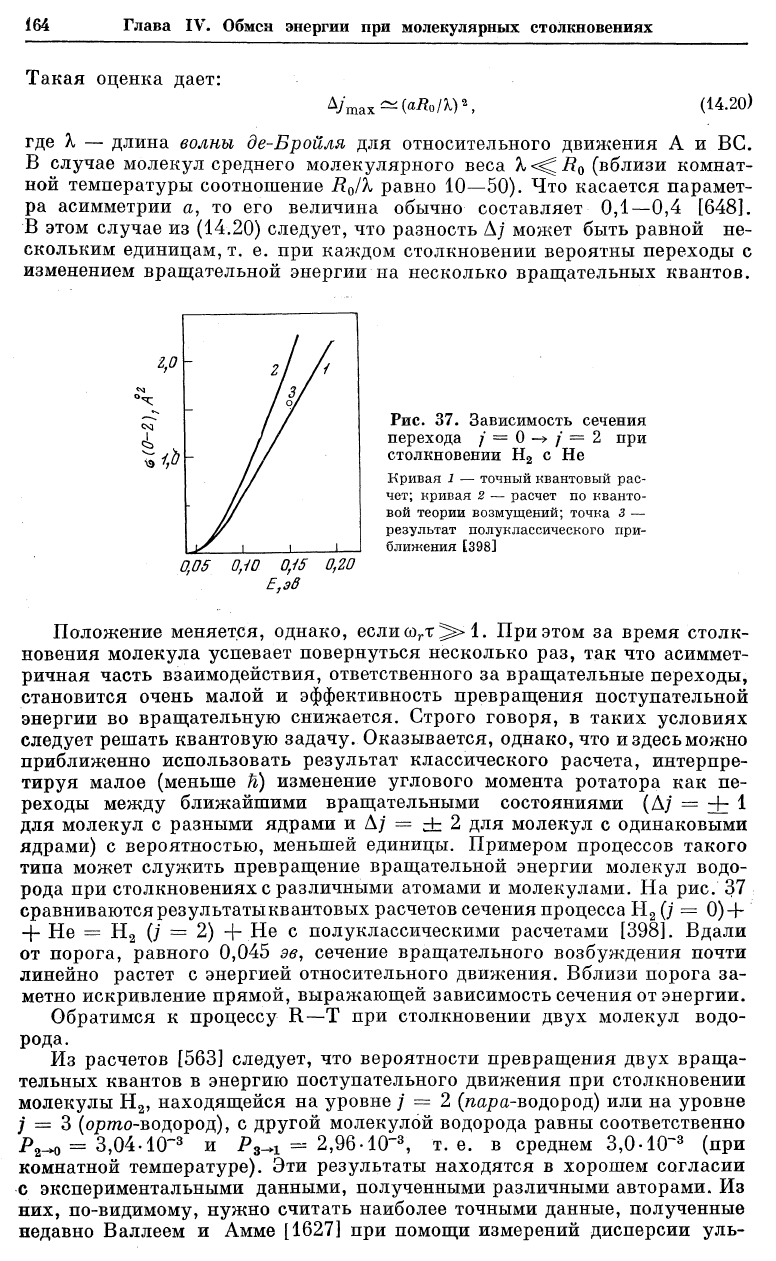
рода при столкновениях с различными атомами и молекулами. На рис. 37
сравниваются результатыквантовых расчетов сечения процесса Н
2
(j =
0)
+
+ Не = Н
2
(j = 2) + Не с полуклассическими расчетами [398]. Вдали
от порога, равного 0,045 эв, сечение вращательного возбуждения почти
линейно растет с энергией относительного движения. Вблизи порога за-
метно искривление прямой, выражающей зависимость сечения от энергии.
Обратимся к процессу R—Т при столкновении двух молекул водо-
рода.
Из расчетов [563] следует, что вероятности превращения двух враща-
тельных квантов в энергию поступательного движения при столкновении
молекулы Н
2
, находящейся на уровне / = 2 (^ара-водород) или на уровне
j = 3 (ортшкводород), с другой молекулой водорода равны соответственно
iVo = 3,04.10~
3
и Р
3
_>! = 2,96.Ю-
3
, т.е. в среднем 3,0.10~
3
(при
комнатной температуре). Эти результаты находятся в хорошем согласии
с экспериментальными данными, полученными различными авторами. Из
них, по-видимому, нужно считать наиболее точными данные, полученные
недавно Валлеем и Амме [1627] при помощи измерений дисперсии уль-
Кривая 1 — точный квантовый рас-
чет; кривая 2 — расчет по кванто-
вой теории возмущений; точка 3 —
результат полуклассического при-
ближения [398]
Рис. 37. Зависимость сечения
перехода / = 0
—>
/ = 2 при
столкновении Н
2
с Не
0,05 O
f
iO. О
г
15 0,20
Е.эв

тразвука. Согласно данным работы [1627], при комнатной температуре
6
jP
2
_>о = 2,43
-1СГ
3
и Рз-^х —2,36 -1СГ
3
. Заметим, что еще раньше при
помощи этого же метода для вероятности превращения вращательной
энергии в поступательную при столкновении двух молекул водорода Царт-
ман [1717] получил 3,3-Ю""
3
. Таким образом, этот процесс в водороде,
согласно как экспериментальным, так и теоретическим данным, требует
300—400 столкновений. См. также [1570].
В работе [1627] приводятся экспериментальные данные для вращатель-
ной релаксации при столкновении молекул Н
2
с атомами Не, Ne и Аг,
полученные в этой работе и в работах других авторов. Измеренные зна-
чения вероятностей Р
г
и соответственно чисел столкновений Z
r
для Не,
Ne и Аг имеют тот же порядок величины, что и для Н
2
.
Экспериментальные данные [562, 1027, 1627], измеренные в темпера-
турном интервале 75—300° К в [693, 1413], сравниваются с вычисленными
на основании квантовомеханических представлений. Отмечается хорошее
согласие теории с опытом. При этом величина Z
r
для столкновений Н
2
с
Н
2
, Не и Ne имеет приблизительно одинаковую зависимость от темпе-
ратуры, а именно Z
r
~1 !Т: при уменьшении температуры от 300 до
100° К Z
r
увеличивается приблизительно в 3 раза.
Из всего сказанного выше об обмене поступательной и вращательной
энергии следует, что в большинстве случаев для возбуждения вращатель-
ных уровней за счет энергии относительного движения сталкивающихся
молекул требуется не больше 10 столкновений (Z
r
). И только в случае
молекул водорода требуются сотни столкновений. По-видимому, этот
вывод справедлив и для процессов передачи вращательной энергии (об-
мен R—R).
§ 15. ПРЕВРАЩЕНИЯ КОЛЕБАТЕЛЬНОЙ ЭНЕРГИИ
Обмен поступательной и колебательной энергии (обмен Т — V)
Вообще говоря, превращение поступательной энергии молекул в
колебательную при столкновениях не может быть рассмотрено в рамках
модели, в которой игнорировалось бы превращение поступательной энер-
гии во вращательную и вращательной в колебательную. Это следует из
того факта, что эффективность превращения поступательной энергии во
вращательную в принципе велика и пренебречь взаимодействием посту-
пательных и вращательных степеней свободы при рассмотрении меха-
низма колебательного возбуждения молекул нельзя. Тем не менее для
молекул, у которых асимметричная часть потенциала межмолекулярного
взаимодействия мала, теория, основанная на пренебрежении взаимодей-
ствием поступательных и вращательных степеней свободы, дает правиль-
ные результаты по зависимости скорости колебательного возбуждения
молекул от параметров взаимодействия и молекулярных констант. По-
скольку значения параметров потенциала точно не известны, теория носит
полуэмпирический характер, и поэтому возможные ошибки, связанные
с пренебрежением превращения поступательной энергии во вращатель-
ную, неявным образом компенсируются оптимальным подбором парамет-
ров. Разумеется, существуют случаи, когда никакой разумный подбор
параметров взаимодействия не может объяснить результат эксперимента
в терминах Т—V-обмена энергией. Тогда необходимо привлекать либо
взаимодействие с вращением, либо неадиабатическое взаимодействие с
близко расположенными электронными термами.
6
Согласно [1627], i>
4
_
2
= 1,50- 1(Г
3
и Р^ = 0,68-10"
3
.

Наглядное представление о возможности превращения поступатель-
ной энергии в колебательную (и обратно) при столкновении атома А с
молекулой М дает рис. 38. Заметим, что в то время как для перехода
поступательной энергии во вращательную наиболее выгодное направление
удара перпендикулярно к оси молекулы (рис. 36), для возбуждения
колебаний наиболее выгоден удар вдоль оси молекулы (рис. 38, а). Доля
переданной энергии и в этом случае должна зависеть от соотношения масс
ударяющей частицы и ударяемого атома. При обратном процессе перехода
колебательной энергии в поступательную (рис. 38, б) необходимо еще
принять во внимание, что передача энергии может произойти лишь в той
а
М А
О О
Рис. 38. Механическая модель обмена колебательной и по-
ступательной энергии при столкновении атома с молекулой
а — переход поступательной энергии в колебательную; б — переход
колебательной энергии в поступательную
фазе колебаний, в которой большая часть энергии колебаний имеет форму
кинетической энергии, т. е. лишь в течение некоторой доли периода
колебаний [1315].
Эти соображения не дают, однако, никаких указаний на вероятность
превращения энергии.
Качественное представление о вероятности превращения поступа-
тельной энергии в колебательную (и обратно) может быть получено на
основании адиабатического принципа. В данном случае ввиду того, что
величина колебательного кванта обычно выражается тысячами калорий,
условие малой вероятности обмена энергии (14.10) можно считать, вооб-
ще говоря, выполняющимся, что находится в хорошем согласии с опытом.
Из неравенства (14.10) также следует, что условие малой вероятности
должно быть тем более справедливым (жестким), чем больше величина
передаваемой энергии.
Обращаясь к теории обмена поступательной энергии с колебательной,
рассмотрим сначала Т—V-обмен применительно к колебательному воз-
буждению и дезактивации двухатомных молекул ВС при столкновениях
с атомом А: А + ВС (v) ->- А + ВС (г/). При этом будем считать, что мо-
лекула ВС обладает малой асимметрией и в момент столкновения нахо-
дится в невырожденном электронном состоянии.
Теория процессов Т—V в основном развивается в двух направлениях,
относящихся к описанию переходов между нижними колебательными
состояниями ВС и переходов между сильно возбужденными колебатель-
ными состояниями ВС. Первое направление связано с исследованиями
колебательной релаксации, второе — с исследованиями неравновесных
эффектов в химических реакциях. Оба эти направления будут рассмот-
рены ниже с привлечением ряда упрощений, позволяющих получить яв-
ные выражения для вероятностей переходов.
Амплитуда колебаний ядер для нижних колебательных уровней двух-
атомной молекулы мала по сравнению с характерной шириной потенциа-
ла межмолекулярного взаимодействия. Для оценки амплитуды колебаний
а при заданной энергии E
v
аппроксимируем потенциал Морзе парабо-

лическим потенциалом вблизи минимума [262]. Это дает
i/^i.:
У ~D
~~СГ
'
Поскольку для низших уровней отношение EJD мало, мы видим, что
амплитуда колебаний мала по сравнению с характерной шириной по-
тенциальной ямы, являющейся величиной порядка 1/а (а — параметр
потенциала Морзе, § 8). Следует ожидать, что масштабные параметры
внутримолекулярного потенциала ВС и межмолекулярного потенциала
«системы А+ВС одного порядка. Поэтому межмолекулярный потенциал
U (/?, г) можно представить в виде ряда по степеням х = г — г
е
, ограничив-
шись первыми двумя членами. Тогда для сферически симметричного взаи-
модействия гамильтониан системы А + ВС примет вид
6
:
.
ч
Р-вс •
II - + V(R) 4- —2~ г
2
+ U (R) + XV (R). (15.1)
Здесь первые два члена — относительная кинетическая энергия А и ВС
и потенциальная энергия взаимодействия атома А с неколеблющейся
-молекулой ВС (г = г
е
), третий и четвертый члены — кинетическая и по-
тенциальная энергия внутренних степеней свободы ВС и xV' (R) — энер-
гия взаимодействия, обусловливающего обмен между поступательной и
колебательной энергией. При V' = 0 относительное движение А и ВС
,и внутреннее движение ВС (колебания и вращения) независимы. Пос-
кольку xV
r
предполагается малым, расчет вероятности колебательных
переходов P
vv
> может быть выполнен в рамках теории возмущений с ис-
пользованием в качестве нулевого приближения состояний невзаимодей-
ствующих частиц, отвечающих упругому соударению А и ВС и свобод-
ному колебательному движению молекулы ВС. В полуклассическом
приближении первый порядок теории возмущений [формула (8.60)] дает:
оо
Р
т
>
(Ь.
«) = I .1
V
-
1S
P~
ех
Р [-Г (
E
v -
Е
«)«]
dt
f' (
15
-2)
— оо
где x
vv
> — матричный элемент величины х. В V' (R) должна быть под^
ставлена функция R (£), отвечающая траектории упругого рассеяния А
на ВС. Однако даже без конкретизации взаимодействия и траектории из
(15.2) можно получить некоторые важные сведения о зависимости P
v1)
r
от v, г/, а также от относительной скорости и, если столкновение явля-
ется почти адиабатическим по отношению к молекулярным колебаниям,
т. е. если выполняется условие
&E
VV
'Xl%^>
1, где т — характерное время
изменения V' и AE
vv
> = E
v
— E
v
>. Если U (R) аппроксимируется потен-
циалом гармонического осциллятора, то x
VV
' будет отлично от нуля только
для переходов на соседний уровень, v ->- v d= причем
Отсюда следует, что E
v
— Е& = Тт.
Далее при больших сот интеграл в выражении (15.2) оказывается про-
порциональным ехр (—сот), т. е. резко зависит от частоты колебаний (о
11131].
6
Поскольку в этом приближении V и V' зависят только от расстояний А — ВС (R)
и В — С (г) и не зависят от угла у, эта модель получила название модели дыша-
щих сфер [949J.

Полагая т = l(b)/u, где 1(b) — масштабный параметр взаимодействия
для данной траектории с прицельным параметром Ъ и и — скорость от-
носительного движения до столкновения, представим окончательный
результат для P
vv
> в виде:
(
2со/ (Ъ)
\
P
V,
гн-1
=
[*
+
*)
В
(Ъ,
и) ехр —J^i] , (15.3)
где В (Ъ, и) — некоторая функция Ъ и и, зависящая от них слабее,
чем экспоненциальный множитель.
После вычисления сечения неупругого столкновения и усреднения
по скоростям в соответствии с выражением (8.27), получим константу
скорости колебательного перехода k
Vi
которую удобно представить в
виде произведения числа столкновений на среднюю вероятность перехода
k
v,v
+
l=nRlu<P
vv
,>.
Из (15.3) следует:
ЛТТ)}
(15
-
4)
<
P
v,
О)
ех
Р
<
P
v, г+Дг^
0 П
Р
И
где С — некоторая функция температуры, слабо меняющаяся по срав-
нению с экспоненциальным множителем, и 1
0
= 1(0).
Из соотношения (15.4), известного в литературе как формулаЛандау —
Теллера [1131], вытекают следующие особенности колебательного возбуж-
дения молекул при столкновениях:
а) переходы происходят только между соседними колебательными
уровнями;
б) вероятность перехода линейно растет с номером колебательного
уровня;
в) температурная зависимость вероятности перехода следует закону:
^<P
V9V+1
>~T-%
Явные выражения для С и 1
0
могут быть найдены при определенных
модельных представлениях относительно потенциалов Fn F. По ана-
логии с одномерной трактовкой задачи о колебательном возбуждении в
теории Ландау и Теллера [1131], в теории Шварца, Славского и Херц-
фельда (теория SSH) [667, 949] считается, что налетающий атом взаи-
модействует только с ближайшим к нему атомом молекулы по экспонен-
циальному закону, качественно передающему характер обменного взаи-
модействия. В этом случае при конфигурации системы А—ВС, близкой
к линейной,
V = В ехр (— aR),
т
с
V
' = «m
B+
m
c
B
™Р
Обычно газокинетический поперечник JRQ^VOC, ЧТО используется для
приближенного расчета сечений [860, 1570]. При этом расчет средней
вероятности <JP
v>v+1
) дает результат, совпадающий с величиной вероят-
ности для линейного столкновения при введении дополнительного сте-
рического множителя /
г
, который полагается равным
1
/
3
. Кроме того, в
качестве поправки учитывается притяжение А и ВС на больших расстоя-
ниях, которое приводит к ускорению партнеров при их сближении [262
г
§ 9]. Наконец, можно ввести поправки на ангармоничность колебаний"

[262, § 9]. Одна из них связана с тем, что межмолекулярное взаимодей-
ствие при сближении партнеров увеличивает частоту колебаний ВС^
уменьшая вероятность перехода. Это уменьшение не зависит от номера,
колебательного уровня.
Вторая поправка связана с тем, что для ангармонического осцилля-
тора матричные элементы x
Vi v+
A
V
(Ai;^> 1) не равны нулю, и уровни энер-
гии не эквидистантны. Однако при условии со1 переходами через
один, два и т. д. уровня можно пренебречь ввиду уменьшения вероятности
переходов с увеличением Av по экспоненциальному закону. Неэквидис-
тантность же уровней сильно влияет на зависимость P
Vi i+1
от v, поскольку
частота перехода (o
ViV+1
зависит от v. Для ангармонического осциллятора'
частота co
V)V+1
для малых v линейно падает с v:
где х
е
— константа ангармоничности. Учет этого обстоятельства приво-
дит к тому, что возрастает с г; не по линейному закону, как в (15.4),
а гораздо быстрее. При учете этой поправки получается следующее вы-
ражение для вероятности одноквантового возбуждения:
<
p
v.
V
+
1>
= (* + 1) 4
v
f
r
fJt
A
'
B
'*xР (- ^Щр) ' (
15
'
5
>
ГДе
Т = ехр
[(07T)
x/
*x
e
]
t
0' = 4я
а
со
2
р,/а
2
к
>
2я0
К
—
б'
Что касается других поправок (А и Б), то их явные выражения приве-
дены в работе [262, § 9]. Средняя вероятность дезактивации (P
v+ljv
} по-
лучается из
v+1
} заменой знака в последнем, экспоненциальном члене.
Главное условие, которое ограничивает применимость выражения
(15.5), заключается в требовании малости P
vv
> по сравнению с единицей
или малости переданной энергии AE
v
по сравнению с величиной E
tr
поскольку только в этом случае использованная при выводе (15.5) тео-
рия возмущений дает правильный результат. Это условие обычно вы-
полняется для не очень высоких колебательных уровней при темпера-
турах до нескольких тысяч градусов. Поэтому вероятности (15.5) могут
быть использованы для построения системы кинетических уравнений,,
описывающих колебательную релаксацию при нагревании до этих тем-
ператур или при «остывании» не очень сильно возбужденных молекул.
Если же начальное состояние сильно колебательно возбуждено, то ве-
роятность перехода между высшими уровнями может оказаться сравни-
мой с единицей даже при условии, когда вероятность перехода между
низшими состояниями мала.
При этом наряду с одноквантовыми переходами становятся возмож-
ными и многоквантовые переходы (которые вообще не описыцаются тео-
рией возмущений). Более того; при достаточно больших скоростях отно-
сительного движения даже и вероятность перехода 0 —1 может быть
значительной — именно такая ситуация осуществляется при исследова-
нии неупругих молекулярных столкновений в условиях молекулярных
пучков в области энергии порядка электронвольта. В связи с этим воз-
никает необходимость выхода за рамки теории возмущений с целью вы-
яснения основных закономерностей многоквантового колебательного воз-
буждения молекул (см. [262], § 11; 1396]).
Т
А+
Т
Ъ +
Т
С
. /
Р
= Vs,

Одной из моделей, используемых для расчета многоквантовых пере-
ходов между колебательно-возбужденными состояниями, является модель
гармонического осциллятора. По сравнению с ранее рассмотренной моделью
Ландау — Теллера в эту модель внесен ряд поправок. В частности, Мей-
хан [1187] предложил приближенную теорию, в рамках которой энергия
AE
v
, переданная осциллятору ВС при линейном столкновении с атомом
А, выражается следующей формулой:
4 т
^ = (l
+ m)
2 Ф«), (
15
'
6
)
где
77ъ mjjn^/m^ -f~ m
B
w
G
)
И
(E
t
- — относительная поступательная энергия А и ВС). Достоинством
приближения (15.6) является то, что оно пригодно для расчета AE
v
при
любых величинах отношения AEJE
t
(не только при малых).
В частности,,-приусловии 1 (импульсныйпредел) формула (15.6)
принимает вид:
" 4га,,
•
AE
v
=
(1 + т)*
E
f
-Этот результат можно"получить 'также., рассматривая линейное столкно-
вение жесткого шара А с гантелью ВС и предполагая, что в момент со-
прикосновения А и В происходит мгновенный обмен кинетической энер-
гией между ними.
Таким образом, формула (15.6) позволяет проследить связь между
процессами Т—V и Т—Т.
Построенный в рамках этой модели квантовый вариант теории поз-
воляет получить сравнительно простые выражения для вероятности мно-
гоквантовых переходов, удовлетворительно аппроксимирующие резуль-
таты трудоемкого решения точной динамической задачи [929].
Рассмотренная в этом разделе теория полностью пренебрегает воз-
можностью перехода колебательной энергии сталкивающейся молекулы
в ее вращательную энергию или во вращательную энергию партнера по
столкновению (если последний не является атомом). Если совместно с
вероятностью колебательных переходов рассчитывать по теории возму-
щений вероятности вращательных переходов, то можно показать, что
1-й член разложения (9.9) приведет к изменению вращательного кванто-
вого числа ] на ± X. С этим изменением j связано изменение вращатель-
ной энергии молекулы на величину = ±
2
У
hBE
r
X
(см. [267]) так,
что доля поступательной энергии, превратившейся во внутреннюю
энергию молекулы при одноквантовом колебательном переходе, будет
составлять foe ± АЕ
Т
. Подставляя со = AE
r
/h в (15.3) вместо со, найдем,
что учет вращательных переходов меняет показатель экспоненты на
2l/u-AE
r
X/h. В среднем Е
Т
= кТ и их (кГ/ji)
12
, из чего следует, что
учет Х-го члена разложения потенциала (9.9) может увеличить вероят-
ность перехода приближенно в ехр [(ц/^вс)
1
''
2
Ml
r
i] раз.
Поскольку (Цг
е
<Cl)> мы видим, что этой поправкой можно пренебречь,
если высшие члены разложения (9.9) относительно невелики и если при-
веденная масса сталкивающихся частиц существенно не превышает
приведенной массы fi
B
c молекулы ВС. Эти условия удовлетворяются для
столкновений симметричных (или почти симметричных) двухатомных
