Колпаков Б.А., Лебедев Б.О. Техническая физика. Часть 1 - Теплофизические основы судовой энергетики
Подождите немного. Документ загружается.

31
Так как Ṽ/μ=v - удельный объём газа, а R̃/μ=R (Дж/(кг· К) - удель-
ная газовая постоянная, уравнение состояния идеального газа может
быть записано в таком виде -
pv=RT , (3.6)
или в таком -
pV = mRT, (3.7)
где V= mv - объём газа, m - масса газа.
Если представить идеальный газ, состоящий из материальных то-
чек, которые совершают только поступательное движение, то внутрен-
няя энергия 1 моля молекул такого газа будет равна
2
m
N=U
2
м м“
w
~
(3.8)
При сопоставлении уравнений (3.1) и (3.7) получается равенство
n
p
N
U
2
3
=
~
, откуда TRVpU
~~~
2
3
2
3
==
В изохорном процессе нагревания газа работа не совершается, и, в
соответствии с первым законом термодинамики, теплота полностью
преобразуется во внутреннюю энергию рабочего :
dTcqUd
v
×==
~
~
~
d
Отсюда молярная теплоёмкость одноатомного газа в изохорном
процессе равна
),
~
/
~
/
~
~
КкДж/(моль RTTRTUс
v
×==== 4812
2
3
2
3
(3.9)
Сравнение полученного значения молярной теплоёмкости
v
с
~
c
экспериментальными данными, показывает, что оно примерно соответ-
ствует теплоёмкости одноатомных газов, но значительно отличается от
экспериментальных данных по двухатомным и многоатомным газам.
Причина различия заключается в том, что в двухатомных и многоатом-
ных газах затраты теплоты на изменение внутренней энергии вызваны
дополнительно изменением энергии вращательного движения атомов в
молекуле вокруг центра вращения.
Одно из основных положений молекулярно-кинетической теории
говорит о том, что внутренняя энергия газа распределяется равномерно
между степенями свободы движения молекул. Материальная точка,
которой считается молекула одноатомного идеального газа, имеет три
НГАВТ - Стр 31 из 239
Новосибирская Государственная Академия Водного Транспорта

32
степени свободы, на каждую из них в одном моле газа приходится внут-
ренняя энергия, равная
12,48: 3=4,16 кДж/моль
Молекулы двухатомных газов имеют пять степеней свободы: три
поступательного движения и два - вращательного. Молярная теплоём-
кость двухатомного газа в изохорном процессе равна
4,16 х 5 = 20,80 кДж/моль
В многоатомных газах молекулы имеют шесть степеней свобо-
ды (три степени поступательного движения и три степени вращательно-
го движения), и изохорная молярная теплоёмкость таких газов состав-
ляет
4,16 х 6 = 24,96 кДж/моль
Более точные значения теплоёмкостей дают формулы, в которых учиты-
вается, помимо вышеназванных, энергия колебательного движения ато-
мов в молекулах, которая тоже реагирует на изменение температуры.
Численные значения молярной теплоёмкости иногда используют в
расчётах, где не требуется большая точность, чаще используются экспе-
риментальные данные, изложенные в табличной или графической фор-
ме.
3.2 Смеси идеальных газов
Газовой смесью является атмосферный воздух, состоящий из ки-
слорода, азота, водяных паров и некоторых других газов. В тепловых
двигателях и котлах сложными газовыми смесями являются продукты
сгорания топлива, содержащие, кроме азота и кислорода, углекислый
газ, окислы углерода, азота и серы. Газообразное горючее, используемое
в бытовых и производственных отопительных приборах, тоже является
смесью различных газов – метана, пропана, бутана и других углеводо-
родов. Нижеприведенная методика позволяет вести расчёты в задачах,
где рабочими телами являются эти сложные вещества.
Если несколько газов, химически не реагирующих между собой,
поместить в общий сосуд, то благодаря хаотическому движению моле-
кул, каждый из них равномерно распределится по всему объёму сосуда,
и образуется газовая смесь. Для смесей идеальных газов справедливы
основные положения и законы термодинамики. Есть и специфические
НГАВТ - Стр 32 из 239
Новосибирская Государственная Академия Водного Транспорта
33
свойства газовых смесей. Одно из них фиксирует закон Дальтона: дав-
ление смеси
с
p равно сумме парциальных давлений компонентов:
å
=++=
n
inC
ppppp
1
21
... , (3.10)
где
n
ppp ...,
21
- парциальные давления компонентов.
Парциальным называется давление, которое оказывает компонент,
находящийся один в объёме смеси при той же температуре, которую
имеет смесь.
Газовая смесь может быть задана массовыми, объемными и моляр-
ными долями.
Массовой долей
i
g называют отношение массы данного компонен-
та
i
m к массе всей смеси
C
m :
Ci
mmg /
1
=
Объёмной долей компонента
i
r называется отношение парциаль-
ного объёма
i
V к объёму смеси
C
V :
Cii
VVr /=
Парциальным объёмом называют объём компонента при давлении
и температуре смеси.
Под молярной долей
i
n
понимают отношение числа молей данно-
го компонента
i
z к числу молей смеси
C
z :
Cii
zz /=
n
Суммы массовых, объёмных и молярных долей равны единице:
1
1
=
å
n
i
g , 11
1
==
åå
n
1
i
n
i
,r
n
Для компонентов, как и для смеси в целом, справедливо уравнение
состояния идеального газа:
CiiCi
TRmVp = , (3.11)
CiiiC
TRmVp = , (3.12)
CCCCC
TRmVp = , (3.13)
где
Ci
RR , - удельные газовые постоянные компонента и смеси;
C
T -
температура смеси, равная температурам компонентов
i
T .
НГАВТ - Стр 33 из 239
Новосибирская Государственная Академия Водного Транспорта

34
При делении (3.11) на (3.12) получается формула для определения
парциального давления:
iCiiCCi
rp p VpVp ×=®= 1/ (3.14)
При делении (3.12) на (3.13) определяется взаимосвязь между объ-
ёмными и массовыми долями компонентов:
C
i
ii
CC
ii
C
i
R
R
gr
Rm
Rm
V
V
=®= (3.15)
В соответствии с законом Авогадро объемы молей любых идеаль-
ных газов при одинаковых температуре и давлении равны. Поэтому
парциальный объём любого компонента можно представить как произ-
ведение объема моля на число молей этого компонента, а объём смеси
как произведение объема моля на число молей смеси. Отсюда следует,
что объёмные доли численно равны молярным долям:
ii
r
n
= .
Если просуммировать уравнения (3.11) для всех компонентов сме-
си, то получится
CCi
n
iiC
TmRgpV )
å å
=
1
(3.16)
Учитывая (3.10) и решая совместно уравнения (3.16) и (3.13), на-
ходится формула для определения удельной газовой постоянной смеси:
i
n
iC
RgR
å
=
1
(3.17)
Кажущаяся молярная масса смеси определяется с помощью уни-
версальной газовой постоянной
C
R/8314=
m
(3.18)
При расчёте теплоты следует учитывать, что теплота, передаваемая
смеси
C
Q , идёт на нагрев компонентов, пропорционально их относи-
тельным количествам и теплоёмкостям
TcmTcmTcmTcm
QQQQ
пncC
nC
D+D+D=D
®++=
...
,...
2211
21
, (3.19)
откуда следует формула для расчёта массовой теплоёмкости смеси
iiс
gсс
å
= , (3.20)
где с
1,
с
2
…
,
с
i
- массовые теплоёмкости компонентов.
НГАВТ - Стр 239 из 239
Новосибирская Государственная Академия Водного Транспорта

35
Аналогично находятся формулы для расчёта объёмной и молярной
теплоёмкостей смесей:
iiciiс
cc , rСС
n
åå
=×
¢
=
¢
~~
, (3.21)
где
i
C
¢
и
i
c
~
- cоответственно, объёмные и молярные теплоёмкости
компонентов смеси.
3.3 Влажный воздух
В технике встречается много аппаратов и устройств, в которых
происходят процессы увлажнения или осушения воздуха для выполне-
ния каких-то технологических процессов или создания комфортных
условий в бытовых помещениях.
Воздух, не содержащий водяного пара, называется сухим, а содер-
жащий - влажным. Содержание водяного пара в атмосферном воздухе
зависит от давления и температуры, а также от наличия источников
испарения. Смесь сухого воздуха и перегретого водяного пара называет-
ся ненасыщенным влажным воздухом. Этот воздух способен при дан-
ных условиях поглощать водяной пар. Смесь сухого воздуха с насыщен-
ным водяным паром называется насыщенным влажным воздухом. При
условиях насыщения этот воздух не способен поглощать влагу.
Температура, до которой необходимо охлаждать ненасыщенный
влажный воздух, чтобы он стал насыщенным, называется точкой росы.
При анализе процессов, происходящих с воздухом, используется
теория идеальных газов. Влажный воздух рассматривается как смесь
идеальных газов, давление которой р складывается из парциальных
давлений сухого воздуха
в
р и водяного пара
п
р :
р= р
в
+ р
п
Масса пара в 1
3
м влажного воздуха, численно равная плотности
пара
п
r
при его парциальном давлении
п
р , называется абсолютной
влажностью. Отношение действительной абсолютной влажности к
максимально возможной абсолютной влажности
s
r
при той же темпе-
ратуре называется относительной влажностью:
Sп
rrj
/= (3.22)
НГАВТ - Стр 35 из 239
Новосибирская Государственная Академия Водного Транспорта

36
Величина
j
выражается в долях или в процентах. Для сухого воз-
духа
j
=0, а для насыщенного
j
=100%.
Для определения абсолютного содержания водяного пара в воздухе
кроме абсолютной влажности необходимо знать температуру влажного
воздуха, однозначно определяющую величину давления насыщения
S
р .
Отношение массы водяного пара
п
m , содержащегося во влажном
воздухе, к массе сухого воздуха
в
m называется влагосодержанием воз-
духа:
вп
mmd /= (3.23)
Измеряется влагосодержание в кг/кг или в г/кг.
Если в формуле (3.23) массы пара и сухого воздуха выразить из
уравнений состояния, то получится
Sв
в
п
вп
пв
в
в
п
п
/рр,
р
р
рR
рR
ТR
Vр
:
ТR
Vp
d 6220
462
287
==== (3.24)
Учитывая, что
пвSп
pp, pр р -=×=
j
, выражение (3.24) можно
представить в таком виде:
S
S
p p
p
d
j
j
-
= 6220, (3.25)
Так как процессы, происходящие в сушильных или увлажнитель-
ных устройствах чаще всего изобарные, необходимо уметь определять
изобарную теплоёмкость влажного воздуха как газовой смеси.
Обычно теплоёмкость влажного воздуха относят к 1 кг сухого воз-
духа, то есть к (1+d) кг влажного воздуха. Она равна сумме теплоёмко-
стей 1 кг сухого воздуха и d кг пара:
рпрвр
cdсс ×+= , (3.26)
где теплоёмкости сухого воздуха
рв
с и водяного пара
рп
с определяют-
ся из таблиц теплоёмкостей.
Энтальпия влажного воздуха h определяется как сумма энтальпий
1 кг сухого воздуха
в
h и d кг водяного пара c энтальпией
п
h :
пв
hdhh ×+= (3.27)
Расчёты термодинамических состояний и процессов с влажным
воздухом выполняются обычно по специальной диаграмме “энтальпия -
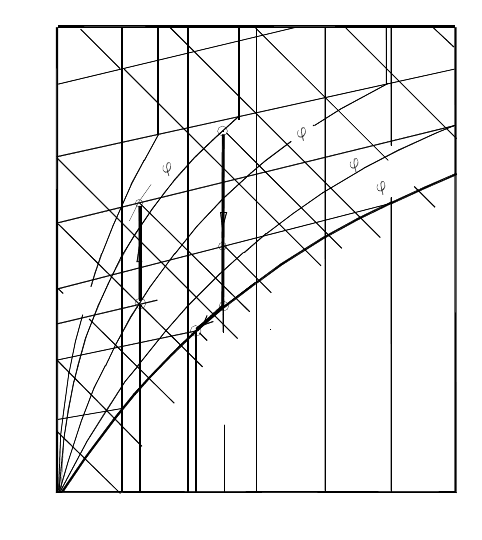
влагосодержание”, которая показана на рисунке 3.1.
НГАВТ - Стр 36 из 239
Новосибирская Государственная Академия Водного Транспорта
37
На диаграмме представлены:
- линии относительной влажности
j
=Сonst;
- линии равных температур (изотермы) t=Const;
- линии равных энтальпий (изоэнтальпы) h=Const.
Иногда на диаграммах изображаются линии равных плотностей
или удельных объёмов. Диаграмма строится для давления воздуха 745
или 760 мм рт ст, что соответствует средним значениям атмосферного
давления.
Для удобства пользования диаграммой при её построении была
использована косоугольная система координат с осями, расположенны-
ми под углом 135 °. Поэтому изоэнтальпы оказываются прямыми, на-
клонёнными под углом 45°.
Линии
j
=Const поднимаются до изотермы
s
t , соответствующей
температуре насыщения при заданном барометрическом давлении, по-
сле чего практически вертикально поднимаются вверх. Это говорит о
том, что при
s
tt > относительная влажность зависит только от влаго-
содержания. и при заданном значении d остаётся постоянной. Термоди-
намическое состояние влажного воздуха на этой диаграмме определяет-
ся точкой . Так, точка А фиксирует термодинамическое состояние с
температурой
A
t , влагосодержанием
A
d , относительной влажностью
A
j
и удельной энтальпией h
A
.
Процесс нагрева воздуха с постоянным влагосодержанием, кото-
рый наблюдается, например, в калорифере или при теплообмене в
обычном радиаторе, изображается вертикальной линией А - В. В резуль-
тате этого процесса влажный воздух нагревается до температуры t
B
при
снижении относительной влажности до
В
j
. Удельная теплота процесса
определяется по формуле
ABВА
hhq -=
-
, (3.32)
где удельные энтальпии влажного воздуха в начале h
A
и в конце h
B
процесса определяются по диаграмме.
Процесс охлаждения влажного воздуха в области ненасыщенного
воздуха С-D протекает при постоянном влагосодержании. При дальней-
шем охлаждении (процесс D-Е-F), когда достигается точка росы, соот-
ветствующая температуре t
к
на линии насыщения φ = 100%, происхо-
НГАВТ - Стр 37 из 239
Новосибирская Государственная Академия Водного Транспорта
38
дит выпадение влаги в виде капель. Количество теплоты, отнятой от
охлаждаемого воздуха в процессе С-D -Е-F, равно
FCFC
hhq -=
-
, (3.32)
а количество выделившейся влаги составляет
FC
ddd -=D (3.33)
В изоэнтальпийном процессе С-К температура воздуха умень-
шается, а влажность увеличивается. Такие процессы происходят при
увлажнении воздуха водой, температура которой близка к температуре
воздуха.
С помощью диаграммы h - d можно рассчитывать относительную
влажность воздуха, температуру и другие параметры при смешении
потоков воздуха, а также определять парциальное давление водяного
пара во влажном воздухе.
Рисунок 3.1
s
Удельная
энтальпия
, кДж
/кг
, h
A
B
C
D
E
F
t
t
t
В л а г о с о д е р ж а н и е, d, кДж/кг
Т
е м
п
е
р
а
т
у
р
а, t,
С
= 100 %
B
A
A
B
D
C
h
h
h
h
B
D
A
t
d
d
d
A
F
E
НГАВТ - Стр 38 из 239
Новосибирская Государственная Академия Водного Транспорта

39
Constv TConst v
v
RT
n-n
=×®=×
1
4 Анализ политропных процессов идеальных
газов
4.1 Особенности политропных процессов
Политропными называются процессы с постоянной теплоёмко-
стью. В каждом из этих процессов рабочее тело может иметь любое
значение теплоёмкости
n
с от 0 до ±¥, но в течение процесса теплоём-
кость должна быть постоянна.
При изучении политропных процессов используются термодина-
мические законы, формулы для определения теплоты, работы, измене-
ния энтропии и внутренней энергии в процессах, а также уравнение
состояния идеального газа.
Для определения уравнения политропного процесса, связующего
переменные параметры состояния, используются формулы, опреде-
ляющие энергетический баланс в соответствии с первым законом тер-
модинамики:
vdpdiq -=
d
→ vdpdTcdTс
pn
-= (4.1)
pdvduq +=
d
→ pdvdTcdTc
vn
+= (4.2)
После деления (4.1) на (4.2) и замены ncccс
vnpn
=-- )/()( получается
pdv
vdp
n -= , откуда 0=+
v
dv
n
p
dp
(4.3)
Показатель политропы n может принимать любое числовое значение.
В результате интегрирования и последующего потенцирования
уравнения (4.3) определяется взаимосвязь между давлением и удельным
объёмом в политропном процессе:
Constv pConst vnp
n
=×®=+ lnln (4.4)
Если по уравнению состояния произвести замену vRTp /= в вы-
ражении (4.4) , то определится взаимосвязь между температурой и
удельным объёмом в политропном процессе:
Aналогично определяется взаимосвязь в политропном процессе
между температурой и давлением:
НГАВТ - Стр 39 из 239
Новосибирская Государственная Академия Водного Транспорта

40
Const
p
T
Const
p
(RT)
RT/p , pv
n
n-n
n
=®=×=
1
(4.6)
В политропном процессе 1-2 соотношения между начальными и
конечными значениями параметров определяются из выражений (4.4 -
4.6):
.
n
n
nn
)
p
p
(
T
T
, )
v
v
(
T
T
, )
v
v
(
p
p
1
1
2
1
2
1
2
1
1
2
2
1
1
2
-
-
=== (4.7)
Удельная теплота политропного процесса равна
)(
12
TTcq
n
-= , (4.8)
где теплоёмкость политропного процесса определяется из выражения
ncccс
vnpn
=-- )/()( ,
откуда
1
-
-
=®-=-
n
kn
cc ncnccс
vnvnpn
, ( 4.9)
где
vp
cck /=
Удельная работа политропного процесса равна
dv
òòò
===
-
2
1
2
1
2
1
v
v
k-
v
v
k
v
v
21
vConst
v
dv
Constpdvl
Учитывая, что
kk
vpvpСonst
2211
== , дальнейшее решение имеет
вид:
n
vpvp
n
vv
Constl
nn
-
-
=
-
-
=
+-+-
-
1
1
1122
1
1
1
2
21
Окончательно
)()(
21221121
1
1
1
TT
n
R
vpvp
n
l -
-
=-
-
=
-
(4.10)
Изменение удельной внутренней энергии в политропном процессе
определяется по формуле
)
1212
T(TcudT, ucdu
vv
-=-= ( 4.11)
Изменение удельной энтропии в политропном процессе равно
,// TdTcTqds
n
==
d
)/ln(
1212
TTcss
n
=- (4.12)
При известных параметрах в начале и конце процесса 1-2 показатель
НГАВТ - Стр 239 из 239
Новосибирская Государственная Академия Водного Транспорта
