Киреев П.С. Физика полупроводников
Подождите немного. Документ загружается.


Наличие знаменателя в (3.22) связано с тем, что функция распре-
деления Максвелла, которая использована в (3.22), не нормиро-
вана.
Интегрирование по координатам, от которых в данном случае
функция распределения не зависит, дает объем тела V. Удобно
перейти к новым' переменным, положив
p*=(2mkT)x\ (3.23)
В таком случае
00 1
(kT) ^ X
2
dx
(Ε) = — ~kT. . (3.24)
jj х
2
e~
x
dx
ο ,
При вычислении мы учли, что
со β оо j
J х
2
e-*dx = ~ ix
2
e~
x
dx. (3.25)
о 0
Это легко доказывается интегрированием по частям, последний же
интеграл (3.25) равен (интеграл Пуассона). Кроме того, мы
нашли нормировочный коэффициент для функции БольЦмана: нор-
мированная к единице при интегрировании по фазовому пространству
функция Больцмана имеет вид.
If 1 \Т-
Найдем теперь среднюю энергию электронов вырожденной системы
при тех же предположениях:
fo(E, Τ) =
р2
1
(3.27)
— F
2т
Г
е
kT
+1
(β) ^ ±! . (3.28)
\ IIH-LrX
21

Переходя к переменным (3.23) и сокращай на одинаковые вели-
чины числитель и знаменатель, можем записать
I
х
2
dx
J е^Й +
1
(,
E
)=kT . (3.29)
При большой температуре, когда kT^>F и можно
пренебречь единицей по сравнению с е* в подынтегральном выра-
жении уже при малых х. В этом случае квантовая статистика
переходит в классическую и
(E) = \kT. (3.30)
При очень низких температурах функция Ферми —Дирака имеет
вид прямоугольной единичной ступеньки, интеграл можно вычислить
от 0 до x = F/kT, поэтому
F/kT
kT \ x^dx
= Ч\
F
· (
3
·
31
>
S x
l/2
dx
0
Как видно из (3.31), энергия вырожденного электронного газа
не зависит от температуры, поэтому он не вносит вклада в тепло-
емкость тела, что полностью объясняет закон Дюлонга —Пти для
твердых тел.
Если провести более строгий расчет, то для <Ε) получим выра-
жение
<*>=4М'+Ш]. (3.32,
Объяснение независимости теплоемкости твердого тела при обыч-
ных температурах от движения электронов явилось крупным успехом
квантовой теории, поскольку по классической теории электроны
~
должны давать вклад в удельную теплоемкость металла величиной
|-kn. -
Однако при низких температурах распределение электронов по
энергетическим состояниям определяется не тепловым движением,^
а волновыми свойствами электронов и вытекающим из них тгринци-
пом Паули, благодаря чему (E) = -^F
f
что составляет величину
22

в несколько электронвольт, поэтому тепловое движение слабо влияет
на величину энергии электронного газа. Однако при больших темпе-
ратурах, когда kT>F
Ql
энергия электронного газа будет опре-
деляться его температурой.
Переход от квантовой статистики к классической можно опре-
делить условием
kT
B
= F
0i
(3.33)
или
T
B
= Fo/k
K
(3.34)
Температуру Τ
ΰ
называют температурой вырождения, поскольку
при Τ>Т
В
электронный газ является классическим, а при Т<.Т
В
—
квантовым {вырожденным).
При описании свойств полупроводников будут использованы как
функция Ферми —Дирака (вырожденные полупроводники), так и
функция Больцмана (невырожденные полупроводники).
В дальнейшем будет необходимо вычислять интегралы вида
/ = [ φ (£)/„(£, T)dE. (3.35)
о
Если через ψ (Ε) обозначим первообразную для функции φ(£),
то, интегрируя по частям, получим:
оо оо
/ = ψ (Ε) fo (Л, Л I - J Ψ (£)
д/о{
0Ё
Τ) dE
- (
3
·
36
)
О О
Первый член в (3.36) обычно обращается в нуль, для этого
достаточно, чтобы ψ(0) = 0, а ψ(£) возрастала с ростом энергии
медленнее, чем экспонента. Считая, что эти условия выполнены,
опустим первый член в (3.36). Разложим ψ(£) в ряд Тейлора
в окрестности точки E = F:
00 00
V-rr^dE. (3.37)
о rt = 0 F
E
— F
Переходя к безразмерной переменной ξ=
kT
и учитывая соот-
ношение (3.15), запишем:
ОО 00
'--И^И-я J t"i«E· ел»
/2
= 0 — F/kT
Для сильного вырождения нижний предел можно заменить на —оо.
В этом случае члены нечетной степени дают нуль, и (3.38) можно
представить в виде:
'-Σ^ ^С, (3.39)
г=о i:
23

где через С
2г
обозначены определенные интегралы вида
оо оо
. (3.40)
—ОО —00
Вычисление коэффициентов С2г проводится с использованием
некоторых специальных функций, например дзета-функции Римана
ζ (2
С^ = 2 О
—
2
1
~
2Г
) ζ (2r). (3.41)
Используя значения £(2r), можно найти С2П
ζ (2) = |; C(4)-g;,..
ι ^ _π2 ^ __7π
4
r
_ 31π
8
6 '
U4
360' 15120' "·
или C
0
= 1; C
a
^ 1,64; С
4
я^ 1,89; С
б
^1,96 и т. д.
Ограничиваясь несколькими членами ряда, запишем:
оо
5 φ (Ε)
/о
(Я, Г) =
Ψ (/=)
(F) + +
· · ·
· (3.42)
0
Во многих случаях можно ограничиться двумя членами
00
'\<f(E)f
0
(E,T)dE**ib(F) + %(kr)W(F). (3.43)
О
Выражение (3.43) можно использовать, например, для вычисле-
ния (3.29).
2 2
Положив
г|)
= у£
5
/
2
и
г|)
= у£
3
/
2
для верхнего и нижнего инте-
гралов, найдем:
3 '3 2 2 6
15 π
2
ОТ
3 4 ' 6 t ^
^Z
7
+
4 ' 6 I F
J
ρ[, + -(»)•]. . (3.44)
Видим, что при ΤО (3.44) переходит в (3.31). Аналогично
можно найти
'-М'-ет »«>
при условии постоянства концентрации электронов. Подставив (3.45)
в (3.44), получим (3.32).
24

Резюме § 3
1. Для описания электронного газа может быть введена функция
распределения
/
(г, р, t), представляющая собой вероятность нахож-
дения электрона в единичном фазовом объеме.
2. Для любой физической величины а можно найти среднее
значение (а) на основании соотношения (3.8).
3. Квантовая функция распределения электронов по состояниям
(3.10) зависит только от энергии и температуры. Она близка к единице
при E<F
—
2kT> близка к нулю при E>F + 2kT
f
испытывает
резкое изменение в интервале энергии порядка'±2kT относительно
энергии Ферми F. Системы, подчиняющиеся квантовой статистике,
называют вырожденными. С ростом температуры,, когда F становится
меньше kT> функция Ферми —Дирака переходит в функцию Больц-
мана,. или классическую функцию распределения (3.12).
4. Средняя энергия вырожденного электронного газа опреде-
ляется выражением (3.32), невырожденного газа
—
выражением (3.24):
(Е)
=р ®
F
0
[l + (f )
2
]; (Ε) = 4*7.
(3.1
ρ)
5. Температура вырождения Т
в
электронного газа определяется
энергией Ферми F
0
:
Т
в
= F
0
/kT. (3.2р)
При Т>Т
Ъ
газ является классическим (невырожденным), при
Τ < Т
в
—
квантовым (вырожденным).
6. Для вырожденных полупроводников и металлов вычисления
с функцией Ферми —Дирака дают:
оо ОО
5 <р(£)/о(£, T)dE = q(E)fo(E, Τ) I +
о о
' + + + (З.Зр)
где =
§ 4. ПОЛУПРОВОДНИКИ, КЛАССИФИКАЦИЯ ВЕЩЕСТВ
ПО ВЕЛИЧИНЕ ПРОВОДИМОСТИ
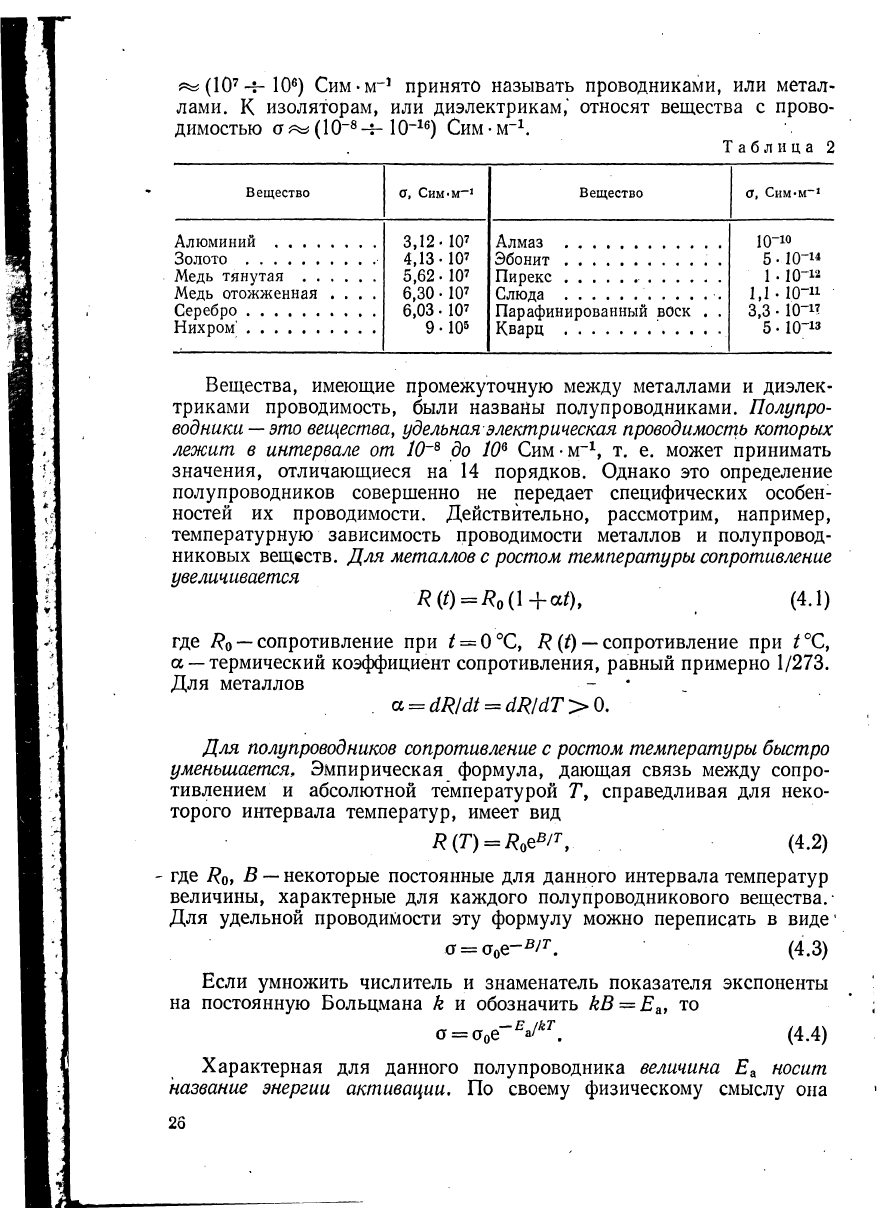
Реальные вещества характеризуются различной величиной удель-
ной электрической проводимости σ. Примеры проводимости некоторых
веществ даны в табл. 2;
Из табл. 2 видно, что для таких веществ, как золото, серебро,
медь, проводимость имеет величину в несколько единиц на 10
7
Сим-м
-1
,
а эбонит и янтарь имеют проводимость, характеризующуюся вели-
чиной порядка 10
14
Сим-м Ч Вещества с проводимостью σ^
25
^(10
7
-*-10
б
) Сим-м"
1
принято называть проводниками, или метал-
лами. К изоляторам, или диэлектрикам,' относят вещества с прово-
димостью σ я^ (10
-8
-τ- 10
-16
) Сим
·
м
-1
.
Таблица 2
Вещество
Алюминий . . . .
Золото
Медь тянутая . .
Медь отожженная
Серебро
Нихром
1
σ, Сим·м
-1
3.12- 10
7
4.13-107
5,62
·
ΙΟ
7
6,30
·
ΙΟ
7
6,03. 107
9 -10
5
Вещество
Алмаз
Эбонит
Пирекс . . .
Слюда
Парафинированный воск
Кварц . .
σ, Сим-м
-1
10-ю
5 -10-14
10-12
10"
11
Ю-*?
Ю-13
1
1,1
3,3
5
Вещества, имеющие промежуточную между металлами и диэлек-
триками проводимость, были названы полупроводниками. Полупро-
водники
—
это вещества, удельная электрическая проводимость которых
лежит в интервале от 10~
8
до 10
6
Сим-м
-1
, т. е. может принимать
значения, отличающиеся на 14 порядков. Однако это определение
полупроводников совершенно не передает специфических особен-
ностей их проводимости. Действительно, рассмотрим, например,
температурную зависимость проводимости металлов и полупровод-
никовых веществ. Для металлов с ростом температуры сопротивление
увеличивается
(0 =
7?
0
(1
(4.1)
где R
0
—
сопротивление при
?
= 0°С, R(t)
—
сопротивление при t°С,
α
—
термический коэффициент сопротивления, равный примерно 1/273.
Для металлов
. a = dR/dt = dR/dT>0.
Для полупроводников сопротивление с ростом температуры быстро
уменьшается. Эмпирическая формула, дающая связь между сопро-
тивлением и абсолютной температурой Т> справедливая для неко-
торого интервала температур, имеет вид
R(T) = R
0
e
B
/
T
, (4.2)
где R
0
, В
·—
некоторые постоянные для данного интервала температур
величины, характерные для каждого полупроводникового вещества.·
Для удельной проводимости эту формулу можно переписать в виде
1
0
= а
о
е-*/
7
\ (4.3)
Если умножить числитель и знаменатель показателя экспоненты
на постоянную Больцмана k и обозначить kB = E
&
, то
о = o
0
e~
E
a/
kT
. (4.4)
Характерная для данного полупроводника величина £
а
носит
название энергии активации. По своему физическому смыслу она
26

различна для разных интервалов температур. На рис. 3 приведены
графики зависимости сопротивления металла и полупроводника от
температуры Т. На рис. 4 приведены графики зависимости Ιησ
от обратной температуры.
Наличие энергии активации Е
а
означает, что для увеличения
проводимости к полупроводниковому веществу необходимо подвести
энергию. Опыт показывает, что проводимость полупроводников уве-
личивается не только при нагревании (т. е. при подведении к полу-
проводнику тепловой энергии), но и при освещении, при облучении
ядерными частицами; она меняется при наложении электрических и
магнитных. полей, при изменении внешнего давления и т. п. Это
означает, что полупроводники —это вещества, проводимость которых
сильно зависит от внешних условий: температуры, давления, внешних
полей, освещения, облучения ядерными частицами.
, Полупроводник
Ind
. Ind
1/τ
1/Т
Рис. 3. Зависимость сопротивления
металлов и полупроводников от тем-
пературы
Рис. 4. Зависимость Ιησ от обрат-
ной температуры для металлов и
полупроводников
Так как при О и при отсутствии подвода энергии извне
проводимость (невырожденных) полупроводников стремится к нулю,
то мы можем сказать, что полупроводники
—
это вещества, обладающие
проводимостью только в возбужденном состоянии. При таком опре-
делении в принципе нет различия между полупроводниками и
диэлектриками, в то время как отличие полупроводников от металлов
отражено достаточно четко.
Влияние 'условий на проводимость полупроводников проявляется
по-разному в зависимости от структуры и свойств вещества. При
неизменных внешних условиях проводимость одного и того же
вещества в виде чистого и- совершенного монокристалла, моно-
кристалла с дефектами и примесями и поликристалла различна.
'Учитывая все сказанное, можем определить полупроводники
следующим образом: полупроводники — это вещества, имеющие при ком-
натной температуре удельную электрическую проводимость в интер-
вале от 10~
8
до 10
6
Сим
·
м
-1
, которая зависит в сильной степени
от вида и количества примеси и структуры вещества и от внеш-
них условий: температуры, освещения, электрических и магнитных
полей и т. п.
ЭТО определение позволяет отличать полупроводники от метал-
лов—проводимость металлов значительно слабее зависит от внеш-
27
них условий, поскольку для создания проводимости в полупроводни-
ках их необходимо перевести в возбужденное (активированное) со-
стояние, в то время как состояние проводимости металлов является
состоянием невозбужденным. Указание на интервал возможных зна-
чений удельной проводимости позволяет отличать полупроводники
от диэлектриков. Отсюда следует, что различие между полупроводни-
ками и диэлектриками чисто количественное и в значительной мере
условное.
Существует два типа полупроводниковых веществ: ионные и
электронные. В ионных полупроводниках ток переносится ионами
вещества, вследствие чего состав и структура ионного полупровод-
ника меняется при прохождении через него электрического тока.
Для приборов, преобразующих энергию, такие вещества не при-
годны, так как они будут
разрушаться при прохожде-
нии через них тока. Такие
вещества в данном курсе не
ρ ассм атр и в аются.
В электронных полупро-
водниках ток переносится
электронами, вследствие чего
<
переноса вещества при про-
хождении тока не происхо-
дит, и приборы, изготовлен-
ные из этого материала, могут
работать длительное время.
Рис. 5. Положения простых полупроводни- К полупроводникам (элек-
ковых веществ в таблице Мейделеева тронным) ОТНОСИТСЯ огромное
количество самых различных
веществ. Но практическое значение в настоящее время имеют лишь
некоторые из них. Однако по мере развития химии и технологии
получения чистых веществ число полупроводников, находящих ши-
рокое практическое применение, быстро возрастает.
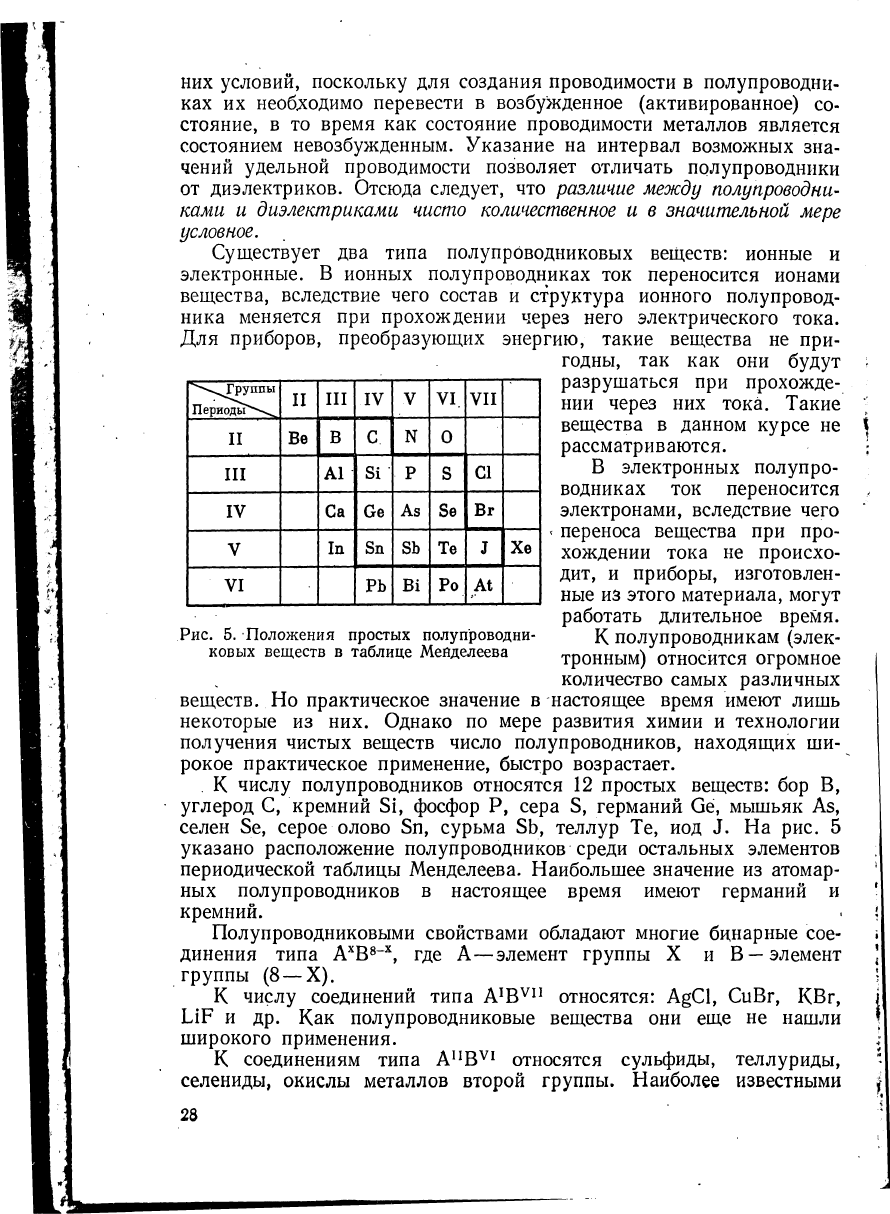
. К числу полупроводников относятся 12 простых веществ: бор В,
углерод С, кремний Si, фосфор Р, сера S, германий Ge, мышьяк As,
селен Se, серое олово Sri, сурьма Sb, теллур Те, иод J. На рис. 5
указано расположение полупроводников среди остальных элементов
периодической таблицы Менделеева. Наибольшее значение из атомар-
ных полупроводников в настоящее время имеют германий и
кремний.
Полупроводниковыми свойствами обладают многие бинарные сое-
динения типа А
Х
В
8-Х
, где А—элемент группы X и В —элемент
группы (8 —X).
К числу соединений типа A
I
B
VI1
относятся: AgCl, CuBr, KBr,
LiF и др. Как полупроводниковые вещества они еще не нашли
широкого применения.
К соединениям типа Α
π
Β
νι
относятся сульфиды, теллуриды,
селениды, окислы металлов второй группы. Наиболее известными
^\Группы
Периоды*—
и
III
IV
ν
VI.
VII
II
Be
В С
Ν
О
III
А1
Si
Ρ
s
CI
IV
Са Ge
As
Se
Br
V
In
Sn
Sb
Те
J
Xe
VI
Ρ Ь
Bi
At
28

с
реди них являются соединения CdS, CdSe, CdTe, ZnS, ZnO, ZnSe,
HgTe, HgSe и некоторые другие. В ближайшем будущем многие из
нй
х найдут широкое практическое применение.
Одними из важнейших в настоящее время полупроводни-
ковых соединений являются вещества типа Α
ΙΠ
Β
ν
. К ним при-
надлежат антимониды, арсениды, фосфиды, нитриды элементов
второй подгруппы третьей группы: алюминия, галлия, индия,
бора.
В число «соединений» типа A
IV
B
IV
входят SiC, SiGe.
Помимо соединений вида А
Х
В
8_Х
, к полупроводниковым вещест-
вам относятся такие соединения, как A
iy
B
VI
(PbS, PbSe, PbTe),
AiB
VI
(CuS, CuO, Cu
2
0) и др.
Большой интерес представляют более сложные соединения
и твердые растворы, как вещества вида A
x
B?
-x
Bf~
x
, А
Х
А
Х
В
8-Х
,
Α?ΑίΒ
8-χ
Β
8
-
χ
. Примерами твердых растворов могут служить GaAsP,
InGaSb или ZnCdSeTe.
Комбинируя различные элементы, можно будет получать .соеди-
нения с наиболее подходящими для данных практических целей
свойствами. Помимо этого, полупроводниками являются различные
более сложные соединения.
Кроме неорганических веществ, к полупроводникам причисляются
и некоторые органические вещества, такие, как антрацен метилено-
вый голубой, фталоцианин, коронен и·др. .
Разнообразие полупроводниковых веществ с большим набором
свойств обусловило их широкое практическое применение для изго-
товления различных приборов.
Полупроводниковые диоды позволяют выпрямить ток от милли-
ампер до тысяч ампер, от низких частот до сверхвысоких частот,
от напряжения в доли вольта до сотен вольт. Триоды, или
транзисторы, используют для усиления и генерации колебаний
в широком диапазоне частот. Регистрация светового и корпус-
кулярного излучения, преобразование энергии излучения и теп-
ловой в электрическую достигается полупроводниковыми приемни-
ками и преобразователями с большим коэффициентом полезного
Действия. '
В измерительной технике широко используют всевозможные
«датчики», позволяющие преобразовывать различные воздействия в
электрический сигнал для измерения давлений, магнитных полей,
температур, энергии излучения.
Полупроводники находят широкое применение для получения
когерентного -излучения с большим . к.п.д. преобразования
электрической энергии в световую. Трудно перечислить все те
области, где полупроводниковые приборы уже нашли приме-
нение.
В основе каждого прибора лежат определенные физические про-
цессы и явления, без знания которых невозможно правильно исполь-
зовать существующие и разрабатывать новые приборы.
29

§ 5. МОДЕЛЬНЫЕ ПРЕДСТАВЛЕНИЯ О ПРОВОДИМОСТИ ПОЛУПРОВОДНИКОВ.
ПОНЯТИЕ ДЫРКИ
Кристаллическая решетка какого-либо вещества возникает в ре-
зультате взаимодействия атомов. Характер взаимодействия определя-
ется строением электронных оболочек атомов, образующих кристалл.
Основную роль при этом играет так называемый обменный эффект,
в результате которого какие-либо два атома могут передавать элект-
роны Друг другу, что приводит к возникновению сил притяжения
между атомами. Эта связь носит название гомополяр ной, по-
скольку она чаще всего наблюдается между одинаковыми атомами.
Так как в ее образовании участвуют в первую очередь валентные
электроны, то она называется и ковалентной. Наибольшей силы
связь возникает в том случае, когда атомы обмениваются парой
электронов с противоположно направленными спинами. Отсюда оче-
видно, что ковалентная связь должна обладать свойством насыще-
ния—добавление третьего электрона не может увеличить энергию
связи, так как при этом всегда два электрона будут иметь параллель-
ные спины. Это свойство ковалентной, или парноэлектронной, связи
вытекает из принципа Паули, который в данном случае гласит, что
два электрона с одинаковыми проекциями спина не могут находиться
в одной и той же области пространства между атомами. Примерами
веществ с ковалентной связью являются алмаз, кремний, германий.
Если во взаимодействие вступают два различных атома, то мак-
симальна я плотность электронного облака (плотность вероятности
нахождения электронов) может сместиться ближе к одному из взаи-
модействующих атомов, и именно к тому атому, который имеет
большее число электронов в валентной оболочке. В предельном
случае максимальная плотность электронного облака находится
у одного из взаимодействующих атомов, который тем самым прев-
ращается в отрицательно заряженный ион, в то время как другой
атом превращается в положительный ион. В этом случае связь носит
название ионной, поскольку ее можно рассматривать как резуль-
тат кулоновского притяжения разноименных ионов. Наиболее отчет-
ливо ионная связь проявляется в щелочно-галоидных кристаллах
(NaCl, LiF и др.). Ионная связь есть предельный случай ковалент-
ной связи. О таких веществах, как окислы или сульфиды элементов
второй группы, говорят, что связь на столько-то процентов ионная.
Другим предельным видом обменного взаимодействия является обмен
электронами любой пары атомов кристалла. Электроны принадлежат
решетке в целом, они коллективизируются. Эта связь носит назва-
ние металлической, так как она наиболее характерна для
металлов. Однако нужно помнить, что резкой грани между тремя
видами связи провести нельзя. В органических кристаллах наблю-
дается сравнительно слабая молекулярная связь, обусловленная
так называемым взаимодействием Ван-дер-Ваальса, в основе кото-
рого лежит взаимодействие между индуцированными дипольными
моментами молекул.
30
