Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов
Подождите немного. Документ загружается.


раствора
х. 3ависимость
перенапрях{ения
водорода
от логарифма плотности
тока
Аля
свинцового
электрода при не очень больтпих плотностях
тока
9"ъ?"ь##?1#",""
водорода не зависит
от
одновременного
протеца-
ния процесса
растворения
свинца, т. е. эти
две
реакции
не влия}от
одна
на
другую
(если
только
не происходит
изменения состояния
поверхности
электрода).
1очка
пересечения поляри3ационнь]х кривь1х
для
реакции
разряда
ионов
водорода и
Реакции
анодного
растворения
свинца
дает
по оси
ординат
стационарный
потенциа.!
!оо
а
по оси абсцисс-скорость
саморастворения
свинца |"
(см.
рис.
126).
Ёаблюдаемь1е на
опь1те 3начения скорости саморастворения свинцо-
вого электрода
хоро1по
совпадают со
значен|4ям\4'
найденными
ука3аннь1м
вь1!ше
путем
из
поляри3ационнь1х кривьтх[11!.
Р1ньле
соотно1пения имеют
место
при
растворении
в
кислотах металлов'
для
которь1х
процессь]'
свя3аннь1е с ионизациеи и
разрядом
металла' про-
исходят
медленно,
как'
например, в случае
металлов группь! )келеза.
Ёормальньтй
потенциал }{елеза
по отно1пению к
двухвалентнь]п{
его ионам
равен-0,44
в,
Ёсли
х(е
поместить этот металл
в
1 н.
раствор
соляной
кислоть|' то стационарнь:й
потенциал
его
равен_0,26
в.-
€разу
видно'
что
такой
потенциал
нельзя
рассматривать
как
равновеснь]й
по от-
но!шению к ионам
х(еле3а
(такому
значени1о
равновесного
потенциала
соответствовало
бьт
значение активности ионов
Ре'*,
равное
пример-
но 106,
которое ли1пено
физинеского
смьтсла).
Рассмотрим весь процесс' состоящий,
как
и
1
ранее разобраннь:х
слу-
чаях'
|4з
четь]рех электрохимических
реактлий.
€тат{ионарньтй потенциал
)келе3ного
электрода
при
растворении
в кислоте примерно
на
0,26 в более
отрицателен,
чем поте'нциал
обратимого
водородного
электрода в этощ
рас-
творе'
поэтому
скорость
иони3ации водорода !, на этом электроде
!1ичтох(но
мала
и ею
мох(но прене6рень.
[(роме того'
в
этом случае возмох{но
еще
одно
упрощение'
связанное
с тем'
что ток обмена >келе3а при
его
равно-
весном потенциале сравнительно
невелик.
|!р' потенциалах более
поло_
>кительнь1х, чем
равновеснь]й
потенциал,
скорость
катодн0го процесса
:*
разряда
ионов
}келеза |, станет еще
мень1пе и
9}о
в первом
приблих<ении
такх{е
мох{но
пренебрень
по сравнению
со
скоростями
':"
2
1огда в
уравнении
(277)
останутся
только
два
члена
из
четь1рех,
!|:
!', соответ-
ствующие
реакциям
иониза;!ии
)келе3а
|1
ра3ряда
ионов
водорода.
3ави-
симость
скорости этих
реакций
от
потенщиала мо>*{но исследовать в
отдель-
ности' если
при
поляри3ации электрода
для
нескольких значений
потенциала
измерять
не только суммарньтй
ток'
но
и
количество
раство-
ряющегося
в единицу
времени
)келе3а
для
первой
реакции
и
количество
вьцеляющегося
водорода
для
второй.
|1оляризационную
кривую вь|деления
водорода
на }келезе мох<но вь1ра-
зить
уравнением
такого
)ке типа'
как
и
для
ртутного
электрода
(по
край-
ней мере
в
некоторой
области плотностей
}ока
и
коншентрат{ий):
(286)
Рсли
поверхность
электрода
не меняется' то скорость ионизации
железа
связана с
величиной
потенциала
электрода такх{е
экспоненциаль-
ной зависимостью
'
9рг
!а-: Ёаепт
(287>
19* 29!

14зобра>хая
графинески
поляризационные
кривь1е выделения
водоро-
да
|1л|4
ионизации
желе3а' мо}(но'
как
и в'случае
амальгамного и свинцо-
вого
электродов'
по точке
пересечения определить величину
стационарного
потенциала и вФ1ичину
скорости саморастворения
желе3ного электрода
{см.
рис.
!27).
3адана
о нахо}|(дении
скорости
саморастворения
х{елеза мох<ет бьтть
ре1шена
так)ке
прямым
аналитическим
путем, так
как
в
уравнении
Р7Ф'
вырах(ающем
условие
стационарности'
сохраняются
только
два
экспо-
19/,
+
/!с
.
Рие.
127.
||оляризационнь|е
кривь|е процессов
выделе'
ния
водорода (!1)
п
растворения
)келеза
(!2) в кислых
растворах
него вь|ра>кенпя
для
!'
н
о:.9Р
9эрР
Ё'||1')е_-вт
':
Ё'е
и'
ре1пая'относительно 9'
получаем вь1рах(ение
для
величины
стационар-
ного
потенц|4ала
где
9":.А+
6{};
,
1п
[Ё-]'
А:
Р|
1,Ё'
,.
-
1*; |')Р',,
*я.
|[одставляя
3начение
Ал$
Рс
в
уравнение
для
после
несло}кнь|х
преобра3ований,
соотно1шение
саморастворения
!":&т[Ё*]
"'+9,
(2э0)
йз
уравнения
(239)
видно'
что стационарньтй
потенциал
для
такого
металла,
у
которого скорости ион\43ац\4и
и
разряда
ионов
металла
при
рав-
новесном
потенциале
невелики
и
сравнимь]
со скоростью
ра3ряда
ионов
водорода'
долх(ен
изменяться
с
и3менением
концентрации ионов
водорода
в
растворе
так
>ке' как
||
потенциал
о6ратимого
водородного
электрода.
||равда,
коэффишиент перед логарифмом
концентрации
ионов
водорода
не
равен
коэфишиенту в
уравнении
для
обратимого
водородного
эле-
292
1
?г,
%
|, из
(286)
(2в8)
(2вэ)
++
|'
или
д]|я
!2,
получаем,
для
величины
скорости
ктрода' так
как сумма
(".*Р)
мо)кет
отличаться от единиць1*.
Ёо'так
как
с[1
и
$,
являются
правильнь|ми
Аробями,
6лизкими к
1/',
это
отличие
не
очень
велико
и в
общих чертах
ход зависимости
9"
от
[!1-]
таков
'{е'
как
и
у
водородного
электрода[|0'121.
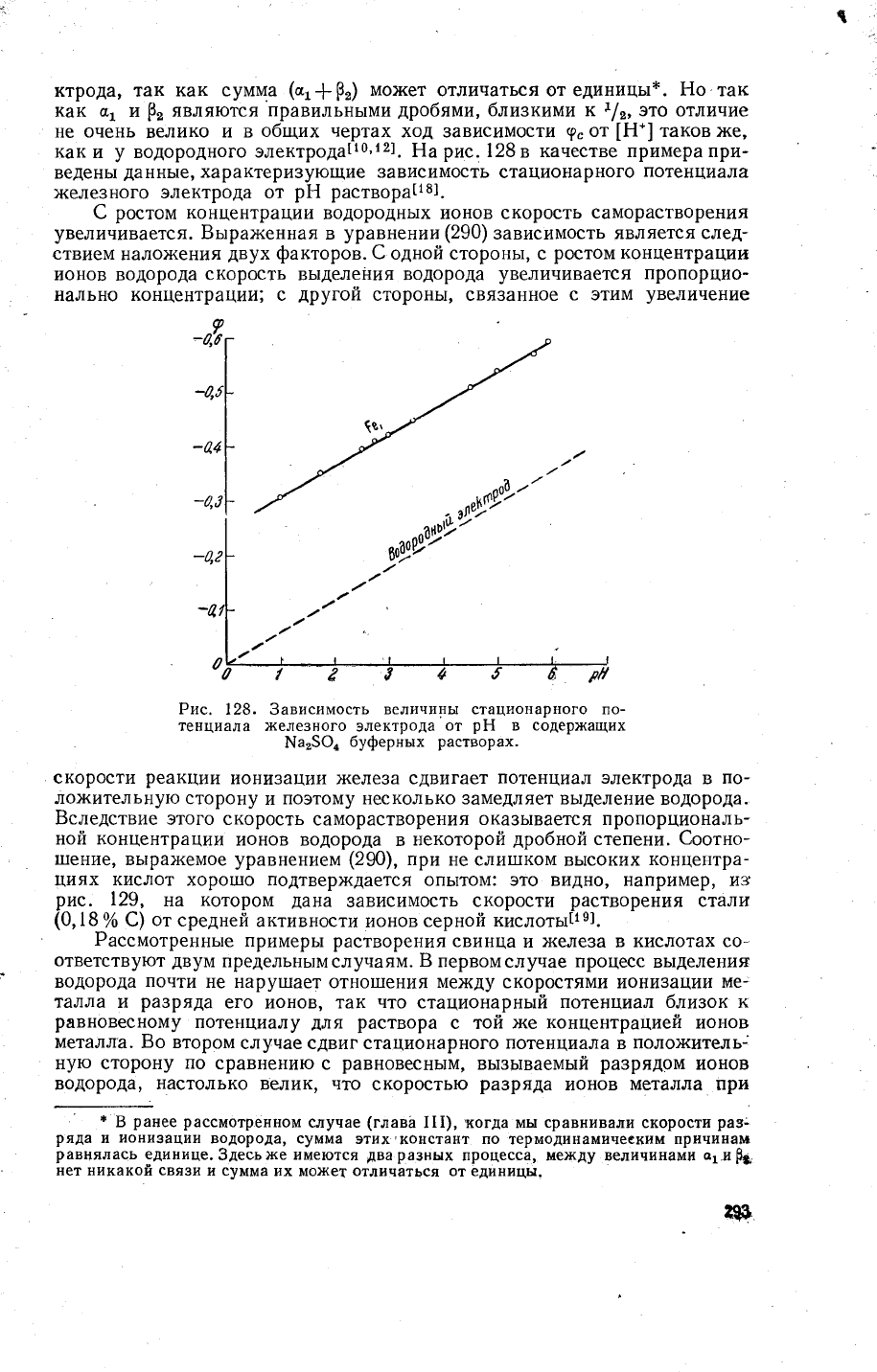
Ёа
рис.
128
в
качестве примера при-
ведень|
да
ннь|е'
характери3ующие 3ависимость
стационарного
потенциала
>келезного электрода от
рЁ раствора(18!.
€
ростом
концентрации
водороднь1х ионов
скорость
саморастворения
увеличивается.
Бырах<енная
в
уравнении
(290)
зависимость
является след-
ствием
налох(ения
двух
факторов.
€
одной сторонь]' с
ростом
концентрации
ионов
водорода
скорость вьгделе1*ия
водорода
увеличивается
пропорцио-
нально концентраци||; с
лругой
стороны' связанное
с этим
увеличение
Ф
_ць
-ц5
-ц4
-03
1о'
,.^оф-"
-
.1Ф'2
,Ф'!уу'
Рис'
!28. 3ависимость
величины стационарного по-
те нци ал
а
*Ё33?
.''!?Ё*{'
,::'*#'-:
содер)кащих
скорости
реакции
т4он||за\\|7|4 )келе3а сдвигает
потенциал электрода
в
по-
ло>кительную сторону
и
поэтому несколько замедляет вь]деление
водорода.'
Бследствие
этого скорость
саморастворения
оказь|вается пропорциональ-
ной концентрации
ионов водорода в
некоторой
дробной
степени.
6оотно-
!пение' вь!ражемое
уравнением
(2Ф),
при
не сли1шком
вь]соких
концентра-
циях
кислот
хорошо подтверх{дается
опь]том:
это
видно' например' и3
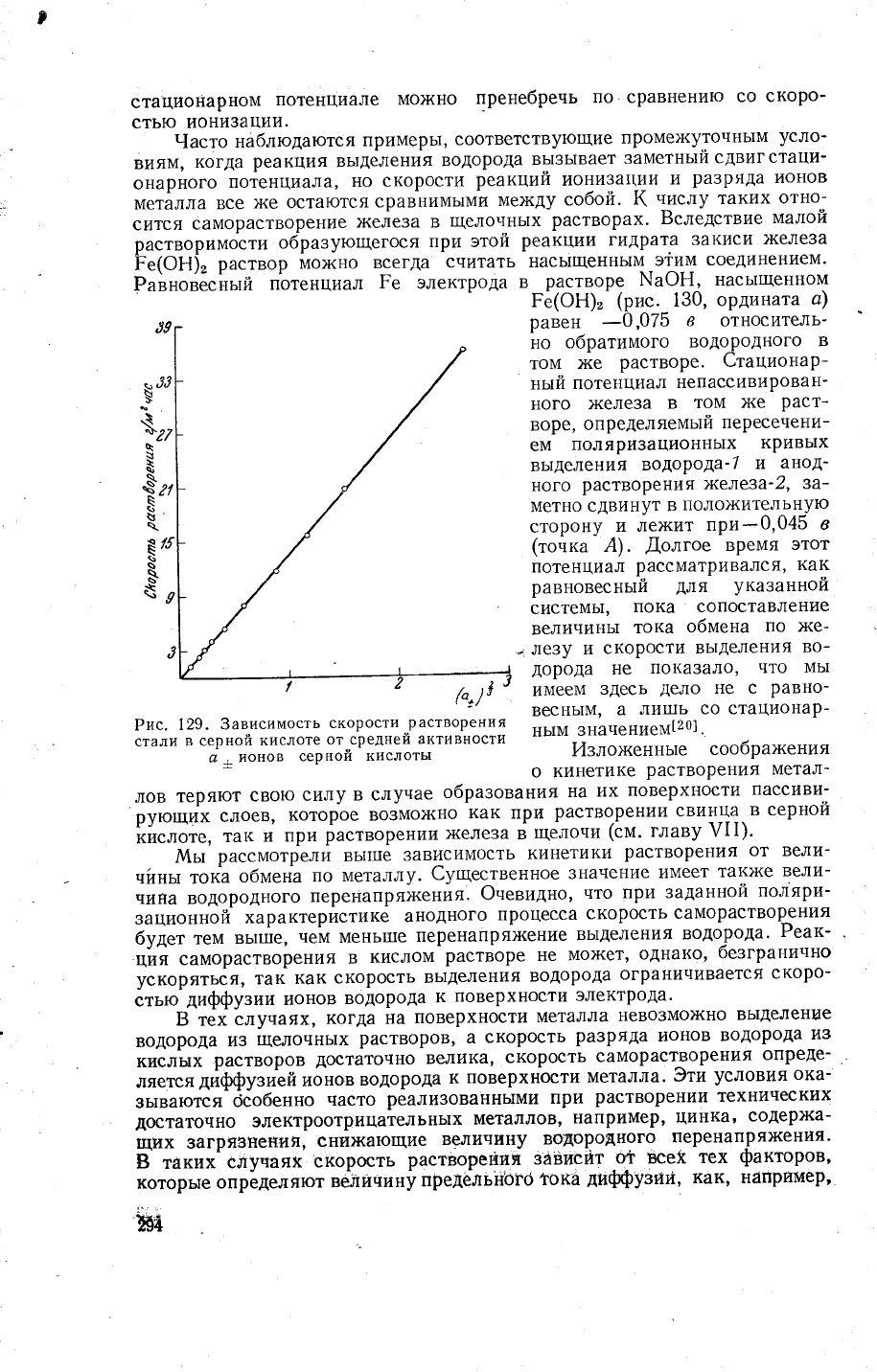
рис.
\29,
на
котором
дана
зависимость
скорости
растворения
стал||
(0'1в
%
€)
от
средней
активности
ионов
серной
цц6д9161[19!.
Рассмотреннь1е
примерь|
растворения
свинца
и
)келеза
в
кислотах со_
ответствуют
двум
предельнь]м
случаям.
Б
первом
случае
процесс
вь|деления
водорода
почти
не нару1лает
отно1пения
мех<ду
скоростями ионизации
ме;
талла и
ра3ряда
его
ионов'
так
что
стационарнь:й
потенциал близок к
равновесному
потенц|1алу
для
раствора
с той
){(е концентрашией ионов
металла. Бо втором
случае сдвиг стационарного
потенциала
в
полох<итель:
ную
сторону
по
сравнению с
равновеснь1м'
вь1зь1ваемьтй
разрядом
ионов
водорода'
настолько
велик'
что
скоростью
ра3ряда
ионов
металла
при
'
*
в
ранее
рассмотренном
случае
(глава
1|1)' хогда мы
сравнивали
скорости
ра9;
ряда
п
ионизации
водорода' сумма
этих'конста[{т по
термодинамичееким
причинам
Рав1{ялась
единице.3десьже
имеются
дваразных
процесса' ме)кду ведичинами
с1ир3
нет никакой
связи
и
сумма
их мо)кет отличаться от едйницы.
а9}
стационарном
потенциале
мо}кно
пренебречь
по сравнению
со скоро_
стью
иони3ации.
9
асто
наблтодаютс
я п
римерьт'
соответств}ющие
п
роме)куточнь{м
усло_
виям'
когда
реакция
вь1деления
водорода
вь|зь|вает
заметньтй
сдвигстаци-
онарного
потенциала'
но скорости
реакций
ионизат1иц
1|
ра3ряда
ионов
металла
все
)ке остаются
сравнимь]ми
ме)кду
собой.
(
числу таких
отно._
сится
саморастворение
)келеза в
щелочнь|х
растворах.
Бследствие
малой
растворимости
образу1ощегося
при этой
реакт1ии
гидрата
закиси
)келе3а
Ёе(ФЁ),
раствор
мо){{но
всегда
считать
нась|щеннь!м
этим
соединением.
РайноЁеснь;й
пБтенциал
Ре
электрода
в-р?^с1Рор9
\'9Р'
нась1щенном
га(он),
(рис.
130,
орди|1ата
а}
ге((-)п)2 (рис.
!о0'
орд|4\1а1'а
ц)
39с
равен
_0,075
6 относитель_
&,/1
Рис.
129.
3ависимость
скорости
растворения
стали
в серной
кислоте
от средней
активности
4
+
ионов
серной
кислоть|
лов
теряют
сво1о
силу
в случае
образования
на
|1х
поверхности
пасеиви-
рующих
слоев'
которое
во3мох{но
как
при
раств9р-е_н11_свицце.
в
серной
кислоте'
так
и при
растворении
)келеза
Б
щелочи
(см.
главу !!|)'
}1ьт
рассмотрели
вь]1пе
зависимость
кинетики
растворения
от вели-
чйньт тока
обмена
по
металлу.
6ушественное
значение
имеет
так)ке
вели-
чина
водородного
перенапря;енйя.
Фчевидно'
что
при заданной
поляри-
зационной
характеристике
анодного
процесса
скорость
саморастворения
булет тем
вь11пе,
чем мень1ше
перенапрях{ение
вь1деления
водорода.
уеак_
ция
саморастворения
в
кислом
растворе
не
мох(ет'
однако'
безгранинно
ускоряться'
так
как
скорость
вь1деления
водорода
ограничивается
скоро-
стью
диффу3ии
ионов
водорода
к
поверхности
электрода'
Б
тех
случаях'
когда
на
поверхности
металла
нево3мох{но
вь|деление
водорода
и3
щелочнь|х
растворов'
а
скорость
ра3ряда
ионов
водорода
и3
кислых
растворов
достаточно
велика,
скорость
саморастворения
опреде-
ляется
дйфузией
ионов
водорода
к
поверхности
металл а'
эти
условия
ока-
3ьтваются
осо6енно
часто
реали3ованными
пр||
растворении
технических
достаточно
электроотрицательнь|х
металлов'
например'
цинка'
содер)ка-
щихзагрязне|тия'сних(ающиевеличп1{увэдород!{огоперенапря)кения.
Б-
'а*'х'случаях
скорость
раствоРеЁия
заЁисйт
ф
все*
тех
факторов'
которь|е опредедяют
велинину
предельного
1ока
дифузии,
как' например'
но
обратимого
водородного
в
том
х{е
растворе.
€та:.:,ионар-
нь|й
потенциал
непассивирован-
ного
)келеза
в
том
)ке
раст-
воре,
определяемь1й
пересе1|ени-
ем
поляризационнь1х
кривь1х
вь1деления
водорода-/
и
анод-
ного
растворения
>келеза-2,
за-
метно
сдвинут
в
поло)кительную
сторону
и ле)кит
при_0,045
в
(тонка
,4).
Аолгое
время
этот
потенциал
рассматривался,
как
равновеснь1й
для
указанной
системь1'
пока сопоставление
величиньт
тока
обмена
по х{е-
ч
ле3}
и
скорости
вь1деления
во_
дорода
не
показало'
что
мь1
имеем
здесь
дело
не с
равно_
веснь1м'
а
ли1пь
со стационар-
нь!м
3наченц3ц[201
.
йзло>кенньте
сообра)кения
о кинетике
растворения
метал-
х{

скорости
разме1пивания
и вя3кости
растворителя
(см.
главу
|)*.
3тот вь1вод
находит
свое
полное
подтвер}кдение
на опь1те.
6ушествование
прибли-
3ительно
обратной
пропорциональности
мех<ду
скоростью
растворения
Рис.
130.
,[1,ействие
кислорода
на
скорость
саморастворения
железа
в шелочном
растворе:
,/-катодная
кривая
вь|деления
водорода'
2_ано',ная
кривая
растворения
активного
>келез_
ного электроАа,
3-катодная
кривая
восстановления
кисло'
рода,
4-анодная
-кр|1вая
_пассивного
}келе3ного
электрода'
'
Абсциссь|
точек
А,
Б
и 6
вь:ра>кают
соответственно
ско_
рости
ко.ррозии
активного
}келе3ного электрода
с
выделением
водорода'
активного
электр-ода
с
восстановле11ием
кислорода
и
пассивного
электрода'
Фрли"'''
точки
а-равновеснь:й
потенциал
х{елеза
в том
)ке
растворе.
|1отенциаль:
отнесены
к
обратимому
водородному
в том
)ке
растворе
металлов
и
вязкостью
раствора,
которое
нух{но
о>кидать
в
этом
случае'
бьтло
обнару>кено
у>ке
1(аяндером
в
18в1 г.|1].
$
5.
РАствоРвнив
мБтАлловв
пРисутствии
кислоРодА
и
дРугих
окислитвлви
Б предьтдущих
параграфах
мь1
рассматр|1вали
процесс
саморастворе-
ния
металлов
в
растворах
электролитов'
сопровох<датощийся
ра3рядом
ионов
водорода
и
вь|делёнием
газоьбразного
водорода'
1(ак
у>ке
упомина-
лось,
реакция
самораствоРения
металлов
мох<ет
протекать
и
по
другим
*
€корость
растворения
металла
в
кислоте
в
определенных
условиях
мо)кет
3а_
висеть
от интенсивностй
размешл||вания
и
при плотностях
тока'
значительно
мень1пих
йр"д"',"'.'
тока
диффуз!-:и
п0
ионам
вод6рода.
|1редставим
себе,
например'
свин-
цБвый
электрод,
омыЁйёмый
струей
раствора
хлористого
водорода'
не
содер)кащего
11онов
свинц}.
1(онцентрация
иойов
свинца
у
поверхности
9лектрода
в
этом
случае
цри
;;;;;';;;ръ;"и'р|?'воре"иязависит'
очевидно'
о{ скорости
струи'
уводящей
образую_
-й"е""
ион*'от
э/ектро,{а.
1ак как,
с
другой
стороны, концентрация
ионов
свинца
опре_
деляет
поте11циал
электрода'
а
следовательно'
и
скорость
выделения
водоРода'
равную
скоростирастворенияметалла,топоследняявсвоюочередьдол)кназависетьоти|!.
тенёивности
р?змешивания.
Расчет
показывает'
однако'
что
в этом
случае
у1'19_ч}3Р
зависимость
йесравненно
слабее
выРажена'
чем
в случае,
рассмотренном
в тексте[1?].
295

путям: если в
растворе
имеются вещества,
способЁь1е к
электролитическому
восстановлению
на
поверхности металла
(например,
раствореннь:й
кисло-
род
во3духа' а3отная кислота, иод ил|4
другие
окислители),
то
реакция
ио|1\4за\ии
металла мо}кет компенсироваться
реакцией
восстановления
этих
веществ' а не
Реакцией разряда
ионов
водорода'
Больгшое
практическое значение
имеют
пРо|дессьт
растворения
метал_
лов'
сопровох<да1ощиеся
восстановлением
растворенного
кислорода
(так
на3ь]ваемое
растворение
металлов
с
<кислородной
деполяризацией>)*.
||о-
следние
бьтли
подробно
изуненьт
Ё.
[.
1оматпо361ц[211. Босстановление
кислорода
происходит на больтпинстве металлов при потенциалах
значи-
тельно
более поло}кительнь!х' чем
реакция
вь1деления водорода.
Бследствие
этого при нась|1пении
растворов
кислородом воздуха
растворение
металлов
ускоряется'
если
поверхность
сохраняется в активном
состоянии.
Ба
рис.
130
приведень{
кривь]е зависимости скорости
ионизац|1и
>келе-
за
(кривая
7), а такх<е вь|деления
водорода
(кривая
2)
и восстановления
кислорода
(кривая
3)
от
потенциала
активного >келе3ного электрода
(для
щелочнь]х
растворов).
1очка
А соответствует стационарному состояни}о'
устанавливающемуся
в отсутствие кислорода
воздуха
(например,
в
ра-
створах'
нась1щеннь1х водородом
ил|4 азотом), в то
время как точка
Б
:азобра>кает стационарное
состояние электрода
в
растворе'
соприкаса}о-
щемся
с воздухом.
в
присутствии во3духа'
как
видно
и3.
рисунка'
скорость
саморастворения
увеличивается.
Бследствие незначительной
растворимости
кислорода
в
растворах
электролитов
(в
не
очень
концентрированнь1х
растворах'
нась|щеннь!х
во3духом'
концентрация
растворенного
кислорода составляет примерно
2,5.
|0-4 моля
на лшпор)скорость
реакции
катодного
восстановления
кисло-
рода
ограничивается
дифузией
кислорода к поверхности электрода и не
мо-
)кет
превь11шать
3начения' соответствующего
предельном}
Аифузионному
току кислорода'
какэто
видно
из
поляри3ационной кривой
восстановления
кислорода
(кривая
3,
рис.
130).
}насток
последней
с
крутьтм подъемом
соответствует предельному току
диффузии
по кислороду.
|[ри коррозии металлов в присутствии кислорода
нео6ходимо
разли-
чать три случая.
Ёсли поло>кение кривой, вь1ра}{ающей зависимость
потенциала
металла
от
скорости
анодного
процесса' соответствует случаю
7'
на
рис.
131,
то
точка
пересечения
ее с
кривой,
вь]ра)кающей
скорость
катодного
процесса,
лех<ит в
области
предельного
тока
по кислороду
(тонка
3).
|!ри потенциале саморастворения
мы в этом случае' как говорят' на-
ходимся
в
диффузионной
области
по
кислороду.
Абсцисса
точки
пересе-
чения'
определяющая
величину тока саморастворения' в
этом случае
практически не изменяется при
изменении
полох(ения кривой |'; инане
говоря' скорость
корро3ии' определяемая
дифузией
кислорода к
его
поверхности' не зависит
от
природь]
металла' а зависит
от
условий
разме-
тпивания'
вязкости
раствора
[ 1.
А.,
как
это
ух<е
бь:ло
разъяснено
при
рас-
смотрении
растворения
металлов в
кислотах.
йначе
обстоит
дело
в случае
/,
соответств!ющем меньтпей
скорости анодного.процесса
при
том >ке
потен-
шиале.
|!ри
потенциале саморастворения
мы находимся в кинетической
*
||роисхо>кдение
этого
термина' широко
применяемого
в
коррозионной дите-
ратуре'
связано
с
распространенным
рань1ше
неправильным
представлением
о
роли
кислорода
при
растворении
металла'
согласно которому
кислород
-окисляет
Быдедя:ощийся водород и сни)кает поляризацию
электрода'
возникающую
благодаря
появлению
водорода
на поверхности
металла.
Б
действительности
электровосстановлецие
кислорода
является
самостоятельной
реакцией,
протекающей
независимо' от выде_
ления
водорода.
296
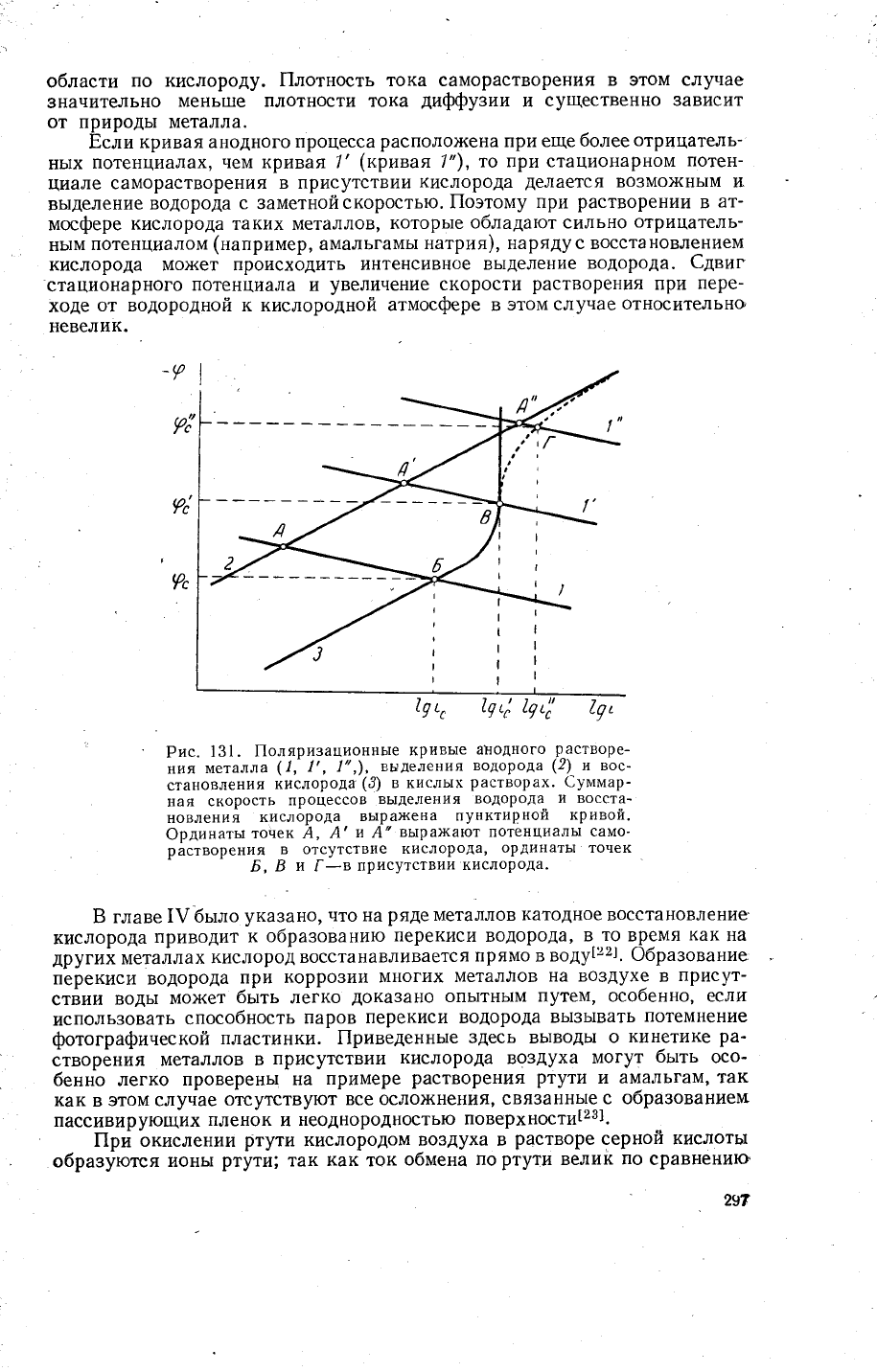
о6ласти
по кислороАу.
||лотность тока саморастворения
в этом случае
значительно
мень1пе плотности тока
дифузи|4
|4
существенно
3ависит
от природь| металла.
Ёсли
кривая анодного
процесса
располо'{ена
при еще
более
отрицатель_
нь1х
потенц!4алах,
чем кривая 7'
(крпвая'|''),
то
при стационарном
потен-
циале
саморастворения
в присутствии
кислорода
делается
во3мох{нь!м и.
вь|деление
водорода
с заметнойскоростью.
|{оэтому
при
растворении
в
ат-
мосфере
кислорода так\4х металлов'
которь]е
обладают сильно
отрицатель-
нь]м
потенцу!алом
(например,
амал
ьгамь|
натрия), на
р
яду
с восста
новлением
кислорода мо)кет происходить
интенсивное
вь|деление
водорода.
€двиг
стационарного
потенц|4ала
и
увеличение
скорости
растворения
при
пере-
ходе
от водородной к кислородной
атмосфере в
этом случае
относительно
невелик.
|9
',
[9с|
/9с}'
|9,
'
Рис.
131.
|[оляризационнь|е
кривь|е
анодного
растворе-
ния
металла
(1'-
|',1",),
выделения
водорода
(2)
и вос'
становления
кислорода
(3)
в кислых
растворах.
€уммар_
ная
скорость
процессов
вь1деления
водорода.
и восста-
новления
кислорода
вь|ра)кена
пунктирной
кривой.
ФрАинаты
тонек ,4,
А'
и А"
выра)кают потенциалы
само-
растворения
в отсутствие
кислорода'
ординать| точек
Б,
Б
тл
[_в
присутствии
кислорода.
3 главе
1!6ьтло
указано'
что на
ряде
металлов
катодное
восстановление'
кислорода
приводит
к обра3ованию
перекиси
водорода'
в..19 в-Р9мя
как
на
других
металлах
кислород
восстанавливается
прямо
в
воду|э21.
Фбразование
перекиси водорода
при
корро3ии
многих
металлов
на воздухе
в
присут-
ствии
водь1
мох{ет
бйть
легко
доказано
опь]тнь1м
путем' особенно, если
использовать
способность
паров
перекиси водорода
вь]зывать
потемнение
фотографинеской
пластинки. ||риведеннь1е
здесь вь]водь|
о
кинетике
ра'
створения
металлов
в
присутствии
кислорода
воздуха
могут
бь:ть
осо'
бенно легко
проверень|
на
примере
растворения
ртути
и амальгам'
так
как
в
этом случае
отсутствуют
все осло)кнения,
свя3аннь|е
с обра3ованиеш
пассивирующих
пленок
и
неоднородностью
поверхности!23!.
|{рй окислении
ртути
кислородом
воздуха в
растворе
серной
кислоть1
образуются
ионы
ртути;
так
как
ток
обмена
по
ртути
велик
по
сравнени}Ф
-9
Р!
29т

со скоростью восстановления кислорода
на
ртутном
катоде'
то
ртутнь1й
электрод принимает
равновеснь]й
потенциал'
соответствующий концен-
'трации
ионов
ртути'
устанавливающейся
в
растворе
при
даннь1х
условиях
разме1шивания|
а
скорость
растворения ртути
определяется скорость[о
электровосстановления кислорода при это1\[
потенциале. 1ак как
при
по-
-тенциалах
ртути
в
растворах'
содерх{ащих
ионь1
ртути'
восстановление
кис-
лорода
мох<ет
идти
только
до
перекиси
водорода' то в
растворе
накопляет_
ся
перекись
водорода в
количестве'
эквивалентном
количеству
ионов
ртути'
пере1шед1лих
в
раствор.
Рсли потенциал
ртутного
электрода сильно сдви-
нуть в отрицательную сторону' вводя в
раствор
вместо н25о4 электролит,
'анионь1
которого
свя3ь1вают ионьт
ртути
благодаря комплексоообразова-
нию'
например,
!(€\, то
скорость
восстановления кислорода
при
стацио_
нарном
потенциале
возрастает*' и
мь|
приблих<аемся
к
условиям'
соответст-
в}ющим
кривой
'|'на
рис.
131; скорость
растворения
определяется
в этом
случае в основном
лиффузией
кислорода
к поверхности
электрода.
Аналогичньте
соотно1ления наблюдаются
и
лри
растворении
амальгам
так|1х
металлов, как
кадмий
или
таллий
в
присутствии кислорода. |[ри этом
переходят
в
раствор
ионь!
электроотрицательного металла
со
скоростью,
равной
скорости
восстановления
кислород3.
Рсли концентрация
амальгамы
мала'
то скорость
восстановления
кислорода' как
и в
случае
чистой
ртути'
определяется
потенциалом
электрода
(ки
нетическая область
по
кислороду)
;
при
боль:пих концентрациях металла амальгамь!
достигается'
однако
пре-
дельньтй
ток
по кислороду, величина которого
ух{е
не зависит ни
от
потен-
циала,
ни от природьт металла
(диффузионная
область).
||рисутствие
других
окислителей. в
растворе,
кроме кислорода во3-
духа,
как
правило'
так){{е
приводит к
возрастанию скорости
саморастворе-
ния металлов. Фднако
в
отдельнь]х
случаях
наблюдаются
исключенйя,
свя-
заннь]е с изменением состояния
поверхности. 1ак,
например,
прибавление
к
раствору
ионов €г'Ф'_
(или
€гФ;-),
обладающих сильнь]м окисляющим
действием
и, следовательно' легко
вэсстанавливающихся,
в
ряде
случаев
увеличивает
саморастворение
металлов.
Б
других
условиях
те
)ке самь|е
ионь1 оказь]вают тормозящее
действие
на процесс саморастворения'
так
как под
их
воздейстцием
на поверхности
металла
образуется тон-
кий
пассивирующий
слой,
который
и3меняет
кинетику электроднь!х
реакший
и частично
защищает электрод. |1о этой
причине
в
растворь1
электролитов
часто прибавляют
хромать1
с
целью
сни)кения
корро3ии
пдеталлов[2{].
Бсли
условия
для
образования
пассивирутощей
пленки благоприятньт,
то
и в
присутствии кислорода мо)кет
наступить
не
повь11пение'
а
пони)кение
скорости саморастворения
металла.
€оотнош:ения эти хоро11]о
.иллюс-тр^и-
руются
поведением
)келе3ного электрода
в
растворе
шелони
(рис.
130)'
1(ак
у>ке
ука3ь]валось,
гладкий х<елезньтй электрод,
поверхность которого
свободна от окисной пленки'
приобретает в
растворе,
свободном
от
кисло-
рода'
потенциал'
которь:й на
0,045
в
отрицательнее
обратимого
водород-
ного
в том >ке
растворе
(тонка
/) и
знаяение
которого определяется
равен-
ством скоростей процессов
анодного
растворения
)келе3а
с
образованием
Ре(ФЁ),
(кривая
2)
и
вьтделения водорода
(кривая
/).
*
1(ак
бьтло показано
в главе 1!' восстановление кислорода
на
ртутном
электроде
при
постоянном потенциале замедляется
при введен_и_и в^раствор поверхностно-актив-
'ных
анионбв'
к чисду
которь|х
принадле)кит и ион
(|:[-.
Фднако
сдвиг анодной
кривой
-растворения
ртути'
а
вследствие этого и стационарного потенциала
самоРастворения
.в
сто_рону отрицательных
потенциалов'
настолько
значителен'
что скоРость
восстано-
вления
кислорода
при стацйонарной.потенциале' а
следоватёльно'
и скорость само-
раствореЁия
р1утй,
не
умёньй}!6тсй,
а ёйльно ьозрастают.
'9в

Рсли
раствор
щелочи
1{ась!щать
кислородом'
то
катодньтй
процесс
вь1деленияводорода3аменяетсянапроцессвосстановлениякислорода'
характеризуемь1и
,''"р',,ш"онной
кривой
3;
этот
процесс'
если
срав-
нивать
их
пРи
одинаковь:х
потенциалах'
протекает
бьтстрее'
чем вь]де-
;;;;;"ЁБ}"|Б!^.
3'о
приводит
к
увеличению
,р"'91:_-.,оло)кительнь1х
зарядов
к
электроду,
что
вь]зь1вает
сдвиг
стационарного
потенциала
электрода
в
пол''кийельную
сторону
(тояка
.Р)'
"'следовательно'
уве_
.личениескоростианодногопроцесса'по.касвойстваповерхностиоста1отся
'неи3меннь1ми.
Фднако
чере3
некоторое
время
при
этом
6-":::.'::::)кительном
потен-
.циале
на
поверхности
х{елеза
возникает
пассивирующий
слой'
которьтй'
как
это
видно
т43
поло)кеь]ия
поляризационЁо1-
1!::"й
4'
сильно
замедляет
скорость
анодного
,р'ш""'
при
данг{ом
по_тенциале'
Равная
ей
при
стационарнь1х
условиях
ёкорость
йатодного
процесса
восстановле-
ния
кислорода
поэтомутакх{едол)кна
сильно
упасть'
что возмо)кно
только
й;
;;;;;"й"*
"щ"
более
сильном
сдвиге
стационарного
.потенциала
в
поло}<ительную
сторону;
последний
доходит
до
значений'
локащих
. на
0,7-0,8
в
поло>к1_{Ё'!'1""
обр-атимого
водородного
в
том
)ке
растворе
й;;;
в|.
сй"".
''Б],_йы.ы.,"йа
11ч."ечием
природь1
анодного
процесса
исоответствующимуменьшениемскоростикатодногопроцесса,вотличиеот
первоначаль
ного
"дй'.а,
при
котором
мен
ялась
п
ри
рода
катодного
п
роцесса
и
соответственно
увелинйвалась
скорость
анодного'
сопрово)кдается
не
увеличением,
а
уйен,1шением
".'р'''"
коррозии'
|1чи_-этом
изменяется
так)ке
химическая
природа
продуктов
коррозии
вследствие
появления
в
них
трехвалентного
'{елеза'
Бо
всех
случаях'
когда
на
поверхности
металлич-еского
электрода
одновременно
протекают
несколько'лЁ.'р'химических
реакший'
условие
стационарности'
как
сказано
рань1ше'
Бпределяется
равенством
ме)кду
суммарной
скоростью
всех
аноднь1х
и
всех
катоднь]х
реакший'
Ёсли
вид
кинетическихуравненийотдельньтхреак[ийи3вестен'тозначениестацио-
нарного
потенциала
и
скорость
саморастворения
*9|}1:--б,'",
определень]
.
точно
так
х{е,
как
и
в
слу,ае
р'""мо'ре"ньтх
вьттше
реакций
растворения'
сопрово)кдающихся
вьтде}ением
водорода'
Ёеобходимо
отметить'
что
часто
,а
,,"ктродах'
которь1е
мьт
рассмат_
риваем
.^^
р'"''";;;;;,
в
действительности
так)ке
происходит
одновремен_
ное
протекание
многих
электрохимических реакт1ий.
1а_к,
на
платиновом
электроде'
"'*'*"йЁй.й"_*
'й'"6"р"
водорода'
на
котором'основнь]ми
реакциями
являются
разряд
и
|тон|13ат1ия
водорода'
возмо)кнь1
многочи-
сленнь]е
другие
реакт|ии,
связаннь]е
с
окисленй"*
чт-
восстановлением
примесей,
которь!е
всегда
присутствуют
в
растворе'
как'
например'
реакция
восстановления
следов
кислород',''*р'Ё",шихся
Р !1:','р"'
€корости
этихреакцийзависятотусловийо',,',иотстепениочисткираствораи'
по крайней
мере
теоретически,
их
необходимо
учить1вать
в
общем
балансе
электрич€ских
3арядов.
|1рактине"ки,
од"а''
:!_"!?:т.|4
|4х
о6ьтчно
на_
столько
маль1
по
сравненито
со
-"*'рос'ями
осно-вной-реакт]ии' ''''-_-1ч1
вполне
мо)кно
,р",Ёф,,;
по
этой
при,и"е
такие
электродь|
с
достаточнь|м
основаниеммо}{носчитатьравновеснь1ми.Бнекоторь|хслучаях,однако'
соотно1пения
ме)кду
скоростями
ос"о]!ой
и
побочнь!х
реакший-ме91у:*
Ёапример,
,р"
й'й,"й
небольтших
следов
мь11шьяковисть|х
соединении
скорости
реакции
ио11изаци||
|1
разряда
водорода
.т1а
платине
ре3ко
сни_
х(аются;
в
этом
;;;;;-;ъ;!'"'"'
й'?;'нн,,х
реакший
делаются
сравнимыми
со
скоростью
основной,
равновесие
на
пове[:хности
электрода
н-ач|ч:т':
и
потенциал
егю
смещается
в
поло}кительную
сторону
(отравление
плати-
яового
электрода)
*$
$
6.
сАмоРАствоРвнив
и Аноднов
РАствоРвнив
мвтАллов
Ао
сих пор
мь!
рассматривали
поведение
в
растворах
электролитов
изолированнь|х
металлических
электродов'
не вкл}оченнь]х
во
вйетшню:о
электрическ}то
цепь.
||рохо>кдение
элъктрического
тока через
электрод
и связанная
с ни1ш
поляризация
электродов
влияет
на скорость
всех
электрохимических
реак-
:1ий,
протекающих
на
поверхности
металла'
в том числе
и
наскорость
рас-
творения
металла.
|1ри
поляризации
нару1цается
ука3анное
вь1ше
равен-
ство скоростей
растворения
металла
и вь]деления
водорода
(уравнениёэтз1-
суь
плот_
(2э1)
метал-
(292у
|у!
.
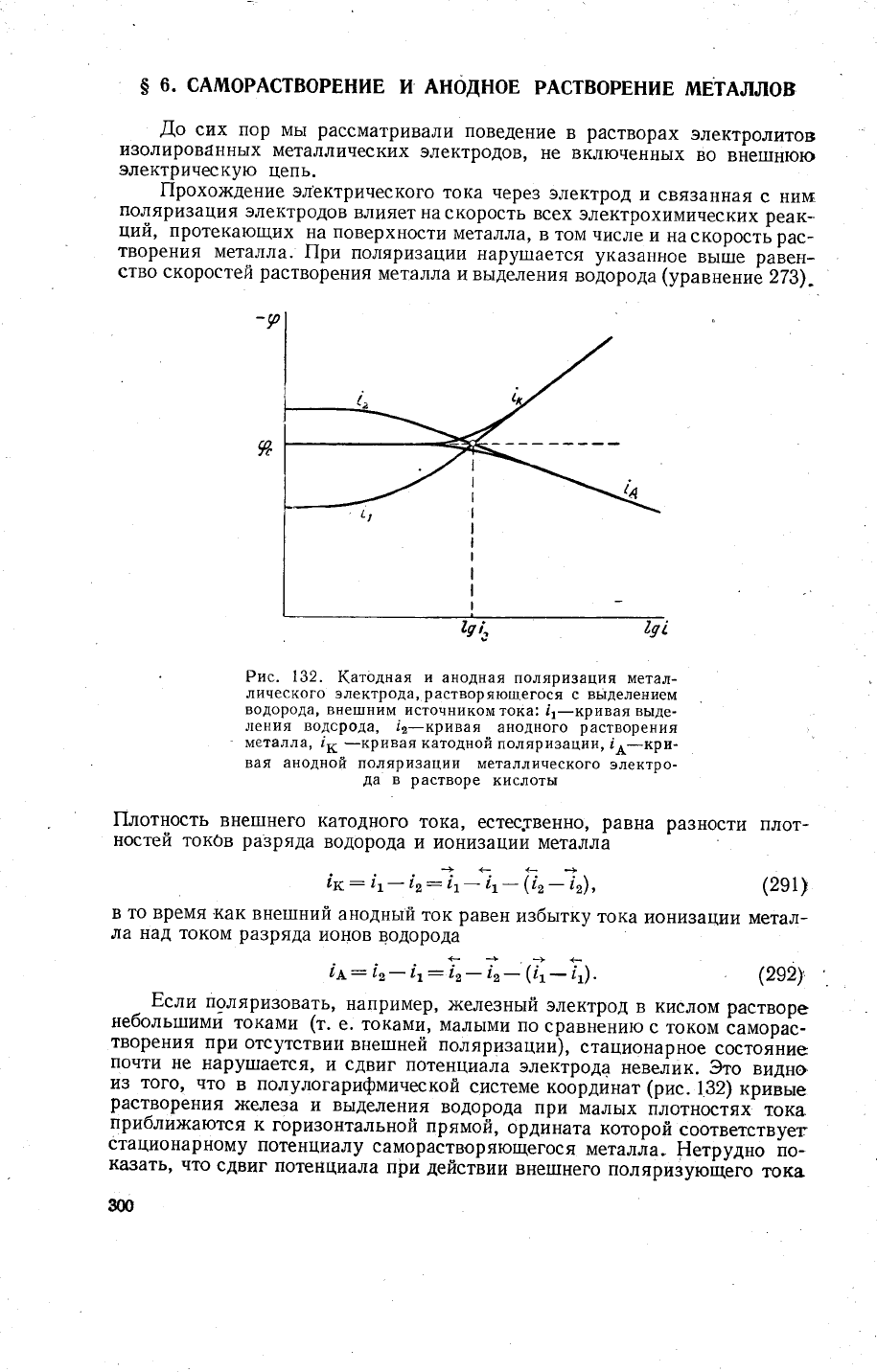
Ё:,"
п9ляризовать'
например,
>келезньтй
электрод
в
кислом
растворе
небольтшими
токами
(т.
е. токами'
маль]ми
по
сравнению
с
током
саморас-
творения
при отсутствии
вне1пней поляризации),
стационарное
состояние
почти
не
нару|пается'
и
сдвиг
потенциала
электрода
невелик. 3то
видно,
из
того'
что
в
полулогарифминеской
системе
координат
(рис.
132) кривые
растворения
}(елеза
и выделения
водорода
при
маль1х
йлотностях
тока
1ц1блих<аютс
я
к гор
изонталь
ной п
р
яйо1|,'
ордй
ната
которой
.'''""..'"у""
стационарному
потенциалу
саморастворяющегося
металла-
Ёетрудно по-
казать'
что
сдвиг
потенциала
при
действии
вне1шнего
поляризую[йго
тока
300
