Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов
Подождите немного. Документ загружается.


вать' как
двих{ение
(дь|рок>
от
вне1пней
поверхности
к
внутренней.
Более
глубокий
анали3
условий
дви)кения
3арях{еннь1х
частиц
в обоих
случаях
приводит к
вь|воду' что скорость окисления
меди
дол)кна
бьтть
больгше
скорости окисления
цинка
и
сильнее
3ависеть
от
давления
кислорода'
чем последняя.
|[рименение
теории
лиффузии
и электропроводности
в
ионнь]х
провод-
никах
и
полупроводниках,
созданной
в
первую очередь
советскими
уче_
нь1ми'
в частности,
я.
и. Френкелем'
по3воляет
и в
других
случаях
разоб_
раться
в явлениях' происходящих
при
росте
окиснь]х
и
других
слоев
}{а
металлах.
Фпь:т пока3ь]вает'
однако' что
наряду
с
дви)кением
катионов
и электронов
ну)кно,
вообще
говоря'
учить!вать
и
двих(ение
анионов'
а'
согласно
некоторь]м
авторам,
и
атомов
кислорода.
(оличественное
ра3-
витие этих представлений
приводит к
соотно!пенито'
и3
которого-
при
неко-
торь{х
упрощающих
допущениях
мо)к_
но
вь]вести
уравнение
(270).
в
некоторь1х
системах
наряду с
медленностью
диффузии
необходимо
учитывать
и
медленность
самой
реакции
на границе
ме)кду
пленкой
и
газом
(или
ме}кду пленкой
и
металлом)'
в
этих
случаях при
\{аль1х
толщинах
скорость
роста
определяется
скоростью
реак_
ц14и,
а
при
больгпих-скоростью
диф_
ф}зии|э:;.
.[!ля
электрохимии
особьлй
интерес
представляют
отклонения
от вь|ра)кен-
ного
уравнением
(270)
лара6олического
3акона
роста
в случае
очень
тонких
пленок,
состоящих
только
и3 одной
или
нескольких
кристаллических
яче-
ек окисла.
1акие
отклонения
наблю_
даются
при
окислении
,{еле3а'
алю-
у.109см]/мцн
0,1
0'3
0,5
А см3т/е
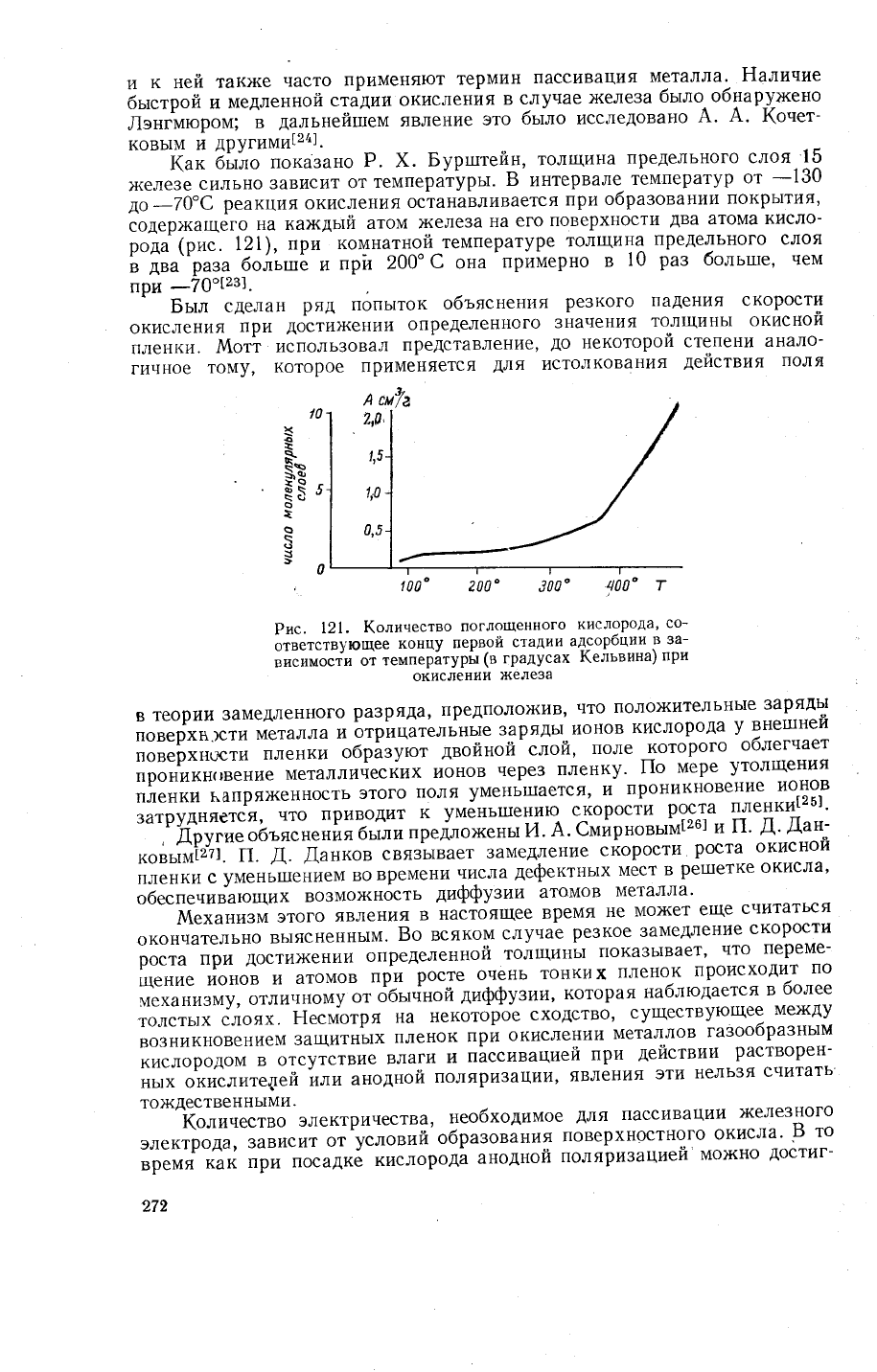
Рис.
|20.
3ависимость
скорости
(,
окисления
)келезного
порошка от
количества
.4 поглощенного
кисло-
рода.
€корость окисления
вь|ра)кена
ъ см3
поглощенного
кислорода в
минуту
мину!я'
нер)кавеющих
сталей
и
других
металлов
при
не сли1шком
вь!_
соких
температурах.
Ёа
рис.
120
дана
зависимость
скорости окисления
>келе3а
от
поглощенного
цоличества
кислорода|23].
Б
этих опь1тах кислород
привод^ился
в
соприкосновение
с )келезом
последовательнь]ми
порциями
при
20"€,
и наблюдалась
скорость поглощения.
вначале
последняя
бьтла
очень
велика'
но
после
поглощения
определенного
количества
кислорода,
т.
е'
образования
пленки
определенной
толщинь|'
скорость
ре3ко
|1адала
до
очень малого
значения.
||ри
низких
температурах
это значение настоль-
ко
мало,
что
'рост
пленки после
дости)кения
указанного
предельного
3начения
практически
полностью
останавливается.
[!ри более
вь!соких
температурах
мо)кно
наблюдать
дальнейш-тий
рост
пленки
и во второй,
медленной
с'[адии пРоцесса
окисления' который
постепен}1о
замедляется
п-ри
увеличении
толщинь] окисного
слоя' как
это бь;ло
разобрано
вь1ше.
Ёаконец,
при
е1{е более
сильном
повь!1пении
температурь1
скорост{,
роста
во второй
(медленной)
стадии
настолько во3растает' что
граница
ме}{ду
первой
и второй
стадиями
исчезает.
1аким
образом,
в
сравнительно
1широком
интервале температур
существует
предельное
3начение
толщинь1 пленки,
при котором
реакция
взаимодействия
с кислородом
ре3ко
замедляется
или
практически
оста-
1]авливается.
Фстановка
реакции
окисления при определенной
толщине
окисной пленки
вне1пне
аналогична переходу
в пассивное
состояние,
271
и
к
ней
так)ке
часто
применяют
термин
пассивация
металла.
Ёаличие
бьтстрой
и
медленной
стЁдтци
окисленйя
в
с-лучае
х{елеза
бьтло
обнар-у>кено
,/1энгмюром;
в
дальнейтпем
явление
это
бьтло исследовано
А.
А.
(очет-
ковь1м
и
Аругими!эа1.
--_('[
о!'''
,'..зано
Р. !,.
Буртптейя,
толшина
предельного
слоя
15
}келезе
сильно
зависит
от
температурьт.
Б
интервале
темлератур
от
-130
до
-70"(
реакция
окисления
останавливается
при
образовании
покрь1тия'
содерх{аще|'о
на
ка)кдь1й
атом
>келе3а
на
его
поверхности
два
атома кисло-
рода
(рис. 121),
при
комнат^ной
температуре
толш{и11
предельного
слоя
!-!Б''
р..'
бо.1'ьгпБ
и
прй
200'с
она
прийерно
в
10
раз
боль:пе,
чем
при
_70'!231.
'
Бьтл
сделан
ряд
попь1ток
объясненття
ре3кого
падения скорости
окисления
при
дости}кении
определенного
3начения
толщинь1
окиснои
пленки.
.г}1от|
исполь3овал
представление'
до
некоторой
степени
анало_
гичное
тому'
которое
применяется
для
истолкования действия
поля
!
00" 200'
300'
!00"
т
Руас.
|2!.
|(оличество
поглощенного
кислорода'
со-
ответств\:ющее
концу
первой
стадии
адсорбшии
в за-
висимос|и
от
темпфату!ы
Р;,"'#::'-
|(ельвина;
при
в
теор
ии
3амедленного
р
а3
р
яда'
п
редполо>{<и
в'
что
поло'(ител
ь
,'*-
-11Р':д?:
поверхь.)сти
металла
и
отрйшательнь1е
зарядь|.ионов
кислорода
у
вне1пнеи
поверхн(юти
пленк;
;;;.у.;
двоаноа'слой'
поле
]:оторого
облетч_а_ет
проникн(}вение
металлических
ионов
чере3
пленку'
по
мере
утолщения
пленки
ьапря)кенность
этого
поля
умен;1пается'
и
проникновение
ионов
затрудняется'
что
приводит
к
умень1шению
скорости
роста
дд9ц6ц[25!'
._
-[|'оугие
объяснения
бьлли
преАл'*"й
й.
А.
€мйрнов51ц|:о;
и |[.
А.!ая--
ко;;ь!].'п.
д
д',.'в
свя3ь1вает
замедление
скорости
роста
окиснои
пленки
с
умень1цением
во
времени
числа
дефектньтх
мест
в
ре1петке
окисла'
обеспечивающих
возмох{ность
диффузии
атомов
металла'
./[еханизм
этого
явления
в
настоящее
время
не
мох<ет
еще
считаться
окончательно
вь]ясненнь1м.
во всяком
случае
резкое
замедление
скорости
роста
при
дости)кении
определенной
толщинь]
г|оказь{вает,
что
переме-
щение
ионов
и
атомов
при
росте
о_ч9нь
тонких
пленок
происходит
по
механизму'
'''"','й!ъ'';б;{""й
!иффузии,
которая
нблтоАается
в
более
;";;;;,;
;;оях.
Ёесйотря
на
некоторое
сходство'
существующее
ме'(ду
во3никновением
3ащитнь]х
пленок
при
окислении
металлов
газообра3нь1м
кислородом
в отсутствие
влаги
и
пассивацией
при
действии растворен-
нь|х
окислите+еи
или
анодной
поляри3ации'
явления
эти
нель3я
считать
то}кдественнь1ми.
'(''',ес',о
электричества'
необходимое для
пассивации
)келезного
электрода'
.'"".
"'Б',;;ъ;;й'
образова
ния
поверхностного
окисла'
Б то
время
как
при
посадкё
кислор0да
анодной
поляризацией'мох<но
д0стиг-
272
А
см7а

нуть
пассивации
электрода
количествами'
соответотвую1цими
образо_
ванито
доли
монослоя'
при
окислении
х{елеза
газообрйнь1м
кислородом
для
пассивации
требуется
значительно
больгшее
^'',{й'"'
последнего.
(ак
бьтло
показано,
об
элейтрохийй_ческо';
'''й"''"{"'"'',"*"р'д,
мо)к}{о
судить
по
длине
задер)кки
на
кривой
3ависимости
потенциала
от
пропу-
щенного
количеств_а
электричества
(рис.
1
1
1)'
||ри
,''"'й_'р"дварительной
пасс'1вации
)келе3а
на
воздухе
эта
задерх<ка
исче3ает'
т.
е. на
таком
электроде
при
анодной
лоля{изашии
ге(б!!);;
р;;;;;й
щелочи
не
обра-
зуется'
и электрод
практически
сразу
переходит
в
Ббласт,
более
по]то-
)кительнь1х
потенциалов.
Б
слунае
действия
газообразного
кислорода
такой
ре3ультат дости-
гается
только
после
поглощения
,*<елезом
хотя
и небо!ьтцих
количеств
кислорода,
но
все
)ке
значительно
превь{1па{ощих
количества,
необходимые
для
заполнения
монослоя.
1ак'
количество
кислорода,
соответствующее
2
'
1015
молекул
кислорода
на
квадрат""й
";;;;;;6_'истинной
поверх_
ности
электрода'
не
пассивирует
зайетно
электрод
при
комнатной
темпе-
ратуре'
хотя
оно
у)ке
достаточно
для
образования
с.йоя
окисла
1-Ре.-0,
толщинот?
в средне^м-
около
6А.
[|олная
пассивация
достигается
только
после
посадки
4'1015молекул.
Более
того'
при
'нод"ой
;ь';р;;;;;;
в
разбавленнь|х
растворах
флочи
предварительт{ая
посадка
из
газовой
фазь:
маль;х
количеств
кислорода,
недоста'очнь]х
для
полной
пассивации'
вь]зь]вает
да)ке
заметное
увеличение
кол^ичества
Рё1Фн)',
ооразующегося
при
послед}ющей
анодной
поляри3ации(23].
э
_
""'Б'ор''.,ое
активирую-
щее
действие
маль1х
количеств
йислорода,
поса)кеннь]х
из газовой
фазь:,
свя3ано'
возмо)кно'
с
проникновением
их
под
внетпний
слой
'''й'Б
ре1|]етки
)келе3а'
*'19Р-'"
чох<9о
обнарух<ить-по
и.мененито
3нака
работьт
вь]хода
электрона
при
адсорбции
из
газовой
фаз,л
йал,лх
и
больтпих
количеств
кислорода
(см.
введение,
$
9).
Бозмо>.,о,
,'Б1р,
'оразо"ййй
окисной
пленки
за-сч_ет
анодной
пойри3ации
в
растворах
электролитов
поверхностнь1е
атомь1
кислорода
остаются
связаннь:ми
с
молекулами
водьт'
что
препятс-твует
указанному
подползанию'
Бопрос
о причине
различия
в
эффектив_:т'"
пассивйрующего
действия
кислорода
при
обоих
способах
образовани"
,'"ерх'Бстного
слоя
требует
еще
дальней-
1{]его
изучения.
Б
слутае
алюминия
так)ке
имеются
боль:пие
различияме)кду
явления_
ми,
наблтодаемь1ми
при
окислении
газообр._'-"1#}'Ё'ЁЁЁд"'
и
при
анод-
ной
поляри3ации.
_Фкисление
.'й*'"'"
в газообразном
кислороде
при
комнатной
температуре
лрактически
останавливается
при
образо-
вани|4
весьма
тонкого
защитного
слоя
окисла'
}1ех<дутем_при
анодной
поляризации
в
ряде
электролитов'
например,
,
"ер"'#
*'-'''",
,,
,''-
ми11и|4
толщина
окисного
слоя
мо}(ет
бь:ть
значительно
больгпе,
чем
тол-
щина
мономолекулярного
слоя.
(ак
видно
и3
рис.
122'
ейкость
двойного
слоя
алюминия
в
серной
кислоте
падает
с
увеличением
потенциала.
Бсли
принять
диэлектри-ческу!о
постоянную
окиси
алюминия
на
поверх-
ности
алюминия
равной
10,
то
и3
приведеннь]х
даннь1х
можно
вь|числить'
что
при
потенциале
вь]деления
кислорода
эфективна"
!'йщ'",
окисного
слоя
равна
приблизительно
70А.
||ри
болеесильной
и
достаточно
длительной анодной
поляри3ации
а'1ю-
миния
на
нем
мо}{но
наращивать
сравнительно
толсть1е
окиснь|е
пленки'
толщиной
в
микронь1
и в
сотни
микрон,
что
находит
1широкое
применение
на
практике
(так
назь|ваемое
а нодирован""
''''й!й"г_п;;
а нодирова
нии
на
алюминиевь:й
электрод
накладьтвается
ра3ность
потенциалов
в
несколь-
ко
десятков вольт.
^3то-
приводит
к
увеличению
толщины
окисного
слоя'
так
как
в
поверхностном
слое
создаётся
весьма
боль{пой
градиент
потен-
|8
нипетика
алектродн.
процесоов
273
циала.
способствующий двих(ени1о
ионов
в
слое.
3 химически
неактив-
нь|х
электролитах
типа
бикарбонатов
или
боратов
процесс
останавливается
при образовании
относительно
тонких
и
плотных
слоев;
такие
слои
нахо_
дят
применение
как
и3олиру1ощие
прослойки
в
электролитических
кон-
денсаторах
и
в
вь]прямителйх.
Б химически
более
активнь|х
средах'
напри'
мер,
в
растворах
серной
или
щавелевой
кислот'
вследствие
разру1шения
+
3'0
+
2'0
+
!'0
Рис.
|22.
'**..:;"ъъ?#ъу;жх-'*1тъЁ:.;.},"
Ё25Ф.
в
зави_
пленки
под
действием
электролита,
процесс
анодного
окисления
алюми-
ния
продолх(ается
далее.
||ри
этом
получаются
более
толсть1е
пористь|е
слои'
которые
используются
в
качестве
антикоррозионных
защитньтх
й'"Б'"'*.
6бы,'но
после
3аполнения
пор
подходящими
наполнител9ц1[28}'
|1р#оБ|"Ё
-к'"]й"*''о
университета
н'
п'
с{у11{1ч_пФвь|й
в
|877 т'
пЁедлох<ил
использовать
получаемь1е
п
ри
аяод1911по
ляр|4заци'1
окиснь!е
сйои
для
антикоррозионной
3ащить1
алюминия!4у'''
$4.АктивАцияпАссивнь!.хмвтАлловионАмихлоРА
Разру:ление
пассивирующего
слоя
и'
следовательно'
переход
металла
в
активйое
состояние
значительно
облегчатотся,
если_в
растворе
присут-_
ству}от
некоторь1е
анионь1,
например'
ионь!
хлора'
1ак,
хрРм,
'
бь:вп:ий
в
соприкосновении
с
атмосферньлй
воздухом,
помещеннь1й
_в
^раствор
ь'5б;;
остается
пассивнь1м;'
г[осле
добавления
к
раствору_!-:с-1^*в:''
яе-ко"орое
время
начинается
растворение
хрома
с вь]делением
водорода|оц'|'
Ат|тиви}у:ощее
действие
ионов
хлора
проявляется
и
в
щелочных
рас-
,"'р'!
й
""й*"'
б*ть,
следовательно,
объяснено
более
бь:стрьтм
раство-
рен;ем
окисной
пленки
в
соляной
кислотё
по
сравнени1о
с ее
растворением
в
серной.
!1р,
,нод"ой
поляризации
пассивирующихся
металлов
в
растворах'
содерйащих
ионь|
хлора,
получаются
характернь1"
':::р1::1:::'ъ1у
криЁьте,
проливающие
некоторый
свет
на механизм
9того
явления!"'].
$а
р"".
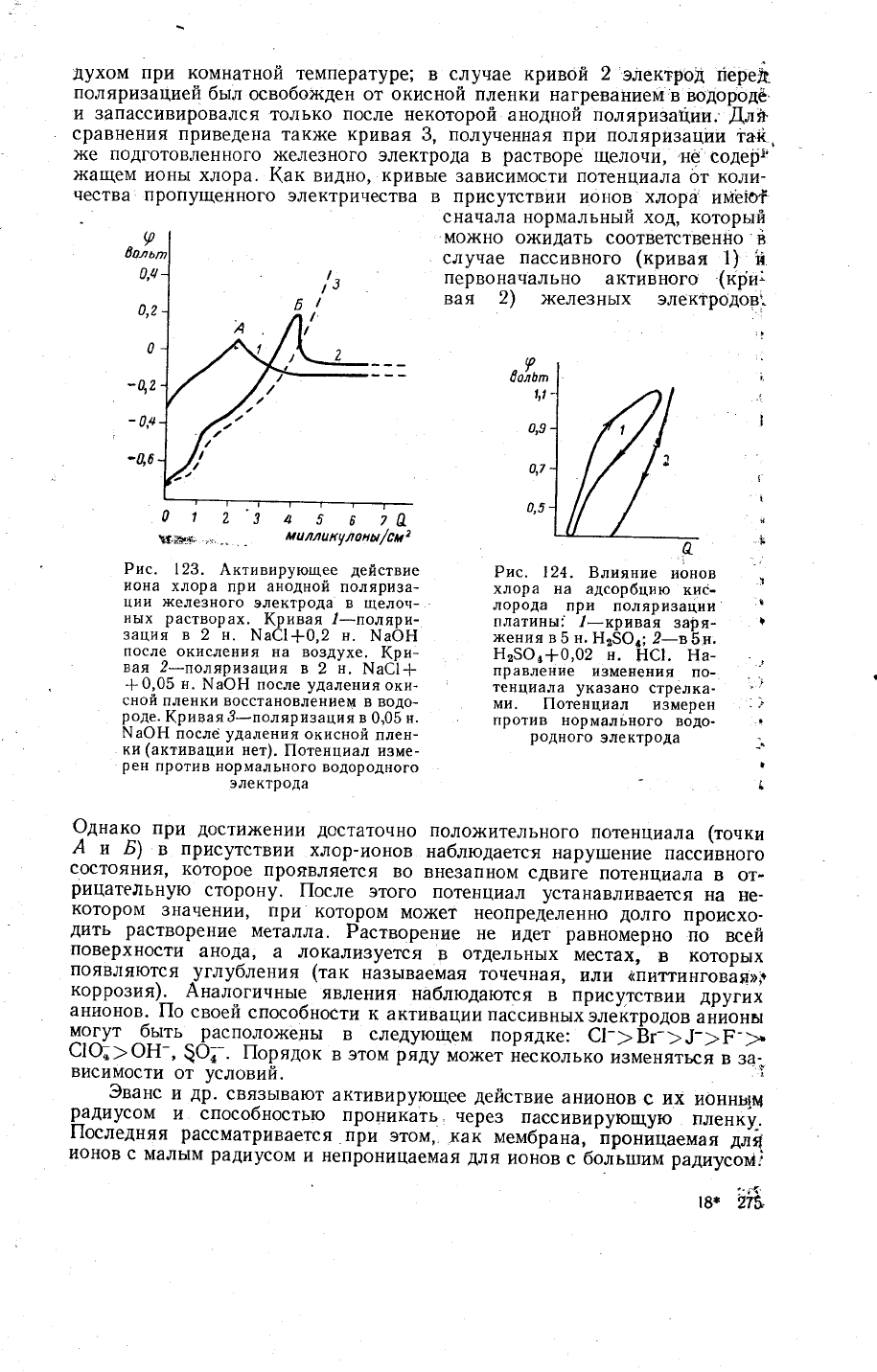
123 привелена
3ависимость
потенциала
)келезного
электрода
от
пройушенного
количества
электричества
в
щелочнь1х
растворах'
содер_
>к_ащих
ионы
хлора.
||оверхность
эле.ктродов
предварительно
подверга_
дась
ра3линной
обработке.
1(ри-вая
1
соответствует.случаю
электрода
е окиЁной
пленкой,
образовавтпФся
при соприкосновении
х<елеза
с
во3:
274
духом
при
комнатной
температуре;
в
случае кривой 2
электрод ЁереА
поляри3ацией
бь:л
освобох<ден от окисной
пленки
нагреванием'в
водорьдё
и запассивировался
только
после
некоторой
анодной поляризации.
Алф
сравнения
приведена
такх<е кривая
3,
полунен|{ая
лри
поляризацйи
та*,
}ке
подготовленного
х<еле3ного
электрода
в
растворе
щелочи'
,не
содер!'
х<ащем
ионь1 хлора. 1(ак
видно' кривь1е
зависимости потенциала
от коли-
чества
пропущенного
электричества
в присутствии
ионов
хлора
имё!сэЁ
сначала нормальнь1й
ход, которь:й
мо)кно
о}кидать
соответственно'в
случае
пассивного (кривая
1)
т!
первоначально
активного
(кЁи:
вая
2)
)келезнь|х
электродов'.
в#ь^
!,1
0'9
0,7
0,5
!
01
!{.*.Ё
*'
4
5
6 ?а
молланчлоны/сп2
Рис.
123.
Активирующее
действие
иона
хлора
при анодной
поляриза-
ции
}келезного
электрода в
щелоч-
ных
растворах.
1(ривая
^/_поляри-
3ация в
2 н.
\а€1*0,2 н.
\аФЁ
после
окисления
на воздухе'
кри-
вая 2-поляр,1зац|1я
в
2
н,
}'|а(]+
*0'05
н.
\аФЁ после
удалеция
оки-
сной пленки восстановлением
в водо-
РоАе.(ривая
3_лоляризация
в
0,05 н.
},]аФЁ
после
удаления
окисной
плен-
ки
(активации
нет).
||отенциал изме-
рен
против
нормального
водородног0
электрода
Фднако
при
достих{ении
достаточно
поло)кительного
потенциала
(тонки
А
п Б)
в
присутствии
хлор-ионов
наблюдается
нару!1]ение
пассивного
состояния'
которое
проявляется
во
внезапном
сдвиге
потенциала
в от-
рицательную
сторону.
|-1осле
этого
потенциал
устанавливается
на не_
котором
3начении'
при
котором
мо)кет
неопределенно
долго
происхо_
дить
растворение
металла.
Растворение
не
идет
равномерно
пъ
всей
поверхности
анода'
а ло.кал\1зуется
в
отдельнь1х
местах,
в
которь]х
появляются
углубления
(так
назь:ваемая
точечная'
|1ли
&литтинговая));'
корро3ия).
Аналогичнь1е
явления
наблюдаются
в присутствии
других
анионов.
||о
своей
способности
к активации
пассивнь]хэлектродов
анионь|
ч9дут
быть^располо)кень|
в следующем
порядке:
€|->Ёг->.|->г,>-
010;>с)н-'
ч0;_.
||орядок
в этом
ряду
мо)кет
несколько
и3меняться
в за-
висимости
от
условий
1
3ванс
и
др.
свя3ь]вают
активирующее
действие
анионов
с
их
ионнь!ц
радиусом
и способностью
проникать,
чере3
пассивирующу}о
пле"*у.
|1-оследняя
рассматривается
при
этом, кай
мембра"',''1р'""паемая
дл{
ионов
с маль]м
радиусом
и непроницаемая
для
ионов с больтшим
радиусом:
!8*
,*
Рис' 124'
Блияние
ионов
хлора на
адсорбцию
кис_
лорода
при
поляризации
платины:
1-кривая
заря-
}кения
в
5
н.
Ёа5Фд;
2-ъ5ц.
н25о4+0'02
н.
Ё€|.
Ёа-
правление
изменения
по-
тенциала
указано
стрелка_
ми.
|1отенциал
измерен
против
нормалБного
водо-
родного
электрода
|
}
!

{акое представление'
однако'
не
вь1дер}кивает
критики. Ёапример,
в
ще_
лочном
растворе
активиру}ощее
действие
анионов
на
)келе3о проявляется
ли1пь
при
достаточно
вь1соком
поло}кительном
потенциале.
3то ясно
ука-
3ывает
на то'
что
мь1
имеем
3десь
дело
с
поверхностнь1м явлением,
завися-
{цим
от
скачка
потенциала в
двойном
слое.
.4,ействительно'
прямь]м
опь1том
мох{но
пока3ать' что
в
присутствии
ионов
хлора
имеет
место
адсорбционное
вь1теснение
кислорода с
поверх-
ности металла.
Ёа'рис.
\24
изо6ра)кень1
снять|е
осциллографинески
анодные
и
катодные
кривь1е заря)кения
платинового эле1(трода
в
раство-
рах5
н.
Ё'5Ф*(1) и
5
н.
Ё'5Ф.10,02
н. нс1(2).
Ёа верхней
насти
кри_
вой
1
как при
катодной' так и
при анодной
полЁризации ясно
видна
кислородная 3адеРх{ка'
которая полностью
отсутствует на кривой 2.
йньлми
словами'
присутствие ионов
хлора в
растворе
препятствует
адсорб-
ции
кислорода на
поверхности
платиньт[9]. при
определенном
достаточно
поло}{ительном
потенциале
подобное
х{е
адсорбционное
вь1теснение
кислорода
хлором
происходит и
на
некоторь|х
участках
поверхности
х{еле3ного
электрода' вследствие
чего
в
этих
местах
нару1шается
пассиви_
Р}ющая
пленка и происходит активация
х{елезного электрода.
Активирующее
действие
ионов
хлора
мо)кет проявиться
не только
при
анодной
поляри3ации'
но
и
в
присутствии окислителей, смещающих
по_
тенциал
металла в
поло)кительну{о
сторону. ||ри опрелеленнь|х
соотно-
{!|ениях
ме)кду
концентрац|1ями
лассиватора
и
акт!4ватора в
растворе
во
многих
сл}:наях
наблюдаются
периодические колебания
потенциала
металла,
переходящего
и3
пассивного
состояния
в активное'
и
обратно.
Фбъяснение
периодических явлений,
по
Б.
А.
(истяковскому'
закл]очается
3
том'
что вследствие
конвективнь|х перемещений
электролита,
бедного
и
богатого
окислителем'
происходит периодическая смена
процессов,
ведущих
к
образов2нию
и
к
ра3ру1шению
пассивирующей
цд9ц6ц[51.
Бопрос
об
условиях
во3никновения и
устойнивости
пассивирующих
слоев
является
бесспорно одной из
самь1х
ва)кнь]х
задач
электрохимии'
однако'
нёсмотря
на
3начительное накопление
опь1тного
материала'
он
еще
не
получил
своего
полного
ра3ре1пения.
Фневидно'
что
полная теория
{1ассивности
дол}кна
учить!вать
не
только
кинетику
посадки |4 иониза\\|1|4
0тдельнь1х
атомов
кислорода' но
и 3аконь]
в3аимодействия
мех{ду
ними,
вероятность
ра3ру1пения
пассивирующего слоя благодаря
растворению
находящегося
под ним
металла
и
т.
д.

9. Б. 3. 3
рш
л
е
р,
<1рудь:
второй конференции
по коррозии
металлов''
2'
52
(1943);
дАн
сссР' 37' 2ь8, 262
{1942);
жФх'
14'357
(19{0);
18,
|31
(1944).
10.
г. Б.
(л
ар
ц _и-г.
Б.
А ки мов,
<1руль:
второй
конференциипокоф-
ро3ии
металлов>, 2, 33
(1943).
11.
Боп|по1|ег-ц.
Р-гап с1<.,7.
Б!е[{гос[:еп.,55,
180
(1951);
Боп}:о|_
[е
г
ц. !е1
{ ег, 7.
р[лув.
€1тегп, 19в,
|27
(1950);
!е
| {
ег''7.
в1е[1гос}:еп.,
55, 274
(1951).
1?. ц ц.
3алкинд и
Б. в.
?'ршлер'
жФх,
25,
565
(1951).
.
13. в. и.
Беселовский,
жФх,
15, 145
(19{1);
22,
1302
(!948);
в. и. гинзбург
и Б. й. 3еселовский,
[Ф!,,
24,366
(1о50).
11. 1. 4'
|4--офа
и
л.
4.
}1едведева,
ААЁ
сссР, 6о,
213
(1949).
15. Б. н. 1( а
б^а.н'оэ'-5тр]д!'_второй
_ко_феРенцци
по
коррозии
металлов!.'
изд. АЁ
сссР' 2'
67
(!9{3);
дАн
сссР,
31, 338,
582
(1941).
_^__16-,^4'.
0. |(
у
р
т т1,
(
вопросу
об анодной
пассивности
металлов'
изд.
АБ
сссР
(1936).
|!.^?.А.
Р1 офа,€.
9.
1у1 ирлина
и 11.
Б.
}4,оисеева,жпх,22'
983 (1э4э).
!8.
[итировано
по Б. ||.
Батракову,
<Бестник
Ан
сссР> м
8,
67
(1950).
19.ц. д
Аан
ков' |[роблемы
к1нетики икатализа1
вьтп.5,45(|94в,.
2о' в. н. палеолог
и[.
Б. Акимов'€борникработ,подрёд.г.3.Ак:+
мова, йсследования
в области
электрохимического
и
коррозионного
поведения
метал_
лов
и^-сплав9Р'
гос'
изд-во оборонной
промылшленностй,
^[.,
235 (1950).
21:
в, и' А
р
х
а
р
о в,
Фкисление
металлов,
.&1еталлургиздат (!9+5!;
| . Б. А
к
н-
м о в, 1еория
и методь|
исследования
корро3ии металлов'
изд_во
Ан'сссР
(1945}:
р.
3
в
а
н
с., 1(оррозия,
пассивность
и защита металлов,
под
ред.
|. Б.
Акймой,
14зд-во нерно-й-и
цветной
металлур-гии,
!т1.
(!941);
2-е изд.,.]'1ондон
(|946).
??. 9'. у
а-8_ п е т,
7.
р|:':'уз'
€фгп,_(Б),
21,
25
(1933);
32, 447 (1936):
23.-11. А.1]!
умилова
и
Р. {,.Бурштейй,дАн
сссР,ъ!,475(1948);
Р._},
Б_ур-1']!
ейн,}1.
А.сурова
и-й.
ь. 3арлденман,'){(,}х,
)ц,у;'|
(1^959}'^Р;.^4:.
Б
ур
ш:тей
н,
[{.'
А. 1{!
уми
ло в а и(.
А. [ол
ьбер {,
жФх,
22,
792
(1946).
24. А'.
^.
|(онетков' <Азвестуая
АнсссР>,охн.390(19{{);
!.
[ап9тпо|г,
.}. Агп. €1-:егп. 5ос., 39'
1380
(!918).
_?5..ц.$о1_{'
1гапз.-
Раг.5ос.,36,472 (19{0);
43,429
(9+7\;
\.
€абгега,
}.{.
\
'
1-!'
Р.ер.
-Рго9гезз
Р1туз.'
12,
163
(1949).
26. и.
А. € м и
р
н
о
в,
[31Ф,
14, 46
(1944).
27.л'
!.. Аанков'
дАн-9с9Р|:5!,449
(19{6);
<1рудьт
второй
конфрег*_
ции
по'ко!розии-
металлов''
изд.
АЁ
сссР'
2'
12|
(1943).
28.
г. в.Акимов,Ё.
А.1
ома1]]ови^&1.
[{. 1юкина'жох,12,433,
568
(19{2);
н.
д.
1 о
м а тл о в,
<3естник
ин)кенеров
и техников),
59/210946\'
Ё.
д.
томашов и
}[. Ё'
1юкина, 14сследования
по корро3ии
металлов'
!, ,|т0,
126, изд. Ан
сссР
(1951).
?9'
п.
1.|.
_9,
у
г и н о в,
}{РФ}Ф,
Физинеский
отд.,
10,
2
(1в78).
30. н. А. йзг9рь!шев
и
А.д. обручева,€борник'раб6тпочистой
иприкладнойхимии,
ш1'93(1923);
н.
А.
и3гарытпев,
<1руд*
второй
конфе-
ренци_и
по_
физико-химическим
вопросам
(1928).
31. л.
в. Б антокова
гБ. Ё. |(абанов,
ААЁ
сссР,
59, 917
(194&)'
32.
в. в.
,г!осев,
[иссертация,
йнститут
физинеской
химии
АЁ
сссР
(195!).
-
,!

$
1.
химичвский
и
элвктРохимичвский
мвхАни3м
:'{
'',
'"..
РАствоРвния
мвтАллов
.
;
|[роцесс самопрои3вольного
растворения
металлов в
растворах
?'г[ецтр9литов
является одной из основнь]х
причи}{ коррозии
(химияе-
ского
разрутшения)
металлов.
']"
|!роблема
коррозии
металлов,
ввиду ее исключительного
прикладного
и
народнохозяйственного 3начения'
давно
привлекала
внимание
многих
ласследователей.
Ряд
ценгтьтх
наблюдений в
этой области бьтл сделан
ух<е
?!1'
Б-
.[|омоносовь|м.
Б
настоящее время имеется
больтпая
литература'
охватывающая
как
теоретические'
так
и
многочисленные
практические
вопрось1
по
корро3ии металлов
и
по методам защить] от нее.
Б
данной
книге
мы
не
имеем возмо)кности
подробно остановиться на
иметощемся
богатом
опь!тном
материале,
которьтй мо}кно найти
в
специальнь1х
курсах
по кор-
ро3ии
йеталлов
(см.
общий список литературы в
этой
главе),
и
коснемся
лишь
некоторых
основнь1х
принципиальных
сторон теории
растворения
*"$'#.".с
растворения
металлов в
растворах
электролитов
(в
отлиние
от процессов
растворения
в воде
таких веществ'
как
сахар или
соль)
сопровох(дается
химическими
изменениями:
металл переходит в
раствор
с'
образованием
ионов
или
малодиссоциированнь]х
соединений
металла;
дднов'ременно
с
этим
происходит
выделение газообразного водорода
ил:,|
&становление
веществ'
находящихся
в
растворе.
1ак, например'
рас-
}ворение
цинка
в серной
кислоте сопрово'(дается обра3ованием'рас\г-
вора
сернокислого
цинка
и вь1делением
водорода;
во время
растворе-
6йя
'меди'
в
концентрированной азотной кислоте
о6разуется
азотно-
кислая
.медь
ц
продукты
восстановле1{ия азотной
(!18.'!Ф1Б1-:-Фкисль|
23018..
;.'
|,
.
Б
отличие
от
процессов
анодного
растворения
металлов поддействием
в&егшЁё|'о
электрического
тока
(в
электролитичес'ких ячейках |1л|1.'в
.хи-
йических
источниках тока)
растворение
металлов'
происходящее при
простом
соприкосновении
металла
'с
раствором'
часто
на3ь1вают саморас-
творе!{ием металлов.
278

Реакция взаимодействия
металла
с
другими
веществами
мо'(ет
про_
текать
по
двум
различнь|м
механи3мам!
а) в виде
}кимйческой
реакций
без
унастия
свободньтх
электронов'
б)
в
виде
электрохимической
реакции.
1ак, взаимодейётвие
натрия
с газообра3нь|м
хлористь]м
водородом
идет в
одну
стадию
согласно
уравнению
}.,1а
*
Ё61
_>
\а61*
Ё.
Разделение всего
процесса
на
отдельные
самостоятельнь1е
стаАи11'
связанные,
например'
с
предварительным
отщеплением
электр9у-1.от
а1'щ,
,''р'"
(ш;
_'
Ёа*1е),
с
перехолом
электрона
к молекуле
нс1
(нс|+
*{-.-н$с:-)'и
с
послед}1ощим
взаимодействйем
ионов
}.,1а*
и
€1-
с обра-
5ованием
молекулы
}{а€1
бь:ло бьт в
данном
случае
энергетически
слишком
невьтгоднь:м
из:за
необходимости
создания
свободнь|х
ионов
в
газовой
фазе.
€ледовательно'
здесь
протека}от
!1е электрохимические
реакций
с
упастией
электронов'
а
чисто
химическая
реакция.
-
Б водном
растворе
соляной
кислоть1 та
х(е
реакция
происходит
по
электрохимическому
механи3му:
натрий
переходит
-в
раствор
в
чиде
ионов'
оставляя
соответствующее
количество
свободных
электронов
в
металле;
наряду
с
этой анодйой
реакцией
происходит'
с
участием
свобод_
нь|х электронов,
катодное
восстановление
ионов
водорода.
'
Фдно йз
приншипиальнь1х
разлиний
ме}кду
этими
двумя
механизйами
заключается
в
том'
что
при
электрохимическом
механизме
весь
про|десс
состоит
из
двух
или
нескольких
параллельньтх
стадий'
протекающих
одновременно
и
с одинаковь]ми
скоростями
(т.
е.
с
участием
одинакового
.
числа
5лектронов),
но
в остальном
являющихся
независимь|ми
друг
от
друга.
1акие
параллельньте
электрохимические
реакции
принято-
на3ь1-
вать
сопрях{еннь1ми.
Ёезависимость
этих
сопря)кеннь|х
р.еакций
друг
о{
друга
1ьтра>кается
в том'
что,
как
{уд"'
видно из
дальнейшего,
в
ряд€
случаев
мо)кно
оказь1вать влияние
на течение
одной
и3
э-ти_{
реакции'
не
изменяя
основнь]х
кинетических
3акономерностей
другой.
йзменением
состава
раствора
и
других
условий
опь.1та
мо}кно'
например'
заменить
реакцию
восстановления
ионов
водорода
реакциеи
восстановления
других
вещеетв,
не изменяя
при этом
природу
анодного
процесса
иони3ации
металла'.
|(оличественнь1е
соотно1пения'
которые
при
этом
наблюдаются'
будут
уточнены
нами в
последующем
изло)ке!{ии.
"''"8с!и
поверхность
растворяющегося
металла
является
неоднородной
(например, прй налинии.в
металле
включений
других
металлов
или
интер-
металлических
соединений),
то
при
электрохимическом
механи3ме
рас-
творения
металлов'
вследствие
такой
независимости
отдельнь1х
стадии;
мо}}<ет
происходить
прос_тра нственное
ра3деление
сопр
ях(еннь1х
катодного
и
анодного
процессо;.
3'этом
случае
на одних
участках
(например,
на
поверхности
чистого
металла)
происходит
преимущественно
процесс
анодного
растворения
металла;
оста'в1шиеся
электРонь|
переходят
по
метал-
лу
к тем
местам' на
которых
преобладают
катоднь1е
реакции
(надример,
н}
обнах<еннь1х
участках
инородньтх
вклюнений).
1акая картина
напо.-
минает
работу
!альванического
элемента'
в
котором'отрицательнь|й
электрод
(например,
цинк)
растворяется'
когда
он
соединен
проводником
со вторь1м
электродом'
а
на
последнем.
восстанавливаются
ионь1
водорода
или
другие
вещества.
3 гальваническом
элементе
основнь!е_
катод1тыи
и анолный
процессы
пространственно
полностью
разделень1.
Б
отличие
от
этой
картины
при
растворении
металла_по
химическому
механизйу
переход
металла.
в
.раствор
ц
вь1деление
водорода
:проиеходит
в одном
акте
на одном
и том
х{е
участке
поверхности.."
'
-'']''"
279

Рассматривая
ра3личнь{е
реакции'
иногда
трудно
3аранее
сказать'
п-ротекают
ли.они
по
химическому
механизму
или по электрохимическому.
9исто
химический
-механи3м
растворения
наблюдается,
повидимому'
при
взаимодействии
металлов
с некоторь|ми
безводнь:ми
растворами,
например,
с
раствором.хлористого
водорода
в
бензоле
или с
раствором
иода в
сухом
хлороформе*.
||ри
растворении
металлов
в воднь1х
растворах
электроли-
тов в
подавляющем
больтпинстве
случаев
имеет место
электрохиминёский
механи3м
растворения
с
участиемсвободньтх
электронов.
|[равда'
и
в этих
случаях
не'исключена'
возмох<ность'
что наряду
с
электрохимическими
реакциями
в некоторой
степени происходит
и
чисто
химическое
взаимодей_
ствие металла
с
9лектролитом'
но
значение последнего-подчиненное'
и во
всех
практически
ва)кнь1х
случаях
растворения'металлов
в воднь]х
рас_
творах
мох{но
ограничиться
рассмотрением
электрохимического
механи3-
'1.^д
втРо4у
об
электрохимическом
механи3ме
растворения
при1пел
в
1830
г. Р. 1(аяндер,
которь|й провел
систематическое
и3учение
скорости
растворения
металлов
в
различнь|х
электр9дц121[1).
Фсновнь:е
вопрось|
теории электрохимического
растворения
метал-
лов
касаются
взаимной
связи аноднь|х
и катоднь!х
процессов'
происходя-
щих
на поверхности
металла
}т<е
в
1830
г.
Ае_ля-Рив!31
установил
3ависимость пРоцесса
рас-
творения
металлов
отналичия
вклточений
или
других
неоднородностей
по_
верхности' которь]е
образуют
совместно
с
чистой
поверхность}о
металла
больтпое
число
короткозамкнуть|х
гальванических
элементов микроско-
пических
ра3меров-так
назь|ваемь1х
местных (ло*альньлх)
элементов'
или
микроэлементов.
Б
результате
работьт
локальнь|х
элементов происходит
растворение
основного металла.
в
таких элементах
анодньтй про_
цесс
протекает
на чистой поверхности
металла'
а
катодный
процесс-на
включениях.
3акономерности
распределения
катодного
и анодного
про-
цессов
в
других
случаях могут'
конечно'
сильно
отличаться от
рас-
смотренного
здесь простейшего
примера.
|[ервое
количественное
оформление
теории
локальных элементов
бьтло
дано
Ё. |{. 6лугиновь:м'
которьтй
связал скорость
ра3ру1пения
металла
с электродви>кушей
сталой
и
сопротивлением
локальнь|х элемен_
тов|{]; аналогичное
соотно1пение
значителБно по3}ке
бьтло предлох{ено
|1альмаэром|51.
1еория
локальнь1х
элементов получила
в
дальнейп-тем
1пирокое
раз-
витие; особенно
ценный
вклад бь:л
сделан
в нее советскими
исследова-
телями-[.
Б.
Акимовь1м
и его сотрудниками|6|.
1(ак
будет
видно
из
дальнейтпего,
11ал'1,чие
короткозамкнуть1х
ми-
кроэлеп{ентов'
т.
е. пространственное
разделение
катодной
и анодной
реакции'
возмох{ность
которого
вь1текает
из
электрохимической природь1
коррозионного
процесса
в
целом'
во многих
практических
ва'(нь1х слу-
чаях
привоАит к
3начительному
ускоренито
последнего. Б
классической
теории корро3ии
отсюда часто
делается
неправильнь:й
вь]вод
о полной
химинечкой
устойвивости
металла
с совер1шенно чистой
и
однородной
поверхностьто. 3
действительности'
однако' однородность поверхности
металла
не является препятстви@]\,{т{.|!{,
одновременного протекания
на
ней
как аноднь1х' так
и катоднь1х процессов'
так что
и химически
чисть:й
и однороднь:й
(например,
>кидкий)
металл
мох(ет
растворяться
в
растворе
*
||ри воздействии
газов'
содер'{ащих водя.ные
пары'
коррозия металлов
про_
исходит при
участии
адсорбированной пленки
воды' и, как в водных
растворах
элек_
тролитов'
она
протекает по электрохимическому механизму.
Растворение металлов
в
плохо проводящйх неводных
растворах
в некоторь|х случаях
протекает так)ке
по
электрохимическому'
механизму.
280
