Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов
Подождите немного. Документ загружается.


играет
роль
поверхностного
сопротивления' хотя
фи3ическая
природа
затруднения
ддя
прохо>кдения
тока в этом случае
иная' чем
при
омическом
€опротивлении. частное
от
деления
этой
величинь1 на
удельное
сопротив-
*ление
раствора
(4,
мох{но
рассматривать'
как меру
рассеивающей
способ_
:ности;
оно
имеет'
очевидно'
размерность
длинь|.
1Фртина
распределения
тока зависит'
однако' не от абсолютной
величинь1
+|+|,
'''отношения
€е
к
величинам
!
и
А,
определяющим
геометрические
ра3мерь|
системь1.
-{ем
больгпе
[
и'
А
при
постоянном
мех{ду
ними отно1пении'
тем больп:е
дол}к-
на
бь:ть
величина
+|+|*'"
''"',
чтобьт
обеспечить
равномерное распре-
деление
тока. Б
этом
легко
убедиться,
если
представить
уравнение
(266)
в следующем
виде:
А
|я-|т
[
(266а)
Б.
23
2.Б.
в. 3ргплер,
жФх'
22,683
(19{8);
к.
о.
Розенталь
и
Б.
3
р
ш| л е
р,
жФх'
22, 1344
(1948).
3.А. т.
Баграмян'жФх'22'217
(19{8);н.
1.(удрявцёв,
жФх'
54э,
(1э49).
-
4' ]' Ё еугоуз&у,
Б1ес1го6е
Ргосеззез, )1зсшзз|опз
Раг. 5ос.,
1' 2!2
|9+\;
!.
[ейр о вский,
}1. }1атиагп, [имия, |' 3
(1951).
5. с. с а г
6 а гп, Р1есЁго0е Ргосезвев, !!зспзз!опв
Раг.
5ос.,
1' 182
(1947).
6. [ейровский
и суиек, €опр1.
&еп6.
183'
125(1926).
7. м.
у
о 1 гп
е
г,
1(!пе11[
6ег Р[:азепб!16шп9, !гез0еп ш.
[е|ра|9
(1939).
.8.
к.
м.
| орбунова и||.
А.Аанков'<9спехихимии)'
!7'7|о
(1948);
3гап4ез.,
2.
р}луз.
€[пегп., \42,97
(1929).
!|
||а?к!
.
-
]-!д !
ц)!| о|
|'
'
|{риведен
нь1е
вьтводы
пол
учень|
дл
я
чрезвь1ча
й но
}п
Рош1енной
геометр и
-
ческой
модели.
}1о>кно,
однако'
пока3ать' что
и
для других,
6олее
сло)к-
,ных
случаев' характер
распределения
тока
определяется
соотно1пением
з!1Фкду
величиной
*
!
+
|
, ,"*'''рой
длиной'
зависящей от
линейньтх
размеров
и
формьт
системы. 1ак,
если катодом слу)кит
внутренняя
поверх.
,+{ость
узкой
трубки, против
вь]хода
и3
которой
находится
анод[26],
то
для
равномерности
распределения
тока по поверхности трубки
необходимо,
-2
1]0'-\
Р
чтобы
величина
:
!
;+ ! бьтла бьт ве.пика
по сравнен||ю
с
:_
'
где
/-длина,
.
ш|
о!
\
а г-радиус
трубки.
Ёа
практике
для
определения
рассеивающей
способ-
ности в относительнь1х
единицах
мо}|{но
пользоваться следу'ющим
спосо_
6ом: 7-о6ра3но
и3огнутьтй
электрод
покрь]вается металлом
в
данной
ванне,
тосле чего
толщина
образовав1пегося
осадка
металла
измеряется
в
разнь|х
'местах
электрода.
||о степени
равномерности
покрь1тия
судят
о
рассеи-
вающей
способности
ванньт!?7]. Ё4д' заметить' что по причинам'
аналогич-
ным и3ло)кеннь1м
вь]1пе'
распределение
тока
т'а
электроде
находится
так)ке
в 3ависимости
от
формь;
и
распол0}кения
второго
электрода и
от
11ал||чия' непроводящих
тел в
растворе
электролита|281.
литвРАтуРА
к
глАвв у|
1. !(
тексту
1.
<Борис
€еменович
$коби>,
в
кн.
<,[1юди
русской
науки}
(с
предисловием акад.
€.
й.
Бавилова),
2,89{
(19{8);
Б.
с.
я
к
о
б и, [альванопластика
или способ по
дан-
чь'1ч
о!р39^_шам производить
медные
изделия
из медных
растворов
помощью
гальвани3ма'
спб.
(!840).
25[

'
9.
}]овьте исследоЁания
по кристаллографии
и
кристаллохимпп,
€борник
[1'
Рост
крттсталлов'
под
ред.
г.
Б. Бокия,
14зд.
иностр. лит_ры'
(1999-)_.
10.
А. г.'€айар цеР
и
(.
€.
Б
встропьев,
)(Фх'
5'
854
(|934)'
11.
Р.
к
а и ш
е в,А.
!]]елудко
и
Р.
Б
ли
з н
а ко в,
(известия
Болгарско*
АЁ>,
(ерия
физинеская,!'
137
(1950).
'12.'А.
т. Б
а г
р7м
я
н,
3лектроосаждение
металлов' и3д. Ан сссР
(1950)-
13. Р
г 6 е
у-6
г
0т у. !
о
!
п е
г,
7.
р!уз.
€1':егп.,
!57' 165
(193|);
в
г
0 е
у'6
г
Ё
а"
там
же' |72,
157-
(1935);
Ф
о
л
ь м е
р,
)(Ф)('
5' 319
(1934).
14.
к.
м.
[орбу'нова
й|7.
А. Аанков'жФх'23'616(1949).
15. н.
т.
(удр
я
вцев,
}(Ф{,,
23' 849
(1949).
16.
о. Бсин,
А. Балабай.и
А. }1
атанцев,
}(Ф[,6,
1071
(1Р35);
Ф.8син
и А. }1
ата'нцев'жФх'8'326(1936)'
17.к.
м.
| орбунова
яА. и'
жукова,}{Ф{'22'|Ф7
(1948);
23'
605
(1э4!).
'1в.ь.
А.
Ройтер,в.
А. юза
иЁ. €. ||о;г!уяц,дФ4'13'.605'80Б
(1939);
в.
А. Р
о й т е
р,
<9краинский химический
журнал) 1в' 225
(|950).
' '19.А.
т. Баг_рамян
и3. А.
€оловьева'.[АЁсссР'77,629(1951);
о' А.
в
с\1н
и
}1.
А. .[1отп
карев'
жФх'
13' 186(1939).
20.
п.
д.
[
а н
к о
в,
€труктура
и механизм
образования пленок
на
повер-{-
ности металлов'
статья
в
<1руда1 второй конференции по корро3ии
металлов>,
|1"
121
(19{3);
к.
м.
горбунова,т.
в.
ива'новская|1
н. А. 1!]ишаков'
жФх,
25,
981
(1951)'
5т.
о. А.
Б
си н и
др., )(Ф)(,
8,326
(1936);
6' 795' 1071
(1935)'
22.ю.
в.
Б аймаков'
жФх'
25' 483
(19б1).
23. н.
А.
йзгары1пев
и
|1.€.
1итов,
)(РФ{Ф,
насть
хлм',--49, 57}
(1917);
50,225
(|9!в);
н._А.
изгарышев
и
д.
в. €тепанов')'1(РФ[Ф, пасть
хим., 50,
236
(1918)'
'
24'' А.
г.
с а м
а
р
ц
е в,
.[,АЁ
сссР,
2,{78
(1935); .1руды
второй.конференций
покоррозииметаллов>,_1'133(19{0);
см.так)кеА.т.ваграмян,.[АЁсссР,22"
243
(!039).
2ь.й.
А.
.||ошкарев,Ф.
А. Бсин
и
Б.А.
(отникова,
[Ф{,,9'
1412
(1939);
м. А. л
о тш
к
а
р
е
в
и А.
А.кр
ю ко
в а,ААЁ
сссР' 62,
97
(9цФ;77,
919
(|о50)"жФх,
23,2о9,221:|457
(1949),
26, 731
(|952);
м.
А. л
о
ш
к'а
р
е в,.|1.АЁ
сссР,7]'729(|950);
А.
А.
|(рюкова
и
м.
А'.[|отшкарев'
дАн
сссР'
8!, 1097
(|э51).
'
26. А.
н. Ф
р
у
м
к
и н,
)1(Ф!,'
23' |477
(1919):
27.
н.
т.
(
у
др
я
в
це
в,
А|1[,
22' 367
(1919).
28.
в.
п.
]у1
й:ш
о в е
ц,
Б|![,
24,353
(1951).
29.н.
Б. ]у1
иллер
иБ.
А.
|!лесков,.[|АЁсссР,74,323(195|).
30.., .
9апопе
}1.
Ёа|зз|пз[у,
.}
.с|!гп.р}пуз|чше,49,с123(1952)-
3|. с.
в.
| о
р
6 а
ч е в и
8. ||.(-1'
р
о с_1-е н
ц-9,
Б'Ф)('
2в,624',787, 8о2
(1952)-
32. А. н.
Ф
|: у
м к и
н.
.(АЁ
сссР'
85' 373 (1952).
2. Ф6щая
1. в.
и..[1айнер
и Ё.1.
(удрявцев,Фсновыгальваностегии,
насть 1'
.
|лава |/!|
пАссивность
и
кинвтикА
элвктРоднь!х
пРоцвссов
$
1. пАссивность
мЁтАллов
и
окиснь!в
плвнки
-
|1одобно
тому
как
ра3ряд
ионов
металлов
ускоряется
при
переходе
к
более
отрицател
ьнь|м
потенциалам,
а
ноднь]е
п
роцессьт
растворени
я
метал
_
лов
дол)кнь]
ускоряться
при сдвиге
потенциала в
поло)кительную
сторону'
1вление
это,
действительно'
наблюдается,
наприме!,
при анодной
поля-
ризации
никеля
или
х(еле3а
в
соляной
кислоте'
однако
во многих
случаях
11ри
достаточно
поло)кительном
значении
потенциала' а иногда
и
просто
при
увеличении
длительности
анодной
поляризации
происходит
резкое
3амедление
скорости
растворения
металла.
1ак, например'
крепкая
азотная
кислота является
сильнь1м
окисли'
тедем'
которь!й
мох<ет
сообщить
металлу
вь|сокий поло}кительнь]й
потен-
циал.
|{ри'таком
потенциале
дол)кно
бьтло
6ьт происходить
бьтстрое
растворение
>келе3а,
если
бь:
сохранялись
те
соотно1шения
мех{ду
ско-
ростью
растворения
и
потенциалом,
которь|е наблюдаются
пр_и
неболь_
йой
анодной
йоляризации
х{еле3а
в
кислых
растворах.
в
действитель-
ности,
одт{ако,
химическая
реакция'
наступающая
шри
погру}кении
)келеза
в
крепкую азотную
кислоту'
продол)кается
ли1шь
короткое вре-
мя'
а
затем
прекращается и
далее
х{еле3о
остается
практически
совер-
1шенно
устойчивь]м'
|1ринято
говорить'
что
}келе3о
пере1пло
в
ппассивное
состояние
(в
противополо}кность
активному
состоянию
}келеза'
раство-
ря}ощегося
в
соляной ил\4
ъ
ра3бавленной
а3отной
кислотах).
|1ер:хол
и3
активного
в
пассивное
состояние
носит название
пассивации, а
обрат-
ньтй
процесс_активацт4и
илу1
депассивации
металла.
||ассивность
металлов
имеет
больтпое
практическое
значение'
так
как она
является
вах(ней1пим
фактором'
обусловливающим
устойчи_
вость
таких
металлов'
как
)келе3о
и
алюмит{ий,
во
многих средах.
всте-
ственно
поэтому' что вопросу
о
во3никновении
пассивного
состояния
было
посвящено
оче;ь
больйе
количество исследований.
Бпервьте явление
паосивац|ти
металлов
наблюдал
м.
в. .[1омоносов.
Б
рабой
м.
в..[[омоносова|1](о
действии
химических
рас_творителей>
в
5
зз
сказано
следующее:
<(огда
для
растворения
металла
берутся
две
равнь1х
порции одного
и
того
)ке
кислотного
спирта'
но
одна
|43
ъ|их
!Б*!'"о
раз6авлЁна
прилитой
водо1о'
то таковая
растворяет
больц:ее
25а

количество
металла'
чем первая
...))'
и
далее,
чере3
несколько
строкР
в
$
34:
(при
употре6лений
достаточно
крепкого
селитряного
спирта
для
растворения]4еталла
растворение
бьтстро
кончается.
.'>]'
1,1з приведБн-
ного
видно,
.лто
.[{омоносов
наблюдал
и описал
явление
пассивации
ме-
та.пла в
крепкой
азотной
кислоте
Фарадей
вь]сказал
предполох{ение'
согласно
которому
пассивное
со_
стояние
обусловливается
присутствием
на
поверхностй
металлов
химиче_
ски
связанного
кислоРоАа.
<1(ислородная)
теория пассивности
полг]ил&
в
дальней:пем
!широкое
развитие
благодаря
работам
многочисленнь1х
уче*
нь1х'
среди
которых
уках{ем
особецно
на
акад.
в.
А.
(истяковского.
9ванса
и
др.
[1|енбейном
и
[итторфом
бьтло
вь:сказано
иное
предполо'кениеР
согласно
которому
пассивньтй
металл
нуцно
рассматриват|,
как
особуто
_химически
неактивну1о
форму
металла.
Бглядьт,
6лпзкие
к
этой
точке
3рения'
до
сих по]
защип\аются
некоторь|ми
немецкими
и
американ-
скими
авторами.
1ак,
3.
.,|\4юллер|:)
ц ёго последователи
придерх(и-
ваются
взгляда'
мало
отличающегося
от
предполо>кения
1]]ейбей-
на; согласно
,&1юллеру'
полная
пассивация
металла
является
результа_
том
(и3менения.электронного
состояния))
металла
у
основания
пор
в изоли_
Р}ютцей
пленке'
во3никающего
вследствие
прохождения
чере3
порь|
тока
боль:пой
плотности.
}лиг!3]
считает'
что
пассивность
обусловлена
распределением
а'ек*
тронов
в
атомах металла:
пассивность
металлов
группь1
>келеза
во3ни_
кает
в
результате
удаления
электронов
с
4-оболочки
атома
металла-
1ак,
пассивность
гомогеннь1х
сплавов'
йо
9лигу,
определяется
тсм ком-
понентом'
которйй
труднее
-отдает
электронь|
с
ё-о6олояки, 11риче}д
пассивирующий
компонент
берет
электронь|
от
другого
компонентаР
легче
их
отдающего'
а
активация
сплавов
происходит
при
заполнени|4
этой оболочки.
|!ассивцру'ощее
действие
кислорода
улиг
объясняет
темя
что кислород
забирает
на
-себя
часть
электронов
с
4-оболочки
поверх1
ностнь!х
атомов металла.
Аля
обоснования
1воей
теории
}лиг
пь:та}ся
использовать
зависимость
пассивируемости
сплавов (например,
]\]|-€ш}'
от
их состава.
Фднако,
как
показал
более подробньтй
разоор
!опроса
га1'
следствия
из этой
теории
часто
противоречат
опь]тнь|м
данйьтм.
{ак,
со-
глас
но
-эти
м п
р
едста вл
ени
ям'
пасси ви
р уемость
нер)кавеющ
ей ст
а ли
долх<
на
бьтла^бьт
возрастать
при
увеличении
содерх<айия
)келеза'
а не хрома.
('ощее
во3ра}кение
против
объяснения
пассивности
особь:м
аллотро-
пическим
или
электроннь!м
состоянием
металла
основь!вается
на том
факте"'
что
явление
лассивац14и
сопровох{дается
не
изменениями
физинеских.
свойств
сап{ого
металла'
а
изменением
устойнивости
адсорбшионньлх
или
фазовьтх
пленок
на
его 11оверхности.
|[ас6ивнь:й
шпеталл
с
термодинамиче*
ской
точки
зрения
не является
более
благороднь|м'
чем
актиЁньтй. Бо
всех
изученнь{х
случаях
при
пассивации
на
поверхности
металла
либо
соз-
даются
слои
соли
или
окислов,
образующих
отдельнуто
фазу,
либо
адсор-
бируются
в боль:пем
или мень1пем
количестве
кислород
или
А}}гие:
вещества.
в]]с9Р:-
в первую
очередь
благодаря
разносторонним
исследованиям'
акад.
Б.
А.
(истяковского'
а также
работай
Ё. А.
йзгарь|1пева'
[
.
Б.
А[и-
мова
и
др.'
получила
полное
признание
теория'
связь1вающая
пассивность.
с образован-ием
окист{ь|х
или
других
слоев
на поверхности
металла.
в.
А.
(истяковск11гь;
6'6р'л
и изучил
явлейия
частичной
и
пол_
ной пассивации,
п.роисходящи9
при переме1шивании
раствора'
-содерх(а-
щего
пассиватор
(мотоэлектрические
явления).
|!ереметпивание
увелн-_
чивает подачу
вещества'
вь]зь|вающего
переход
металла
в пассивное
вФ_
'!ь1

сто я
ние'
к повер
х
ности металл
а' 11
эт|1м
облегчает наступление пассивно с ти
-
|{ри
этом
наглядно бьтла
показана
ва}кная
роль
состава
раствора
в яв-
лениях
пассивации.
Р|з
работьт
Б. А.
1(истяковского такх(е
следует' что
3начительное
изменение
потенциала
электрода,
происходящее вследствие
переме!пивании
раствора'
является
признаком
неравновесности
электрода-
Б первьтх
работах
пассивность
рассматривалась
как
явление
полного
прекращения
анодного
процесса
растворения
металла.
Б
действительности
наблюдаются и имеют
вах(ное значение
переходнь]е
случаи,
когда
пасси_'
вирование
металла приводит
не
к
полной
остановке анодного
пРоцесса
(нто,
собственно,
принципиально
и
невозмо)кно),
а
к существенному 3а-
медлению его.
Ёа значение
частичной пассивности металла впервь|е
ука-
зал
Б. А.
!(истяковский!5].
1аким
образом,
в
проблеме
пасеивности
воз-
никла 3адача-установления
связи ме)кду состоянием
поверхности
ме--
талла и
скоростью электрохимических
процессов' протека}ощих
на ме-
талле.
н.
А.
йзгарьттпев опь1тами в спиртовь1х и
пиридиновь]х
раство*
рах
показал' что
пассивируемость
7п,
€6,,
€ш и
других
металлов кисло-'
родом
растворенного
воздуха
3ависит
от
природы
растворителя;
в
раство-
рах
солей в
указаннь|х
растворителях
пассивное состояние наступает'
легче'
чем в воднь1х
растворах,
что свя3ано
с
меньт'пей скоростью
электрод-
нь|х
процессов в этих
растворителях.
[!ри
взаимодействии
кислорода.
с
поверхностью металла в
присутствии органического
растворителя
од-
новременно
происходит
сопрях(енное окисление молекул
последнегФ
с образованием
соединений перекисного характера!6]'
в
литературе
да-
ются
различные
определения
понятия пассивации. Ёаиболее
правиль_
нь]м
является определение' согласно которому
пассивация состоит в
по_
вь|!пении
перенапря}ке|1|4я
ил\1, в замедлении
анодного
процесса
раство_
рения
металла вследствие изменения
состояния его
поверхности' обра-
зования
на ней адсорбционньлх
|{л\4
фазовьгх
слоев окислов пл14.
солей.
}4сследование
явлений
пассивности
сводится
либо
к и3мерению
ско-
рости
электроднь]х
процессов'
протекающих
на
поверхности пассивирую-
щегося
металла,
либо к
и3учени}о
природь1 пассивиру1ощих слоев.
Аля"
изучения
изменений
скорости анодного пРоцесса
растворения
металла ис--
поль3уются
обьтчньте электрохимические методь]
снятия
поляризационнь1х.
кривь|х и
кривь|х
зарях{ения' иногда в сочетании с аналитическими
измере-
ниями' и
осциллографинеский
метод
(Аля
изунения
бьтстрьтх
процессов)*
,[1,ля
определения
средн9й
толщинь!
пассивирующих пленок' кроме
метода.
кривь1х
заря)кения'
применяются
описаннь]е в вводной
главе
метод
изме-
рения
емкости
при
помощи переменного
тока и оптические
методь:.
Аля
определения
омического
сопротивления
и
пробивного напрях{ения 3а-
щитнь]х
пленок на
поверхности
металлов предлох{ен
метод'
по
которому
на
поверхность
наносится калля
ртути
и измеряется
сила
постоянногФ
тока'
протекающего
мех{ду
ртутью
и
исследуемь]м
металлом'
_при
нало-
х{ении
п{е>кду ними
постоянного
электрического напря>кения[7].
Различнь;е металль| сильно
отличаются
ме)кду собой
по степени своей
склонности
пассивироваться. 6
технической
точки зрения особое
3наче-
ние
имс!ет
со3дание сплавов' на
поверхности которь1х
легко
возникала
бьг
устойнивая
пассивирующая
пленка'
повь|тпающая
!1х
сопротивляемость.
химическим воздействиям. 1( таким
сплавам относятся
в
перву}о очередь-
так
на3ь|ваемь]е нер)кавеющие.стали, содерх(ащие'
кроме х<еле3а'
обьтчно
хром
и никель или
марганец'
а так}(е
не6ольгпие
добавки
ряда
други)с
9дементов'
как'
например' титан или нио6ий. Ёа изделиях
из
таких спла-
вов
под
действием
атмосферного воздуха
или
воды возникает
химичес*:а
я5&
0,2
0,',-
а
кулоно|'
смэ
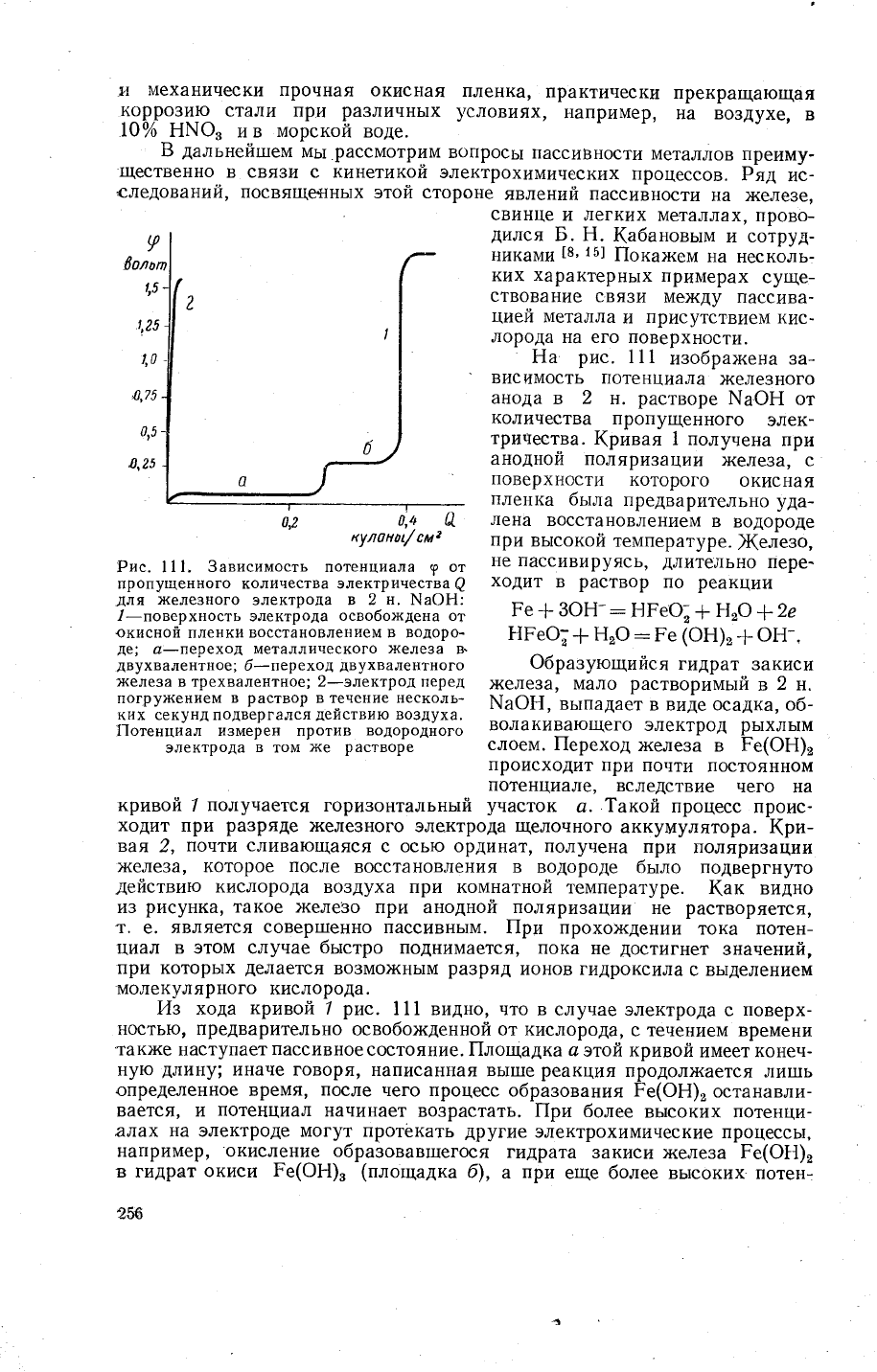
Рис. 11|.
3ависимость потенциала
9
от
пропущенного количества электрипества
{
для
железного
электрода
в 2
н.
!х|аФ!{:
1_поверхность
электрода
освобо>кдена от
окисной
пленки
восстановлением в водорФ-
де;
с:переход металлического
>келеза
в.
двухвалентное;
6_переход
двухвалентного
)келеза в трехвалентное; 2-электрод перед
погру)кением
в
раствор
в течение
несколь_
ких секунд подвергался
действию
воздуха.
11отенциал измерен против
водородного
электрода
в
том
)ке
растворе
71
механически
прочная
окисная
пленка'
практически
прекращающая
19РРо-3!Р^
стали при
ра3личнь]х
условиях'
например'
на во3духе'
в
10%
ншо3
и..в
морской
воде.
Б
дальнейтшем
мь1
рассмотрим
вопрось1
пассивности
металлов
преиму_
щественно
в свя3и с кинетикой
электрохимических
пРо!ессов.
Р"д
ис_
следований'
посвящеянь]х
этой стороне
явлений пассивности
на }келезе'
свинце
и легких
металлах'
прово-
дился
Б. Ё.
(абановь]м
и сотруд-
никами
|8'
15]
пока)кем
на ттё€(Ф.'1Б:
ких
характернь!х
примерах
суще-
ствование
свя3и
ме}кду
пассива-
цией
металла
и
присутствием
кис-
лорода
на его поверхности.
Ё{а
рис'
111
изобра>кена 3а-
'
висимость потенциала
)келезного
анода
в 2 н.
растворе
\аФЁ
от
количества
пропущенного
элек-
тричества.
(ривая
1 полунена
при
анодной поляризации
х{елеза' с
поверхности
которого
окисная
]1ленка
бьтла
предварительно
уда-
лена
восстановлением
в
водороде
при
вь|сокой
температуре.
железо,
не пассивируясь'
длительно
пере-
ходит
в
раствор
по
реакции
Ре
*
3ФЁ-:
ЁРеФ;
\Ё\'Ф
|2е
нРео;+
н2о:
Ре
(ФЁ),
+
о1_{-.
Фбразующийся
гидрат
закиси
}келе3а' мало
растворимь:й
в
2
н.
1'{аФЁ,
вь1падает
в виде осадка, об-
волакивающего
электрод
рь]хль!м
слоем. |1ереход
х<елеза
в
Ре(ФЁ),
происходит
при
почти
постоянном
потенциале'
вследствие
чего
на
кривой
/
полунается
гори3онтальнь|й
участок
а..1акой процесс
проис_
ходит
при
ра3ряде
}*(елезцого
электрода
щелочного
аккумулятора.
(ри-
вая
2,
почти сливающаяся
с осью ординат, получена
при
поляризации
}{еле3а' которое
после
восстановления в
водороде
бьтло подвергнуто
действию
кислорода
во3духа при комнатной
температуре.
(ак
видно
и3
рисунка'
такое )келезо
при
анодной
поляризации
не
растворяется'
т.
е.
является
совер1пенно
пассивнь]м.
|1р" прохох{дении
тока потен-
циал
в
этом случае бьтстро поднимается'
пока
не
достигнет
знанений,
т1ри которь1х
делается
во3мох{ным
разряд
ионов гидроксила
с вь1делением
молекулярного кислорода.
14з хода
кривой
7
рис.
111 видно, что
в случае электрода
с
поверх-
ностью'
предварительно
освобо}кденной от кислорода'
с течением времени
так)ке
наступает
пассивноесостояние.
|{лощадка
аэ"[ой
кривой
имеет конеч_
ную
длину;
иначе
говоря' написанная
вь1111е
реакция
продол>кается
ли1пь
определенное время,
после
чего процесс
образования Ре(ФЁ),
останавли-
вается' и
потецциал
начинает
возрастать. |1ри
6олее
вь1соких потенци-
2лах на электроде могут протекать
другие
электрохимические
пРо{ессьт,
например' окисление образовавтшегося
гидрата
зак|1сих(елеза Ре(Ф}1)'
з гидрат
окиси
Ре(Ф}!)3 (площадка
б),
а
лри
еще более вь1соких' ||81€н:
256

циалах
вь!деление
молекулярного
'
кислорода.
Б
рассматриваемом
слу-
чае
пассивация свя3ана с накоплением
на
поверхности пассивирующих
окислов,
которое
происходит
одновременно
с
образованием непассивирую'
щего
слоя
Ре(ФЁ),
|в:.
||римером,
на
котором
мо)кно
хоро1по
проследить
соотно1пения мех{ду
степенью
пассивности
и
количеством
кислорода
на
поверхности'
является
анодное
растворение
платинь1 в
соляной кислоте
!9].
при
анодной
поля-
ри3ации
платинь1 в
растворах'
содерх{ащих
достаточное
количество
хлор-
ионов'
она
переходит в
раствор
хотя и с
небольтпой,
но
вполне измеримой
скоростью.
|1оследнюто мо)кно определить
по
силе тока'
которьтй
прохо-
дит
чере3
платиновьлй электрод
при
определенном
потен1(иале. ||ри этошп
оказь1вается'
что с течением времени
сила тока
падает' т.
е.
скорость элек-
трохимического
процесса
умень1пается.
(ак
показал Б.
Б. 3ртплер,
это
умень1шение
закономерно
свя3ано
с медленнь1м накоплением
на поверх_
ности платинь1
кислорода' происходящим одновременно
с
растворе1{.1ем
платинь1.
.[,ля
определения
количества
кислорода
на
поверхности платинь1
бьтл
исполь3ован
метод кривь1х 3аря}{ения' описаннь]й в
$
4
введения.
|1осле того
как
электрод
бьтл подвергнут
анодной
поляризацу1илри
посто-
янном
потенциале
в течение определенного
проме)кутка времени, и
с|4ла
анодного
тока
упала
до
некоторой
доли
своего
первоначального 3начения'
анодная
поляризация прекращалась' и током больтпой
плотности снима-
лась
катодная
кривая
3аря)кения.
||о
длине
3адер)кки
на
кривой
3аря)ке-
ния
мо}кно
бьтло определить
количество кислорода' которое
успело
нако-
питься на поверхности платинь|' и
установить
соотно1пение
ме)кду этим
количеством и
плотностью
анодного тока
растворения
платинь|
перед пре-
кращением
анодной
поляризации. Фказалось'
что
при
увеличении
коли-
чества
кислор(эда
{
на поверхности скорость
растворения
!
убь:вает
по эк-
споненциал
ьному 3акону !
:
ае_
бц,
г
де
а
и
6
постоя
нньте, причем
количество
кислорода'
которое бьтло
достаточно для
заполнения только 6%
поверх-
ности
платинь1'
у}ке
вь]зь|вало
умень111ение
скорости
растворения
платинь1
ъ
4
раза;
3аг{олнение
|2% ловерхности
3амедляло
растворение
в
16
раз
п т.
д.
3начительная
пассивация вь|зь1валась' таким образом,
количест-
вами кислорода'
которьте бьтли
еще
далеко
недостаточньт
для
образова-
ния одноатомного слоя
на поверхности металла.
Рассмотрим
несколько
подробнее
условия
во3никновения
и исчезно-
вения
пассивного состояния.
Бсли
при
постоянной
плотности тока вести
анодное
растворение
платинь|'
по потенциал
во времени
растет
посте-
пенно. Б
других
случаях' напротив'
иассивация проявляется
вне3ап-
но. 1ак,
из хода
кривой
1
рис.
1 1 1
видно, что
потенциал
)келезного-
элек-
трода на
всем протях{ении площадки а
и3меняется мало, а 3атем
бьтстро
возрастает.
||роцессу т7ассивацу|и способствует
увеличение
анодной
плотности
тока.
Бо многих
случаях
при
дости)кении
}]екоторой плотности тока
про-
исходит внезапнь:й
переход
электрода в
пассивное
состояние.
||римером
мо)кет слу}(ить поведение )келеза в
концентрированной
щелочи
при
повь!-
гшенттой температур9!32). |{ц;1цяя
кривая
рис.
112
показьтвает
во3растание
потенциала при
увеличении
плотности
тока на активном х{елезном
элек-
троде в
10
н._
ш;он
при 30". |[лотности тока 2'10-3 а|см2 соответствует
резкий
подъем
кривой
вверх в связи
с пассивацией
>келеза.
|1ри. этом элек-
трохиминеский
пРоцесс Ре->РеФ,
-,
т.
е'
переход
металлического
)ке-
леза в
двувалентнбе
состояние прекращается.
|{рекращение
одного анодного
процесса' наступающее
в
результате
пассивации
электрода' часто не
препятствует
протеканию на том
)ке элек-
троде
других
аноднь!х
процессов' приводящих к о6разованию соединений
17
т1::петика
э!1ентродя. |]роцессов
257
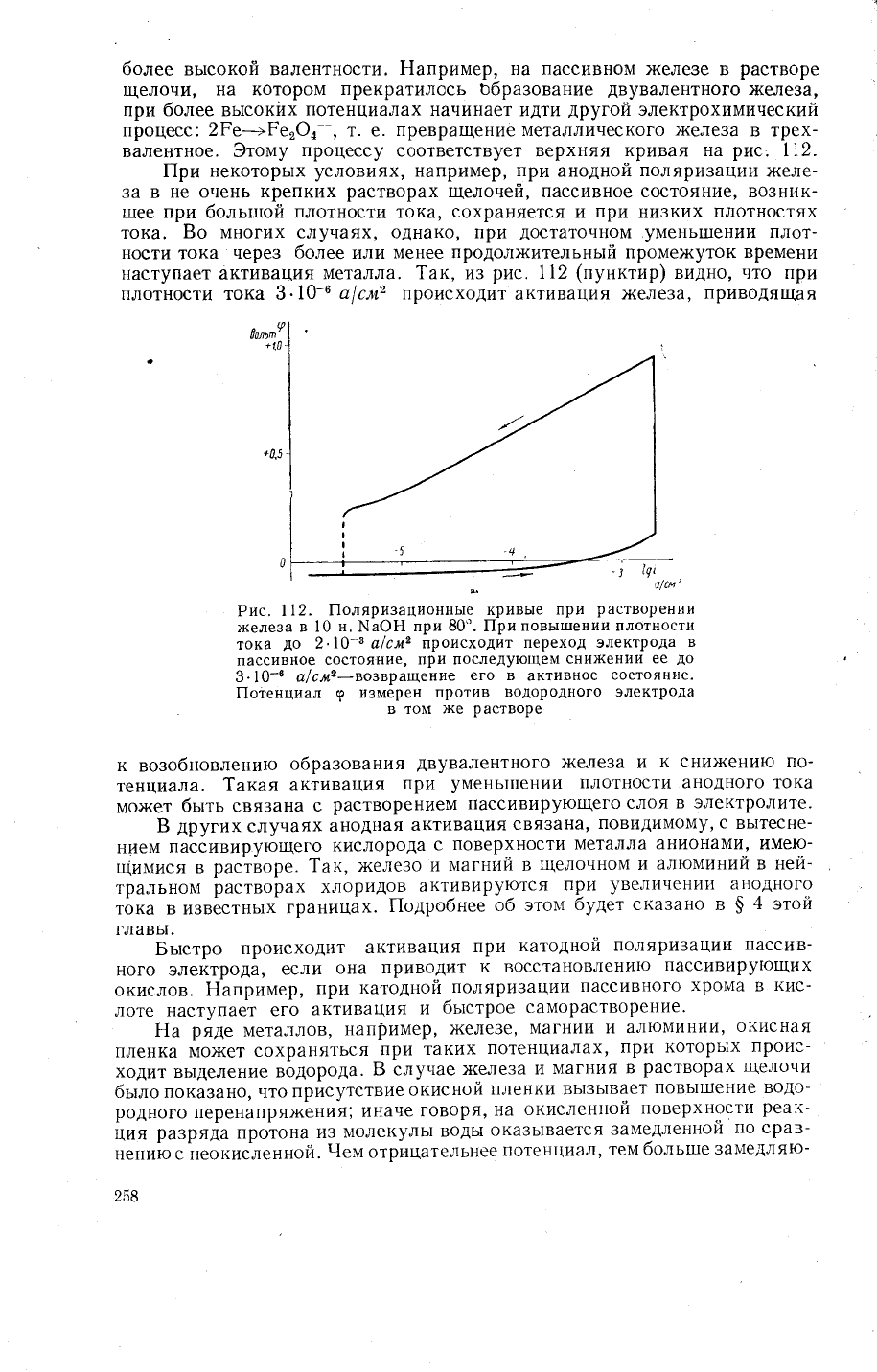
более вьтсокой валентности.
Ёапример' на пассивном )келезе
в
растворе
щелочи'
на котором
прекратилось ббразование
двувалентного
'келе3а'
при более вьтсокйх
потенциалах начинает
идти
другой
электрохимический
процесс:
2Ре_>Ре'Ф4
,
1.е.
превращение металлического желе3а
в трех-
валентное. 3тому
процессу
соответствует верхняя
кривая на
рис,
112.
|[ри
некоторь|х
условиях'
например,
при
анодной
поляризации
}келе-
за в
не о(1ень крепких
растворах
щелочей,
пассивное состояние' возник-
1]]ее при
6ольп:ой
плотности тока'
сохраняется
и
лри
низких
плотностях
тока.
Бо многих случаях' однако' при
достаточном
.умень[пении плот-
ности
тока
нерез
более
ил\4
менее продолх{итель.нь:й промех(уток
времени
}-|аступает актив^]\ия
металла. 1ак, из
рис.
112
(пунктир)
видно,
(]то
при
плотности тока 3.|0_в
а/см2
происходит
активация
х{еле3а'
приводящая
0,',19
+!.8
Рис.
112.
|1оляризационнь!е
кривые
при
растворении
железа
в 10
н.
$аФЁ
при
80".
||ри
повы1шении плот11ости
тока
до
2.10-3 а|см2
происходит
переход электрода
в
пассивное
состояние,
при последующем
сни)кении
ее
до
3.|0_в
а|см2_возвращение
его в
активное
состояние.
||отенциал
9
и3мерен
против водородного
электрода
в том
}ке
растворе
к
возобновлению
образования
двувалентного
)келе3а и
к сни)кению по_
тенциала.
1акая активация
при
умень1!]ении
плотности аводного тока
мо}кет
бьтть связана
с
растворением
пассивирующего
слоя
в электролите.
Б
других
случаях
анодная
активация
свя3ана'
повидимому'
с
вь1тесне-
нием
пассивирующего
кислорода
с
поверхности
металла
анионами'
име|о-
щимися
в
растворе.
1ак,
х{елезо
и
}1агний в
щелочном
и
а.птоминий
в ней_
тральном
растворах
хлоридов
активируются
при
увели!1ении
а}]одного
тока в и3вестнь1х
границ'х.
|1одробнее
об этоп{
булет сказано в
$
4
этой
главь!.
Бь:стро
происходит
активация
при
катодной
поляри3ации
пассив-
ного электрода'
если
она
приводит
к восстановлени1о
пассивирующих
окислов. Ёапример,
при
катодной
поляризации
пассивного
хрома в
кис-
лоте наступает
его
акт|4ващия
и
бьтстрое
саморастворение.
Ёа
ряде
металлов'
например,
)келе3е,
магнии
и алюмин|1и'
окисная
пленка мо}кет
сохраняться
при
так|1х
потенциалах'
при
которь]х
проис-
ходит
вь]деление
водорода.
Б слунае
х{еле3а
и
магния
в
растворах
щелочи
бьтло показано' что
присутствие
окисной
пленки вь{зь!вает
повь|1пе}{ие водо_
родного
перенапря}кения;
иначе
говоря'
на
окисленной
поверхности
реак-
ция
разряда
протона
из
молекуль!
водь1
оказь!вается
замедлен|{ои
по срав-
нени1о с нео
кисленной.
9ем
отрицательнее
поте
нциал' тем
бол
ьгпе за}1едл
яю-
258
щее
действие
окисной..пленки
!8!.
при
длительной
катодной
поляри3ации
ил|1
лр|\
механической
зачистке поверхности
мо}кно
удалить
окисную
пленку
и
тем
сни3ить
водородное
перенапрях{ение.
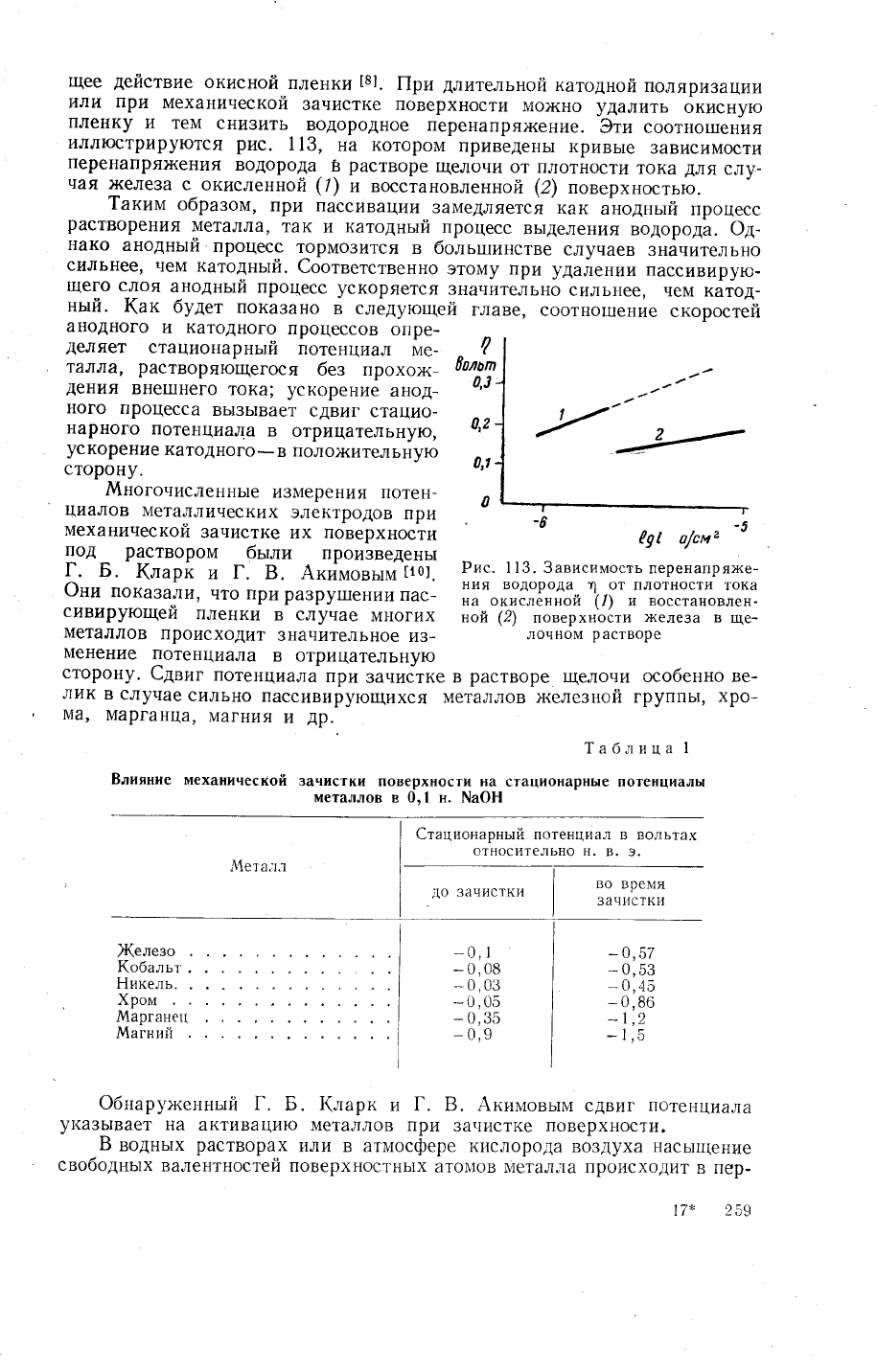
3ти соотно1пения
иллюстрируются
рис.
1 13,
на котором
приведень]
кривь1е
3ависимости
перенапря)кения
водоро4а.
-Р
растворе
щелочи
от плотности
тока
для
слу-
чая
х{еле3а
с
окисленной
(/)
и восстановленной
(2)
поверхностью.
[аким
образом,
при
пассивации
замедляется
как
анодньтй
процесс
растворения
металла'
так
у1
катодньтй
пРоцесс
вь]деления
водорода. Фд_
нако
анодньлй
процесс
тормо3ится
в больптинстве
случаев
значительно
сильнее'
чем катодньтй.
€оответственно
этому
при
удалении
пассивирую-
щего
слоя
анодньтй
пРоцесс
ускоряется
значительно
сильнее'
чем катод_
ньлй.
1(ак
будет
показано
в слёдующей
главе,
соо'нотпе,й"
"'.'р'.'"й
анодного
и
катодного
процессов
опре_
деляет
стационарнь:й
потенциал
ме-
талла|
растворяющегося
без прохо)<-
дения
вне11]него
тока;
ускорение
анод-
ного
процесса
вь!3ь|вает
сдвиг
стацио-
нарного
потенциала
в
отрицательную'
ускорение
катодного-в
полох{ительную
сторону.
}[ногочисленнь|е
измерения
потен-
циалов
[{€12а'1!]490€ких
электродов
при
механической
зачистке
их поверхности
1оА-
р3створом
6ьтли
прои3ведень|
г.
Б.
|(ларк
и
[.
Б.
Акймовь]м
!10].
Фни
показали,
нто лри
разру1пении
пас-
сивирующей
пленки
в
случае
многих
металлов
происходит
3начительное
из-
'
-о
-4
!9| о/см2
Рис. 1 13. 3ависимость
переналря)ке_
ния водорода т|
от
плотности тока
на окисленной (/) и восстановлен-
ной
(2\
поверхности
желе3а в
ще_
лочном
растворе
менение
потенциала
в
отрицательную
сторону.
6двиг
потенциала
при
3ачистке
в
растворе
щелочи
особенно ве-
лик
в
случае
сильно
пассивирующихся
металлов >келезной группь{'
хро-
[3,
марганца'
магния
и
др.
1аблица
1
8лияние механической
3ачистки поверхности
на стационарные потенциаль|
металлов
в 0' 1 н. !п,[аФЁ
€тационарнь:й потенциал в
вольтах
относительно н.
в. э.
Ае:'а',т",':
до
зачистки
во вреп'1я
зач11стки
,&1агн иЁт
*0,1
-
0,08
-
0,03
-
0,05
-
0,35
-
0,9
-0,5'/
_0'5з
-
0,46
-
0,86
-1,2
-
1,5
9бнарух<еннь:й
г.
Б. |(ларк
и
[.
Б. Акимовь:м
сдвиг
потенциала
ука3ывает
на
активацию металлов
при
зачистке поверхности.
Б
водньтх
растворах
или в атмосфере кислорода
во3духа
нась]щение
свободньтх
ва"центностей
поверхностнь1х
ато\1ов птетал.'|а происходит
в пер_
!7* 259

вую
очередь
за
счет образования
окиснь1х
слоев, возникновение
которь1х
имеет
основное
з?ачение в явлениях
пассивности.
Фкисньте слои, образую-
щиеся
в воднь1х
растворах'
могут содер}{{ать
химически связанную
во-
ду.
Фднако в
образовании
пассивирующих
слоев могут
участвовать
и
дру-
гие
группь1 атомов или
молекуль1'
достаточно
прочносвя3аннь]е с
металлом.
Б
дальнейгпем
мь|
еще
остановимся на таких
примерах.
$
2.
АдсоРБционнь|в
и
ФА3овь!в
пАссивиРующив слои
3а
отдельнь!ми исключениями
в
настоящее
вреп{я
не существует боль_
|ших
разногласий
мех{ду
ра3личнь1ми
исследователями
по
вопросу
о
ро-
.ци окиснь1х слоев
в явлениях
пассив!1ости.
Аначе
обстоит' однако'
дело
с
представлениями
о строении
этих слоев.
3
то время
как
некоторь1е ис-
следователи
счита}от'
что
для
пассивирования металла
достаточно
образо-
вания
мономолекулярного
слоя
или
да){{е
заполнения только
части
по_
верхности
металла,
другие
принимают' что
пассивирующие окисльт обра-
зуют слой,
являющийся
отдельной
фазой
и
механически
изолирующий
металл
от
окрух{атощей
средь1.
3десь мь]
только
в{ратце коснемся этого
вопроса'
исходя
из
наиболее однозначнь1х экспериментальнь]х
даннь1х
и
ограничиваясь,
по возмо)кности'
теми егосторонами'
которь1е
имеют 3на-
чение
для
электрохимической
кинетики.
Фписанньте
в
предь1дущем
параграфе
опь1ть]
пока3ь1вают'
что значи-
тельное замедление
скорости
растворения
платиньт
достигается
у)ке
при
заполнении
сравнительно
небольш:ой
части
ее
поверхности
атомами
кислорода.
1акая
пассивация, очевидно'
никак
не мо)кет бьтть
объ-
яснена
образованием
и3олир}ющей
пленки. Бьтло вьтска3ано
предполо-
)кение'
согласно
которому и3менение
к14не"[ики анодного
процесса
в этом
случае
целиком
определяется
изменением
строения
двойного
электриче_
ского
слоя
|9].
(ак
это
следует и3 адсорб:1ионнь1х
опь1тов'
описаннь1х
в
введении'
появление на
поверхности металла слоя адсорбированного
кислорода' благодаря его
дипольньтм
свойствам' вь|3ь1вает глубокие
и3ме-
|1ения
в
строении
двойного
слоя'
резко
сних{ая
ту
часть скачка
потенци-
ала
металл/раствор,
которая
зависи'|
от
свободнь1х зарядов
поверхности
металлов и ионов
двойного
слоя, ил\4
дах<е
меняя ее знак на
обратньтй'
Б
$
3 главьт 1!
указьтвалось,
что и в
случае некоторь]х
других
окисли-
тельнь]х
процессов
появление окиснь1х
слоев сопрово)кдается
умень1пе_
нием
скорости
реакции.
{отя сушествование
свя3и мех{ду
изменением
строения
двойного
слоя и
пассивацией несомненно, необходимо отметить,
что
объяснение
эффектов
пассивац14и одним только
и3}1енением
электри_
ческого
поля
у
поверхности металла является
менее оправданнь1м'
чем'
например,
аналогичное
объяснение
в
случае повь11пения перенапря)кения
водорода
при
адсорбции
катионов
(см.
главу |11).
!,ействительно'
в
то
время
как
валентно-нась!щеннь|е
и
гидратированнь1е ионь1 влияют
на
тече-
ние
электрохимического
процесса
в первую
очередь благодаря
со3давае-
мому ими
электрическому
полю' присоединение к
поверхности металла
атома
кислорода
изменяет
ее
химическу}о
природу
и мо}кет
различнь]ми
путями
воздействовать
на ее
реакционную
способность.
|1ри исследова|1ут|4
природь1
пассивиру1ощих слоев
ну)кно
учить1вать'
что
пассивация часто
сопрово)кдается
другими
|1араллельнь1ми
аноднь1ми
процессами.
Б
качестве примера
рассмотрим
количественнь]е
соотно1пе_
|1ия
при
лассиваци|1 )келеза в
щелочнь1х
р
аствора
х.
(ол
ичество
кисло
рода'
необходимое
для
перевода х{елеза
(поверхность
которого предваритель_
но
бьтла
освобо>кдена от окиснь1х слоев)
в
пассивное
состояние
определялось
260
.
