Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов
Подождите немного. Документ загружается.

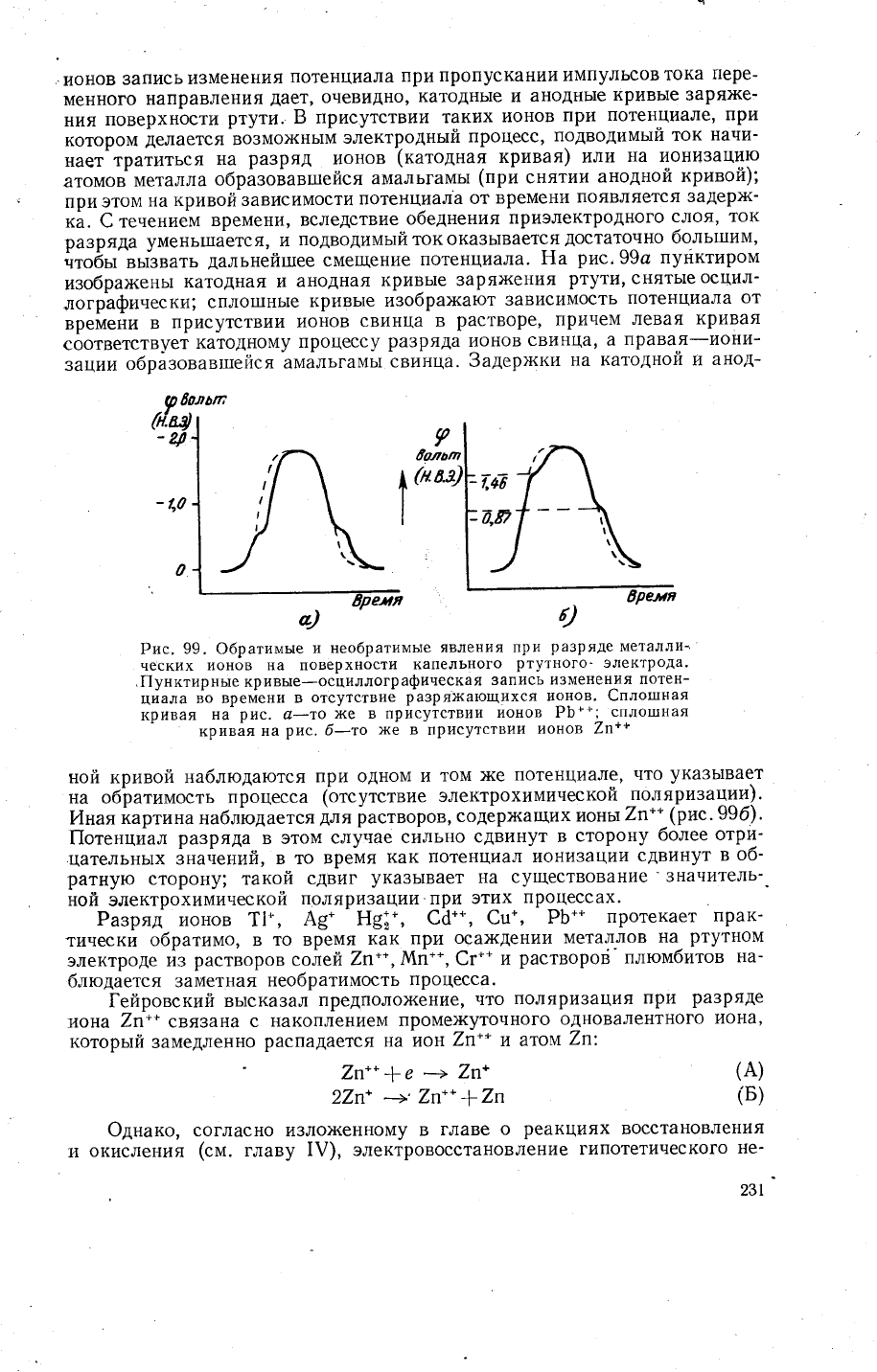
ионов
запись
изменения
потенциала
при пропускаъ|14|т
импульсов
тока
пере-
менного
направления
дает,
очевидно'
катоднь1е и
аноднь1е
кривь]е 3аря>ке_
ния
поверхности
ртути.
Б присутствии
таких
ионов
при
потенциале'
при
котором
делается
во3мо'<нь1м
электооднь|й
процесс,
подводимый
ток
начи_
нает тратиться
на
ра3ряд
ионов
(катодная
кривая) |тли
на ионц3ацию
айомоЁ
металла
обр!зоЁавшейся
амальгамь1
(прй
съ|яти|1
анодной
кривой);
при
этом
на
кривой 3ависимости
потенциала
от
времени
появляется
задер>*<_
ка. € течением
времени, вследствие
обеднения
приэлектродного
слоя' ток
ра3ряда
умень1пается'
и
подводимь1й
ток
ока3ь]вается
достаточно
больтпим,
ч.о,3,'
вьйвать
дальнейшее
смещение
потенциала.
Ёа
рис,99с
пуйктиром
и3обрах{ень1
катодная и
аноАная
кривь!е 3аря}кения
ртути'
снять1е
осцил_
лографически;
спло1пнь!е
кривь1е
и3обрах<ают
зависимость
потенциала
от
времени
в
присутствии
ионов
свинца в
растворе,
причем
левая
кривая
соответствует
катодному
процессу
разряда
ионов
свинца' а
лравая-ион\4-
зац|1и
о6рйзовавгпейся
амальгамь1
свинца.
3адерх<ки
ъ1а
ка1одной и
анод-
со
6ольтт
с!аа:
-ц
-10
0
7п**
*е
-->
7п+
27п'
--->'7п**
|7п
Фднако,
согласно и3ло)кенному
в
главе
о
реакциях
восстановления
и
окисления
(см.
главу
|!), электровосстановление
гипотетического
не_
6)
@)
Рис.
99. 0братимь:е
и
необратимь!е
явления при
ра3ряде
ческих
ионов |{а поверхности
капельного
ртутного'
электрода.
,|[унктирнь:е кривые-осциллографивеская
запись
изменения
потен-
циала
во времени
в
отсутствие
разряжающихся
ионов. €плотпная
кривая
на
рис.
@_то
)ке в
присутствии
ионов РБ**;
сплотпная
_
кривая
на
рис.
б_то
>ке
в присутствии
ионов
7п++
ной
кривой
наблюдаются
при одном
и
том
)ке
потенциале'
что
ука3ь]вает
на об}атимость процесса
фтсутствие
электрохимической
поляризат{ии).
Анаякартина наблйдается
для
растворов,
содерх{ащих
ионы
7л--
-(рис.99б).
|1отенцйал
ра3ряда
в этом
случае
сильно
сдвинут
в
сторону
более
отри_
цательнь1х
значений,
в то
врейя
как потенцу1ал
ион|1зации
сдвинут
в
об-
ратную
сторону; такой
сдвиг
указь1вает
на
существование'значитель-.
ной
электрохимической
поляризации при
этих
процессах.
Разряд
ионов
т|*,
А8. Б8|-,
€0**, €ц*,
Рь**
протекает
прак-
тически
обратимо, в
то время
как
при
оса}кдении
металлов
на-
ртутном
электроде
и3
растворов
солей
7п**,мА*',€г**
и
раствороЁ
плюмбитов
на-
6людается 3аметная
необратимость
процесса.
[ейровский
вь1сказал
предполо}кение'
что
поляризация
при
разряде
'1она
7л'"
свя3ана
с
накоплением
проме)куточного
одновалентного
иона'
которьтй
замедленно
распадается
на ион
7(|''
и атом
7л:
(А)
(Б)
231
устойчивого
однозарядного
|то|та 7л+
дол)кно'
вероятно'
идти легче,
а
не
труднее
'реакции
(А),
и
естественнее
предположить'
что
в случае
ра3ряда
ионов
цинка
электрохимическая
поляри3ация
связана
с
первь!м
элемен_
тарнь_1м
актом электрод!{ого
процесса
(А),
а
не
с
последующими
стадп-
ями
!3?].
.&[о>кно предполох(ить'
что подо6ньте
)ке
соотно1пения
имеют
ме_
сто
и
при
3амедленном
разряде
других
металлических
ионов'
хотя
имеется
еще
недостаточное
количество
данньтх для
окончательнь1х
вь]водов.
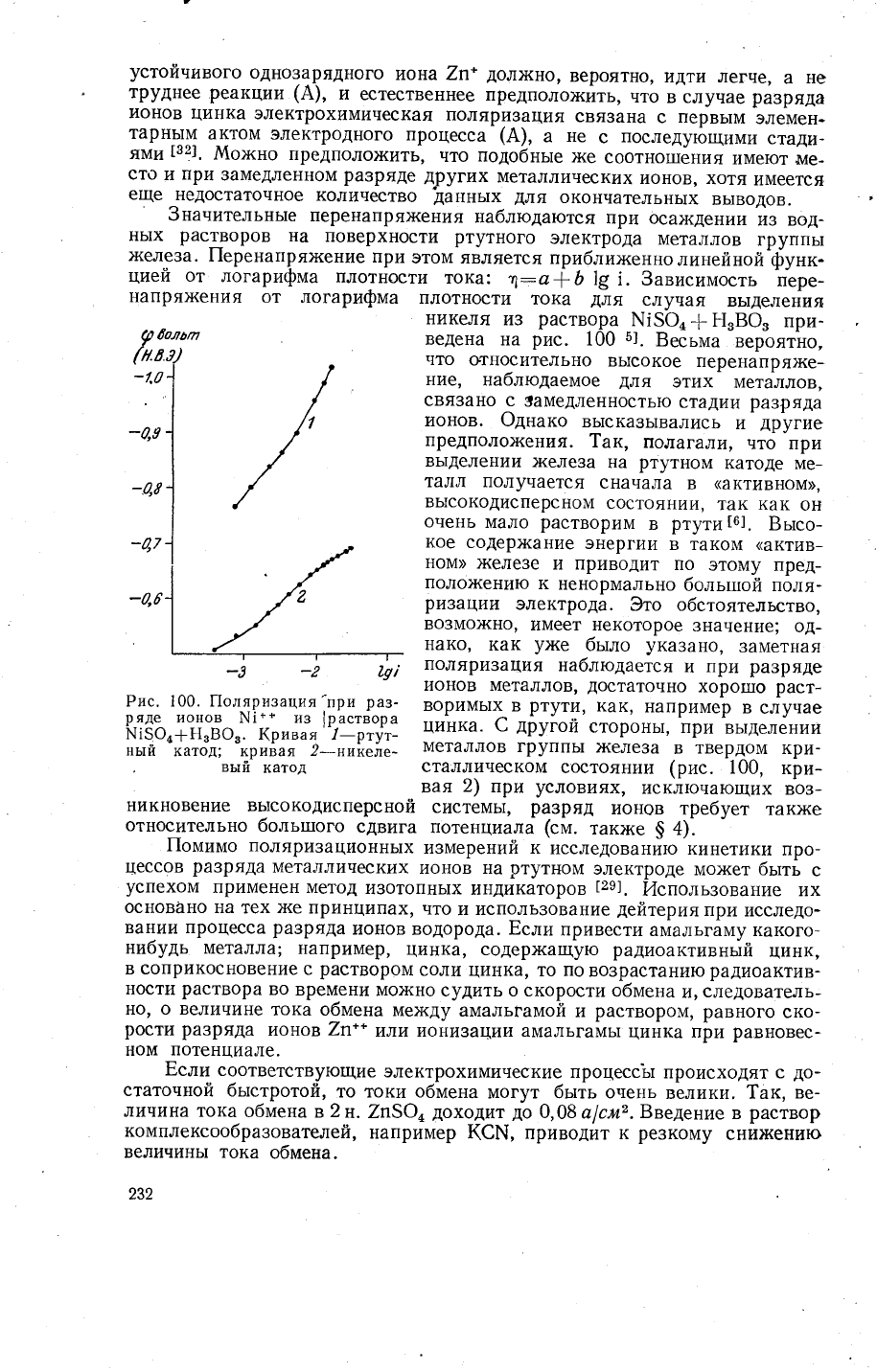
3начительнь1е
перенапрях(ения
наблюдаются
при
осах<дении'из
вод-
нь1х
растворов
на
поверхности
ртутного
электрода
металлов
группь|
х(елеза.
||еренапря)кение
при
этом является
приблих<енно
линейной'функ-
цией
от
логарифма
плотности
тока:
1=а|0
19
|. 3ависимость
пере-
напря)кения
от логарифма
плотности
тока
для
случая
вь|деления
никеля
и3
раствора
\15Фц
{
Р1'8Ф,
при-
ведена
на
рис.
100
5].
Бесьма
вероятно'
что
0гносительно
вь1сокое
перенапря)ке-
ние'
наблюдаемое
для
этих
металлов,
связано с
5амедленностью
стадии
ра3ряда
ионов. Фднако
вь1сказь1вались
и
другие
предполо)кения.
1ак,
полагали'
что при
вьтделении
)келе3а
на
ртутном
катоде
ме-
талл получается
сначала
в
(активном))'
вь1сокодисперсном
состоянии,
так
как
он
очень
мало
растворим
в
ртути
!о1.
Бьтсо-
кое
содерх<ание
энергии
в таком
(актив_
ном)
)келезе
и приводит
по
этому
пред-
поло)кению
к
ненормально
больтцой поля-
ризацит4
электрода.
3то обстоятельство'
возмо>кно'
имеет некоторое
значение;
од-
нако'
как
у)ке
бь;ло
указано'
3аметная
поляри3ация
наблтодается
и
при
разряде
ионов металлов'
достаточно
хоро|по
раст_
воримь1х
в
ртути'
как'
например
в
случае
цинка.
€
другой
сторонь1' при
вь1делении
металлов
группь|
)келеза
в
твердом
кри-
сталлическом
состоянии
(рис. 100,
кри-
вая
2)
при
условиях'
исключающих
во3-
никновение
вь]сокодисперсной
системь1'
разряд
ионов
требует
так>ке
относительно
больтпого
сдвига
потенциала
(сй.
таюке
$
4).
||омимо поляризационнь1х
измерений к
исследованйю
кинетики
про_
цессов
разряда
металлических
ионов на
ртутном
электроде
мо}{{ет бьтть
с
успехом
применен метод
и3отопнь]х
индикаторов
г29].
йспользование
их
ос}1овано на тех х{е
принципах'
что
и
исполь3ование
дейтерия
при
исследо-
ван|ти
процесса
ра3ряда
ионов
водорода'
Рсли
привести
амальгаму какого_
ни6уАь металла;
например'
цинка'
содер}кащую
радиоактивнь1й
цинк'
в соприкосновение
с
раствором
соли
цинка'
то по
во3растанию
радиоактив_
ности
раствора
во
времени
мо)кно
судить о скорости
обмена
и'
следователь-
но' о величине
тока обмена
ме)кду
амальгамой
и
раствором'
равного
ско_
рости
разряда
ионов
7[|'*
или ионизации амальгамь1
цинка
при
равт{овес_
ном
потенциале.
Рсли
соответствующие
электрохимические
прошессы
происходят с
до-
статочной
бьтстротой,
то токи обмена
могут бьтть очень
велики' 1ак,
ве-
л|1чи11а тока
обменав2н.7п3Ф,
доходит до
0,03
а|см2.
Бведение
в
раствор
комплексообразователей,
например 1(€|х1,
приводит к
резкому
сних{ени1о
величинь| тока
обмена.
232
-ц8
_ц7
-ц0
-3
-2
ц/
Рис. 100. |1оляризация'при
раз_
ряде
ионов
ш!*" из
|раствора
ш|5о4+нзво3.
!(ривая 1-ртут-
ньтй
катод; кривая
2-никеле-
"
вь1й
катод

$
3.
явлвния'
нАБлюдАвмь!в
пРи
во3никноввнии
и Роств новой
ФА3ь]
3 тех
случаях,
когда в
результате
процесса
электрооса}|{дения по-
является
новая
фаза, условия разряда
ионов
приобретают характернь|е
особенности.
3
начальньтй
момент
появления новой
фазьт
особенности
эти
вь1ступают
как в случае
во3никновения
твердого металлического кристал-
ла, так
и
при
возникнове|ти|1
калли
х<идкого
металла' например'
ртути;
однако
при
дальнейтпем
росте
поверхность
кристалла
и
поверхность >л(идко-
сти
в
некоторь]х
отно|пениях
ведут
себя
по-разному. ]очки >кидкой
по-
верхности в среднем
энергетически
равноценнь1'
поэтому
безразлинно,
в
какой точке на
поверхности
х{идкого
металла
осах<дается
атом, обра-
зующийся
при
разряде
иона.
йначе
обстоит
дело'
когда
в
результате
электрооса}кдения
ионов
растет
кристалл твердого металла.
||ре>кде нем
перейти
к
обсух<дению
условий
протекания процесса
во3никновения
и
роста
металлических кристаллов
в
результате
разряда
ионов
(,роце"с,
электрокристаллизации),
напомним
некоторь]е основнь]е
представления о механи3ме
обьтчной
кристаллизации,
не сопровох(да}о-
щейся
переходом электричества
чере3
границу
ра3де.,]а.
Фсновьт этого
направления11ауки
бьтли зало>кеньт
работами
[>к.
Б.
[иббса и
русского
ученого
[.
Б.
Бульфа.
Б последние
десятилетия
теория заро)кдения и
роста
кристаллов
получила зна11ительное
развитие
благодаря
исследова-
ниямФольмера,
€транского
и
Ар.3десь
мь1 смо)кем
коснуться
ли1|]ь
немно-
гих
и притом самь]х
элементарнь1х
сторон этого ва)кного
вопросд
|7'
8,
91.
{арактерной
и
давно
известной
осо6енностью
процесёа
во3никновения
новой
фазьт
является существование
начального
пересь]щения. |!редполо-
)ким'
что
мь|
хотим путем охла>кдения вь1звать
кристаллизацию соли
и3
раствора.
Бсли
растворимость
соли
падает
с
пони}кением температурь],
то, бхла>кдая
раствор'
мь] мо)кем
достигнуть
такого состояния'
при
кото-
ром
концентрация
раствора
соответствует
нась1щению' т. е.
раствор
мо)кет
находиться в
равновесии
с твердь!м кристаллом.
|!ри этом' однако'
еще
не начнется вь]деление
новой
фазьт.
.[,ля
осушествления
его в
измеримьтй
проме}куток времени
необходимо,
нтобьт концентрация
раствора
превь{сила
в
некотором определенном
отно1пении
равновесную
концентрацию, или'
как принято говорить, что6ьт
бьтла
достигнута
некоторая степень
пересь1_
щения.
|!ересьтщение
в
3начительной
мере сних<ается'
если
в
раствор
ввести
кристаллик того
)ке
вещества'
на
ко-тором мо>кет
происходить
дальнейтшее
отлох(ение и3
раствора.
Фблегчение кристаллизацути
мо)кет
бьтть вьтзвано
и
другим
твердь]м телом' если
его кристаллическая
ре1петка
достаточно
6лизка
к
ре1петке
вь1деляющихся
кристаллов, в частности' если
оно
мох<ет
образовьтЁать изоморфнь]е
смеси с веществом' вь!деляющймся
из
раствора^
9вление
пересь]щения объясняется следующим
образом.
)/словие
равновесия
ме)кду
двумя
фазами
определяется
равенством
химических
потенциалов ка'(дого компонента в
обеих
фазах.
{имический
потенциал
кристалла'
образу:ощегося в
условиях,
близких
к
равновеснь]м'
дол)кен
бьтть
поэтому
равен
химическому
потенциалу
того
же
вещества в
нась]щен-
ном
растворе.
Фднако
химический
потенциал кристалла' если он
достаточно
мал' 3ависит
от его
размеров;
при сильном
умень1пении размера
кр,1сталла
величина
химического
потенциала
увеличивается.
3то
происходит
вслед-
ствие того' что в
маленьком кристалле
относительно велика
доля
ато-
мов, находящихся на
поверхности и менее
прочно
свя3аннь1х
с
остальнь1ми
атомами'
чем
атомь1
в середине кристалла.
||оэтому 1!{аленькие
кристалль|
неустойнивь|
по отно1шению к нась1щенному
раствору'
находящемуся
в
равновесии
с
боль1пими кристаллами.
Фчень
маленькие
кристалль!,
233

обра3овав1пиеся
в таком
растворе
вследствие
случайнь]х
флюктуаций
кон'
центрашии,
вновь
!аспадаются.
[ля
того
чтобьт
кристалл мог
расти
в
рас_
творе,
да)ке
если
концентрация
последнего больп:е концентрации нась1-
щения,
необходимо,
н{обь;
размерь1
кристалла
превь1сили некоторую
критическую
величину'
при
которой
его
химический
потенциал сделается
равнь1м
химическому
потенциалу
растворенного
вещества в
окрух<аю-
щей
среде,
т. е.
при
которой
раствор
сделается
нась1щеннь1м
по отно1шению
к кристаллу
данного
ра3мера.
1аким образом,
пРоцесс
во3никновения
кристалла
начинается
с создания
зародь]1па
минимальной
величинь1'
для
чёго
нео6ходимо
затратить
некотору}о
работу
(см.
них<е).
Фневидно, нто
работа
эта буАет
тем мень1пе' и'
следовательно,
во3никновени_е
зародь]1па
тем
вероятнее'
чем мень1пе
критические
ра3мерь1
зародьт1па.
Бьтполнение
этого
условия
делается
возмох{нь]м
при
во3растании
химического
потен-
1\иала
растворенного
вещества, т. е.
при
увеличении
степени
пересьтщенйя
раствора.
Фтсюда
следует'
что
облегчение начала
кристалл11зации
при
увеличении
пересь|щения
связано
с тем'
что критические
размерь1
заро-
дь1ша'
а
следовательно'
и
ра6ота,
необходимая
для
его
со3дания'
умень-
1паются
по мере
увеличения
пересь1щения' а
вероятность его возникнове_
ния
увеличивается.
йзло>кенньте
до
сих
пор вь1водь1 не связань1
с закономерностьто
распо-
лох{ения
атомов
в
кристаллической
реш]етке
и
поэтому в
равной
степени
применимьт
и
к случаю
во3никновения
)кидкой
фазьт,
например'
капелек
из
пересьтщенного
пара.
Рассмотрим
количественнь1е соотно1шения
сначала
на
последнем
примере, так-как
они
в
этом случае
оказь1ваются
более
про-
сть|ми.
Фбозначим
концентрацию
нась1щенного
при
данной
температуре
пара
через с..
-1огда
радиус
,'
капельки'
которая мо)кет н_аходиться
в
рав_
новесии
с
пересь1щеннь1м
паром
концентрац|1и с
при
той >ке
температуре
и
которая'
следовательно,
мо)кет
слу)кить
3ародь11пем
для
роста
больгших
капель'
определяется
соотно1пением
1омсона
(1(ельвина)*:
Р7
\л!-:Р
,
где
о-поверхностное
натя)кение
)кидкости' а
0-ее
молекулярный
объем.
3то соотноцение
легко
вь|водится
термодинамическим
путем.
Аля
созда-
ния такой
!<алли 3ародь11ша
из
окрух<атощей
средь|
необходимо
затратить
работу
А,
равную
. .1
А:
5
о5,
(252)
где
5-поверхность
каллу||
равная
4тг2'
Ёа
первьтй взгляд
мо)'(ет
-показаться
непо!:ятньтм,
нто эта
работа
равна
*
'',
а
не
о5.
|1оследнее
бьтло бьт,
действительно'
правильно'
если
бьт капля
образовьтвалась
из
}кидкой
фазьт,
||ли'
т1ри
постоянном
об-ьеме системь],
из нась1щенного
пара,
находящегося
в
равновесии
с
>кидкой
фазой,
имеющей
плоскую
поверх-
ность.
|!ри
образовании
капли
и3
пересь1щенного
пара мо>кно'
однако'
сначала вь]играть
работу;
переведя
его и3
пересь1щенного
состоя|1|\я
в
состояние
нась1щения.
3тот
вь1игрь]1п
равен
Р[!п9-
н6
моль
и'
следователь-
но'
составляет
!!!
р7у1-:-
3
о
"'"'с"
-
с"-
например'
н.
к.
А
д
а м, Ф_изи:<а
и
тех._теор.
1''_р*,
й._л.'
1947,
стр.
э!;
).
т(.
явлений,
[ос.
йзд-во тех.-теор.
лит'рь1,
л.'
1936'
(251)
(253)
химия
поверхностей,
[ос.
изд_во
Р а
й
д
и
л,
)(имия
поверхностных
стр. 36.
234

для
количества
вещества, необходимого
для
образования
ка\|лис
радиусом
г.
||одставляя
в
вь!ра>кение
(253)
знанение
&7|п|
и3
уравнения
(251),
св
получаем
*#
*',"*:|*г,':
}"з.
Бьтчитая
величину
{
'5
из величинь1
работьт
о5, которую
ну)кно 3а-
тратить
для
образования
капли
и3
нась|щенного
пара, мь| получаем
при_
веденное в
уравнении
(252)
значение
А.
|1одставляя
в
(252)'3начение
3:4тг2,
вь1численное
при
помощи
уравнения
(251),
полунаем
,
16тс3о2
^:
3л,Р
Ф *'
(254)
-
(255)
(257)
(258)
3на-
отно_
(25э)
о"(
14з
уравнения
(255)
явствует'
нто
работа
образования
зародь;1ша
умень-
1пается
по п1ере
увеличения
степени
пересь1щен^"
*!,что
вполне понятно'
так
как при
этом
умень1паются
размерь|
капли-зародь]1па.
!г1:5 статистической
механи}(и следует' что
ме'{ду
работой
,4,
необходи_
мой
для
образования
капли'
и вероятностью этого
собьттия
Р
сушествует
соотно1пение.
А
||
:
Б.е_Ф, (256)
где
Ё-постоянная
Больцмана,
1. €.
$
{ш-''"'о
молекул
в
моле),
а
Б-
некоторьтй
фактор,
пропорциональности.
Ретшающее
значение
для
вели-
чиньт
|( имеет вь|ра'{ение
в показателе'
откуда следует' что вероятность
поя!вления
зародь11ша
новой
фазы
долх<на
резко
во3растать
при
увеличе-
нии пересь|щения.
[[1зло>кенньте
сообрах<ения
сохраняют свою с'1лу
и
для
кристалличе-
ского 3ародь1]'па'
с
той только
разницей,
что поверхностнь1е
натя)кения
ра3личнь]х
граней
в этом случае
имеют
ра3личнь1е
3начения.
||оэтому,
вместо вь1ра)кения
дляА,
приведенного
в
уравнении(252),
ну)кно
написать
1
А:+
)
'',5;,
где суммирование-
проводится
по
всем
равновеснь1м
граням
кристалла*.
3начения
работьт
образования
зародь11па-калл|1
или
кристаллйка
в
уравнени
ях.(252)и(257) относятся кслунаю
зародьтгпей'
которь1е во3ника1от
в
объеме
фазьт.
3ти
значения могут
бьтть
сушественно сни)кень1
(т.
е. веро-
*
Ёекоторое изменение
ну)кно
внести' очевидно' и в
уравнение
(251)''
так как
понятие
радиуса
неприменимо
к твердому кристаллику.
,[|.ля
кристаллика
термодина-
мически
равновесной
формы
можно всегда найти
тонку,
расстояния
которой
7', |'...,
7з;
от
г!аней
кристалла
удовлетворяют
условию
о1
62 6|
т:Б:"':т'
где
о1' о2... о,-поверхностные
натя)кения соответствующих
граней
([.
вульф).
чение
]-
в
уравнении
(251)
нух<но заменить
в
случае кристаллика
на любое из.
г"
.'с
{шении
т:
кттп
!_:2-!
.
св
п1

ятность
появления
3ародь]1ша
мо'{ет
бьтть
увелинена),
если
возникновение
]оБо*
фазьт
имеет
место
на
у)ке
существуйшей
поверхности
раздела.
|!о'-
Ё'"д,"Ё
о6стоятельство
опять
легче
всего
пояснить_на
примере
>кидкой
капли.
|[редполох<им,
что )кидкая
капля
возникает
не
в объеме,
а
|1а
твердой
плос^ой
стенке.
Фбозначим
через
о1 поверхностное
натях{ение
>кидкости''
через
б2-поверхностное
натя)кение
твердой
поверхности
в атмосфере
пара'
нерез
'''-пограничное
натя)кение
на
границе
)кидкость
/
твердое
тело'
нерез
51:велйяину
свободной
поверхност|4
ка{7ли
и чере3 5''-велинину
поъерхности
ра3дела
калля/
твердоетело.
тогда
при
помощи
тех
}ке
ра99ут_
дений,
кото,ь'е
приводят
в случае
свободной
капли
к
уравнению
(252),
мох(но
показать'
что
А:
+
(''5,
*
о::5:а
-:
оа5:э).
(260)
|1ри
полном
смачивании
б2:
б1
*
отя'
5т
:5тя
и
величина
А
обращается
в нуль;
в
других
случаях
она
буАет
919*""а
по
сравнени}о
со
значением'
которое
определяется
уравнением
(2.52)' лринем
это сни-
>кение
тем
боль!ше,
чём
луч1ше
смачивание
твердой
стенки
)кидкостью'
Физический
смьтсл
этого эфекта
3аключается
в
том'
что
работа
образова-
ния
зародь11ша
умень1пается
благодаря
вь1игрь]1пу
энергии'
связанному
с
в3аийодействи!м
ме)кду
частицами
твердого
тела
и х{идкости.
||одоб-
нь!м
х{е
образом
и
появление
трехмерного
кристаллического
зародь11па
облегчается
присутствием
твердой.
поверхности'
причем величина
этого
сни)кения
долх{на
3ависеть
от
природь1
поверхности,
на
которой
происхо_
дит
появление
3ародь1тша.
Аля
того
что6ьт
получить
представление
о
влия'
ни'
'риродьт
повёрхност11,
мох<но
использовать
уравнение
(260),
и3
кото-
рого
ви{но,
что
работа
А 6улет
тем
мень1пе'
чем
мень1ше
величина
о0
ъта
границе
ме)кду
у)ке
имеюфйся
и
вновь
о6разующейся.фазами.
||оэтому
сходство
ме)кду
кристаллическими
ре1петками
обоих
фаз
облегнает
по-
явление
кристаллического
зародь11ша.
(ак
видно
из
излох{енного'
явления
при
возникновении
зароды1па
новой
кристаллической
фазьт
во
многих
отно1пениях
аналогичнь]
наблю-
дающимся
при
появле|1ии
калли.
хотя
мех{ду
обоими
случаями
и
могут
]уйБ""']'.Ё
б'',-""
количественнь1е
ра3личия'
свя3аннь]е
хотя
бьт
с
тем,
что
поверхностное
натях(ение
о твердь|х
тел
имеет часто
гораздо
боль-
1пие
значения'
чем )кидких.
-
-_
€ушествейное
раздичие
ме>кду
х<идкой
и твердойфазой
обнару>кивает-
ся
прй
рассмотренйи
условий
их
дальнейшего
роста.
Б то
время
как
в
сду-
,'"
';^"!^'й
.поверхности
.дальней1пее
присоединение
-частиц
к
у}<е
обра-
3овав1шейся
кап'1е
происходит
беспрепятственно,
образование
ка)кдого
новогослоянагранирастущегокристаллапредставляеттрудности'до
йЁкотороа
степенй
сходнь!е
с теми'
которь1е
во3никают
при обра3ова|1|1|1
зародь11па
кристалла.
3то
происходит
потому,
что
различнь1е
поло}кения
ат6ма
(мьт
ограничимся
здесь
случаем
атомной
реш:етки)
на
грани
расту-
щего
кристалла
энергетически
неравноценнь1.
поясним
это
на
нескольких
простейших
примерах'
'
||редставий
себе
грань
кр'1стал'ла
кубинеской
системы'
разделенную
на
ряд
элементарнь1х
;чеек
наподобие
шахматной
доски.
Рассмотрим
раз-
личнь!е
поло)кения
атома
на
такой
грани
с точки
3рения
прочности
их
свя-
3и.
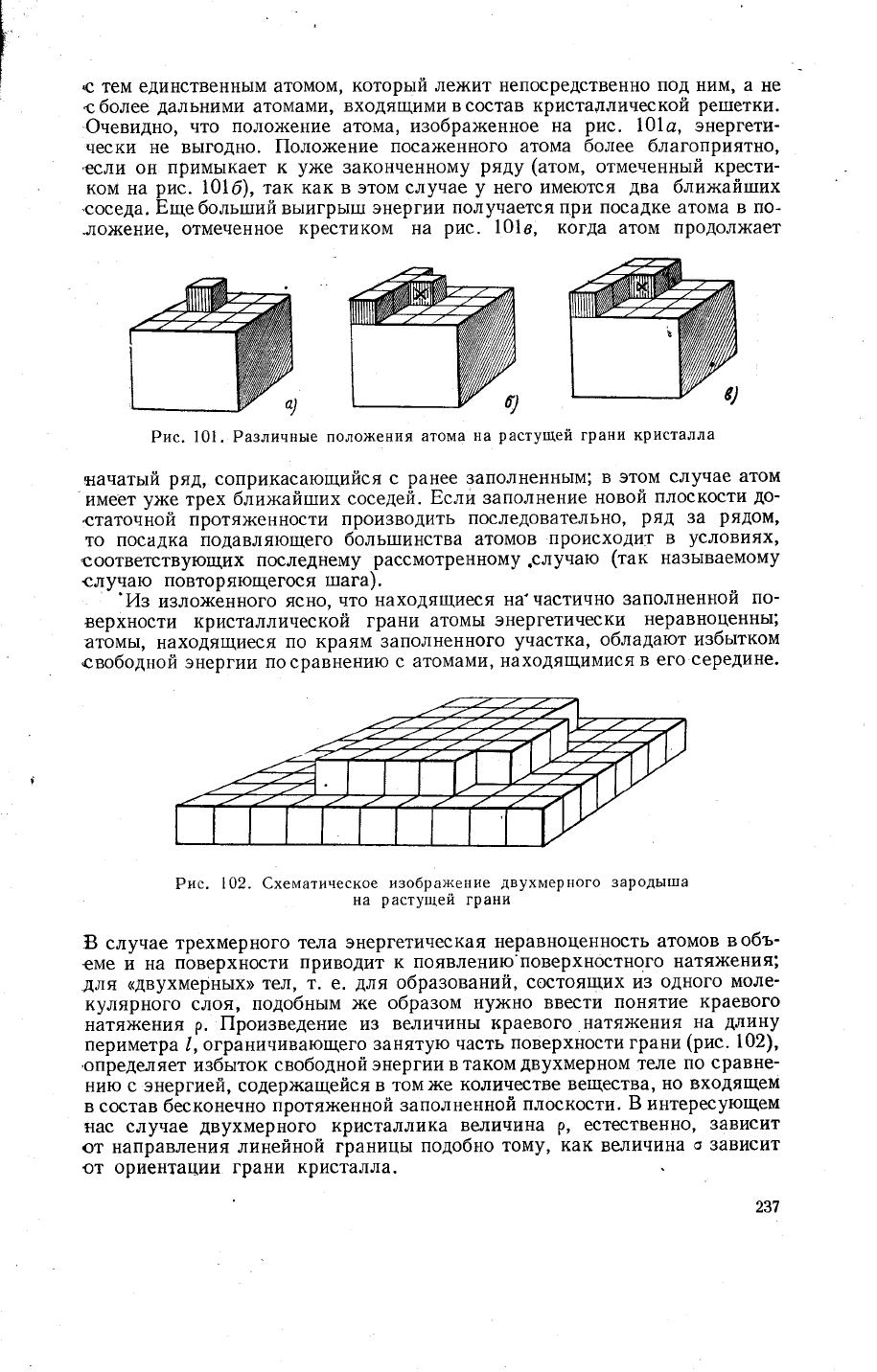
пусть
атом,
и3обра)кеннь1й
в
виде
ку6'1ка,
находится
на
середи[1е
гра_
ни
(рйс.
101а);
у
такъго
атома
только
один
бли>кайтлий
сосед'
а именно-
тот
атом'
которь]и
находится
под ним.
Бзаимодействие
рассматриваемого
атома
с
поверхностью
в
3начительной
мере
определяется
взаимодействием
236
[
ь
г
[
с тем
единственнь]м атомом'
которь]и
ле}кит непосредственно
под
ним'
а
не
с
более
дальними
атомами'
входящими
всостав кристаллической
ре1петки.
,0невидно,
что
полох{ение
атома,
изобрах<енное
на
рис.
101с, энергети-
чески не вь|годно.
|[оло>кение
поса)кенного атома
более благоприятно,
,если
он примь1кает
к
у)ке
законченному
ряду
(атом,
отмеченньтй
крести-
ком
на
рис.
101б), так
как в этом случае
у
него име}отся
два
блих<айгпих
соседа.
Бщебольгпий вьлигрьтгш энергии
получается
цри
посадке атома в по_
.ло'{ение, отмеченное
крестиком на
рис.
101в, когда
атом
продолх(ает
Рис.101. Различнь:е
поло)кения
атома
на
растушей
грани кристалла
*тачатьтй
ряд,
соприкасающийся
с
ранее
заполненнь]м;
в
этом
случае
атом
имеет
у)ке
трех
6ли>кайулих соседей.
Бсли заполнение
новой
плоскости
до_
статочной
протя)кенности
прои3водить
последовательно'
ряА
3а
рядом'
то
посадка
подавляющего
боль1шинства
атомов
происходит
в
условиях,
соответствующих
последнему
рассмотренному
рлучаю
(так
на3ь1ваемому
случаю
повторяющегося тпага).
'Аз
и3лох(ьнного
ясно,
что
находящиеся
нгчастично
3аполненной
по-
верхности
кристаллической
грани
атомы
энергетически
неравноценнь|;
атомь!,
находящиеся
по краям 3аполненного
участка,
обладают
избь:тком
свободной энергии
посравнению
с атомами,
находящ11мися
в
его
середине.
Рис.
102.
(хематическое
изобра>кение
двух1\,1ерного
зародь|ша
на
растушей
грани
Б
слунае
трехмерного
тела энергетическая
неравноценность
атомов
вобъ_
€ме и
на
поверхности
приводит к
появлению'поверхностного
натя)1(ения;
для
(двухмернь!х>
тел,
т.
е.
для
образований,
состоятт\их из
одного
моле_
кулярного слоя'
подобньтм
>ке обра3ом
ну){<но
ввести
понятие
краевого
натя'{ения
р.
|{роизведение и3
величинь1 краевого
натях{ения
на
длц-ну
периметра
!',огранинивающего
3анятую
часть
поверхности грани
(рис.
102),
'опреде.]1яет
и3быток
свободной
энергии в
таком
двухмерном
теле
по
сравне-
нию
с энергией'
содер'(ащейся
в том)ке
количестве
вещества'
но входящем
в состав бесконечно
йротях<енной заполненной
плоскости.
Б
интересующем
нае случае
двухмерного
кристаллика
величина
Р'
естественно'
3ависит
от
направления линейной
границь1
подобно
тому,
как
величина
б
3ависит
от ориентации грани
кристалла.
237

||ол
ьз
уяс
ь этими представле
н||ями,
мох{
но
пол
учить
ряд
соотно:'шений,
аналогичных
уравнениям
(251),
(256)
и
(257),
но относящихся
к
двухмер-
ному
кристаллику. 1ак,
мох<но показать'
что ме)кду
величиной пересьтще_
нпя
|1
линейньтми
ра3мерами
двухмерного
кристаллика'
термодинамиче_
ски
устойнивого
при
данном
пересь|щении'
существует
соотно1пение'
ана-
логичное
уравнению
(25!)'
в
которое,
однако'
вместо
величинь1поверхно_
стного натях<ения
входит
краевое
натяжение
р.
3то соотно1пение
опреде-
ляет
величину
двухмерного
кристаллика,
которь:й
мох(ет слу>кить
в
ка-
честве
3ародь11па
для
образова11ия
нового слоя
на
данной
грани.
[ля
ра-
ботьт образования
такого
зародь|1па
.4,
полунается
вьтра>кение,
которое
только численным
коэфициентом
отличается
от
вьра)кения
для
работьп
образования
трехмерного
3ародь1тла
(257):
А,:+2р'|,.
(261)
€уммирование
в правой
части
уравнения
(261)
нух<но
производить
по
всей
длине
периметра'
ограничивающего
двухмернь{й
зародыгп.
}1окду
вероятностью
во3никновения
двухмерного
зародь]1па
и
величиной
/1
су-
ществует
соотно1пение'
полностью
аналогичное
уравненито
(256),
А1
у|: вр_нт,
(262,
где
{'-такх<е
некоторьтй
фактор
пропорциональности.
Ёзло:кенньте
сообрах<ения
приводят
кследующей
картине
роста
крис-
талла. ||ри некотором (небольптом)
пересь1щении
на
законченном
слое мо-
гут
достаточно
часто
возникать
двухмернь!е
3ародь|1пи
нового слоя. 1акой
3ароды1п, бьтстро
разрастаясь'
заполняет
всю
поверхность
новь1м
слоем'
на
котором
во3никает
новь:й
зародь]1п
ит.
д.1аким
образом,
рост
кристалла
происходйт
послойно,
причем
ка>кдь;й
слой
имеет толщину порядка
моле-
кулярных
ра3меров.
Б некоторьтх
случаях'
например' при
росте
кристаллов паРатолуи_
Ау|на
из.-его
паров'
усовер1пенствованнь]ми
оптическими
методами
уда_
лось
действительно
обнарул<ить
появление
одно-
или
двухмолекулярнь1х
елоев постоянной
толщинь1
на поверхности
растущего
кристалла.9аше,
однако'
такие
слои
укрупня}отся
в более
_толстьте;
ря_д
последующих
слоев сливается
в
один
общий
слой,
граница
которого
движется
по по-
верхности
растушей
грани.
|1рияина
этого перехода
к
относительно
больплим
толщинам
слоев
еще полностью
не
вь1яснена;
на одной возмох{-
ной
принине этого
явления
мы
остановимся
ни)ке.
Ёеобходимо
заметить'
что
вся
изобрах<енная
карт|1на
роста
кристалла
ирезвьтнайно
упрощена.
Б
частности,
мь!
все время предпол1гали,н1о
форма
растущего
4ристалла
идеально
правильна.
Растушие
реальнь1е
кристалль!
всегда
обнару>кивают
от(лонения
от
такого
идеального
строения'
в
осо-
бенности
при
3аметнь|х пересь1щениях.
1(ак
показьтвает
более
детальная
теория'
наличие
таких
отк.]тонений
умень1пает
работу
образования
двух-
мерных
зародь::шей
и сних{ает
границу
пересь1щен
||я,
лрут которой
еще во3-
можен
рост
кристалла
с
заметной
скоростью|9).
$
4.
во3никноввнив
и Рост мвтАлличвской
ФА3ь|
пРи
пРоцвссв
элвктРоосАждьния
Фсновньте
выводы' к
которь|м мь] при1пли
при
рассмотрении
условий
во3никновения
|1
роста
кристаллов'
могут
бьтть
перенесень|
на процессь!
электроосах(дения. Фднако
в
то
время
как при
обьтчном пРоцессе
кристал-
238

99
лизации
вероятность
появления
трехмернь1х
и
двухмернь1х
3ародь11пей
определялась
величиной
пересь1щения, в
данном
случае'
когда
для
пере-
хода частиць1 и3
раствора
в
ре1петку
металла ей
необходимо
сообщитьэлек_
тривеский
заряд,
роль
пересь|щения
играет
дополнительньтй
(по
отно1ше-
нию к
равновесному)
сканок
потенциала
на границе
металл/раствор,
т. е.
поляризация
электрода.
Разность
химических
потенциалов вещества
в состоянии
равновесного
зародь11па и
в
массивной
фрме Р
-
Р'
в
случае
кр|1сталлт4за1\и|4
и3
пересь1щеннь|х
растворов
равна
&71п9
в
случае
электроосах<дения
эта величина
мо}(ет бьтть вьтра)кена
чере3
разность
электрических
потенциалов'
т. е. чере3 величину
поляризации
т]к. таким
образом,
по
уравнению
(259)
Р_Рв
--2Р^0к:+.
(263)
-[
3то
соотно1пение
позволяет
установить
3ависимость
ме)кду
размерами
зародь!1ша
и
величиной
поляризации
?]к,
специфинески
связанной
с.воз-
1{икновением
зародь]1шд|т!.
! случае'
если имеет
место одновременно
и
обеднение
раствора
ионами
металла' то
величина
16
складь|вается
с
ве-
личиной
концентрационной
поляризации.
€оотнош:ения
(257)
и
(256),
определяюшие
работу
образования
3аро-
дь|1па
и
вероятность
его
появления'
сохраняют
свою силу и
при процессе
электрооса)кдения.
1аким образом, открь]вается
во3мо)кность
определе-
ния йинимальной
поляри3ации'
при
которой в
доступнь]й
наблтоденито
проме}куток времени
мо}кет
произойти
вьтделение
металла на
яу>керодной
поверхности.Адя
по
этому
пути, Фольмер
рассчитал
минимальное
перена-
пря}кение
при
вь]делении
ртути
из
разбавленного
раствора
уксуснокислой
ртути
на
угле.
|1ри
этом
ну}кно
бьтло внести
поправку на
то' что
ртуть'
хотя и
очень
мало, но все
}{(е несколько
смачивает
уголь
и,
следовательно'
работа
образования
зародь1!па
сни)кается.
3ычисленное
1аким
образом
3начение
минимальной
поляризации
вь1деления
равнялось
0,34в; наопь1те
наблю^ались
3начения
около
0,2
в.
1.1спользованньте
здесь
представления
до
некоторой
степени
анало-
гичнь|
упоминав1пейся
нами в
главе
!
теории
водородного
перенапря)ке_
ния'
которая свя3ь!вала
поляризаци}о
при
вь1делении
водорода
с
пересь1-
щением'
необходимым
для
образования
пузь]рьков газа.
Фднако
работа,
необходимая
д]|я
образования
пу3ь!рька газа, относительно
мала, и
поля-
риза::,ией,
связанной
с этим этапом
процесса вь|деления
водорода'
мох{но
пренебрень
по сравнению с
электрохимической
поляризацией,
сопрово}к-
дающей
ра3ряд
иона
водорода
(за
исключением
того случая'
когда выд9-
ление
га3а
происходит
на
катоде
с
очень
низким
перенапрях(ением).
йначе
обстоит
дело
в
рассмотренном
3десь
случае
образования
зародь]|па
металлической
фазьт,-работа
образования такого
3ародь!1па,
в свя3и
с вь1соким
3начением
пограничного натяжения' вел14ка'
в
то время
как
электрохимическая
поляризашия
(например,
при
разряде
ионов
ртути)
мох(ет
бьтть очень мала.
|{оляризационнь1е
явлен|1я
при
вь1делении
новой
кристаллической
фазьт
иссл?довались
А. [. €амарцеБьтм и
(.
6. Рвстропьевь1м!10].
€огласно
даннь1мэтих
авторов'
при
электрооса>кдении
твердь1х
металлов
на
чух{ерод-
ной
основе с
постоянной
силой
тока
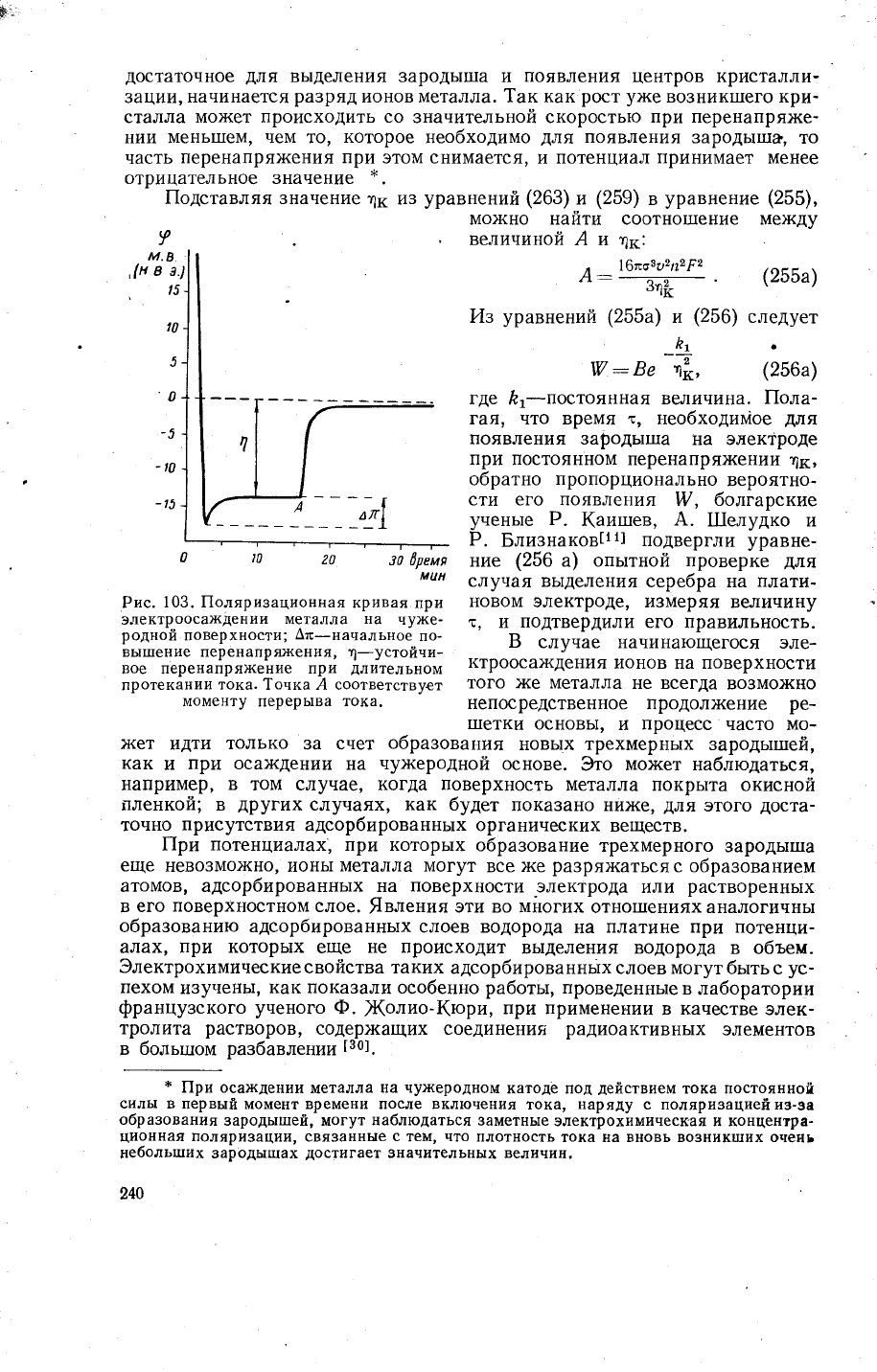
наблюдается зависимость
потенциала
катода
от времени,
подобная
изобра>кенной
на
рис.
103. ||одводимое
коли_
чество электричества
тратится
сначала
на зарях{ение
поверхности
катода'
потенциал
которого смещается в
отрицательну1о
сторону
(а
такх<е
на
о6-
разование
адсорбированного
слоя
из
атомов
вь1деляющегося
.металла'
см. ни>ке). 1(огда
достигается
некоторое
(начальное
перенапря)кение)'
239
&.
достаточное для
вь|деления зародь!1па и
появления
центров
кристалли-
3ации,
начинается
разряд
ионов металла. 1ак как
рост
у}ке
во3ник1шего кри_
сталла
мох{ет происходить со
значительной скоростью
при перенапря)ке_
нии мень1пем' чем то,
которое
необходимо
для
появления
зародь11па'
то
часть
перенапря}{ения при
этом снимается'
и
потенциал
принимает
менее
и3
уравнений
(263)
и
(259)
в
уравнение
(255)'
мо)кно найти соотно1пение мех<ду
,
величинойАит16
у
!у1'
в.
,|н
в э.]
15
-5
-'0
-15
'
!в.'"ф
(255а\
д
:
-3т]к
14з
уравнений
(255а)
и
(256)
следует
10
'0
_р|
||
_
Бе
'\?,
(256а)
0 10
20
зо 0ремя
мцн
Рис.
103. |1оляризационная
кривая при
электрооса}(дении
металла
на
чу>ке_
родной
поверхности;
Ат-начальное
по_
вь|т:]ение перенапря}кения,
1-устойни-
вое перенапряжение
при
длительном
протекании
тока. 1очка,4 соответствует
моменту
перерыва
тока.
где
Ё'-постоянная
величина. |1ола-
гая' что время
т'
необходимое
для
появления
3ародь1!па
на электроде
при
постоянном
перен?п[{,жёнии
т]6'
обратно
пропорционально
вероятно_
сти его появления
|м, болгарские
учень1е
Р.
|(аигпев,
А.
11!елудко 14
Р'
Близнаков||1]
подвергли
уравне-
ние
(256
а) опьттной проверке
для
случая вь1деления
серебра на
плати_
новом
электроде' измеряя
величину
.с'
и
подтвердили
его правильность.
в
случае начинающегося
эле-
ктрооса)кдения
ионов на поверхности
того )ке металла
не всегда
во3мо}кно
непосредственное
продол}кение
ре-
1шетки
основь1'
и
процесс
часто мо-
,{ет
идти
только
3а счет
образования
новь1х трехмерных зародьтгпей,
как
и
при оса)кдении
на
чу)|{ер0дной
основе.
9то
мо>кет наблюдаться,
например,
в
том случае' когда
поверхность
металла покрь|та
окисной
|-]ленкой; в
других
случаях' как будет
показано них(е'
для
этого
доста-
точно
присутствия
адсорбированнь|х
органических
веществ'
|1ри
потенциалах,
при которых
образование
трехмерного 3ароды1ша
еще
невозмо)кно' ионьт
металла
могут
все
}ке
разрях{атьсяс
о6разованием
атомов' адсорбированнь1х яа
поверхности
Рлектрода
или
раствореннь1х
в
его
поверхностном
слое.
9вления
эти во многих
отно1шениях аналогичнь|
образованию адсорбированнь1х
слоев водорода
на
платине при потенци-
алах'
при которь|х
еще
не происходит
вь|деления водорода
в объем.
3лектрохимическиесвойства
таких
адсорбированнь1х слоев могут
бьтть с
ус-
пехом и3учены,
как показали особенно
работьт,
проведеннь1ев
лаборатории
фр.,цуз"^ого
ученого
Ф.
)(олио-(тори,
при применении
в
качестве
элек-
тролита
растворов'
содерх<ащих соедине1]ия
радиоактивнь|х
элементов
в
больтдом
!а3бавлении
!301.
*
||ри осал<дении
металла
на чу)керодном
катодё под
действием
тока
постоянной
силы в
первый момент времени после включения
тока' наряду с поляризацией из_за
образования
зародышей, могут
на6людаться
заметные
электрохимическ-ая и концентра_
ционная
поляри3ации'
связанные
с
тем'
что
пдотность
тока на вновь возник1ших оче[{ь
небольгцих зароды]цах
достигает
3начительных величи}|.
240
