Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов
Подождите немного. Документ загружается.


промех{уточный продукт снова
восстанавливается
катод1{о'
так
что
одиш'
и тот
же металлический ион мох{ет многократно вступать
в
реакцию.
||римером такого
действия
мол(ет слу'<ить
реакция
восстановления]
ацетилена в
этилен'
происходящая
в
присутствии
ионов
хрома
{161;
на
катоде
6г*
**
*
е
-_>
(['*
,
химическая
реак{.]'ия
2€г*"
*
2н-
_[
€'Ё,
-'2€г***
*
€'Б*,
.
на
катоде
€г***
-{_е_>
(г.*
и
т.
д.
(ак
вьттекает из и3ло)кенного'
для
определения
механи3ма Ф1(!1€"т1!{1€./1Б:
нь1х
и восстановительнь1х
реакший
необходимо, как
и
в случае вь1деления
водорода'
всестороннее изучение зависимости скорости
реакции
от
потенциала
и состава
раствора'
с
привлечением
по
во3мох{ности
не3ави-
симь1х
даннь|х
об
адсорбции
отдельнь1х компонентов
на
поверхности элек-
трода. |[олунение
таких
даннь1х
является
одной из
дальней|1]их
задач'
электрохимической
кинетики.
$
5. РвАкция элвктРовосстАновлвния
кислоРодА
Реа
кция катодного
восста
новления
растворенного
молекуляр ного кис-
лорода встречается в
целом
ряде
ва)кньтх процессов'
напримеР, пРи
работе'
гальванических элементов с электродами
возду1пной
деполяризации'
при
корро3ии
и
растворении
металлов
в
присутствии
во3духа
||
т.
д.
Реакция
эта бьтла
и3учена н.
д.
1оматповьтм[17], исследовав1пим
влияние
мате-
ръ1ала
электрода на ее тененич 3.
А.
Р1офа!:в!,
в. с.
Багоцким[191,
А. 14.
(расильщиковь1ц [203
1другими' и
мы
обладдем
рядом
сведений об ее,
механизме.
€уммарнуто
реакцию
восстановле}{ия кислорода
мох{но
себе
предста-
вить
следующим образом;
в кислом
растворе
.
Ф'*4е*4Ё1-
-;2н2о,
в
щелочном
растворе
Ф''{4е
+2н2о
-+4ФЁ_,
т. е. в суммарной
реакции
прцниматот
участие
четь1ре
электрона.
Бсто.
реакцию
мох(но
разбить
на
две двухэлектроннь1е
ступени с проме}куточ_
ным
образованием перекиси
водорода
0,
*2"+ун**
н'о,
_12'%
2н2о.
(ак
ух<е
бьтло
указано
($
3),
перекись
водорода в этих
условиях
является
термодинамически
неустойнивьтм
промех<уточнь]м продуктом
и
мох(ет
накопляться
в и3меримьтх количествах
только вследствие кинети-
ческих
причин.
Фбразование перекиси
водорода
наблюдается при катодной
реакции
восстановления
кислорода
только
на определеннь1х
электродах
(ртуть,
серебро, алюминий,
активнь1й
уголь
и
некоторь|е
другие).
Ба
-других
электродах получаются
лигпь неболь1пие количества перекиси,
'а
иногда ее присутствие и совсем нель3я
о6нару>кить.
||ервая
стад|1я восстановления
кислорода-стад\4я
восстановления
до
перекиси-луч1пе
всего и3учена на
ртутном
и
на
серебряном электродах.
Ёа обоих
этих электродах наблюдаемь|е
в
кислой
и в
щелочнойсреде
явле-
ния
отличаются
друг
от
друга.
||оляризационнь1е
и3мерения
в
кисль]х
растворах
приводят к
линейной
3ависимости
1иехцу потенциалом
и логарифмом
плотнооти
тока.
(оэфиши.
ент наклона прямь1х' каки
Аляреакции
вь|деления
водорода'
6лизок"
+
,
||оляризашионнь1е
измерения нель3я продолх(ить
до
высоких
плотностей'
(г)
201
тока' так
как вследствие
малой
растворимости
кислорода в водном
рас-
творе
довольно
бь:стро
начинает
сказь|ваться
ко}1центрационная
поляри_
3ация.
|'|ри
умень1пении
парциального
давления
кислорода
потенциал
восстановления
сдвигается
в отрицательную
сторону'
причем из ве]1и-
чинь|
сдвига
мо}(но
найти
коэфициент
(09
|
6
А
р6');,
который такх{е
6лизок
"'#.
9та
зависимость
бьтла
подтверх{дена в
1широком интервале
изменеЁий
давления
кислорода
от
70
до
0,0|
аптм'
3опрос
о зависимости
потенциала восстановления
от
рЁ
раствора
представляет
больтпой
интерес
для
установления
механи3ма
реакции.
0о.утьгт
-ц!00
^
-7
у
_|
о
_3
_
-х-х_
+
_ _
*-+*
+-+
_
-'-|-
'х
+0)00
14
р/1
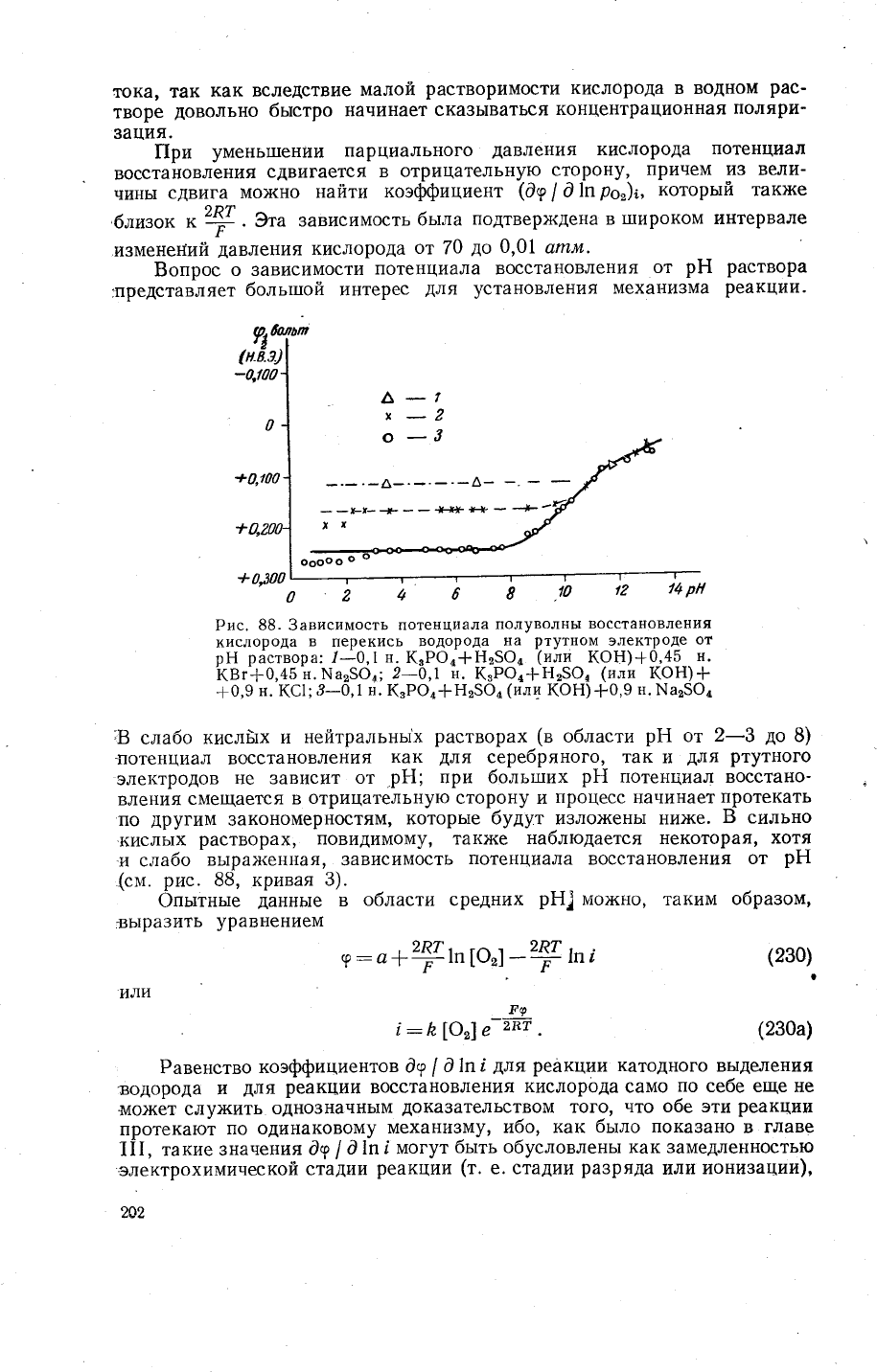
Рис.
88. 3ависимость
потенциала
полуволнь1
восста!]овления
кислорода
в
перекись
водорода
на
ртутном
электроде
от
рЁ раствора:
/-0,1
н.
кзРо4+н25@'
(или
кон)+0'45
н.
квг+0,+5
н.!.{а2$06;
2-о,| А.
к3Ро4+н25о,
(или
кон)+
-Ё0,9
н.
(€|;3-0'1
н.
('РФ,{Р25Ф,
(или
кон)+0'9
н.
}х|а25Фд
8
слабо
кислйх
и
нейтральнь|х
растворах
(в
области
рЁ
от
2_3
до
3)
_потенциал
восстановления
как
для
серебряного' так и
для
ртутного
электродов
не зависит
от
.рЁ1;
[ри боль[]их
рн
потенциал восстано-
вления
смещается
в
отрицательную сторону и
процесс
начинает
цротекать
по
другим
3акономерностям'
которь1е будут и3ло}кень1 ни}ке.
Б
сильно
-кисль1х
растворах'
повидимому' так}ке
наблюдается некоторая'
хотя
'и
сла6о
вь]рах{енная' 3ависимость
потенциала
восстановления
от
рн
(см.
рис.
63, кривая
3).
Фпьттные
даннь]е
в
области средних
рЁ]
мох<но' таким
образом,
вь!разить
уравнением
0
+0,100
или
9:
"+2#1п
[Ф,]
_'$
л"
с
р9
]
:
Р.[Фа| е_тв'т
(230)
(230а)
Равенство
коэффишиентов
09
|
01п!
для
реакции
катодного
выделения
водорода
|1
для
реакции
восстановления
кислорода само
по
себе еще не
мо)кет
слу>кить
однозначнь1м
дока3ательством
того'
что обе эти
реакции
протекают
по оди1{аковому
механи3му'
|тбо' как
бь]ло пока3ано
в главе
1||, такие
значения
0ч
|
01п!
могут
бьтть обусловлень] как замедленностью
электрохимической
стадии
реакции
(т.
е. стадии
разряда
илп
ионпзации),
202

'сак
|а
замедленность|о
других'
неэлектрохимических
стадий,
если
они
пРотекают на
неоднородной
поверхности
металла'
ли6о если
имеется
.3начительное
3аполнение
поверхности
адсорбированными
атомами или
молекулами.
Б
слунае
реакции
восстановления кислорода на
ртутном
или
сереб-
ряном
электроде
факторы
заполнения или
неоднородности поверхности'
однако' исключаются.
Фтсутствие
влияния 3аполнения
поверхности
вь1те-
кает'
в
частности' и3 того
опь1тного
факта,
что скорость
реакции
приопре-
деленном
потенциале пропорциональна парциальному
давлению
кислорода
над
раствором
(уравнение230а),
т.
е.
что
реакция
в
сравнительно 1широком
интервале
парциальньтх
давлений
кислорода
протекает по
кинетическим
закономерностям
реакций
первого порядка.
1акой порядок
в
случае гетеро-
геннь1х
реакций
наблюдается
обьтчно
только в том случае' когда
поверхно-
стная
концентрация адсор6ированнь{х
реагирующих
веществ
пропорцио-
нальна их
объемной
концентрации'
т. е.
в самом начале
адсорбционной изо-
термьт
лри наличии незначительной адсорбции.
Б
слунае восстановления
кислорода такой
порядок
реакции
о3г{ачает'
во-первь]х' что
поверхност-
ная концентРация адсорбированного
кислорода мала
и
пропорциональна
его объемной
концентрац|4и| и'
во-вторь]х'
что
в замедленной с1адии
реак-
ции
участвуют.молеку4ь]'
а
не
атомь1
кислорода.
.[,алее,
как
видно и3
уравнения
(230а), ни
ионь1'
ни
атомь1 водорода не
прини1!1ают
участия
в
элементарном акте
электрохимического
пРоцесса.
1аким образом,
ука3аннь1е
вь11ше опь]тнь1е
закономерности
могут
бьтть объяснень1
толь1(о
допущением'
что замедленной является
стад\4я
присоединения
электрона
к молекуле
кислорода с образованием отрица-
тельно 3аря)кенного
иона
Ф|
0'*
е
-_>
о',
т. е.
электрохимическая
реакция'
в которой
участвует
молекулярньтй
кислород
(возмох<но,
адсорбированцьтй на
поверхности
электрода),
но
не
участвует
водород*.
||редполо>кение о
существовании молекулярного
иона
0| вь]ска3ы-
валось и
рань1пе'
в
частности,
в связи с истолкованием
кинетики
ката-
литического
ра3ло)кения
перекиси
водорода и
фотохимических
процессов.
Аон Фэ
можно
рассматривать'
как
аниоц неустойнивой
кислотьт
ЁФ'.
(ак
показали в особенности
работьт
!г1. А.
(азарновского
и его сотрудни-
ков,
негидратированнь]й ион
Ф[
входит в состав вь1с1лих окислов
щелочнь1х
и
щелочно3емельнь]х
металлов' например' 1(Ф'|э:1.
Рсли
следовать
общим
представлениям
теории замедленного
ра3ряда
с
учетом
влияния строения
двойного
слоя,
то скорость
реакции
(!,)
мо>кно
вь1ра3ить
уравнением
!:Ё|Ф']е
(231)
где
Ф' как и
рань1ше'
коэффициент'
приниматощий 3начение'
3аключенное
ме)кду
нулем и единицей.
Рсли принять
величину
о
равной
0,5,
и
сни-
тать
ф'
прибли>кенно
постояннь1м'
то
уравнение
(231) совпадает
с
уравне-
нием
(230а),
[. €.
правильно передает кинетические 3акономерности'
на-
блюдаемьле в
слабокисль1х и
нейтральных
растворах.
|[редполох<ение
о замедленности электрохимической
стадит4
(д)
подтверх{дается
рядом
следствий
и3
уравнения
(23\)' Фсобенный интерес
*
Бапротив, электровосстановление
кислорода
11а
Р1-электроде
происходит'
повидимому' при
участии
адсорбированного
водорода.
(д)
203

представляёт
влияние адсорбирующихся
поверхностно-активных
ионов
(например,
ионов
(|-
илут
Бг-) на кинетику
восстановления
кислорода на:
ртутном
электроде.
(ак
следует
из
даннь]х'
приведеннь]х на
рис.
88,
кривая 2,
присутствие ионов хлора в
концентрации 0,9
экв|л
приводит при
рЁ{
<
9
к
сдвигу
потенциала
восстановления
кислорода в отрицательнуто
сторону
на
0,075
6
по
сравнению с
потенциалом
восстановления
в
раство-
рах
сульфатов. 3то явление
мо;{но объяснить влиянием
ф'-потенциала,
делаюц1егося
более
отрицательнь1м
при
адсорбции
анионов'
(ак
вь:те-
кает
из
электрокапиллярнь]х
измерений,
при переходе
от
сульфатов
к-
хлоридам
величина
изменения
ф'-потен:{иала
составляет-0,030
в.
Ретшая
уравнение
(231)
относительно
9'
находим
?
:#1пЁ
*
ф,+#
1п
[Ф,]
_$т"
;.
(232у
,[[егко
видеть' что
при постоянной
плотности
тока и3менение
ф'-потенциала
дол}кно
сопрово}кдаться изменением электродного потенциала в ту
х(е сто-
рону
и
на
одинакову}о величину' что очень хоро1по подтверл{дается
приве-
деннь|ми
опь|тнь|ми
данным|!.
8
присутствии
сильно
адсорбирующихся
анионов'
как.]-
или 6|.{_,
потенциал
восстановления кислорода сдвигается
в отрицательну}о сторону на несколько
десять1х
39д61д
[37|.
Реакционноспособньтй
анион
Ф2 легко
реагирует
даль1ше
с
ионам|{
водорода
и со
вторь1м электроном
с
образованием перекиси
водорода
о'+н-
=
но2,
но'*е;? ЁФ',
(в}
ЁФ'+н*
=
н2о2.
.|[ох<но
предполо)кить' что мех(ду ионом
Ф;
и молекулой
перекиси
уста-
навливается
равновесие
о'+2н-ф.е ?- Ё'Ф''
Фтсюда
следует' что
концентрация
ио'на
Ф2
в
растворе
при
3ада!{ном
по-
тенциале определяется
уравнением
[Ф: ]
: (1*# _к'
[н2о2] [он_]'
(233)
Б
сильно
кислой
среде' когда концентрация ионов водорода велика'
возмох{но'
в
стадии
присоединения
электрона
к
молекуле
кислорода
(А}
одновременно
участвует
и ион водорода; в этом случае
дол}кен
непосред-
ственно
получаться
свободнь:й
радикал
ЁФ'.
Бстественно,
что
участие
иона водорода в
3амедленной стадии
приводит к некоторой зависимости
потенциала
восстановления
от
рЁ.
3начительньтй интерес
представляют
3акономерности
при
восстано-
влении кислорода в
щелочнь]х
растворах.
Б
этом случае
поляри3ационнь1е'
|(ривь1е представляют
собой в
полулогарифминеской
тпкале
прямь|е
с
коэф-
фи:{иентом
наклона 30-40
;лв' |\рът
увеличении
рЁ
на
единицу
потенциал
восстановления,
сдвигается в отрицательную сторону при6лизительно
на
58
мв
пр|1рЁ
1
||
и
па
29
мв при более вь1соких
рБ
(см.
рис.
88).
1акуто
3акономерность
мо>л<но
объяснить
двумя
способами.
Бсли счи-
тать'
что' как
|1 в кислом
растворе'-
замедленной является электрохими-
ческа*
стаАия,
то и3
величины коэфишиента наклона
поляризационнь1х
кривь|х
следует, что 3амедленной
дол>кна
бьтть
реакция
присоединения вто-
рого'
а
не первого
электрона'
т. е.
электрохимическая стадия
204
РФ'*е
-_>
ЁФ'-,
(ж}

а
не
стадия
- оя*е
_>
Фр
с последующей
реакцией
о'+н-
-?
ЁФ'.
Аействительно,
замедле1{!1ой
стадии
(}{)
соответствовала
рость
реакции'
равная
"3'ч
!
_Ё[|10а]е_б,
(д)
(3)
бьт ско-
(234)
(235)
(236)
(237)
где'
как
и
ра1{ь|[]е'
0
(
с
{
1.
Бсли считать'
нто
образование
ЁФ2
по
реак-
ииям
([)
й
13;
,ротекает бьтстро
по
с-равнению
с
дальнейп:им
его
восста_
новлением
по'(ж),
то
концентрация
ЁФ,
определяется
условиями
равно_
весия
Р9
[ЁФ']
:
('
[Ф''!
[Ё-1
9_Бт.
|!одставляя
'''
з"],""''е
в
(234); находим
для
скорости
реакции
!:
Ё'
[Фъ7|н-]
е-%?&
т1
А]!я
потенциала
я
:6щ:
1":
л
\пЁ'
|#ь
1п
[Ф,]
[н-]
-
с#}
;,
;'
(ак
видно из
этого
вывода'
3амедленность
присоединения
второго
эл е
ктрона в
двухэлектрон
ном
п
роцессе
приводит
к вёличи
не_
коэф:тшиента
наклона
по']яри3ационпь|х
кривь1х'
заключенной
мех<ду
#"#,
''
е'
при
поль3овании
десятичнь]ми
логарифмами,
ме)кду
29 и 58 у'ов'
11кое
истолкование
кинетики'
восстановления
кислорода
в
щелочной
среде
бьтло
предло>кено
А. А'
1(расильщиковь1м
для
случая
серебряного
злектрода
|:о).
€равнение величин
потенциала
восстановления
кислорода
с^равно_
веснь1ми
термодинамическими
значениями
потетлциа,л1а
системь{
о2/н2о2
приводит'
однако'
к
вь1воду'
что
перенапрях{ение
процесса
восстановления
кйслорода
в
перекись
водорода'
по крайней
мере-в
случае
ртутного
элек_
трода'
в
щело!]ном
растворе
очень
мало'
и
нто
наблюдаемь|е
в
этом
случ1:
поляри3ационнь1е
явления
обусловлень1
в
основном
концентра.ционнои
','л"р'",ш
ией, а
не 3амедленностью
собственно
электрохимической
стадии'
3то
6значает,
что
в этих
условиях
пРоцесс весьма
близок--к^обратимому
и
что
при прохо}кдени|1
тока
равновесие
системь]
о2|н2о2
почти
не
нару1пается.
Ёаблюдаемое
изменение
механизма
процесс1
пРи
переходе
от кисль]х
к
щелочнь1м
растворам
легко
объяснимо.
.[,ействительно,
согласно
уравнению
(233),
сташионарная
конт(ентрация
ионов
Ф2 в
растворе
при
повь{йении
рЁ{
раствора
растет.
Б
'той
)*{е
мере
дол)кна
во3растать
и
скорость
реакции
Ф!
*
Ф"! е,
(и)
обратной
реакции
(А).
при
}1екотором
р[1
скорость
анодной
реакшии
(Р1)
["д"',""""
сравнимой
со
скорость1о
катодной
реакции
(А),
и система
о,
|
[1'о
',
вследствие
увеличени
я_ то
ка.обмена'
сдел аетс
я
обратимой'
"'
('1{
,оказь'вае|
количественньтй
раснет,
переход
этой
системь|
и3
необратимого
в
обратимое
состояние
наступает
на
ртутном
электроде
при
значении
рн,
близком
к 9.
Б
обратимом
состоянии
потенциал
элек-
205

трода' т.
е.
потенциал восстановления
кислорода' меняется
при
увеличе-
нии
рн
так
же'
как
и
потенциал
обратимого кисло!од!1о-перекисного
элек-
трода. йзменение
это'
как легко вь|вести
из
обьтчнь:х термодинамических
соотно1шений
для
потенциала обратийь:х электродов'
составляет 58
лов
на
единицу
рЁ
до
3начения
рЁ, равного
11,
и
29
мв
на
единицу
рЁ
в бо-
лее
щелочнь]х
растворах
(в
которь1х перекись
водорода
содер}кт{тся
в
виде ионов
но')' Ёаклон
поляр'|зационных кривь|х в
щелочнь1х
раство*
рах'
по
3аконам
концентрационной
поляризации'
долх{ен
равняться
29
мв.
Бсе
эти вь1водь|
количественно
подтверх{даются
опь1тнь1ми
даннь|ми.
'
Ёеобходимо 3аметить'
что
истолкование
закономерностей, наблюдае-
мь!х в
щелочнь]х
растворах'
является
следствием основного
допущения
о
3амедленности
стадии
(А)
в слабокисль1х и
нейтральнь|х
растворах
и
не
требует
новь1х
допушений.
!,оротпее согласие опь1тнь|х
дан!{ь1х,
получен-
нь]х в
щелочнь]х
раствора,х'
с
ука3аннь]ми
вь1водами
является
поэтому
дополнительнь]м
подтверх<дением правильности представления
о замед-
ленности
электрохимической
стадии образования
молекулярного
!4о|1а
кислорода. ||рибли>кение системь1
кислород/перекиёь водорода
от необра-
тимого
состояния
к обратимому
при
увеличении
рЁ раствора
наблюдается
такх(е и
на
угольном
электроде.
Бторая
с'1адия
восстановления
кислорода-восстановление перекиси
.водорода
в воду-и3учена
менее
подробно.
},арактерной особенность}о
этой стадии
является 6ольтлая величина
коэффициента наклона
09|0\9[,
которая
равна
220_240-:сав
(в
десятичнь|х
логарифмах} нто соответствует
значению
с
в
кинетическом
уравнении'
близкому
к
0,25' Белинина коэф_
фит1иента
09|019[Ё'Ф']
по
абсолтотной
величине
такх{е
6лизка к этому
3начению.
3то означает, как
и
в случае
кислорода' что
при
заданном
по-
тенциале
скорость
реакции
восстановления
перекиси
водорода
пропорцио-
нальна
концентрации этого
вещества.
Б кисльтх
растворах
и
вплоть
до
значения
рн,
равного
1
1,
потенциал
восстановления
перекиси
водорода
не завис14т
от
рЁ раствора;
в
более
щелочнь1х
растворах
наблюдается
резкий
сдвиг
потенциала
в
отрицатель-
ную
сторону.
|(инетические закономерности
во
всем интервале
рЁ
(вклюная
и
ще_
лочнь1е
растворь:)
полность{о охвать1ваются
уравнением
(238),
тде
(н'о'-константа
диссоциации
перекиси
водорода'
А
ёд'}'-ёё
общая
анал\4тическая
концентрация
(диссошиированной и недиссоциированной
насти)'
)/нить:вая,
что концентрация
недиссоциированньтх
молекул
пере_
киси
водорода
[|-{2о9]
вь|ра)кается соотно1шением
[Ё'Ф']:##@,.
^''*
,
най*
денное
из
опыта
уравнение
(238)
мо)кет
бьтть
переписано в виде
9:а*#'"[Ё,Ф,]
_$т"с
9
:
.
4-#
1п
сд,6"
+
#:'
щ${;
_$
тп ;,
-Рр
!: Ё
[[1аФа7е
цт'т
3ти
закономерности
полностью
о6ъясняются
предполох<ением'
что'
3амедленной
стадией в
процессе
восстановления
перекиси водорода
является
стадия
присоединения
электрона
к
молекуле
перекиси водорода.
(ак
и в случае Ёосстановления
молекульт
Ф2,
эта стадия
протекает
без
участия
ионов водорода,
вследствие
чего
потенциал
восстановления
206
(23э)
(24о)

-4
в
кислых
растворах
от
рн
не зависит.
||рисоединение
электрона
к молекуле
перекиси
водорода
сопрово}кдается,
вероятно'
одновременнь|м
расщепле-
нием молекуль1
на ион и
на свободнь1й
радикал
гидроксила
г|2о2+е
->
он+он-.
(к)
й в
щелочнь|х
растворах'
в
которь1х
перекись водорода
сильно
диссо_
циирует,
катодному
восстановлению
подвергаются
не
ионь1
перекиси водо-
рода,'
а недиссоциированные
молекульт.
€двиг потенциала восстановле_
ния
перекиси
в отрицательную
сторону
в
щелочнь|х
растворах
свя3ан'
таким
обра3ом,
с
умень1пением
концентрации
недиссоциированнь1х
моле'
кул
при
увеличении
рЁ раствора.
3атрудненность
восстановления
ионов
перекиси
по сравнению
с восстановлением
молекул объясняется'
вероят_
но' тем,
что отрицательнь]е
ионьт
перекиси отталкива[отся
от
поверхности
электрода,
которая
так)ке
3арях{ена
отрицательно
(см.
$
6).
€уммарная
реакция
восстановления
молекулярного
кислорода в
воду
мо'>кет
протекать
и
инь]м
путем'
помимо того,
которьлй
приведен
в
схеме
(|);
например,
Ф2
*>
2Фд^"
\
Ф'д"*2н-+
2е
-->
Ё'Ф
1'
(л)
Б этом
случае
проме>куточнь1м продуктом
является
не
перекись водо-
рода'
а адсорбированнь:й
атом
кислорода.
Босдтановление^-кислорода
на
угле
в определенных
условиях
идет
такх{е и
по
схеме
[т7сээ1'
то)ке самое,
во3мо)кно'
имеет
место и в случае
некоторь]х
других
электродов.
$
6.
РвАкции
восстАновлвния Анионов
1т1ногие неорганические
анионь1
(например,
€г@;-,
!!1пФ1, АзФ5--,
БгФэ, .1Фз, 5'Фб-) восстанавливаются
на катоде. ||роцесс
восстановления
анионов
интересен
тем,
что отрицательньтй
заряд восстанавливающейся
частицы
в тех случаях,
когда
поверхность электрода такх(е отрица-
тельно
заря}кена'
накладь1вает
на
его
кинетику
некоторь!е
спет{ифинеские
особенности.
Ёекоторьте
анионь|'
как
$Ф5
и
\Ф;,
восстанавливатотся
на
ртутном
электроде в обьтчньтх
условиях
ли1пь при очень
отрицательнь|х
потенциа-
лах. Рсли, однако,
к
раствору
прибавить небольтпое
количество
солей
с
поливалентнь]ми
катионами
(например,
соли
Ба**, [а*** |\л\4 1[****),
то
протекание
реакции
восстановления
этих ионов
облегчается'
причем
ско-
рость
ее тем
больгпе'
чем
вь11пе
концентрация
и валентность
прибавляемьтх
катионов*[40].
в'случае
анионов
БгФ3
и
3Ф3
прибавление
многовалентнь|х
катионов такх{е 3начительно
ускоряет реакцию,
?. €.
умень1шает
пере_
напря)кение
при
определенной
плотности тока.
Фсобенности электровосстановления
анионов
вь|ступают
наиболее
отчетливо
в
случае
восстановления
52Ф;_
на
ртутном
электроде'
и3учен-
ного впервь:е 1.
А. 1{рюковой12ц1.
Ёа
рис.
89
приведена
катодная
поля'
ризационная
кривая
для
амальгамированного вращающегося
электрода
в
разбавленном растворе
1('5'Ф*.
|(ак видно
и3
этого
рисунка,
в такош1
растворе
процесс
восстановления иона
5'Ф.- начинается
при
потенциале'
6лизком к потенциалу
н. к. э.;
при
увеличении
поляризации
вскоре
достигается
предельньтй
диффузионньтй
ток, зависящий
только
от
концен_
*
3та
реакция'
к со)клению' недостаточно
исследована,
||о некоторым
данным,
вь1ход продуктов
восстановления
иона \Ф| по току
мень[пе
теоретического'
так
что ток
расходуется
частично
на вь|деление водорода
[2э1.
207
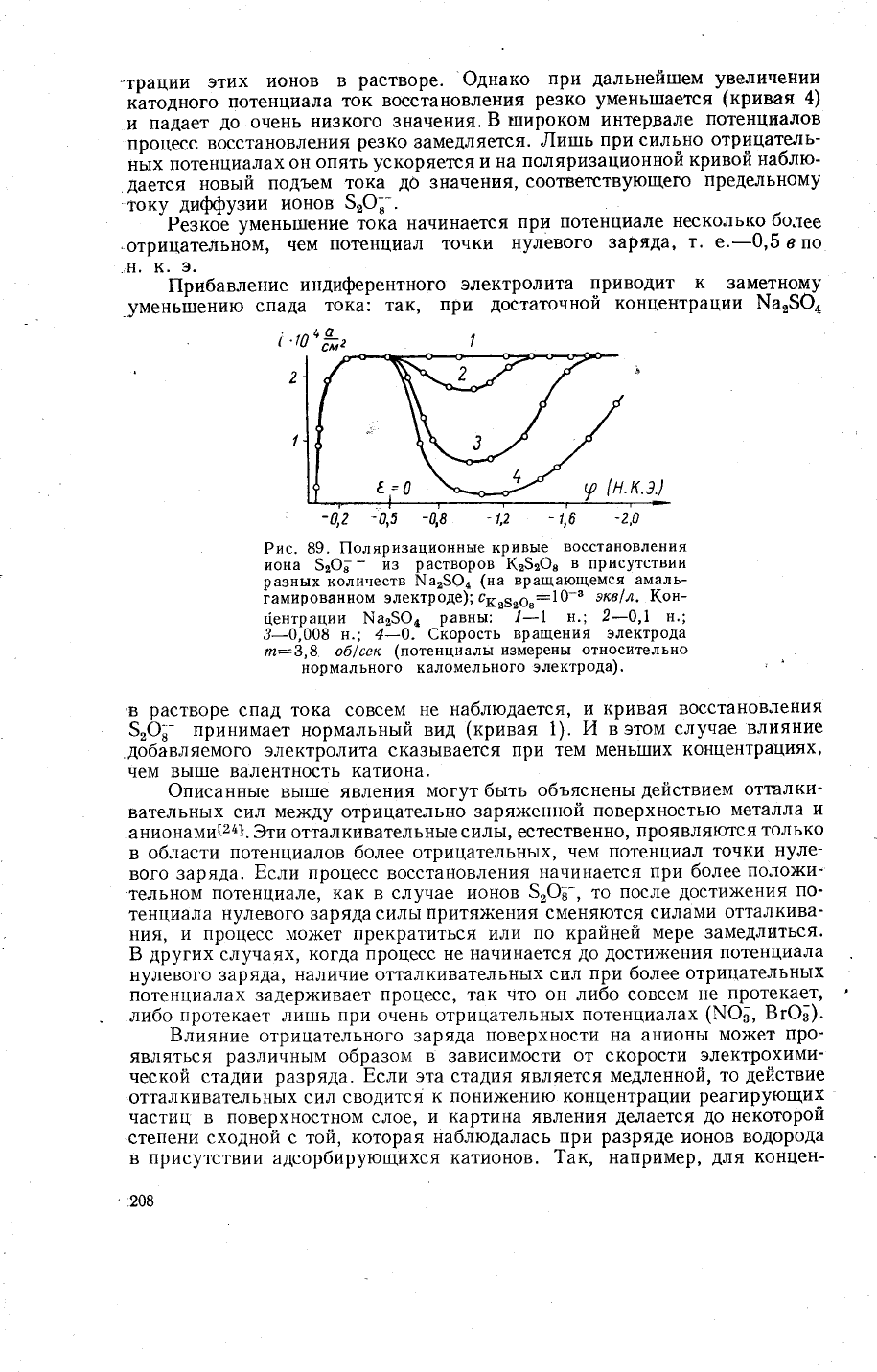
-трации
этих
ионов
в
растворе.
'Фднако
при
дальнейшем
увеличениц
катодного
потенциала
ток
восстановления
ре3ко
умень1пается
(кривая
4)
и
падает
до
очень
низкого
значения.
Б
:пироком
интервале
потенциалов
процесс
восстановлешия
ре3ко
3амедляется.
лишь
при сильно
отрицате.,1ь-
ных
потенциалахон
опять
ускоряется
и
на
поляризационной
кривой
наблю_
дается
новь1й
подъем
тока
до
значения,
соответствующего
предельному
току
дифузии
ионов
5'Ф'-.
"РезйоБ
умень1шение
тока начинается
при
потенциале
несколько
более
.отрицательном'
чем
потенциал точки
нулевого
заряда,
т' е'-0,5
в по
-н.
к.
э.
|[рибавление
индифрентного
электролита
приводит
к
3ам_етному
умень1пению
спада
тока: так,
при
достаточной
концентрации
ша25ц
/.тоц$, 1
-0,2
-0,5
-0,8
-
1,2
-
1,6
-2,0
Рис. 89. |1оляризационнь]е
кривь1е
восстановления
иона
52Ф;
_
из
растворов
(з5:Ф,
в
присутствии
разных
количеств
}.1а25Фд
(на враша_юшемся
амаль-
гамированном
электроде);
с6"516":10-э
366| 1.
\он-
т{ентрации 1'{а2$@.
равнь|:
1_|
н.;2_0,|
н.;
,_0,008
н.;4_0. €корость
вращения электрода
тп:3,8. об/сек
(лотенциалы
измерены относительно
нормального
каломельного
электрода)
в
растворе
спад тока совсем
не наблюдается,
и
кривая восстановления
5'@!_
принимает
нормальнь1й
вид
(кривая
1). й в
этом
случае
влияние
добавляемого
электролита ска3ь1вается при
тем мень1пих
концентрациях'
чем
вь!|пе валентность
катиона.
Фписанньте
вьт1пе явления
могут бьтть
объяснень|
действием
отталки_
вательнь]х сил
ме)кду отрицательно
3аря)кенной
поверхностью
металла
и
анионами[2ц1'3тш
отталкивательнь1есиль1,
естественно'
проявля}отся
только
в
области
потенциалов более отрицательнь1х'
чем потенциал точки
нуле-
вого
заряда.
Рсли
процесс восстановления
начинается
при более
поло)ки-
тельном
потенциале' как
в случае
ионов
5'@ь-,
то
после
достих{ения
по_
тенциала
нулевого
заряда
силь]
притях(ения сменяются
силами отталкива-
ния,
и процесс мо)кет прекратиться или
по
крайней
мере замедлиться.
3
других
случаях'
когда
пРоцесс
не
начинается
до дости)кения
потенциала
нулевого заряда'
наличие отталкивательнь1х
сил
при
более
отрицательнь1х
потенциалах задер)кивает
процесс'
так
что он либо совсем
не
протекае-т'
либо
ттротекает
лйгпь
при
очень отрицательнь]х
потенц'1алах
(]'{Ф;, БгФ]).
Блияние
отрицательного 3аряда
поверхности на анионь{
мо}кет
про-
являться
различнь1м
образом
в
3ависимости
от
скорости
электрохими-
ческой стаду1и
разряда.
Бсли эта
стадия
является
медленной'
то
действие
отталкивательнь!х
сил с
водится
к поних{ению концентрации
реагируютцих
частиц в поверхностном слое'
и
картина
явления
делается
до
некоторои
степени
сходной
с
той,
которая наблюдалась
при
ра3ряде
ионов
водорода
в
присутствии
адсорбиру1ощихся
катионов.
1ак, например'
для
концен-
:208
2

трации иона 52о;-
в
поверхностном
слое
[52о;-]в
имеет
2Рфт
[5'Ф'-*].:
[5?о;-]етт
(24\\
€корость
ра3ряда
иона 52о; при
простейтших
предположениях
дол-
х<на
бь:ть
равна
_ог
(?_фт)
(2|о)
РФт
_*Р9
|
:
Ё
[5яФв-
-!"е-____тт--:
Ё
[5яФ*-.!
е-
--пт-
2-Ф-
\242)
| аким
обра3ом,
отрицательное
3начение
ф1-потен
|114ала
сни}(ает
ско_
рость ра3ряда
а11|1она'
причем
действие
это
особенно
велико'
так
как
91-потенциал
входит
в
пока3атель
с коэфициентом
(2*.),
т.
е.
оба
вь|3ы-
ваемь1е
им эфекта
(поних<ение
концентрации
иона
и
умень1пение
действия
поля
двойного
слоя
на энергито
акт|1вацу1и)
складьтваются.
(ак
в|1дно
и3
уравнения
(242),
влияние
поля
на
скорость
реакции
восстановления
анио_
нов вь|рах{ается
прои3ведением
двух
мно)кителей,
входящих
в
правую
часть
уравнения
(2+\.
г1ри
ув'еличении
отрицательнь1х
значений потенци-
ала мнох(итрд5
2-Ф9Р|Р?
монотонно
во3растает'
что
и определяет
ускорение
реакции'
наблюдающееся
при
обьтчной
зависимости
скорости
реайции
от
потенциала.
Б
лравуто
часть
уравнения
(242)
входит'
однако,
еще
мнох{и-
тель
е
(2+фРи|пт'
которь1й
убьтвает
при
во3растании
отрицательнь1х
зна_
чений
9.
1аким образом,
при
усилении
катодной
поляризации
эти
мно)ки_
тели
изменяются
в
противополо)кнь]е
сторонь1'
и
ход
величинь|
!
зависит
от
того'
какой
и3 них
влияет на нее
силь!{ее.
(ак
известно
из
$
3
введения' при
и3менении величинь|
9
вели9ина
фт
и3меняется
особенно
сильно
в6лизи
точки нулевого
заряда'
поэтому
вблизи этой
точки' как
показь!вает
расчет'
[
падает
при
сдвиге
потенциала
в отрицательну1о
сторону.
Ёапротив,
на
значительном
отдалении
от точки
нулевого
3аряда при
больгших
отрицательнь|х
9,
величина
ф1
мало
и3ме-
няется
с
Р'
и
ход
! определяется
восновном
мнох(ителем
2-*Р!&|,
что
и
при-
водит ко
второму подъему
величинь1
1.
Рсли
электрохимическая
реакция
разряда
протекает
бьтстро,
то
при
нал||чии
отрицательного
ф1-поте!1циала
само проникновение
аниона
к
поверхности
электрода
чере3
лиффузную
насть
двойного
слоя мо'(ет
сделаться
медленной
стадией
реакции'
тре_
бующей
энергии
-активац||и,
которая
тем боль1пе'
чем
больхпе
(по
айо_
лютной
велинине)
ф1-потен4иал.
Б
этом случае
второй подъем
при
даль-
ней:шем
сдвиге
потенциала
в отрицательную
сторону
у)|(е
ц3393ц6д19ц
[411.
в обоих
случаях
прибавление
постороннего
элек}ролита'
которое
сни_
>кает
абсолютную
величину
фт-потент{иала
и тем самь1м
умень1шает
вели-
чину сил
отталкивания'
дол)кно
увеличивать
скорость
реакции.
3
этом
смысле
особенно
эффективньтми'
как
это
и
наблюдается
на опь1те'
дол}кньт
бь:ть поливалентнь1е
катионьт,
не
только
сни)кающие
а6солютную
вели-
нину-ф'-потенциала'
но и
и3меняющие
его
3нак на
обратный.
Аномальньтй
ход
поляризационнь|х
кривых'
по1о6ньтй
описанному
здесь, наблюдается
и
при
восстановлении
5'Ф]-
на
катодах
и3
(6
и
Рб,
а такх{е при
восстановлении
ряда
других
анионов
на
Ё9-электроде,
как,
например'
ионов
Ре(€\)6-_,
Р|€|а-,
Р1
(шо?)'-
у|
др.
$
7. РвАкции
восстАновлвния
оРгАничвских
ввщвств
Б
литературе
описано
несколько
ть1сяч окислительных
или
восстано_
вительнь1х
реакций,
протекающих
с
участием
органических
веществ.
3лек-
трохимические
реакции
приобретают
все больтшее
3начение
для
синтеза
место
соотно1||ение
]4
нинотина
9ле1{тродн.
процеооов
209

новыхорганическихвеществ'длякачественногоиколичественного
анализа'
а
так}1(е
для
и3учен14я
ряда
особенностей
строения
органических
;;й;;;:
бд,,*о
[одроб!:ьте
сис1ематические
исследован|\я
вл|4янпя
ра3-
;йй
факторов
н[
кинетику
процесса
._проведены
в
настоящее
время
''',*'
дЁя
небольшого
количества
реак:{ий'
|{римером
'",'.й'"',йБ
-йр'"'1а
"
д'19{1:9_".1-'-1р:б"о
изупенной
реакцйи
яв.]|яется
реакция
восстановл€ния
щавелевой
кислоть{
на
ртутном
электроде
до
глиоксиловой
кислоть|'
Реакция
эта
протекает
по
уравненито
(соог1)9+
2н*
+2е
---> соон'сно+н'?о'
Аляэтойреакцииисследоваласьзависимостьпотенциалавосстано-
вления
от
концентра1\и|\
компонентов
в
растворе
и
от
плотности
тока
на
амальга"р'"',"''
свинцовом
[ц21
14
на
капел'ьном
ртутном
электро_
;;х1'ъ'.
йз
!".у',татов
последних
измерений
вь1текает'
что
потенциал
восстановления
меняется
линейно
с
лога.рифмом
плотности'тока'
причем
коэффишиент
наклона
поляри-заци91ной
.груэ'у
_(0ч/01е])
равен
[!,бЁЁ:1'1о0
в
(в интервале
!Ё
от
1,5
до
4).
Ёаблюдаемая
зависимость
потенциала
"'.."^,','6йй!
.]'
общей
концентрации
щаве;1евой
кислотьт
и
от
концентрации
ионов
водорода
является
слох<ной'
Бсли'
однако'
рас-
считать
зависимость
потенциала
восстановления
не
от
общей
концентраци1{
щавелевой
кислоть1'
а
от
концентрации
недиссоциированнь1х
молекул
(ко--
торая
при
постоянной
общей
коншентра_цу1
!стественно
3ависит
от
рЁ
!йЁ'"'рЁу'
то
для
коэффччиента
091019
[Ё'€'Фд]
получаетс_я
:^"::::::';
6й',""й",
близкое
к
0,100
в.
[алее
оказь|вается'
что
при
постояннои
1""ц"й"6"ц''
"ед"."оциированнь1х
молекул
потенциал
восстановления
;;^;;;;;,;;ъ
рн р]Ё',Бр''1"
у^..'нном
ин'ервале
р}!).
_1аким
образом,'
результать1
измерений
могут
бь:ть
вь:рах(ены
уравнением
,:Ё|н,ср
,7'-#'
(243)
где
Ё
и
с_постоянные
(с:0,6)'
1акаякинетическаязависимостьмо)<етбытьобъясненапредполо.
жением'
что в
","'!!!'"
рй
т
1'5
до
4
реакцией'
определяющей
ско_
рость
восстановления
щавелевой
кислоть1
на
ртутном
электроде'
является
присоединение
электрона
к молекуле
щавелево!|
кислоты.
14оньт
водорода
в.этой'стадии
не
унаётвуют
и
ли1шь
в
дальнейп:ем
присоединяются
вместе
со
вторым
",**'р'йБй
т|
образовавщемуся
иону-радикалу
с
образованием
молекулы
глиоксиловой
ки|лоты.
||оследовате.]1ьные
стаА|4|1
восста
новле_
Ёй!-й'*'евой
кислоть1
в
глиоксиловую
могут
быть
изобрах(ены
следую_
щей
схемой:
о
!!
!!
--с
Ё_''
ш
о
о
!|
+н++е
с_н
_+!
с_он
1!
о
.о!п!
с/-1 !
+н*
--"\|он|
-н,о.
с_о[1
!!
о
1от
факт,
что
молекулы
щавелевой
кислоты
восстанавливаются
на
отутномэлектроделегчеанионакислоть1'находитсявполномсоответствии
Ё;ъ;;;;";;
Б
5'о
о восстановлении
отрицательных
ионов
на
одноименно
;;р;йъ;;;я
,'Ёер",'с"и
электрода.
3аметим,
что
глиоксиловая
кислота
мох{ет,даль1шевосстанавливатьсясобразованиемгли{олевойкислоты
ёЁ;рщёббй.-Б'."'кающие
при
восётановлении
щавелевой
кислоты
210
б
!
с_он
!
с_он
!!
о
