Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов
Подождите немного. Документ загружается.


электролита. Рсли
физинеские
и химические
свойства
всех
точек поверх-
ности одинаковь|'
то
в любой
точке с
равной
вероятностью
могут
протекать
катоднь1е
и
аноднь|е процессь]'
и
нельзя
ра3граничивать
катоднь|е
и
анод_
нь1е
участки.
Бозмох<ность
растворения
гомогеннь]х
металлов
приводит
к
вь]воду' что
и
на
гетерогенной (неоднородной)
поверхности
не
происхо_
дит
полной
диференц|\аци||
катоднь]х
и
а|{однь1х
процессов;
на такой по-
верхности
работа
локальнь1х
элементов
и свя3анное
с
ней
растворение
металла
накладь|вается
на
растворение'
происходящее
как
результат
сопря>кеннт
реакций
в пределах
ка)кдого
и3
однороднь]х
участков
по-
черхности.
Б
зависимости
от степени
неоднородности
поверхности
в
раз-
нь|х
'
случаях
степень
диференц|1ации
катоднь!х
и
аноднь]х
процессов
мо)кет бь:ть
разлинной.
Баряду
с
вопросом
о в3аимной
связи
катоднь!х
и
аноднь{х процессов
при
и3учении
растворения
металлов
часто
возникают
вопрось!,
связаннь1е
ё
накопленц€м продуктов
коррозии.
Рсли
продукть:
корро3ии
хоро1|]о
растворимь1
(например,
при
растворении
>келеза
в соляной
:1йслоте),
т6 они
удаляются
и3
реакционной
3онь1 путем
дифузии
и
конвекции;
в таких
случаях
поверхностная-
концентрация
этих
веществ
мо>*<ет
бьтть
рассни-
тана
по
уравнениям
дифузионной
кинетики (см.
главу
1). Фднак6
очень
часто продукть|
коррозии
нерастворимь1
и оса}кдаются
на
металле
в виде
более
или
менее
плотной
пле.нки.
Фбразование
и
рост
1аких
пленок на
поверхности
металлов'
а такх(е
адсорбционнь1х
пассивирующих
слоев'
есте-
ственно'
сильно
влияет
на
реакцию растворения
и в некоторь!х
случаях
мо}кет
привести
к
3амедлению
ее
или
почти
полному
прекращенито.
1аким
образом, явления
пассивности'
рассмотреннь1е
в
г}ав6
у||, имеют
боль-
[пое
3начение
при
протекании
коррозионнь1х
процессов'
что
бьтло особенно
подчеркнуто
в
работах
Б.
А.
(ист]тковского.
Б
настоящей
главе
основнь]е
3акономерности
растворения
металлов
будут
рассмотрень1
снача_ла
на
примере
металлов
с однородной
поверх-
ностью;
вслед
3а этим
в
$
7 мьт
разберем
те
особенности,
которьте
наблю-
да}отся
при
растворении
металлов
с неоднородной
поверхностью.
|1ри
рассмотрении
э^|их
вопросов
мь[
обратим
внимание
преимущественно
на
случаи
растворения
металлов
в кисль|х
растворах'
в которь|х
пр6ду;<тьт
реакции
часто хоро1по
растворимьт.
8
на1пем
излох{ении
мь1 остановимся
лиш]ь
на
простейгпих
системах
и' в
частности'
не смо)кем
коснуться
прак_
тически
ва}кного
случая
корро3ии
на
границе
трех
фаз,
исследованного
в.
А.
(истяковским
и его сотрудникапти[21.
$
2.
сопРяжвннь1в
элвктРохимичвскив
РвАкции
и
стАционАРнь1в
потвнциАль|
элвктРодов
||ри
рассмотрении
закономерностей
реакции
вь|деления
водорода
мь1
ука3ь1вали
на
то' что на
платинированном
электроде'
погру'<енном
в
!{асыщеннь:й
водородом
раствор
электролита'
возмо>кно
одновремен-
ное
протекание
двух
электрохимических
реакций:
реакции разряда
ионов
вод9рода
Ё-*е
-'1|2н2
и
обратной
реакции
ионизации
водорода
,/'|7'-,
-,
Ё*1е;
скорости этих
двух
реакций
("
эле^'Р",'еских
едини!лах)
йй
ооо-
значили
нерез
!
для
реакции
разряАа
и !-для
реакции
ио1{и3ации.
Б
равновесном
состоянии'
когда
электрод
не поляризуется,
р€акции
разряда
и
иони3ации компенсируютдруг
друга
искорости
их
равнь|
!:]:!о
(!0:|авновеснь:й
ток обмена).
|1ри
прохо)кдении
электрического
тока
чере3
электрд
равновесие
нару1пается,
нару1шается
.и
равенство
скоростей
281

прямой и
обратной
реакций.
6корости этих
реакцутй
завпсят
от|потен-
циала
электрода'
от
концентрации
ионов
водорода'
от
давления
молеку-
лярного
водорода
и
от
других
факторов.
3та
связь
вь|ра){(ается
кинети-
ческими
уравнениями
да!тной
электрохимической
реакции.
3ид
уравнений
и
числовь]е
з1{ачения
входящих
в
них
постоянных
зависят
от характера
электродной
реакш-ии
и
природь|
электрода.
Б
главе
1||
бьтло
пока3ано'
что
ддя
ряда
электродов
реакция
выде-
ления водорода
подчиняется
кинетическому
уравнению*
аРо
+
|
:Ёт[Ё-]
е
.т
,
(27\)
(272)
'
?Р9
]
:Ё'
р|!|
еат
||ри теоретическом
рассмотрении
реакции
вь1деления
водорода
бь1ло
сделано
допущение'.
3аключа1ощееся
в
том'
что кинетические
3акономер:.
ности протека11ия
ках{дой
из
упомянуть1х
реакций
могу'т
бь:ть
рас9мотрень(
не3ависимо
от закономерностей
протекания
другой
реакции;
инь]ми
словами'
предполагалось'
что на
скорость
электрохимической
реакции
не
влияет
одновременное
протекание
другой
реакшии
на том)ке
электроде.
1(ак
у>ке
указь1валось
(глава
1[1),
правильность
этого
допущения
мо)!(ёт
бьтть обосйована
на
опь]те' например'
определением
величинь1
тока
обмена
при
равновесном
потенциале
'
Ёа кинетические
уравнения
прямой
и обратной
реакции
накладь1-
вается
единственное
требование
о том'
чтобь1
при
равновесном
потенциале
и при
льбой
концентрации
компонентов
скорости
об9]*.реа}[и]
равня_
лис; бь1
друг
другу.
^Бсли
подставить
в
уравнения
(27|)
и
(272)
вместо
переменной
9
знанение
равновесного
потенциала
в
данной
системе
9р,
пР3-
вь|е
части
этих
уравнений
долх(нь1
принять
одинаковое
значение.
|!оследнее
ус7овие
мо>кно сфор
мул и
ровать
та
к>ке следу}ощим
обра3ом
:
если
известно кинетическое
уравнение
прямой
и
о6ратной
реакции
и
если
значение
равновесного
потенциала
не и3вестно'
то
это!последнее
3начение
мох(ет
бьтть
найдено
как
ре1пение
уравнения'
вь1ра>кающего
условие
электрохимического
равновесия:.
]:
!'
(^*
бьтло
показ6но в глаье
111,
реп:ение
этого
уравнения'
действи-
тельно'
приводит
к хоро1по
и3вестному
и3
термодинамики
вырах(ени|о
для
равновесного
потенциала.
}казанная вь|1пе
картина
справедлива
для
любого
электрода'
на
поверхности
которого
протекает только
одна
пара электрохимических
реак-
ший
(т.
е.
прямая и
обратная
реакция),
как'
например,
для
цинкового
'электрода'
погрух{енного
в
раствор
сернокислого
цинка
(реакция
ра3ряда
и
ионизация
цинка), для
платинового
электрода'
погру}кенного
в
смесь
солей
двух_
и
трехвалентного
х(елеза
(реакшйи
окисления
Ре**
и
восста-
новления
Ре'**). Фчень часто
встречаются'
однако'
слг{а.и'
{огда
'на
электроде
одновременно
протекает
больп]ее
число
реакций.
6 такими
явлениями
мь1 встречаемся;
в
частности,
в
процессах
растворения
метал-
лов
в
растворах
электролитов.
*
Ради
упрбщен!ля
в
этой главе
мы
везде' где
обратное
специально
не
оговорено'
оудей
в-!]йеЁ'в?
пёр:Ёого
гру6ого
приблип<ения
счит-а|ь.велинину
ф'
по-стоянной
(т.
е.
о1!'}"п'ы
вс"
ураЁне!+ия:к р}ётвора#
с
одинаковой
общей концентр}циёй
электролита)'.
289

|1редставим
себе
металлический электрод'
погрух(енный
в
раствор
кислоты' насыщенный водородом.
Ёа
поверхности этого электрода
во3-
мох<но протекание
двух
пар
электрохимических
реакший
(с
унастием
водорода и
металла)
+
реакции
|'
€
),1
Ё*
+
е
*'/,
!1', скорость
'/'\[,*ъ1*
+
е
)
!т1'е,'
!
пе
-+
}1е
)
}1е
_+
!т1.;е,'
|
пе
>
>>
!2
>]2
€корости этих
реакций
3ависят
от потенциала
электрода
и
от
кон-
шентраций
реагирующих
компонентов. Ёекоторь1е
и3
этих
реакций
могут
йротекать
со скоростью,
неизмеримо
меньгпей скорости
остальнь1х;
если,
например,
в
первоначальньтй момент
времени
концентрация ионов
металла в
растворе
равна
нулю'
то'
естественно'
и скорость
[еак{иц
рд3_
ряда
этих ионов
долж|{а
равняться
нулю.
'
''
.&1ногие металльт,
пойещеннь1е
в
кислоть1'
растворятотся
с
образо_.
ванием
соответствующих
солей
и
газообра3ного водорода.
3то
ознаиает,
что в
отсутствие вне1пнего тока
скорость
реакции
ионизацит4
металла
и
скорость
реакции
-разряда
ионов водорода
превь!1пают
скорости
соот_
ветству1ощих
обратньтх
реакт{ий.
3ффективная скор9сть
растворения
ме-
талла
мо)кет
бьтть вьтрах<ена'
как
разность
плотностей тока
реакци14
|1они-
3ац|1и и
реакции
ра3ряАа
ионов
металла !';"-;, в
то время
как скорость
вь|деления водорода вь!рах{ается'
как
разность
плотностей тока
разряда
и
ионизации
водорода !':й_т'.
Ёсли
электрод
не
включен
в
электрическую
цепь
и
чере3 него извне
.1]е
проходит электрический
ток' то вь1деление водорода
и
растворение
металла происходят в эквивалентнь]х
количествах' т. е' скорости
обоих
лроцессов
!, и |,
равЁьт
.|_.2-
.с
(273)
(|"-скорость
саморастворения
металла) или,
подставляя
скорости
отдель-
"?*.?1-
нь|х электрохимических
реакции'
!1-!1:|'-12,
и'
следовательно'
+++€
!'* 1': ]т* !>.
(274)
6умма скоростей
всех
катоднь1х
реакций
равна
сумме скоростей
всех.аноднь|х
реакций;
колинество электронов'
освобо>кдающееся в
ходе
одной
реакции' равно
количеству электронов'
вступающих во
вторую
реакцию.
Ёа
поверхности
электрода
не происходит'накопления
элек_
трических зарядов' и
электрическое
состояние
системы во времени
не
меняется' т. е.
является
стационарнь1м.
}равнение
(273)
тт вь|рах(ает
усло-
цие
стацирнарности.
Б отличие
от
рассмотренного
вь|1пе примера
платин[4!ов&н$ФгФ БФ,{,Ф:
родного
электрода отс-утствие
вне1шнего
электрического тока в
последнем
случае-
еще
отнюдь
не
мо}кет слул(ить
при3наком
равновесия.
[отя
на
поверхности
электрода
соблю
дается
баланс
электрических
з&рядо8,
1(0./|1{.
чество метадла
вее врем8
убьтвает;
а
газообра3ный водород
все в!€}19:
|{акопляется'
т.'' е.; [и.м4!{-€скЁй
состав: системь|
постепенно меняется'
28

€корость
этих химических изменений
(т.
е.
скорость саморастворе-
ния металла)
мох<ет
бь:ть вьтчислена'
если и3вестнь1
кинетические
законо-
мерности
отдельных
электрохимических
реакций,
происходящих
на
поверхности
электрода.
Б,ля
расчета
величин этих токов
необходимо,
по1\{имо концентраций компонентов'
3нать
еще
величину потенциала
элек-
трода.
Ёа металлическом электроде' погру)кенном
в
раствор
кислоть!'
устанавливается
некоторое
стационарное
зЁачение потенциала, отличное
от
равновесного
потенциала
данного
металла и
от
равновесного
потен-
|\иала
водородного
электрода.
1очно
так
)ке' как
равновесньтй
потенциал
водородного
электрода мо)кет бь:ть
вьтведен
из
условия равенства
ско-
ростей разряда
и ионизации водорода, стационарный потенциал металли-
ческого электрода в
растворе
кислоть1
мох{ет бьтть, по крайней
мере
в
прин-
ципе'
определен
при помощи
уравнения
{274),
вь1ра)кающего
условие
ком-
пенсации четь1рех'
электрохимических процессов.
Аля
этой
цели
необ-.
ходимо подставить
в
уравнение
(27ф
вь]ра>кения
для
зависимости
ско-
рости
отдельнь!х
реакций
от потенциала
и концентраций и
ре1шить
полученное
уравнение
относительно
потенциала.
Рсли
предполо)кить,
что
кинетические закономерности
реакций разряда
и
иоцизации
металла
имеют такой
х(е
вид'
как и
для
реакций
с
участием
водорода' то
уравнение
(274)
принимает
вид:
@|рч
'эР9
ЁтРр $еР?
Ё,
[Б-]
е-
пт
{Ё,
[}1е"-]
е_
|]'т
:ь;р1#еФ+Ё'уе-тт
3ная величину
стационарного
потенциала
электрода' легко найти
величину
скорости
саморастворения
металлического электрода
в
растворе
кислотьт
!".
!"_'Ё,[Ё-]
е
-#у
_ь''р!|99#
:
ё!'еч#
-Ё,
[}1е'-]
,_#.
е76)
Бходящие
в
эти
уравнения
3начения
концентраший
могут бьтть задань:
заранее или
определяться
условиями
лиффузии
в
рассматриваемой
системе.
}равнение
(275)
в
таком виде, как правило'
однако'
не
применяется
для
расчета
величинь1 стационарного потенциала.
(ак
булет видно
и3
дальнейгпего,
во
многих
случаях скорость некоторь1х
электрохимиче-
ских
реакций
значительно мень1пе скорости
других,
одновременно с ними
протекающих. 3
этих
случаях в
уравнении
(275)
мо}кно
пренебрень нле-
нами'
соответству}ощими более медленнь1м
реакциям'
вследствие этого
ре[пение уравнения
упрощается.'Фсобенно
простое
ре1пение
получается
в том случае' когда
в
уравнении
(275)
остаются только
два
члена' т. е.
когда
мох{но пренебречь
скоростями всех
реакций,
кроме
одной
катодной
и одной анодной.
Беличиньт
стационарного
потенциала-
и
скорости саморастьорения
металла могутбьттьлегко.найденьт
графияеским путем.
Б главе 111
(рис.68)
мь1
ух(е
познакомились
со способом графинеского изобрах<ения
зависи-
мости скорости
п}ямой
и
обратной
электрохимической
реакции
от
потенциала
электрода. Ёа
рис.
|25
ъ
полулогарифминеском масгптабе
изобрах<ена
такая
}ке
зависимость
скоростей
реакшии
от
потенциала эле-
ктрода'
но
у:л<е
для
электрохимических
реакций
с
участием
как
водорода,
так
и
металла. Б
изобра>кенном
случае
кривь|е
для
реакций
с
у.|астием
металла
еильно сдвинуть1
в
область
отрицательнь1х
потенциалов по
срав-
нени}о
с
кривь1ми'
относящимися'к
вь|делению
и
иони3ации
водорода.
€плогпнь:м|4
л14:.1иям|4
приведень| кривь1е
зависимости
ффктивной
ско-
рости
выделе!1ия водорода
(]')
и'растворения
металла
(|')
от потенциала
электрода. Б
отсутствие
вне[пнего тока эти
две
скорости
равнь1,
т. е.
%4
(275)
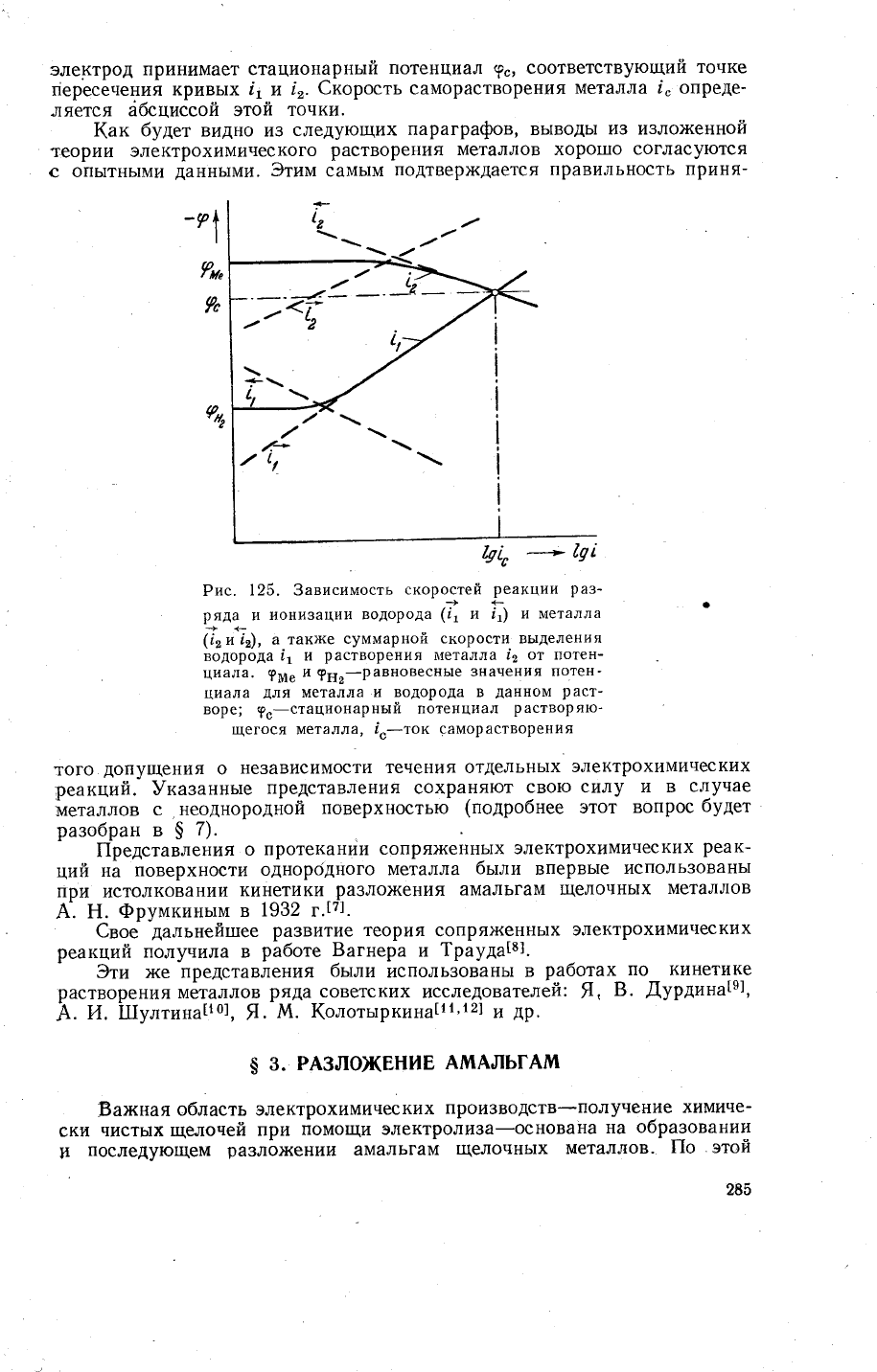
электрод
принимает стационар!{ь|й
потенциа.!
|с>'соответствующий
точке
пересечения
кривь|х !1
и
!,.
€корость саморастворения
металла |" опреде_
ляется
6бсциссой этой
точки.
1(ак булет видно и3
следующих
параграфов' вьтводь1
из изло)кенной
теории электрохимического
растворения
металлов хоро1по
согласуются
с
опытнь|ми
даннь1ми.
3тим
самь|м
подтвер}кдается
правильность приня-
-Р|
Ру,
9,
Рис.
125. 3ависимость
''','"'"'''{"^;':^:'
чд}
и
ионизации
водорода
с1
"
Б
и металла
'
(!'и
!), а.такх(е
суммарной
скорости' выделения
водорода
,1 и
растворения
!\{еталлА
12 Ф"| потен_
циала.
9ме
и
9н2-равновеснь|е
3начения
потен_
циала
для
металла
и водорода в
данном
раст-
"
"
,
?..*.'
;:
};#;:
;"т
"#
1";ъ1'
:;'#:
"'
того
допущения
о
независимости
течения отдельнь]х
электрохимических
реакций.
}казанньте
представления сохраняют
свою силу
и в
сл-учае
металлов
с
.
неоднородйой
поверхностью
(подробнее
этот
вопрос
будет
'""яъъь;.}'],];"
о
протеканйи
сопря>кенных
электрохимических
реа
к-
ций
на
поверхности
однорбдного
металла
6ьтли
впервь1е
использовань!
при
истолковации
кинетики_-ра3лох{ения
амальгам
щелочньтх
металлов
А_.
н.
Фрумкиньтм
в
1932
г.|71.
€вое
дальнейтпее
развитие
теория
сопря)кеннь1х
электрохимических
реакций
получила в
работе
Багнера
и
1рауда|8].
_
3ти )ке
представления
бьтли
исполь3овань1
в
работах
по кинетике
растворения
металлов
ряда
советских
исследователей:
я'
в.
Аурдина|р],
А.
и' !11ултина!1о:,
9._м.
(олоть:ркич3!11,121
ц
др.
$
3.
РА3лохвнив
АмАльгАм
8а>кная
область электрохимических
прои3водств_получение
химиче-
ски
чистых
щелочей
при
йомощи электроли3а-основана
на
о6разовании
и
последующем
разло}{{ении
амальгам
щелочнь1х
мета'1лов.
||о этой
/?
./
(.;
------/-
.?=+
',
-12
285

лричине
вь1яснение механизма
реакции
ра3ло}кения
амальгам
предс1ав-
ляет
не
только
теоретическпй, но и
практический интерес.
Б
ряде ра6от
бьтло
установлено,
что скорость
разло}{ения
амальгамь}
натрия воднь1ми
буферньтми
растворами
в
отсутствие кислорода
воздуха
пропорциональна
квадратному
корню
из
концентрации натрия
в амаль-
1ду3[131. |акая
зависимость
скорости
!еакцдд
от концентрации
реагирую-
щих
веществ
встречается
довольно
редко.
Асходя и3
обь]чнь|х
закономер-
ностей
химической
кинетики' мо)кно
бьтло бьт
предполох(ить'
что
амаль-
гама
долх<на
ра3лагаться
со
скоростьто' пропорциональной ее
концен_
трации' т. е.
по
мономолекулярному
3акону.
Ёа основе
представлений
об
электрохимическом
механизме
растворения
мо>кно'
однако' легко
истолковать
эту
необь1чную
зависимость и'
как булет
видно из
дальней-
1пего' теоретически
вь1числить константу
скорости
реакции.
Ёа
поверхности
амальгамь1 возмо>кнь1
следу}ощие
электрохимиче-
ские
реакции:
!{**е->Ё
"*'р'"', '_]
Ё-+Ё*{е
',
;
}{а**е*>\а
)
й
\а_+!'{а*{е
>
'
в
данном
случае
рассмотрение
механизма
упрощается
6лагодаря
тому'
что обратной
реакцией
ионизации водорода
мо>кно
пренебрень,
так
как амальгама натрия имеет весьма
отрицательнь:й
потенциал
|4!,
',"",
мало.
1аким образом,
по
водороду
мо>кно
учить|вать
ли1пь одну пряму1о
геар}#
натрия во3мо'{нь|
две
реакции:
переход
в состояние ионов
и
о6рат-
ная
реакция-образование
атомов натрия и3 ионов.
|[ереход
в состояние
ионов
дол)кен
происходить
несколько бьтстрее,
так
как
суммарная
реакция
идет
в сторону
разло)кения
амальгамьт.
ффективная
скорость
растворе-
ния]{ащия |2 является
ра3ностью
скоростей
ио|1изац|1и и
разряда
натрия
]я:!ц-]я'
в отсутствие
пось!лаемого
и3вне
тока
амальгамньтй
электрод при-
нимает стационарное
состояние'
которое определяется
равенством
ско-
ростей
выделения
водорода и
растворения
натрия
+€+
|т: !я_
!>'
(277}/
||одставляя в
уравнение
(277)
вь|ра)кения
для
зав|4ср1мости скорост|{
ка>кдой отдельной электрохимической
реакции
от
потенциала
электрода
и от
состава
раствора
и
ре1пая
это
уравнение
относительно потенциала'
мох<но найти 3начение
стационарного
потенциала амальгамного эле-
ктрода
и при
его
помощи величину
скорости
ра3ло)кения
амальгамь}
натрия'
Фднако в
рассматриваемом
случае- величина
скорости саморастворе-
ния
металла
мо>кет
бьтть найдена еще
более прость1м
путем.
(ак
показь::
вает опь1т'
при
пропускании электрического
тока
умеренной
силь1 от
вне!ш-
него источника
через амальгамнь1й
электрод' находящийся в
растворе'
содерх(ащем ионь|
[''[а*, потенциал этого электрода
почти не меняется.
3то означает,
что токи
разряАа
ц
йонизации
натрия в
отдельности
очень
велики
и
относительное
их и3менение
при прохо)|{дении
вне|шнего
тока
так
мало'
что
не сказь!вается
на состоянии электрода.
1о
же самое имеет
место'
когда
амальгамнь:й
электрод
не поляри3уется
вне1пним источником'
286

но: на
нем
выделяется-
водород.
1ак как
перенапрях(ение
водорода
на
амальгаме
(как
и
на
чистой
ртути)
велико'
скорость
вь]дедения
водорода
сравнительно
мала
дах<е
при очень
отрицательнь1х
3начениях
потенциала
амальгамного
электрода.
поэтому в
уравнении.(277)
левая
часть является
величиной
небольп:ой
посравнению с
членами правой
части' которь1е'
ка}к-
дьтй
в
отдельности'
очень
велики.
1аким
образом' одновременное
проте-
кание
реакции
вь1деления
водорода
сравнительно
мало меняет
скорости
реакций
обмена
натрия' и
равновесие
ме)кду
натрием амальгамь1
и
ионом
натрия
почти не
нару1пается.
|1о
этой причине
с
достаточнь1м
прибли)ке_
нием
мо>кно считать'
что
потенциал
растворяющегося
амальгамного
электрода
совпадает
с
равновеснь1м
потенциалом
амальгамного
электрода
в
растворе
ионов
натрия
той
х(е
концентрации.
|!ринятое
допущение
о приравнивани|1
стационарного
потенциала
равновесному
законно во
всех случаях'
когда ток
обмена
мех{ду
метал-
лом и его
ионами
велик'
а
скорость
ра3ряда
ионов
водорода
мала'
ка.к
это' в
частности' имеет
место в
случае
ра3лох(ения
амальгамы
натрия*.
Ёайдем вь]рах(ение
для
скорости
растворения
амальгамь1
натрия
в кислых
буфернь:х
растворах'
содер}кащих
3начительное
количество
ионов
натри;
^(Ёапримёр,
в
растворах
фосфатов
натрия).
3
этих
раство_
рах
мо)кно
в
первом прибли}1(ении
не
учитывать
изменение
концентра-
ции
ионов
}{а*
и Ё*,
происходящее вследствие
иони3ации
натрия и вь1де-
ления водорода'
и
считать
эти
концентра|\|1|4
постоянными.
Ёсли
считать амальгаму
разбавленной
по отно1шению
к натрию'
то
дл'я
равновесного
потенциала
мох(но
написать:
Рш':9$'+$
:,
[1'{а-]
_
$:,
1ш.1
:
91ч'_$
:.
1ш,1,
(27в)
где
[ша]-концентрация
металлического
яатрия в
амальгаме**.
9&'
(нор-
малЁньтй
потенциал
амальгамь|
натрия)
согласно
наиболее
надех{нь1м
даннь1м
равен-1
,&44
в.
|1о
отноцлению
к
водороду
система'
так
как на амальгаме
разря'(аются
ионь!
водорода
а
||он\13ац\4и
водорода
не
происходит'
Аля
того
что6ь|
найти величину
{,
необходимо
тическое
уравнение
реакции
вь1деления
водорода
*9Р
*чР
7':Ё,
[['|-]
е-Б-:
2\ е_т
очевидно'
далека
от
равновесия'
со скоростью
,1,
подставить в
кине-
3начение
равновесного
потенциала
амальгамного
электрода
нению
(27в).
(27э)
по
урав-
*
|1о тем
}ке причинам
(сушествоваяие большого
тока
обмена
для
реакции
разряда
и
ионизации
щелочных
мета'л!тов)
потепциал
мало меняется
'1
пр'1 катодной
поляриза-
ции
амальгамы.
3то
обстоятельство
имеет больтпое
значение
при
опр_еделении
опти-
мальных
условий
работы
ртутной
ванны
для
хлорного
электролиза.1ак
как
потен-
циал
ртутйого
электрода
мало меняется
с
плотностью
вне1пнего
тока'
то
с
ростом
послед-
него
растет
в основном
скорость
выделения
натрия| в
то время
как
скорость
вь|деления
водоРода
почти
не меняется.
(
лругой
стороны'
скорость-
выделения
хдора
на аноде
ванны пропорциональна
плотности
тока.
||оэтому
во избея<ание
появления в
ванне
взрывнатой сйеси
хлора
и водорода
электролитическое
образование
амальгамь1
дол)кно
вест1!сь
при
достаточно
вь|соких плотностях
тока.
**
Айальгамы
щелочных
металлов
обнару:кивают
у)ке
при
малых
концентрациях
щ"'',,'''
й"','''
6ол,шие
отклонения
от
3аконов.йдеальных
растворов.
||оэтому
при
не сли[||ком
ни3ких концентрациях
натРия
в
ртути
значение
концентрации
[1''!а]
в
уравнении
(278)
дол>кно
быть заменено
на
значение
активности'
что приводит
к более
сло)кным
кинетическим
соотно1цениям.
28т

}нитьтвая,
что
скорость
вь1деления
водорода пропорционалъна
ско-
рости уменьшения
концентРа|\ии
натрия
в амальгаме
!1:!':-Ё,{#
,
получаем после подстановки
в
уравнение
(279)
!'!е
- чд
:#
,#
(,1,'_#
:п
|ша])
:
Ё,
[тта]*
,
А* 1зщ
ь':+е
н'1'
'
-_
/
:й
(}/шф
-
1,,ща1)
1,,
ща]:
угБй_
\
с.
(2в0)
(281)
(2в3)
(2в4)
(ак
бьлло
пока3ано
в
главе
1|!,
в случае
вь]деления
водорода
на
ртути
константа а
6лизка
к
1/'.
}1ох<но предполох{ить'
что
эта закономерность
сохраняется
и
Аля
разбавленньтх
амальгам.
||рис:1/,
уравнение
(2в0)
принимает
вид:
-цР:!,[\2]1/з
(2в2)
1аким
образом,
исходя
и3
представления
об электрохимическом
механи3ме
пРо{есса
растворения
амальгам
и из
уравнения
для
пере-
напрях<ения
водорода' мь!
получаем
вь1рах<ение'
согласно
которому
ско-
рость разло}кения
амальгамь1,
действительно'
дол>кна
бь:ть пропорцио-
нальна
квадратному
корню
и3 концентрац|1и
амальгамь1' |{ак
это и бьтло
найдено на
опь|те.'
Бсли
проинтегрировать
дифференциальное
уравнение
(2&2),
с
учетом
начального
условия'
согл_а_сно которому
лри
!:0 величина
[!.{а] равна
исходной концентрации
[},[а],,
получим:
(ак
видн-о
и3
уравнения
(284),
корень
квадратньтй
и3
концентрации
амальгамь|
убьтвает
со
временем по
линейной
зависимости.
Бследствие
этого
рассматриваемая
реакция
полностью
завер1пается
в
конечньтй
от-
резок
времени'
равньтй
":#и
шф.
1акой
ре3ультат
необьтнен;
для
химических
реакций
первого'
второго
и более
вь|соких
порядков
понятие
конца
реакции'
как
известно'
является
неопределеннь|м;
скорость.
этих
реакций
асимптотически
прибли}кается
к
нулю,
иначе
говоря'
эти
реак-
ции
постепенно
затухают'
а не обрь:ваются
вне3апно.
-
||равильность
вь]веденного
закона
кинетики
ра3лох<ения
амальгам
бча
экс-периментально
подтверждена
в
работах
_€.
и.
€клярент<о|16!
и
3' А.
йофа|:ь:. Б
других
случаях
ра3ло)кения
амальгам
могу| наблю-
даться
и
несколько
инь]е
соотно1пения;
так'
легко пока3ать'
что
для
амаль-
гам
двухвалентнь|х
металлов,
например'
6ария
или
цинка'
те
)ке
сообра-
)кения приведут
к зависимости,
по
которой
скорость
ра3ло)кения
пропор-
циональна
корн}о
нетвертой
степени
и3 концентРацпи
2у2д51,2ц51[8!.
-
|!риведеннь]е
вь|1]]е
соотно1пения
справедливь]
в том
случае' когда
во
время
реакции
меняется
ли1шь концентрация
амальгамь{'
а
концентра-
ции
других.компонентов
системьт
(ионов
водорода'
ионов
металла
в
ра-
створе
и
др.)
остаются
постояннь]ми.
Б
слу.!ае
разло)кения
амальгам
растворами'
в
которь[х
концентрации
компонентов
не остаются
постояннь|ми'
уравнения
реакции
принимают
288

несколько
более
сло>кный
вид;
эти
уравнения
могут
бь:ть
выведень1
ана-
логичнь|м путем;
но
при
этом
необходимо'
коневно,
учить1вать
изменения
концентрации
ионов
в
уравнении
д]1я
кинетик|1
разряда
ионов
водорода.
Ёсли,
кроме
того'
при
этом
заметнь:м
образом
и?ме"яе'ся
общая
й;йа;-
трация
электоолита
в
растворе,
то необходимо
также
учесть
влияниеф:-
потенциала
и ввести
в
кинетические'уравнения
соответствующие
видо-
изменения|16].
Ёа
практике
чаще
приходится
иметь
дело
с
разлох{ением
амальгам
щелочными
растворами'
в
ко-торь|х
вь1деление
водорода
происходит
за
счет
разряда
молекульт
водьт.
|,\сходя
из
рассмотреннь|х
здесь
принципов'
мох(но
вывести
диффре1шиальньте
уравнения
реакции
разлох{ения
амаль-
гам
и
для
этого
случая.
['ля
такого вь!вода
нео6ходимо
использовать
урав-
нение
для,
перенапрях<ения
водорода
на
ртутном
катоде
в
щелочнь|х
растворах
(см.
уравнение
227)
и
уравнение
для
равновесного
потенциала
амальгамного
электрода.
Абсолютная
величина
константь1
скорости
разло)!(ения
амальгам
в
щелочнь1х
растворах'
как вь]текает
и3
и3ло'{ен-
'ного'
мо)кет быть
вь:числена
из нормального
потенциала
амальгамного
электрода
и
перенапря)кения
водорода
на
ртутном
катоде
в
щелочнь1х
растворах.
|[олуненньте
та(им
образом
уравнения
для
скорости
разло-
)кения
амальгам
щелочнь1х
металлов
хоро1шо
согласуются
с опь1том.
Фбрат-
но'
по скорости
ра3лох(ен}1я
амальгам
мо)кет
бьтть
найдена
величина
пере_
напря}кения
водорода
в
щелочнь1х
растворах'
как
это
у)ке ука3ь]валось
в главе
1|[.
$
4. РАствоРвнивтввРдь|х
мвтАллов
с
вь|двлвнивм
водоРодА
Рассмотренная
вь]]пе'
реа
кция
разлох<ения
амальгам
характеризуется
тем' что
в ходе
процесса
происходит
постепенное
изменение
концентрации
растворенного
в амальгаме
металла.
||ерейдем
теперь
к процессу
растворе-
ния чисть|х
металлов'
при
котором
не происходит
и3менения
состава
металлической
фазьт.
'
Рассмотрим
два
отличающихся
друг
от
друга
крайних
случая
-рас-
творения
твердь]х металлов
в кисль1х
растворах
(в
отсутствии
кислорода
воздуха).
€начала
разберем
слунай,
когда
скорости
ра3ряда
ионов
|| |1они3а-
ции
металла
велики'
а скорости
разряда
ионов
и
иони3ации
водорода
маль1. 3тот
слунай
аналогитен
тому,
которь:й
наблтодается
при
ра3ло-
х(ении
амальгам
щелочнь|х
металлов.
3 качестве
типичного
примера
мо)кет
слу'{ить пРоцесс
Растворения
свинца
Р
серной кислоте'
протека}ощий,
например,
в
свинцовом
аккуму-
л яторе. Б
зарях<енном
а ккумул
яторе отрицательнь]е
пласти
нь1 представл
яют
собой металлический
гу6натьтй
свинец, погру}кеннь:й
обьтчно
Ё
3
н.
серную
кислоту.
||ри стоянии
аккумулятора
происходит
растворение
свинца
с вьщеле!!ием
водорода' что
приводит
к
самопрои3вольному
его
ра3ряду.
Б
данном
_случае
возмо}кно протекание
тех же четь1рех
электрохими-
ческих
реакций,
которь1е
6ьхли
указань|
вь]1пе.
3десь
такх{е мо)кно
прене-
бреньскоростьюиони3ации
водорода' потому
что потенциал
свинца
Ё
&
н.
серной кислоте
значительно
более
отрицателен
(примерно
на 0,37
с),
нем
обратимьтй потенциал
водородногоэлектрода
в этой
растворе.
Ф*стаются
тРи лроцесса'
скорости которь1х
связань1
соотно1пением
7':
!'-!'.
€ледует
3атем
учесть'
что по
сравнению
со скоростью
вь1деления
во-
дорода
скорости
ра3ряда
|1
иони3ации
свинца
велики.
Бэтихусловиях'
как
и в случае
ра3ло)кения
амальгам'
ре1пение
3адачй
мох(ет бьтть
найдено
19
кшнет;:на
0лентродп.
процессов
289
достаточно
просто'
так
как потенциал
электрода
практическиочень
бли-
зок
к
потенциалу
равновесного
свинцового
электрода'
которь1й
опреде_
ляется
термоди11амическим
уравнением
9:90+#1п
[РБ*-],
(285)
где
90:-0,
13 с
по
нормальному
водородному
электроА!'
.
!1ри
раст,орении
свинца
в
растворе-черной
кислоть1
образуется
мало'
растворийая
сернокислая
соль
свинца.
||о протпествии
короткого
проме-
>кутка_временирастворделаетсянасыщеннь1мипроисходитвь|падение
соли
в
твердом
виде.
"-".'н
'';;ь:1'6
йобрах<еньт
3ависимости
потенциала
от
логарифма
плот-
ности
тока при
катодной
1*ри,а"
2), атак>хепри
анодной
(кривая
/)
поляри-
-у
0,80
0.60
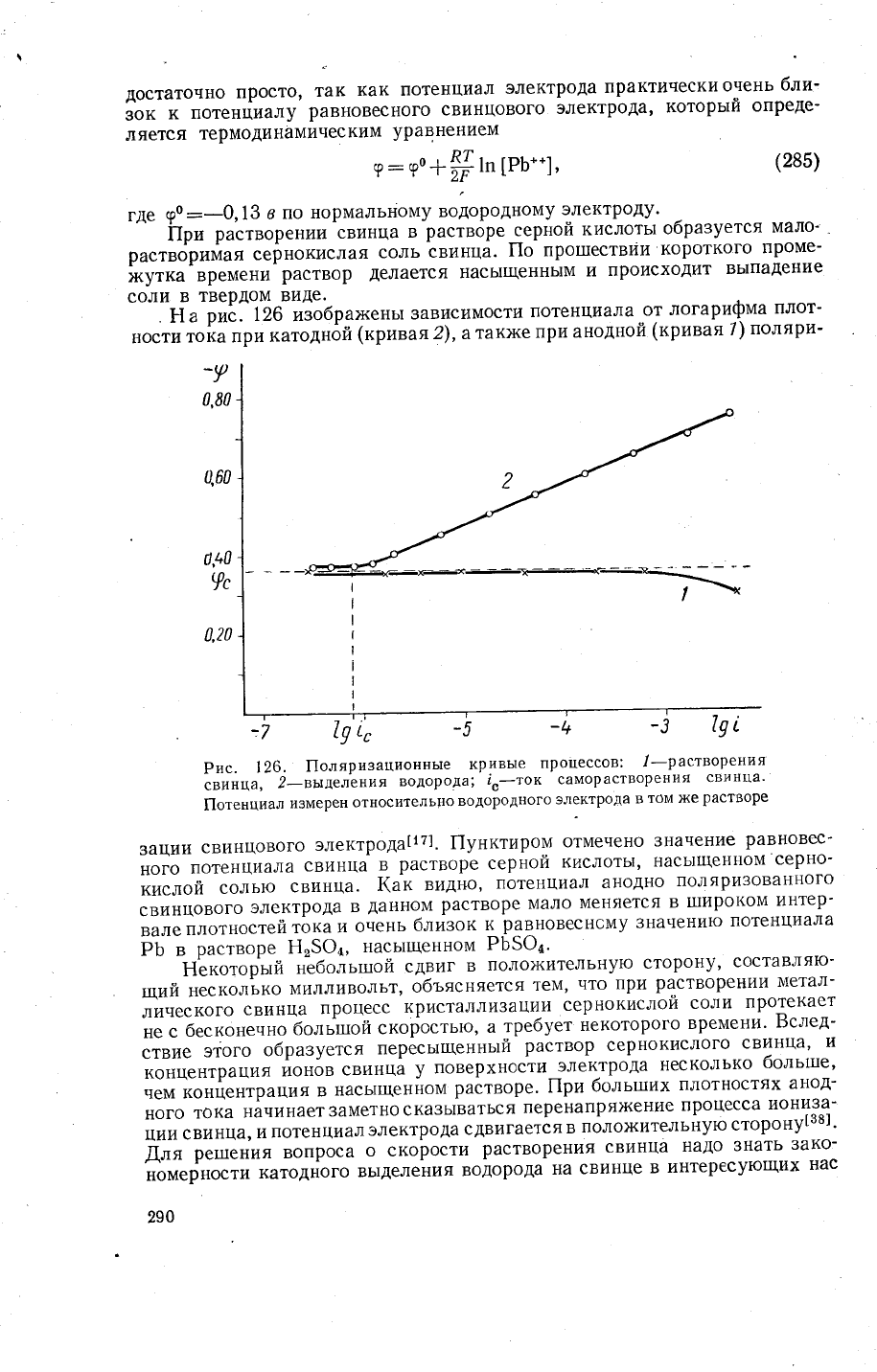
Рис.
\26.
|1оляризашионные
кривь|е
процессов:'1-растворения
",""ц',
2-вь:деления
водорода;
1"_ток
саморастворения
свинца'
|1отенциал
измерен
относительно
водородного
электрода
в
том же
растворе
зации
свинцового
электрода|1т].
||унктиром
отмечено
3начение
равновес_
ного
потенциала
свинца
в
растворе
серной
кислоть!'
нась1щенном
серно-
кислой
солью
свинца.
|(ак
видт+о,
потенциал
анодно
поляризованного
свинцовогоэлектродавданномрастворемаломеняетсяв1пирокоми1{тер.
".'"
,''','стей
тока
и
очень
близок
ц
равновеснсму
3начени1о
потенциала
ЁБ_
'
р'"',оре
Ё'59д'
нась1щенном
РБ5Фд'
Ёекоторьтй
нБбольтпой
сдвиг
в
поло)кительную
сторону'
составляю_
щий
несколько
милливольт,
объясняется
тем,
что
при
растворении
метал_
лического
свинца
процесс
кристалли3аци-и
сернокислой
соли
протекает
""
]о"".'"ечно
бол{тшой
скоростью,
а
требует
йекоторого
времени'
Бслед-
-""'"
этого
образуется
пересь|щеннь:й
раствор
сернокислого
свинца'
и
концентрация
ионов
свинца
у
поверхности
электрода
несколько
больтпе,
чем
концентрация
в
нась|щенном
растворе.
|1ри
больтших
плотностях
анод-
ного
тока
начинает
заметно
сказь]ваться
перенапря)кение
процесса
иониза_
циисвинца'ипотенциалэлектродасдвигаетсявполо}кительнуюсторону!..,.
!,ля
ретпения
вопроса
о скорости
растворения
свинца
надо
3нать
3ако-
номерности
катодного
вь1деления
водорода
на
свинце
в
интересующих
нас
290
090
9с
0,20
-+
:7
