Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


,,Н-ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИИ 171
рН-зависимость параметра
k
C
at/Km
получается из рН-зави-
симости v при низких значениях [S] [или из отношения уравне-
ний
(5.18)
и (5.19)]. Уравнение
(5.17)
можно упростить, поло-
жив [S] равным нулю и преобразовав его к виду
(5.20)
kcat/Км
(и v при[Э]<С Дм) определяется ионизацией свобод-
ного фермента.
3. Простое правило для идентификации компонента
ферментативной
реакции, определяющего характер
рН-зависимости
кинетических параметров
Приведенные выше результаты являются следствием общего
правила, состоящего в том, что «зависимость константы равно-
весия К или константы скорости k от рН для процесса X -*• У
определяется константами ионизации X».
Применим
это правило к
схеме
(5.14), имея в
виду,
что суб-
страт также может содержать способные к ионизации группы.
а.
рН-зависимость
&
ca
t.
Рассматривается процесс
fc
cat
ES *• ЕР.
(5.21)
рН-зависимость параметра /e
C
at определяется ионизацией фер-
мент-субстратного комплекса.
б.
рН-зависимость
Дм-
Рассматривается процесс
ES —^*- E+S.
(5.22)
рН-зависимость /См определяется ионизацией фермент-субстрат-
ного комплекса.
в. рН-Зависимость 1/Д^
Рассматривается процесс
Е+
S —^ ES.
(5.23)
рН-Зависимость 1//См определяется ионизацией свободного
') Может вызвать удивление тот факт, что использование 1//См вместо Км
дает
иное значение рК
а
- Математическая сторона этого вопроса ясна из ана-
лиза уравнений
(5.11)
— (5.13). рН-Зависимость Кп позволяет получить рКа
для Е, S и ES, однако для разных графиков эти константы определяются
различными способами. Другой подход к анализу зависимости lg Км от рН
предложен Диксоном [1].

172
ГЛАВА
5
фермента и свободного субстрата.
г.
рН-Зависимость
ft/К
cat/M
/с пл\
E+S
У ЕР. (5.24)
рН-Зависимость
£
C
at//(M
определяется ионизацией свободного
фермента и свободного субстрата.
В. Модификации простой теории и отклонения от нее
Для объяснения рН-зависимости параметров каталитическо-
го процесса в случае более сложных механизмов, чем механизм
Михаэлиса — Ментен в его первоначальном виде, необходимо
модифицировать рассмотренную выше в общих чертах простую
теорию.
1. Модификации,
обусловленные
наличием
дополнительных
промежуточных
соединений
а.
Промежуточные
соединения,
образующиеся
в
ходе
реакции
[3]
*S
*2
ft
3
E+S
=?==*
ES »- ЕА -> ЕР. (5.25)
Присутствие дополнительных промежуточных соединений не
сказывается на рН-зависимости kcaJKn или l/Км, поскольку
эти
параметры зависят только от свойств свободного фермента и
свободного субстрата. рН-зависимость k
ca
t или 1//(м и в этом
случае позволяет получить р/Са для свободного фермента и
свободного субстрата. Однако теперь рН-зависимостьй^и/См
отражает изменение свойств как промежуточного соединения,
так
и фермент-субстратного комплекса. Если ЕА в уравнении
(5.25) представляет собой основное фермент-содержащее со-
единение,
то рН-зависимость k
ca
t и Км даст его р/(
а
. Если же
накапливаются и ES, и ЕА, то мы получим значение р/С
а
, явля-
ющееся средневзвешенным значением между р/С
а
для ES и ЕА
И].
б. Наличие
непродуктивного
связывания [5]
В том случае, когда наряду с продуктивным происходит
непродуктивное связывание субстрата, рН-зависимость k
ca
\ и
Км может дать кажущееся значение р/Са для важной в катали-
тическом отношении группы активного центра, которое далеко от
его действительного значения в продуктивном комплексе. Такая

рН-ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ 173
ситуация имеет место в том случае, если соотношение
между
продуктивным и непродуктивным связыванием сказывается на
ионизации
этой группы. Предположим, что активность фермен-
тов зависит от состояния группы, которая при высоком значении
рН
находится в форме основания. Если, скажем, при низком рН
продуктивное связывание
субстрата
осуществляется легче, чем
при
высоком, то происходящее при снижении рН (через р/Са
каталитической группы) уменьшение скорости по мере протежи-
рования этой группы
будет
частично компенсироваться увеличе-
нием непродуктивного связывания. В
результате
кажущееся
значение р/С
а
, определяющее рН-зависимость
k
ca
t,
станет мень-
ше,
чем р/Са для продуктивного комплекса. рН-Зависимость
/См изменяется аналогичным образом.
Проанализируем этот случай с привлечением математичес-
кого аппарата.
*
а
НЕ
=*=*=
Е
HES =?=* ES — *• ЕР
(5.26)
Медленно-
«И
к
HES' =е=* ES'
Здесь HES и ES — продуктивные комплексы, К' и К — кон-
станты равновесия для процессов взаимопревращения
между
ними
и непродуктивными комплексами HES' и ES'. Решая
уравнение скорости, получаем
(5>27)
Преобразовав уравнения
(5.27)
и
(5.28)
к виду (5.8), из
знаменателя выражения получаем, что наблюдаемое значение
р/(а равно
P^obs
= P<-'g
(
(
1
1
+ ff
)
-
(5.29)
По
причинам, обсуждавшимся ранее, рН-зависимость
&cat//CM и l/К/л при наличии непродуктивного связывания не
изменяется.
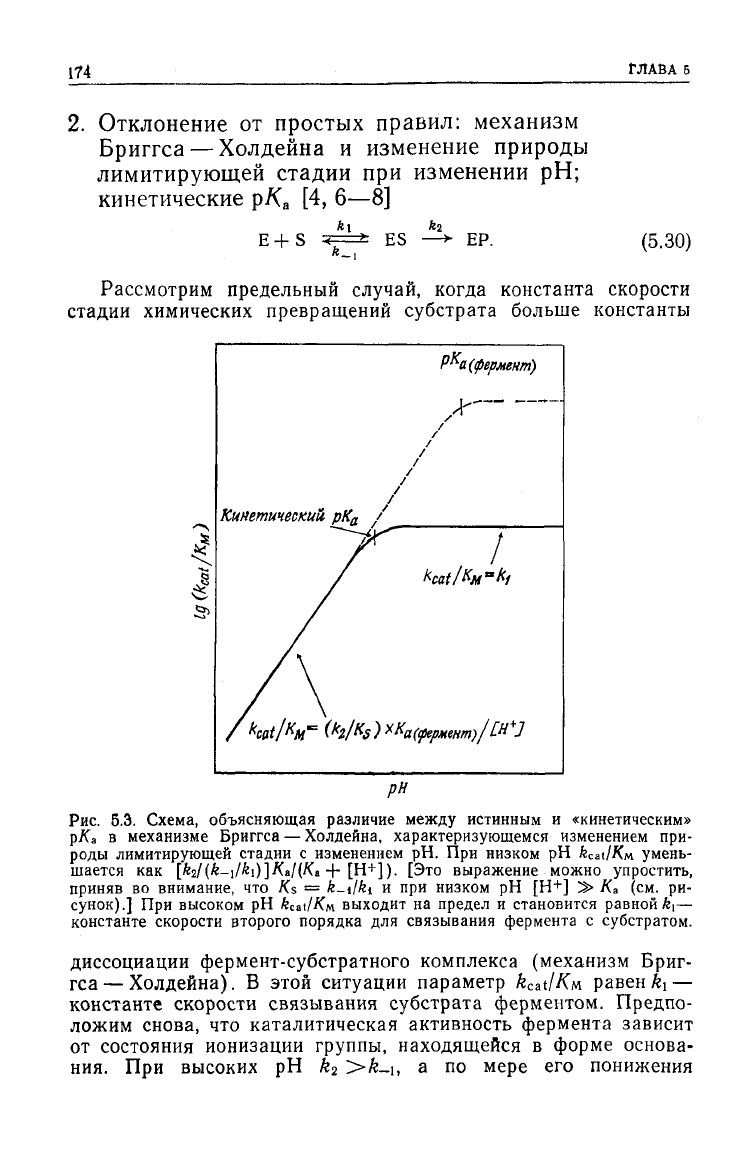
174
ГЛАВА
Б
2. Отклонение от простых правил: механизм
Бриггса — Холдейна и изменение природы
лимитирующей стадии при изменении рН;
кинетические
рК
а
[4, б—8]
Е+
s
ES
ЕР.
(5.30)
Рассмотрим предельный случай, когда константа скорости
стадии химических превращений субстрата больше константы
Рис.
б.Э. Схема, объясняющая различие
между
истинным и «кинетическим»
piCa в механизме Бриггса — Холдейна, характеризующемся изменением при-
роды лимитирующей стадии с изменением рН. При низком рН
k^ilKn
умень-
шается как [A
2
/(fe-i/^i)]/(a/(/(a +
[Н+]).
[Это выражение можно упростить,
приняв
во внимание, что Ks =
fe-1/61
и при низком рН [Н
+
] » К
а
(см. ри-
сунок).] При высоком рН fccat/Км выходит на предел и становится равной k
t
—
константе скорости второго порядка для связывания фермента с субстратом.
диссоциации
фермент-субстратного комплекса (механизм Бриг-
гса— Холдейна). В этой ситуации параметр
kcat/Км
равен ^ —
константе скорости связывания субстрата ферментом. Предпо-
ложим снова, что каталитическая активность фермента зависит
от состояния ионизации группы, находящейся в форме основа-
ния.
При высоких рН k
2
>k-\, а по мере его понижения

рЫ-ЗАВИСИМОСТЬ
СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИИ 175
къ уменьшается вследствие протонирования основания, пока не
станет меньше й_ь Это приводит к
тому,
что кажущееся значение
рКа,
определяемое из рН-зависимости
kcat/Км,
получается
меньше р/С
а
участвующего
в катализе основания (рис. 5.3) [7].
Можно
показать, что кажущаяся константа ионизации опреде-
ляется соотношением
•/Сарр
= -Ка (^2 +
k-i)/k-i,
(5.31)
где
К&
— константа ионизации данной группы фермента.
/Сарр называется
кинетическим
р/С
а
, поскольку он определя-
ется не ионизацией как таковой, а зависит от отношения кон-
стант скорости процессов, не связанных с переносом протона.
Кинетические
р/С
а
получаются всякий раз, когда природа лими-
тирующей стадии изменяется с изменением рН.
3. Экспериментальное определение кинетических
и
равновесных р/(
а
[7, 8]
рЯа, которые представляют собой комбинацию констант рав-
новесия
и р/Са конкретных титрующихся групп 1как в
случае
непродуктивного связывания; уравнение (5.29)],определяются в
ходе
титрования как реально существующие р/С
а
. Если в фер-
мент-субстратный комплекс [схема
(5.26)]
включить кислоту
или
основание, то каталитическая группа
будет
титроваться в
соответствии с р/С
а
, определяемым уравнением (5.29). Анало-
гичным образом, если измерять с помощью того или иного спек-
трального метода долю основания, находящегося в ионизиро-
ванной
форме, то обнаружится, что оно ионизируется с р/Са,
определяемым уравнением (5.29). Иначе обстоит дело с
кине-
тическими р/Са-
Для механизма Бриггса — Холдейна, характеризующегося
тем, что природа лимитирующей стадии изменяется с измене-
нием
рН, прямое титрование каталитических групп
будет
давать
истинную константу, отличающуюся от соответствующих вели-
чин,
получаемых из рН-зависимости ft
C
at//(M [см. уравнение
(5.31)].
4. Микроскопические и макроскопические р/С
а
Когда кислота представлена различными формами, напри-
мер HES и HES' [схема (5.26)], р/С
а
каждой из этих форм
называется
микроскопическим.
рК
а
системы, определяемый тит-
рованием,
например рДоьз в уравнении (5.29), называется по-

176
ГЛАВА
5
разному:
макроскопический,
кажущийся
или
групповой
рК
л
.
В отличие от кинетического этот р/Са во
всех
случаях
является
истинным.
Г. Влияние поверхностного заряда на рК
а
групп в ферментах
На
поверхности молекулы фермента находится множество
полярных групп. Так, например, на поверхности химотрипсина
локализованы 4 остатка аргинина и 14 остатков лизина, которые
имеют положительные заряды, и 7 остатков аспартата и 5 —
глутамата,
заряженных отрицательно. Это приводит к созданию
вокруг молекулы фермента ионного окружения, т. е. электро-
статического поля, которое может стабилизировать или
деста-
билизировать находящиеся внутри белковой
глобулы
(или ча-
стично погруженные в нее) ионные группы. Проведенные Лин-
дерстрём-Лангом расчеты показали, что изменение рКа
погру-
женных групп является сложной функцией размера и формы
молекулы белка, а также ионной силы раствора [9]. Значение
этих эффектов четко показано в ряде работ, в которых располо-
женные на поверхности карбоксилат- или аммоний-ионы подвер-
гались химической модификации.
При
высоком рН активный центр химотрипсина несет отри-
цательный заряд, а при низком — нулевой. Можно ожидать, что
оснбвная
форма активного центра при высоком рН
будет
стаби-
лизироваться положительным поверхностным зарядом и
деста-
билизироваться — отрицательным. Как видно из табл. 5.2, это
предположение подтверждается экспериментально. Превраще-
ние
14 положительно заряженных остатков лизина в отрица-
тельно заряженные карбоксилат-ионы при взаимодействии хи-
мотрипсина
с янтарным ангидридом приводит к
тому,
что р/С
а
группы, степень ионизации которой определяет рН-зависимость
&cat
для гидролиза метилового эфира ацетилтриптофана, уве-
личивается от 7,0 до 8,0. И наоборот, превращение 13 отрица-
тельно заряженных карбоксильных групп в положительно заря-
женные амины понижает р^
а
до 6,1. Аналогичным образом
ацилирование
поверхностных аминогрупп трипсина уксусным
ангидридом приводит к увеличению р/С
а
свободного фермента
на
0,2 единицы.
Эти эффекты можно промоделировать с помощью изменения
рН.
При рН < 5 карбоксильные группы протонируются, а при
рН
> 9 аммонийные группы лизина в
результате
депротониро-
вания
начинают
утрачивать
свой положительный заряд. При
экстремальных значениях рН это вызывает изменение кривых
титрования фермента. Наиболее сильно такие эффекты проявля-

рН-ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
177
Влияние поверхностного заряда фермента на рКл
Таблица
5.2
-Фермент
Химотрипсин
а
)
Сукцинилхимотрипсин
а
)
Этилендиаминхимотрип-
син
Трипсин
8
)
Ацетилтрипсин
в
)
Модификация
Lys (-NH*)-^
->
—NHOCCHZCHJCOJ-
Asp, Glu (-COp
->
-+
—CONH (CH
2
)
2
NH
+
8
Lys (NHp -> —NHCOCH3
P*a
7,0
6
)
8,0
6
)
6,1
е
)
7,0
r
)
7,2
r
)
*cat.
c
47
74
50
0,7
1,2
а
) в-Химотрипсин,
25 °С,
ионная сила
0,1.
Valenzuela
P.,
Bender
M. L.,
Blochlm.
Ыо-
phys.
Acta, 256, 538
(1971).
б
)рК
а
,
определяющий
ft
ca
t Для
реакции гидролиза метилового эфира ацетил-Ь-трип-
тофана.
в
> Spomer
W. E.,
Wootton
J. F.,
Biochlm.
blophys.
Acta,
235, 164
(1971).
г
'
р/С ,
определяющий *cat/^M
для
реакции гидролиза амида бензонл-Ь-аргинипа.
ются
при
низкой ионной силе
— 0,2 М или
меньше;
при
повыше-
нии
концентрации солей эффекты уменьшаются,
а в
1 М раство-
ре исчезают совсем.
К
счастью, многие кривые титрования полу-
чены
при рН
между
5 и 9,
когда титруется небольшая часть
поверхностных групп; хорошие результаты получены при ионной
силе
0,1 М
18,10].
На
константы скорости стадий,
в
ходе
которых совершаются
химические превращения, влияет
не
только изменение
р/С
а
уча-
ствующих
в
катализе кислот
или
оснований,
но и
изменение
поверхностного заряда, если
оно
достаточно велико.
Это
изме-
нение
аналогично изменению ионной силы
в
неферментативных
ионных
реакциях,
а два
указанных эффекта аналогичны вторич-
ному
и
первичному ионным эффектам
в
физической органиче-
ской
химии.
Д.
Графическое представление данных
Предположим,
что
один
из
таких кинетических параметров,
как
ftcat, определяется долей фермента, находящегося
в
форме
кислоты.
В
этом случае скорость реакции
будет
зависеть
от
константы
ионизации
/С
а
и рН
следующим образом:
Ik
Л =k
\и*]/(
К 4-
Гн
+
Л
^491
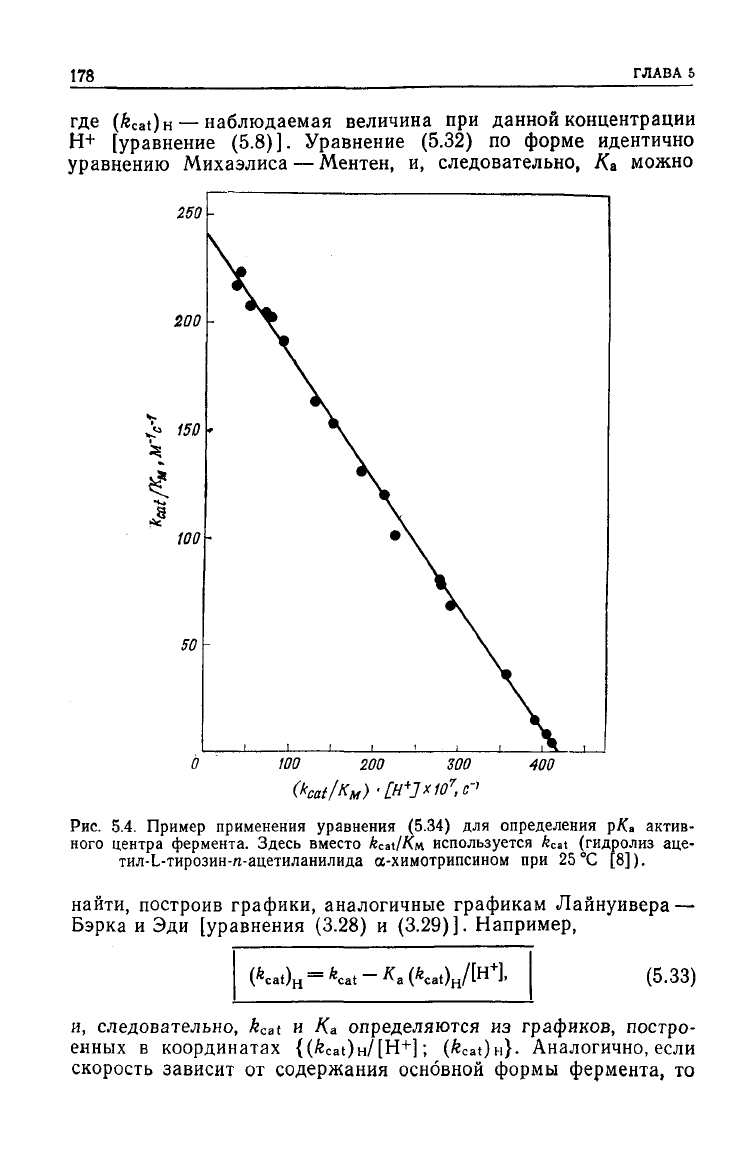
178
ГЛАВА
5
где (АсаОн — наблюдаемая величина при данной концентрации
Н+
[уравнение (5.8)]. Уравнение
(5.32)
по форме идентично
уравнению Михаэлиса — Ментен, и, следовательно, /С
а
можно
260 -
100
200
300
400
Рис.
5.4. Пример применения уравнения
(5.34)
для определения р/Са актив-
ного центра фермента. Здесь вместо
к
С
в\1Км.
используется
fc
C
at
(гидролиз аце-
тил-Ь-тирозин-п-ацетиланилида а-химотрипсином при 25 °С [8]).
найти,
построив графики, аналогичные графикам Лайнуивера —
Бэрка
и Эди [уравнения
(3.28)
и (3.29)]. Например,
(5.33)
и,
следовательно, k
ca
t и /Са определяются из графиков, постро-
енных в координатах {(&саОн/[Н+]; (6
ca
t)n}. Аналогично, если
скорость зависит от содержания основной формы фермента, то

рН-ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ 179
можно показать, что
(5.34)
В этом
случае
строят график в координатах {(&саОн[Н+];
(*C.t)
H
}.
В более сложных
случаях,
когда кинетический параметр не
уменьшается до нуля при высоком или низком рН (как это часто
имеет место на графиках зависимости констант ассоциации или
диссоциации
от рН), для графического анализа используется
разность
между
наблюдаемым значением параметра при дан-
ном
рН и одним из предельных значений при экстремальных
рН.
Е.
Примеры
и
экспериментальные
данные
Ферментом,
кинетические свойства которого при разных рН
изучены лучше, чем свойства остальных ферментов, является
химотрипсин; хорошо известны его структурные особенности и
механизм каталитического действия. Чрезвычайно широкая спе-
цифичность
химотрипсина и, следовательно, возможность ис-
пользования
различных субстратов позволяет исследовать про-
стой механизм Михаэлиса — Ментен, механизм с накоплением
промежуточных соединений, обнаруживать непродуктивное свя-
зывание и анализировать механизм Бриггса — Холдена с изме-
нением
природы лимитирующей стадии при варьировании рН.
рН-зависимость
k
c&
t/KfA для гидролиза субстратов имеет
вид колоколообразной кривой с максимумом при рН 7,8 и р/С
а
,
равными
6,8 и 8,8, для а-химотрипсина и максимумом при рН
7,9 и р/Са, равными 6,8 и 9,1, для 6-химотрипсина. Значение
р/Са
= 6,8 соответствует ионизации каталитически важного ос-
нования
в активном центре, а рЛа = 9,1—ионизации а-амино-
группы Пе-16, которая в протонированном состоянии стабилизи-
рует
каталитически активную конформацию фермента. Эта
важная в конформационном отношении ионизация не влияет на
рН-зависимость
&
ca
t,
для которой обычно характерна сигмоид-
ная
кривая с р/Са 6—7, но приводит к увеличению /См при
высоком рН.
1. рК
а
активного центра химотрипсина
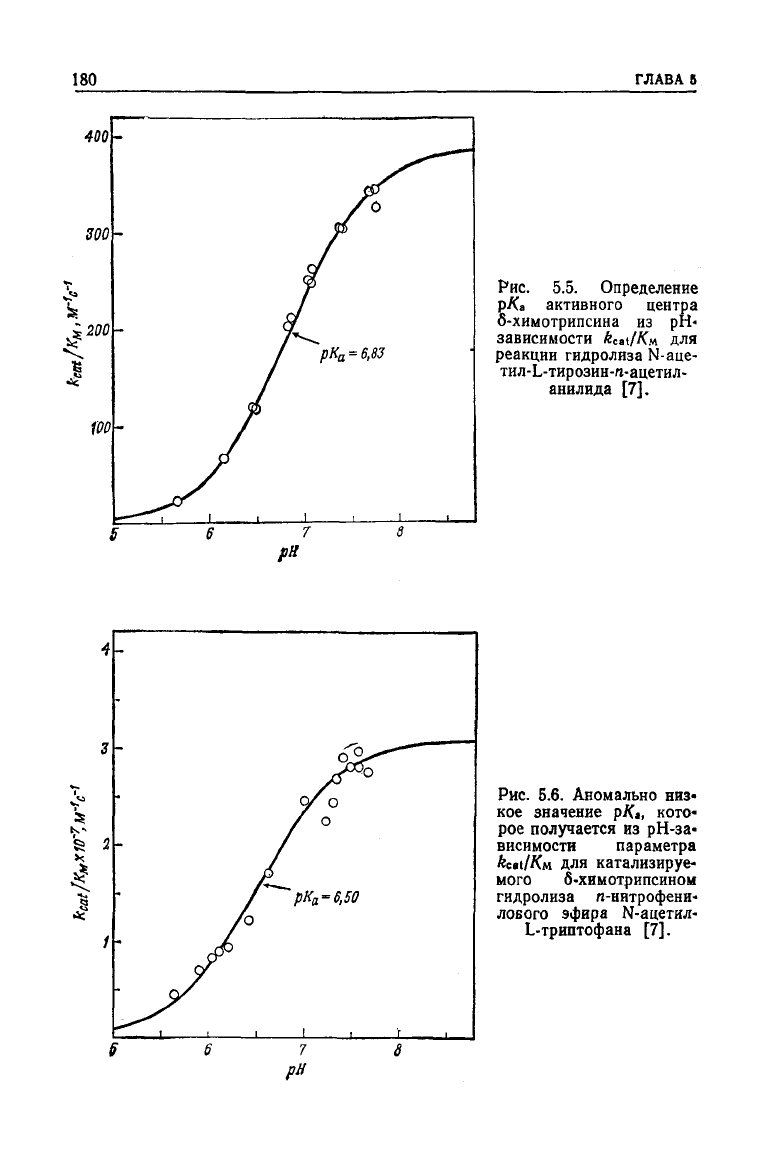
а. Свободный фермент
Теория
предсказывает, что если при изменении рН не проис-
ходит
изменения природы лимитирующей стадии, то рН-зависи-
мость
kcai/Км
для
всех
неионизирующихся субстратов даетзна-
180
ГЛАВА
5
400-
Рис.
5.5.
Определение
р/Са активного центра
б-химотрипсина
из рН>
ЗаВИСИМОСТИ
fecat/К.ч
ДЛЯ
реакции
гидролиза N-aue-
тил-Ь-тирозин-я-ацетил-
анилида
[7].
Рис.
5.6.
Аномально
низ-
кое значение
рК,,
кото-
рое получается
из
рН-за-
висимости параметра
kcti/Км
для
катализируе-
мого б-химотрипсином
гидролиза п-нитрофени-
лового эфира N-ацетил-
L-триптофана
[7].
