Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


ПРАКТИЧЕСКАЯ КИНЕТИКА 201
удается, проще попытаться изменить их соотношение, изменив
условия проведения реакции, чем прибегать к методу наимень-
ших квадратов.
2.
Реакции
второго порядка
А
+
В
Л. с. (6.10)
Кинетику
реакций второго порядка удобнее всего анализи-
ровать, если «превратить» их в реакции псевдопервого порядка,
приняв,
что концентрация одного из реагентов намного выше
концентрации
другого. При [А] 3> [В] концентрация А за время
реакции
практически не изменяется и, следовательно,
d
[C]/dt
= - d [B]/d/ = k
2
[A]
o
[B]. (6.11)
Исчезновение
В и накопление С представляет собой реакцию
первого порядка с константой скорости псевдопервого порядка
k
2
[А] о. Построение графиков для серии таких реакций, имеющих
разные значения [А]
о
, позволяет определить k
2
.
Когда начальные концентрации веществ А и В близки, ана-
литическое решение кинетического уравнения имеет вид
(in
[А]
о
[В]/[В]
0
[А])/([В]
0
- [А]
о
) = Ы (6.12)
которое трудно представить в графической форме. Однако ситу-
ация
существенно упрощается, если [А]
о
=[В]о. В этом случае
аналитическое решение имеет вид
=
Ы (6.13)
Это простое уравнение достаточно точно выполняется, даже
когда начальные концентрации не совсем равны
друг
другу.
В этом случае вместо [А]
о
в уравнении (6.13)
следует
исполь-
зовать среднее между значениями [А]
о
и [В]
о
.
3.
Кинетика
Михаэлиса — Ментен
Несмотря
на то что в последнее время для приведения экс-
периментальных данных к виду, соответствующему интеграль-
ной
форме уравнения Михаэлиса — Ментен, очень широко при-
меняется
ЭВМ и это даже стало чем-то вроде моды, лучше всего
для определения k
ca
t,
kcat/Км
и Км использовать классический
подход, заключающийся в измерении начальных скоростей (т.е.
при
глубине превращения до 5%) и построении такого графика,
как
график Эди — Хофсти [уравнение (3.29)] [3—5]. Измере-
ния
скорости целесообразно проводить при следующих концент-
рациях субстрата: 8/(м, 4/См, 2Км, Км, 0,5/См, 0,25/См, 0,125/(м.

202
ГЛАВА
6
В.
Определение
констант
диссоциации
фермент-субстратных
комплексов
1. Кинетика
Как
указывалось в гл. 3, /См для ферментативных реакций не
всегда равна константе диссоциации фермент-субстратного ком-
плекса; она может быть меньше или больше этой величины в
зависимости от того, происходит накопление промежуточных
соединений или выполняется механизм Бриггса — Холдейна.
Чтобы на основании результатов стационарной кинетики опре-
делить константы диссоциации фермент-субстратных комплек-
сов, необходимо либо вводить какие-то допущения о механизме
реакции,
либо постараться получить дополнительные данные.
Более ценную информацию
дает
предстационарная кинетика,
поскольку в этом
случае
стадии химического превращения суб-
страта и стадии связывания часто можно разграничить.
Константы
диссоциации
для
конкурентных
ингибиторов
лег-
ко
определить из опытов по ингибированию, используя уравне-
ние
(3.32). Это уравнение выполняется независимо от того, яв-
ляется ли К/л истинной константой диссоциации для субстрата.
Сначала
следует
показать, что ингибирование является конку-
рентным; для этого определяют кажущуюся константу /См для
субстрата при различных концентрациях ингибитора, а затем из
уравнения
(3.32)
рассчитывают Ki. Значительные изменения в
/См
получены только при относительно высоких концентрациях
ингибитора.
2. Равновесный диализ
Этот метод позволяет прямо измерить концентрацию свобод-
ного и связанного с ферментом лиганда. Раствор фермента (и
лиганда) отделяют от раствора лиганда при помощи полупро-
ницаемой мембраны, через которую
могут
проходить только
небольшие молекулы. После установления равновесия, отобрав
пробу из ячейки, содержащей белок, определяют
сумму
концен-
траций свободного и связанного лиганда; анализ пробы из дру-
гой ячейки
дает
концентрацию только свободного субстрата.
Измерения
можно проводить, используя лиганды, меченные ра-
диоактивными изотопами, и ячейки объемом всего 20 мкл. Для
анализа отбирают три образца по 5 мкл. Однако, поскольку для
достижения равновесия
даже
при работе с самыми крупнопори-
стыми мембранами требуется по крайней мере 1—2 ч, этот метод
непригоден для исследования нестабильных лигандов и фермен-

Фермент
+
Лиганд
Лиганд
Полипроницаемая
мембрана
Рис.
6.3. Принцип равновесного диализа.
Рис.
6.4. Микроячейки для равновесного диализа [Englund P. Т., Huber-
man
J. A., Jovin Т. М., Kornberg A., J. biol. Chem., 244,
3038
(1969).]
Полу-
проницаемую мембрану помещают
между
двумя ячейками из плексигласа и
скрепляют их. Изображенное устройство имеет два типа ячеек; меньшие по
размеру половинки ячеек
могут
крепиться к любому торцу центрального
блока.
1
ж
I
Рис.
6.5. Микроячейки, изображенные на рис. 6.4, смонтированные на вра-
щающемся барабане для помещения их в термостат.
204
ГЛАВА
в
тов. Для проведения быстрых измерений используется метод
неравновесного
диализа
[6], который основан на измерении
скорости
диффузии лиганда через мембрану из отсека, где он
находится вместе с ферментом, в зависимости от концентрации.
Связывание
замедляет скорость диффузии.
3. Равновесная гель-фильтрация [7]
Некоторые гели (например, сефадекс и биогель) имеют поры
такого размера, что в них вполне
могут
поместиться небольшие
лиганды,
тогда
как для белковых молекул эти поры слишком
40-
s
зо
•
\
?
20
* SO
29
28
27
-
-
.-••'•.
л
«Poo»
'•'t
m •
•
I L
Ш
••
•
".•«.
1
0,5
1,0
Объем,
мл
1,5
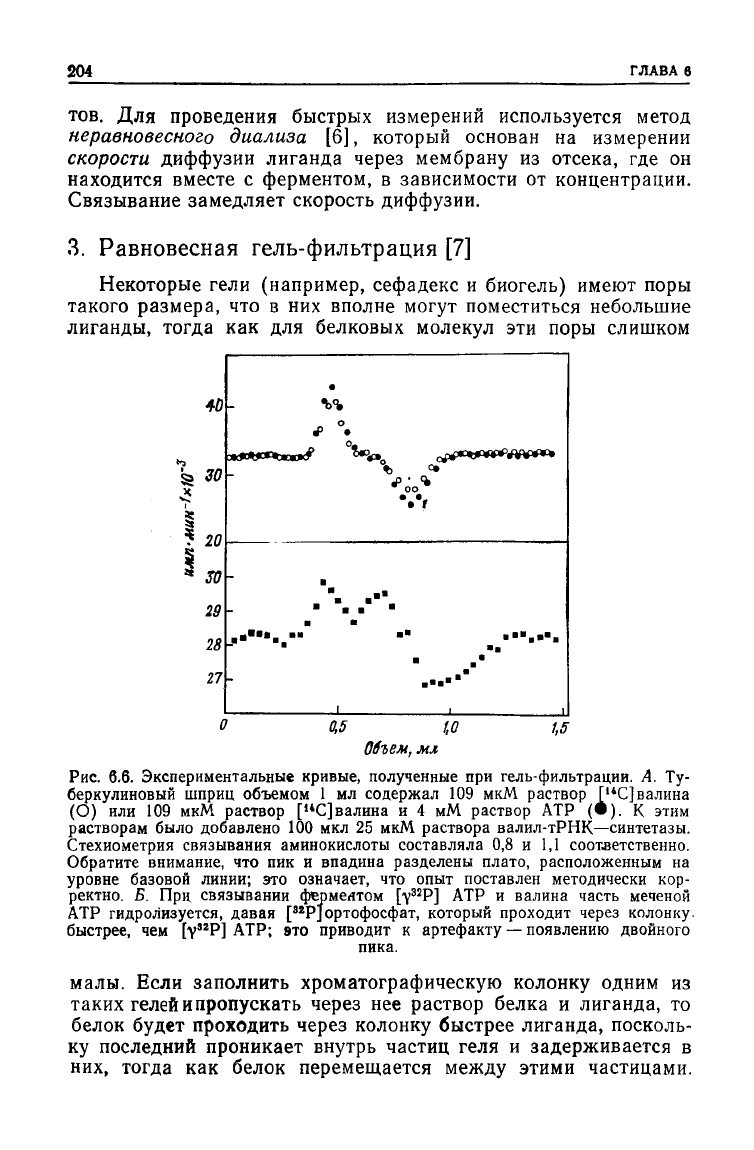
Рис.
6.6. Экспериментальные кривые, полученные при гель-фильтрации. А. Ту-
беркулиновый шприц объемом 1 мл содержал 109 мкМ раствор [
и
С]валина
(О) или 109 мкМ раствор ["С]валина и 4 мМ раствор АТР (•). К этим
растворам было добавлено 100 мкл 25 мкМ раствора валил-тРНК—синтетазы.
Стехиометрия связывания аминокислоты составляла 0,8 и 1,1 соответственно.
Обратите внимание, что пик и впадина разделены плато, расположенным на
уровне базовой линии; это означает, что опыт поставлен методически кор-
ректно.
Б. При связывании ферментом
[v
32
P]
ATP и валина часть меченой
АТР гидролизуется, давая [
82
Р]ортофосфат, который проходит через колонку.
быстрее, чем [у"Р] АТР; это приводит к артефакту — появлению двойного
пика.
малы. Если заполнить хроматографическую колонку одним из
таких гелей и
пропускать
через нее раствор белка и лиганда, то
белок
будет
проходить
через колонку быстрее лиганда, посколь-
ку последний проникает внутрь частиц геля и задерживается в
них,
тогда
как белок перемещается
между
этими частицами.

ПРАКТИЧЕСКАЯ КИНЕТИКА 206
При
проведении равновесной гель-фильтрации колонку уравно-
вешивают раствором лиганда и наносят образец фермента,
уравновешенный буферным раствором. Проходя через колонку,
белок связывает лиганд и перемещает его с такой же скоростью,
с какой движется сам. В
результате
положение пика, соответ-
ствующего
выходу
лиганда из колонки, совпадает с положением
пика,
отвечающего белку,
тогда
как впадина на кривой нахо-
дится в области, обычно занимаемой небольшими молекулами.
Площадь под пиком равна площади впадины и соответствует
количеству связанного лиганда.
Достоинство этого метода состоит в том, что фермент нахо-
дится в контакте с данной молекулой лиганда очень недолго, и,
следовательно, метод может использоваться в тех
случаях,
ког-
да фермент медленно гидролизует лиганд. Еще одним преиму-
ществом данной методики является то, что имеющиеся гели
позволяют разделять молекулы по размерам; это, например,
дает
возможность исследовать связывание
тРНК
(мол. вес
25 000) аминоацил-тРНК—синтетазой (мол. вес 100 000) [8].
Рассмотренный
метод позволяет работать с микроколиче-
ствами препаратов. При связывании небольших лигандов
удоб-
но
использовать туберкулиновый шприц объемом 1 мл, запол-
ненный
сефадексом G-25. В шприц вводят образец объемом
100 мкл и каждую каплю (объемом
35—40
мкл) собирают в
пробирку. Для измерения объема капель их втягивают в шприц.
Однако при разделении белка и крупного лиганда приходится
использовать колонки значительно большего размера (типичный
пример
— колонка размером 0,7 X 18 см, применяющаяся для
разделения
тРНК
и тРНК—синтетазы).
Возможные
источники
ошибок
Для правильной постановки эксперимента необходимо, чтобы
а) базовая линия оставалась постоянной; б)
между
пиком и
впадиной
находилось плато, расположенное на уровне базовой
линии
(это означает, что лиганд и белок существенно различа-
ются по подвижности) и в) площадь пика была равна площади
впадины.
(Поскольку очень трудно приготовить точно такой же
раствор фермента и лиганда, как раствор лиганда в уравнове-
шивающем буфере, целесообразно провести анализ аликвоты
раствора фермента перед его нанесением на колонку с тем,
чтобы внести необходимые поправки в площадь впадины.)
Причиной
артефактов может быть задержка лиганда на ко-
лонке,
обусловленная, например, связыванием лиганда с гелем
(как
в
случае
ATP, ADP и AMP, которые связываются с сефа-
дексом).
Из-за более высокой подвижности фосфата и пирофос-
фата, образующихся при гидролизе
[v
32
P]
ATP, появляются
дополнительные
пики
и впадины (рис. 6.6).
206
ГЛАВА
в
4. Ультрацентрифугирование
Связывание небольшого полимера с более крупным (напри-
мер,
тРНК
с аминоацил-тРНК.—синтета-зой) нельзя исследовать
методом равновесного диализа, а для равновесной гель-фильт-
рации
требуются относительно большие объемы. В этом
случае
используют метод аналитического центрифугирования, позволя-
ющий работать с объемами
100—200
мкл. Ячейку центрифуги
I
I
TPHK
Фермент
тРНК
(л-Фермент)
тРИК
Седиментация—*-
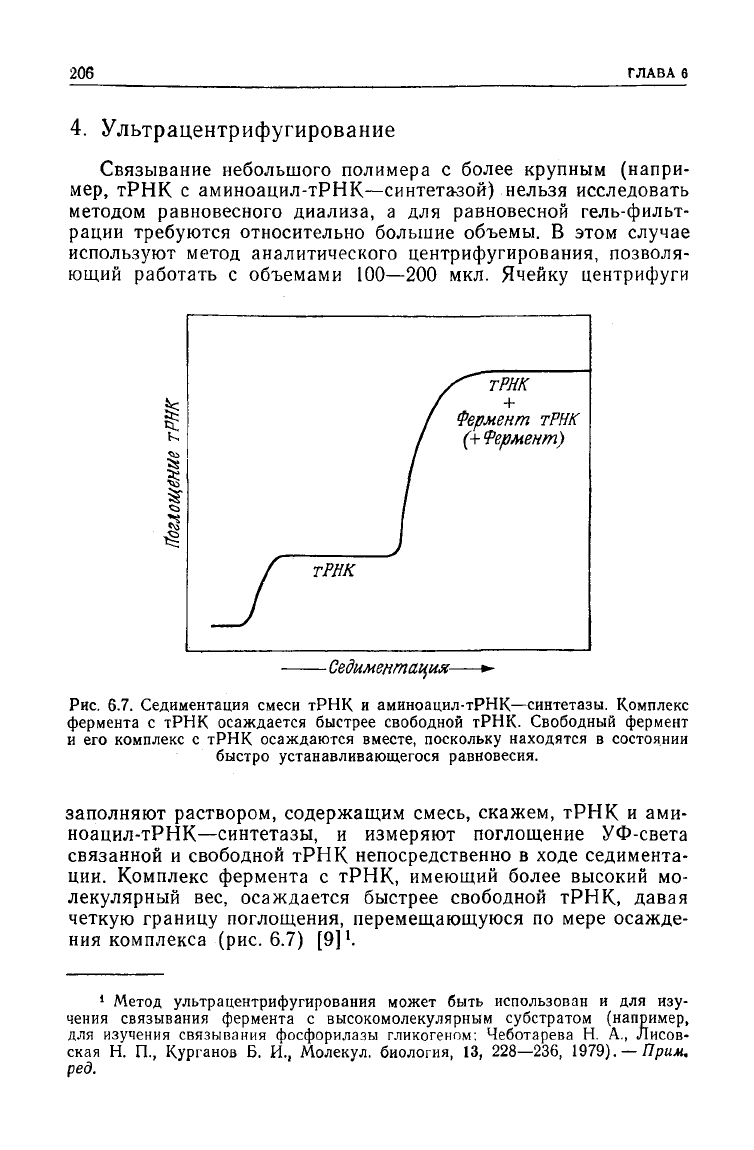
Рис.
6.7. Седиментация смеси
тРНК
и аминоацил-тРНК—синтетазы. Комплекс
фермента с
тРНК
осаждается быстрее свободной
тРНК.
Свободный фермент
и
его комплекс с
тРНК
осаждаются вместе, поскольку находятся в состоянии
быстро устанавливающегося равновесия.
заполняют раствором, содержащим смесь, скажем,
тРНК
и ами-
ноацил-тРНК—синтетазы, и измеряют поглощение УФ-света
связанной
и свободной
тРНК
непосредственно в
ходе
седимента-
ции.
Комплекс фермента с
тРНК,
имеющий более высокий мо-
лекулярный вес, осаждается быстрее свободной
тРНК,
давая
четкую границу поглощения, перемещающуюся по мере осажде-
ния
комплекса (рис. 6.7) [9]'.
1
Метод ультрацентрифугирования может быть использован и для изу-
чения связывания фермента с высокомолекулярным субстратом (например,
для изучения связывания фосфорилазы гликогеном; Чеботарева Н. А., Лисов-
ская
Н. П., Курганов Б. И., Молекул, биология, 13,
228—236,
1979).
—
Прим.
ред.

ПРАКТИЧЕСКАЯ
КИНЕТИКА
207
5. Фильтрование
[10]
Многие
белки, связанные
с
каким-либо медленно отщепляю-
щимся
лигандом, адсорбируются
на
фильтрах
из
нитроцеллю-
лозы,
тогда
как
свободный лиганд такими фильтрами
не
удер-
живается.
В
некоторых случаях
это
дает
исследователю очень
экономичный
метод анализа связывания.
С его
помощью полу-
чено много ценных данных
о
присоединении нуклеиновых кислот
к
белкам. Отметим возможные источники ошибок
при
использо-
вании
фильтрования: часто связывание осуществляется менее
чем
на 100%;
фильтры
могут
отличаться
от
партии
к
партии
и
насыщаться
при
довольно низких концентрациях белка.
6. Спектроскопические методы
За
исключением ЯМР,
с
помощью которого удается измерить
концентрации
свободного
и
связанного лиганда, спектроскопи-
ческие методы обычно
не
позволяют прямо определить число
связанных молекул лиганда.
При
связывании лиганда
в
спектре
происходят изменения, позволяющие найти лишь
долю
связан-
ного белка,
и, не
имея дополнительной информации, нельзя
установить
число
присоединившихся молекул лиганда. Типич-
ным
примером такого рода является изменение
в
спектре флуо-
ресценции
белка
или в
спектре флуоресценции
или
поглощения
лиганда, вызываемое присоединением лиганда
к
ферменту.
Обычно
в
таких опытах добавляют возрастающие количества
лиганда
к
относительно разбавленному раствору белка
и
строят
график
зависимости изменения какого-либо параметра спектра
от количества добавленного лиганда. Если связываемый лиганд
не
является хромофором,
то
исследуют конкурентное ингибиро-
вание процесса присоединения лигандов-хромофоров.
7.
Титрование
Если
константа диссоциации комплекса достаточно мала,
можно определить число эквивалентов лиганда, которое вызы-
вает максимальное изменение
в
спектре;
это
максимальное
из-
менение
имеет место
в том
случае, когда заняты
все
центры
связывания.
Например,
к
раствору белка, концентрация которо-
го
по
крайней мере
в 10 раз
больше константы диссоциации,
добавляются возрастающие количества субстрата.
Для
установ-
ления
стехиометрии строят график, представленный
на рис. 6.8.
Другой метод титрования предложен Джобом
[11].
208
ГЛАВА
в
0,04 -
0,00
[WP]/[Me№]
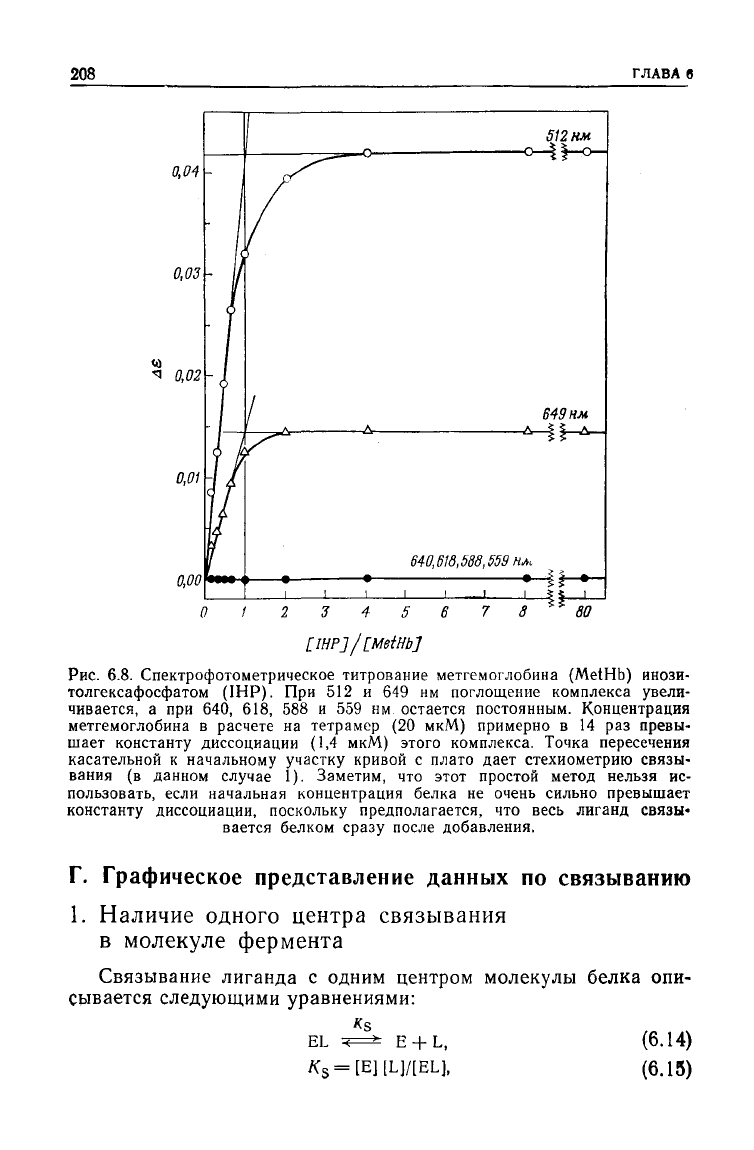
Рис.
6.8. Спектрофотометрическое титрование метгемоглобина (MetHb) инози-
толгексафосфатом
(IHP).
При 512 и 649 нм поглощение комплекса увели-
чивается, а при 640, 618, 588 и 559 нм остается постоянным. Концентрация
метгемоглобина в расчете на тетрамер (20 мкМ) примерно в 14 раз превы-
шает константу диссоциации (1,4 мкМ) этого комплекса. Точка пересечения
касательной к начальному участку кривой с плато
дает
стехиометрию связы-
вания
(в данном случае 1). Заметим, что этот простой метод нельзя ис-
пользовать, если начальная концентрация белка не очень сильно превышает
константу диссоциации, поскольку предполагается, что весь лиганд связы-
вается белком сразу после добавления.
Г.
Графическое
представление
данных
по
связыванию
1. Наличие одного центра связывания
в молекуле фермента
Связывание лиганда с одним центром
молекулы
белка опи-
сывается
следующими
уравнениями:
EL +=^ E + L,
(6.14)
- E + L,
5
=
[E][L]/[EL],
(6.15)

ПРАКТИЧЕСКАЯ
КИНЕТИКА 209
где [Е] и [L] — концентрации свободного фермента и лиганда
соответственно.
Вводя полную концентрацию фермента [Е] о, получаем
tf
s
).
(6.16)
Уравнение
(6.16)
аналогично уравнению Михаэлиса — Мен-
тен и может использоваться аналогичным образом. Удобным
способом графического представления данных является по-
строение графика, аналогичного графику Эди:
[EL] = [E]
O
-/C
S
([EL]/[L]).
(6.17)
Построение
графика в координатах {[EL]/[L]; IEL]}
дает
зна-
чение Ks.
Уравнение
(6.17)
нельзя использовать для непосредственного
анализа спектроскопических данных, поскольку концентрация
EL
неизвестна. Однако, поскольку эта величина обычно прямо
пропорциональна
изменению определенного параметра спектра,
можно написать, что
AF = AF
max
-K
s
(A/7[L]),
(6.18)
где AF — изменение этого параметра при добавлении лиганда к
раствору белка до конечной концентрации [L]. График в коор-
динатах
{AF/fL];
AF}
дает
Ks и
&F
m3X
— изменение параметра
при
переходе всего белка в связанное состояние
1
.
2. Наличие нескольких центров связывания
а. Идентичные центры
Если
молекула белка имеет п идентичных, не взаимодей-
ствующих
друг
с
другом
центров, то уравнение
(6.17)
можно
преобразовать к виду
v = «-/C
s
(v/[L]),
(6.19)
где v — число молей лиганда, связанных с одним молем белка.
Из
графика, построенного в координатах
{v/[L];
v}
(график
Скэтчарда), можно найти стехиометрию (л) и константу Ks-
1
Особый случай спектрофлуориметрического титрования при сопостави-
мых концентрациях фермента и лиганда, когда величины [Е]о и Д/^пах не-
известны, проанализирован в
следующих
работах: Курганов Б. И.,
Гуре-
вич В. М., Сугробова Н. П., Яковлев В. А., Молекул, биология, 6,
698—704,
1972; Курганов Б. И., Сугробова Н. П., Яковлев В. A., FEBS Letters, 19,
308—310,
1972. —
Прим.
ред.

210
ГЛАВА
6
Неидентичные
центры
Если
в молекуле белка имеется два типа центров, один —
сильно
связывающий, а другой — слабо, то график Скэтчарда
будет
состоять из
двух
частей, относящихся к связыванию с
разными
центрами. Определить значения Ks из таких графиков
можно только в том случае, если эти константы различаются по
крайней
мере в 10 раз.
Приложение:
сцинтилляторы
1.
ВВОТ.
Хотя этот смешивающийся с водой сцинтиллятор
уступает по емкости раствору
Брэя
[12], его проще приготовить
и
он не портится при стоянии на свету. В нем может присут-
ствовать до
1
% воды. Два литра сцинтиллятора содержат 9 г
ВВОТ (2,5-быс-[5'-г/7ег-бутилбензоксазолил-(2')]-тиофена),
1,51 г толуола и 0,51 г метоксиэтанола.
2.
РРО/РОРОР.
Фильтры из нитроцеллюлозы можно пря-
мо погружать в этот не смешивающийся с водой сцинтиллятор.
Состав сцинтиллятора: 2,5 л толуола, 12,5 г РРО (2,5-дифенил-
оксазола) и 0,75 г РОРОР (1,4-бнс-[2 (5-фенилоксазолил)] бен-
зола).
СПИСОК
ЛИТЕРАТУРЫ
1.
Ehrenberg
M.,
Cronvall
E.,
Rigler
R., FEBS Letts., 18, 199 (1971).
2.
Guggenheim
E. A., Phil. Mag., 2, 538 (1926).
3. Nimmo I. A., Atkins G. L, Biochem. J., 141, 913 (1974).
4.
Jennings
R. R., Niemann C, J. Am. chem. Soc, 77,
5432
(1955).
5.
Cornish-Bowden
A., Biochem. J., 149, 305 (1975).
6.
Colowick
S. P., Womack F. C, J. biol. Chem., 244, 774 (1969).
7. Hummel J. P.,
Dreyer
W. J., Biochim. biophys. Acta, 63, 530 (1962).
8.
Waterson
R. M.,
Clarke
S. J.,
Kalousek
/=\,
Konigsberg
W. H., J. biol. Chem.,
248, 181 (1973).
9.
Krauss
G.,
Pingoud
A.,
Boehtne
D.,
Riesner
D.,
Peters
F., Maass G., Eur.
J. Biochem., 55, 517 (1975).
10. Yams M.,
Berg
P.,
Analys.
Biochem., 35, 450 (1970).
11.
Job P., Annls. Chim. (Ser. 10), 9, 113 (1928).
12.
Bray
G. A.,
Analyt.
Biochem., 1, 279 (1960).
