Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


ИЗМЕРЕНИЕ
КОНСТАНТ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
151
таких опытов.
Во
многих
случаях,
приступая
к
этим исследова-
ниям,
экспериментатор имел перед собой четкую
задачу,
кото-
рую
он
хотел
решить.
В
других
случаях исследование проводи-
лось просто
с
целью накопления информации.
Как бы то ни
было,
всегда необходимы воображение
и
умение продумать
и
поста-
вить эксперимент.
При
этом весьма полезен следующий систе-
матический подход.
Анализ времени релаксации можно разделить
на две
основ-
ные
части:
1.
Следует
отнести время релаксации
к
определенному
фи-
зическому событию.
2.
Это
физическое событие необходимо
«встроить»
в
общий
кинетический
механизм изучаемого процесса.
Рассмотрим
два
примера. Первый пример
—
исследование
связывания
лиганда ферментом
в
ходе
некатализируемой реак-
ции.
При
этом
могут
произойти
два
физических события: связы-
вание
и
индуцируемое лигандом конформационное изменение
фермента. Чтобы установить число промежуточных стадий
и
определить соответствующие
им
константы скорости, прежде
всего необходимо определить число времен релаксации
и
найти
их концентрационную зависимость.
В
идеальном
случае
число
времен релаксации
будет
равно числу стадий данной реакции.
Если
найдено
даже
одно время релаксации
и его
концентраци-
онная
зависимость нелинейна,
это
может означать,
что
процесс
протекает
в две
стадии [например, уравнения
(4.71)
и
(4.74)].
Далее стоит воспользоваться
несколькими
физическими метода-
ми
(например, исследовать флуоресценцию
и
поглощение
ли-
ганда
и
белка), поскольку некоторые стадии
могут
быть выяв-
лены только
с
помощью
одного
из
этих методов.
В
ходе
рассматриваемой реакции
могут
протекать
и
другие
физические
процессы,
например отдача
или
присоединение протона
или из-
менение
степени агрегации белка.
В
первом
случае
весьма поле-
зен
еще
один метод
—
измерение
рН, для
чего можно использо-
вать просто цветные индикаторы. Агрегация осложняет кинети-
ческие исследования, однако
ее
можно обнаружить
и
количе-
ственно охарактеризовать,
что
также
даст
дополнительную
информацию.
Для
исследования простых реакций релаксацион-
ные
методы часто оказываются эффективнее
струевых,
посколь-
ку позволяют изучать более быстрые процессы. Однако иногда
метод остановленной струи более ценен, например,
при
исследо-
вании
процессов, слишком медленных, чтобы применять метод
температурного скачка. Кроме того, некоторые эксперименты
(такие,
как
исследование влияния сильных изменений
рН)
можно осуществить только
в том
случае, если использовать
ме-
тоды, включающие быстрое смешивание реагентов (хотя неболь-
шого изменения
рН
можно добиться, применив метод темпера-

162
ГЛАВА
4
турного скачка с использованием буфера, рКа которого зависит
от температуры).
Второй пример — исследование механизма действия фермен-
та в условиях протекания ферментативной реакции. Помимо
определения стадии связывания и выявления конформационных
изменений,
в этой реакции необходимо исследовать стадии об-
разования и разрыва связей и идентифицировать промежуточ-
ные соединения. Химические процессы обычно лучше всего ис-
следовать методами, которые позволяют прямо измерить кон-
центрацию химических соединений, например методом останов-
ленной
струи с регистрацией оптической плотности раствора и
методом замороженной струи. Иногда лучше воспользоваться
косвенными методами, например методом флуоресцентного ана-
лиза. Идеальной для исследования является такая ситуация,
когда промежуточное соединение накапливается и его можно
обнаружить и измерить концентрацию. Вообще для подтверж-
дения имеющихся данных и получения новых
следует
привле-
кать возможно большее число различных методов. Примеры
применения
таких методов даны в гл. 7.
Г.
Абсолютные
концентрации
ферментов
1. Титрование активных центров
и
начальный
«всплеск»
концентрации продукта
Для расчета констант скорости из данных стационарной ки-
нетики
и определения стехиометрии связывания необходимо
знать концентрацию активных центров ферментов. Рассчитать
эту величину исходя из молекулярного веса белка и его концен-
трации нельзя, поскольку не всегда удается выделить абсолютно
чистый фермент. Проблема определения концентрации была ре-
шена путем применения метода титрования активных центров и
сочетанием исследования ферментативных реакций в стацио-
нарных и предстационарных условиях, позволяющих связать
концентрацию активной формы фермента с начальным вспле-
ском концентрации продукта. Начальный всплеск наблюдается в
тех
случаях,
когда по
ходу
реакции происходит накопление
связанного с ферментом промежуточного соединения. Первый
моль субстрата быстро реагирует с ферментом с образованием
стехиометрических количеств фермент-содержащего промежу-
точного соединения и продукта, а дальше реакция замедляется,
поскольку идет медленный распад промежуточного соединения с
высвобождением свободного фермента:
Е + S > EI * Е
(4.76)
+
+
Pi Ps
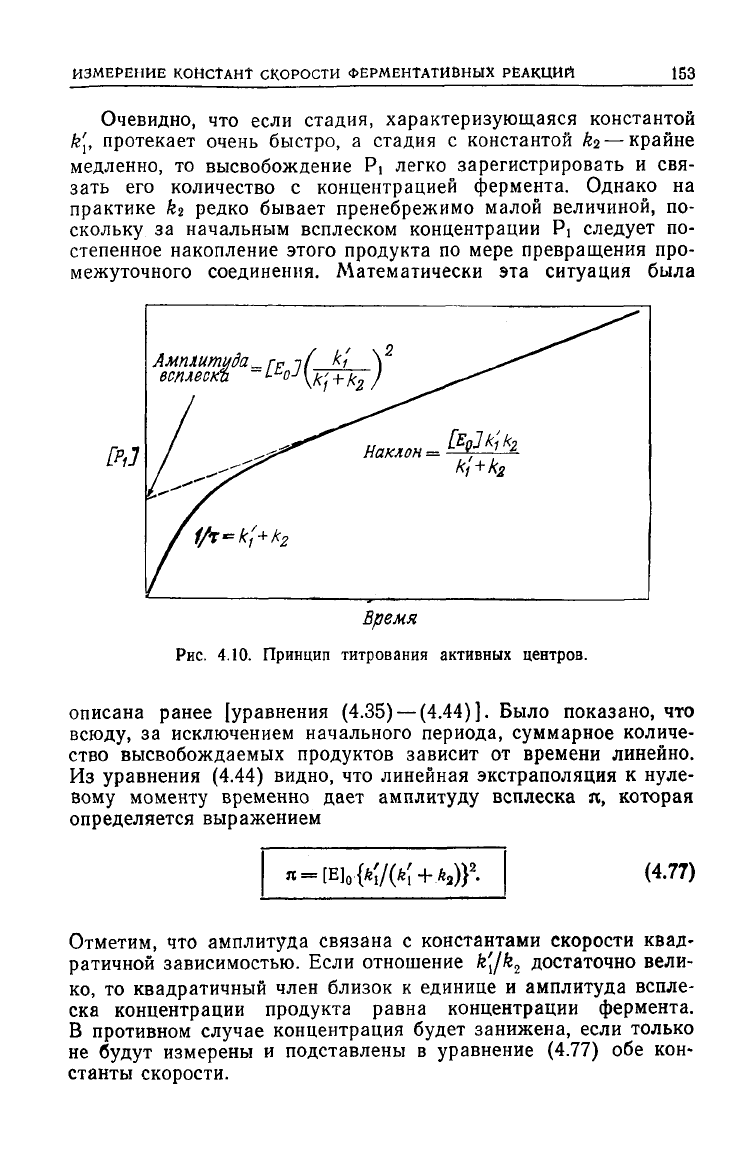
ИЗМЕРЕНИЕ
КОНСТАНТ
СКОРОСТИ
ФЕРМЕНТАТИВНЫХ
РЕАКЦИЙ
153
Очевидно, что если стадия, характеризующаяся константой
k\, протекает очень быстро, а стадия с константой ki — крайне
медленно, то высвобождение Pi легко зарегистрировать и свя-
зать его количество с концентрацией фермента. Однако на
практике кг редко бывает пренебрежимо малой величиной, по-
скольку за начальным всплеском концентрации Pj
следует
по-
степенное накопление этого продукта по мере превращения про-
межуточного соединения. Математически эта ситуация была
Амплитуда
всплески
Время
Рис.
4.10.
Принцип
титрования
активных
центров.
описана ранее [уравнения
(4.35)
—(4.44)]. Было показано, что
всюду,
за исключением начального периода, суммарное количе-
ство высвобождаемых продуктов зависит от времени линейно.
Из
уравнения
(4.44)
видно, что линейная экстраполяция к нуле-
вому моменту временно
дает
амплитуду всплеска я, которая
определяется выражением
(4.77)
Отметим, что амплитуда связана с константами скорости квад-
ратичной зависимостью. Если отношение k'Jk
2
достаточно вели-
ко,
то квадратичный член близок к единице и амплитуда вспле-
ска концентрации продукта равна концентрации фермента.
В противном
случае
концентрация
будет
занижена, если только
не
будут
измерены и подставлены в уравнение
(4.77)
обе кон-
станты скорости.
154
ГЛАВА
4
2. Зависимость амплитуды всплеска от концентрации
субстрата
Константа
k[, входящая в уравнение (4.76), представляет
собой
кажущуюся константу скорости первого порядка для ре-
акции
образования промежуточного соединения при данных ус-
Время,
мин
12
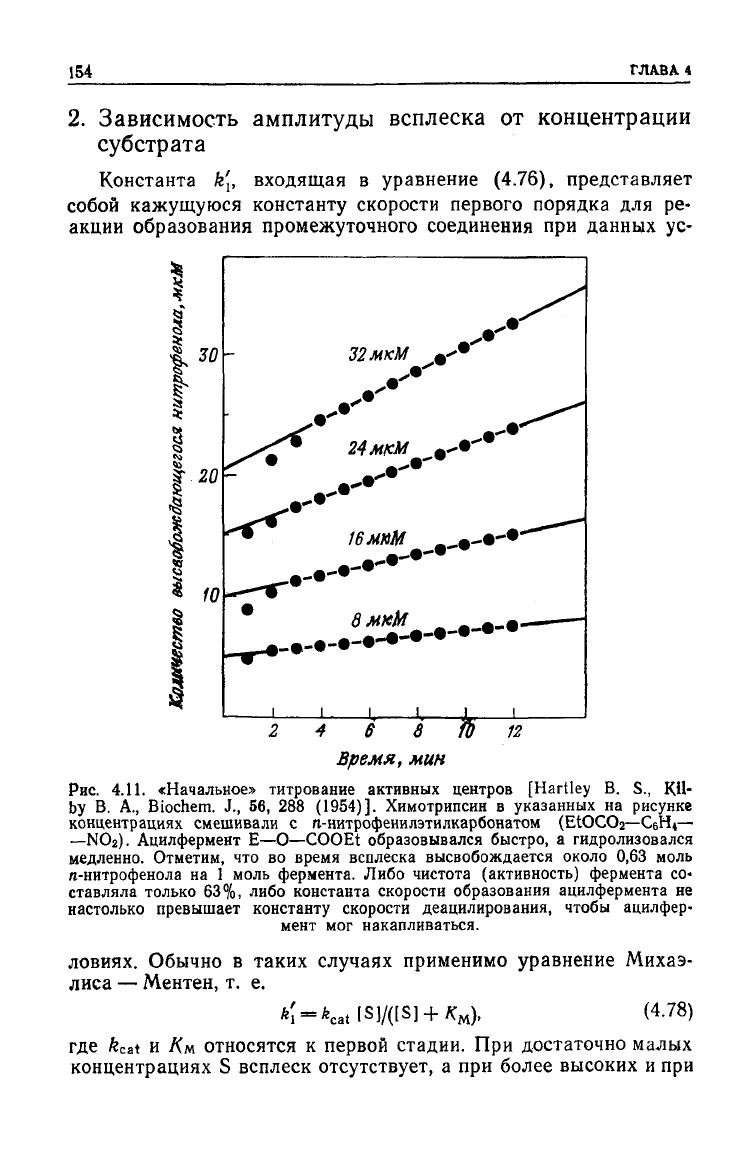
Рис.
4.11.
«Начальное»
титрование активных центров [Hartley В. S., К.И-
Ьу В. A., Biochem. J., 56, 288 (1954)]. Химотрипсин в указанных на рисунке
концентрациях
смешивали с n-нитрофенилэтилкарбонатом (ЕЮСОг—СбН
4
—
—NO2).
Ацилфермент Е—О—COOEt образовывался быстро, а гидролизовался
медленно. Отметим, что во время всплеска высвобождается около 0,63 моль
га-нитрофенола
на
1 моль фермента. Либо чистота (активность) фермента со-
ставляла только 63%, либо константа скорости образования ацилфермента не
настолько превышает константу скорости деацилирования, чтобы ацилфер-
мент мог накапливаться.
ловиях.
Обычно в таких случаях
применимо
уравнение
Михаэ-
лиса
—
Ментен,
т. е.
tf
M
), (4.78)
где fecat и К/л относятся к первой стадии. При достаточно малых
концентрациях
S всплеск отсутствует, а при более высоких и при
ИЗМЕРЕНИЕ
КОНСТАНТ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
155
условии, что k
ca
t много больше k
2
, вновь появляется. Подстав-
ляя
(4.78)
в (4.77), получаем
^ТгЧ-
(4-79)
1
+
_2_
'VIE]
Еесли fecatS
>
^
2
, то уравнение
(4.79)
можно использовать для
экстраполяции амплитуды всплеска к малым концентрациям S,
исходя из значений, полученных при различных концентрациях
субстрата.
Очевидно, что когда k
2
не является пренебрежимо
малой величиной,
следует
соблюдать осторожность, чтобы не
получить заниженное значение концентрации фермента.
3.
Определение концентрации активных центров,
исходя из анализа скорости ферментативной реакции
Титрование активных центров применимо не
всегда,
посколь-
ку для этого необходимо, чтобы в
ходе
реакции накапливалось
2
4 6
Время,
мин
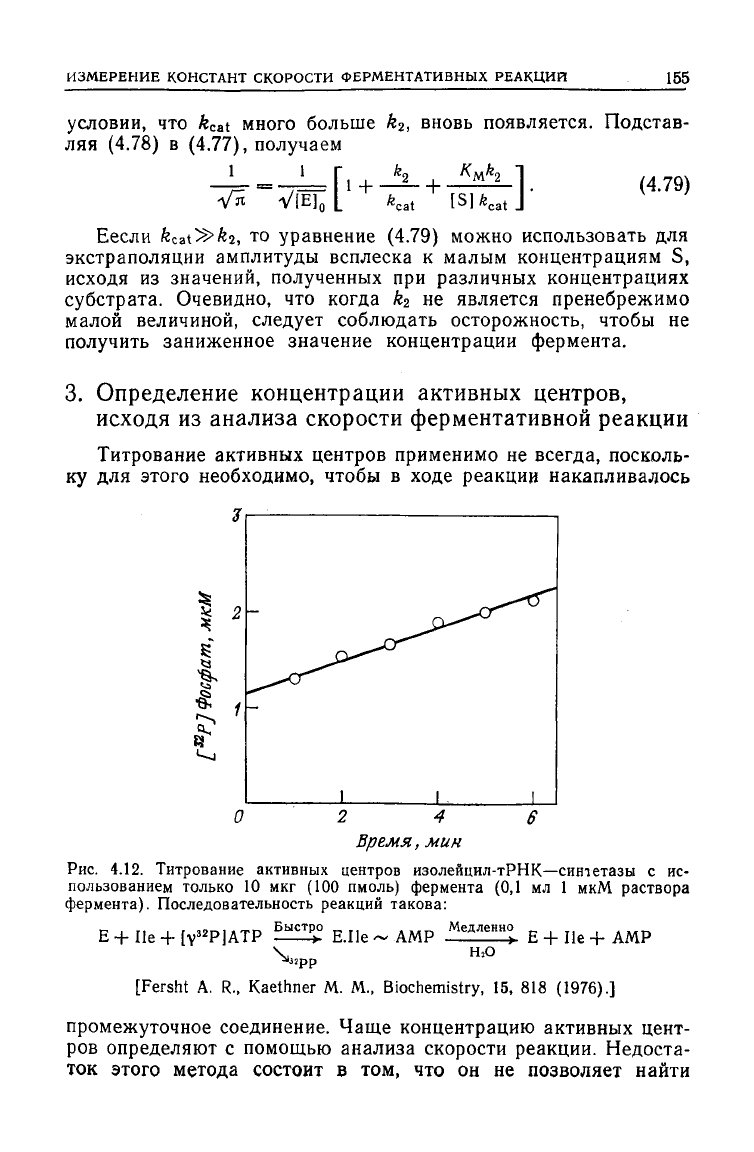
Рис.
4.12. Титрование активных центров изолейцил-тРНК—синтетазы с ис-
пользованием
только 10 мкг (100 пмоль) фермента (0,1 мл 1 мкМ раствора
фермента).
Последовательность реакций такова:
He+[Y
32
P]ATP
АМ
р
тленно
Е
ШО
Пе
+ АМ
Р
[Fersht
A. R., Kaethner M. М., Biochemistry, 15, 818 (1976).]
промежуточное соединение. Чаще концентрацию активных цент-
ров определяют с помощью анализа скорости реакции. Недоста-
ток этого метода состоит в том, что он не позволяет найти

156
ГЛАВА
4
абсолютную концентрацию фермента, если не проведена калиб-
ровка по данным титрования активных центров. Кроме того,
скорость реакции зависит от условий. Если в данной лаборато-
рии
эти условия
могут
поддерживаться более или менее посто-
янными,
то от лаборатории к лаборатории они чаще всего
варьируют. Для спектрофотометрического титрования активных
центров необходимо несколько миллиграммов фермента; при
использовании радиоактивной метки это количество можно
уменьшить в 1000 раз [11]. Метод титрования активных центров
с его относительной нечувствительностью к условиям, в которых
проводится реакция, и возможностью определять абсолютные
концентрации
фермента наиболее ценен для получения воспро-
изводимых данных и для сравнения констант скорости, полу-
ченных с помощью стационарной и предстационарной кинетики.
(Для стационарной кинетики константа скорости обычно вклю-
чает экспоненциальный член, не зависящий от концентрации
фермента,
тогда
как для стационарной кинетики константа ско-
рости прямо пропорциональна концентрации.)
Часть 2. ПОРЯДОК
ВЕЛИЧИН
КОНСТАНТ
СКОРОСТИ
ДЛЯ ФЕРМЕНТАТИВНЫХ
ПРОЦЕССОВ
А. Верхний предел констант скорости [12]
1. Ассоциация и диссоциация
Для анализа констант скорости химических реакций лучше
всего использовать
теорию
столкновений.
Константа скорости
бимолекулярной реакции представляет собой произведение
трех
сомножителей; частоты соударений Z, стерического факторар,
равного доле молекул, имеющих необходимую ориентацию, и
экспоненциального члена, в который
входит
энергия активации и
который равен доле молекул, обладающих достаточной
энер-
гией:
(4.80)
Когда энергия активации равна нулю, а стерический фактор —
единице, константа скорости бимолекулярной реакции имеет
максимальное значение. В таком
случае
говорят, что скорость
процесса лимитируется
диффузией
и равна частоте межмолеку-
лярных столкновений. Предположив, что реагирующие молеку-
лы представляют собой незаряженные сферические частицы ра-
диусами г
а
и гъ, мы можем рассчитать частоту столкновений по
следующей формуле:
Z
= (2ЯГ/3000Т)) (r
a
+
r
b
f/r
a
r
b
,
(4,81)

ИЗМЕРЕНИЕ
КОНСТАНТ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ 157
где г) — вязкость среды. Для
двух
молекул одинакового радиуса
частота соударений в воде при
25°С
равна 7-Ю
9
М-'с-
1
.
Следует
отметить, что две большие молекулы сталкиваются точно с такой
же частотой, как и две малые. Это обусловлено тем, что уве-
личение площади мишени точно компенсируется уменьшением
скорости диффузии крупных молекул. Однако частота столкно-
вения
небольшой молекулы с большой выше частоты для
двух
предыдущих случаев, поскольку имеют место оба упомянутых
фактора — увеличение площади (за счет большой молекулы) и
увеличение подвижности (за счет малой). Более сложные рас-
четы, учитывающие с одной стороны электростатическое взаи-
модействие
между
молекулами, которое увеличивает частоту
соударений, а с
другой
— влияние геометрии небольшой молеку-
лы на частоту ее столкновения с молекулой большого размера,
дают
диапазон частот
10
9
—10
й
М-'с"
1
. Аналогичным образом
устанавливается верхний предел для констант скорости
диссо-
циации
бимолекулярных комплексов—10
9
—10
12
с~'. Экспери-
ментально показано, что многие константы скорости второго
порядка
для реакций, протекающих без участия протонов или
гидроксил-ионов,
имеют величину порядка 10
9
М
-1
с~'.
2. Химические процессы
Верхний предел для констант скорости любых моно- или
внутримолекулярных реакций равен частоте молекулярных ко-
лебаний —
10
12
—10
13
с-
1
.
3. Перенос протона
Перенос
протона
между
такими электроотрицательными
атомами, как О, N или S, совершается чрезвычайно быстро.
Бимолекулярные реакции обычно лимитируются диффузией, и
константы
скорости имеют порядок 10
10
—10
и
М-
1
с-
1
(табл. 4.1).
Например,
константа скорости переноса протона от Н
3
О+ на
имидазол, который является более сильным основанием, чем
Н
2
О (и потому такой перенос благоприятен), равна
1,5-10
10
М-
1
с-
1
. Константу скорости обратной реакции — перено-
са протона от имидазолий-иона на молекулу воды — можно вы-
числить из разности р/Са этих соединений с помощью следую-
щих уравнений:
[В] [НА]
=
W*A:
(4.83)
- J
•LHA]
=?==*
[BH
+
] + [Ai,
(4.84)

158
Константы
скорости переноса протона,
ГЛАВА
4
Таблица
4.1
\~
х
с"
1
;
25°С
а)
Н
+
и
ОН"
Анионы
неорганичес-
ких
кислот
Карбоксилаты
Феноляты
Еноляты
Амины
Карбанионы
k
1,4-
10
й
Ю
10
—10
11
—5 -
10'°
~5-10'°
~5-10
10
10
10
<
1-Ю
10
ОН~
и
Неорганические
кис-
лоты
Карбоксильные
кис-
лоты
Фенолы
Еиолы
Ионы
аммония
Карбоновые кислоты
Фосфорные кислоты
k
~
10
10
~
ю
10
~
10'°
~
ю
10
—
3
•
10
10
<
1-Ю
9
10
8
-10'°
Eigen
M.,
Nobel Symposium,
5, 245
(1967).
откуда
(4.85)
Рассчитанная
таким образом константа скорости переноса
протона
от
имидазолий-иона
(р/С
а
=
6,95)
на
молекулу воды
([Н
2
О]
=
55 М, р/Са
=
-1,74)
равна
1,7-10
3
с-
1
.
Перенос
протона
от
карбоновых кислот
на
карбоновые осно-
вания
обычно происходит гораздо медленнее. Обусловлено
это
тем,
что
более низкая электроотрицательность углеродного
ато-
ма
требует
стабилизации отрицательного заряда
на
карбоновом
основании
путем делокализации электрона. Последующая пере-
стройка структуры
и
влияние растворителя
могут
замедлить
результирующую скорость переноса.
Одно время считалось,
что
скорость установления равновесия
между
кислыми
и
основными каталитическими группами
фер-
мента
и
растворителем устанавливает верхний предел числа
оборотов
для
катализируемых кислотами
и
основаниями реак-
ций,
равный 10
3
c~'. Объяснялось
это
тем,
что
константа скорости
переноса протона
от
имидазолий-иона
на
молекулу воды
н от
воды
на
имидазол составляет
~2*10
3
с~'.
Однако перенос
про-
тонов
между
имидазолом
или
имидазолий-ионом
и
молекулами
буфера
в
растворе совершается
с
константами скорости,
во
мно-
го
раз
превышающими указанную величину. Например,
в
случае
АТР,
р/Са
которого равен
р/С
а
имидазола, константа скорости
составляет ~10
9
M~
1
c-
1
(при
концентрации
АТР
в
клетке около
2
мМ).
Имеется
и ряд
других
метаболитов, присутствующих
в
клетке
в
миллимолярных концентрациях, которые содержат
со-
ответствующие кислые
и
основные группы,
в
результате
чего

ИЗМЕРЕНИЕ
КОНСТАНТ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
159
равновесие между каталитическими группами фермента и рас-
творителем может устанавливаться со скоростью
10
7
—10
8
с"
1
или
выше. Числа оборотов ферментов обычно существенно ниже
этого значения — они лежат в диапазоне
10—10
3
с~',
хотя число
оборотов карбоангидразы и каталазы равно 10
6
и 4-Ю
7
с
-1
со-
ответственно. Свойства карбоангидразы рассмотрены в гл. 12,
разд. Е.
Таблица
4.2
Константы
скорости
переноса
протона
на
имндазол
и от
имидазолий-иоиа
(рК
а
= 6,95)
а)
[12J
Донор
(DH
+
)
Н
3
О
+
Н
2
О
СНзСО
2
Н
НАТР
3
'
п-Нитрофенол
HP
2
Oj"
Фенол
со*-
Глюкоза
-1,74
15,74
4,76
6,7
7,14
8,45
9,95
10,33
12,3
k
(DH
+
-> Im),
М"
1
с"
1
1,5 • 10">
45
1,2-10»
2-Ю
9
4,5 • 10
8
1,1 • 10
8
МО
7
1,9 • 10
7
1,6-10
5
*(ImH
+
>D),
И"
1
с"
1
31
2,3 • 10
10
7,7 • 10
е
Ы0
!
7,0 • 10"
3,6 • 10
9
1
• 10
10
2 • 10
10
2 • 10
10
а) т=25 °С
ионная
сила=0.
Скорость
в
случае
НгО
рассчитана
при
[Н2О]=55
М.
Б.
Константы скорости ферментативных реакций
и
лимитирующие
процессы
1. Ассоциация ферментов и субстратов
Согласно расчетам, лимитируемые диффузией частоты стол-
кновений
фермента и субстрата должны быть порядка 10
9
М~
1
с~
1
.
Приведенные
же в табл. 4.3 наблюдаемые частоты в основном
лежат в интервале 10
6
—К^М-'с-
1
. Наиболее высокие значения
приближаются к величинам, лимитируемым диффузией, но са-
мые низкие лежат существенно ниже этого предела. В одних
случаях это может быть обусловлено необходимостью десольва-
тации,
в
других
(что более вероятно)—тем, что процесс на
самом деле является двухстадийным, а считается одностадий-
ным.
Например, при низких концентрациях лизоцим связывает
NAG
2
С константой скорости — 5 -10
6
М-'с-
1
. Однако измерения
при
более высоких концентрациях показывают, что связывание
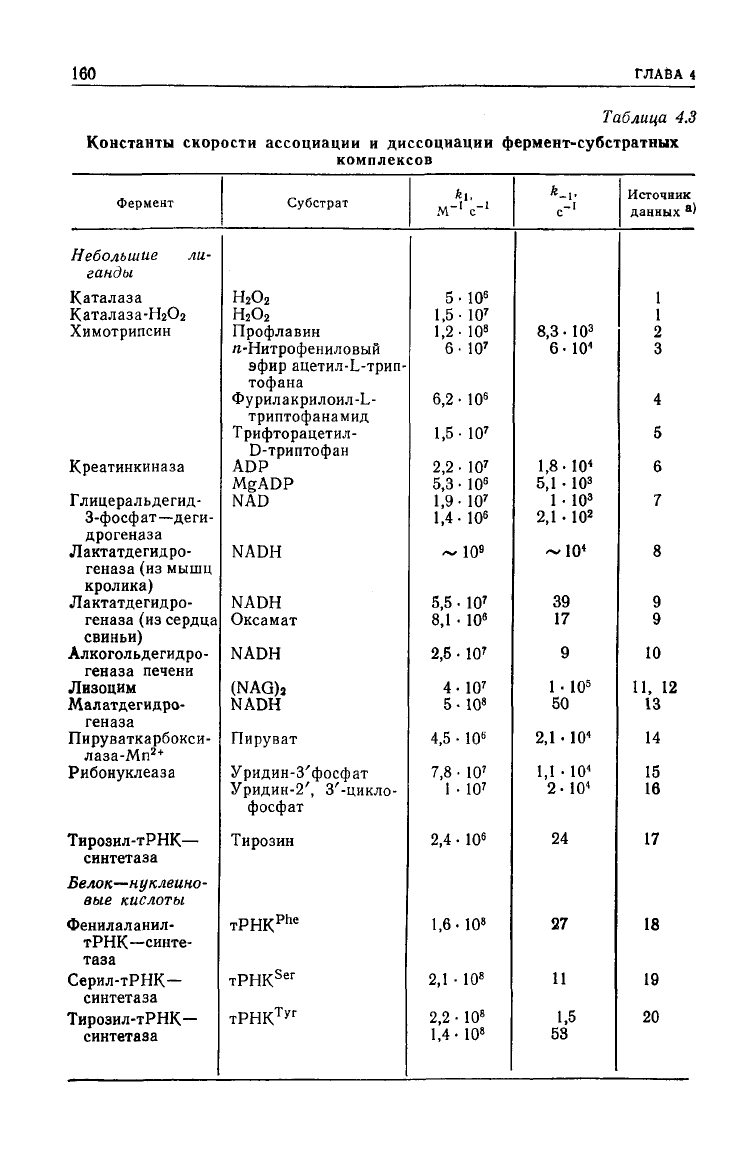
160
ГЛАВА
4
Таблица
4.3
Константы скорости ассоциации
и
диссоциации
фермент-субстратных
комплексов
Фермент
Небольшие
ли-
ганды
Каталаза
Каталаза-НгОг
Химотрипсин
Креатинкиназа
Глицеральдегид-
3-фосфат—деги-
дрогеназа
Лактатдегидро-
геназа
(из
мышц
кролика)
Лактатдегидро-
геназа
(из
сердца
свиньи)
Алкогольдегидро-
геназа печени
Лизоцим
Малатдегидро-
геназа
Пируваткарбокси-
лаза-Мп
2+
Рибонуклеаза
Тирозил-тРНК—
синтетаза
Белок—нуклеино-
вые
кислоты
Фенилаланил-
тРНК—синте-
таза
Серил-тРНК—
синтетаза
Тирозил-тРНК—
синтетаза
Субстрат
Н
2
О
2
н
2
о
2
Профлавин
п-Нитрофениловый
эфир
ацетил-Ь-трип-
тофана
Фурилакрилоил-L-
триптофанамид
Трифторацетил-
D-триптофан
ADP
MgADP
NAD
NADH
NADH
Оксамат
NADH
(NAQ)j
NADH
Пируват
Уридин-З'фосфат
Уридин-2', З'-цикло-
фосфат
Тирозин
тРНК
РЬе
T
p
HK
-Ser
тРНК
Туг
И"
1
с"'
5-10
е
1,5- 10'
1,2
-
10
s
6-
10'
6,2-10
6
1,5
•
10'
2,2
•
10'
5,3-10
6
1,9-10'
1,4-10
6
~10
9
5,5
•
10'
8,1
•
10
е
2,5
•
10'
4-10'
5-Ю
8
4,5
•
10
в
7,8
•
10
7
1
•
10
7
2,4
•
10
6
1,6-10
8
2,1
•
10
8
2,2
•
10
8
1,4- 10
8
с"'
8,3-10
3
6-
10
4
1,8
•
W
5,1
•
10
3
1-
10
3
2,1
•
10
2
~10
4
39
17
9
1-Ю
5
50
2,1
•
10
4
1,1
•
10
4
2-Ю
4
24
27
11
1,5
58
Источник
данных
а
1
1
2
3
4
5
6
7
8
9
9
10
11,
12
13
14
15
16
17
18
19
20
