Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Карбоангидраза
603
позволяет отнести это (взаимодействие к активному центру. Проч-
ность связи Zn-Cl сильно зависит от рН. Она максимальна при
рН 6 и резко падает при рН 9,0. Величина рКа, описывающая
этот процесс, может быть найдена экстраполяцией данных ЯМР,
полученных при нескольких концентрациях хлорида, к нулевой
его концентрации [122, 123]. Эти значения рК
а
составляют
7,0+0,1 для фермента быка и 8,1 ±0,1 для изофермента В челове-
ка, что соответствует величинам константы ионизации координи-
рованной молекулы воды, найденным при изучении протонного
резонанса Со(II)-фермента [125]. Как отмечалось выше, то же
обнаруживается и при компл ексометр ичеоком титровании [86].
Эти результаты свидетельствуют о конкуренции между Cl
-
и
ОН~ за место в координационной сфере металла при высоких
значениях рН. Еще раньше Линдског [101] в своих исследованиях
различного влияния анионов на спектры Со(II)-карбоангидразы
при различных рН объяснил такие же соотношения (см. выше).
Как и в случае протонного резонанса, при рН<6 наблюдается
значительное уменьшение уширения линии
35
Cl, по-видимому,
вследствие каких-то структурных изменений в белке.
Введение парамагнитных групп в белок посредством привязы-
вания к нему стабильных свободных радикалов является ценным
методом спектроскопического исследования [126, 127]. Получае-
мые от введенного !свободного радикала сигналы ЭПР можно ис-
пользовать для контроля за изменениями в белке. При этом
можно сделать определенные выводы и об окружении свободного
радикала. Первые примеры применения этой техники представили
МакКоннел с сотр. [128—130]. Удобнее всего оказался стабиль-
ный свободный радикал имнноксильной группы (нитрокснд)
[131, 132], поскольку сам он мало реакционноспособен, но может
а — без фермента, Av ,-.j.-=12,5 Гц; б — 3,5-10-
5
M
апокарбоангидразы в 0,01 M ацетатном буфере
(рН 4,8), Av-Av
с
,-=7,0 Гц; в —4,МО-
1
M карбоан-
гидразы в 0,01 M трис-буфере (рН 8,2), Av-Avq- =
=49,4 Гц [122].
Рис. 16.17. Спектр ЯМР
35
Cl в 0,5 M растворе
NaCl.
5.1. Карбоангидраза со спиновыми метками

604
Г лава
10
быть привязан к различным соединениям, содержащим опреде-
ленные активные группы. Последние могут !Присоединяться к ак-
тивному центру или к специфическим аминокислотным остаткам
белка [127—130].
Рис. 16.18. Спектр ЭПР соединения
VIiI (А) и растворе (!магнитное поля
3401 Гс, аплитуда модуляции 0,5 Гс)
и его эквивалентных комплексов с
различными изоферментами карбо-
ангидраз (Б, В и Г) (магнитное поле
3401 lie, амплитуда модуляции 6,3
Гс) [ 133 J (Б — Zn(II)-Kap6oa«nm-
раза В быка; В — Zn(II)-Kap6oaH-
гидраза В человека; Г — Co(II)-Kap-
боангидраза В человека).
При исследовании иминоксильного радикала установили, что
свободный электрон в основном локализован на 2ря-ат0М'Н0Й
орбитали азота. Сигнал от свободного радикала вследствие сверх-
тонкого взаимодействия с ядром азота расщепляется на три ли-
нии [126, 127] (рис. 16.18). Это сверхтонкое расщепление зависит
от ориентации иминоксила относительно приложенного поля.
Поэтому три различные линии наблюдаются вдоль трех осей
строго ориентированного монокристалла иминоксила [127].
Однако в разбавленных растворах небольших молекул, содержа-
щих свободный радикал, вращение молекул происходит значи-
тельно быстрее, чем обращение спина. Поэтому различные поло-
жения свободного радикала относительно внешнего поля усред-
няются. С другой стороны, если радикал привязан к макромоле-

Карбоангидраза
605
ле с гораздо меньшей скоростью вращения, так что обращение
ина происходит прежде, чем молекула примет все возможные
иентации, то спектр будет комбинацией спектров для различных
иентаций свободного радикала, например 'комбинацией спект-
•в, отвечающих трем осям монокристалла. Подобная картина
!блюдается при дроблении кристалла, когда ориентация полу-
!емого порошка является комбинацией всех ориентаций кри-
аллов [129]. Поэтому спектры таких заторможенных свободных
щикалов относят к спектрам порошкового типа [127, 128].
Поскольку свободный электрон парамагнитного радикала при-
дан к группе +N—О
-
, он вообще не взаимодействует с элек-
юнными облаками и ядрами окружения, как это имеет место у
юбодных электронов ионов переходных металлов. Поэтому из-
енения спектров ЭПР говорят главным образом о степени затор-
оженности. Этот метод только начинает -применяться к металло-
ерментам, но некоторые результаты уже получены.
Сульфамиды связываются с активным центром, координируясь
иона металла (разд. 4). Их способность к связыванию мало
ависит от структуры группировок, присоединенных к сульфа-
:иду. Поэтому удается довольно просто ввести в карбоангидразу
миноксильные метки, привязывая их к сульфамиду. Одно из та-
их соединений (VII) синтезировали и использовали Мушак и
^оулмен [133].
VII
Спектр ЭПР этого соединения в растворе показан на
эис. 16.18, А, а спектры его эквимолярных комплексов с различ-
гыми изоферментами карбоангидразы—на рис. 16.18, Б, В и Г.
Связывание со всеми тремя формами фермента затормаживает сво-
Зодный радикал. Заторможенность несколько больше у фермента
быка, что согласуется и с большей прочностью связей сульфамидов.
Сравнение этого спектра с расчетными данными Ицковича [126,
134] для заторможенных свободных радикалов приводит к вели-
чине времени корреляции (т) для связанного с ферментом быка
иминоксила в 2-Ю
-8
—4-Ю
-8
с. Интересно, что для времени вра-
щательной релаксации, рассчитанного для комплекса той же
формы карбоангидразы с флуоресцирующим сульфамидом, Чей и
Кернохан [103] получили значения :2,89-10
-8
с.
Co(II) и Zn(II) вызывают почти одинаковую заторможенность
иминоксильной метки, а так как связывание определяется метал-
лом, то и центры связывания в обеих активных металлокарбоан-

606
Г лава
10
гидразах должны быть почти одинаковыми. Ни Hg(II)-, i
Cd(II)-производные не затормаживают иминоксильный сульф
мид, что также согласуется с данными об отсутствии связывай
сульфамидов с этими металлоферментами.
Другой характерной особенностью является практически по
ное отсутствие спин-спинового взаимодействия между парамг
нитным Co(II) и иминоксилом. Это, видимо, не является неож
данным, так как в соответствии с представлениями о спосо
связывания сульфамидов свободный радикал должен находить
от Co(II) на расстоянии 15—20 А.
5.2. Магнитная восприимчивость
Линдоког и Эренберг [1135] детально исследовали магнитну
восприимчивость Со(II)-карбоангидразы В человека и некоторь
ее комплексов с ингибиторами. Все комплексы фермента соде
жат высокоспиновый Co(II) с магнитными моментами от 4,2 ;
4.7 магнетонов Бора. Поскольку чисто спиновый момент предп
лагается равным 3,9 магнетона Бора, все комплексы показывак
ожидаемое увеличение магнитного момента вследствие спин-орб]
тальных связываний [92]. Согласно многочисленным данным
магнитной восприимчивости высокоспиновых комплексов Со (II
при октаэдрической координации магнитные моменты еоставляк
4,7—5,2 магнетона Бора, а при тетраэдрической — 4,1 — 4,9 мао
нетона Бора. Все описанные квадратно-плоскостные комплекс:
Co(II) являются низкоспиновыми и имеют магнитные моменты о
1.8 до 2,0 магнетона Бора. Последнее, вероятно, не слишко:
удивительно, так как низкоспиновая конфигурация d
7
-иона може
стабилизироваться благодаря эффекту Яна — Теллера [92]. Bc
личина магнитной восприимчивости Со (II)-карбоангидразы соглг
суется с несколькими вариантами тетраэдрической геометрт
К сожалению, интерпретация тонких различий восприимчивост
невозможна. Независимо от силы поля лигандов тетраэдрически
комплексы Co(II) являются высокоспиновыми вследствие распре
деления орбитальных энергетичеоких уровней. Со(П)-карбоанги
драза остается высокоспиновой и при относительно высоком пол
лигандов, особенно в сульфамидном комплексе, который ;
тому же имеет наибольшую восприимчивость.
6. РЕНТГЕНОСТРУКТУРНЫЙ АНАЛИЗ КАРБОАНГИДРАЗЫ С
ЧЕЛОВЕКА
Рентгеноструктурные исследования кристаллических препара
тов карбоангидразы С человека Страндберг с сотр. [22, 23, 44
45, 85] довели до степени разрешения 2 А. Наряду с более ран
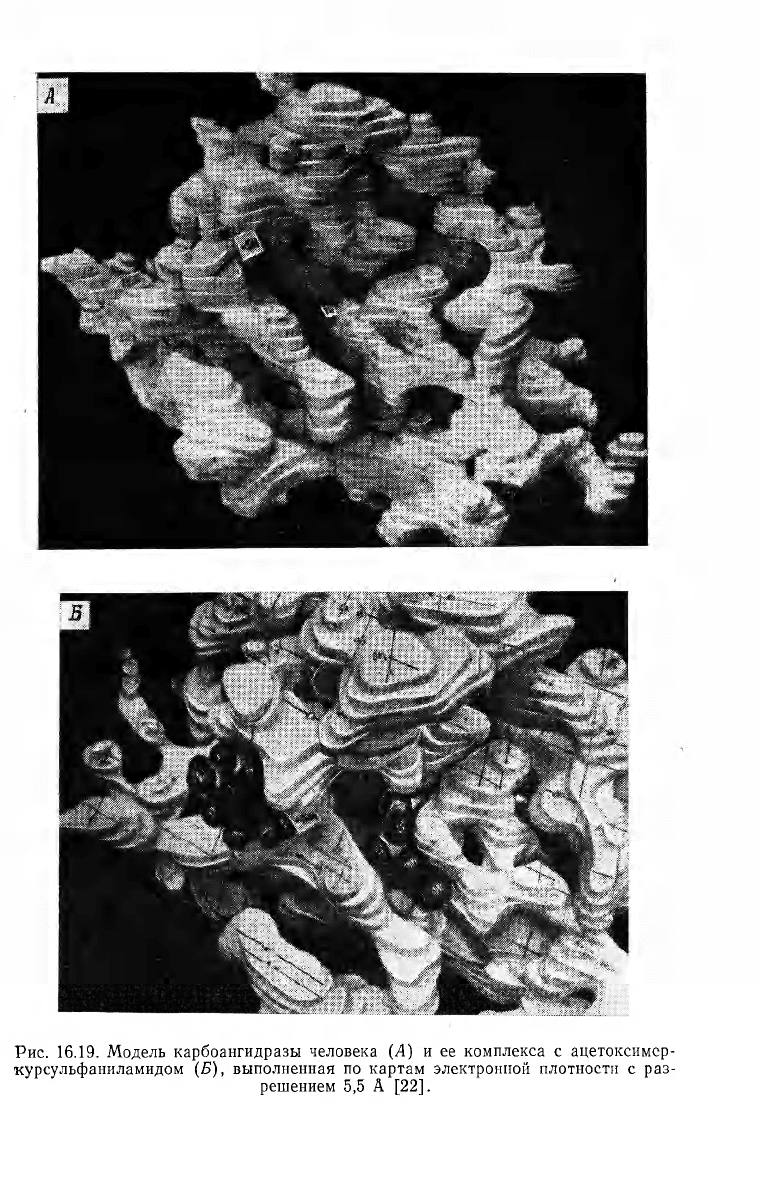
Рис. 16.19. Модель карбоангидразы человека (Л) и ее комплекса с ацетоксимер-
курсульфаниламидом (Б), выполненная по картам электронной плотности с раз-
решением 5,5 А [22].

Карбоангидраза
609
^полоВть
юпивного,
центра
доступ н активному
,центра
активный
\
гз
- ... „
центр \ меченый HIS ?
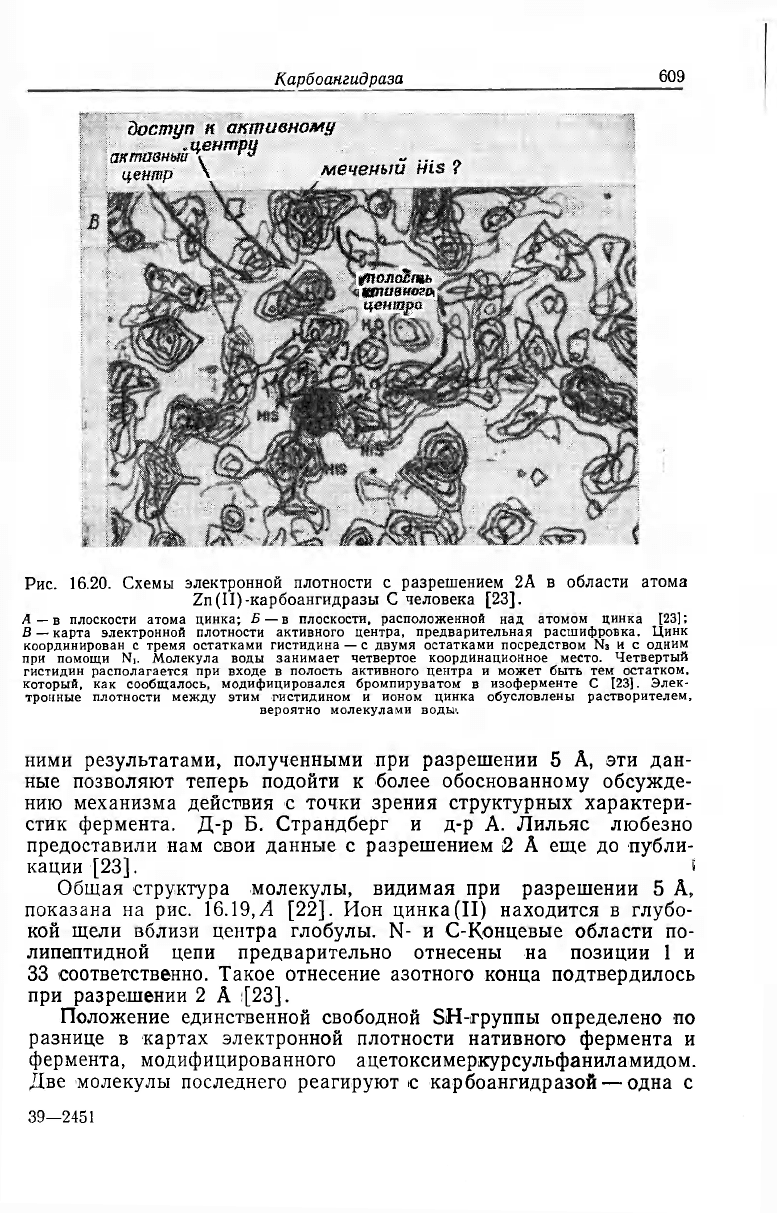
Рис. 16.20. Схемы электронной плотности с разрешением 2А в области атома
Zn(II)-карбоангидразы С человека [23].
Л —в плоскости атома цинка; Б—в плоскости, расположенной над атомом цинка [23]:
В — карта электронной плотности активного центра, предварительная расшифровка. Цинк
координирован с тремя остатками гистидина — с двумя остатками посредством Ns к с одним
при помощи N,. Молекула воды занимает четвертое координационное место. Четвертый
гистидин располагается при входе в полость активного центра и может быть тем остатком,
который, как сообщалось, модифицировался бромпируватом в изоферменте С [23]. Элек-
тронные плотности между этим гистидином и ионом цинка обусловлены растворителем,
вероятно молекулами воды».
ними результатами, полученными при разрешении 5 А, эти дан-
ные позволяют теперь подойти к более обоснованному обсужде-
нию механизма действия с точки зрения структурных характери-
стик фермента. Д-р Б. Страндберг и д-р А. Лильяс любезно
предоставили нам свои данные с разрешением 2 А еще до публи-
кации [23]. S
Общая структура молекулы, видимая при разрешении 5 А,
показана на рис. 16.19, Л [22]. Ион цинка (II) находится в глубо-
кой щели вблизи центра глобулы. N- и С-Концевые области по-
липептидной цепи предварительно отнесены на позиции 1 и
33 соответственно. Такое отнесение азотного конца подтвердилось
при разрешении 2 А [23].
Положение единственной свободной SH-группы определено по
разнице в картах электронной плотности нативного фермента и
фермента, модифицированного ацетоксимеркурсульфаниламидом.
Две молекулы последнего реагируют с карбоангидразой— одна с
39—2451

610
Г лава
10
активным центром, а другая со свободной сульфгидрильно
группой [22]. Модель этого комплекса показана на рис. 16.19, £
SH-группа удалена от иона Zn(II) на 14 А.
Карта электронной плотности с разрешением 2 А показывает
что центр тяжести сульфамида находится от иона цинка на рас
стоянии 3,2 А. Это в пределах длины связи и согласуется с пред
ставлением о координации сульфамидного атома азота у ион;
цинка (разд. 4).
Атом ртути ацетоксимеркурсульфаниламида находится на зна
чительно большем расстоянии от цинка, т. е. бензольная част]
сульфамида лежит в щели, ведущей к иону цинка [22]. Низкш
константы диссоциации сульфамидных комплексов карбоангидра
зы в растворах (Ю
-5
—Ю
-9
М)
[111
—114] свидетельствуют о том
что кроме координационных имеются и другие типы связей межд}
белком и циклической частью молекулы сульфамида. Изменена
в спектрах поглощения и флуоресценции связанных сульфамидоЕ
свидетельствуют о гидрофобном характере связывающей полости
[30, 103, 105]. Однако основание этой полости, расположенно?
вокруг атома цинка, может быть достаточно гидрофильным.
На рис. 16.20,Л и Б приведены две карты электронной плот-
ности с разрешением 2 А. Одна из них соответствует плоскости,
в которой находится ион цинка, а вторая — плоскости, располо-
женной сразу над ним. Наибольшей плотности на картах отве-
чает ион металла. Вокруг него заметны три координированные
группы белка, электронные плотности которых хорошо совмеща-
ются со структурой остатков гистидина (рис. 16.20,В). Так как
аминокислотная последовательность пока не известна, идентифи-
кация должна считаться лишь предварительной. Интересно, что
два из этих трех лигандов (на рис. 16.20, В они расположены ле-
вее) относятся к одному и тому же участку пептидной цепи и их
разделяет только один остаток.
Кроме описанных трех лигандов на схеме заметно еще одно
скопление над атомом цинка (на рис. 16.20,Л — немного правее).
Оно несколько слабее, чем у белковых групп, и, видимо, отно-
сится к молекуле воды из раствора. По направлению это скопле-
ние соответствует местам связывания сульфамида, которые на
рис. 16.20, Б обозначено символами Аз (сульфамидная группа) и
A
4
(Hg в бензольной части). При связывании сульфамида слабое
скопление замещается более плотным. Имеется значительное ко-
личество данных о том, что в растворе фермента это четвертое
место занимают координированные H
2
O или OH
-
(см. ниже).
Точная структура вокруг иона Zn(II) не может быть опреде-
лена и с помощью карт при разрешении 2 А. Для этого необхо-
дима еще большая степень разрешения. Строение этой области
белка приближается к тетраэдрической геометрии, хотя спектры
Go (II)-карбоангидразы указывают на значительное искажение.

Карбоангидраза
611
Некоторые общие особенности структуры глобулы карбоан-
гидразы заметны и на этих картах. На пространственной модели
полипептидной цепи, построенной в соответствии с ними [23],
обнаруживаются четыре фрагмента правой опирали, по два витка
в каждом. Только один из этих участков соответствует парамет-
рам a-спирали, остальные значительно искажены и скорее похо-
дят на Зю-спираль [23]. Как отмечалось в разд. 2, спектры ДОВ
и КД различных карбоангидраз также указывают на малую сте-
пень спирализации.
Основной особенностью вторичной структуры белка, как сле-
дует из карт электронной плотности с разрешением 2 А, является
большая область p-конфигурации, занимающей центральную часть
молекулы. По меньшей мере восемь таких фрагментов, направ-
ленных антипараллельно друг к другу, образуют изогнутую
складчатую структуру. Еще три или четыре участка цепи также
расположены параллельно или антипараллельно к этой структу-
ре. В результате в центре глобулы образуется большая гидро-
фобная область. В этом отношении структура карбоангидразы
очень похожа на строение карбоксипептидазы А [136, 137]
(гл. 15). Три гистидиновых лиганда, связанных с ионом Zn(II),—
тоже из этой (З-конфигурации.
7. МЕХАНИЗМ ДЕЙСТВИЯ
Первоначально считали, что карбоангидраза является высоко-
специфичным ферментом, катализирующим только одну реак-
цию— обратимую гидратацию CO
2
[уравнение (1)]. В последние
годы были найдены и другие реакции, катализируемые этим фер-
ментом. К ним относятся гидролиз п-нитрофенилацетата [24—27]
о
он
I
CH
3
-C-H
он
(5)

612
Г лава
10
![уравнение (3)], гидролиз сультона 2-окси-5-нитро-а-толуолсуль-
фокиелоты [28—30] [уравнение (4)] и гидратация ацетальдегида
![31—33] [уравнение (5)], а также некоторых других альдегидов
[138, 139].
Гидролиз сультона катализируется ферментом исключительно
эффективно [28—30]. Число оборотов меняется от 600 до
20 000 молей субстрата/мин на 1 моль фермента в зависимости от
природы изофермента, рН, присутствия или отсутствия ингиби-
рующих анионов и органического растворителя [30, 41]. Такая
большая скорость реакции (4), особенно если сравнить с относи-
тельно медленным гидролизом «-нитрофенилацетата (от 6 до
20 молей/мин на 1 моль фермента), по-видимому, объясняется
специфическим характером взаимодействия с активным центром,
так как структура сультона похожа на структуры сильных суль-
фамидных ингибиторов (разд. 4).
Физиологическое значение реакций (3) — (5) в настоящее вре-
мя неизвестно. Важность же обратимой гидратации CO
2
оче-
видна. В водных растворах эта реакция протекает относительно
быстро и без помощи ферментативного катализа. Кинетическая
схема этого процесса, предложенная Эйгеном и сотр. [140]
[уравнение (6)], имеет то преимущество, что она учитывает непо-
средственное равновесие CO
2
с HCO
3
и HaCO
3
.
H
+
+ HCO
3
-
"13
H
2
CO
3
1*31
к
13
» H
2
O + CO
2
Ij
*32
Кинетические .константы уравнения (1) следующим образом вы-
ражаются через параметры этой схемы:
kl = &31+
Й
32 И 6-1=^13^0+^23 (
7
)
где K
a
— истинная константа диссоциации угольной кислоты,
р/(=3,6. Константа первого порядка для скорости гидратации
—d [CO
2
]
K= ^r
t
-/[CO
2
] (8)
определена в некоторых работах. Сообщались значения: 0,03 с
-1
Г141], 0,0358 с-
1
[142], 0,0375 с
-1
[143] для 25°С и 0,0434 с"
1
[114] для 37
0
C. Лучшее значение для константы скорости деги-
дратации k-i, по-видимому, составляет 15 с
-1
[142, 143] при 25
0
C.
В присутствии фермента гидратация CO
2
осуществляется в
IO
7
раз быстрее, чем без катализатора (см. ниже). При рН>1С
