Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

Карбоангидраза
583
скую конфигурацию вносят два других атома кислорода, распо-
ложенные от центра на расстоянии 2,928 А. Имеются данные о том,
что их влияние и является причиной изменения спектров [97].
Спектр поглощения в видимой области Cu (II)-карбоангидра-
зы, на котором можно различить три полосы поглощения, также
\, нм рН
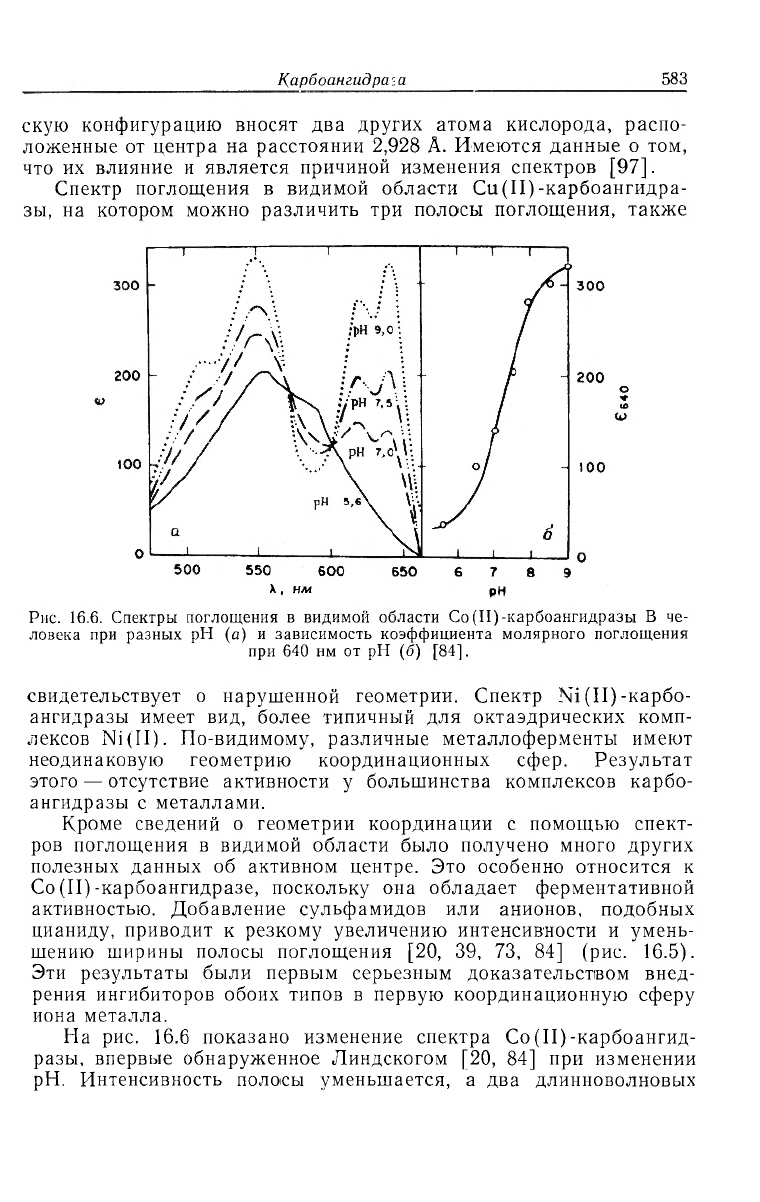
Рис. 16.6. Спектры поглощения в видимой области Со(II)-карбоангидразы В че-
ловека при разных рН (а) и зависимость коэффициента молярного поглощения
при 640 нм от рН (б) [84].
свидетельствует о нарушенной геометрии. Спектр Ni (II)-карбо-
ангидразы имеет вид, более типичный для октаэдрических комп-
лексов Ni(II). По-видимому, различные металлоферменты имеют
неодинаковую геометрию координационных сфер. Результат
этого — отсутствие активности у большинства комплексов карбо-
ангидразы с металлами.
Кроме сведений о геометрии координации с помощью спект-
ров поглощения в видимой области было получено много других
полезных данных об активном центре. Это особенно относится к
Со(II)-карбоангидразе, поскольку она обладает ферментативной
активностью. Добавление сульфамидов или анионов, подобных
цианиду, приводит к резкому увеличению интенсивности и умень-
шению ширины полосы поглощения [20, 39, 73, 84] (рис. 16.5).
Эти результаты были первым серьезным доказательством внед-
рения ингибиторов обоих типов в первую координационную сферу
иона металла.
На рис. 16.6 показано изменение спектра Со(II)-карбоангид-
разы, впервые обнаруженное Линдскогом [20, 84] при изменении
рН. Интенсивность полосы уменьшается, а два длинноволновых
584
Г лава
10
пика при рН<6 Еообще ие наблюдаются. Величина рK
a
, отве-
чающая этому сдвигу, в зависимости от условий лежит в интер-
вале рН 7—8 [20, 73, 84, 86] и, по-видимому, идентична той кон-
станте, которая определяет рН-зависимость активности фермен-
та [26, 27, 29, 86, 99—101]. По всей вероятности, геометрия коор-
X, им
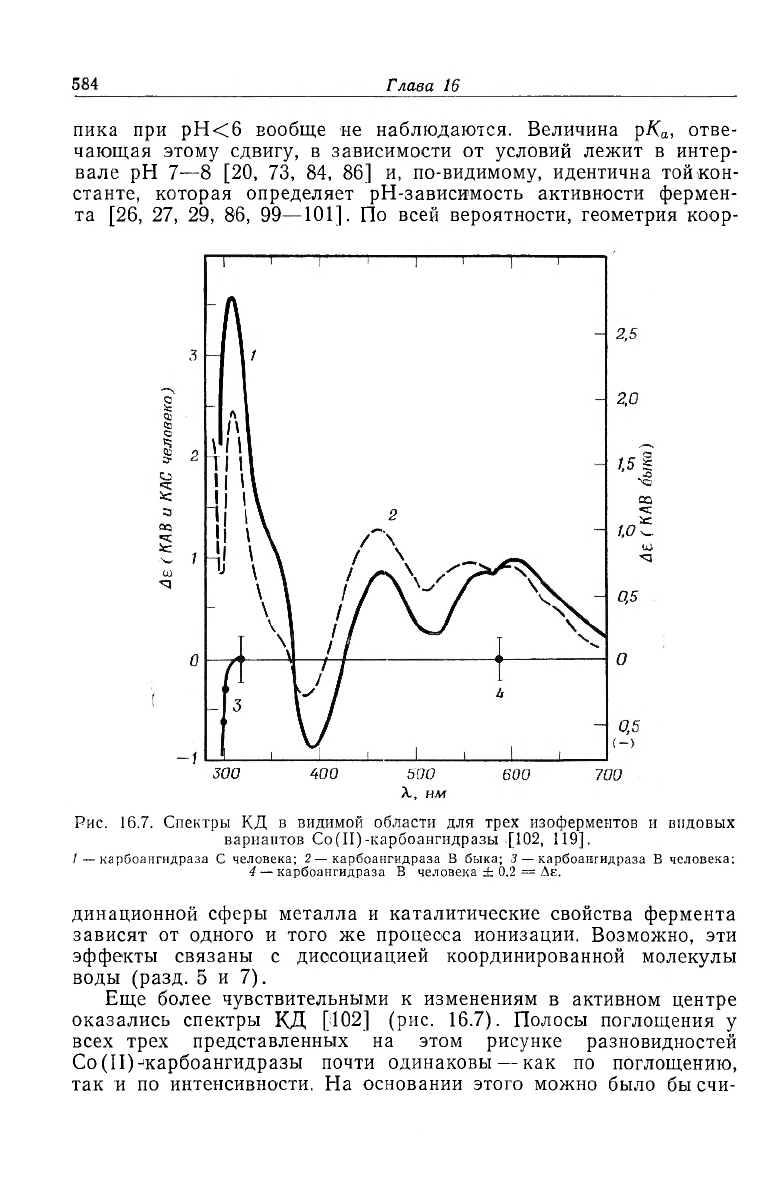
Рис. 16.7. Спектры КД в видимой области для трех изоферментов и видовых
вариантов Co(II)-карбоангидразы [102, 119].
1 — карбоангидраза С человека; 2 — карбоангидраза В быка; 3 — карбоангидраза В человека;
4 — карбоангидраза В человека ± 0,2 = Ле.
динационной сферы металла и каталитические свойства фермента
зависят от одного и того же процесса ионизации. Возможно, эти
эффекты связаны с диссоциацией координированной молекулы
воды (разд. 5 и 7).
Еще более чувствительными к изменениям в активном центре
оказались спектры КД [102] (рис. 16.7). Полосы поглощения у
всех трех представленных на этом рисунке разновидностей
Со(П)^карбоангидразы почти одинаковы — как по поглощению,
так и по интенсивности. На основании этого можно было бысчи-
Карбоангидраза
585
тать одинаковой и структуру координационной сферы. Но вели-
чины эллиптичности указывают на существенные различия. Изо-
ферменты С человека и В быка весьма оптически активны
(Ae«3—5), а у формы В человека во всей области Ае<0,2.
При 10-кратном увеличении чувствительности и у этого фер-
мента можно обнаружить небольшие положительные полосы эл-
липтичности, соответствующие всем полосам поглощения
)
X, нм
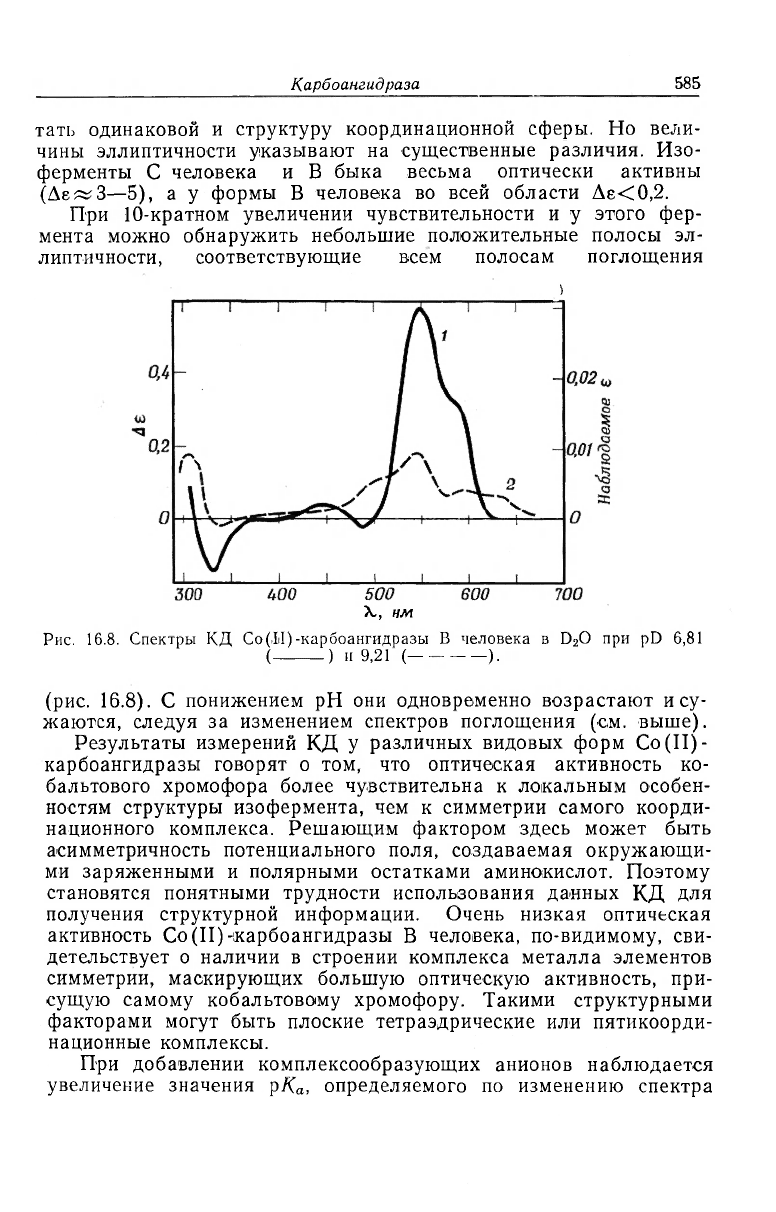
Рис. 16.8. Спектры КД Co(II)-карбоангидразы В человека в D
2
O при pD 6,81
( ) и 9,21 ( ).
(рис. 16.8). С понижением рН они одновременно возрастают и су-
жаются, следуя за изменением спектров поглощения (ем. выше).
Результаты измерений КД у различных видовых форм Co(II)-
карбоангидразы говорят о том, что оптическая активность ко-
бальтового хромофора более чувствительна к локальным особен-
ностям структуры изофермента, чем к симметрии самого коорди-
национного комплекса. Решающим фактором здесь может быть
асимметричность потенциального поля, создаваемая окружающи-
ми заряженными и полярными остатками аминокислот. Поэтому
становятся понятными трудности использования данных КД для
получения структурной информации. Очень низкая оптическая
активность Co(II)-карбоангидразы В человека, по-видимому, сви-
детельствует о наличии в строении комплекса металла элементов
симметрии, маскирующих большую оптическую активность, при-
сущую самому кобальтовому хромофору. Такими структурными
факторами могут быть плоские тетраэдрические или пятикоорди-
национные комплексы.
При добавлении комплексообразующих анионов наблюдается
увеличение значения р/(
а
, определяемого по изменению спектра

586
Г лава 10
при изменении рН. Увеличение этого параметра тем больше, чем
значительнее у добавляемых ионов сродство к металлу [101].
Такой же сдвиг р/С
а
в присутствии тех же анионов заметен и на
кривых зависимости скорости реакции от рН [101]. Одно из воз-
можных объяснений этого — конкуренция между гидроксилом и
анионами за свободное место в координационной сфере иона ме-
талла. Такое объяснение согласуется с многочисленными данны-
ми о наличии в активном центре связей фермент — Zn—ОН
(см. ниже).
3.4. Связывание ингибиторов
Исследование функциональных и физико-химических аспектов
взаимодействия ингибиторов с активным центром карбоангидразы
способствовало разработке новых методов изучения фермента.
Кинетические, спектральные и рентгеноструктурные данные о
взаимодействии карбоангидразы с ингибиторами двух главных
типов (сульфамидами и небольшими анионами) свидетельствуют
о том, что их ферментативное связывание осуществляется одним
и тем же центром белка [21, 101, 103]. Имеется достаточно осно-
ваний считать, что главную роль в этом взаимодействии играет
обычная координация ионами металлов, хотя реальная картина
явлений ингибирования может включать и другие типы взаимо-
действий [231
•
Изменение спектральных свойств под воздействием сульфами-
дов будет обсуждено в разд. 4. С помощью
3
Н-ацетазоламида
можно непосредственно показать, что для связывания этого суль-
фамида необходим ион металла (рис. 16.9, а) [21]. При концент-
рациях, меньших Ю
-4
М, ацетазоламид не связывается апофер-
ментом, тогда как Zn (II)-карбоангидраза присоединяет 1 моль
ингибитора уже при концентрации последнего 5-10~
7
M
(рис. 16.9, а). Характерно, что подобный тип взаимодействия об-
наружен только с цинковыми и кобальтовыми комплексами кар-
боангидразы — единственными активными разновидностями ме-
таллофермента (табл. 16.8). По-видимому, только реакционноспо-
собная конфигурация активного центра допускает возможность
связывания сульфамидов [21].
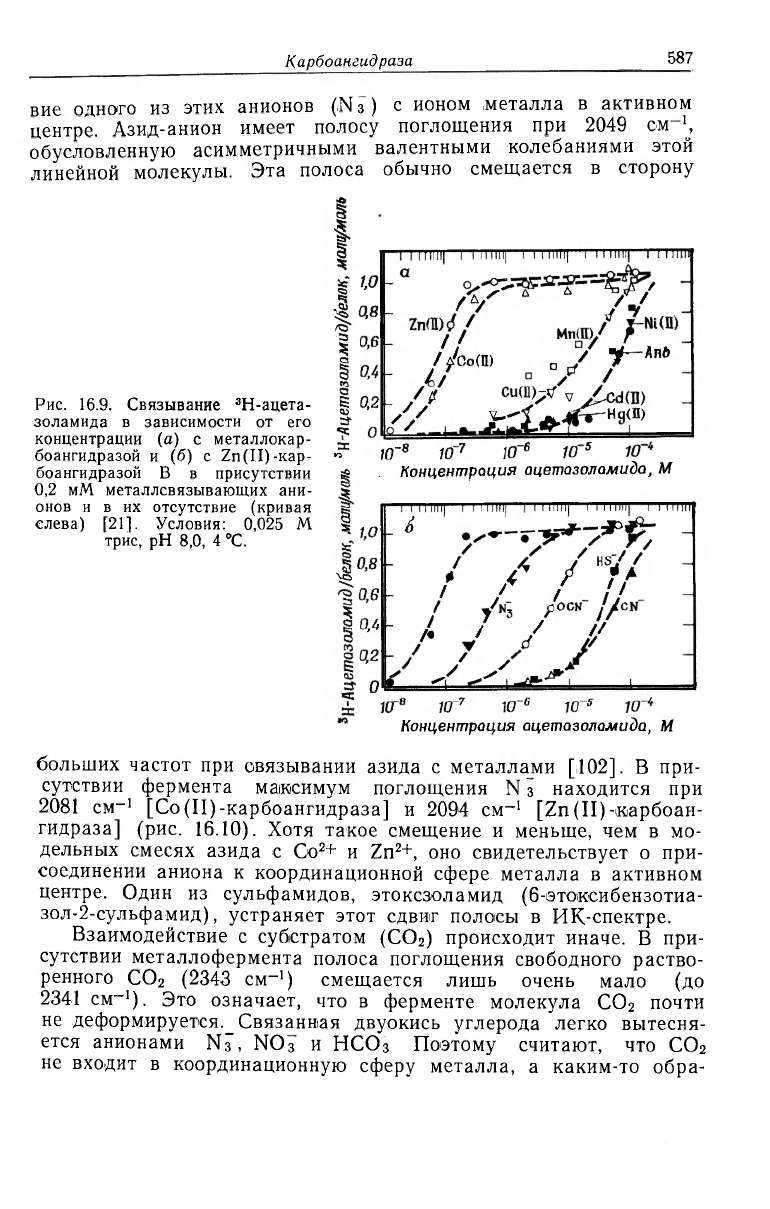
Азид-, цианат-, сульфид- и цианид-анионы способны вытеснять
сульфамид из активного центра (рис. 16.9, б). Концентрация
3
Н-ацетазоламида, необходимая для связывания с ферментом в
присутствии равных и постоянных концентраций этих анионов,
оказывается прямо пропорциональной величинам их сродства к
активному центру, рассчитанным из кинетики ингибирования
(CN-5sSH~>OCN->Ni) [21].
При исследовании инфракрасных спектров поглощения Рипе и
Уонг [105] также смогли показать непосредственное взаимодейст-
Карбоангидраза
587
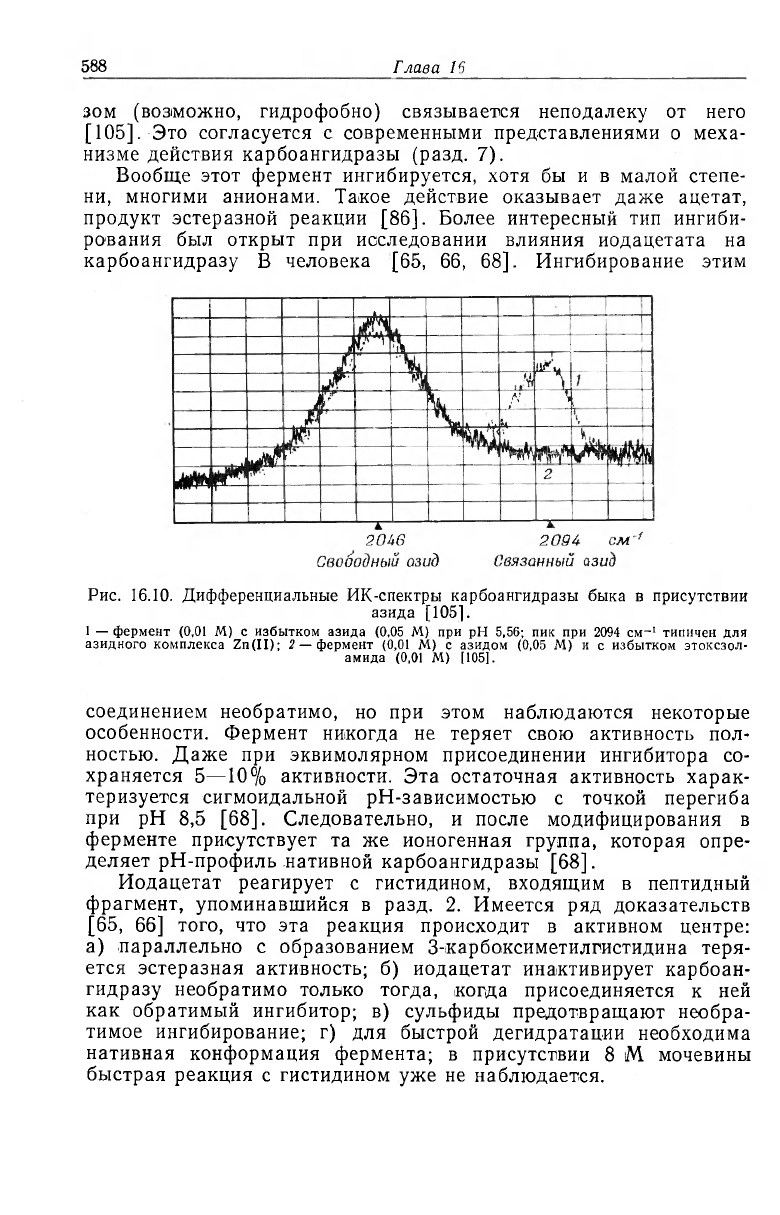
вие одного из этих анионов (N3) с ионом металла в активном
центре. Азид-анион имеет полосу поглощения при 2049 см^,
обусловленную асимметричными валентными колебаниями этой
линейной молекулы. Эта полоса обычно смещается в сторону
Рис. 16.9. Связывание
3
Н-ацета-
золамида в зависимости от его
концентрации (а) с металлокар-
боангидразой и (б) с Zn(II)-Kap-
боангидразой В в присутствии
0,2 мМ металлсвязывающих ани-
онов и в их отсутствие (кривая
слева) [21]. Условия: 0,025 M
трис, рН 8,0, 4 °С.
Концентрация ацетазоламида, M
Концентрация ацетазоламида, M
больших частот при связывании азида с металлами [102]. В при-
сутствии фермента максимум поглощения N з находится при
2081 см-
1
[Co(II)-карбоангидраза] и 2094 см-
1
[Zn(II)-карбоан-
гидраза] (рис. 16.10). Хотя такое смещение и меньше, чем в мо-
дельных смесях азида с Со
2
+ и Zn
2
+, оно свидетельствует о при-
соединении аниона к координационной сфере металла в активном
центре. Один из сульфамидов, этоксзоламид (6-этоксибензотиа-
зол-2-сульфамид), устраняет этот сдвиг полосы в ИК-спектре.
Взаимодействие с субстратом (CO
2
) происходит иначе. В при-
сутствии металлофермента полоса поглощения свободного раство-
ренного CO
2
(2343 см
-1
) смещается лишь очень мало (до
2341 см
-1
). Это означает, что в ферменте молекула CO
2
почти
не деформируется._ Связанная двуокись углерода легко вытесня-
ется анионами N3, NO
3
и HCO
3
Поэтому считают, что CO
2
не входит в координационную сферу металла, а каким-то обра-
588
Г лава 10
зом (возможно, гидрофобно) связывается неподалеку от него
[105]. Это согласуется с современными представлениями о меха-
низме действия карбоангидразы (разд. 7).
Вообще этот фермент ингибируется, хотя бы и в малой степе-
ни, многими анионами. Такое действие оказывает даже ацетат,
продукт эстеразной реакции [86]. Более интересный тип ингиби-
рования был открыт при исследовании влияния иодацетата на
карбоангидразу В человека [65, 66, 68]. Ингибирование этим
Рис. 16.10. Дифференциальные ИК-спектры карбоангидразы быка в присутствии
азида [1051.
1 — фермент (0,01 M) с избытком азида (0.05 M) при рН 5,56; пик при 2094 см-
1
типичен для
азидного комплекса Zn(II); 2 — фермент (0,01 M) с азидом (0,05 М) и с избытком этоксзол-
амида (0,01 M) [105].
соединением необратимо, но при этом наблюдаются некоторые
особенности. Фермент никогда не теряет свою активность пол-
ностью. Даже при эквимолярном присоединении ингибитора со-
храняется 5—10% активности. Эта остаточная активность харак-
теризуется сигмоидальной рН-зависимостью с точкой перегиба
при рН 8,5 [68]. Следовательно, и после модифицирования в
ферменте присутствует та же ионогенная группа, которая опре-
деляет рН-профиль нативной карбоангидразы [68].
Иодацетат реагирует с гистидином, входящим в пептидный
фрагмент, упоминавшийся в разд. 2. Имеется ряд доказательств
[65, 66] того, что эта реакция происходит в активном центре:
а) параллельно с образованием 3-карбоксиметилгистидина теря-
ется эстеразная активность; б) иодацетат инактивирует карбоан-
гидразу необратимо только тогда, когда присоединяется к ней
как обратимый ингибитор; в) сульфиды предотвращают необра-
тимое ингибирование; г) для быстрой дегидратации необходима
нативная конформация фермента; в присутствии 8 M мочевины
быстрая реакция с гистидином уже не наблюдается.
Карбоангидраза
589
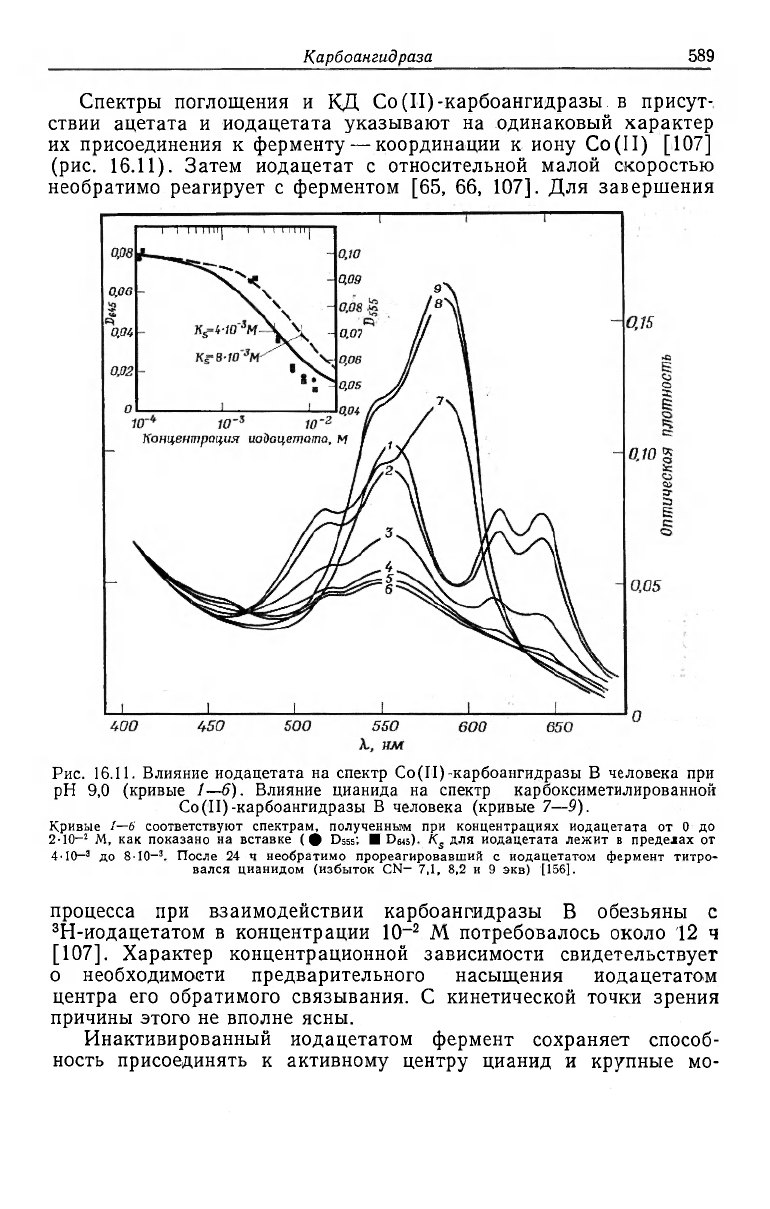
Спектры поглощения и КД Со(II)-карбоангидразы в присут-
ствии ацетата и иодацетата указывают на одинаковый характер
их присоединения к ферменту— координации к иону Co(II) [107]
(рис. 16.11). Затем иодацетат с относительной малой скоростью
необратимо реагирует с ферментом [65, 66, 107]. Для завершения
Рис. 16.11. Влияние иодацетата на спектр Co(II)-карбоангидразы В человека при
рН 9,0 (кривые 1—6). Влияние цианида на спектр карбоксиметилированной
Co(II)-карбоангидразы В человека (кривые 7—9).
Кривые 1—6 соответствуют спектрам, полученным при концентрациях иодацетата от 0 до
2-Ю-
2
М, как показано на вставке (ф D555; • Deis). K
s
для иодацетата лежит в пределах от
4'IO-
3
до 8-Ю
-3
. После 24 ч необратимо прореагировавший с иодацетатом фермент титро-
вался цианидом (избыток CN- 7,1, 8,2 и 9 экв) [156].
процесса при взаимодействии карбоангидразы В обезьяны с
3
Н-иодацетатом в концентрации Ю
-2
M потребовалось около 12 ч
[107]. Характер концентрационной зависимости свидетельствует
о необходимости предварительного насыщения иодацетатом
центра его обратимого связывания. С кинетической точки зрения
причины этого не вполне ясны.
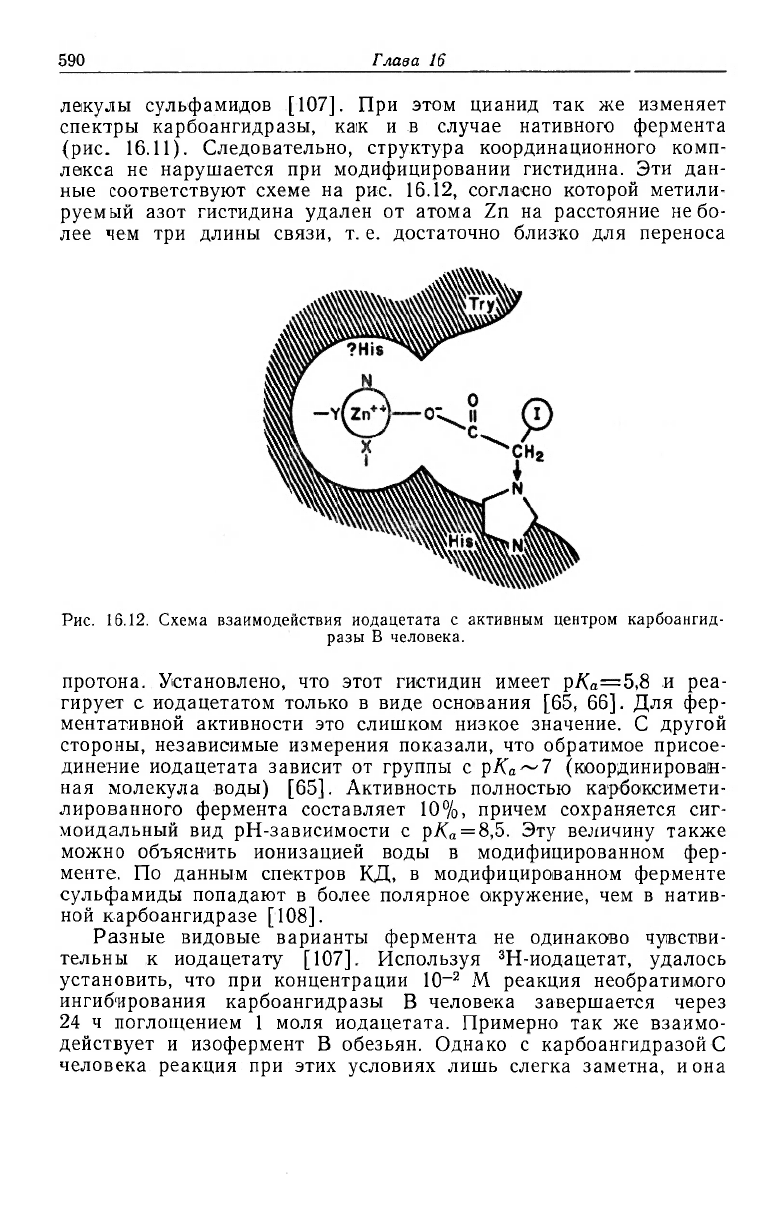
Инактивированный иодацетатом фермент сохраняет способ-
ность присоединять к активному центру цианид и крупные мо-
590 Г лава
10
л скулы сульфамидов [107]. При этом цианид так же изменяет
спектры карбоангидразы, как и в случае нативного фермента
(рис. 16.11). Следовательно, структура координационного комп-
лекса не нарушается при модифицировании гистидина. Эти дан-
ные соответствуют схеме на рис. 16.12, согласно которой метили-
руемый азот гистидина удален от атома Zn на расстояние не бо-
лее чем три длины связи, т. е. достаточно близко для переноса
Рис. 16.12. Схема взаимодействия иодацетата с активным центром карбоангид-
разы В человека.
протона. Установлено, что этот гистидин имеет р/(
а
=5,8 и реа-
гирует с иодацетатом только в виде основания [65, 66]. Для фер-
ментативной активности это слишком низкое значение. С другой
стороны, независимые измерения показали, что обратимое присое-
динение иодацетата зависит от группы с р/С
а
—
7 (координирован-
ная молекула воды) [65]. Активность полностью карбоксимети-
лированного фермента составляет 10%, причем сохраняется сиг-
моидальный вид рН-зависимости с р/Са
==
8,5. Эту величину также
можно объяснить ионизацией воды в модифицированном фер-
менте. По данным спектров КД, в модифицирО|ванном ферменте
сульфамиды попадают в более полярное окружение, чем в натив-
ной карбоангидразе [108].
Разные видовые варианты фермента не одинаково чувстви-
тельны к иодацетату [107]. Используя
3
Н-иодацетат, удалось
установить, что при концентрации 10~
2
M реакция необратимого
ингибирования карбоангидразы В человека завершается через
24 ч поглощением 1 моля иодацетата. Примерно так же взаимо-
действует и изофермент В обезьян. Однако с карбоангидразой С
человека реакция при этих условиях лишь слегка заметна, иона

Карбоангидраза
591
вообще не происходит в случае карбоангидразы В быка [107].
Отсюда вытекает, что если гистидин есть во всех разновидностях
фермента, то в некоторых из них он обладает пониженной реак-
ционной способностью.
Для выяснения механизма катализа оказались полезными ис-
следования смещения кислотно-основных равновесий в фермента-
тивной системе вследствие присоединения лигандов к свободным
местам координационной сферы металла активного центра. При
ингибировании ионами, подобными CN
-
или HS
-
, в области зна-
чений рН, меньших величины рН для диссоциации HCN или
H
2
S (при 23 °С —9,3 или 6,9 соответственно [108]), должно на-
блюдаться выделение протонов. Общее количество последних
будет зависеть уже от нового положения кислотно-основных рав-
новесий системы. Для карбоангидразы исследование этих явле-
ний было проведено с помощью дифференциального титрования
в интервале рН от 6 до 10 [86], т. е. в области устойчивости циа-
нидного комплекса фермента. Метод заключался в фиксировании
(на рН-стате с точностью
1
±0,02 мкмоль H+) выделения или по-
глощения протонов после прибавления к раствору фермента экви-
молярного количества ингибитора, содержащегося в небольшом
объеме его концентрированного раствора.
Для решения поставленной задачи полезно провести сравне-
ние экспериментальных результатов с теоретическими зависимо-
стями, основанными на использовании какой-нибудь гипотетиче-
ской модели исследуемого процесса. Одна из таких схем, пред-
полагающая замещение цианидом координированной молекулы
воды, может иметь вид:
(a) EZn H
2
O + HCN «=±. EZn CN
-
+ H
2
O + H+
VK =8
-H
+
р/С
а
=9,3
—H
(2)
(б) EZn-OH
-
+ CN
-
т—» EZn CN" + OH"
Реакции (2а) и (26) должны иметь место в очень кислых и
в очень щелочных растворах соответственно, если, конечно, зна-
чения рK
a
координированной молекулы H^O не выходят за пре-
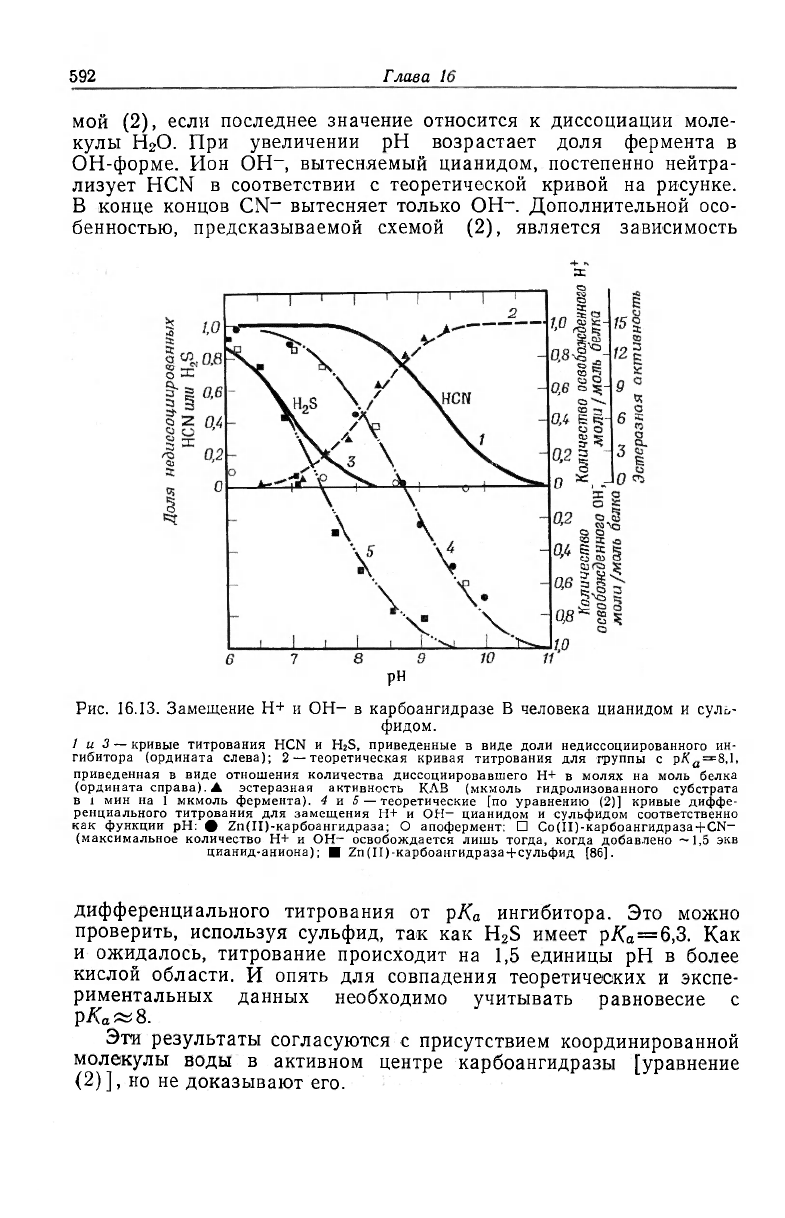
делы экспериментального интервала рН. Как показано на
рис. 16.13, кривая титрования для реакции цианида с Zn(II)-Kap-
боангидразой пересекает ось абсцисс; 1 моль H
+
освобождается
при рН 6,0 и 0,7 моля HO
-
освобождается при рН 10,1. Подоб-
ное изменение кислотно-основных равновесий является функцией
металла, так как при добавлении ионов CN
-
к апоферменту рН
системы не смещается. Аналогичная кривая наблюдается и для
случая кобальта (рис. 16.13). Эти результаты указывают на су-
ществование еще одного равновесия с р/С
а
8 (пунктирная кривая
на рис. 16.13). Экспериментальная картина согласуется со схе-
592
Г лава
10
мой (2), если последнее значение относится к диссоциации моле-
кулы H
2
O. При увеличении рН возрастает доля фермента в
ОН-форме. Ион 0Н~, вытесняемый цианидом, постепенно нейтра-
лизует HCN в соответствии с теоретической кривой на рисунке.
В конце концов CN
-
вытесняет только ОН
-
. Дополнительной осо-
бенностью, предсказываемой схемой (2), является зависимость
ж
рН
Рис. 16.13. Замещение H
+
и ОН- в карбоангидразе В человека цианидом и суль-
фидом.
1 и 3 — кривые титрования HCN и H
2
S, приведенные в виде доли недиссоциированного ин-
гибитора (ордината слева); 2 — теоретическая кривая титрования для группы с рХ
а
=8,1.
приведенная в виде отношения количества диссоциировавшего H+ в молях на моль белка
(ордината справа). А эстеразная активность КЛВ (мкмоль гидролизованного субстрата
в 1 мин на 1 мкмоль фермента). 4 и 5 — теоретические [по уравнению (2)] кривые диффе-
ренциального титрования для замещения H+ и OH- цианидом и сульфидом соответственно
как функции рН: • ZndU-карбоангидраза; О апофермент: • Со(П)-карбоангидраза +CN-
(максимальное количество H+ и OH- освобождается лишь тогда, когда добавлено —1,5 экв
цианид-аниона); • 2п(П)-карбоангидраза + сульфид [86].
дифференциального титрования от рK
a
ингибитора. Это можно
проверить, используя сульфид, так как H
2
S имеет р/С
а
=6,3. Как
и ожидалось, титрование происходит на 1,5 единицы рН в более
кислой области. И опять для совпадения теоретических и экспе-
риментальных данных необходимо учитывать равновесие с
р/Са«8.
Эти результаты согласуются с присутствием координированной
молекулы воды в активном центре карбоангидразы [уравнение
(2)], но не доказывают его.
