Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Карбоангидраза
593
Возможны и другие объяснения этих явлений. Одно из них
редполагает, что анионом замещается какой-то белковый ли-
анд, диссоциации которого отвечает очень большая величина
IK
a
- Последний затем присоединяет протон. А взаимодействие
амой этой группы с металлом также зависит от рН со значе-
;ием р/С
а
~8. Однако данная гипотеза не очень убедительна.
Результаты, полученные методом ЯМР, дают все основания при-
[исывать значение рКа~8 координированной молекуле воды
разд. 5).
После того как Манн и Кейлин [21] обнаружили ингибирова-
[ие карбоангидразы сульфамидами, было получено еще много
юдобных соединений. Установлено, что для эффективного инги-
жрования структура их молекул должна удовлетворять двум
)бщим требованиям. Во-первых, необходима незамещенная суль-
фамидная группа (I, А).
Обычно модифицирование этой группы приводит к утрате инги-
эирующей способности. Правда, недавно появились сообщения о
гом, что некоторые модификации хотя и сильно снижают эффект
гнгибирования, но еще оставляют возможности для связывания
4. КОМПЛЕКСЫ КАРБОАНГИДРАЗЫ
С СУЛЬФАМИДАМИ
R
А
сульфаниламид (!)
'2
N N
NH
2
хлортиазидф
ацетазоламид(Ш)
этоксзоламадШ)
и-окси-3 -
нитро^ензолсульфамид (F)
8—2451

594
Г лава 10
с ферментом [67]. Второе требование к структуре молекулы — ш
личие объемистого ароматического или гетероциклического рад!
кала (R), присоединенного к свободной сульфамидной групп
Как видно из приведенных схем (II—V), детали строения этог
радикала могут быть самыми различными. (Подробный списс
этих соединений дан Мареном [109] и Баром [110].) Сульфамид
интересны также тем, что они оказывают фармакологический
терапевтический эффекты на различные обменные реакции орг;
низма, завершающиеся превращением карбонатов [109]. В п<
следнее время выяснилось, что сульфамиды являются очень це]
ными для исследования физико-химии и механизма действия фе]
мента. Ниже эти сведения изложены в специальных разделах.
4.1. Образование комплексов, константы диссоциации
Величины констант диссоциации, рассчитанные по кинетич»
ским данным для некоторых комплексов карбоангидразы с сул:
фамидами, изменяются от 2-10~
9
для этокезол амида до 2,6-10
для сульфаниламида и представлены в табл. 16.11. Исключ]
тельно низкие значения констант говорят о весьма высокой про
1
ности связей в этих нековалентных комплексах. Эта особенное!
была использована для разработки удобного метода определена
концентрации карбоангидразы титрованием ее растворов эток
золамидом [103, 105, 112]. Как отмечалось выше, спектральнь
изменения при связывании сульфамидов и исследования с ni
мощью
3
Н-ацетазоламида свидетельствуют о непосредственно
взаимодействии сульфамидов с ионами металла в активно
центре [20, 21], причем координация, очевидно, происходит г
счет группы —SO
2
—NH
2
[21, 111]. Это согласуется с результатам
рентгеноструктурного анализа [22, 23] кристаллического компле:
са карбоангидразы С человека с сульфамидом. Они показываю
что во внутреннюю координационную сферу цинка включена ами:
ная группа сульфамида (разд. 6). По-видимому, в связыванг
участвуют анионная группировка (—SO
2
—NH
-
) с одним прот
ном, замещенным на металл [30, 103]. В отсутствие конкуренцг
последнего величина р/С
а
для этой группировки колеблется от
до 10 (в зависимости от структуры R) [109, 115]. Некоторые
исследователями было обнаружено максимальное связываю
при рН~7. В кислых и щелочных растворах прочность взаим
действия быстро падает [86, 115, 116]. Причиной распада ком
лекса в кислой области может являться уменьшение количесп
анионной формы ингибитора.
В щелочных растворах сульфамиды, вероятно, вытесняются]
координационной сферы конкурирующими гидроксильными ион
ми. Точно так же зависит от рН и константа скорости второ]
порядка для образования комплекса фермент — сульфанилами

Карбоангидраза 595
Таблица 16.11
«Константы диссоциации» для комплексов карбоангидразы с сульфамидами
3
Соединение
Константа
диссоциации, M
Литература
ульфаниламид
2,8 ю-
6
111
4
-Ацетилсульфаниламид
5,0
ю-' 111
ихлорфенамид 2,5
IO-
8
111
цетазоламид
8,0
ю-
9
111
1,5
Ю-76
21
.етазоламид
9,0 ю-
9
111
тоюсзоламид
1,0
ю-
9
111
лоротиазид
2,2
ю-
6
111
,иклотиазид
6,0 ю-'
67
лорацетилциклотиазид 6,5
ю-
5
67
Диметиламинонафталин-1 -сульфамид
(ДНСА)
2,5
IO-
7
Q
103
'-Сульфамилфенил-2-азо-7-ацетамидо-1 -ок-
си,нафталин-3,6-дисульфонат (неопронтозил)
1,5
10-61-
30
а
Если не указано иначе, считается, что величина K
1
- равна константе диссоциации.
,
1
K
s
> определенная непосредственно по связыванию
3
Н-ацетазоламида.
B
K
S
> определенная флуоресцентным методом.
r
A
s
»
определенная спектрополяриметрическим методом.
начение которой составляет п-римерно 7-IO
4
л-моль-'-с
-1
рН 7,9, 25
0
C, измерена методом остановленной струи) [115].
Еоэтому величины рК
а
должны представлять ионизацию какево-
одного фермента, так и свободного ингибитора [115]. Однако
ри интерпретации этих данных надо соблюдать осторожность,
высокая прочность связей карбоангидразы с сульфамидами явля-
тся результатом не только координационного взаимодействия,
о и других эффектов (гидрофобных связей, энтропийных и про-
их вкладов). Поэтому любые изменения в структуре белка
следствие изменения кислотности среды могут также сказы-
;аться на величине сродства к ингибиторам.
При действии сульфамидов на карбоангидразу наблюдается
:инетика ингибирования как конкурентного, так и неконкурент-
ого типа в зависимости от времени наблюдения и порядка сме-
иивания реагентов [116—118]. Причина подобных расхождений,
:ероятно, кроется в чрезвычайно низкой скорости диссоциации
[нгибиторных комплексов, следствием чего является и малая
:корость установления равновесия с конкурирующей молекулой
убстрата [115, 117].
8*
596
Г лава 10
4.2. Спектры поглощения и круговой дихроизм
Особенно ценным оказалось использование сульфамидов в к
честве молекулярных зондов, чему способствует наличие хром
форов в молекулах сульфамидов и белка. Лучший пример белк
вого хромофора — ион Co(II). Выше уже отмечалось (рис. 16.5
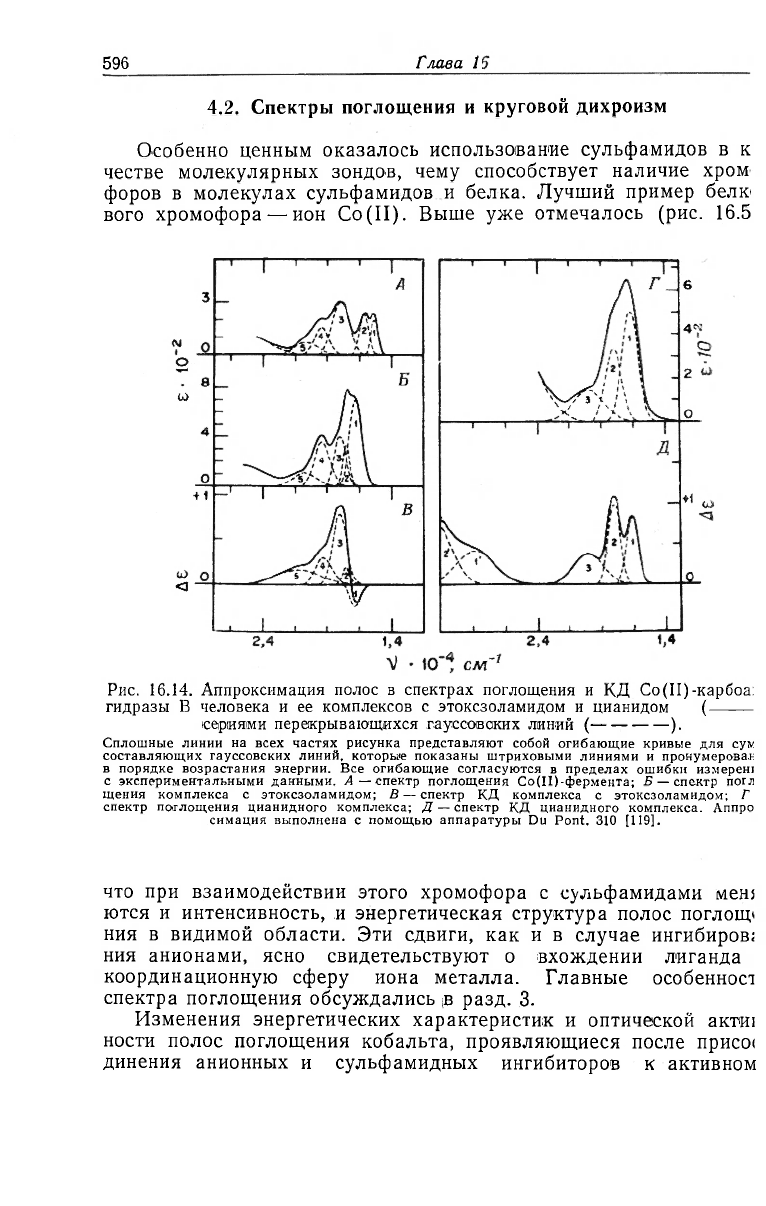
Рис. 16.14. Аппроксимация полос в спектрах поглощения и КД Co(II)-карбоа:
гидразы В человека и ее комплексов с этоксзоламидом и цианидом (
сериями перекрывающихся гауссавоких линий ( ).
Сплошные линии на всех частях рисунка представляют собой огибающие кривые для сук
составляющих гауссовских линий, которые показаны штриховыми линиями и пронумеровав
в порядке возрастания энергии. Все огибающие согласуются в пределах ошибки измерен!
с экспериментальными данными. А — спектр поглощения Со(П)-фермепта; Б — спектр погл
щения комплекса с этоксзоламидом; В — спектр КД комплекса с этоксзоламидом; Г
спектр поглощения цианидного комплекса; Д — спектр КД цианидного комплекса. Аппро
снмация выполнена с помощью аппаратуры Du Pont. 310 [119].
что при взаимодействии этого хромофора с сульфамидами меш
ются и интенсивность, и энергетическая структура полос поглощ*
ния в видимой области. Эти сдвиги, как и в случае ингибиров;
ния анионами, ясно свидетельствуют о вхождении лиганда
координационную сферу иона металла. Главные особенност
спектра поглощения обсуждались в разд. 3.
Изменения энергетических характеристик и оптической актш
ности полос поглощения кобальта, проявляющиеся после присо<
динения анионных и сульфамидных ингибиторов к активном

Карбоангидраза
597
центру карбоангидразы, являлись объектом многих исследований.
Эсновные результаты суммированы в примерах, приведенных на
рис. 16.14, где показаны спектры поглощения и КД этоксзоламид-
ных и цианидных производных Со (II)-карбоангидразы В челове-
ка. Эти спектры разложены на соответствующие гауесовские
полосы поглощения и эллиптичности для демонстрации (хотя бы
приблизительной) их тонкой структуры [119].
Из проведенного анализа становятся ясными два обстоятель-
ства. Во-первых, все спектры характеризуются расщеплением ви-
димых полос, что говорит о заметном искажении координацион-
ной геометрии даже в ингибированном ферменте. Во-вторых,
для аппроксимации спектров этокезоламидного комплекса
(рис. 16.14, Б и В) требуется такое же количество гауссовских
полос, что ,и для спектра немодифицированной Со (II)-карбоан-
гидразы (рис. 16.14,/4). Результатом введения сильного лиганда
сульфамида, по-видимому, является также смещение в коротко-
волновую область двух слабых полос. Однако общая мульти-
плетность спектра при этом не снижается. Последнее можно объ-
яснить строгими структурными условиями замещения лиганда
(см. рентгеноструктурные данные, разд. 6). Одновременно изме-
няются спектры КД в ближней ультрафиолетовой области хро-
мофоров, что особенно четко проявляется для цианидного комп-
лекса (рис. 16.14, Г). Эти полосы также легко обнаруживаются в
спектре КД немодифицированного Со(II)-фермента (рис. 16.7 и
16.8). Специфическая геометрия координации активного центра,
свойственная ей необычная серия d—d-переходов (рис. 16.14,А),
а также сродство к сульфамидам являются хорошо известными
особенностями белковой химии карбоангидразы. Такие же спек-
тральные полосы имеются и у Со (II)-производных фермента,
выделенного из акул, который, по-видимому, развивался по обо-
собленному эволюционному пути за несколько сотен миллионов
лет до наступления эры млекопитающих [42].
4.3. Взаимодействие с сульфамидами,
содержащими хромофоры
4.3.1. Оптические спектры
Введением хромофоров в молекулу сульфамида можно выз-
вать появление серии спектральных линий, соответствующих
электронным переходам в области активного центра. Многие
сульфамиды обладают хромофорными группировками, оптиче-
ские свойства которых меняются после связывания с карбоангид-
разой [30, 102, 115, 120]. Но наиболее ярко эти эффекты прояв-
ляются при взаимодействии с оксинафталиновым производным
598
Г лава
10
азосульфанил амида — 2- (4-сульфанилфенилазо)-7-ацетамидо-1
океинафталин-3,6-дисульфонатом (VI)
ОН
,N=N-/ SO
2
NH,
"O
3
S-
Для этого сульфамида характерны интенсивные полосы поглоще-
ния в видимой области около 500 нм и ряд полос в ультрафиоле-
товой области. При связывании с карбоангидразой наблюдается
+ )
I
9
§
6
6
5
U
О
га
п
3
Wl
-
'Cl
Ь
,—
Q
4J
12
(-)
/\
- у
200
300 300
I
t
OO
X, HM
J -
500
(+)
10
Л
о I
а
CX
ю 5
15
(-)
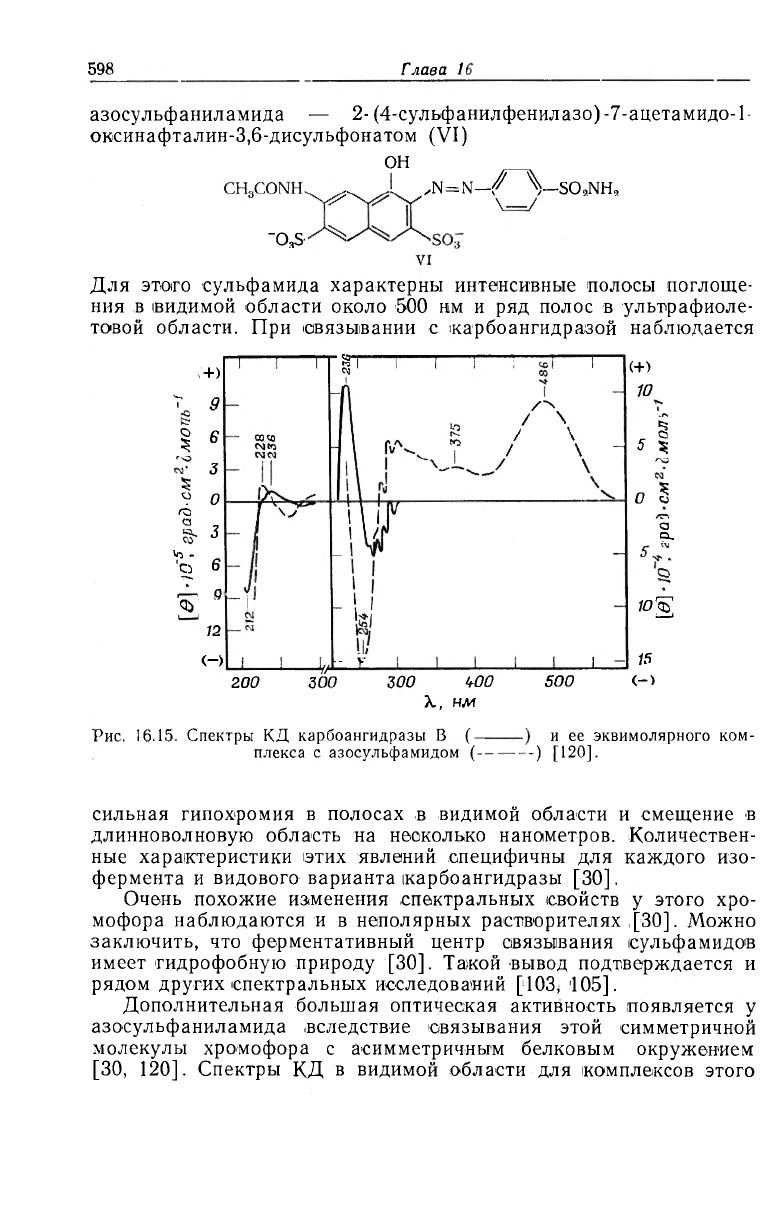
Рис. 16.15. Спектры КД карбоангидразы В (-
плекса с азосульфамидом (-
и ее эквимолярного ком-
-) [120].
сильная гипохромия в полосах в видимой области и смещение в
длинноволновую область на несколько нанометров. Количествен-
ные характеристики этих явлений специфичны для каждого изо-
фермента и видового варианта карбоангидразы [30].
Очень похожие изменения спектральных свойств у этого хро-
мофора наблюдаются и в неполярных растворителях ,[30]. Можно
заключить, что ферментативный центр связывания сульфамидов
имеет гидрофобную природу [30]. Такой вывод подтверждается и
рядом других спектральных исследований [103, 105].
Дополнительная большая оптическая активность появляется у
азосульфаниламида ,вследствие связывания этой симметричной
молекулы хромофора с асимметричным белковым окружением
[30, 120]. Спектры КД в видимой области для комплексов этого

Карбоангидраза
599
сульфамида с карбоангидразой В обезьяны приведены на
рис. 16.15, где для сравнения также показан спектр нативного
фермента [120]. Наряду с большими полосами эллиптичности в
видимой области имеются дополнительные интенсивные полосы
эллиптичности в ультрафиолетовой области, которые полностью
затемняют КД-сиектр нативного белка. Сила вращения некото-
рых этих полос (Rh~2-IO
-38
ед. CGS) по своей величине больше
соответствует собственно несимметричным хромофорам, чем сим-
метричным, оптическая активность которых возбуждена асиммет-
ричным окружением [121]. Следовательно, структуре белка свой-
ственно особенно эффективное асимметрическое потенциальное
поле [30].
У разных типов карбоангидразы величина и знак полос эллип-
тичности для комплексов с этим сульфамидом сильно различа-
ются [30]. Очевидно, это является следствием различной молеку-
лярной структуры областей, окружающих активный центр.
К такому же заключению приводят и результаты, полученные ме-
тодом ЯМР с
35
Cl :[122, 123] и комплексометрическим титрова-
нием [86]. Подобные структурные расхождения могут служить
причиной неодинаковой удельной активности у изоферментов и
видовых вариантов !карбоангидразы [77].
4.3.2. Флуоресценция
Карбоангидраза быка образует сильно флуоресцирующий ком-
плекс с 5-диметиламинонафталин-1-сульфамидом (ДНСА) [103].
Исследуя усиление флуоресценции лиганда и тушение ультрафио-
летовой белковой флуоресценции, Чен и Кернохан [103] показа-
ли, что с одной молекулой фермента связывается одна молекула
флуоресцирующего сульфамида. Константа диссоциации этого
комплекса равна 2,5-Ю
-7
М. Флуоресценция свободного сульфа-
мида имеет пик испускания при 580 нм и квантовый выход 0,055.
Соответствующие значения для связанного ингибитора — 468 нм
и 0,84. Большое смещение максимума испускания в коротковол-
новую область можно объяснить сильной гидрофобной природой
центра связывания, а также отрывом одного протона от сульфа-
мидной группы лиганда при присоединении к ферменту [103].
Расчеты эффективности переноса энергии привели к неожидан-
ным результатам: 85% фотонов, поглощенных семью остатками
триптофана, переносятся к единственной связанной молекуле
ДНСА. Такая эффективность намного больше когда-либо ранее
наблюдавшейся у белков, содержащих только одну 5-диметила-
минонафталин-1-сульфанильную группировку. Хотя диаметр гло-
булы равен 51 А, связанная молекула ДНСА, очевидно, удалена
от каждого из семи остатков триптофана не больше, чем на кри-
тическое расстояние переноса, составляющее для триптофана

600 Г лава
10
.21,3 А. Согласно этим данным, остатки триптофана и центр свя
зывания сульфамида находятся в глубине молекулы. Рентгено
структурный анализ (разд. 6), выполненный, правда, на друго»
видовом варианте (карбоангидраза С человека), привел к таком;
же заключению. Тем самым доказывается аналогичность струн
тур этих двух форм фермента.
4.3.3. Фосфоресценция
Гэлли и Страйер [124] использовали явление фосфоресценции
возникающей при триплет-триплетном переносе энергии, дл:
изучения взаимодействия еще одного связанного сульфамида
остатками триптофана в белке. Между синглетными состояниям]
хромофоров перенос электронной энергии возбуждения возможе)
на расстояния порядка 30 А, тогда как триплет-триплетны]
перенос энергии требует значительно меньших расстояний -
около 12 А. Если синглетное состояние триплетного акцептор,
обладает большей энергией, чем еинглетное состояние триплетно
го донора, последний может возбуждаться светом с длиной вол
ны, не поглощаемым триплетным акцептором. В этих условия
фосфоресценция триплетного акцептора наблюдается только пр:
триплет-триплетном переносе энергии. Гэлли и Страйер [124
обнаружили подобные явления у !комплекса карбоангидразы бык,
с ж-ацетилбензолсульфамидом (МАБС). Фосфоресценция трипто
фана карбоангидразы вызывается юветом с Я=280 нм. Фосфорес
ценция сульфамида возбуждается светом ic длиной волны 330 нм
которая ие вызывает свечения фермента. Однако в комплексе
фосфоресцирующем при воздействии >.=330 нм, свечение, вере
ятно, обусловлено скорее триптофаном, чем МАБС [124]. Следо
вательно, остатки триптофана расположены очень близко о
центра связывания, образуя, видимо, поверхность его полости.
5. ЯДЕРНЫЙ МАГНИТНЫЙ РЕЗОНАНС
И ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС
До недавнего времени методы магнитного резонанса не ис
пользовались для исследования карбоангидразы. Однако тепер
методы протонного магнитного резонанса и электронного спинс
вого резонанса применяются и для этого фермента благодаря хи
мическим особенностям его активного центра, содержащего ио
металла. Используя хорошо известный эффект увеличения скорс
ста релаксации протонов воды, индуцированный парамагнитным
ионами металлов, Фабри и сотр. [125] доказали присутствие ко
ординированных H
2
O или OH
-
в первой координационной сфер
Co(II) в активном центре карбоангидразы. Парамагнитный ио
Карбоангидраза
601
[еталла имеет -магнитный момент, в несколько тысяч раз боль-
шй, чем другие ядра. Поэтому беспорядочное движение таких
онов оказывает гораздо больший эффект на релаксирующие
оседние протоны растворителя, особенно если парамагнитный
;ентр включен в макромолекулу с относительно слабым тепловым.
и
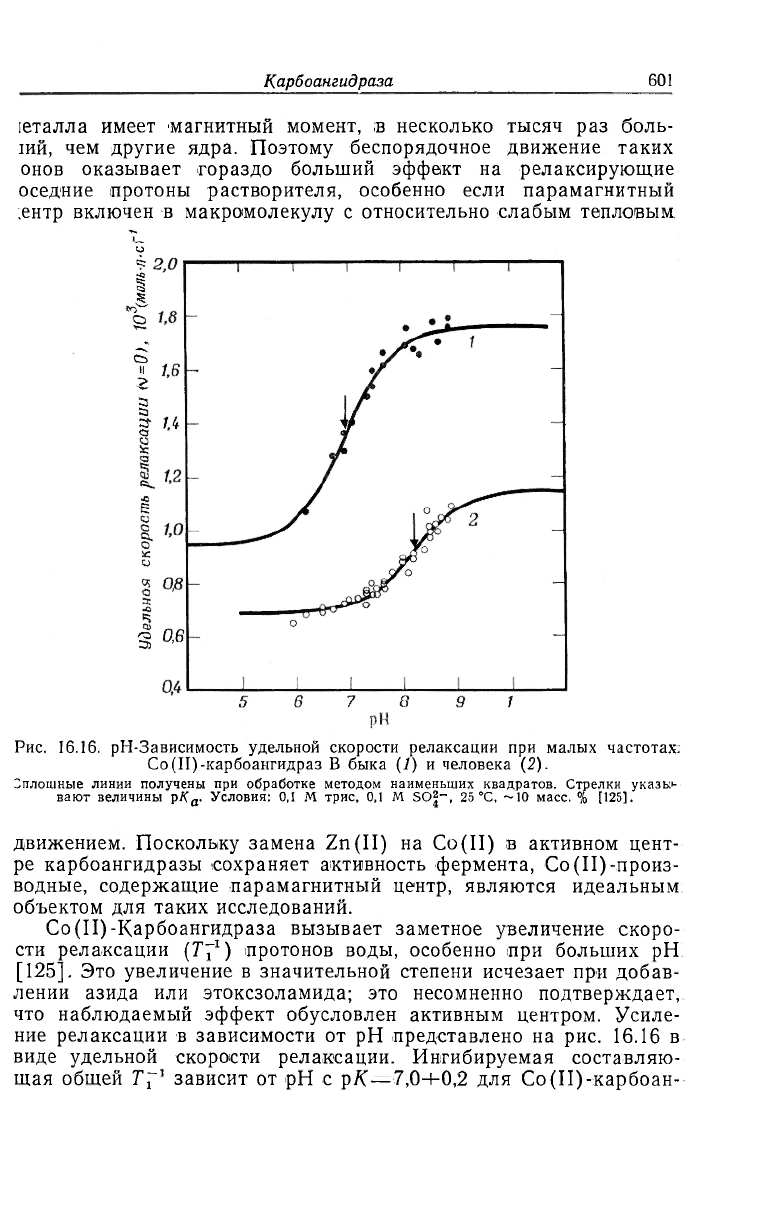
Рис. 16.16. рН-Зависимость удельной скорости релаксации при малых частотах:
Со(П)-карбоангидраз В быка (1) и человека (2).
Сплошные линии получены при обработке методом наименьших квадратов. Стрелки указь;|-
вают величины рK
a
- Условия: 0,1 M трис, 0,1 M SO|~, 25 °С, —10 масс. % [125].
движением. Поскольку замена Zn(II) на Co(II) в активном цент-
ре карбоангидразы сохраняет активность фермента, Со(II)-произ-
водные, содержащие парамагнитный центр, являются идеальным
объектом для таких исследований.
Со(II)-Карбоангидраза вызывает заметное увеличение скоро-
сти релаксации (Г7
1
) протонов воды, особенно при больших рН
[125]. Это увеличение в значительной степени исчезает при добав-
лении азида или этоксзоламида; это несомненно подтверждает,
что наблюдаемый эффект обусловлен активным центром. Усиле-
ние релаксации в зависимости от рН представлено на рис. 16.16 в
виде удельной скорости релаксации. Ингибируемая составляю-
щая общей Tf
1
зависит от рН с рК—7,0+0,2 для Со(П)-карбоан-

602
Г лава 10
гидразы быка и с р/( = 8,2±0,2 для Со (II)-карбоангидразы В чело
века. Из зависимости величины ингибируемой ,компоненты обще!
скорости релаксации от напряженности магнитного поля рассчи
таны значения времен корреляции для дипольного взаимодейст
вия протона с электронным моментом кобальта (Ю
-11
с), расстоя
ния между протоном и кобальтом (2,2—2,5 А) и времена пребы
вания протона х
м
(Ю
-5
с) [125]. Лучше всего эти данные можне
объяснить тем, что протон, определяющий ингибируемую част!
1
/T
u
находится либо в гидроксильном ионе, связанном с Co(II)
в активном центре, либо в молекуле воды, которая одним ато
мом водорода связана с соседним остатком. Характерно, что зна
чения рK
a
, описывающие изменения увеличения скорости релак
сации, очень похожи на величины, полученные для координиро-
ванной молекулы воды при комплексометрическом титрованш
(разд. 7) —8,1 для карбоангидразы В человека и 7,4 для изофер
мента быка [86].
Трудно объяснимой особенностью этого явления остается отно-
сительно слабое усиление релаксации при низких значениях рН
где координированной частицей, скорее всего, является молекула
H
2
O. Можно предположить, что в кислой области затруднен (или
происходит по измененному механизму) обмен с протонами воды
из раствора [125]. Напомним, что титрование при рН от 9 дс
6 сопровождается явным изменением геометрии координации
(разд. 3.3). Однако пока не установлена четкая взаимозависи-
мость между возможными изменениями строения координацион-
ной сферы и уменьшением усиления релаксации.
Несколько отличным методом для изучения тех же особенно-
стей активного центра воспользовался Уард [422, 123]. В качест-
ве ЯМР-зонда в этих работах применялся
35
Cl, ядро которогс
имеет спин
3
/
2
и электрический квадрупольный момент Q. Для
сред, в которых ядра хлора находятся в условиях градиента на-
пряженности электрического поля, ширина линии для резонанса
35
Cl определяется уравнением
2л
Av =-g- (A/Q)
3
T
где Av — полная ширина при половинной амплитуде; q— градиент
напряженности электрического поля у ядра; т — время корреля-
ции, описывающее неупорядоченные молекулярные движения,
ответственные за изменения во времени градиента q [422]. Со-
гласно этому соотношению, связывание
35
Cl с Zn(II) приводит к
ускорению релаксации ядра и уширению линии (рис. 16.17).
Zn(II)-Карбоангидраза тоже вызывает это уширение, а апофер-
мент нет (рис. 16.17). Это свидетельствует о том, что хлорид мо-
жет занимать одно координационное место у иона Zn(II) в актив-
ном центре. Уширение линии устраняется цианидом, что также
