Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Карбоангидраза
Рис. 16.1. Кристаллы карбоангидразы из эритроцитов приматов и ее сульфамид-
ных комплексов.
а — карбоангидраза С обезьяны; б — комплекс карбоангидразы В обезьяны с азосульфами-
дом; в — карбоангидраза В обезьяны; г — комплекс карбоангидразы B человека с ацетазол-
амидом.
36
;
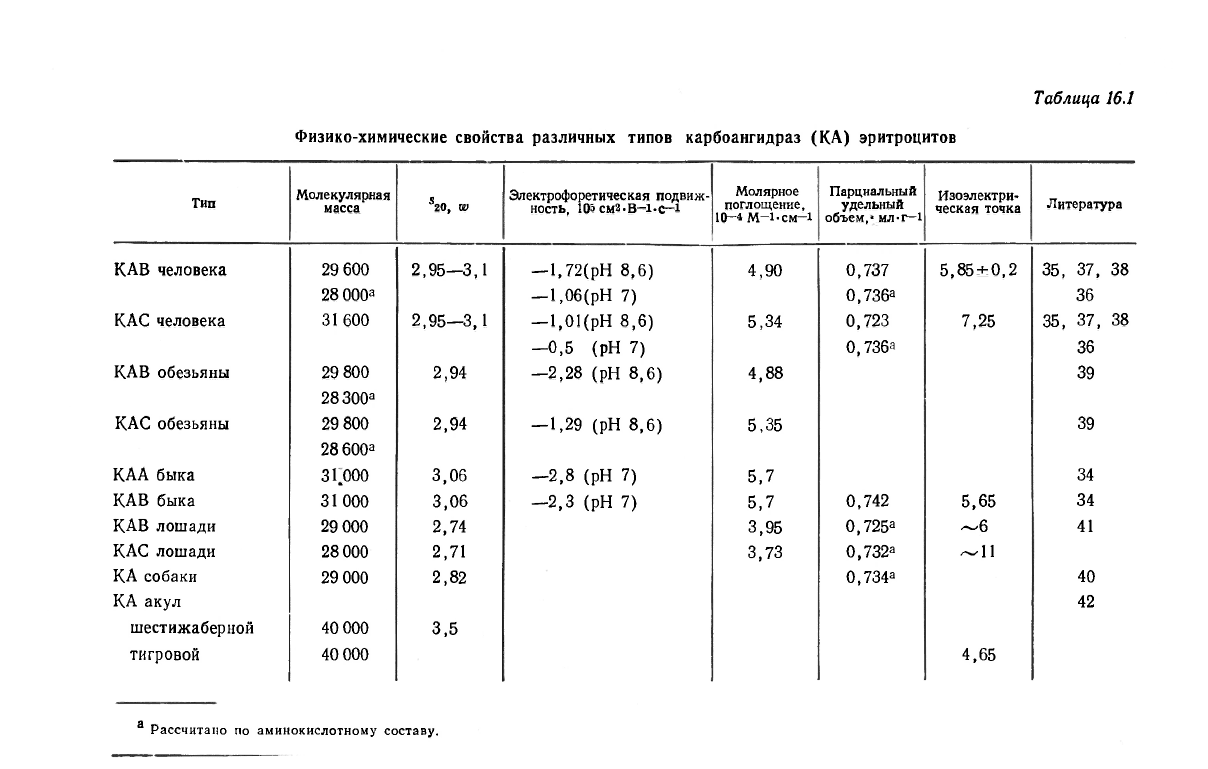
Таблица 16.1
Физико-химические свойства различных типов карбоангидраз (KA) эритроцитов
Тип
Молекулярная
масса
S
20, W
Электрофоретическая подвиж-
ность, 105 см2. B-I-C-I
Молярное
поглощение,
10-4 М-1-CM-I
Парциальный
удельный
объем,' мл-г-1
Изоэлектри-
ческая точка
Литература
KAB человека
29 600
2,95—3,1 -1,72(рН 8,6)
4,90
0,737
5,85 + 0,2
35, 37, 38
28 OOO
a
—1,06(рН 7) 0,736
а
36
KAC человека
31 600
2,95—3,1 —1,01(рН 8,6)
5,34
0,723
7,25
35, 37, 38
—0,5 (рН 7)
0,736
а
36
KAB обезьяны
29 800
2,94 —2,28 (рН 8,6)
4,88 39
28 300
а
KAC обезьяны
29 800 2,94
—1,29 (рН 8,6)
5,35
39
28 600
а
KAA быка
31.000 3,06
-2,8 (рН 7)
5,7
34
KAB быка
31 000
3,06
-2,3 (рН 7)
5,7
0,742
5,65
34
KAB лошади
29 000 2,74
3,95
0,725
а
г**/Q
41
KAC лошади
28 000
2,71 3,73
0,732
а
~п
KA собаки
29 000 2,82
0,734
а
40
KA акул
42
шестижаберной
40 000
3,5
тигровой
40 000 4,65
а
Рассчитано по аминокислотному составу.

Карбоангидраза
565
ся в форме сульфамидных комплексов [22, 30]. Все эти типы кар-
боангидразы являются мономерными формами с молекулярной
массой около 30 000, содержащими в молекуле 1 г-атом Zn(II)
[34—41]. Некоторые физико-химические свойства этих ферментов
приведены в табл. 16.1.
2.1. Аминокислотный состав
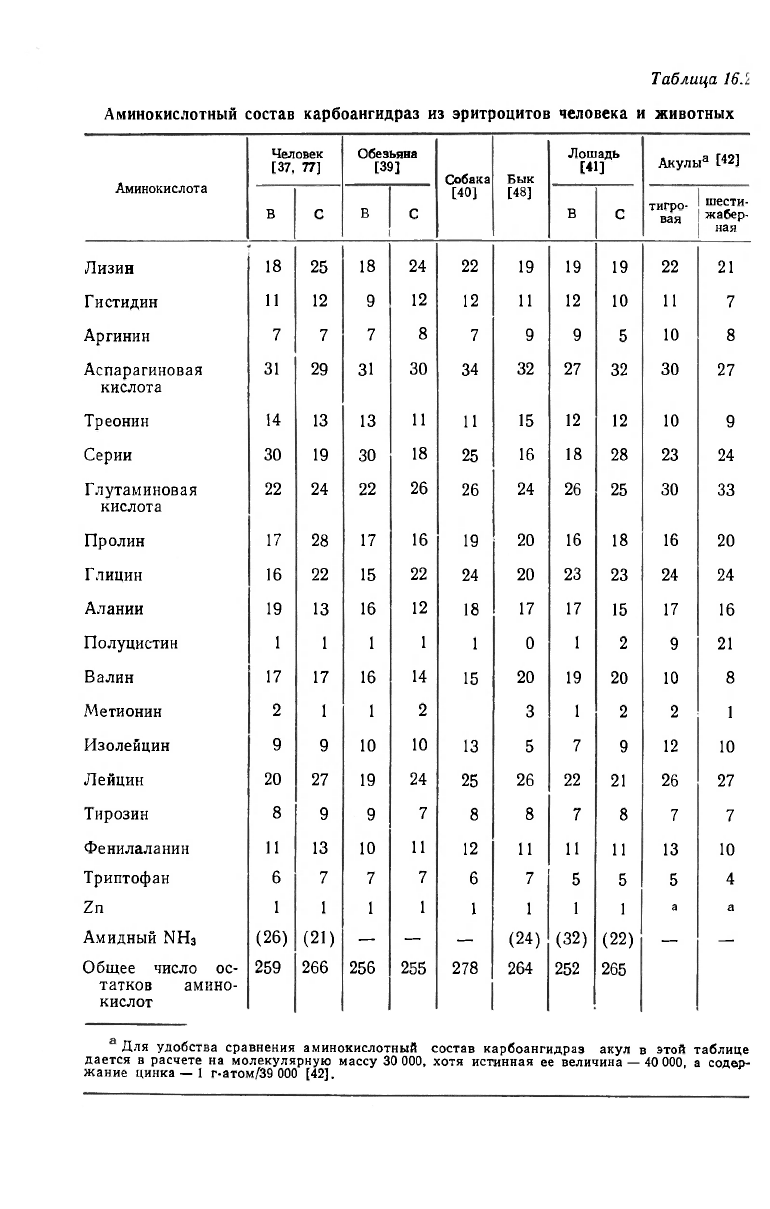
Аминокислотный состав карбоангидраз эритроцитов представ-
лен в табл. 16.2. Характерно наличие только одного остатка цис-
теина у большинства изоферментов и отсутствие этой аминокис-
лоты в ферменте быка. Имеется один или два остатка метионина
(см. ниже о расщеплении бромцианом) и небольшое число остат-
ков тирозина и триптофана. С эволюционной точки зрения самой
старой является карбоангидраза из эритроцитов акул. Фермент
шестижаберной акулы имеет, вероятно, самую низкую для своей
группы изоэлектрическую точку, равную 4,7, что согласуется с от-
носительно высоким содержанием аопарагиновой и глутаминовой
кислот (табл. 16.2). Единственный остаток цистеина карбоангидра-
зы С человека, по-видимому, не участвует непосредственно в ка-
тализе. По данным рентгеноструктурного анализа, он расположен
на расстоянии примерно 14 А от иона цинка [22, 23].
При выделении карбоангидразы из эритроцитов млекопитаю-
щих стало очевидным, что у каждого биологического вида можно
обнаружить несколько электрофоретически различных белков
с карбоангидразной активностью [34—40, 46]. У быка это фермен-
ты А и В [34], у человека — карбоангидразы В и С [35—38].
Наиболее существенные отличия физико-химических свойств таких
изоферментов определяются различием их аминокислотного соста-
ва (табл. 16.2) и последовательности аминокислот. А это в свою
очередь проявляется в функциональных и структурных особенно-
стях (см. ниже). Например, для изоферментов человека наблюда-
ется значительная разница в уровне активности. При гидратации
CO
2
карбоангидраза В проявляет удельную активность около
40 000 ед./мг белка, а тип С — примерно 1200 000 ед./мг белка
[47] (подробнее см. разд. 7). С физиологической точки зрения ин-
тересно, что содержание этих изоферментов в организме неодина-
ково— количество высокоактивной карбоангидразы С в 5—10 раз
меньше, чем фермента типа В. Результатом этого является при-
мерно равное распределение суммарной карбоангидразной актив-
ности между двумя изоферментами.
Наличие в эритроцитах двух изоферментов карбоангидразы с
различной первичной структурой является, по-видимому, отличи-
тельной особенностью приматов. Различные белковые фракции с
карбоангидразной активностью, выделяемые из гемолизатов низ-
ших видов млекопитающих, имеют одинаковый аминокислотный
Таблица
16.1
Аминокислотный состав карбоангидраз из эритроцитов человека и животных
Аминокислота
Человек
[37, 77]
Обезьяна
[39]
Собака Бык
Лошадь
[41]
Акулы
3
112]
Аминокислота
В
с
B
С
[40]
[48]
В
С
тигро-
вая
шести-
жабер-
ная
Лизин
18
25
18
24
22
19 19
19
22
21
Гистидин
11 12
9
12
12 11 12
10 11
7
Аргинин
7
7
7
8
7 9 9
5
10
8
Аспарагиновая
кислота
31
29
31
30
34 32 27
32 30 27
Треонин
14
13
13
11
11
15
12
12 10
9
Серии 30
19 30
18
25
16
18
28
23 24
Глутаминовая
кислота
22 24 22
26
26
24
26
25
30
33
Пролин
17
28
17
16
19
20
16 18 16
20
Глицин 16
22
15
22
24
20 23
23
24 24
Алании 19
13
16
12
18
17 17
15
17
16
Полуцистин 1
1 1
1
1
0 1 2
9
21
Валин
17
17 16
14
15
20
19 20 10
8
Метионин
2
1 1
2
3
1
2
2 1
Изолейцин
9
9 10
10
13 5
7
9
12
10
Лейцин
20 27
19
24
25
26
22
21 26 27
Тирозин
8
9
9
7
8
8
7
8 7
7
Фенилаланин
11
13 10
11
12
11 11
11 13 10
Триптофан 6 7
7
7
6
7
5
5 5
4
Zn 1
1
1
1
1
1
1
1
а
а
Амидный NH3 (26) (21)
—
—
—
(24)
(32)
(22)
— —
Общее число ос-
татков амино-
кислот
259
266
256
255
278 264
252
265
Для удобства сравнения аминокислотный состав карбоангидраз акул в этой таблице
дается в расчете на молекулярную массу 30 ООО, хотя истинная ее величина — 40 ООО, а содер-
жание цинка — 1 г-атом/39 ООО [42].

Карбоангидраза
567
состав и удельную активность [34, 40, 48]. (Единственное исключе-
ние— фермент лошади [41]). Эти «изоферменты» представляют
собой слабо различающиеся конформации одного и того же белка.
Отличия в заряде у таких макромолекул могут быть следствием
различного распределения водородных связей между остатками
аминокислот. Индивидуальные изоферменты приматов могут на-
блюдаться в виде отдельных полос при электрофорезе в геле [39,
49].
Среди приматов детально изучена также карбоангидраза эрит-
роцитов макак-резус, которая состоит из двух изоферментов — В и
С, почти идентичных изоферментам человека (табл. 16.1 и 16.2).
Подобные результаты получены и при исследовании гемолизатов
некоторых других приматов [46]. Известны также мутанты [46,
49].
2.2. Карбоангидразы растений
Вследствие простоты выделения и большого физиологического
значения карбоангидразы эритроцитов животных привлекали вни-
мание исследователей. Однако после появления первых сообщений
о том, что растительные карбоангидразы не содержат цинка [51]
и не ингибируются сульфамидами [51], возрос интерес и к этим
ферментам. Опубликованы результаты исследований высокоочи-
щенных растительных карбоангидраз.
Таблица 16.3
Физико-химические свойства растительных карбоангидраз
Источник
S
20, W
Молекулярная масса
Содержание цинка
Литература
Шпинат
6,8
140 000
145 000 (равновес-
ное центрифуги-
рование)
0,0013 мкг/мг
52
Петрушка
8,8
170 000
180 000 (равновес-
ное центрифуги-
рование)
1 г-атом/29 000 г
белка
53, 54
Neisseria sica 28 000
1 г-атом/30 000 г
белка
56
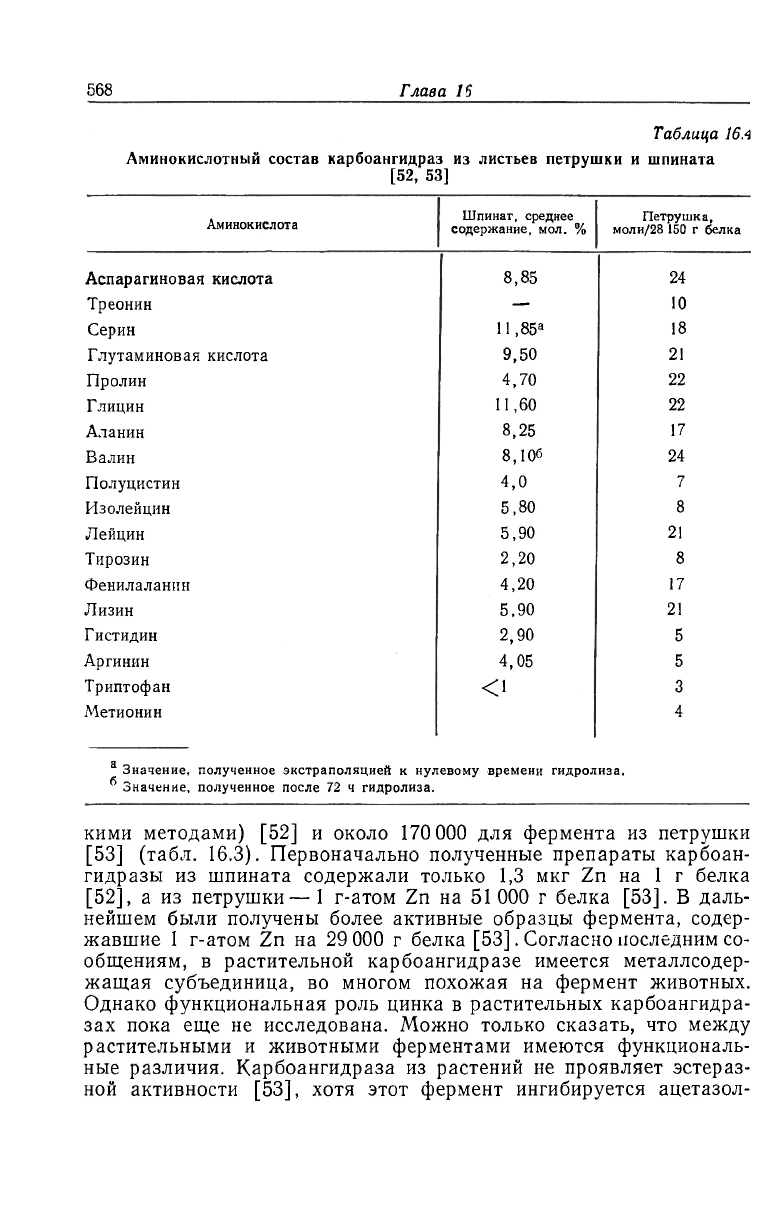
Физико-химические свойства ферментов из листьев шпината
[52] и петрушки [53, 54] суммированы в табл. 16.3. Их аминокис-
лотный состав приведен в табл. 16.4 Наиболее заметная особен-
ность этих ферментов — большая кажущаяся молекулярная мас-
са— около 140 000 для фермента из шпината (определена несколь-
568
Г лава
10
Таблица 16А
Аминокислотный состав карбоангидраз из листьев петрушки и шпината
[52, 53]
Аминокислота
Шпинат, среднее
содержание, мол. %
Петрушка,
моли/28 150 г белка
Аспарагиновая кислота
8,85
24
Треонин —
10
Серии
11,85
3
18
Глутаминовая кислота
9,50
21
Пролин
4,70
22
Глицин
11,60 22
Алании
8,25
17
Валин
8,106
24
Полуцистин
4,0 7
Изолейцин
5,80
8
Лейцин
5,90
21
Тирозин
2,20
8
Фенилаланин
4,20
17
Лизин
5,90
21
Гистидин
2,90
5
Аргиннн
4,05
5
Триптофан
<1
3
Метионин
4
а
Значение, полученное экстраполяцией к нулевому времени гидролиза.
® Значение, полученное после 72 ч гидролиза.
кими методами) [52] и около 170 000 для фермента из петрушки
[53] (табл. 16.3). Первоначально полученные препараты карбоан-
гидразы из шпината содержали только 1,3 мкг Zn на 1 г белка
[52], а из петрушки— 1 г-атом Zn на 51 ООО г белка [53]. В даль-
нейшем были получены более активные образцы фермента, содер-
жавшие 1 г-атом Zn на 29 000 г белка [53]. Согласно последним со-
общениям, в растительной карбоангидразе имеется металлсодер-
жащая субъединица, во многом похожая на фермент животных.
Однако функциональная роль цинка в растительных карбоангидра-
зах пока еще не исследована. Можно только сказать, что между
растительными и животными ферментами имеются функциональ-
ные различия. Карбоангидраза из растений не проявляет эстераз-
ной активности [53], хотя этот фермент ингибируется ацетазол-

Глава 16
569
амидом и азидом [53]. Интересно, что в некоторых случаях при
эпределении молекулярной массы карбоангидразы акулы также
получены значения больше 100 000 [42]. Необходимо отметить, что
это единственная карбоангидраза животного происхождения, кото-
эая содержит значительное количество цистеина (табл. 16.2).
2.3. Прочие карбоангидразы
Проведена частичная очистка карбоангидразы на куколок ба-
бочки Heleothis zea [55]. При гель-фильтрации на сефадексе G-100
получены активные фракции, отвечающие молекулярной массе
80 000—90 000. Однако эти препараты могли содержать комплексы
фермента с посторонним клеточным материалом [55]. По некото-
рым свойствам (ингибирование азидом и ацетазоламидом, Ki=
= 0,03 мкМ) этот фермент имеет сходство с карбоангидразой эрит-
роцитов. Наймен и сотр. [56] получили гомогенный препарат бак-
териальной (из Neisseria sica) карбоангидразы с молекулярной
массой 28 000. Фермент содержит на каждую субъедини-
цу молекулярной массы ~ 30 000 один атом цинка. Количество
триптофана и тирозина значительно меньше, чем у ферментов эри-
троцитов млекопитающих, но в остальном их свойства одинаковы
[56].
2.4. Последовательность аминокислот
Ведутся активные исследования первичной структуры изофер-
ментов карбоангидразы бы:р и карбоангидраз В и С человека [49,
57—61]. Опубликованы предварительные результаты этой работы
[49, 60, 61], однако к настоящему времени определены последова-
тельности аминокислот только для некоторых фрагментов поли-
пептидной цепи. Они представлены в конце данного раздела.
Относительно ограниченные исследования N- и С-концевых
фрагментов макромолекулы тем не менее привели к довольно ин-
тересным результатам. Риккли [37] и Маррик [62] и их сотруд-
ники показали, что все формы карбоангидразы человека не содер-
жат свободной аминогруппы на N-конце полипептидной цепи. Ни
при каких условиях с этими изоферментами не удалось получить
положительной реакции с динитрофторбензолом [49]. Лоран с
сотр. [63], анализируя обе формы (В и С) по методу Филлипса
[64], обнаружил только по одной N-ацетильной группе на 1 моль
каждого изофермента.
Лоран и Дерриан [49] после обработки белка гидразином в
течение 17 ч при 100°С смогли выделить примерно 1 моль
ДНФ-ацетилгидразида. Эти результаты свидетельствуют о том,
что у большинства (если не у всех) форм карбоангидразы N-KOH-
цевая аминокислота ацетилирована. В дальнейшем тем же авто-

570
Г лава
10
Таблица
N-Концевые аминокислоты, изолированные из карбоангидраз человека
и быка [49]
1 2 3 4 5 6
KAA человека
N-auemn-Ala-Ser-Pro-Asp-Trp-Gly-Tyr- Asp-Asp-Lys
I
.. . Lys-Ser-Trp-Glu-Pro-Qln-Gly-Asn
KAB человека
N-anemn-Ala-Ser-Pro-Asp-Trp-Gly .. .
KAC человека М-ацетил-Ser . . .
KAB быка
И-ацетил-Бег .. .
рам удалось изолировать N-ацетилированные пептиды [49]
(табл. 16.5). На N-концах карбоангидразы С (KAC) человека и В
(KAB) быка оказалось возможным идентифицировать только одну
аминокислоту (N-ацетилсерин), так как от этих форм отщепление
большего пептидного фрагмента осуществляется труднее, чем от
изофермента В [49]. Карбоангидраза А —электрофоретически от-
деляемый изофермент эритроцитов человека, по активности и ами-
нокислотному составу идентичный форме В [35, 38]. Это сходство
дополняется одинаковой последовательностью N-концевых амино-
кислот (табл. 16.5).
Определение С-концевой структуры молекулы основано на спо-
собности бромциана отщеплять от С-конца изоферментов карбоан-
гидразы быка и человека пептиды, содержащие 19 или 20 остатков
аминокислот [57—59]. Строение этих пептидов показано в
табл. 16.6. При нумерации остатков предполагается, что 21-й ами-
нокислотой во всех случаях является метионин. Это позволяет во
всех трех последовательностях выделить наибольшее число гомо-
логичных участков (отмеченных рамками в табл. 16.6). Карбоан-
гидраза В человека при этом оказывается короче на одну С-конце-
вую аминокислоту (лизин). Наблюдается также большое структур-
ное сходство карбоангидразы С человека с изоферментами низших
видов млекопитающих. Последнее согласуется с результатами фи-
зико-химических и кинетических исследований (разд. 2.3).
При третьем способе определения первичной структуры анали-
зировался пептидный фрагмент, содержащий остаток гистидина,
способный реагировать с иодацетатом в активном центре карбо-
ангидразы В человека (подробнее об этой реакции см. в разд. 7).
После взаимодействия фермента с иодацетатом получается единст-
венный карбоксиметилированный остаток гистидина, входящий в
пентапептид ТЬг-З-карбоксиметил-His-Pro-Pro-Leu, выделенный
Брэдбери [65, 66]. Андерссон и сотр. [58] определили, что амино-
кислоты этого фрагмента занимают места 59—64, считая от
С-конца.
С другой стороны, показано, что остаток гистидина реагирует
с N-хлорацетилхлортиазидом, когда последний замещает сульф-

Карбоангидраза
571
Таблица 16.6
С-Концевые аминокислотные последовательности карбоангидраз человека
и быка
21 20 19 18 1? 16 15
В человека Met-Glx-HisjAsn'-AsnjArg-Pro
человека Met-Val-Asp
Asn-TrpjArg-Pro
IB быка
Me t - Leu - Ala 1 Asn'-Trp - Arg - Pro
14 13 12 ]1 10 9 8 7 6 5 4 3 2 i
Thr-Gln-Pro-Leu-Lys^Gly-Arg
j
Thr-Val-Arg-Ala-Ser-Phe-
-Asn Arg
Ala
Gln-Ile-Lys-Ala-Ser-Phe-Lys
Gln-Pro-Leu-Lys
l
-
Gln-Pro-Leu-Lysj-AsnjArgjGln-Val-Arg-Gly-Phe-Pro-Lys
амид, связанный с активным центром [60, 67]. При кислотном гид-
ролизе хлортиазид отщепляется и образуется карбоксиметилгисти-
дин. Этот гистидин отличается от упоминавшегося выше остатка
модифицируемого иод- или бромацетатом [60, 68]. Гистидин, взаи-
модействующий с сульфамидами, в первичной структуре карбоан-
гидразы В человека занимает место в области от 65-й до 76-й ами-
нокислоты (считая от N-конца).
Хотя полностью первичная структура не определена ни для од-
ной формы карбоангидразы, продолжаются интенсивные исследо-
вания фрагментов, получаемых при гидролизе трипсином [60, 61].
Результатом всех этих работ является картина частичной последо-
вательности аминокислот двух изоферментов человека, представ-
ленная в табл. 16.7.
2.5. Кислотно-основные свойства
Методами потенциометрического и спектрофотометрического
титрования обеих форм карбоангидразы человека [69, 70] и изо-
фермента В быка [71] были получены детальные кривые титрова-
ния в области ионизации гидроксильной группы тирозина. При кис-
лотном титровании карбоангидразы В человека наблюдается ска-
чок при рН 4,0—4,2, соответствующий поглощению 7 протонов на
1 моль [69]. Эти семь групп, по-видимому, являются скрытыми в
глубине молекулы остатками гистидина. Четыре остальных гисти-
дина в нативном белке титруются нормально. При обратном тит-
ровании щелочью от рН<2 число групп, титруемых при рН 5—8,
возрастает до 11. По-видимому, скрытые в глубине нативной струк-
туры остатки гистидина освобождаются при кислотной денатура-
ции [69].
При спектрофотометрическом титровании карбоангидразы В
человека обнаружены три типа тирозильных групп [69]. При рН<
<11,5 теплоты и энтропии ионизации первых четырех остатков
тирозина имеют нормальные значения, однако одна или две из
этих групп характеризуются повышенной величиной рК
а
[69].

572
Г лава
10
Ионизация оставшихся трех или четырех тирозинов протекает
очень медленно и в более щелочной области. При этом наблюдает-
ся одновременное медленное снижение ферментативной активнос-
ти [69].
Главное отличие кислотно-основных свойств изофермента С от
описанной выше формы В заключается в положении изоэлектриче-
ской точки (при рН 7,3 и 5,8 соответственно) [70]. Оба изофермен-
та имеют похожие кривые титрования (скачок при рН 4; 7 скры-
тых остатков гистидина [70]). Три тирозильных остатка титруются
нормально, остальные шесть находятся в глубине молекулы. Мед-
ленная ионизация последних сопровождается необратимыми изме-
нениями конформации. Форма С, по-видимому, более чувствитель-
на к щелочной денатурации, чем форма В [70].
Карбоангидраза В быка имеет изоэлектрическую точку при
рН 5,65 [71]. При титровании этого фермента кислотой также об-
наруживаются 7 остатков гистидина, протонирование которых про-
исходит в узком интервале около рН 4 и сопровождается значи-
тельной перестройкой конформации. При обратном титровании все
11 гистидинов титруются нормально [71]. Только один тирозин
титруется свободно с повышенным значением рK
a
(10,8). Осталь-
ные семь медленно ионизируются только при рН>12— и тоже с
потерей ферментативной активности [71]. Таким образом, во всех
исследованных до сих пор препаратах карбоангидразы из эритро-
цитов млекопитающих обнаружены остатки гистидина и тирозина,
заключенные в глубине молекулы. Тем самым подтверждается
предположение о существовании гистидил-тирозильных взаимодей-
ствий (возможно, водородных связей), являющихся характерной
структурной особенностью карбоангидразы [69—71]. Во всяком
случае, наличие внутри глобулы фенольных гидроксидов и имида-
зольных групп представляется существенным для каталитических
свойств этого фермента.
2.6. Спектры поглощения и оптическая активность
Спектры поглощения в ближней ультрафиолетовой области у
всех разновидностей карбоангидразы эритроцитов имеют вид, ти-
пичный для белков. При 280 нм наблюдается максимум и четко
выраженное плечо при 290 нм. Величины молярного поглощения
при 280 нм для некоторых изоферментов приведены в табл. 16.1.
Риккли и сотр. [37] исследовали абсорбционные спектры кар-
боангидразы человека в области 185—230 нм. Полученные резуль-
таты свидетельствуют о том, что структура макромолекулы, по-
видимому, не содержит (или содержит очень мало) а-спиральных
участков, так как наличие последних обычно проявляется в виде
значительной гипохромии, не характерной для изученных образцов
