Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

Карбоксипептидаза А и другие пептидазы
543
Таблица 15.5
Термодинамические и кинетические константы для различных
металлокарбоксипептидаз [41, 76, 89]
Ион металла
IgK
a
Субстрат
Ион металла
IgK
a
БГГФ
БГФ КГФ
ГФЛ
Ион металла
IgK
a
K
6
k
6
кат
к
м
и
кат
К
М
Ь
кат
К
М
ь
кат
Zn 10,5 8,0
1,2
8,1
5,6
19,5 5,5 0,76
28,6
Ni
8,2
7,4
1,1
2,1
27,6
Со
7,0 6,0
5,9
4,8
7,4
11,7
12,3
0,98 37,7
Mn
5,6
2,9 0,23
1,1
0,45
22,9
2,3
3,2
56,8
Cd
10,8
5,5
61,5
Hg
21,0
Cu 10,6
Неактивна со всеми субстратами
а
Константы устойчивости комплекса с металлом с поправкой на влияние 1 M Cl- и
0,05 M трис-буфера (рН 8).
® Величины Kp^ даны в 10* М, а Л
кат
—в IO-
3
мин-
1
.
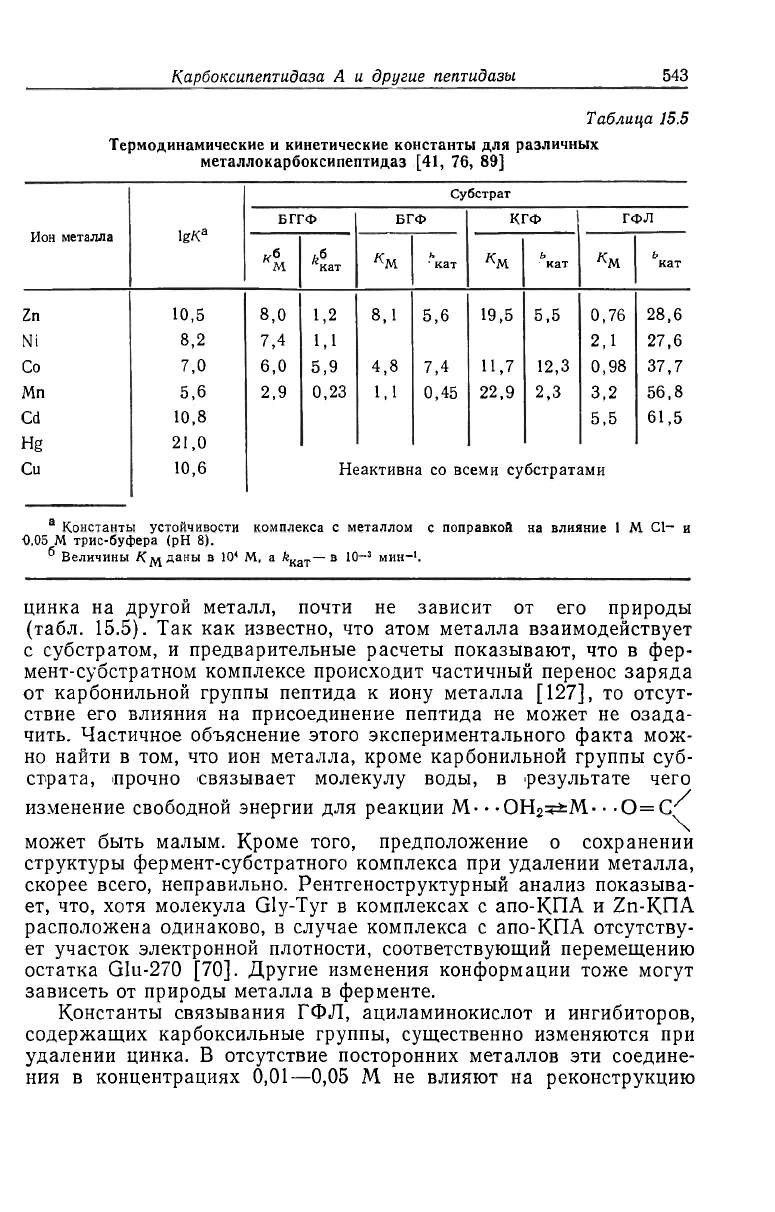
цинка на другой металл, почти не зависит от его природы
(табл. 15.5). Так как известно, что атом металла взаимодействует
с субстратом, и предварительные расчеты показывают, что в фер-
мент-субстратном комплексе происходит частичный перенос заряда
от карбонильной группы пептида к иону металла [127], то отсут-
ствие его влияния на присоединение пептида не может не озада-
чить. Частичное объяснение этого экспериментального факта мож-
но найти в том, что ион металла, кроме карбонильной группы суб-
страта, прочно связывает молекулу воды, в результате чего
изменение свободной энергии для реакции M- • -OH
2
=FbM-
•
-O=Q^
может быть малым. Кроме того, предположение о сохранении
структуры фермент-субстратного комплекса при удалении металла,
скорее всего, неправильно. Рентгеноструктурный анализ показыва-
ет, что, хотя молекула Gly-Tyr в комплексах с апо-КПА и Zn-КПА
расположена одинаково, в случае комплекса с апо-КПА отсутству-
ет участок электронной плотности, соответствующий перемещению
остатка Glu-270 [70]. Другие изменения конформации тоже могут
зависеть от природы металла в ферменте.
Константы связывания ГФЛ, ациламинокислот и ингибиторов,
содержащих карбоксильные группы, существенно изменяются при
удалении цинка. В отсутствие посторонних металлов эти соедине-
ния в концентрациях 0,01—0,05 M не влияют на реконструкцию

544
Г лава
10
Zn-КПА из апофермента [88]. Константы Км (или Ki), описываю-
щие взаимодействие этих соединений с Zn-КПА, изменяются от
IO
-5
до IO
-2
M (табл. 15.5). Отсюда можно заключить, что удале-
ние металла изменяет константу равновесия для ГФЛ более чем
в 100 раз. Сродство КПА к фенилпропионату изменяется в зави-
симости от природы металла в следующем ряду: Zn>Cd>Co
[98], а константы Ki в случае ингибиторов, содержащих карбок-
сильные группы, для Mn-КПА примерно на порядок ниже, чем для
Zn-КПА [72]. Можно отметить, что структурная интерпретация
такого влияния металлов затруднена.
Металло-КПА, не катализирующие гидролиз, могут тем не ме-
нее присоединять субстраты. При образовании комплексов дипеп-
тидов или апилпептидов с Cd-, Cu- и Hg-КПА происходит измене-
ние скорости обмена металлов. В качестве примера можно
привести присоединение ГФЛ к неактивной Си-КПА [88]. Количе-
ственные данные по константам связывания отсутствуют, однако
само сохранение связывания означает, что утрата ферментатив-
ной активности не является следствием потери способности присо-
единять субстрат в активном центре.
Роль металла в катализе, по всей вероятности, заключается в
том, что он в качестве кислоты Льюиса оттягивает электроны от
углеродного атома карбонильной группы. Эта точка зрения нашла
отражение в разнообразных предполагаемых механизмах действия
КПА [128, 129]. Ее прямым подтверждением служит обнаружение
связи Zn—О в кристаллическом состоянии. Кроме того, изменение
природы металла сказывается прежде всего на величине &
К
ат- Тем
не менее активности нескольких металло-КПА не укладываются в
ряд Ирвинга—Уильямса, в котором кислоты Льюиса располагают-
ся в порядке изменения их силы (Mn<;Fe<Co<'Ni<Cu>Zn)
[5]. Для пептидных субстратов эффективность металлов изменяет-
ся в ряду Co>Zn=Ni>Mn>-Cu=0, а для эфирных —в ряду
Cd>Mn>Co>Zn=Ni>Hg>Cu=0 (табл. 15.5). Выяснение спо-
соба, которым белок изменяет «естественный» ряд каталитической
эффективности металлов, необходимо для понимания функцио-
нальных свойств этого металлофермента. Нельзя сказать, что сей-
час в этой области достигнуты значительные успехи. Особенно
большую роль в ферментативном гидролизе могут иметь простран-
ственные и геометрические факторы. Например, выпадение Си-
КПА из ряда Ирвинга—Уильямса может быть результатом того,
что из-за ограничений, накладываемых ориентацией белковых ли-
гандов и геометрией иона Cu
2
+, атом кислорода карбонильной
группы субстрата не может занять положение, при котором возмо-
жен перенос части заряда на ион металла. Действительно, на кар-
тах электронной плотности комплекса Cu-КПА и глицилтирозина
с низким разрешением [70] не наблюдается участка с положи-
тельной плотностью около остатка Glu-270, что предполагает отсут-

Карбоксипептидаза А и другие пептидазы
545
ствие его взаимодействия с а-аминогруппой. К сожалению, низкое
разрешение не позволяет сделать заключение о состоянии связи
металл—кислород. В модельных системах Cd
2
+ не уступает Со
2
+
как кислота Льюиса, тем не менег rd-КПА не катализирует гидро-
лиз пептидов. Отсутствие активности у Cd-КПА трудно объяснить
только на основании геометрии лигандов у металла [5]. По-види-
мому, следует учитывать и другие факторы, такие, как размер
иона. Существенными могут быть также ограничения, накладыва-
емые складчатой структурой белка. Примером служит смещение
атома Hg
2
+ на А по сравнению с Zn
2
+ (разд. 2.4.3). Если мо-
лекула присоединенного субстрата соответственно изменяет свое
положение, то в результате водородная связь между ним и остат-
ком Туг-248 [2, 3] может исчезнуть. Аналогичная ситуация может
существовать для Cd-КПА, поскольку ион Cd
2
+ не уступает по раз-
меру иону Hg
2
+. В качестве общего объяснения уникальной реак-
ционной способности белка в присутствии иона активного металла
предложены изменения в количестве лигандов и их освобождение
или обмен в ходе реакции [5].
Известны модельные системы с Cu
2
+ и Со
3
+, способные ката-
лизировать синтез и гидролиз пептидных и эфирных связей [130—
133]. В комплексах Со
111
, рассматриваемых в гл. 1, активируется
атака по карбонильной группе, которая присоединена к атому ме-
талла. Однако эффективность катализа ферментом значительно
выше, чем в случае моделей. Это может частично объясняться эк-
ранирующим эффектом белковой молекулы по отношению к иону
металла [22]. После присоединения субстрата атом цинка, фор-
мально несущий заряд +1, перестает контактировать с массой рас-
творителя и оказывается в среде с низкой диэлектрической прони-
цаемостью. В результате этого происходит усиление электрического
поля вокруг атома металла, что вызывает увеличение поляризации
карбонильной группы субстрата.
3.5. Механизм действия
3.5.1. Предположение, основанное на анализе
кристаллической структуры
Предполагаемый механизм гидролиза пептидов, основную роль
в котором играют атом цинка и остатки Glu-270 и Туг-248, основан
на предположении о большом сходстве комплекса с глицилтирози-
ном и кинетически важного ферментативного комплекса ES [2, 3].
Рентгеноструктурное исследование показывает, что боковые груп-
пы только этих аминокислот белка находятся вблизи атомов пеп-
тидной связи. Следовательно, в интересующем диапазоне рН доно-
ром протона и нуклеофильным агентом могут быть только остатки
Туг-248 и Glu-270. Кроме них, обе эти функции могут выполняться
35—2451

546
Г лава 10
молекулами воды. Поскольку глицилтирозин является конкурент-
ным ингибитором гидролиза более длинных пептидов, а другие пеп-
тиды присоединены в кристаллах нативной и модифицированной
КПА сходным образом, то этот механизм считается применимым к
пептидам вообще. Гидролиз некоторых эфиров, таких, как ГФЛ
обнаруживает столько особенностей, что его надо обсуждать от-
дельно. Расщепление пептидов протекает в несколько стадий, по-
следовательность которых и относительные скорости не вполне из-
вестны.
1) Связывание. Субстрат присоединяется таким образом, чте
его С-концевая часть оказывается в полости специфичности, а
СООН-группа — вблизи остатка Arg-145. Пептидная группа NH
образует водородную связь с остатком Туг-248, который изменяет
свое положение. Атом кислорода карбонильной группы присоеди-
няется к атому цинка. Эти взаимодействия приводят к некоторому
искажению плоскостного расположения атомов пептидной связи,
в результате чего геометрия образующейся аминогруппы становит-
ся в какой-то степени тетраэдрической.
2) Катализ металлом. Атом цинка поляризует связь C=O, уве-
личивая электрофильность атома углерода, в результате чего ус-
коряется атака его водой или нуклеофильной группой белка.
3) Атака атома углерода карбонильной группы. Карбоксильная
группа остатка Glu-270 смещается, однако не вступает во взаимо-
действие с а-аминогруппой субстрата, как в комплексе с дипепти-
дом. Скорее всего, она либо образует ангидрид, в котором субст-
рат ковалентно присоединен к белку, либо действует в качестве
обобщенного основания, катализируя атаку водой по атому угле-
рода карбонильной группы.
4) Расщепление пептидной связи. При разрушении пептидной
связи, сопровождающемся передачей протона от остатка Туг-248
уходящей аминогруппе, образуются продукты реакции или ацил-
фермент.
5) Выброс продуктов реакции. Если в реакции участвует кова-
лентный интермедиат, то он атакуется молекулой воды. Возмож-
но, что на этой стадии происходит основной катализ комплексом
Zn
2
+—H
2
O или Zn
2+
OH
-
. После завершения гидролиза состояние
ионизации вновь образовавшихся кислотной и основной групп из-
меняется в соответствии с рН среды, а фенольная группа Туг-248
присоединяет протон и возвращается в исходное состояние (рис.
15.13).
Для объяснения высокой скорости гидролиза длинных пептидов,
в которых предпоследняя NH-группа не замещена, предполагается
образование водородной связи [66, 67] между этой группой и ос-
татком Туг-248 [2]. Для этого NH-группа смещается в результате
поворота вокруг простых связей по отношению к положению, зани-
маемому ею в комплексе с Gly-Tyr. Циклическая структура, возни-
Карбоксипептидаза А и другие пептидазы 547
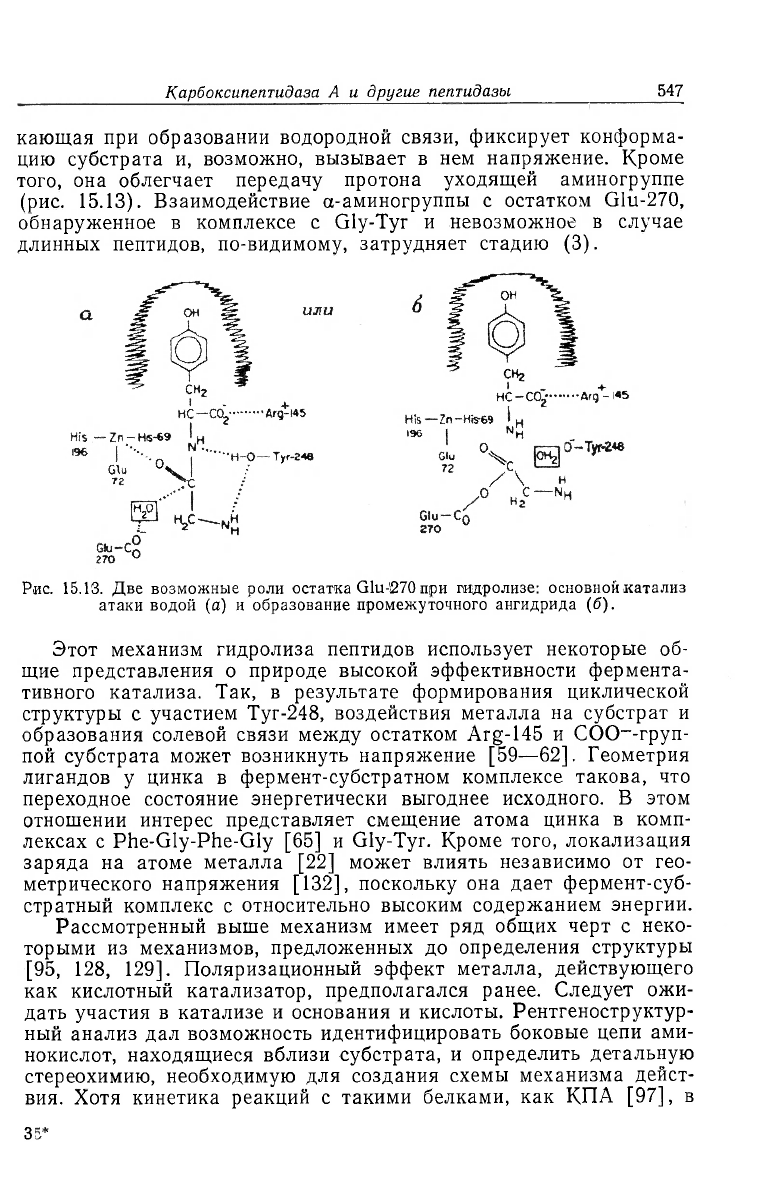
кающая при образовании водородной связи, фиксирует конформа-
цию субстрата и, возможно, вызывает в нем напряжение. Кроме
того, она облегчает передачу протона уходящей аминогруппе
(рис. 15.13). Взаимодействие а-аминогруппы с остатком Glu-270,
обнаруженное в комплексе с Gly-Tyr и невозможное в случае
длинных пептидов, по-видимому, затрудняет стадию (3).
Рис. 15.13. Две возможные роли остатка Glu-270 при гидролизе: основной катализ
атаки водой (а) и образование промежуточного ангидрида (б).
Этот механизм гидролиза пептидов использует некоторые об-
щие представления о природе высокой эффективности фермента-
тивного катализа. Так, в результате формирования циклической
структуры с участием Туг-248, воздействия металла на субстрат и
образования солевой связи между остатком Arg-145 и СОО~-груп-
пой субстрата может возникнуть напряжение [59—62]. Геометрия
лигандов у цинка в фермент-субстратном комплексе такова, что
переходное состояние энергетически выгоднее исходного. В этом
отношении интерес представляет смещение атома цинка в комп-
лексах с Phe-Gly-Phe-Gly [65] и Gly-Tyr. Кроме того, локализация
заряда на атоме металла [22] может влиять независимо от гео-
метрического напряжения [132], поскольку она дает фермент-суб-
стратный комплекс с относительно высоким содержанием энергии.
Рассмотренный выше механизм имеет ряд общих черт с неко-
торыми из механизмов, предложенных до определения структуры
[95, 128, 129]. Поляризационный эффект металла, действующего
как кислотный катализатор, предполагался ранее. Следует ожи-
дать участия в катализе и основания и кислоты. Рентгеноструктур-
ный анализ дал возможность идентифицировать боковые цепи ами-
нокислот, находящиеся вблизи субстрата, и определить детальную
стереохимию, необходимую для создания схемы механизма дейст-
вия. Хотя кинетика реакций с такими белками, как КПА [97], в
33*

548
Г лава 10
кристаллическом состоянии часто количественно отличается от ки-
нетики в растворе, рассмотрение имеющихся структур комплексов
фермент — субстрат и фермент — ингибитор позволяет сделать не-
которые строгие выводы. Так, близость остатков Glu-270 и Туг-248
к субстрату делает их участие в реакции очень возможным, тогда
как отсутствие связи между атомом цинка и азота пептида пред-
полагает, что стабилизация уходящей группы металлом [5] играет
лишь незначительную роль в катализе. Однако кристаллографиче-
ские методы пока нельзя использовать для изучения быстрых реак-
ций со специфическими субстратами. Поэтому кинетические гипо-
тезы, основанные на знании структуры, необходимо проверять дру-
гими методами. Некоторые проблемы, касающиеся механизма
действия, рассмотрены в заключительных разделах эгой главы.
3.5.2. Некоторые альтернативные механизмы
Рассмотренный выше механизм можно назвать «минимальным»
в том смысле, что он предполагает использование на каталитиче-
ских стадиях всего двух групп белка (Туг-248 и Glu-270), молеку-
лы воды и иона цинка. Изучение химической модификации указало
также на участие в катализе остатка гистидина. Хотя из-за уда-
ленности остатков His-69 и His-196 от субстрата представляется
маловероятным, что они служат нуклеофилами, вполне возможно,
что один из них перестает быть лигандом у атома цинка [5] и в
качестве основания принимает участие в переносе протона. Эта
стадия может не лимитировать скорость реакции. Однако при свя-
зывании не обнаруживается удаления какого-либо из остатков ги-
стидина от атома цинка. По аналогии с карбоангидразой рас-
сматривался также механизм, включающий атаку по карбониль-
ному атому углерода субстрата ОН~-группой, присоединенной к
иону цинка [2]. Из-за стерических препятствий такой механизм
менее вероятен, чем тот, в котором роль цинка заключается в по-
ляризации кислородного атома карбонильной группы субстрата.
3.5.3. Специфичность и изменение конформации
Способность КПА отщеплять только С-концевые аминокислоты
и отсутствие у нее эндопептидазной активности можно объяснить
стерическими эффектами. Внутренние пептидные связи субстрата
нельзя поместить около атома цинка таким образом, чтобы оста-
ток 145 и, возможно, 248 не мешали бы связыванию пептида. От-
бор субстратов, у которых на С-конце находятся ароматические
аминокислоты, а не основные, по-видимому, также происходит на
стадии связывания [86]. Труднее объяснить, почему не расщепля-
ется связь в глицилтирозинамиде, поскольку он присоединяется
к КПА [88]. По-видимому, необходимость присутствия свободной

Карбоксипептидаза А и другие пептидазы
549
группы COO
-
как-то связана с движением остатка Туг-248. При
отсутствии заряда на конце пептида перемещение этой аминокис-
лоты не происходит, как, например, в случае лизилтирозинамида,
и активный центр остается недостроенным, поскольку в нем нет не-
обходимой для гидролиза фенольной группы. Изменение конфор-
мации остатка Туг-248, по-видимому, можно наблюдать в раство-
ре* [109, 112, 113], что облегчает дальнейшие эксперименты по
выяснению необходимости этого превращения.
3.5.4. Промежуточные соединения и стадия,
лимитирующая скорость
Природа стадии, лимитирующей скорость, и соответствующего
переходного комплекса пока не установлена. По аналогии с боль-
шим числом реакций карбонильной группы, при которых в ней про-
исходит разрыв связи углерод—кислород, предполагается образо-
вание нестойкого тетраэдрического промежуточного соединения
[58, 134]. Возникает интересный вопрос: включение какой группы
приводит к его образованию
—•
молекулы воды или остатка
Glu-270? Вторая возможность подразумевает ковалентное присо-
единение субстрата к белку и требует протекания второй реакции
замещения, в которой происходит атака ацилфермента водой. Ис-
ходя из особенностей структуры, наиболее вероятен в качестве ко-
валентного промежуточного соединения ангидрид с участием ос-
татка Glu-270. Однако нуклеофильная способность карбоксильной
группы обычно невелика, а амин является плохой уходящей груп-
пой [58]. С другой стороны, есть основания полагать, что остаток
Glu-270 как основание катализирует атаку воды по атому углерода
карбонильной группы.
Для того чтобы различить нуклеофильное замещение и прямую
атаку водой, предпринимались попытки обнаружить ковалентные
промежуточные соединения в гидролитических реакциях, катализи-
руемых КПА. Однако пока они не увенчались успехом. При ис-
пользовании в качестве субстратов циннамоил- и индолакрилоил-
фенилаланина не происходит начального выброса продукта и из-
менений оптического поглощения, которые указывали бы на
существование интермедиатов [90]. Конечно, невозможность обна-
ружить их может объясняться тем, что стадия деацилирования не
является скоростьлимитирующей для этих субстратов.
Указания на существование промежуточных соединений можно
получить, изучая соответствующие реакции обмена и переноса
[58]. Однако транспептидазная или трансэстеразная активности
* По спектральным изменениям трудно различить перемещение ароматическо-
го остатка из гидрофильного в гидрофобное окружение и прямое взаимодействие
с модификатором, а также установить, что глубина изменения коррелирует со
степенью образования комплекса.

550
Г лава
10
типа A—X или A-B=^X-B у КПА не обнаружены [135,
136]. Отчасти это объясняется тем, что равновесие реакции сильно
смещено в сторону гидролиза, поэтому сопряжение обратной реак-
ции с каким-либо термодинамически выгодным процессом, как,
например, при синтезе карбоксипептидазой В ингибитора трипсина
[137], могло бы облегчить выяснение механизма. Перенос ациль-
ного фрагмента на гидроксиламин оказался очень информатив-
ным при изучении механизма действия химотрипсина, однако в
реакциях, катализируемых КПА, аналогичное образование гидро-
ксамата не обнаружено. КПА катализирует обмен атомов
18
O кар-
боксильной группы ацетилфенилаланина. Эта реакция ингибирует-
ся о-фенантролином, и ее зависимость от рН примерно такая же,
как для гидролиза [135]. В случае химотрипсина похожие обмен-
ные реакции в «псевдосубстратах» объясняют образование кова-
лентных промежуточных соединений. Однако сам факт существо-
вания обмена кислорода не служит строгим доказательством про-
исходящей атаки нуклеофильной группой белка; обмен может
происходить и путем прямого замещения. Предполагают, что суб-
страты, обменивающие атомы кислорода, связываются таким об-
разом, что карбоксильная группа оказывается на месте карбониль-
ной группы пептидной связи. Связь обмена
18
O в ацетилфенилала-
нине с механизмом действия карбоксипептидазы можно было бы
подтвердить, определив ориентацию ациламинокислот по отноше-
нию к иону металла.
Чтобы узнать, происходит ли перенос протона на стадии, лими-
тирующей скорость, были измерены изотопные эффекты с дейте-
рием. Если скорость определяется общим основным катализом ата-
ки водой по субстрату или ацилферменту, то отношение &II
2
O/£D
2
O
может быть равно 2 или больше. По-видимому, перенос протонов
при гидролизе пептидов происходит не на самой медленной ста-
дии, поскольку отношение скоростей для КГФ [85] и БГФ [138]
меньше 1,2. При гидролизе эфирных субстратов, ГФЛ и циннамо-
илфениллактата дейтериевый изотопный эффект равен 2 [22,
138]. Однако нельзя с уверенностью сказать, что гидролиз этих
эфиров происходит посредством общего основного катализа.
Так как изучение изотопных эффектов не позволило охаракте-
ризовать важные промежуточные соединения, то можно было ожи-
дать, что для определения механизма будет полезным измерение
индивидуальных констант скорости. Использование таких субст-
ратов, как дансил-Gly-Tyr, для которого можно применить флуо-
риметрию в соответствии с методом остановленной струи, дает
возможность количественно охарактеризовать некоторые стадии в
катализе [8]. Скорость всех последовательных стадий реакции
должна быть по крайней мере не меньше общей скорости гидро-
лиза субстрата в стационарной фазе. Например, если постулирует-
ся, что остаток Туг-248 служит донором протона, то он должен

Карбоксипептидаза А и другие пептидазы 551
изменить свое положение при каждом обороте реакции и, следо-
вательно, спектральные изменения, наблюдаемые при добавлении
субстратов или ингибиторов к нитро-КПА или арсанилазо-КПА
при условии, что они служат правильной мерой переориентации
этого остатка, должны протекать по крайней мере так же быстро,
как превращение субстрата в целом. По предварительным данным,
константа скорости изменения спектра при взаимодействии Gly-Tyr
и арсанилазо-КПА при 25
0
C не меньше 200 с
-1
. Таким образом,
скорость этого процесса равна скорости гидролиза лучших пептид-
ных субстратов КПА, что свидетельствует о том, что конформаци-
онный переход может быть одной из стадий реакции [139].
Можно надеяться, что другие детали механизма гидролиза пеп-
тидов также будут вскоре установлены. Гидролиз эфиров, таких,
как ГФЛ, обнаруживает ряд особых черт. Ряд различий в гидро-
лизе эфиров и пептидов сказывается на влиянии модификации ти-
розина, замещения металла и прибавления D
2
O, ингибиторов и
активаторов. Было высказано предположение о том, что механиз-
мы гидролиза эфиров и пептидов различны [128] и что центры
присоединения двух типов субстратов полностью или частично не
совпадают [100, 117]. Из известного несходства двух реакций дей-
ствительно вытекает существование количественных различий в
соответствующих им наборах констант скорости, из-за которых
стадии, лимитирующие скорость, для гидролиза пептидов и эфиров
могут не совпадать. Однако это можно объяснить не только с по-
мощью гипотезы «двух механизмов». Например, активность нитро-
КПА, Cd-КПА и Hg-КПА при гидролизе ГФЛ можно объяснить,
предположив, что некоторые эфиры могут превращаться без пере-
дачи протона от остатка тирозина [2, 3]. Узловой вопрос о воз-
можности превращения некоторых субстратов по различным меха-
низмам с участием различных каталитических групп заслуживает
более тщательного изучения.
4. ДРУГИЕ ПЕПТИДАЗЫ
4.1. Карбоксипептидаза В
Карбоксипептидазы, отщепляющие с большой скоростью от
С-конца пептидов остатки Lys и Arg, выделены из свиньи [140,
141] и быка [142, 143]. Наилучшими субстратами для них служат
пептиды, имеющие на концах основные аминокислоты, и эти фер-
менты называются карбоксипептидазами В (КПВ). По ряду
свойств КПВ очень похожа на КПА: ее молекулярная масса равна
34 000 [142, 144], содержание цинка составляет 1 г-атом/моль
[144] и его удаление или замена сопровождается изменением ка-
талитической активности [145]. Из аминокислотного состава и

552
Г лава
10
величины молекулярной массы следует, что длина цепи КПВ та-
кая же, как у КПА; для КПВ свиньи она составляет 304 остатка
[144], а для КПВ быка —300—301 остаток [142, 143, 146]. Пер-
вичная структура КПВ быка определена лишь частично [146—
148], а о рентгеноструктурных исследованиях сообщений не было.
Активная форма КПВ образуется при гидролизе профермента с
молекулярной массой 57 000 трипсином [142, 149].
Для описания специфичности КПВ использовано несколько суб-
стратов и ингибиторов [141]. По отношению к ним этот фермент
напоминает КПА. С наибольшей скоростью гидролизуются такие
модельные пептиды, как гиппуриллизин [150] (&
К
а
Т
= 1,32-
-IO
4
мин
-1
, /(м = 7,7-10
_4
М), гиппуриларгинин (&
К
ат = 6,3-
• Ю
-3
мин
-1
) и его эфирный аналог гиппуриларгининовая кислота
(&кат= 1,43-IO
4
мин
-1
, XM=O,4-Ю
-4
М). Сравнение с данными, при-
веденными в табл. 15.4, показывает, что эти величины такие же,
как для соответствующих субстратов КПА. Катализируемый КПВ
гидролиз эфиров ингибируется избытком субстрата, а образующие-
ся при реакции амино- и оксикислоты ингибируют гидролиз и эфи-
ров и пептидов [151]. Отсутствие активности КПВ по отношению
к гиппурил-Б-лизину и гиппурил- ь-лизинамиду напоминает КПА.
Это же можно сказать относительно способности использовать в
качестве субстратов пептиды, содержащие некоторые необычные
аминокислоты, такие, как гиппурил- ь-гомоаргинин и бензоил-р-ала-
нил-ь-лизин. Присутствие пролина в предпоследнем от конца по-
ложении уменьшает скорость реакции, а дипептид ГЛИЦИЛ-L -лизин
является очень плохим субстратом [141]. КПВ быка гидролизует
типичные пептидные субстраты КПА, но с меньшей эффективно-
стью. Гиппурил-р-фениллактат, по-видимому, одинаково хорош как
для КПА, так и для КПВ быка [142]. Гидролиз субстратов КПА
под действием КПВ не является результатом наличия примеси
КПА, так как КПВ ингибируется аналогами своих субстратов, на-
пример Е-аминокапроновой кислотой, которая не влияет на соот-
ветствующие реакции КПА [142]. Самыми эффективными конку-
рентными ингибиторами служат соединения, содержащие группу
COO
-
и радикалы, похожие на боковые цепи Arg и Lis [150]. Как
и в случае КПА, картина ингибирования фенилпропионатом слож-
на [142].
Сравнение аналогичных последовательностей КПВ и КПА быка
дает основание предположить, что эти ферменты представляют со-
бой структурные гомологи [152, 153]. Предполагается, что струк-
турные гены двух карбоксипептидаз происходят от общего пред-
шественника [152—154]. По аминокислотному составу два белка
довольно близки. Поразительные различия наблюдаются только в
содержании полуцистина, которое составляет семь для КПВ [142]
и два для КПА. КПВ быка содержит три дисульфидных мостика
и одну сульфгидрильную группу. Одна из петель цепи КПВ раз-
