Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Карбоксипептидаза А и другие пептидазы 533
циннамоилфениллактата является следствием непродуктивного
связывания, то эффективность гидролиза этих субстратов должна
быть очень велика.
3.2. Кинетико-структурные корреляции
3.2.1. Присоединение субстратов и ингибиторов
Существование дополнительных кинетических путей подразуме-
вает определенные особенности структуры КПА. Субстраты, кото-
рые способны активировать или ингибировать свой гидролиз, долж-
ны связываться более чем на одном центре. Модификаторы, по-ви-
димому, тоже присоединяются одновременно с субстратами.
Комплексы с модификаторами или субстратами, связанными на не-
скольких центрах, не подвергались прямому кристаллографическо-
му изучению. Однако моделирование позволило найти способ свя-
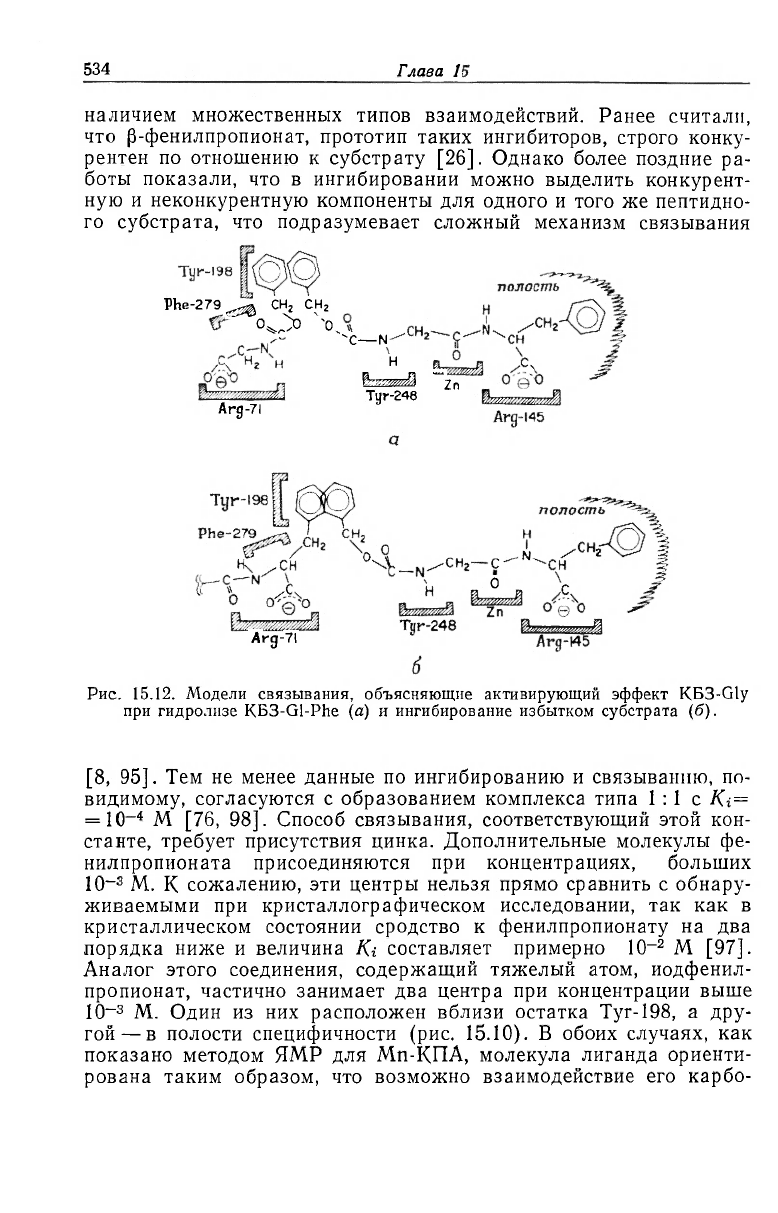
зывания, объясняющий кинетический эффект модификатора,
КБЗ-Gly [2, 3] (рис. 15.12). Если КБЗ-группа этого соединения на-
ходится вблизи остатка Туг-198, а группа COO
-
взаимодействует
с остатком Arg-71, то возможны помехи ориентации субстрата в
продуктивном комплексе. Для объяснения ингибирования субст-
ратом при гидролизе КГФ было предположено, что вторая молеку-
ла КГФ образует с ферментом те же связи, что и КБЗ-Gly [2, 3]
(рис. 15.12). Однако эта модель не может полностью объяснить ки-
нетику субстратного ингибирования. В предполагаемой области
связывания субстрата трудно разместить более двух молекул ацил-
пептидов, в то время как кинетический анализ указывает на при-
соединение четырех или пяти молекул субстрата в растворе [85]
и более чем двух в кристалле [97]. Высокий кинетический порядок
реакции может объясняться связыванием на других участках мо-
лекулы фермента или более сложным образом [28].
По-видимому, при непродуктивном или конкурентном связыва-
нии используются некоторые из взаимодействий, возникающих в
продуктивном фермент-субстратном комплексе. Так, из пяти свя-
зей, образуемых молекулой Gly-Tyr, только одна — между амино-
группой субстрата и остатком Glu-270 — считается непродуктивной.
Другие неактивные комплексы могут образовываться в результате
смещения субстрата вдоль «связывающей выемки», приводящего
к присоединению карбоксильной группы к атому цинка, или в ре-
зультате «неправильного» связывания, при котором N-ацильный
заместитель ацилдипептида занимает полость, определяющую спе-
цифичность, а концевая группа COO
-
вступает в контакт с остат-
ком Arg-71 [2, 3].
Структурные и кинетические данные показывают, что присоеди-
нение некоторых ингибиторов общего вида RCOO
-
осложняется
534
Г лава
10
наличием множественных типов взаимодействий. Ранее считали,
что (З-фенилпропионат, прототип таких ингибиторов, строго конку-
рентен по отношению к субстрату [26]. Однако более поздние ра-
боты показали, что в ингибировании можно выделить конкурент-
ную и неконкурентную компоненты для одного и того же пептидно-
го субстрата, что подразумевает сложный механизм связывания
Phe-279^ CH
2
CH
2
0
O
3
О
Arg-71
"С —N
H
Ф"г.г>шЛ3 2п
Tgr-248
O
Arg-71
Рис. 15.12. Модели связывания, объясняющие активирующий эффект КБЗ-Gly
при гидролизе КБЗ-Gl-Phe (а) и ингибирование избытком субстрата (б).
[8, 95]. Тем не менее данные по ингибированию и связыванию, по-
видимому, согласуются с образованием комплекса типа 1:1с Ki=
= IO
-4
M [76, 98]. Способ связывания, соответствующий этой кон-
станте, требует присутствия цинка. Дополнительные молекулы фе-
нилпропионата присоединяются при концентрациях, больших
IO
-3
М. К сожалению, эти центры нельзя прямо сравнить с обнару-
живаемыми при кристаллографическом исследовании, так как в
кристаллическом состоянии сродство к фенилпропионату на два
порядка ниже и величина Ki составляет примерно Ю
-2
M [97].
Аналог этого соединения, содержащий тяжелый атом, иодфенил-
пропионат, частично занимает два центра при концентрации выше
10~
3
М. Один из них расположен вблизи остатка Туг-198, а дру-
гой— в полости специфичности (рис. 15.10). В обоих случаях, как
показано методом ЯМР для Mn-КПА, молекула лиганда ориенти-
рована таким образом, что возможно взаимодействие его карбо-

Карбоксипептидаза А и другие пептидазы
535
ксильной группы с атомом металла активного центра [71]. Более
того, в отсутствие цинка сродство центра, расположенного в поло-
сти, уменьшается, а центр вблизи остатка Туг-198 вообще переста-
ет связывать иодфенилпропионат при его концентрации 0,10 М.
При большей концентрации ингибитора кристаллографическим ме-
тодом обнаруживаются два дополнительных места присоединения
иодфенилпропионата, однако они удалены от атома цинка.
Влияние центров, изображенных на рис. 15.10, на кинетику ре-
акции не вполне ясно. Связывание в полости, по-видимому, предпо-
лагает конкурентное ингибирование по отношению к любому суб-
страту, располагающемуся подобно Gly-Tyr. С другой стороны,
возможно, что ингибитор, находящийся вблизи остатка Туг-198,
присоединяется к атому цинка, не создавая стерических препятст-
вий связыванию длинных пептидов, рассмотренному в разд. 2.4.1.
Координационное число атома цинка при таком неконкурентном
взаимодействии, вероятно, становится равным пяти. Данные по
связыванию, из которых вытекает стехиометрия 1:1, казалось бы,
свидетельствуют в пользу того, что ингибитор не может одновре-
менно заполнять оба центра, обнаруживаемые кристаллографиче-
ским методом [70]. Однако факт защиты от модификации двух
тирозиновых остатков при высокой концентрации фенилпропионата
[99] проще всего объясняется одновременным присоединением
двух (или более) молекул ингибитора. Оглядываясь назад, прихо-
дится сожалеть, что ингибитор, ведущий себя столь сложным об-
разом, так часто использовался для изучения активного центра
КПА.
Обсуждение моделей присоединения эфирных субстратов наме-
ренно до сих пор откладывалось. Прямые данные о структуре от-
сутствуют, так как попытки получить кристаллические комплексы
КПА с эфирными субстратами пока не увенчались успехом. Неко-
торые, но не все эфирные субстраты ведут себя иначе, чем пепти-
ды. Например, активаторы гидролиза пептидов ингибируют гидро-
лиз циннамоилфениллактата [79], а ингибирование (3-фенилпро-
пионатом неконкурентно по отношению к пептидам и конкурентно
по отношению к ГФЛ [76]. Исходя из этих различий, было вы-
сказано предположение о том, что продуктивное связывание эфи-
ров и пептидов может происходить различным образом [100].
Полное описание взаимодействия с эфирами потребует эксперимен-
тов, позволяющих установить взаимное расположение важных
групп на ферменте и субстрате, т. е. использования флуоресцент-
ных и резонансных методов или проведения дополнительного рент-
геноструктурного анализа*.
* Недавно рентгеноструктурный методом с разрешением 6 А было показано,
что продукт гидролиза эфира L-p-фениллактат присоединен к КПА так же, как
L-фенилаланин [65].

536
Г лава
10
3.2.2. Зависимость активности от рН
Влияние рН на ферментативную активность иногда можно объ
яснить в рамках модели, предполагающей, что катализ зависит о
-
состояния ионизации некоторых аминокислот. Тогда, если зависи
МОСТЬ А?кат /Км от рН описывается колоколообразной кривой, по Hei
можно определить константы ионизации Ku и Kie каталитичесю
важных групп в свободном ферменте. Константы ионизации, отно
сящиеся к комплексу ES, можно получить из зависимости k
Kат
о-
рН [101]. В случае КПА определение величин К\
е
и K^
e
было бь
полезным для установления роли тирозина и других остатков, рас
положенных вблизи субстрата. Однако имеющиеся данные доволь
но скудны. Пептидный субстрат КБЗ-Gly-Gly-Phe был исследоваг
недавно в условиях, при которых интерпретация результатов не
осложняется ингибированием или активацией [7]. Кривые зависи-
мости &КАТ/Км ОТ рН оказались колоколообразными, что предпола-
гает участие в катализе как кислой, так и основной групп. Кривые
описывающие влияние рН на &
К
ат, для этого субстрата имеют точ-
ку перегиба около рН 6. В щелочной области (до рН 10,5) k
Kai
практически постоянна**. Отсутствие данных, указывающих на тит-
рование второй группы в комплексе ES, не исключает возможности
участия в реакции кислотного катализа, если предположить, на-
пример, что соответствующая стадия не лимитирует скорость реак-
ции (ср., однако, работу [103]). Зависимость гидролиза КГФ от
рН представлена в нескольких ранних работах. Данные, получен-
ные при высокой концентрации субстрата, указывают на сложный
характер влияния рН на &
К
АТ и Км [26]. По зависимости началь-
ной скорости от рН [104] были определены величины P^CES. равные
6,5 и 8,6, однако сравнение с ацилтрипептидами показывает, что эти
данные нуждаются в уточнении. При более низкой концентрации
КГФ влияние рН на /г
кат
менее выражено [85].
Зависимость k^/Кж от рН описывается колоколообразной кри-
вой в случае двух эфирных субстратов — ацетилманделата [92] и
циннамоилфениллактата [91]. Константы ионизации свободного
фермента оказались равными Ю
-6
'
9
и IO
-7
'
5
, и Ю
-6
'
5
и Ю
-9
'
4
M со-
ответственно. Не предложено никаких объяснений расхождения
кривых в щелочной области. Предварительное сравнение рН-зави-
симостей начальных скоростей гидролиза ГФЛ и КГФ обнаружи-
* Ku — константа ионизации свободного фермента, определяющая более
«кислую» ветвь колоколообразной кривой, Кге — аналогичная константа для вто-
рой ветви кривой, ^ES — кажущаяся константа ионизации комплекса ES, опреде-
ленная по зависимости й
кат
от рН.
** Опубликована полная сводка данных по влиянию рН на гидролиз грипеп-
тида [102]. Как Ям, так и k
K
^fKu зависят от состояния ионизации группы
с рК около 9. Этой группой может быть остаток Туг-248, что означало бы, что
он принимает участие в связывании субстрата. Существует несколько предполо-
жений о природе группы с меньшим значением р/С, влияющей на &
К
ат и йкат/Км.

Карбоксипептидаза А и другие пептидазы
537
ло, как казалось, принципиальное отличие эфиров от пептидов, по-
скольку кривая рН-зависимости для эфиров была сигмоидальная,
а для пептидов — колоколообразная. Однако работы с КБЗ-Gly-
Gly-Phe
1
ацетилманделатом и модифицированными карбоксипепти-
дазами [105] не подтвердили универсальности этой закономерно-
сти.
Влияние природы субстрата на характер рН-зависимости мож-
но объяснить изменением стадии, лимитирующей скорость [106].
Кроме того, следует иметь в виду, что простейшая модель рН-эф-
фектов не включает конформационные переходы и изменения при-
роды стадии, лимитирующей скорость, при изменении рН [58].
3.3. Химическое изучение роли различных
остатков в активном центре
3.3.1. Модификация остатков в центре связывания
субстратов
Химическая модификация тирозина убедительно доказывает,
что эта аминокислота играет некоторую роль в активном центре
КПА*. Особенно удачной оказалась «дифференциальная модифи-
кация» в присутствии и в отсутствие субстратов или ингибиторов.
Впоследствии она была дополнена определением расположения
центра модификации в аминокислотной цепи. Модификация тиро-
зина включала ацетилирование уксусным ангидридом [104] или
ацетилимидазолом [99], иодирование [107], нитрование тетранит-
рометаном [105] и диазотирование диазоний-1Н-тетразолом [108]
или диазо-п-бензоларсонатом [109]. При реакции с ацетилимида-
золом в КПА модифицируются пять тирозиновых остатков, однако
влияние ацетилирования на активность связывается с модификаци-
ей только двух остатков, которые можно защитить р-фенилпропиона-
том. В результате ацетилирования &
кат
для пептидов (включая
ацилтрипептиды) понижается до 3—6% первоначальной величины
76, 89], в то время как гидролиз ГФЛ (но не ацетилманделата
TlO]) происходит все еще достаточно быстро. Основной эффект
ацетилирования на гидролиз ГФЛ заключается в уменьшении суб-
стратного ингибирования, в результате чего оно появляется при
большей концентрации субстрата [78]. Величины &кат и Км для
ГФЛ увеличиваются при ацетилировании [78, 89].
Реагенты, отличающиеся от ацетилимидазола, селективно моди-
фицируют тот или иной из двух остатков тирозина, что оказывает
разное влияние на пептидазную активность. Нитрование одной ти-
розильной группы приводит к пропорциональному уменьшению ак-
тивности [105], тогда как присоединение 1 моля диазобензоларсо-
* В механизме, рассматриваемом в разд. 3.5.1., тирозину отводится роль
донора протонов.

538
Г лава 10
ната к этому же, по-видимому, остатку вызывает уменьшение ак-
тивности лишь на 50%- Модификация же диазо-1Н-тетразолом
примерно одного остатка тирозина, происходящая при умеренном
избытке реагента, почти не сказывается на пептидазной активно-
сти. Нитро-, арсанилазо- и тетразолиазо-КПА способны гидроли-
зовать эфирный субстрат, ГФЛ, причем они менее чувствительны к
субстратному ингибированию. Дополнительная модификация тет-
разолнлазо-КПА тетранитрометаном приводит к включению одной
нитрогруппы и значительной потере пептидазной активности. От-
сюда был сделан вывод, что при такой двойной модификации КПА
нитро- и тетразолилазогруппы присоединяются к разным остаткам
тирозина [105]. Если это так, то только один из них существен для
гидролиза пептидов, тогда как ингибирование избытком ГФЛ конт-
ролируется обоими. Однако для окончательного установления мест
модификации необходимо определить первичную структуру получа-
ющихся производных.
Отождествление одного из каталитически важных остатков ти-
розина с Туг-248 основывается на пространственном расположении
последнего и аминокислотной последовательности пептида, полу-
ченного иодированием КПА действием
131
I в присутствии фенилпро-
пионата и затем
125
I в его отсутствие. После гидролиза иодирован-
ной КПА пепсином был выделен пептид с наибольшим отношени-
ем
123
1/
131
1. Его аминокислотная последовательность оказалась Ile-
Tyr-Gln-Ala [111], что совпадает только с участком полипептидной
цепи 247—250 [4]. Уменьшение реакционной способности остатка
Туг-248 при связывании фенилпропионата можно объяснить изме-
нением конформации белковой молекулы.
Хотя остаток Туг-198 и удален от расщепляемой пептидной свя-
зи, он может участвовать в вандерваальсовых взаимодействиях с
субстратами, большими, чем глицилтирозин (рис. 15.3 и 15.4). Бо-
ковые цепи других остатков тирозина, расположенных в районе ак-
тивного центра, направлены в сторону от участков присоединения
субстрата. Таким образом, второй остаток этой аминокислоты, ко-
торый, судя по результатам модификации, участвует в образовании
активного центра, вероятно, является остатком 198. Иодфенилпро-
пионат присоединяется в кристаллах КПА к центру, расположен-
ному вблизи фенольной группы Туг-198 (рис. 15.10). Если фенил-
пропионат связывается аналогичным образом, то становится понят-
ным влияние этого ингибитора на модификацию. Высокую реак-
ционную способность остатков Туг-198 и Туг-248 можно частично
объяснить тем, что они находятся в контакте с окружающим рас-
творителем. Кроме того, рК нитруемого остатка тирозина меньше,
чем р/( остальных [112].
Расположение остатка Туг-248 в комплексе КПА с Gly-Tyr
вполне согласуется с предположением о том, что модификация
именно этой аминокислоты оказывает существенное влияние на

Карбоксипептидаза А и другие пептидазы
539
гидролиз пептидов. Так, судя по структуре, в нитро- и арсанилазо-
карбоксипептидазах заместители присоединены к остатку Туг-248.
Изменения спектров, наблюдаемые при прибавлении р-фенилпро-
пионата [109, 112, 113] или глицилтирозина [109] к нативной или
модифицированной КПА, хотя и не могут быть однозначно интер-
претерированы, однако хотя бы отчасти обусловлены переориента-
цией остатка Туг-248 [2, 3]. (Сообщение [114] о том, что спектры
тетразолилазо-КПА, в которой модифицирован не остаток 248
[105], тоже изменяются в присутствии глицилтирозина, подчерки-
вает необходимость определения аминокислотной последователь-
ности соответствующих пептидов в различным образом модифи-
цированной КПА.)
Влияние ацетилирования на гидролиз пептидов объясняется
главным образом уменьшением й
К
ат, хотя Км тоже может изме-
няться при этом. Для ацетил-КПА величина Км для КГФ в каче-
стве субстрата [78] и Ki для этого же пептида в качестве ингиби-
тора гидролиза ГФЛ [100] на порядок выше значения Км для
превращения КГФ нативной КПА. Ранее сделанный вывод о том,
что влияние ацетилирования на активность КПА связано с нару-
шением способности связывать ГФЛ и дипептиды [115], не согла-
суется с результатами экспериментов по конкуренции и рентгено-
структурными данными об образовании комплекса между Gly-Tyr
и ацетил-КПА. Действительно, присоединение гиппурилфенилала-
нина и КБЗ-Gly-Gly-Phe почти не изменяется при ацетилировании
КПА [76, 78]. Тем не менее из этих данных по модификации не
следует, что тирозин непосредственно участвует в катализе*. Для
проверки постулата об участии остатка Туг-248 в качестве донора
протона [2, 3] было бы полезно исследовать кинетические пара-
метры и рН-зависимость гидролиза пептидов арсанилазо-КПА, в
которой рК этой группы понижено по сравнению с нативной КПА
[116].
Обнаружение взаимодействий субстрата с остатками Glu-270 и
Arg-145 в кристаллическом комплексе стимулировало попытки мо-
дифицировать эти остатки [117]. Реакция примерно трех остатков
аргинина в КПА с бутандионом приводит к значительному (85%)
уменьшению пептидазной активности [118]. При удалении моди-
фицирующей группы с одного остатка аргинина активность восста-
навливается. Так же как при реакциях с тирозином, эстеразная ак-
тивность уменьшается не пропорционально пептидазной. Место мо-
дификации и то, каким образом измеряется й
кат
и Км для гидро-
лиза пептидов, не определены. Модификация карбоксильной груп-
пы И-этил-б-фенилизоксазолий-З'-сульфонатом (К-реагент Вудвор-
* Возможно, что величина Км, измеренная в кинетических экспериментах,
относится лишь к небольшой доле фермента [78]. Несмотря на это, вызывает ин-
терес то, что ацетил-КПА сохраняет значительную часть пептидазной активности,
хотя модифицирующий реагент находится в 500-кратном избытке [76].

540
Г лава
10
да) сопровождается потерей и пептидазной и эстеразной активно-
сти, причем скорость инактивации уменьшается в присутствии (3-
фенилпропионата или глицилтирозина. Еще одна группа COO
-
быстро реагирует с этим соединением, что, однако, не влияет на ак-
тивность. Пептид, выделенный после замещения реагента К на
OCH
3
, по-видимому, содержит остаток Glu-88 [93]. Для химиче-
ского подтверждения роли, приписываемой остатку Glu-270, было
бы очень важно получить монопроизводное белка по этой амино-
кислоте (разд. 3.5).
Химическая модификация дает основания предположить, что,
кроме тирозильной, карбоксильной и аргинильной групп, для фер-
ментативной активности КПА важен гистидин. Фотоокисление ги-
стидина в присутствии метиленового синего [119] или бенгальского
розового [120] или реакция одного остатка этой аминокислоты с
диазо-1Н-тетразолом [108] вызывает потерю пептидазной актив-
ности. Положение реагирующих остатков не установлено, хотя
единственными остатками гистидина, расположенными в активном
центре, являются His-69 и His-196. Исчезновение активности в этих
экспериментах не было просто результатом удаления цинка из фер-
мента. Хотя при окислении метиленовым синим и происходила ча-
стичная потеря цинка, в тетразолилазо-His-KnA металл сохраня-
ется полностью. Последнее производное фермента обладало эсте-
разной активностью, причем величина &
К
ат для ГФЛ составляла
Примерно ПОЛОВИНу «кат для немодифицированной КПА [108].
3.3.2. Химическая природа лигандов, связанных
с металлом, и дисульфидная связь
Значительные усилия были потрачены на установление природы
лигандов атома цинка до того, как стали известны трехмерная
структура и аминокислотная последовательность КПА. Как и при
изучении связывания субстрата и поиске каталитических групп, в
основном сравнивали реакционные способности различных остат-
ков в присутствии и в отсутствие присоединяемого компонента, в
данном случае иона металла. В результате был сделан вывод, что
атом цинка связан с цистеином и а-аминогруппой. На самом деле
лигандами цпнка являются остаток глутамата и два остатка гисти-
дина. Было бы полезно для будущего проанализировать некото-
рые опасности, подстерегающие при химическом определении при-
роды лигандов.
Результаты изучения реакции КПА с ПХМБ методом разност-
ной спектроскопии согласуются с предположением о появлении в
молекуле фермента при удалении металла одной реакционноспо-
собной сульфгидрильной группы. Вывод о том, что цистеин служит
лигандом цинка, казалось бы, подтверждался влиянием на апо-
фермент феррицианида и конкуренцией за апофермент ионов се-

Карбоксипептидаза А и другие пептидазы
541
ребра и цинка [24]. Поскольку константы устойчивости для ряда
металлов находились в согласии с моделью бидентатного лиганда,
в котором донорами служат атомы азота и серы [121], было изу-
чено влияние реагентов, специфически взаимодействующих с ами-
но- и имидазольными группами. Фотоокисление гистидина вызыва-
ло постепенное уменьшение активности и содержания цинка [119],
однако прибавление цинка не влияло на скорость инактивации, что
послужило основанием для вывода о том, что гистидин не связан
с металлом. Модификация а-аминогруппы, напротив, затруднялась
при образовании металлофермента [119]. Поскольку величину
р/( 7,7, определенную комплексометрическим титрованием апофер-
мента. вполне можно было отнести к а-аминогруппе, было предпо-
ложено, что концевой остаток NH
2
является лигандом цинка, не-
смотря на то, что его ацетилирование не влияло на ферментатив-
ную активность [122].
Пересмотр этих данных на основании известной структуры КПА
заставляет сделать вывод о том, что при спектрофотометрическом
титровании ПХМБ реагировал с лигандом, связанным с цинком.
Отсутствие SH-групп и высокое сродство центра присоединения
цинка к Hg
2
+ предполагает, что спектральные изменения вызыва-
ются взаимодействием ПХМБ с имидазольной и (или) карбоксиль-
ной группой. Появление изменений в спектре при 250 нм было ра-
нее отмечено при взаимодействии ПХМБ и ЭДТА [123]. Опыт
изучения КПА должен служить указанием на то, что некоторые
специфические центры связывания металла, не содержащие сульф-
гидрильные группы, могут реагировать с производными ртути, вы-
зывая спектральные изменения. Корреляции с модельными
соединениями следует признать ненадежными, поскольку считается
[124], что трудно подыскать модели, похожие по свойствам на ме-
таллоферменты. Единственным методом строгого установления
взаимодействий металл—фермент в- трехмерном пространстве сей-
час является трехмерный рентгеноструктурный анализ. Действи-
тельно, кристаллография представляет собой наиболее точный ме-
тод установления природы лигандов, связанных с металлом. Одна-
ко из-за трудностей в идентификации боковых цепей аминокислот
[22] для полного описания центра присоединения металла необхо-
димо знать первичную структуру белка.
Вывод [121] об участии сульфгидрильной группы в связывании
цинка привел к тому, что существование дисульфидной связи [1]
оставалось незамеченным. Аминокислотный анализ обнаружил
2 моля цистеина в расчете на 1 моль белка. Поэтому из результа-
тов титрования ПХМБ вытекало присутствие в КПА второй, не-
реакционноспособной SH-группы. Ни одну из этих SH-групп нель-
зя было легко алкилировать без предварительной обработки бел-
ка восстанавливающими агентами, такими, как меркаптоэтанол.
После восстановления и алкилирования в присутствии фенилпро-

542
Г лава
10
пионата фермент сохранял свою активность и в нем обнаруживал-
ся 1 моль/моль карбоксиметилцистеина. Последующее удаление
фенилпропионата и повторение реакции приводило к появленик
второй карбоксиметильной группы и инактивации фермента. Уча-
сток аминокислотной последовательности, включающий второе
остаток цистеина, был отождествлен с активным центром [125].
После определения первичной структуры алкилирование «цис-
теина» было изучено повторно. С помощью методик выделения
пептидов с высоким выходом было показано, что при восстановле-
нии и алкилировании в присутствии фенилпропионата реагирует
тот или иной из остатков 138 и 161, но не оба сразу. Таким обра-
зом было подтверждено существование дисульфидного мостика,
связывающего эти аминокислоты [126].
3.4. Зачем нужен металл?
Функцию металла в карбоксипептидазе можно рассматривать
в двух аспектах: участие в связывании субстрата и участие в ка-
тализе. Данные свидетельствуют в пользу того, что в активной ме-
талло-КПА ионы металла участвуют как в связывании субстрата,
так и в катализе, однако логически удобно разделить влияние ме-
талла на ориентацию субстрата на поверхности молекулы фермен-
та и его участие в понижении энергии переходного комплекса.
Надежные данные о типах прямых связей, образуемых атомом
металла активного центра с субстратами и ингибиторами, можно
получить с помощью рентгеноструктурного анализа, а также мето-
дом ЯМР. Уширение резонансных линий протонов нескольких ин-
гибиторов общего вида RCOO
-
при добавлении Mn-КПА можно
объяснить тем, что группа COO
-
находится во внутренней коорди-
национной сфере иона Mn
2
+ [66, 71]. Влияние фенилпропионата
на резонанс ядер
19
F
-
, присоединяемых к Mn в Mn-КПА, подтвер-
ждает этот вывод [67, 72]. Однако полное описание влияния ме-
талла на геометрию связывания субстрата или ингибитора требу-
ет точного сравнения геометрии апо-КПА и различных металло-
КПА в присутствии и в отсутствие субстратов.
Оценка прочности взаимодействий субстрат—металл представ-
ляется довольно трудной. Один из методов заключается в сравне-
нии констант прочности в присутствии и в отсутствие цинка. По
различию между этими константами можно определить изменение
свободной энергии, соответствующее взаимодействию металл—суб-
страт, если допустить, что удаление металла не изменяет структу-
ру E и ES. На практике в присутствии цинка вместо значений кон-
стант равновесия приходится использовать значения /См. Некото-
рые пептиды присоединяются к апо-КПА почти с той же констан-
той равновесия, что и к Zn-КПА [86] (табл. 15.4). Прочность свя-
зи пептидов с активными формами КПА, получающимися заменой
