Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

Карбоксипептидаза А и другие пептидазы
523
объемистыми о-аминокислотами, тоже не могут образовать все те
три типа связей, которые наблюдаются в фермент-субстратном
комплексе.
Si
S
1
S,
S
4
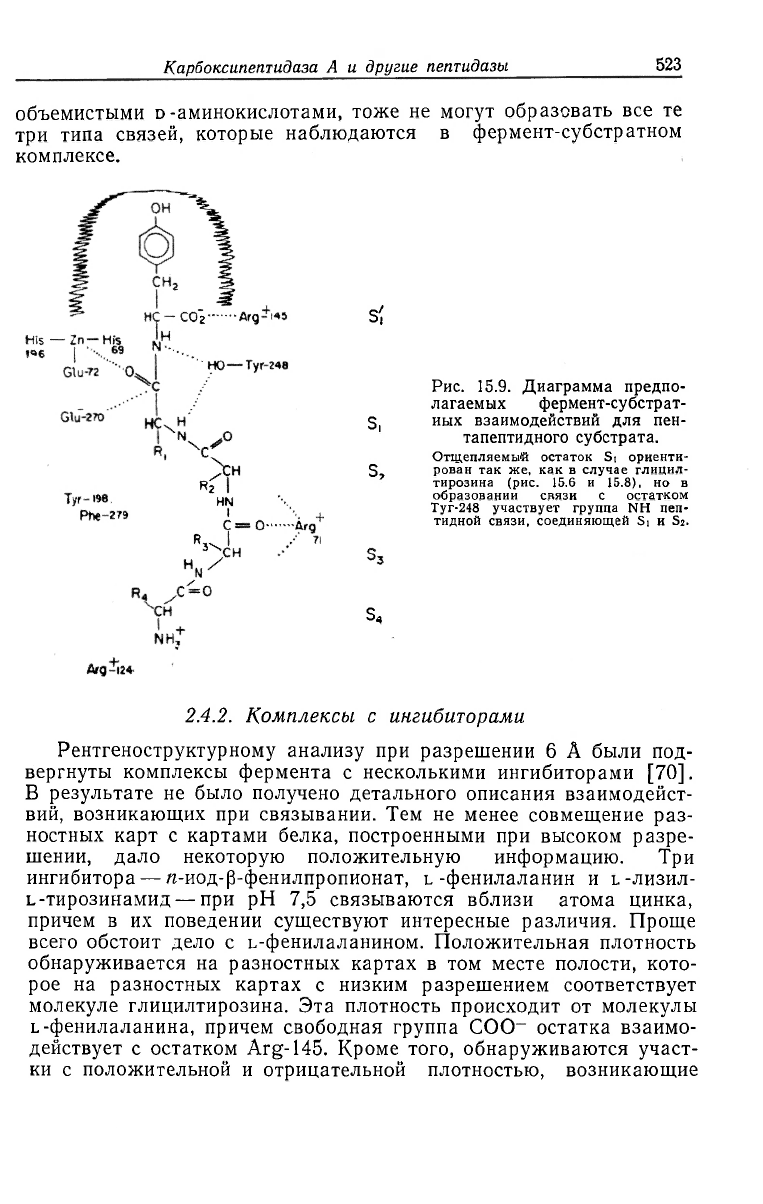
Рис. 15.9. Диаграмма предпо-
лагаемых фермент-субстрат-
иых взаимодействий для пен-
тапептидного субстрата.
Отщепляемый остаток Si ориенти-
рован так же, как в случае глицил-
тирозина (рис. 15.6 и 15.8), но в
образовании связи с остатком
Туг-248 участвует группа NH пеп-
тидной связи, соединяющей Si и S2.
2.4.2. Комплексы с ингибиторами
Рентгеноструктурному анализу при разрешении 6 А были под-
вергнуты комплексы фермента с несколькими ингибиторами [70].
В результате не было получено детального описания взаимодейст-
вий, возникающих при связывании. Тем не менее совмещение раз-
ностных карт с картами белка, построенными при высоком разре-
шении, дало некоторую положительную информацию. Три
ингибитора — n-иод-р-фенилпропионат, L-фенилаланин и L-ЛИЗИЛ-
ь-тирозинамид — при рН 7,5 связываются вблизи атома цинка,
причем в их поведении существуют интересные различия. Проще
всего обстоит дело с ь-фенилаланином. Положительная плотность
обнаруживается на разностных картах в том месте полости, кото-
рое на разностных картах с низким разрешением соответствует
молекуле глицилтирозина. Эта плотность происходит от молекулы
ь-фенилаланина, причем свободная группа COO
-
остатка взаимо-
действует с остатком Arg-145. Кроме того, обнаруживаются участ-
ки с положительной и отрицательной плотностью, возникающие
524
Г лава
10
при перемещении Туг-248. Лизилтирозинамид, напротив, располага-
ется иначе, чем глидилтирозин, и на картах нет признаков конфор-
мационного изменения, затрагивающего остаток Туг-248. Иодфе-
нилпропионат связывается кристаллической КПА на четырех цент-
рах. Если предположить, что центр пиков электронной плотности
при низком разрешении совпадает с положением атомов иода, то
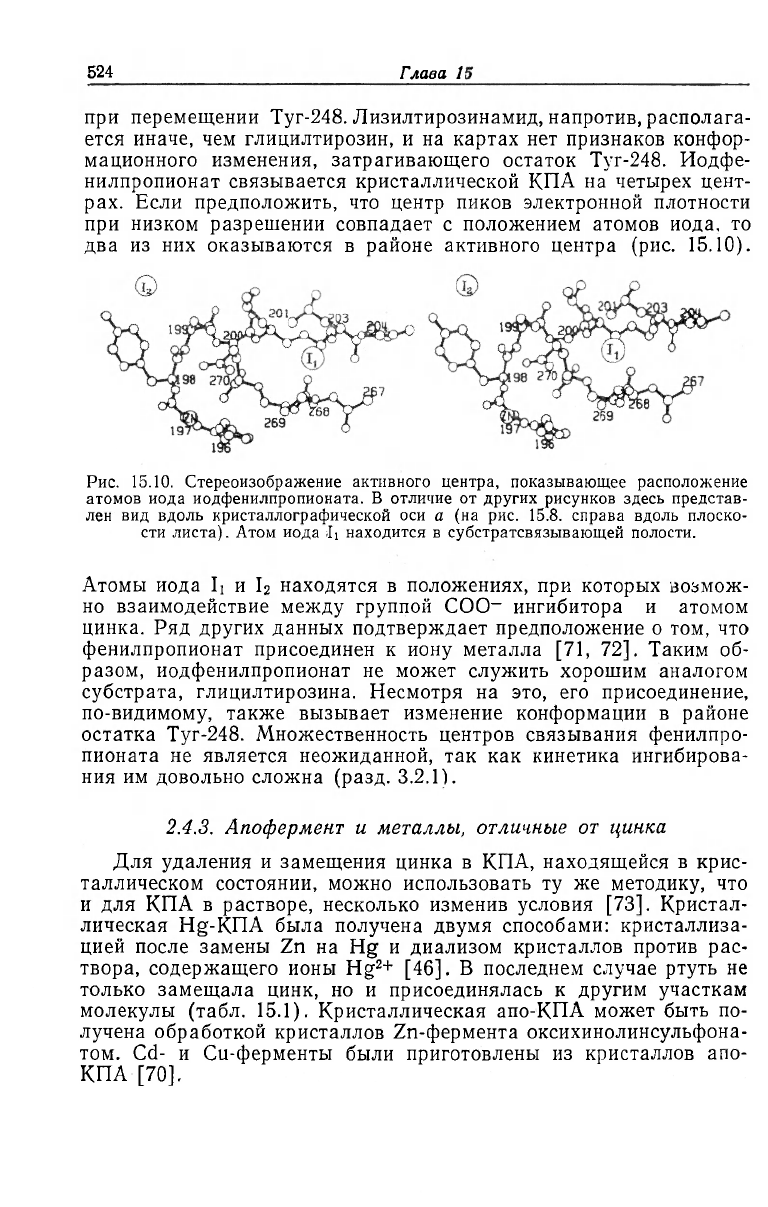
два из них оказываются в районе активного центра (рис. 15.10).
Рис. 15.10. Стереоизображение активного центра, показывающее расположение
атомов иода иодфенилпропионата. В отличие от других рисунков здесь представ-
лен вид вдоль кристаллографической оси а (на рис. 15.8. справа вдоль плоско-
сти листа). Атом иода Ji находится в субстратсвязывающей полости.
Атомы иода Ij и I
2
находятся в положениях, при которых возмож-
но взаимодействие между группой COO
-
ингибитора и атомом
цинка. Ряд других данных подтверждает предположение о том, что
фенилпропионат присоединен к иону металла [71, 72]. Таким об-
разом, иодфенилпропионат не может служить хорошим аналогом
субстрата, глицилтирозина. Несмотря на это, его присоединение,
по-видимому, также вызывает изменение конформации в районе
остатка Туг-248. Множественность центров связывания фенилпро-
пионата не является неожиданной, так как кинетика ингибирова-
ния им довольно сложна (разд. 3.2.1).
2.4.3. Апофермент и металлы, отличные от цинка
Для удаления и замещения цинка в КПА, находящейся в крис-
таллическом состоянии, можно использовать ту же методику, что
и для КПА в растворе, несколько изменив условия [73]. Кристал-
лическая Hg-КПА была получена двумя способами: кристаллиза-
цией после замены Zn на Hg и диализом кристаллов против рас-
твора, содержащего ионы Hg
2
+ [46]. В последнем случае ртуть не
только замещала цинк, но и присоединялась к другим участкам
молекулы (табл. 15.1). Кристаллическая апо-КПА может быть по-
лучена обработкой кристаллов Zn-фермента оксихинолинсульфона-
том. Cd- и Cu-ферменты были приготовлены из кристаллов апо-
КПА [70].

Карбоксипептидаза А и другие пептидазы
525
Карты электронной плотности для нативной КПА и апофермен-
та при разрешении 6 А практически совпадают, за исключением
большого отрицательного пика в положении атома цинка [46]. На
первый взгляд можно было предположить, что в апо-КПА остаток
His-196, несмотря на жесткость p-структуры, изменит свое поло-
жение таким образом, что между ним и остатками Asn-144 и
Gly-270 образуются водородные связи. Однако на разностных'
картах при низком разрешении отсутствуют участки с положитель-
ной и отрицательной плотностью, которые согласовались бы с этим
предположением. Если допустить, что в кристалле, так же как в
растворе, потеря активности коррелирует с удалением цинка, то из
анализа карт апо-КПА можно заключить, что металл участвует
непосредственно в катализе, а не в возможной структурной пере-
стройке апофермента. Этот вывод строго подтверждается взаим-
ным расположением субстрата и металла в кристаллических фер-
мент-субстратных комплексах. Можно отметить, что результаты
химических исследований в растворе не позволили выяснить роль
цинка.
Карты электронной плотности активного центра Hg-КПА были
рассчитаны с высоким разрешением. Центр иона металла смещен
на 1,0 А главным образом вдоль осей х и у по сравнению с поло-
жением иона цинка. На рис. 15.7 атом ртути был бы выше и бли-
же к остатку His-69. Связь этого металла с белком тоже осущест-
вляется через атомы Ni двух остатков гистидина, 69 и 196, кото-
рые расположены так же, как в комплексе с Zn. Возможность
поворота имидазольного кольца в His-196, в результате чего в свя-
зи с металлом мог бы вместо атома Ni участвовать атом N
3
, сле-
дует исключить. Причиной этого является обнаружение на картах
молекулы воды, которая, как и в случае цинка, соединена с ато-
мом N
3
этой аминокислоты водородной связью. Электронная плот-
ность, соответствующая карбоксильной группе остатка Glu-72, не-
сколько понижена. Тем не менее и эта группа, по-видимому, взаи-
модействует с атомом ртути. В остальном карты электронной плот-
ности для комплексов белка с Zn и Hg совпадают. Возможность
использовать Hg-КПА при расчете фаз подтверждает изоморфизм
двух структур. В растворе ртутное производное карбоксипептидазы
проявляет высокую эстеразную активность, но не катализирует
гидролиз пептидов [41]. Однако в кристаллическом виде Hg-КПА
в отличие от Zn-КПА обладает и высокой пептидазной активно-
стью, которая составляет примерно 1/1000 активности Zn-фермента
в растворе [73].
Для изучения структур Mn-КПА и Cu-КПА использовали ме-
тоды магнитного резонанса. Геометрия лигандного окружения этих
ионов в комплексе с белком отличается от существующей в
Zn-КПА. Анализ резонанса иона F
-
и протонов воды в присутствии
Mn-КПА дает основания предположить, что в растворах, содержа-

526
Г лава
10
щи.х F
-
, во внутренней координационной сфере иона металла при-
сутствуют по меньшей мере два небелковых лиганда: один ион
галогена и не менее одной молекулы воды. Если, кроме того, ион
металла связан с тремя белковыми лигандами, то его координаци-
онное число должно быть не менее пяти [6, 72]. Спектры электрон-
ного парамагнитного резонанса кристаллов Cu-КПА согласуются
с плоской геометрией лигандов, а не с искаженной тетраэдриче-
ской. Анализ сверхтонкой составляющей спектра указывает на то,
что среди лигандов есть два атома азота. Кристаллы КПА-у, ис-
пользованные в измерениях электронного парамагнитного резонан-
са, изоморфны соответствующим кристаллам Zn-КПА [74]. Уча-
стие остатков His-196 и His-69 в связывании атома меди не вызыва-
ет сомнения, в то время как природа остальных лигандов и
расположение плоскости, в которой находятся лиганды, по отноше-
нию к молекуле КПА точно не установлены.
3. ФЕРМЕНТАТИВНАЯ АКТИВНОСТЬ
КАРБОКСИПЕПТИДАЗЫ А
3.1. Кинетика (обзор)
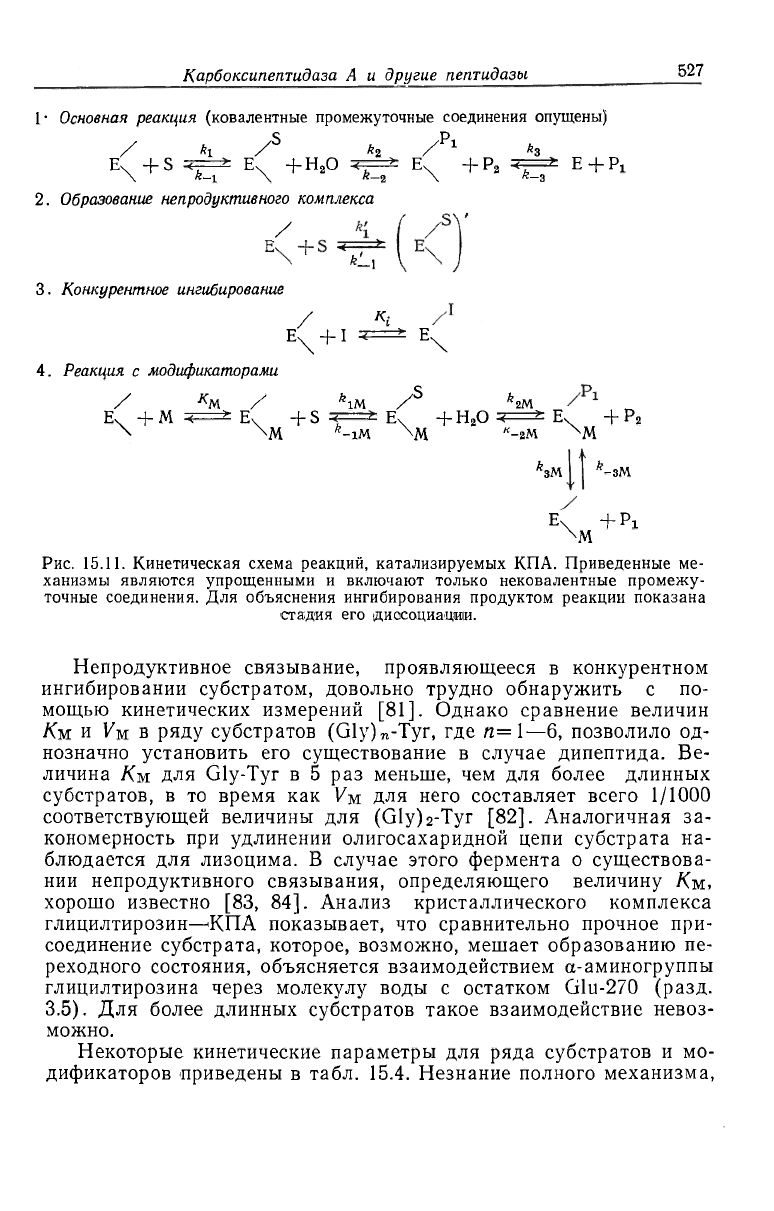
Для описания кинетики реакций, катализируемых КПА, в со-
ответствии с современным уровнем знаний требуется использовать
сложную схему, показанную на рис. 15.11. Она суммирует различ-
ные кинетические явления, которые в какой-то степени подтверж-
дены экспериментально: непродуктивное связывание (путь 2);
конкурентное ингибирование продуктами или аналогами субстра-
тов (путь 3); взаимодействие с модификаторами M (которые мо-
гут включать как продукты, так и субстраты), ведущее к смешан-
ному и неконкурентному ингибированию или активации (путь 4).
Ингибирование избытком субстрата можно считать вариантом пу-
ти 4. Существование тех или иных путей зависит от природы суб-
страта. Например, при гидролизе ГФЛ* ингибирование субстратом
проявляется даже при его концентрации 2-Ю
-4
M [28, 75], в то
время как при использовании похожего пептидного субстрата, гип-
пурилфенилаланина, вместо ингибирования наблюдается актива-
ция [76] (см. также [78]). Активация субстратами обнаружена
также при гидролизе эфира — гиппурилгликолата [77] и пептида—
КБЗ-Gly-Phe [78]. Продукт расщепления последнего субстрата,
КБЗ-Gly, активирует гидролиз некоторых пептидов и в то же вре-
мя конкурентно ингибирует гидролиз циннамоилфениллактата [79]
и ацилтрипептидов [76]. К модификаторам относятся также бенз-
амид, циклогексанон и ряд замещенных спиртов [80].
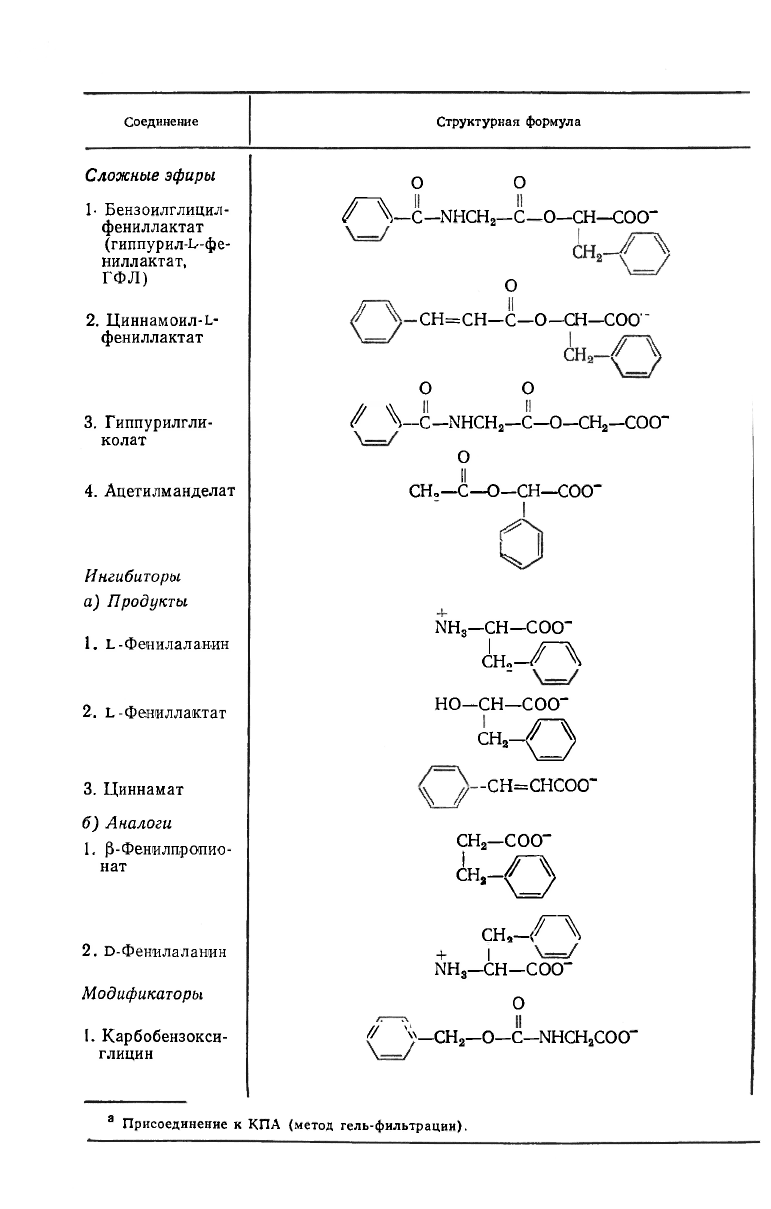
* Формулы субстратов приведены в табл. 15.4.
Карбоксипептидаза А и другие пептидазы
527
1 •
Основная реакция (ковалентные промежуточные соединения опущены)
/ *1 /
S
*2 /
Pl
^
3
,
E
\
+ s
^f
Е
\
+Ha0
^f
Е
\
+Рг 5
^f
E + Pl
2. Образование непродуктивного комплекса
/
k
—\
3. Конкурентное ингибирование
/ Ki
E
X
+ I E
4
4. Реакция с модификаторами
/ V / /
S
*2М. „
E
4
+M ч=* E
4
+S=P=^E
4
+ H
2
O^==* E
4
+P
2
\ \М *-im \М —2М
n
M
*
3
М
-
3
М
E
4
+Pi
x
M
Рис. 15.11. Кинетическая схема реакций, катализируемых КПА. Приведенные ме-
ханизмы являются упрощенными и включают только нековалентные промежу-
точные соединения. Для объяснения ингибирования продуктом реакции показана
стадия его диосоциации.
Непродуктивное связывание, проявляющееся в конкурентном
ингибировании субстратом, довольно трудно обнаружить с по-
мощью кинетических измерений [81]. Однако сравнение величин
Км и Ум в ряду субстратов (Gly)
7l
-Tyr, где п= 1—6, позволило од-
нозначно установить его существование в случае дипептида. Ве-
личина Км для Gly-Tyr в 5 раз меньше, чем для более длинных
субстратов, в то время как Ум для него составляет всего 1/1000
соответствующей величины для (Gly)
2
-Tyr [82]. Аналогичная за-
кономерность при удлинении олигосахаридной цепи субстрата на-
блюдается для лизоцима. В случае этого фермента о существова-
нии непродуктивного связывания, определяющего величину Км,
хорошо известно [83, 84]. Анализ кристаллического комплекса
глицилтирозин—>КПА показывает, что сравнительно прочное при-
соединение субстрата, которое, возможно, мешает образованию пе-
реходного состояния, объясняется взаимодействием а-аминогруппы
глицилтирозина через молекулу воды с остатком Glu-270 (разд.
3.5). Для более длинных субстратов такое взаимодействие невоз-
можно.
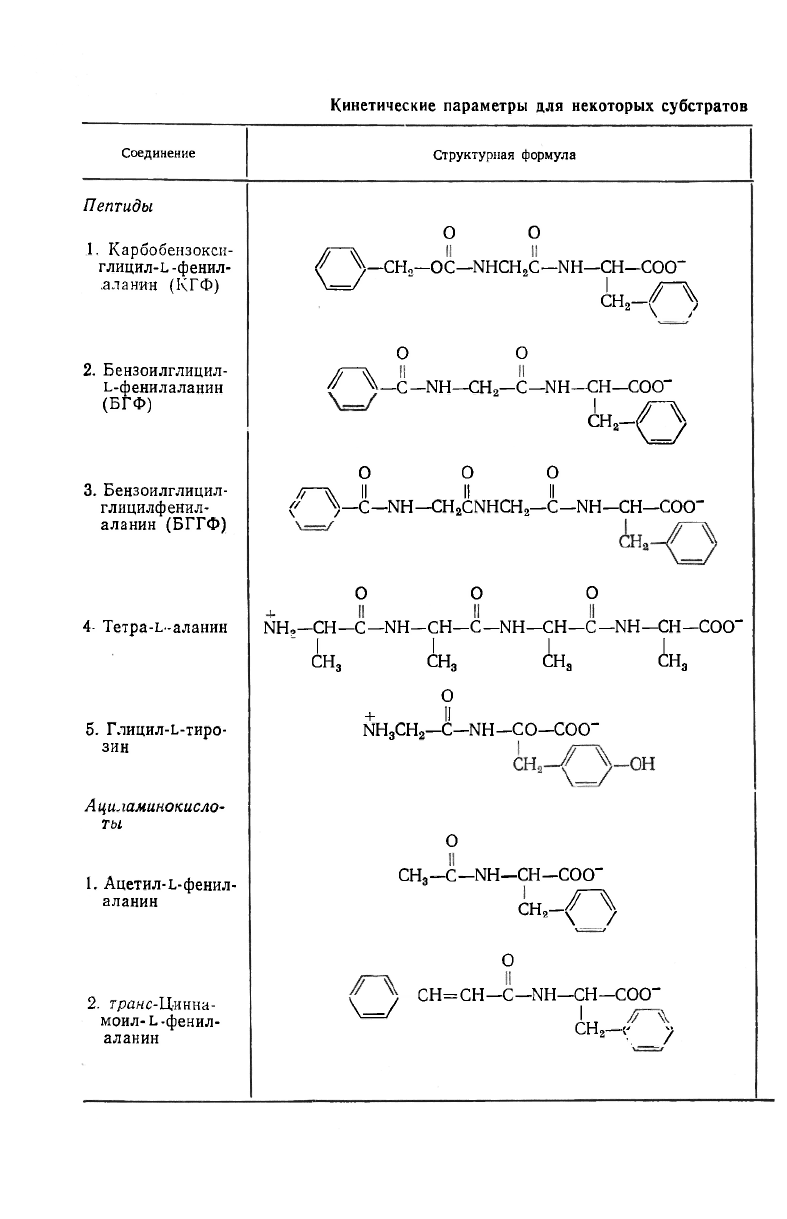
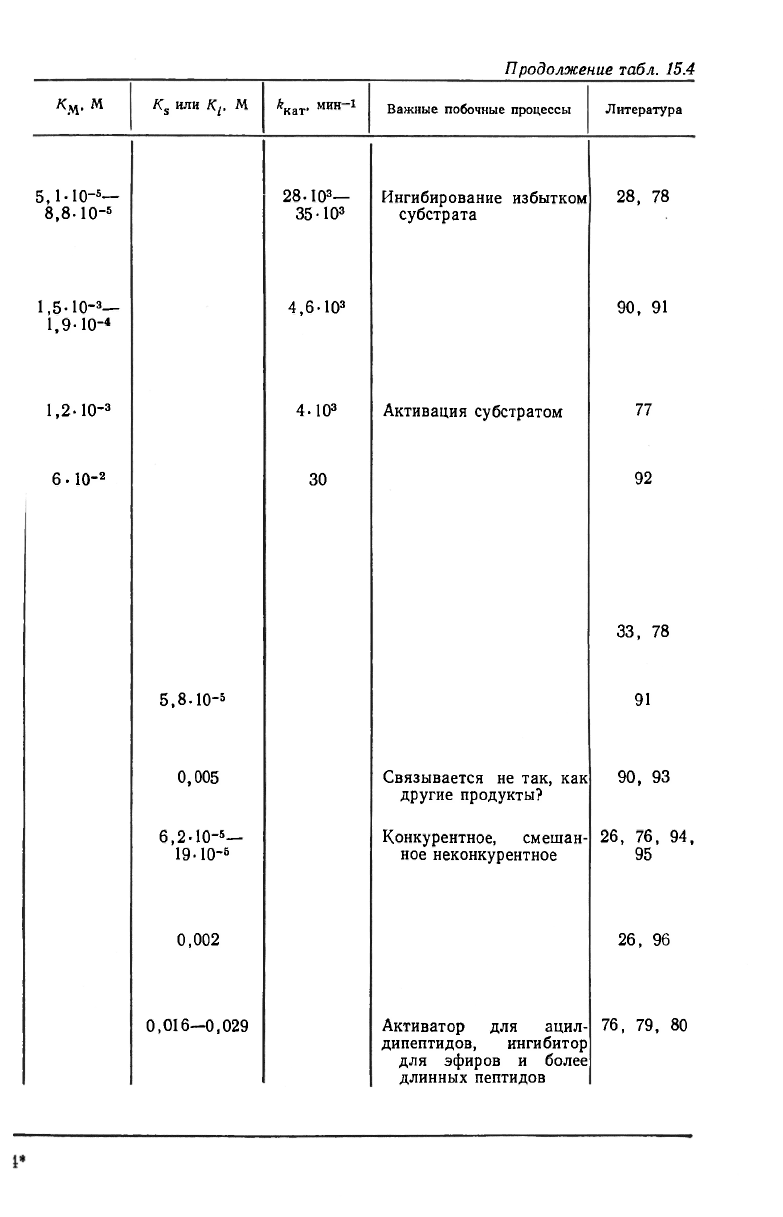
Некоторые кинетические параметры для ряда субстратов и мо-
дификаторов приведены в табл. 15.4. Незнание полного механизма,
Кинетические параметры для некоторых субстратов
Соединение
Структурная формула
Пептиды
1. Карбобензокси-
глицил-L-фенил-
.а л а нин (КГФ)
О О
$ \—СН„—ОС—NHCH
2
C--NH—CH—COO
-
W
" in -TX
2 у 1
2. Бензоилглицил-
ь-фенилаланин
(БГФ)
О о
/~\_с -NH-CH
2
-С— NH-CH-COO
-
" VQ
3. Бензоилглицил-
глицилфенил-
аланин (БГГФ)
О OO
/г-л Il Il Il
f ^—С—NH—CH
2
CNHCH
2
—С—NH—CH—COO
-
ООО
4- Тетра-ь-аланин
NH,-CH-С—NH-CH-C-NH-CH-С—NH-CH-COO
-
I I I I
CH
3
CH
3
CH
3
CH
3
5. Глицил-ь-тиро-
зин
о
+ Il
NH
3
CH
2
-C-NH-CO-COO"
Ациламинокисло-
TbL
о
1. Ацетил-L-фенил-
аланин
CH
3
-C-NH-CH-COO-
сн
2
-/~\
\ /
2. гранс-Цинна-
моил-Ь-фенил-
аланин
о
CH=CH—C—NH—CH—COO-
W
AH
^n
2
V у
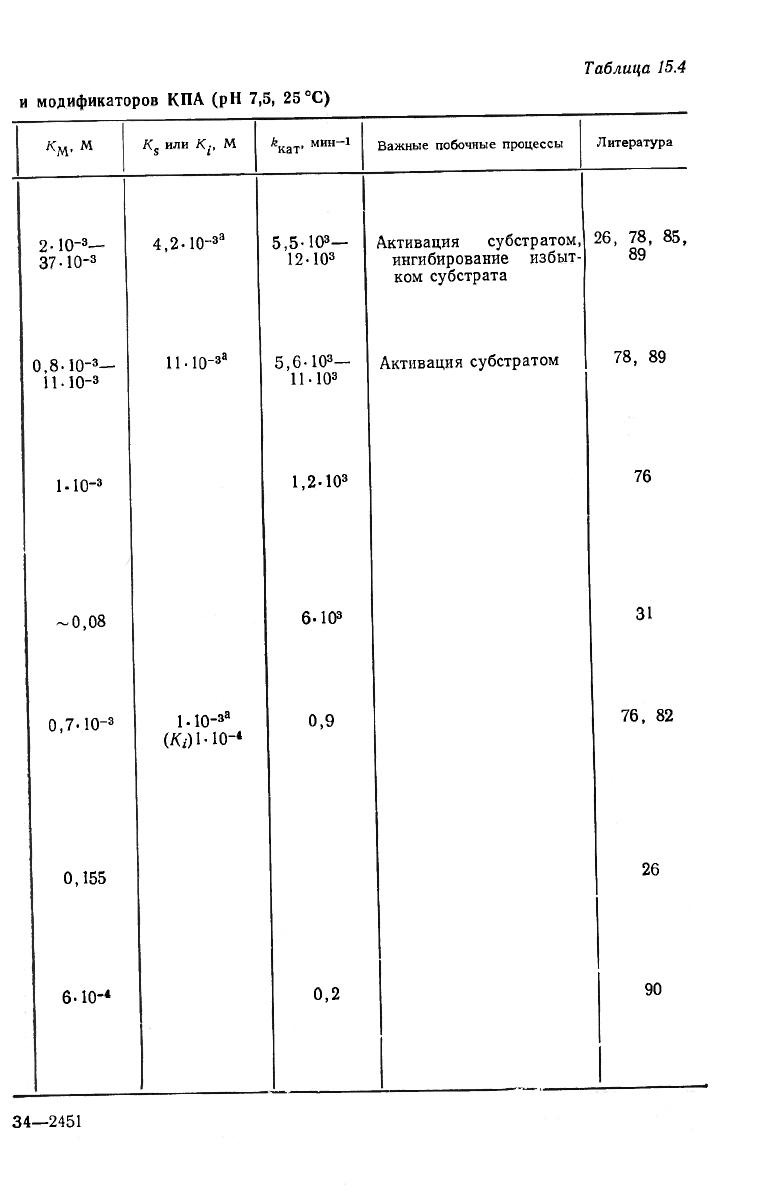
Таблица 15.4
и модификаторов КПА (рН 7,5, 25°С)
К
м
, M
K
s
или K
i
, M
k
Kar-
мин_1
Важные побочные процессы
Литература
2-Ю"
3
—
37-IO-
3
4,2-10-
3
'
5,5-Ю
3
—
12-IO
3
Активация субстратом,
ингибирование избыт-
ком субстрата
26, 78, 85,
89
о,елоз-
ило-
3
11•10"
за
5,6-IO
3
-
11•IO
3
Активация субстратом
78, 89
ыо-
3
1,2-IO
3
76
-0,08
6Л0
3
31
0,7-IO
-3
ыо-
за
(K
i
)
ыо-
4
0,9
76, 82
0,155
26
6Л0-
4
0,2
90
34—2451
Соединение
Структурная формула
Сложные эфиры
1- Бензоилглицил-
фениллактат
(гиппурил-Ь-фе-
ниллактат,
ГФЛ)
2. Циннамоил-L-
фениллактат
3. Гиппурилгли-
колат
4. Ацетилманделат
Ингибиторы
а) Продукты
1. L-Фенилаланин
2. L-Фениллактат
3. Циннамат
б) Аналоги
1. |3-Фенилпрапи'0-
нат
2. D-Фенилаланин
Модификаторы
1. Карбобензокси-
глицин
О О
/"A—C—NHCHa—C—O—CH-COO-
о
CH=CH-C-O-CH-COO
о о
/ V-С— NHCH
2
—C—0—CH
2
—C00-
0
Il
CHo-C -О—CH-СОО"
NH
3
-CH-COO-
(к-ГЛ
НО—CH-COO-
CH
2
-Q
-СН=СПСОО"
CH
2
-COO-
VO
сн^ГЛ
+ I
NH
3
-CH-COO-
O
// w—СН»—О—С—]
CH
2
-О—С—NHCH
a
COO
-
а
Присоединение к
КПА (метод гель-фильтрации).
Продолжение табл. 15.4
К
м
. M
K
s
или K
1
. M
k
KHT'
"И"-
1
Важные побочные процессы
Литература
5,1-10-
5
-
8,8-10-
5
28-IO
3
-
35-IO
3
Ингибирование избытком
субстрата
28, 78
1,5-10-
3
-
1,9-10-*
4,6-IO
3
90, 91
1,2-10-
3
4-IO
3
Активация субстратом
77
6. ю-
2
5,8-10-«
30
92
33, 78
91
0,005
Связывается не так, как
другие продукты?
90, 93
6,2-Ю-
5
—
19-IO-
5
Конкурентное, смешан-
ное неконкурентное
26, 76, 94,
95
0,002 26, 96
0,016-0,029
Активатор для ацил-
дипептидов, ингибитор
для эфиров и более
длинных пептидов
76, 79, 80

532
Г лава
10
конечно, не позволяет выразить k
KaT
и Км через индивидуальны!
константы скорости. Для большого числа субстратов, кинетика ре
акций с которыми не подчиняется уравнению Михаэлиса—Ментен
побочные пути учитывались введением соответствующих поправок
В таблице приведены некоторые константы связывания, использо
ванные ниже при обсуждении влияния модификации и замещенш
металла. Для субстратов приведены значения Км., определенные i
стационарной фазе реакции. Понятно, что предположение о равен
стве константы Михаэлиса равновесной константе связывания не
всегда справедливо для быстро превращающихся субстратов. Kai
видно, константы Км и £
К
ат не связаны простой пропорциональное
зависимостью [76], однако из рассмотрения параметров актнвацш-
гидролиза КГФ было заключено, что &
К
ат вносит вклад в Км [85]
Присоединение к апоферменту изучалось методом, основанном на
анализе влияния субстратов на скорость рекомбинации цинка и
апо-КПА [86]. Если скорость этого процесса в присутствии субст-
рата существенно уменьшается, то при добавлении цинка к смеси
фермента и субстрата и последующем быстром отделении белка
образование Zn-КПА пропорционально количеству КПА, не свя-
занной в комплекс с субстратом. Любые взаимодействия, не влия-
ющие на скорость рекомбинации с металлом, оказываются при
этом незамеченными. Более того, любое изменение равновесной
константы связывания металла под действием субстрата должно
вызывать обратное влияние металла на сродство к субстрату [87].
Качественные оценки связывания были получены также по зави-
симости скорости обмена металлов от природы субстратов и инги-
биторов [88].
Выведение общих правил на основании данных, приведенных в
табл. 15.4, представляется несколько опасным. Частично это объ-
ясняется заметной величиной поправок на существование множе-
ственных путей реакции, а кроме того, известным фактом влияния
таких переменных, как ионная сила, на кинетические параметры
для пептидов. Тем не менее можно отметить некоторые закономер-
ности. Увеличение субстрата в определенных пределах уменьшает
величину Км, что указывает на усиление взаимодействия с фер-
ментом (ср. ацетилфенилаланин, БГФ и БГГФ). Изучение эффек-
та заместителей для ряда пептидов на основе аланина подтверж-
дает это общее заключение [31]. Аномальная кинетика чаще на-
блюдается для малых субстратов. Например, ацилирование
трипептидов упрощает кинетические закономерности [31, 76]. Кро-
ме того, аномалии обычно связаны с присутствием ароматических
остатков в защитных группах [2]. Из сравнения изостерических
соединений ГФЛ и БГФ ранее был сделан вывод о том, что эфиры
связываются ферментом значительно прочнее соответствующих
пептидов. Однако для других субстратов это правило не всегда
сохраняется. Если малая величина Км для эфиров типа ГФЛ и
