Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


ГЛАВА 14
МЕТАЛЛОФЕРМЕНТЫ
М. С. Скраттон
Scrutton М. С, Department of Biochemistry, Rutgers Medicaf
School, Rutgers University, The State University of New
Jersey, New Brunswick, New Jersey 08903, USA
1. ВВЕДЕНИЕ
1.1. Роль ионов металлов в механизме
каталитического действия ферментов
Согласно Ленинджеру [1], примерно одна треть описанных к
1950 г. ферментов требовала для проявления своей максимальной
активности либо добавления иона металла, либо эти ферменты
содержали прочно связанный ион металла, по-видимому, прини-
мающий участие в каталитических процессах. С тех пор примене-
ние усовершенствованных методов анализа металлов в биологи-
ческих системах позволило выявить еще большое число фермен-
тов, относящихся к классу металлопротеинов. Кроме того, уста-
новлена ферментативная активность ряда металлопротеинов, для
которых ранее было показано наличие металла [2].
Целью настоящей главы является выяснение роли металлов
в ферментативном катализе, описание и оценка некоторых мето-
дов, применяемых для изучения роли металлов в ферментативных
реакциях, а также рассмотрение современных представлений об
участии ионов металлов в механизмах ферментативного катализа
дегидрогеназами, карбоксилазами и декарбоксилазами, изомераза-
ми, лиазами, альдолазами, трансферазами и синтетазами. После-
дующие главы этой части будут посвящены роли ионов металлов
в ферментативном катализе пептидазами (гл. 15), карбоангидра-
зами (гл. 16),киназами (гл. 17) и фосфатазами (гл. 18).
Мы не будем проводить здесь различий между металлофер-
ментами (ферментами, содержащими один или более прочно свя-
занных ионов металла) и металлактивируемыми ферментами (для
проявления максимальной каталитической активности которых
необходимо добавление ионов металла). Малмстрём и Розенберг
[3] подчеркивают, что во многих случаях не существует корреля-
ции между каталитической ролью иона металла и его сродством
к апоферменту. Из этого вытекает, что попытки разрешить проб-
лему, исходя из различия в сродстве ферментов к ионам метал-
лов, могут лишь сделать неясной сущность данного явления на
функциональном уровне [4, 5]. Например, фермент с резко выра-
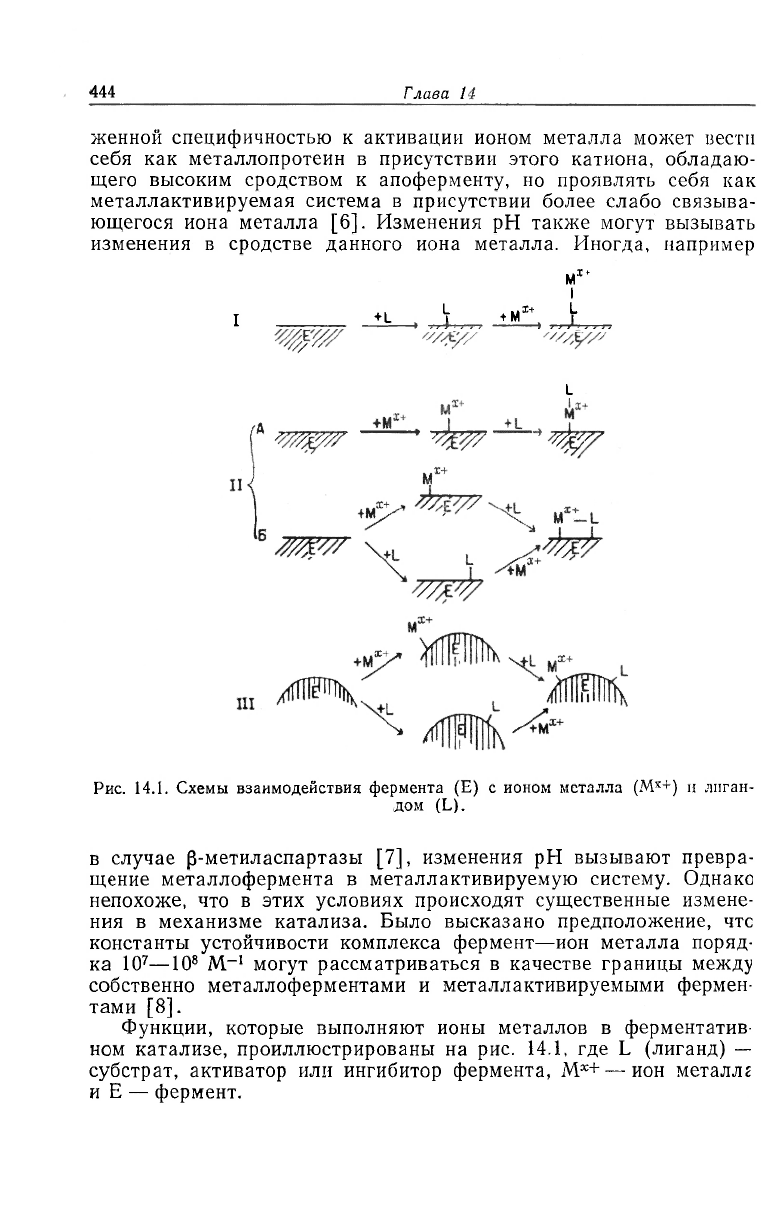
444
Г лава
10
женной специфичностью к активации ионом металла может вести
себя как металлопротеин в присутствии этого катиона, обладаю-
щего высоким сродством к апоферменту, но проявлять себя как
металлактивируемая система в присутствии более слабо связыва-
ющегося иона металла [6]. Изменения рН также могут вызывать
изменения в сродстве данного иона металла. Иногда, например
M
lf
I
I +L , ,Д.,,, +M
1
- }
L
Рис. 14.1. Схемы взаимодействия фермента (E) с ионом металла (М
х+
) и лиган-
дом (L).
в случае (5-метиласпартазы [7], изменения рН вызывают превра-
щение металлофермента в металлактивируемую систему. Однако
непохоже, что в этих условиях происходят существенные измене-
ния в механизме катализа. Было высказано предположение, чтс
константы устойчивости комплекса фермент—ион металла поряд-
ка IO
7
—IO
8
M
-1
могут рассматриваться в качестве границы между
собственно металлоферментами и металлактивируемыми фермен-
тами [8].
Функции, которые выполняют ионы металлов в ферментатив-
ном катализе, проиллюстрированы на рис. 14.1, где L (лиганд) —-
субстрат, активатор или ингибитор фермента, M
x
+ — ион металле
и E — фермент.

Металлоферменты.
445
1.2 Комплексы с лигандом в качестве мостика*
На рис. 14.1,1 изображен комплекс с лигандом в качестве
мостика (мостиковый лиганд). В этом комплексе ион металла свя-
зан только с лигандом и участвует в катализе, не взаимодействуя
непосредственно с ферментом. Комплексы с мостиковыми лиган-
дами характерны для многих ферментов, взаимодействующих с
комплексами M—НДФ- и M—НТФ
2-
, например для креатин-
киназы [9, 10], аргининкиназы [11], аденилаткиназы [12]
и тетрагидрофолатсинтетазы [13]. Описанию этих и других
киназ посвящена гл. 18. В двойном комплексе M
2
+* с АТФ
и АДФ как фосфатные группы, так и атомы азота пуринового
кольца образуют координационные связи с ионом металла [14,
15] (ср. гл. 33). В большинстве случаев АДФ
3-
— (или АТФ
4-
)
имеет примерно такое же сродство к ферментам, как и активный
комплекс M
2
+ —• нуклеотид, но действует как ингибитор реакции
[16]. Следовательно, роль иона металла в подобных комплексах
с мостиковым субстратом может заключаться в активации атома
фосфора, по которому протекает атака. Исключение, по-видимому,
составляет тетрагидрофолатсинтетаза [13] (разд. 12.2). Приме-
ров мостиковых комплексов с ингибитором (активатором) в каче-
стве мостика гораздо меньше, хотя влияние металлов на актив-
ность дТТФ (ингибитор) и дЦТФ (активатор) для дЦМФ-деами-
назы может быть объяснено образованием комплексов с мостико-
выми лигандами, так как эффекты активации и ингибирования
проявляются в присутствии Ca
2
+, Mg
3
+ и Mn
2
+ [17] (разд. 2.4).
1.3. Комплексы с металлом в качестве мостика
Еще одна возможность участия ионов металлов в ферментатив-
ном катализе заключается в образовании таких мостиковых ком-
плексов, в которых центром связывания лиганда является пол-
ностью (рис. 14.1, II, А), либо частично (рис. 14.1, II, Б) ион
металла. Существование мостикового комплекса ферменг •— ме-
талл—-субстрат впервые предположил Хеллерман [18] для объ-
яснения данных, полученных при активации аргиназ ионами ме-
таллов [19], а также для описания медленной металлзависимой
активации некоторых пептидаз [20]. Впоследствии концепция
мостиковых металлов была применена для объяснения металлза-
висимой активации многих ферментов, но до последнего времени
* Применяемые сокращения: СРП — скорость релаксации протонов (скорость
продольной ядерной магнитной релаксации протонов воды); ФЕП — фосфоенол-
пируват; M
2
+ — ион двухвалентного металла; M+ — ион одновалентного металла;
НМФ, НДФ и НТФ — нуклеозидмоно-, нуклеозидди- и нуклеозидтрифосфат;
ТДФ — тиаминдифосфат; ФДФ — фруктозо-1,6-дифосфат, тРНК или транспорт-
ная РНК — РНК, которая несет антикодоны.

446
Г лава
10
не было прямых доказательств существования комплексов с ме-
таллом в качестве мостика. Техника ядерного магнитного резо-
нанса (ЯМР), позволяющая проследить за внутренней координа-
ционной сферой некоторых парамагнитных ионов металлов, на-
пример Mn
2
+, применена и для изучения комплексов с мостиковым
металлом [21]. Первые исследования, в которых изучалась ско-
рость ЯМР-релаксации субстрата, однозначно доказали взаимо-
действие Mn
2
+ и фторфосфата с пируваткиназой из мышц кроли-
ка. Было показано, что при этом происходит образование мостико-
вого комплекса пируваткиназа — Mn
2
+ — фторфосфат. Свойства
этого комплекса согласуются с его предполагаемой ролью в ката-
лизе [22] (гл. 18). Впоследствии применение этого же метода
позволило установить существование комплексов фермент — ме-
талл—субстрат, фермент-—металл — продукт или фермент — ме-
талл—ингибитор еще для семи ферментов [8]. Эти исследования
будут детально рассмотрены в разделах, посвященных отдельным
ферментам (разд. 3—10) и в гл. 18.
Существование комплексов с мостиковым металлом также про-
демонстрировано с помощью рентгеноструктурного анализа (кар-
боксипептидаза) [23] (гл. 15) и инфракрасной спектроскопии
(карбоангидраза) [24] (гл. 16). Однако данные, доказывающие
существование мостиковых комплексов, полученные с помощью
этих методов, не позволяют установить, участвуют ли такие ком-
плексы в катализе. Выяснить это можно сравнением кинетических
и термодинамических свойств мостикового комплекса с аналогич-
ными параметрами, полученными при изучении самих процессов
катализа. В связи с этим метод ЯМР имеет существенные преиму-
щества перед другими методами (разд. 2.3). Однако важность
этого критерия не может быть преувеличена, поскольку в одном
случае был обнаружен комплекс с мостиковым металлом, не при-
нимающий участия в катализе [25].
Во всех мостиковых комплексах фермент — металл — лиганд
ион металла благодаря своим уникальным координационным
свойствам играет важную роль во взаимодействии белок — ли-
ганд. Однако обычно предполагается, что ион металла в комплек-
сах фермент — металл — субстрат оказывает также и каталитиче-
ское влияние [8]. Предположение о каталитической роли часто
вытекает из рассмотрения катализа ионами металла в модельных
системах, которые лишь имеют сходство с биологическими реак-
циями [8, 26, 27]. Хотя предположение о каталитическом участии
ионов металла и весьма привлекательно, однако убедительные
доказательства их каталитической роли в биологических системах
были получены лишь в нескольких случаях. Итак, роль иона ме-
талла в связывании и в катализе в биологических системах не
легко разделить, а модельные исследования обладают лишь неко-
торой степенью приближения.

Металлоферменты.
447
Часто ион металла, весьма эффективный при катализе в мо-
дельных системах, в биологической реакции либо неактивен, ли-
бо малоэффективен. Такая ситуация хорошо исследована для ре-
акций декарбоксилирования оксалоацетатов [28, 29] и гидролиза
пептидных связей [30]. Более того, хотя катализ в биологических
системах и должен подчиняться основным физическим и химиче-
ским законам, наличие третичной и четвертичной структур белков
может стабилизировать такие комплексы и способствовать таким
эффектам, например прямому переносу протона [31], которым
трудно найти аналогии в модельных системах. Эти положения
проиллюстрированы Вангом и сотрудниками на примере механиз-
мов, предложенных для химотрипсина [32] и карбоангидразы
[33]. Расхождение между Вангом и Каплоу во взглядах на воз-
можную роль белкового фермента отражено в дискуссии в гл. 16,
посвященной карбоангидразе [33]. Таким образом, хотя модель-
ные системы во многих случаях и дают полезную информацию,
необходимо соблюдать осторожность при экстраполяции этих
данных на каталитическую роль иона металла в комплексах с
мостиковым металлом.
Вейлли и Уильяме [34] предположили, что окружение иона ме-
талла в ферменте может создавать «энтатное» состояние в отсут-
ствие субстрата. «Энтатное» состояние определяется как «сущест-
вование в ферменте группировок с энергией, более близкой к энер-
гии мономолекулярного переходного состояния, чем к энергии
обычной стабильной молекулы, и, таким образом, образующих
энергетически богатую область» [34]. В случае металлоферментов
этот постулат основывается на изменении абсорбции, электронно-
го парамагнитного резонанса (ЭПР) и (или) спектров дисперсии
оптического вращения (ДОВ) и окислительно-восстановительных
потенциалов некоторых медь-, железо- и кобальтсодержащих фер-
ментов, для которых не найдено объяснения при сравнении их
свойств со свойствами обычных комплексов этих металлов с ма-
лыми молекулами или комплексов металл — белок, не обладаю-
щих каталитической активностью (см. библиографию в статье
Вейлли и Уильямса [34]). Однако «энтатные» спектры поглоще-
ния, полученные для ряда кобальтсодержащих ферментов, во мно-
гом походят на спектры поглощения комплексов, содержащих пя-
тикоординационный Со
2
+ [37а, б]. Нет также полной корреляции
между аномальными спектрами или окислительно-восстановитель-
ными свойствами, которые могут быть следствием асимметричной
или искаженной координации [34], и наблюдаемой каталитиче-
ской активностью. Так, например, Со
2
+-комплексы пируваткиназы
[35] и пируваткарбоксилазы [36] каталитически активны, но
имеют спектр, характерный для октаэдрических комплексов Со
2
+.
Определение скоростей обмена лиганда на связанных с белком
ионах металлов также не дает убедительных доказательств нали-

448
Г лава
10
чия необычных кинетических свойств, которые могли бы быть ха-
рактерны для активированного состояния [8, 37]. Однако до сих
пор не проводились кинетические исследования металлофермен-
тов, имеющих спектральные или окислительно-восстановительные
свойства, характерные для «энтатного» состояния.
Существуют по меньшей мере два пути образования комплек-
сов с мостиковым металлом в тех случаях, когда металл не обра-
зует предварительно прочной связи с ферментом (рис. 14.1):
E + M
2
+ <—>- E — M
2
+ + лиганд <—>- E — M
2
+ — лиганд (1)
E
-]-
лиганд < > E — лиганд -(-M
2+
< > E — M
2+
— лиганд (2)
Возможен и третий путь, если несвязанный ион металла проявля-
ет значительное сродство к лиганду:
M
2+
-f лиганд -<—>- M
2+
— лиганд + E •<—>- E — M
2+
— лиганд (3)
Чтобы определить путь, по которому протекает на самом деле об-
разование мостикового комплекса, необходимо исследовать на-
чальную скорость реакции и скорости связывания лиганда и ме-
талла, причем образование мостикового комплекса фермент — ме-
талл — лиганд должно протекать в кинетически контролируемой
стадии. Однако до сих пор лишь для немногих систем проведено
столь детальное кинетическое исследование. Для пируваткиназы
из мышц [35, 38, 39] данные, описывающие механизм образова-
ния комплексов мостиковых металлов с ФЕП и АДФ, хорошо
согласуются со всеми тремя возможными путями их образования
(ср. гл. 18). Эти данные противоречат предположению [16] о том,
что все комплексы нуклеотидов с ферментами, в которых прини-
мают участие ионы двухвалентных металлов, образуются в ре-
зультате взаимодействия фермента с комплексом металл — лиганд
[уравнение (3)].
1.4. Комплексы с ферментом в качестве мостика
Ион металла может также взаимодействовать с ферментом не
по тому месту, по которому связывается лиганд. Это взаимодей-
ствие может вызывать изменение в свойствах каталитического
центра (или центра связывания лиганда). В таких комплексах
фермент играет роль мостика между лигандом и металлом
(рис. 14.1, III). В противоположность комплексам с мостиковыми
металлами или мостиковыми лигандами (разд. 1.2 и 1.3) в случае
этих комплексов уделялось мало внимания механизмам с их уча-
стием, хотя многие эффекты иона металла могут быть объяснены
образованием комплексов с мостиковым ферментом. Например
действие ионов одновалентных металлов на каталитические свой-
ства многих ферментов обусловлено стабилизацией каталитичесю
активного состояния путем образования комплекса с мостиковым
ферментом [40—42] (было предложено также и другое объяспе-

Металлоферменты 449
ние [43]). Аналогичным образом восстановление активности глут-
аминсинтетазы из Escherichia coli при действии ионов некоторых
двухвалентных металлов, возможно, обусловлено стабилизацией
активной конформации этого фермента [44]. Образование ком-
плексов с мостиковым ферментом часто сопровождается измене-
ниями в параметрах, которые отражают конформацию данного
фермента [44—46]. Однако эти эффекты не характерны для об-
разования только комплексов с мостиковым ферментом, поскольку
при образовании комплексов с мостиковым металлом взаимодей-
ствие металл — фермент также вызывает сходные изменения в па-
раметрах, отражающих конформацию белка [45].
Следует отметить, что для работы многих ферментов требуется
несколько ионов металлов, что может означать участие в меха-
низме катализа сразу нескольких типов мостиковых комплексов.
Так, например, для ацетил-КоА-синтетазы необходимы три иона
металла [47, 48].
2. ЭКСПЕРИМЕНТАЛЬНЫЕ ПОДХОДЫ К ИЗУЧЕНИЮ
МЕТАЛЛОФЕРМЕНТОВ
2.1. Общее рассмотрение
Многие из общих подходов к исследованию механизма дейст-
вия ферментов также применимы и к изучению роли ионов ме-
таллов в ферментативном катализе. Схемы координации, описы-
вающие взаимодействие фермента, металла и лиганда, могут быть
изучены методами, применяемыми при определении стехиометрии
и сродства связывания белками небольших молекул. Эти методы
включают гель-фильтрацию в присутствии или в отсутствие не-
больших молекул [49], метод скоростного диализа [50], ультра-
фильтрацию, метод ультрацентрифугирования по Хейесу — Вели-
ку [52], равновесный диализ [53], а также методы для измерения
только сродства взаимодействия [54—58]. Выбор схемы коорди-
нации ионов металлов и лигандов с ферментами с помощью этих
методов возможен только при отсутствии влияния других факто-
ров. Например, если образуется комплекс E — лиганд — M
2
+, фер-
мент должен проявлять значительное сродство к иону металла
только в присутствии лиганда. И, наоборот, если образуется ком-
плекс E — M
2
+ — лиганд, то не должно происходить значительно-
го связывания лиганда в отсутствие иона металла. Однако прак-
тически ферменты часто проявляют склонность к связыванию обо-
их компонентов комплекса, невзирая на выбранную схему коорди-
нации. Следовательно, важны данные, полученные с учетом сте-
хиометрических и кинетических критериев. Такие важные типы
комплексов, как E — лиганд — M
2
+ и E — M
2
+ — лиганд, обычно
содержат все три компонента в эквимолярных количествах. Более
29—2451

450 Г лава
10
того, если данный комплекс важен при катализе, то константы
диссоциации, измеренные при изучении связывания, должны при-
ближаться к константам, определенным при изучении начальной
скорости реакции в целом, хотя различие в используемых концен-
трациях белка может вызвать в некоторых случаях трудности при
интерпретации. Необходимые константы могут быть получены из
изучения начальной скорости для иона металла (KA)
И
ДЛЯ лиган-
да, если он является ингибитором [Ki). Однако константы диссо-
циации комплексов фермент — субстрат и фермент — продукт не
так легко получить, пока не сделаны допущения относительно
скоростьопределяющей стадии реакции и (или) порядка присоеди-
нения субстрата (или отщепления продукта). Следовательно,
утверждение о кинетической важности таких комплексов, наибо-
лее интересных с точки зрения изучения механизма действия ме-
таллоферментов, связано с большими сложностями.
Для выяснения роли ионов металлов в ферментативном ката-
лизе было изучено изменение начальных скоростей реакции как
функции концентрации субстрата и иона металла. Хотя Малмст-
рём и Розенберг [3] показали, что реакции образования комплек-
сов E — M
2
+ — субстрат и E — субстрат—-M
2
+ для односубстрат-
ных систем имеют сходные кинетические уравнения, в случае мно-
госубстратных систем можно определить порядок при-
соединения иона металла и субстрата по методу Клеланда [59,
60] с введением соответствующих поправок на взаимодействие
металл — субстрат*. Некоторые примеры с использованием этого
подхода будут обсуждаться в следующих разделах (см. также
гл. 18). В этой связи необходимо заметить, что часто неудовлет-
ворительной является практика поддержания постоянной и насы-
щающей концентрации иона металла в ходе изучения кинетики
при выяснении влияния порядка присоединения субстрата и (или)
отщепления продуктов. Во многих системах незакомплексованный
M
2
+ действует как активатор или как ингибитор реакции. Более
того, в случае слабых комплексов, например А^АДФ
-
, относи-
тельная концентрация промежуточных соединений является функ-
цией общей концентрации обоих компонентов комплекса [16].
Наконец, схема координации при взаимодействии ферментов
с ионами металлов и лигандами может быть изучена с помощью
рентгеноструктурного анализа, хотя до сих пор этим методом бы-
ла исследована детально только карбоксипептидаза [23]. Однако
наряду с достоинствами этот метод обладает и рядом недостатков.
Во-первых, рентгеноструктурный анализ можно применять для
* В настоящее время нет хороших обзоров по всем аспектам ферментативной
кинетики. Простую обработку кинетических данных обычных субстратных систем,
куда входит определение Km (константы Михаэлиса) и Ki (константы ингибиро-
вания), можно найти в статье [60а]. Кинетика сложных субстратных систем
лучше всего описана в статьях [59, 60, 606].

Металлоферменты
451
изучения только статического связывания и с его помощью нельзя
оценить кинетическую значимость исследованного комплекса. Во-
вторых, в настоящее время рентгеноструктурные исследования
ограничены изучением комплексов ферментов с самыми простыми
субстратами или ингибиторами. Хотя структуры таких комплек-
сов достаточно интересны, выводы о нормальной каталитической
функции фермента, основанные на изучении комплексов с просты-
ми субстратами, могут оказаться неправильными, поскольку в ре-
зультате изменения характера комплексообразования может на-
блюдаться изменение в каталитической активности. Аналогичные
рассуждения справедливы и при изучении взаимодействия лиган-
дов с ферментсвязанным ионом металла методом инфракрасной
спектроскопии [24].
Все методы, которые мы обсудили, применимы для изучения
механизмов действия любых ферментов независимо от того, вклю-
чают они ион металла или нет. Однако имеются три метода, более
широкое применение которых в изучении металлоферментов осно-
вано на уникальных свойствах ионов металлов. Эти методы будут
рассмотрены более детально, а именно: 1) исследование спектров
ЭПР; 2) измерение парамагнитного вклада в скорости ядерной
магнитной релаксации магнитных ядер (например, протонов) в
лигандах; 3) изучение замены одного металла на другой.
2.2. Электронный парамагнитный резонанс
Теоретические основы применения ЭПР-спектроскопии для ис-
следования окружения парамагнитных ионов металла по характе-
ру влияния поля лиганда на неспаренные электроны были описа-
ны ранее [62]. В данном разделе обсуждается применение метода
ЭПР для изучения металлоферментов.
Во-первых, сверхтонкая структура ЭПР-спектра при высокой
степени разрешения, какая, например, была получена для ком-
плексов Fe
3
+ и Cu
2
+, может экспериментально идентифицировать
природу и число связанных лигандов [63]. Эффективность метода
может быть повышена включением магнитных ядер в лигандные
группы белка. Возможности подобного изотопного замещения бы-
ли проиллюстрированы изучением ЭПР-спектров негемовых желе-
зосодержащих белков [64, 65], в которых атом
32
S был заменен
на
33
S и
77
Se. Спин-спиновое взаимодействие дало сверхтонкое
расщепление, которое позволило довольно точно определить при-
роду лигандов, поскольку в данном случае тонкое спин-спиновое
взаимодействие могло протекать только через химические связи
[66].
Аналогичный подход может быть применен и для того, чтобы
установить существование комплекса E — M
2
+ — лиганд, если
в лиганде присутствуют магнитные ядра. Так, этим методом бы-
ла показана непосредственная координация
19
F- с железом в мет-
29*

452
Г лава
10
миоглобинфториде [67]. И, наоборот, отсутствие ожидаемого
сверхтонкого расщепления ЭПР-сигналов исключает металл-ли-
гандное взаимодействие в комплексе с ферментом [68]. Попытки
распространить этот метод на ферменты, содержащие другие ме-
таллы, например Mn
2
+, оказались неудачными из-за сложности
полученных ЭПР-спектров и уменьшения степени разрешения
спектра при комплексообразовании. Однако недавно для
Мп
2
+-комплекса конканавалина А [69] были получены хорошо
разрешенные ЭПР-спектры, что показывает возможность исполь-
зования ЭПР-спектров этого иона металла для исследования вы-
сокомолекулярных комплексов.
Во-вторых, для изучения схемы координации может быть ис-
пользована чувствительность амплитуд ЭПР-спектров Mn
2
+ к его
окружению. Так, например, если образуется комплекс E — Mn
2
+ —
лиганд, то наблюдаемая амплитуда комплекса Mn
2
+ — лиганд
должна уменьшиться при добавлении фермента. Если же ампли-
туда ЭПР-спектра комплекса Mn
2
+ —лиганд не изменяется при
добавлении фермента, в то время как другие данные показывают
образование тройного комплекса, то это означает, что образуется
комплекс E — лиганд •— Mn
2
+. Такая ситуация наблюдалась при
взаимодействии МпАДФ~ с креатинкиназой [9].
В-третьих, введение в биологические системы стабильных ор-
ганических молекул, содержащих свободные радикалы (спиновые
метки) [71], расширяет возможности использования ЭПР для
изучения таких спин-меченых систем. Спиновые метки могут быть
присоединены к остатку аминокислоты в активном центре фер-
мента или около него [72], а также могут быть включены в ана-
лог субстрата [73]. В любом из этих случаев может быть оцене-
на степень иммобилизации спиновой метки, связанной с белком,
путем сравнения ЭПР-спектров для свободного и связанного со-
стояний, а также может быть изучено действие различных аген-
тов, например диамагнитного иона металла, на окружение спино-
вой метки [72]. В таких экспериментах спиновая метка действует
как детекторная группа [74] и обнаруживается с помощью спек-
тров ЭПР. Однако в присутствии парамагнитных ионов, например
Mn
2
+ и Со
2
+, спин-спиновые взаимодействия преобладают над
процессами релаксации и вызывают заметное уменьшение ампли-
туды ЭПР-сигналов, обусловленных спиновой меткой, поскольку
спины ведут себя так, как будто бы они зафиксированы в жесткой
решетке [74а]. Этот эффект позволяет рассчитать расстояние меж-
ду спинами с учетом времени корреляции диполь-дипольного взаи-
модействия [72, 74а]. Таким образом, использование специфич-
ных спиновых меток для различных аминокислотных остатков или
для различных участков активного центра делает возможным соз-
дание карты активных центров металлоферментов [746].
