Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Активация малых молекул при координации с металлами
423
но тем не менее быть необходимым для проявления его активно-
сти. Таким образом, наряду с ферментами, у которых ион метал-
ла является составной частью активного центра, может наблю-
даться и рассмотренный выше тип активации, при котором ион
металла удален от активного центра.
2. ОСНОВНЫЕ ЭФФЕКТЫ КООРДИНАЦИИ
В результате присоединения лиганда к положительно заряжен-
ному иону металла электронная плотность смещается в направ-
лении этого иона. Теория молекулярных орбиталей для комплек-
сов, в которых л-взаимодействие не играет существенной роли,
приводит, по существу, к такому же результату. С наибольшей
уверенностью этот вывод применим к комплексам жестких осно-
ваний с жесткими кислотами [1]. Если я-связывание становится
существенным, следует учесть, что эффект будет уменьшаться за
счет «обратного донирования» от металла к лиганду или увели-
чиваться при прямом я-донировании.
При взаимодействиях типа жесткое основание — жесткая кис-
лота (гл. 2) поляризация лиганда может вызвать следующие ха-
рактерные последствия:
1) увеличение кислотности атомов водорода при донорном
атоме;
2) облегчение атаки лиганда нуклеофилами и затруднение ата-
ки электрофилами;
3) «маскирование» некоторых реакций свободного лиганда,
зависящих от стерических или электронных взаимодействий, кото-
рые затрудняются или становятся невозможными при координа-
ции.
Помимо перечисленных выше эффектов при координации воз-
можно изменение окислительно-восстановительных свойств лиган-
да или в случае лигандов, способных к таутомерии, смещение
таутомерного равновесия в сторону таутомера, образующего бо-
лее устойчивые комплексы. Большинство этих общих следствий
было впервые четко сформулировано Меервейном в конце 20-х го-
дов [2].
Увеличение кислотности атомов водорода при донорном атоме
впервые наблюдал Вернер [3], который обнаружил, что кислотные
свойства координированных молекул воды или аммиака увеличи-
ваются в зависимости от природы центральных атомов в ряду
Co
3+
<Cr
3+
-<Ru
4+
<Pt
4+
. Универсальность этого явления была
продемонстрирована на большом числе комплексов. Сравнение
свойств свободных и координированных молекул воды можно про-
вести на примере [Cu (H
2
O) 4]
2+
- Константа равновесия, равная
1,07-10~
8
для реакции
[Cu(H
3
O)
4
]
2+
[Cu(H
2
O)
3
(OH)]
+
+H
+

424
Г лава
10
примерно в IO
7
раз превышает аналогичное значение для чистой
воды [4]. Подобное повышение кислотности обнаружено также
для органических лигандов, у которых атомы водорода соединены
с донорными атомами [5, 6].
Тот факт, что нуклеофильная атака координированной частицы
происходит легче, был использован в конце 40-х — начале 50-х
годов [7] для объяснения роли ионов металлов в некоторых фер-
ментативных реакциях и еще раньше был замечен Геллерманом
[8]. Реакции этого типа с участием воды наиболее многочислен-
ны. Сюда относятся реакции гидролиза простых частиц, таких,
как. S
2
Op [9], и конденсированных фосфатов, а также более
сложных соединений [10]—пептидов, производных аминокислот
и фосфорных эфиров. Ниже эти реакции будут рассмотрены бо-
лее подробно.
Маскирование реакций лигандов -— одно из первых свойств
комплексов, которое привлекло внимание исследователей. Тот
факт, что координированный органический лиганд менее чувстви-
телен к действию типичных окислителей, был замечен еще в 1857 г.
[11]. Имеется много примеров подобного маскирования, причем
в большинстве из них донорные атомы участвуют в окислительно-
восстановительных процессах. Есть данные по маскированию ко-
ординированного оксалата при действии на него брома [12], по
защите ЭДТА от действия перманганата [13] и ОЭДТА в реакции
с ванадатом [14]. Также давно замечено, что координированные
анионы не дают характерных для них реакций осаждения или
теряют присущие им основные свойства (например, NH
3
в
[Co(NH
3
)
6
]
3
+). Наконец, маскирование определенных реакций при
координации может играть существенную роль в биологии.
Для больших полидентатных доноров особенно важен еще один
эффект координации — фиксация донорных атомов в определен-
ных положениях друг относительно друга. Создание определенной
конформации лиганда при координации стимулирует реакции, тре-
бующие именно этой конформации, и затрудняет или делает невоз-
можным протекание других реакций.
Последний эффект координации, на котором следует остано-
виться, сводится к активации малых молекул в реакциях с соот-
ветствующими реагентами. Этот эффект часто связан с нуклео-
фильной атакой и поэтому может стимулировать некоторые окис-
лительно-восстановительные реакции.
3. КАТАЛИЗ НУКЛЕОФИЛЬНОЙ АТАКИ
Основным следствием координации субстрата с положительно
заряженным ионом металла является катализ нуклеофильной ата-
ки. Причина его кроется в более благоприятных электростатиче-

Активация малых молекул при координации с металлами
423
ских взаимодействиях в комплексе. Согласно Лейдлеру [15], для
моделей, активированный комплекс которых состоит из двух сфе-
рических реагентов, можно оценить электростатический вклад
(в энтропийных единицах) в энергию активации следующим об-
разом:
AS^ =—IOZAZB (ДЛЯ воды как растворителя)
Если Z
a
— заряд атакующего реагента, ZB
1
— заряд лиганда, а
ZB
2
— заряд иона металла до координации, то
AS^
IRAIWA
=-IOZ
A
ZB
1
Д^
ОМПЛЕКСА
=-IOZ
A
(ZB
1
+ ZB
2
)
Тогда изменение энтропии в процессе комплексообразования
ДА S* = —IOZ
A
ZB
2
Можно записать альтернативное выражение для активированного
комплекса, состоящего из одной сферы, однако его использование
потребует знания радиусов активированного комплекса и реаген-
тов. Рассчитанное значение изменения энтропии активации зави-
сит от природы растворителя и заряда частиц, атакующих суб-
страт. Если растворителем является вода и атакующие частицы
несут положительный заряд, то при координации энтропия примет
более отрицательное значение и достижение переходного состоя-
ния будет затруднено. При атаке отрицательно заряженными час-
тицами эффект будет обратным.
Используя аналогичные модели, можно рассчитать отношение
констант скоростей реакций лиганда и комплекса. Для простой
двухсферной модели результат можно записать так:
. kc ZMZBE
2
ln
kf ed
AB
kT
где k
c
— скорость реакции комплекса, kf — скорость реакции сво-
бодного лиганда, ZM — заряд комплекса металла без учета ли-
ганда, Zb — заряд атакующей частицы, е — диэлектрическая про-
ницаемость реакционной среды, d
A
в — расстояние между субст-
ратом и атакующей частицей в активированном комплексе (одина-
ковое для реакций комплекса и свободного лиганда), k — посто-
янная Больцмана и T — абсолютная температура. Аналогичное
уравнение можно вывести для ион-дипольных реакций.
Рассматривая такую модель, мы всегда ожидаем, что нуклео-
фильная атака ускоряется в результате координации с катионом,
и полагаем, что это ускорение тем сильнее, чем больше заряд ка-
тиона и чем ниже диэлектрическая проницаемость растворителя.
Большой недостаток этой модели состоит в том, что она не учиты-
вает жесткой или мягкой природы взаимодействующих частиц и

426
Г лава
10
поэтому неадекватно отражает специфику каталитических процес-
сов этого типа. Можно вывести более совершенное уравнение, од-
нако для этого нужно более детально описать переходное состоя-
ние.
Перечисляя типы таких реакций, следует назвать все примеры
катализа нуклеофильной атаки ионом металла, приведенные в
обзоре Бендера [10] и иллюстрирующие их широту и общность.
Тут и реакции гидролиза ангидридов кислот, эфиров и амидов
карбоновых кислот, фосфорных эфиров и оснований Шиффа, реак-
ции карбоксилирования и декарбоксилирования, переаминирова-
ния, гидратации, гидрирования, расщепления простых эфиров и
различные процессы, сходные с более тщательно исследованной
группой реакций, в которых протон катализирует атаку ряда дру-
гих нуклеофилов (кроме ОН
-
). Большое преимущество ионов ме-
талла перед протоном во многих реакциях этого типа заключает-
ся в том, что они могут эффективно катализировать процесс в рас-
творах со значительно большим рН. По этой причине такие ионы
металлов были названы «суперкислотами» [16]. Это название
справедливо особенно в тех случаях, когда ион металла образует
хелат, значительно более эффективный в катализе, нежели протон
[17]. Если же ион металла координирует лиганд только по одному
месту, то в этом случае его поляризующее действие и каталитиче-
ская активность обычно не выше, чем у протона; однако ион ме-
талла может проявить свойства «суперкислоты», действуя в обла-
сти рН, не доступной для протона.
4. НЕКОТОРЫЕ ВАЖНЫЕ ГИДРОЛИТИЧЕСКИЕ ПРОЦЕССЫ
В качестве примера того, как координация способствует нук-
леофильной атаке лиганда, рассмотрим некоторые гидролитиче-
ские процессы, служащие «модельными» системами для ряда фер-
ментативных реакций. Эти хорошо изученные системы включают
каталитический гидролиз эфиров аминокислот, пептидных и фос-
фатных связей.
Во всех реакциях термодинамическая устойчивость образую-
щихся комплексов играет главную роль в проявлении катализа.
Если ион металла и молекула лиганда не образуют комплекса, то
экспериментально наблюдается только реакционная способность
свободного лиганда. В водном растворе ион металла конкурирует
с ионом водорода за координацию с лигандом. При увеличении
кислотности реакционной среды уменьшается концентрация не
только нуклеофильного агента — ионов гидроксила (молекулы
воды, хотя и в меньшей степени, также могут выступать в роли
нуклеофила), но и образующегося комплекса. С другой стороны,

Активация малых молекул при координации с металлами
427
при увеличении основности среды происходит гидролиз ионов
металла, приводящий к образованию нерастворимых, а следова-
тельно, и неактивных гидроокисей. Поэтому в большинстве слу-
чаев для проведения каталитического процесса используют огра-
ниченную область рН.
Сравнивая наблюдаемые скорости гидролиза и истинные ско-
рости гидролиза комплексов, содержащих различные лигандные
частицы, нужно учитывать состав раствора. Лиганд в каждом
комплексе подвергается щелочному гидролизу с характерной для
него скоростью, а наблюдаемая общая скорость складывается из
частных скоростей реакций всех присутствующих в реакционной
системе частиц:
"набл.
= у
своб.лиганда
a
KOMmieKca
1
у
комплекса
2
Теперь рассмотрим каталитическую активность комплексных
соединений в реакциях гидролиза лигандов различных классов.
4.1. Эфиры аминокислот
Впервые о катализе щелочного гидролиза эфиров аминокислот
ионами металлов сообщил Кролл в 1952 г. [18]. Впоследствии
многие исследователи изучали эти каталитические реакции и
полностью выяснили роль ионов металла в ускорении гидролиза
[19].
С точки зрения электростатических эффектов следует ожидать,
что координация эфира аминокислоты с положительно заряжен-
ным ионом металла или комплексом будет увеличивать скорость
щелочного гидролиза, так как эта реакция включает нуклеофиль-
ную атаку лиганда. В первом приближении скорость каталитиче-
ского процесса будет определяться главным образом электроста-
тическим зарядом реагирующего комплекса. Обычно это действи-
тельно так: большинство трехзарядных комплексов ускоряют
гидролиз в растворах с рН 3, двухзарядные комплексы — при
рН 5—7, а однозарядовые — в более щелочных растворах, при
рН>7 [17, 20, 21].
Для более точной оценки влияния ионов металла на гидролиз
эфира следует более детально разобраться в процессе взаимодей-
ствия лиганда и металла. В большинстве случаев эфир координи-
руется с металлом, используя в качестве донорного атома только
аминный азот. Карбонильная группа эфира, как и карбоксильная
группа соответствующей аминокислоты, обладает слабыми нук-
леофильными свойствами и не склонна к хелатообразованию. Од-
нако, если в качестве катализатора использовать более электро-
фильный ион металла или комплекс, между металлом и карбони-
лом наблюдается слабое взаимодействие, сопровождающееся
428
Г лава
10
поляризацией карбонильной связи. Эффект хелатообразования
изображен на приведенной ниже схеме:
R-CH-C
,O-R'
Ч
H
2
N
О
6
+
.O-R'
R-CH-C;
H
2
N
M
/
Об"
Заметим, что при образовании хелата карбонильная группа поля-
ризуется, причем ее углеродный атом становится более электро-
фильным. Теперь уже не только облегчается нуклеофильная ата-
ка комплекса, но и активированные центры лиганда становятся
местом атаки. В случае Cu(II), катализирующей гидролиз этил-
одиноковая конфигурация
противоположная конфигурация

Активация малых молекул при координации с металлами
429
глицината, увеличение скорости реакции почти в 200 раз больше,
чем допускают электростатические соображения [22]. Буш [20]
продемонстрировал аналогичный эффект для Co(III), катализи-
рующего гидролиз координированных эфиров аминокислот.
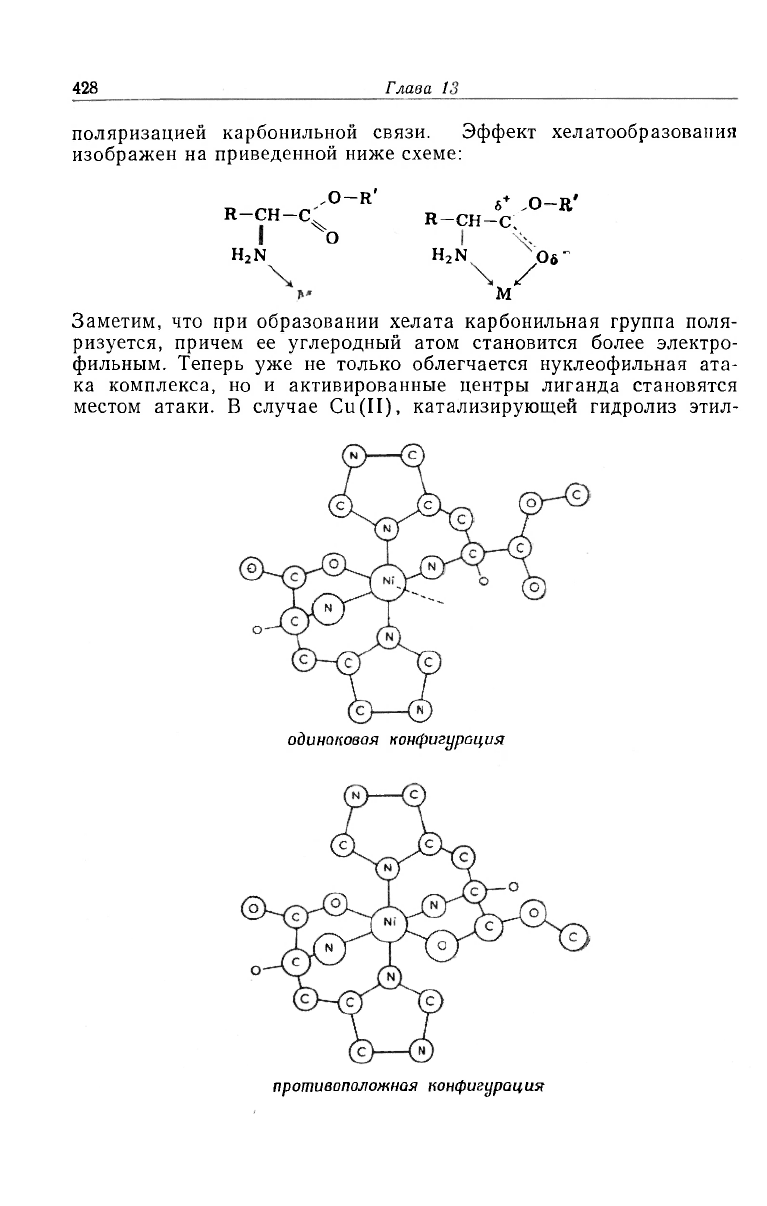
Из-за асимметрии ia-углеродного атома всех аминокислот и их
производных (за исключением глицина) в структуре и реакциях
комплексов, образованных этими лигандами, может проявляться
стереоселективность. Стереоселективность этого типа была обна-
ружена только в тех случаях, когда лиганд первоначально имел,
кроме потенциально координируемой эфирной группы, по крайней
мере два донорных атома, как, например, у гистидина [23]. При
гидролизе эфиров гистидина в присутствии D- и l-изомеров гис-
тидинатоникеля(II) для непосредственного взаимодействия кар-
бонильных групп с ионом металла эфир гистидина и гистидинат
в никелевом комплексе должны иметь противоположные конфи-
гурации. Если они имеют одинаковую конфигурацию, то в этом
случае эфирная группа удалена от иона металла и их непосредст-
венного взаимодействия не происходит.
4.2. Пептидные связи
Полипептиды и амиды аминокислот также подвергаются ка-
талитическому гидролизу. Однако каталитические эффекты часто
выражены не так ярко, как в случае гидролиза эфиров. Широко
используются четырехвалентные металлы типа тория (IY) и це-
рия (III), а также ряд более тяжелых трехвалентных металлов
[24].
Было показано, что при гидролизе пептидных связей цис-гид-
роксиаквотриэтилентетраминкобальтом (III) избирательно отщеп-
ляются N-концевые аминокислоты [25]. Комплексы этого типа
координируют концевую аминогруппу и за счет индуктивного эф-
фекта помогают разорвать связь с остатком следующей аминокис-
лоты. Они широко используются при определении аминокислотной
последовательности пептидных фрагментов.
4.3. Фосфатные связи
Было также обнаружено каталитическое расщепление фосфор-
ных эфиров [26], ацилфосфатов [27] и полифосфатов [28]. Связи
в этих соединениях гидролизуются тоже не так легко, как в эфи-
рах аминокислот, но при использовании высокозаряженных
комплексов и (или) при повышенной температуре эти системы
гидролизуются довольно быстро. В гл. 17 такого рода реакции
будут рассмотрены детально.

4
430
Глава 13
5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
СВОЙСТВА ЛИГАНДОВ
При координации окислительно-восстановительные свойства
лигандов меняются незначительно, однако имеются данные о том,
что ион металла, обладающий окислительными или восстанови-
тельными свойствами, может изменить это общее положение. Изу-
чение поведения таких частиц, как галогенид-ионы, показало, что
координация делает их более устойчивыми по отношению к внеш-
ним окислителям; примером могут служить рекации окисления 1~
в [HgI
4
]
2-
или Br
-
в [HgBr
4
]
2-
. В значительной степени это яв-
ление можно отнести за счет уменьшения доступности электрон-
ных пар лиганда внешним реагентам. Если ион металла сам яв-
ляется окислителем, то координация будет способствовать окисле-
нию лиганда, что подтверждается на примере многоступенчатых
окислителей.
Так, при окислении ионами MnO
4
или СгО|~ скорость первой
стадии реакции часто меньше, чем последующих стадий, в кото-
рых участвуют ионы марганца и хрома в низших степенях окис-
ления, способные координировать окисляемый лиганд. Сам факт
координации, при котором происходит смещение электронной
плотности лиганда в сторону льюисовской кислоты должен уве-
личивать окислительную способность комплексных частиц. Хотя
эту гипотезу трудно проверить, но для Cu(II), Tl(III)
1
Fe(III) и
им подобных окислителей общепринят внутрисферный механизм
окисления и есть данные, подтверждающие это.
Особый интерес представляют системы, в которых лиганд свя-
зан с легко восстанавливающимся ионом металла. В большинстве
случаев восстановление металла в таких системах сопровождает-
ся превращением лиганда в реакционноспособный свободный ра-
дикал, который участвует в последующих реакциях и в образова-
нии конечных продуктов. Иногда при этом образуются важные
продукты, как, например, при окислении Cu(II) а-оксикетонов в
а-дикетоны:
H
R-C—C-R + 2Си
2+
J- R—С—С—R + 2Cu+ + 2Н
+
I II пиридин II II
ОН О OO
Эта реакция может быть использована для превращения бензоина
в бензил [29] и фуроина в фурил [30]. Как было показано Брок-
маном [31], при синтезе нитрилов в присутствии кислорода про-
цессы окисления протекают глубже и за счет повторного окисле-
ния ионов Cu(I) становятся каталитическими. В общем виде реак-
ция выглядит так:
RCHO + NH
3
+ O
2
RCN + H
2
O + H
2
O
i

I
Активация малых молекул при координации с металлами 431
Cu (II)
H
2
O
2
+ субстраты >• H
2
O + продукты
и включает следующие стадии:
комплекс Cu"
RCH
2
OH V RCHO+H
2
O
RCHO+NH
3
V RCH=NH+H
2
O
медленно
RCH=NH + комплекс CuH >- иминный радикал + H
+
+ комплекс Cui
иминный радикал+ O
2
RCsN + HO
2
-
HO
2
- +H+ * H
2
O
2
Активной формой в этой реакции считают комплекс меди
[Cu(NH
3
)
4
(OCH
2
R)]
+
. В отсутствие кислорода этот комплекс
реагирует в стехиометрических количествах, как и следует ожи-
дать, если допустить промежуточное образование комплекса с ос-
нованием Шиффа.
Существует множество подобных автокаталитических процес-
сов, протекание которых зависит от легкости окисления субстра-
та комплексным ионом металла и возможности регенерации окис-
ленной формы последнего кислородом воздуха. Еще одним приме-
ром реакций этого типа является катализ ионами Cu(II) авто-
окисления аскорбиновой кислоты [32] (гл. 20).
Замечательным примером использования координации для
ускорения процессов окисления служит реакция окисления этиле-
на в ацетальдегид тетрахлорпалладатом [33]. Этот процесс ста-
новится каталитическим, если в реакционной среде имеются соли
Cu(II)
5
соляная кислота и кислород. Суммарное уравнение реак-
ции следующее:
C
2
H
1
+ PdClI- + ЗН
2
0 »- CH
3
CHO + Pd + ЗН
3
0+ + 4СГ
Вначале происходит координация и окисление олефина:
PdCll- + C
2
H
4
^—>- [PdCl
3
(C
2
H
4
)]
-
+ СГ
[PdCl
3
(C
2
H
4
)]" + H
2
O PdCl
2
(H
2
O) (C
2
H
4
) + СГ
PdCl
2
(H
2
O) (C
2
H
4
) +H
2
O =F=* [PdCl
2
(OH) (C
2
H
4
)]" + H
3
O+
[PdCl
2
(OH) (C
2
H
4
)F > CH
3
CHO + Pd
0
+ 2СГ
затем
Pd
0
+ 2CUC1
2
+ 2СГ >- PdClf- + 2CUCL
4CuCl + 4НС1 + O
2
>• 4CUCI
2
+ 2H
2
0
Реакции восстановления лигандов лучше всего изучены на при-
мере комплексов Pt(II) с ненасыщенными молекулами. В таких
комплексах олефиновые лиганды восстанавливаются значительно

432
Г лава
10
легче и быстрее, чем свободные лиганды [34]. Примеров восста-
новления других типов лигандов известно довольно мало.
Таким образом, окислительно-восстановительные свойства ли-
ганда изменяются при координации. Если ион металла сам не под-
вергается окислительно-восстановительным превращениям, то он
обычно препятствует окислению лиганда внешними реагентами.
6. МАСКИРОВАНИЕ РЕАКЦИОННОЙ СПОСОБНОСТИ
ЛИГАНДОВ В КОМПЛЕКСАХ
Под маскированием реакционной способности лиганда понима-
ют затруднение или полную невозможность протекания характер-
ных для лиганда реакций в результате координации. Мы уже от-
мечали, что координация препятствует реакциям осаждения га-
логенид-ионов. Последствия координации в таких простых случа-
ях можно предсказать заранее, зная ее влияние на растворимость
продуктов. Для более сложных реакций предугадать эффект мас-
кирования значительно труднее.
Ниже приведены возможные причины появления эффекта мас-
кирования.
1. Образование координационной связи с использованием элек-
тронной пары, необходимой для реакции.
2. Приобретение лигандом в результате координации конфор-
мации, неблагоприятной для реакции.
3. Резкое изменение окислительно-восстановительного потен-
циала лиганда в результате координации, препятствующее само-
произвольному протеканию реакции.
4. Изменение заряда активного центра, затрудняющее ход ре-
акции.
5. Переход лиганда в результате координации в другую форму
(таутомерную или ионную), которая неспособна к реакции или
реагирует значительно труднее.
Маскирование может явиться следствием комбинации двух или
более таких факторов, однако для объяснения этого эффекта в
каждом конкретном случае обычно ищут частные причины, кото-
рыми легче оперировать.
Одним из наиболее ценных приложений маскирования являет-
ся защита карбоксильных и а-аминогрупп в реакциях аминокис-
лот. Образование хелата с Cu(II) позволяет весьма надежно за-
щитить эти группы от большинства характерных для них реакций.
При этом другие, незамаскированные функциональные группы
становятся активными центрами реакции. Затем медь можно от-
делить от аминокислоты в виде нерастворимого сульфида, дейст-
вуя сероводородом или сульфидом натрия. Общая схема реакций
этого типа такова:
