Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Гемэритрин
393
гемэритрина пара крайних линий расщеплена так же сильно, как
и в случае комплексов метгемэритрина, а расщепление между
двумя внутренними линиями меньше. Изомерный сдвиг обоих
дублетов свидетельствует о том, что степень окисления обоих ато-
мов железа оксигемэритрина равна +3.
г) Влияние магнитных полей. Парамагнитные состояния атомов
железа могут вызвать магнитное сверхтонкое расщепление иу
77 к
v*. v к
• >• ,Л*
V
I •
%
Рис. 11.5. Спектры Мессбауэра ок- -.г- • .
глгемэритрина при разных темпера- •*'(
турах. *
J 0,5°/.
• 1 1 1 1 1 I I I 1 1
-4,о -зо ор гр 4р
Скорость, мм/с
спектров Мессбауэра [23, 24]. Величина такого расщепления про-
порциональна усредненному магнитному моменту <|х>, создавае-
мому электроном на ядре за период, соизмеримый с временем су-
ществования возбужденного состояния
57
Fe. Это время имеет
порядок Ю
-7
с, и если время релаксации магнитного момента элек-
трона намного короче этого периода (за счет спин-решеточного или
спин-спинового взаимодействия), то усредненный магнитный мо-
мент электрона в масштабе времени гамма-резонансного перехода
будет равен нулю и сверхтонкого расщепления не будет наблю-
даться. Напряженность поля сверхтонкого взаимодействия имеет
порядок нескольких сотен килоэрстед. Это поле можно индуциро-
вать при понижении температуры и наложении внешнего магнит-
ного поля высокой индукции.
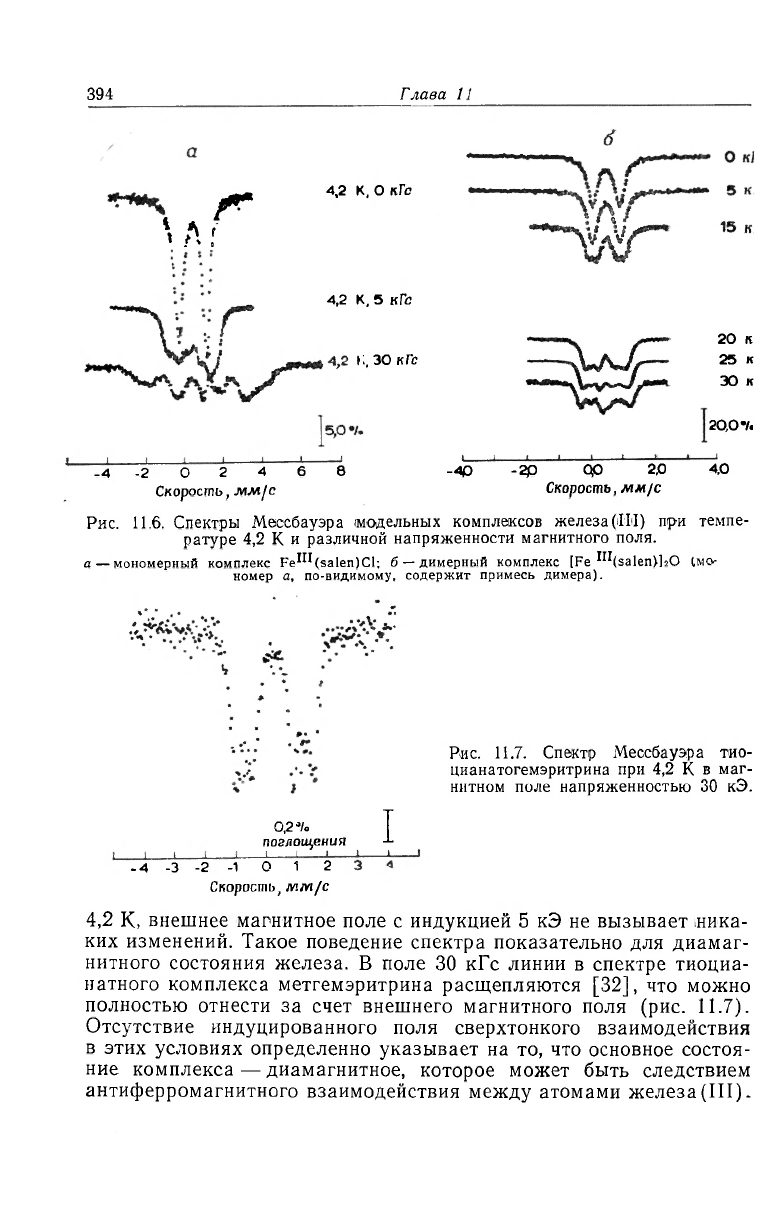
На рис. 11.6 показаны спектры Мессбауэра парамагнитного
моноядерного (а) и биядерного (в) комплексов для сравнения их
поведения в случае наложения внешнего магнитного поля. Ведут
они себя по-разному, и расщепление линии спектра во втором
случае можно объяснить воздействием приложенного внешнего
магнитного поля. В спектре Мессбауэра оксигемэритрина, а также
акво- и тиоцианатного комплексов метгемэритрина, снятых при
394 Г лава
10
fr
\ АI
4,2 К, О кГс
4,2 К, 5 кГс
;,
зо к гс
-4 -2 0 2 4 6 8
Скорость, jvim/c
-AP -гр Op 2,0
Скорость, ммJс
20 к
25 к
30 к
20,0*/.
4,0
Рис. 11.6. Спектры Мессбауэра модельных комплексов железа(111) пр-и темпе-
ратуре 4,2 К и различной напряженности магнитного поля.
а — мономерный комплекс Fe'"(salen)Cl; б
—
димерный комплекс [Fe'
1
^(Salen)I
2
O (мо-
номер а, по-видимому, содержит примесь димера).
0,2¾
поглощения
I
.4-3-2-1 О 1 2
Скорость, мм/с
Рис. 11.7. Спектр Мессбауэра тио-
цианатогемэритрина при 4,2 К в маг-
нитном поле напряженностью 30 кЭ.
4,2 К, внешнее магнитное поле с индукцией 5 кЭ не вызывает ника-
ких изменений. Такое поведение спектра показательно для диамаг-
нитного состояния железа. В поле 30 кГс линии в спектре тиоциа-
натного комплекса метгемэритрина расщепляются [32], что можно
полностью отнести за счет внешнего магнитного поля (рис. 11.7).
Отсутствие индуцированного поля сверхтонкого взаимодействия
в этих условиях определенно указывает на то, что основное состоя-
ние комплекса — диамагнитное, которое может быть следствием
антиферромагнитного взаимодействия между атомами железа(III).

Гемэритрин
395
8.2.4. Электронный парамагнитный резонанс
Спектры ЭПР гемэритрина изучались при разных температу-
рах [25, 31]. В этих спектрах ни разу не было обнаружено сигна-
ла, который однозначно можно было бы отнести к сигналу желе-
за. В некоторых образцах окси- и метгемэритринов был зафикси-
рован сигнал при g = 2, который, по-видимому, обусловлен какой-то
примесью. Кроме того, при восстановлении оксигемэритрина дитио-
нитом натрия наблюдался сигнал при ^= 1,94. Однако этот сигнал
не появляется, если деоксигемэритрин получать из оксигемэритри-
на путем деоксигенации [29].
Некоторые модельные биядерные антиферромагнитные комп-
лексы железа (III) дают сигналы ЭПР [21, 22]. Интенсивность их
уменьшается при понижении температуры, как и следовало ожи-
дать при наличии парамагнитных возбужденных состояний и диа-
магнитного основного состояния. Однако у других аналогичных
комплексов сигналов ЭПР не было обнаружено. Возможно, в этих
случаях спектр ЭПР не наблюдается из-за большого расщепления
в нулевом поле или из-за быстрой релаксации [33]. Спектр ЭПР
антиферромагнитно спаренных ионов железа (III) в биологических
образцах легко можно было бы охарактеризовать по температур-
ной зависимости его интенсивности. Однако, как мы убедились,
этот спектр не всегда может наблюдаться.
9. СТРОЕНИЕ АКТИВНОГО ЦЕНТРА
До тех пор пока структура гемэритрина не будет однозначно
установлена с помощью кристаллографических методов, о природе
связывания железа в его активном центре можно судить по таким
косвенным показателям, как параметры спектров поглощения,
спектров Мессбауэра и магнитная восприимчивость. Интерпрета-
ция этих характеристик по отношению к структурным характери-
стикам не всегда однозначна, и хотя с ними может быть связан
критерий той или иной структуры, они обычно не дают возмож-
ности полностью расшифровать структуру вещества, как это
удается сделать с помощью дифракции рентгеновских лучей.
Итак, строение гемэритрина, которое мы хотим себе предста-
вить, должно объяснять следующие его свойства:
1) малая величина магнитной восприимчивости окси- и метгем-
эритринов и диамагнетизм их основного состояния при низких
температурах;
2) неэквивалентность окружения атомов железа в оксигемэрит-
рине и эквивалентность их окружения в метгемэритрине и диокси-
гемэритрине, что следует из соответствующих спектров Мессбау-
эра;

396
Г лава 10
3) отсутствие эффекта Бора, т. е. выделения протона при окси-
генации;
4) отсутствие сигнала ЭПР от ионов железа в окси- и метгем-
эритринах.
5) спектры поглощения и КД-
Спектры Мессбауэра метгемэритрина в условиях низкой темпе-
ратуры и сильного магнитного поля, а также величина его магнит-
ной восприимчивости при низкой температуре указывают на то,
что железо в этой форме гемэритрина находится в состоянии анти-
ферромагнитного обменного взаимодействия. Малая магнитная вос-
приимчивость при комнатной температуре и величина изомерного
сдвига в спектре Мессбауэра, характерная для высокоспинового
состояния железа(III), ближе всего подходят к картине сильного
(|/|^30 см
-1
) антиферромагнитного взаимодействия между дву-
мя атомами железа (III), находящимися в слабом поле лигандов.
Это антиферромагнитное обменное взаимодействие, по-видимому,
обусловлено сверхобменным взаимодействием через мостиковый
лиганд.
Поскольку остатки цистеина, как было показано, не координи-
рованы атомом железа, это обменное взаимодействие происходит,
по-видимому, без участия серусодержащих лигандов (хотя пока
не исключена возможность участия в мостиковой связи атомов серы
остатка метионина). Среди биядерных неорганических комплексов
железа(III) встречаются примеры мостиковых связей через кис-
лород гидроксил-иона или алкоксигруппы, который подобен фе-
нольному кислороду в остатке тирозина. Однако обменное взаи-
модействие в такого типа мостиковых неорганических комплексах
слишком мало и оно не могло бы настолько сильно снизить магнит-
ную восприимчивость метгемэритрина при комнатной температуре.
Оксомостиковая структура Fe—О—Fe наилучшим образом объяс-
няет как данные, полученные из спектров Мессбауэра, так и вели-
чину магнитной воприимчивости метгемэритрина.
По мнению Гарбетта и сотр. [10], стехиометрия взаимодействия
гемэритрина с азидом и тиоцианатом (лиганд : металл =
1
: 2) и
эквивалентность окружения атомов железа (о чем свидетельствует
вид спектров Мессбауэра) могут быть объяснены образованием
симметричной двухмостиковой структуры I:
9.1. Метгемэритрин
О
Fe; Fe
\ /
X
X = С Г, Br", F~,
4
^N=C=S,
>
^=N=N
1
,C=N, \ч=с=о

Гемэритрин
397
Указанные выше комплексы метгемэритрина обладают близкими
спектрами КД.
Комплексы метгемэритрина с водой, гидроксил-ионом и фторид-
ионом при большой концентрации последнего отличаются от пре-
дыдущего ряда комплексов своими спектрами КД- Как предпола-
гают Гарбетт и сотрудники, эти комплексы соответствуют другому
соотношению лиганд: металл, а именно 2:2. Это отражено в
структуре II:
О
/ \
Fe Fe
II, X=H
2
O, НО", F
-
Оксомостиковые структуры, подобные структуре I, в которой
из-за отталкивания между атомом кислорода и вторым лигандом
угол Fe—О—Fe должен приближаться к 90°, в неорганических
комплексах железа(III) до сих пор не встречались. Так что в дан-
ном случае трудно оценить ожидаемую степень обменного взаимо-
действия. Мостиковая группировка Fe-O—Fe образует угол, близ-
кий к 90°, только в том случае, если кислород связан с третьим
партнером, например протоном. Это сопровождается ослаблением
связи Fe-O и значительным уменьшением эффективности обмен-
ного взаимодействия. Возможно, что протонированию мостикового
этого высказывались предположения о том, что обменное взаимо-
ковой группы в белке либо оксо-мостик связан с белком слабой
водородной связью. В таком случае в оксомостиковой структуре I
могло бы сохраниться короткое расстояние Fe—О и сильный анти-
ферромагнитный обмен, присущие оксомостиковой приблизительно
линейной структуре Fe—О—Fe.
Однако, как было замечено Дунитцем и Оргелем [27], связь
Fe—О, прочная в линейных мостиковых структурах, при больших
отклонениях от линейности может значительно ослабиться. Помимо
этого высказывались предположения о том, что обменное взаимо-
действие через мостик Fe—O-Fe при угле 90° должно быть намно-
го ослаблено по сравнению с обменом при угле 180° [18, 34]. Если
высказанные предположения верны, то для объяснения экспери-
ментально полученных значений магнитной восприимчивости при-
ходится предположить такое строение комплекса, в котором имеет-
ся один приблизительно линейный оксо-мостик (структура III):
Fe-O-Fe
I
X
in
Хотя по своему виду структура III противоречит сделанному
ранее выводу об эквивалентности окружения атомов железа, мож-

398
Г лава
10
но допустить, что присутствие лиганда X вблизи одного атома
железа в точности компенсируется на другом атоме железа за счет
координации какого-то остатка белка. Учитывая, что изомерный
сдвиг в спектре Мессбауэра высокоспиновых комплексов желе-
за (III) сравнительно мало изменяется в зависимости от лигандного
окружения, приведенное выше объяснение вполне допустимо. Ве-
личина квадрупольного расщепления линий в спектре Мессбауэра
может определяться главным образом кислородным мостиком и
не быть чувствительной к остальным лигандам, если они не отно-
сятся к сильно поляризуемым лигандам и не искажают геометрию
комплекса.
9.2. Оксигемэритрин
Спектр Мессбауэра оксигемэритрина совершенно отличен от
спектра деоксигемэритрина и состоит из двух дублетов. Вид спек-
тра свидетельствует об участии обоих атомов железа в связывании
кислорода, хотя по характеру связи с кислородом атомы железа
между собой различаются. Появление двух дублетов в спектре
Мессбауэра нельзя объяснить наличием равновесия между двумя
электронными состояниями или геометрическими изомерами, так
как в широком интервале температур соотношение интенсивностей
линий в спектре не изменяется, а совпадение энергий этих предпо-
лагаемых состояний маловероятно.
Магнитные свойства оксигемэритрина можно было бы объяс-
нить присутствием в нем изолированных низкоспиновых атомов
железа (II), однако близость изомерных сдвигов железа в окси-
гемэритрине и метгемэритрине свидетельствует о том, что в обеих
этих формах гемэритрина присутствуют атомы железа (III), свя-
занные сильным антиферромагнитным обменом. Таким образом,
связанная гемэритрином молекула кислорода по своему состоянию
близка к пероксо-иону.
Исходя из предполагаемой структуры I для комплексов мет-
гемэритрина и по аналогии с модельными оксигенированными
комплексами кобальта, Гарбетт и сотр. [10] предположили, что
активный центр оксигемэритрина имеет следующее строение:
°\0,
Ml
IV
Асимметричная координация мостиковой пероксо-группы в этом
комплексе, которая может быть связана водородной связью с ка-
кой-то группой белка, объясняет различие между двумя атомами
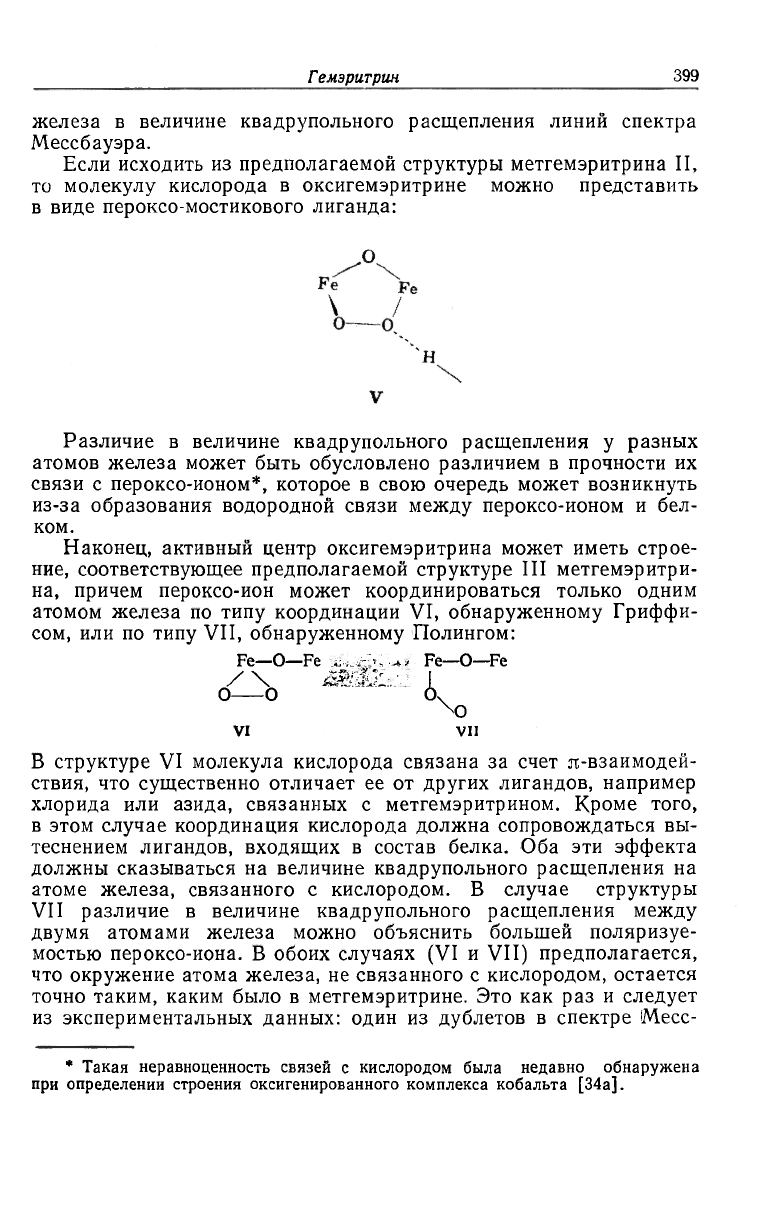
Гемэритрин
399
железа в величине квадрупольного расщепления линий спектра
Мессбауэра.
Если исходить из предполагаемой структуры метгемэритрина II,
то молекулу кислорода в оксигемэритрине можно представить
в виде пероксо-мостикового лиганда:
Различие в величине квадрупольного расщепления у разных
атомов железа может быть обусловлено различием в прочности их
связи с пероксо-ионом*, которое в свою очередь может возникнуть
из-за образования водородной связи между пероксо-ионом и бел-
ком.
Наконец, активный центр оксигемэритрина может иметь строе-
ние, соответствующее предполагаемой структуре III метгемэритри-
на, причем пероксо-ион может координироваться только одним
атомом железа по типу координации VI, обнаруженному Гриффи-
сом, или по типу VII, обнаруженному Полингом:
Fe—O—Fe Fe-O-Fe
/ \ ЖМ1:. 'J I
О О O
4
X)
VI VII
В структуре VI молекула кислорода связана за счет я-взаимодей-
ствия, что существенно отличает ее от других лигандов, например
хлорида или азида, связанных с метгемэритрином. Кроме того,
в этом случае координация кислорода должна сопровождаться вы-
теснением лигандов, входящих в состав белка. Оба эти эффекта
должны сказываться на величине квадрупольного расщепления на
атоме железа, связанного с кислородом. В случае структуры
VII различие в величине квадрупольного расщепления между
двумя атомами железа можно объяснить большей поляризуе-
мостью пероксо-иона. В обоих случаях (VI и VII) предполагается,
что окружение атома железа, не связанного с кислородом, остается
точно таким, каким было в метгемэритрине. Это как раз и следует
из экспериментальных данных: один из дублетов в спектре Mecc-
* Такая неравноценность связей с кислородом была недавно обнаружена
при определении строения оксигенированного комплекса кобальта [34а].

400
Г лава
10
бауэра оксигемэритрина по величине квадрупольного расщепления
и положению почти совпадает с дублетом в спектре метгемэрит-
рина.
9.3. Деоксигемэритрин
Данных о строении активного центра в деоксигемэритрине еще
меньше, чем в отношении других форм гемэритрина. Атомы желе-
за в деоксигемэритрине, очевидно, находятся в одинаковом окру-
жении. Он обладает магнитной восприимчивостью, которая типич-
на для высокоспиновых соединений железа (II), что, однако, не
исключает возможности существования мостиковых групп, посколь-
ку обменное взаимодействие между атомами железа (II) должно
быть слабым.
Во всяком случае, предполагаемое строение деоксигемэритрина
должно соответствовать тому свойству гемэритрина, что равнове-
сие связывания его с кислородом не зависит от рН среды, т. е. от-
сутствует эффект Бора [5, 27]. Более того, измерения рН в про-
цессе оксигенации и деоксигенации гемэритрина показали, что этот
процесс не связан с выделением или поглощением протонов [8].
Так что если в оксигемэритрине присутствует оксо-мостик, то и
деоксигемэритрин должен содержать оксо- или гидроксомостико-
вый лиганд, в противном случае образование оксо-мостика при
оксигенации должно сопровождаться образованием протонов, кото-
рые могут, не выделяясь в раствор, передаваться либо белку, либо
присоединенному молекулярному кислороду.
Из сказанного выше видно, что точное расположение атомов
в активном центре гемэритрина к настоящему моменту нельзя
считать твердо установленным.
9.4. Строение и функции гемэритрина
Одна из главных задач биохимии вообще и неорганической био-
химии в частности — раскрытие механизма действия биологиче-
ских молекул в связи с их строением и электронными свойствами.
При рассмотрении механизма действия гемэритрина как перенос-
чика кислорода мы должны выяснить причины устойчивости (и об-
ратимого образования) оксигемэритрина по отношению к диссоциа-
ции на деоксигемэритрин и молекулярный кислород, а также по
отношению к распаду оксигемэритрина на метгемэритрин и пере-
кись водорода [35]. Устойчивость в первом отношении обусловле-
на термодинамикой процесса и должна быть объяснена исходя из
прочности связей в оксигенированном комплексе. Устойчивость во
втором отношении, по-видимому, обусловлена кинетическими осо-
бенностями системы, поскольку необратимый процесс образования
метгемэритрина все же происходит, хотя и очень медленно. Этот
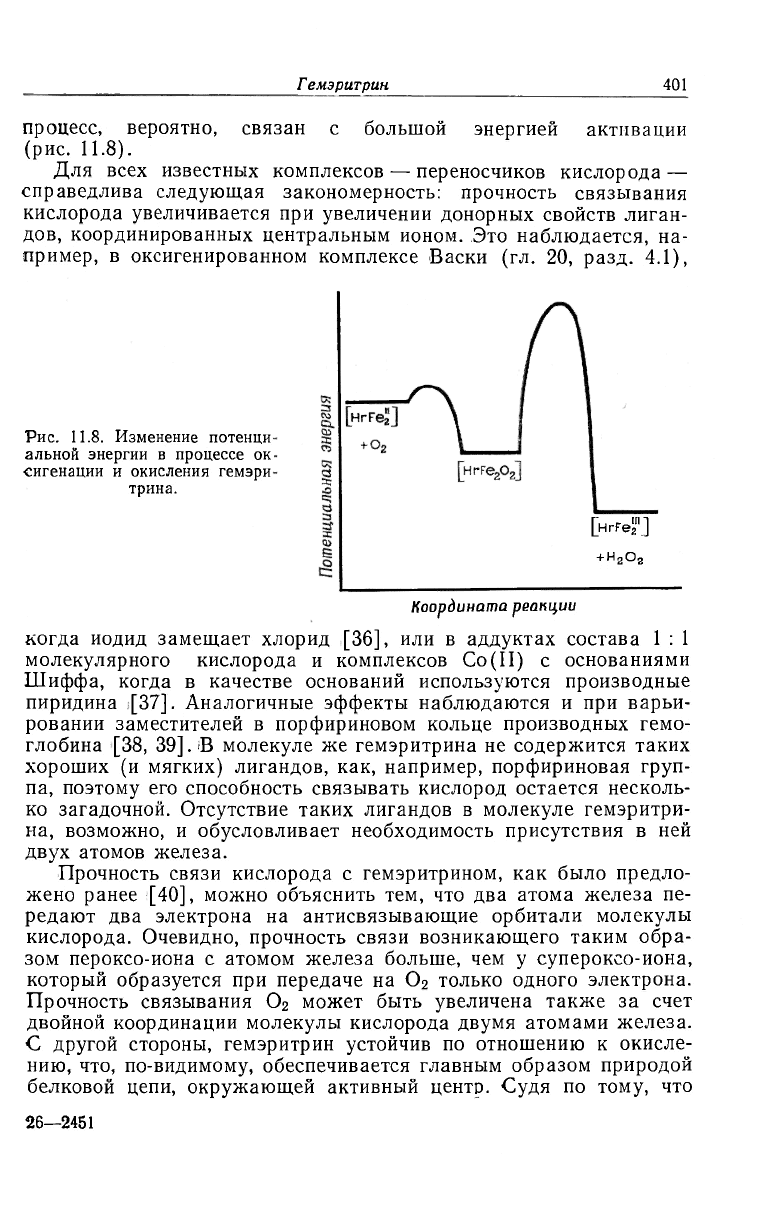
Гемэритрин
401
процесс, вероятно, связан с большой энергией активации
(рис. 11.8).
Для всех известных комплексов — переносчиков кислорода —
справедлива следующая закономерность: прочность связывания
кислорода увеличивается при увеличении донорных свойств лиган-
дов, координированных центральным ионом. Это наблюдается, на-
пример, в оксигенированном комплексе Васки (гл. 20, разд. 4.1),
Рис. 11.8. Изменение потенци
альной энергии в процессе ок
сигенации и окисления гемэри
трина.
Координата реакции
когда иодид замещает хлорид [36], или в аддуктах состава 1 : 1
молекулярного кислорода и комплексов Co(II) с основаниями
Шиффа, когда в качестве оснований используются производные
пиридина [37]. Аналогичные эффекты наблюдаются и при варьи-
ровании заместителей в порфириновом кольце производных гемо-
глобина [38, 39]. В молекуле же гемэритрина не содержится таких
хороших (и мягких) лигандов, как, например, порфириновая груп-
па, поэтому его способность связывать кислород остается несколь-
ко загадочной. Отсутствие таких лигандов в молекуле гемэритри-
на, возможно, и обусловливает необходимость присутствия в ней
двух атомов железа.
Прочность связи кислорода с гемэритрином, как было предло-
жено ранее [40], можно объяснить тем, что два атома железа пе-
редают два электрона на антисвязывающие орбитали молекулы
кислорода. Очевидно, прочность связи возникающего таким обра-
зом пероксо-иона с атомом железа больше, чем у супероксо-иона,
который образуется при передаче на O
2
только одного электрона.
Прочность связывания O
2
может быть увеличена также за счет
двойной координации молекулы кислорода двумя атомами железа.
С другой стороны, гемэритрин устойчив по отношению к окисле-
нию, что, по-видимому, обеспечивается главным образом природой
белковой цепи, окружающей активный центр. Судя по тому, что
LHrFei"]
+ H
2
O
2
26—2451

402
Г лава 10
в гемэритрине с трудом удается произвести обратимое удаление
железа и что оно не может быть извлечено из белка большими
хелатирующнми лигандами [12], атомы железа находятся в глу-
бине белковой глобулы. Факторами, замедляющими разложение
оксигемэритрина, могут быть малая диэлектрическая проницае-
мость и отсутствие кислотных групп вблизи железо-кислородного
комплекса, что препятствует разделению зарядов или кислотному
катализу окисления гемэритрина [2, 41]. Другой причиной устой-
чивости оксигемэритрина может быть специфическое строение са-
мого комплекса железа с кислородом, которое диктуется белковым
окружением и при котором затруднена перегруппировка с выделе-
нием продуктов разложения. Это можно рассматривать как про-
явление эффекта «ловушки» [42].
ДОПОЛНЕНИЯ, ВНЕСЕННЫЕ В КОРРЕКТУРУ
Во время подготовки этого издания к публикации вышло из пе-
чати несколько работ, продолжающих главным образом исследо-
вание спектров Мессбауэра гемэритрина [43, 44] и его магнитной
восприимчивости при низких температурах [45, 46]. Общее мнение
сходится на том, что по крайней мере в окси- и метгемэритринах
атомы железа располагаются в непосредственной близости друг
к другу. Однако детали строения активного центра остаются неяс-
ными. Безусловно, еще необходимо приложить немало усилий,
прежде чем мы сможем окончательно выяснить функции гемэрит-
рина на уровне его молекулярной структуры.
СПИСОК ЛИТЕРАТУРЫ
1. Ghirett F., in О. Hayaishi (ed.), Oxygenases, Academic Press, New York, 1962,
pp. 517—553.
2. Klotz I. M., Klotz T. A., Fiess H. A., Arch. Biochem. Biophys., 68, 284 (1957).
3. Keresztes-Nagy S., Klotz I. M., Biochemistry, 4, 919 (1965).
4. Keresztes-Nagy S., Klotz I. Af., Biochemistry, 2, 923 (1963).
5. Bates G., Brutiori M., Amieoni G., Antonini E., Wyman /., Biochemistry, 7,
3016 (1968).
6. Manwell C., A. Rev. Physiol., 22, 191—244 (1960).
7. Wald G., Allen D. W., J. Gen. Physiol., 40, 593—608 (1957).
8. Okamura M. Y., Klotz I. M., unpublished observations.
8a. Caughey W., in B. Chance, R. Estabrook, T. Yonetani (eds.), Hemes and He-
moproteins, Academic Press, New York, 1966, p. 276.
9. Darnall D. W., Garbett K., Klotz I. M., Biochem. Biophys. Res. Commun., 32,
264 (1968).
10. Garbett K., Darnall D. W., Klotz 1. M., Williams R. I. P., Arch. Biochem. Bio-
phys., 103, 419 (1969).
11. Klotz I. M., Keresztes-Nagy S., Biochemistry, 2, 455 (1963).
12. Darnall D., Klotz I. M., unpublished observations.
13. Garbett K., Darnall D. W., Klotz I. M., in preparation.
