Чемерис М.М., Люкшова Н.В., Мозуленко Л.М. Органическая химия.Часть 1
Подождите немного. Документ загружается.

21
Связи, образующиеся в результате бокового перекрывания двух
р-орбиталей называются
π - связями. Эти связи расположены по раз-
ные стороны от оси, соединяющей ядра двух атомов. Связывающие
π -
орбитали возникают при положительном перекрывании, а разрыхляю-
щие
π
∗
-орбитали - при отрицательном перекрывании: первые имеют од-
ну узловую плоскость, вторые - две. Метод молекулярных орбиталей
предполагает, что при образовании химической связи сначала сближа-
ются только ядра, а затем на образующихся молекулярных орбиталях
размещаются валентные электроны. Причем, при расчете молекулярных
орбиталей применяется тот же подход, что и при расчете атомных орби-
талей, предполагая, что молекулярная орбитальная функция является
линейной комбинацией атомных орбитальных функций (отсюда и назва-
ние приближения - МО ЛКАО).
Е
σ
*
-разрыхляющие орбитали
4Н С
σ - связывающие орбитали
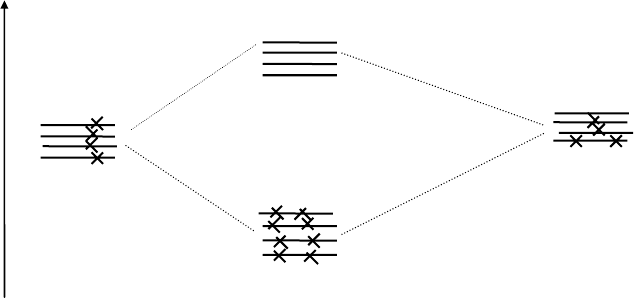
Рис. 2. Энергетическая диаграмма образования
молекулярных орбиталей метана
В образовании молекулярных орбиталей метана участвуют четыре s-
орбитали атомов водорода и четыре орбитали атома углерода (одна - 2s-
орбиталь и три 2p-орбитали), при этом образуются 8 молекулярных ор-
биталей (4 связывающих и 4 разрыхляющих). Все электроны молекулу-
образующих атомов расположены только на
более устойчивых в энерге-
тическом плане
σ -орбиталях. Электроны могут перейти на σ
∗
-
разрыхляющие орбитали только под влиянием внешних условий, напри-
мер, под воздействием электромагнитного излучения. На рис.3 пред-
ставлены энергетические диаграммы молекул этилена и метанола. Как
это продемонстрировано на примере метанола, не все атомные орбитали
могут участвовать в образовании молекулярных орбиталей.
22
Некоторые атомные орбитали могут переходить в молекулу без
изменения и их называют несвязывающими орбиталями.
CH
3
OH
..
..
Е СН
2
=СН
2
σ∗
С-Н
σ∗
С-Н
σ∗
С-С
σ∗
С-О
π∗
σ∗
О-Н
π
n
σ
С-С
σ
О-Н
σ
С-Н
σ
С-О
σ
С-Н
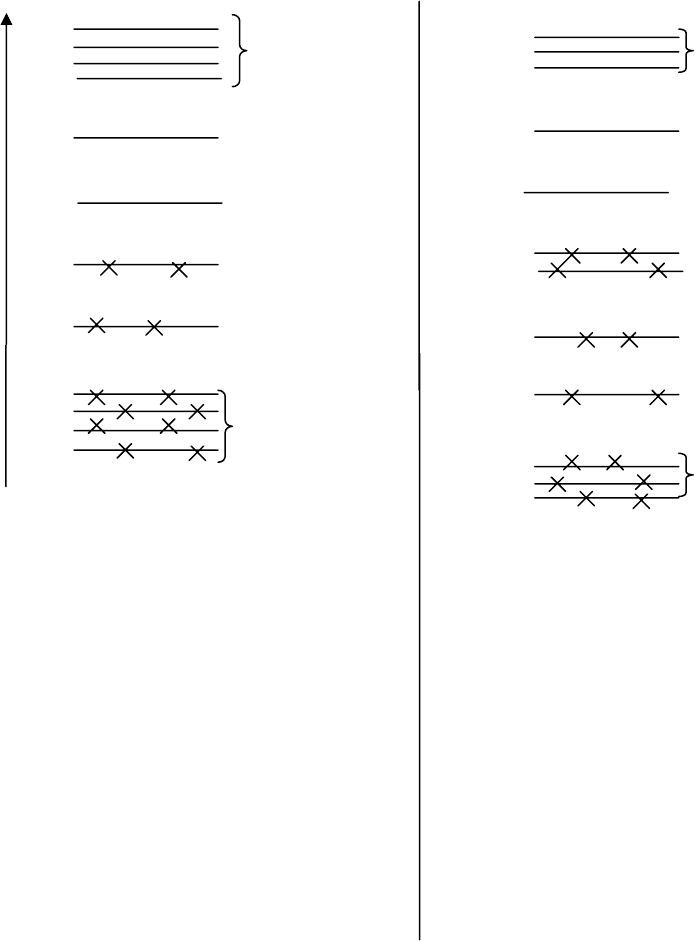
12 молекулярных орбиталей этилена 12 молекулярных орбиталей метило-
образованы из 12 атомных орбиталей: вого спирта образованы из 12 атом-
8 от углерода и 4 от водорода. ных орбиталей: по 4 от кислорода и
В образовании связей участвуют 12 углерода , 4 от водорода (по одной
электронов (8 от двух атомов углеро- ной s-орбитали от каждого атома).
да и 4
от атомов водорода), которые В молекуле метанола в образовании
расположены на следующих молеку- связей участвуют 14 электронов (6
лярных орбиталях: 8 электронов на от атома кислорода и по 4 от атомов
четырех на σ
С-Н
, 2 электрона на σ
С-С
углерода и водородов) и расположе
и 2 электрона на π-орбитали. ны на молекулярных орбиталях
следующим образом: 6 электронов
на трех σ
С-Н
, 2 электрона на σ
С-О,
4
электрона на двух несвязывающих
орбиталях(n)
Рис.3. Энергетические диаграммы молекулярных орбиталей
молекул этилена и метанола.
Второй метод, используемый наряду с методом МО ЛКАО для при-
ближенного решения уравнения Шредингера, является метод валентных
связей или схем (ВС).
23
В методе валентных связей предполагается, что при образовании
молекул происходит сближение между собой целых атомов, которые и
в молекуле сохраняют свою индивидуальность, При этом истинное со-
стояние представляется, как наложение (суперпозиция) не существую-
щих в действительности крайних гомеополярных или ионных структур.
В методе валентных схем волновое уравнение записывают для
каж-
дой из возможных электронных структур молекулы (каждую из них на-
зывают канонической формой) и полную функцию
Ψ получают сумми-
рованием всех мыслимых функций с соответствующими весовыми ко-
эффициентами.
Ψ = С
а
ψ
а
+ С
в
ψ
в
+ . . . . . . С
n
ψ
n
Это выражение напоминает уравнение метода МО ЛКАО, но здесь
каждое
ψ представляет волновую функцию для воображаемой канониче-
ской формы и каждый коэффициент С выражает количественный вклад
такой формы в общую сумму. Например, можно записать волновую
функцию для трех представленных канонических предельных форм мо-
лекулы водорода:
• • . • •
Н - Н Н Н Н Н
А далее, что является общим в обоих методах, решают волновые
уравнения для различных С и выбирают решение, дающее наименьшую
энергию.
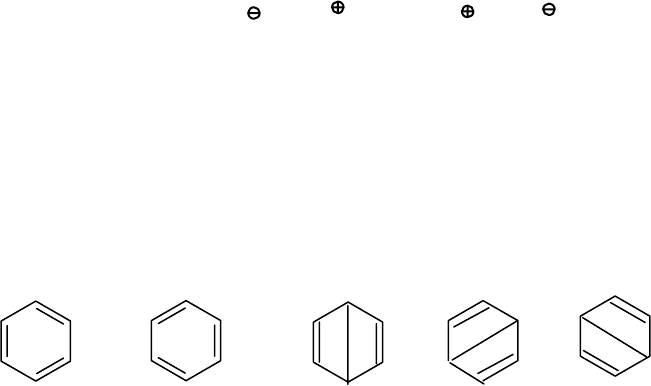
Аналогично поступают и с соединениями, имеющими делокализован-
ные связи, например, бензолом.
Молекулу бензола, как это будет показано позже, можно представить
несколькими каноническими
(предельными) формами.
1
2
3
4
5
Решение волнового уравнения показывает, что, если допустить
вклад структур 1 и 2 одинаковым, получаемая величина энергии меньше,
чем при рассмотрении каждой из структур в отдельности. Эта энергия
становится еще меньше, если допустить вклад структур 3, 4, 5 (так назы-
ваемых структур Дьюара).
Расчеты показали, что вклад структур 1 и 2 составляет по 39%, а
вклад остальных
структур по 7,3 %.
Метод МО ЛКАО и ВС зачастую дают близкие результаты, осо-
бенно для соединений с локализованными связями.
24
1.4.3
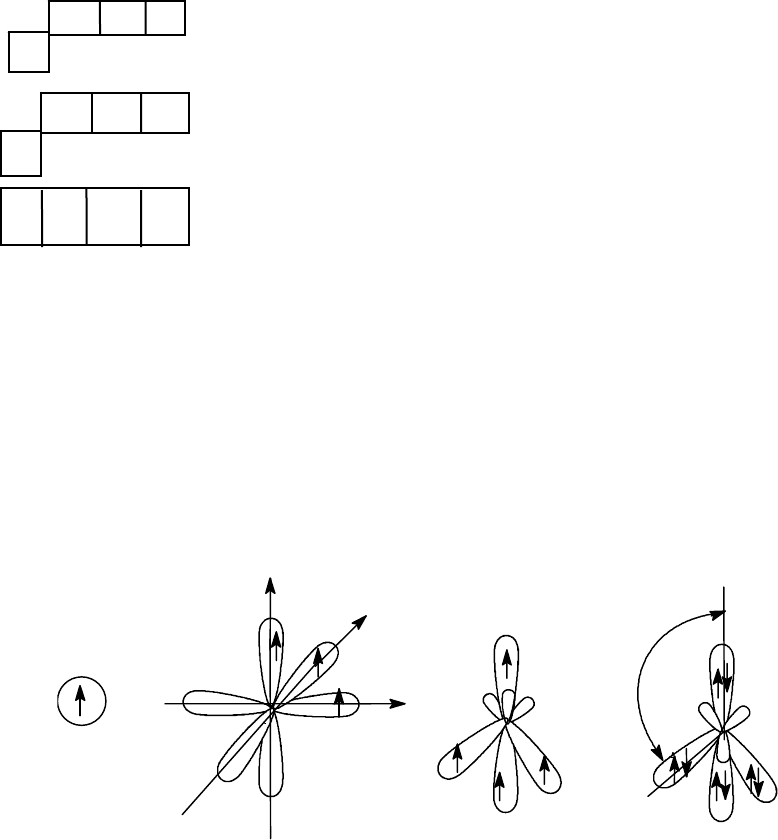
Гибридизация атомных орбиталей углерода
Известно, что на внешнем электронном уровне атома углерода нахо-
дится 4 электрона (2s
2
2p
2
)
↑ ↑
↑↓ 2 s
2
2p
2
- основное состояние
↑ ↑ ↑
↑ 2s 2p
3
- возбужденное состояние
↑ ↑ ↑ ↑ sp
3
- гибридное состояние
Можно представить себе, что один электрон с 2s- подуровня при воз-
буждении перейдет на 2р- подуровень. Однако, ни основное состояние,
ни возбужденное не дает разъяснения по поводу идентичности всех
С - Н связей, например, в метане.
Полингом было введено понятие sp
3
- гибридизации, согласно кото-
рому s-орбиталь и три p-орбитали вступают во взаимодействие с образо-
ванием 4-х абсолютно равнозначных орбиталей (sp
3
), которые, перекры-
ваясь с s-орбиталями водорода, образуют в метане четыре равные по
прочности
σ
С-Н
-связи.
+
X
Y
Ζ
=
H
H
H
H
109
5
,
o
Угол между связями в метане составляет 109,5
о
, что соответствует,
согласно принципа наибольшего "расталкивания" орбиталей, наиболее
выгодной ориентации sp
3
- орбиталей в пространстве. Метан имеет тет-
раэдрическое строение с атомом углерода в центре и атомами водорода в
вершинах тетраэдра. Прочность С - Н связи составляет 427,05кДж/моль.
Длина С-Н связи равна 0,109 нм. В молекуле этана
σ
С-С
- связь образует-
ся за счет перекрывания sp
3
- гибридных орбиталей, ее прочность со-
s-орбиталь
р-орбитали sp
3 -
гибридные Схема строения
орбитали углерода молекулы метана
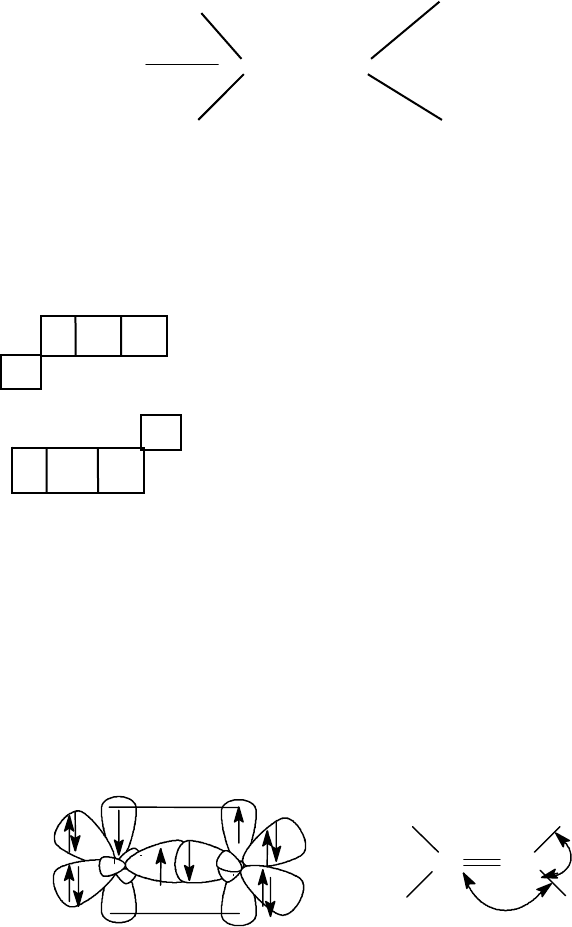
25
ставляет 347,5 кДж/моль, длина 0,154 нм. Энергетические характеристи-
ки С - Н связей примерно такие же, как и в метане.
Н Н
0,154 нм 0,110нм
Н С ⎯⎯⎯ С ⎯⎯⎯ Н
Н Н
sp
2
- Гибридизация - электронное состояние атома, в котором гиб-
ридизуются s- и две p- орбитали; третья p-орбиталь не участвует в гиб-
ридизации.
↑ ↑ ↑
↑ 2s2p
3
- возбужденное состояние углерода
↑
↑ ↑ ↑ sp
2
- гибридизованное состояние углерода
Три образовавшихся sp
2
- гибридных орбитали должны, в соответст-
вии с принципом наибольшего "расталкивания", расположиться в одной
плоскости под углом 120
о
друг к другу. Оставшаяся негибридизованной
р-орбиталь будет расположена перпендикулярно плоскости расположе-
ния sp
2
-гибридных орбиталей.
Тогда образование связей в этилене можно представить следующей
схемой:
Схема строения молекулы этилена
Двойная связь этилена (С = С), прочность которой 607,1 кДж/моль,
представляет собой сумму
σ
С-С
- связи (образованной за счет перекрыва-
ния sp
2
- орбиталей атомов углерода) и π - связи ( образованной за счет
бокового перекрывания p-орбиталей атомов углерода). Прочность
π-
связи меньше прочности
σ
-
связи; ее можно приблизительно оценить (с
учетом данных для этана) в 259,6 кДж/моль (607,1 - 347,5).
H
C
.
H
.
.
.
.
H
H
H
H
σ
σ
σ
σ
π
C
H
H
H
0
1
0
8
6
0
1
3
4
н
м
нм
,
,
121
1
1
7
5
,
o
o
26
В связи с тем, что доля s -характера в sp
2
- гибридной орбитали вы-
ше, нежели в sp
3
, вполне естественно выглядит уменьшение длины связи
С-Н в этилене по сравнению с метаном и этаном, и с учетом “бокового
сжатия“ уменьшение длины связи С-С.
Углы между связями (как видно из представленных данных) в эти-
лене приблизительно соответствуют теоретическим.
sp
2
- Гибридизация используется также и для описания строения мо-
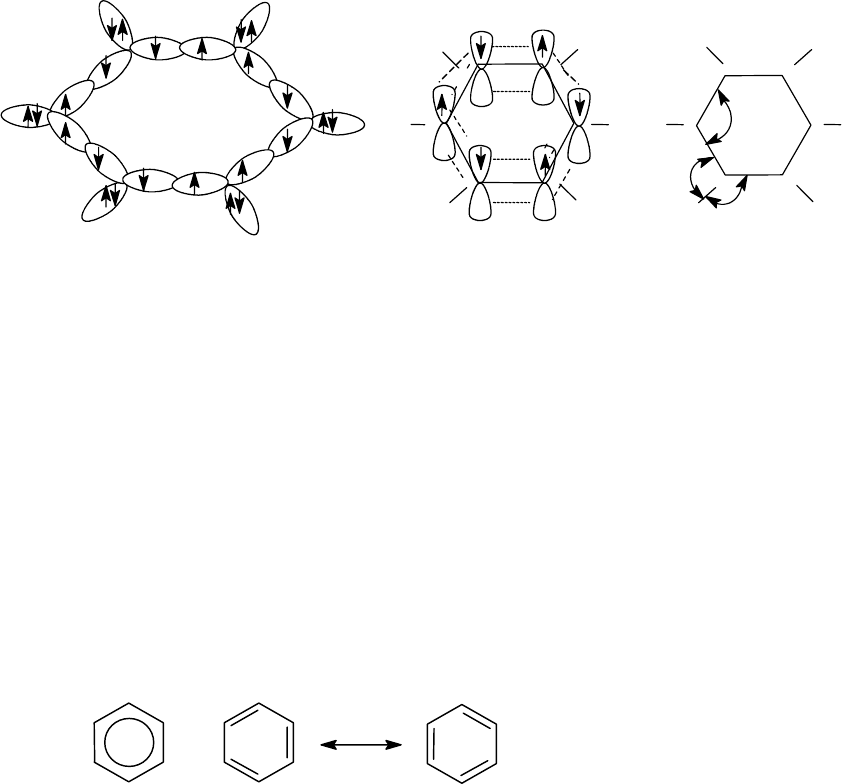
лекулы бензола.
Схема строения молекулы бензола.
Каждый атом углерода бензола связан с двумя другими посредством
σ
С-С
-связей, образованных за счет перекрывания двух sp
2
- гибридных
орбиталей, третья sp
2
- орбиталь за счет перекрывания с s - орбиталью
атома водорода образует
σ
С-Н
- связь. У каждого атома углерода оста-
лось по одной негибридизованной p-орбитали, которые за счет бокового
перекрывания образуют единое
π - электронное облако над и под плос-
костью бензольного кольца в виде тора. Таким образом, бензол пред-
ставляет собой плоскую молекулу с абсолютно равноценными С-С и С-
Н связями, длины которых соответственно равны 0,139 нм и 0,109 нм.
Длина углерод - углеродной связи в бензоле занимает промежуточное
значение между длинами простой и двойной
связей (0,154 нм и 0,134 нм
соответственно).
I II III
Все вышесказанное дает нам право изображать молекулу в виде фор-
мулы 1. Формула 1 подчеркивает равноценность всех С - С связей в бен-
золе (связи С-Н при написании структуры бензола, как правило, опуска-
ются). Однако, формула (1) не полностью отражает способность бензола
вступать в некоторые реакции (например, озонирование по Гарриесу),
характерные
для кратных связей, не в явной форме виден тип гибриди-
зации атома углерода. Поэтому до сих пор при написании многих реак-
ций используются формулы Кекуле II и III, являющиеся с точки зрения
H
H
H
H
H
H
C
C
C
C
C
C
H
C
C
C
C
C
C
H
H
H
H
H
C
CC
C
C
H
H
H
H
H
H
120
120
120
o
o
o
0 139
0109
,
,
нм
нм
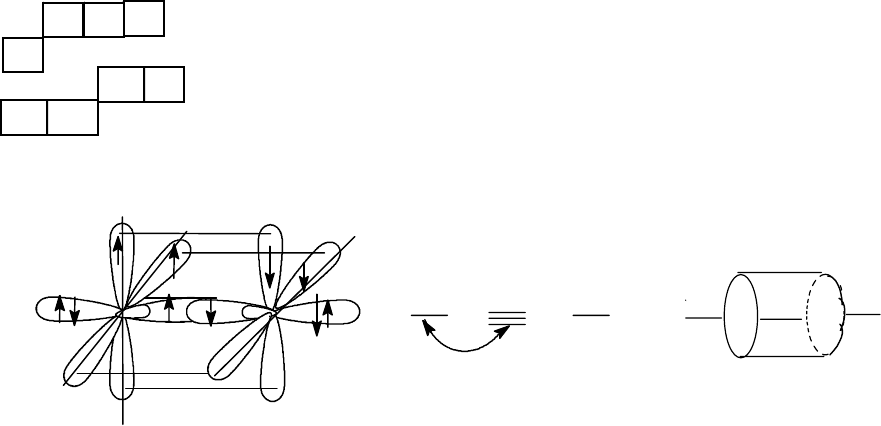
27
теории резонанса (о чем мы узнаем несколько позднее) предельными
(резонансными) структурами. Структура I является по отношению к
структурам II и III резонансным гибридом.
Таким образом, ни одна из предложенных структур не отражает
строение бензола и это не удивительно. Скорее удивительно другое, что
применяемый химиками способ изображения молекул с помощью пало-
чек и кружков
оказывается удовлетворительным в столь большом числе
случаев.
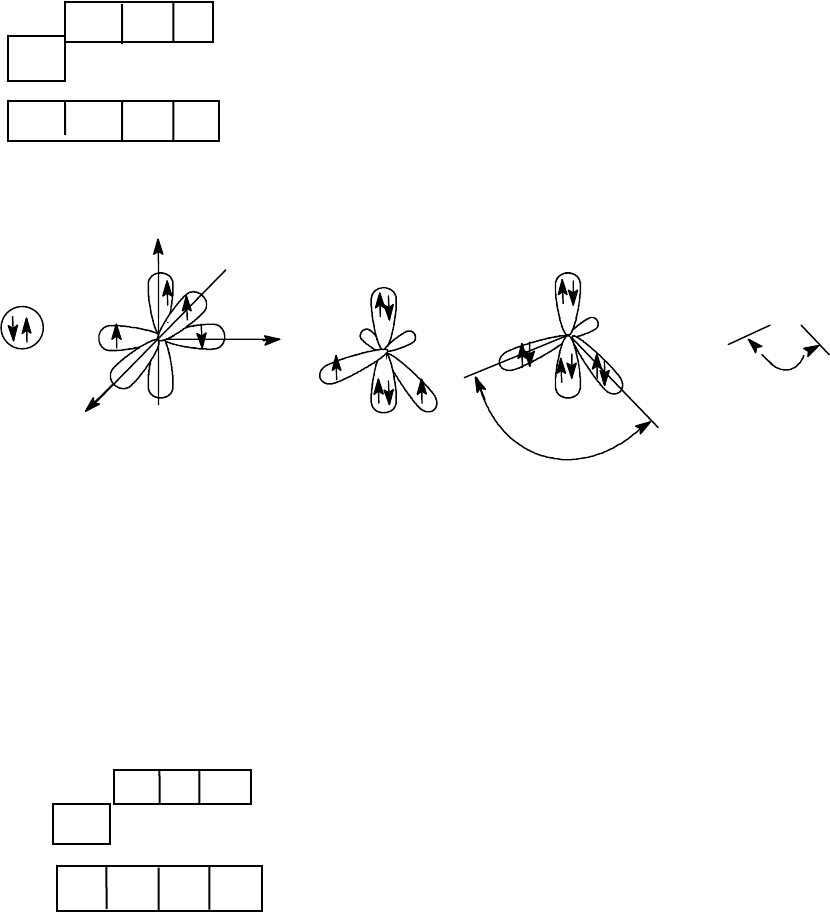
sp - Гибридизация углерода - это электронное состояние атома, в ко-
тором s-орбиталь вступает во взаимодействие с одной p-орбиталью с
образованием двух гибридных орбиталей (sp). Две другие p-орбитали ос-
таются негибридизованными.
↑ ↑ ↑ -2s 2p
3
- возбужденное состояние
↑
↑ ↑ sp - гибридное состояние
↑ ↑
H
0
120
,
.
.
.
.
π
H
H
H
.
.
.
.
π
.
C
C
180
o
,
0
106
н
м
н
м
Схемы образования связей в молекуле ацетилена.
Тройная связь в ацетилене, прочность которой 828,98кДж/моль,
представляет из себя сумму
σ
С-С
-связи, образованной за счет перекрыва-
ния sp-орбиталей атомов углерода, и двух
π-связей, образованных за
счет бокового перекрывания двух взаимноперпендикулярных p-
орбиталей от каждого атома углерода. Таким образом,
π - электронное
облако в молекуле ацетилена имеет цилиндрическую форму. Длина свя-
зей С-С и С-Н меньше, чем в этилене, что объясняется большим s - ха-
рактером sp-орбитали по сравнению с sp
2
- орбиталью. Прочность С-Н -
связи неизвестна, но, вероятно, она больше, чем в этилене.
.
C
C
H
H
28
1.4.4. Гибридизация атомных орбиталей кислорода и азота
Гибридизация орбиталей не является монополией только углеродно-
го атома. Орбитали кислорода и азота также способны гибридизоваться с
образованием sp
3
-; sp
2
-; sp- орбиталей. Отличие состоит в том, что если
на гибридных орбиталях атома углерода находится по одному электрону,
то на гибридных орбиталях атомов кислорода и азота могут находиться
как один, так и два электрона. В образовании ковалентных связей участ-
вуют одноэлектронные орбитали. Двухэлектронные орбитали остаются
несвязывающими (n
- орбитали).
sp
3
- Гибридизация атомных орбиталей кислорода обычно реали-
зуется в спиртах, фенолах.
↑↓ ↑ ↑ 2s 2p
4
- основное состояние
↑↓
↑↓ ↓↑ ↑ ↑ sp
3
- гибридное состояние
O
H
105
о
105
о
H
=
Z
X
+
H
Y
H
O
В молекуле воды угол между О - Н связями 105
о
, что меньше теоре-
тического (109,5
о
). Это, вероятно, вызвано тем, что электронные облака
несвязывающих орбиталей имеют больший размер нежели О-Н связи,
что приводит к искажению углов.
sp
3
- Гибридизация атомных орбиталей азота реализуется в ам-
миаке, аминах.
↑ ↑ ↑ 2 s
2
2 p
3
- основное состояние
↓↑
↓↑ ↑ ↑ ↑ sp
3
- гибридное состояние
s-орбиталь
р
-орбитали
sp
3
-орбитали атома
кислорода
Схема строения молекулы воды
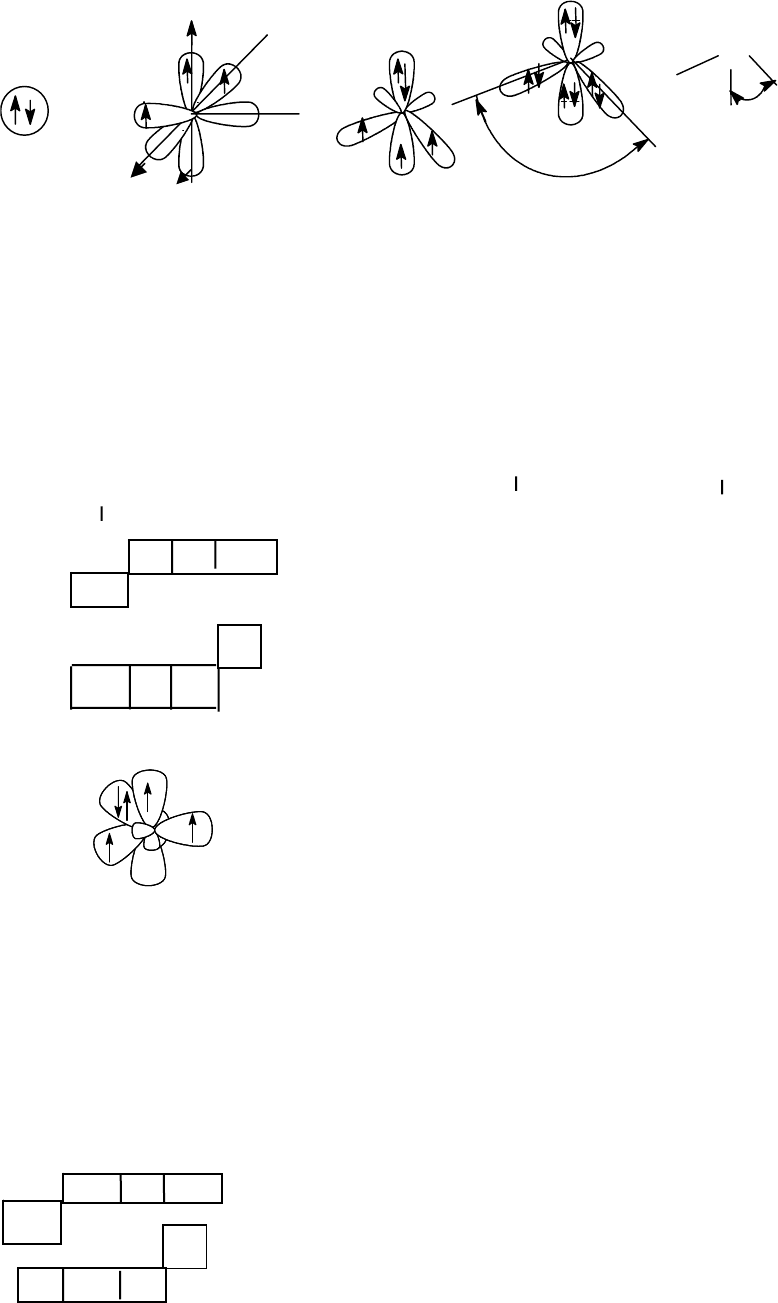
29
+
X
Z
=
H
H
107
o
107
o
H
H
H
N
..
H
Y
Угол между связями в аммиаке составляет 107
о
, что меньше теорети-
ческого (109,5
о
). Это вызвано тем, что электронное облако несвязываю-
щей орбитали имеет больший размер, чем орбитали N-Н связей, и это
является причиной искажения углов.
sp
2
– Гибридизация атомных орбиталей азота имеет место в диа-
зо- и азосоединениях (-N=N-), азометинах (-С= N-), иминах (-С =N-Н ),
оксимах (-С= N-ОН):
↑ ↑ ↑ 2 s
2
2 р
3
- основное состояние
↑↓
↑ sp
2
- гибридное состояние
↑↓ ↑ ↑
В соединениях, имеющих атом азота в sp
2
-гибридном состоянии, две
sp
2
- орбитали идут на образование σ- связей с другими атомами (не обя-
зательно азота); электрон р-орбитали участвует в образовании
π - связи,
а третья двухэлектронная sp
2
-орбиталь остается в молекуле в качестве
несвязывающей орбитали (
n
sp
2
).
sp
2
-гибридное состояние атома кислорода реализуется в оксосое-
динениях, карбоновых кислотах и их производных:
↑↓ ↑ ↑ 2 s
2
2 р
4
- основное состояние
↑↓
↑
↑↓ ↑ ↑ sp
2
- гибридное состояние
s-орбиталь
р
-орбитали
sp
3
-орбитали
атома азота
Схема строения молекулы
аммиака
sp
2
- гибридное состояние атома
азот
а
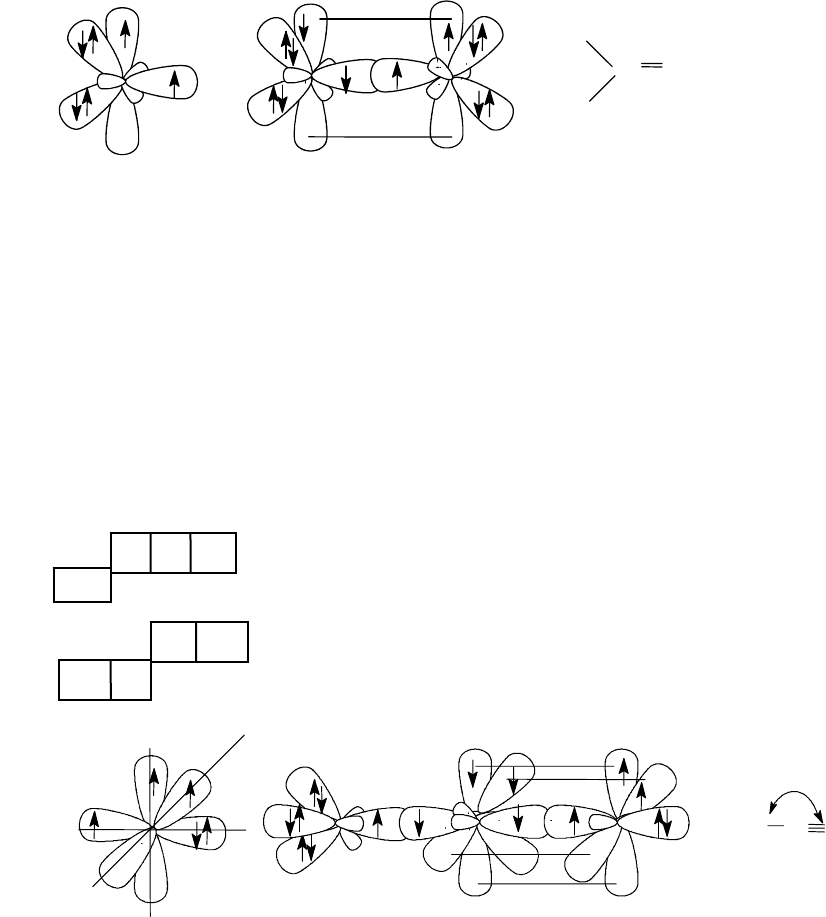
30
Таким образом, в формальдегиде одна из трех sp
2
- орбиталей ки-
слорода участвует в образовании
σ
С-О
- связи, p-орбиталь за счет боково-
го перекрывания с р-орбиталью углерода образует
π - связь. Две другие
sp
2
- гибридные орбитали в образовании связей не участвуют (несвязы-
вающие орбитали n
sp
2
).
sp - Гибридное состояние атома азота.
↑ ↑ ↑
↑↓ 2 s
2
2p
3
- основное состояние
↑ ↑
↑↓ ↓ sp- гибридное состояние
Из двух sp-гибридных орбиталей атома азота одна участвует в обра-
зовании
σ
C-N
-связи, другая (двухэлектронная) остается несвязывающей.
Две p-орбитали азота за счет бокового перекрывания с p-орбиталями уг-
лерода образуют две
π - связи.
sp-гибридное сос-
тояние атома
азота
Схема строения молекулы ацетонитрила
sp
2
-гибридное со-
стояние атома ки-
слорода
Cхема строения молекулы
формальдегида
..
..
C
H
H
O
π
σ
.
C
..
.
.
H
H
H
.
O
π
σ
.
H
H
H
.
H
C
C
.
.
.
.
π
N
C
H
3
.
.
C
N:
N
1
8
0
о
.
