Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.

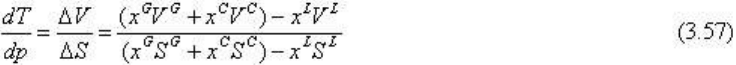
Главная особенность системы и диаграммы ее состояния состоит в поведении
моновариантной линии (A) G+C=L, которая имеет экстремум по давлению. При T и p
вблизи точки E отношение
для этой моновариантной реакции положительно, поскольку количество расплава в
системе невелико и x
G
V
G
+ x
C
V
C
>> x
L
V
L
, а x
G
S
G
+ x
C
S
C
> x
L
S
L
. По мере повышения
температуры и давления происходит увеличение количества расплава и уменьшение
количеств твердой фазы C (плавление) и газовой фазы G (растворение в расплаве). При
этом в силу того, что V
G
>>V
L
, величина ΔV сохранит положительное значение, а ΔS
станет отрицательной: ΔS = x
G
S
G
+ x
C
S
C
- x
L
S
L
< 0, так как x
L
S
L
> x
G
S
G
+ x
C
S
C
, проходя
при этом через экстремальное значение, когда x
G
S
G
+ x
C
S
C
= x
L
S
L
и dT / dp = ΔV / 0 = ∞. В
физическом отношении, наверное, более наглядным является такое объяснение
экстремума: по мере повышения температуры давление газа в системе возрастает, но в
тоже время увеличивается количество расплава и уменьшается количество газовой фазы
таким образом, что при определенной температуре давление газа достигает максимума.
После экстремума линия (A) G+C=L имеет отрицательный наклон и заканчивается в
тройной нонвариантной точке e
c
: C+G
c
+L
c
, которая расположена при высоких T и
небольших p, так как упругость паров нелетучего C в нонвариантной ассоциации
невелика. При изменении T-p параметров, следуя по моновариантной кривой (A),
происходит не только изменение относительных количеств фаз, но и их составов, что
хорошо видно на T-x и p-x проекциях рис. 3.165 и, может быть не так наглядно, на
пространственной диаграмме рис.3.164. При этом для любых T и p расплав содержит
больше c, а газ больше летучего a.
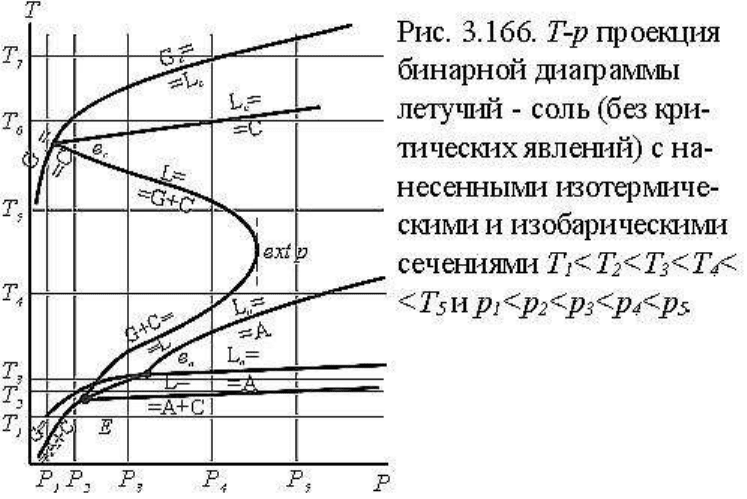
Для построения полной T-p проекции диаграммы осталось обозначить на проекции
моновариантные линии для каждой краевой однокомпонентной системы: в нонвариантной
точке e
a
линии A=L
a
(G
a
), A=G
a
(L
a
) и L
a
=G
a
(A), и в нонвариантной точке e
c
: C=L
c
(G
c
),
C=G
c
(L
c
) и L
c
=G
c
(C). Эти линии также нанесены на рис.3.165, I и эта диаграмма
представляет, таким образом, полную T-p проекцию T-p-x диаграммы бинарной системы
соль-летучий (без критических явлений). Обратим еще раз внимание на то, что линии
сублимации (твердое=газ) и плавления (твердое=расплав) для чистых компонентов
располагаются при больших температурах, чем для бинарной системы.
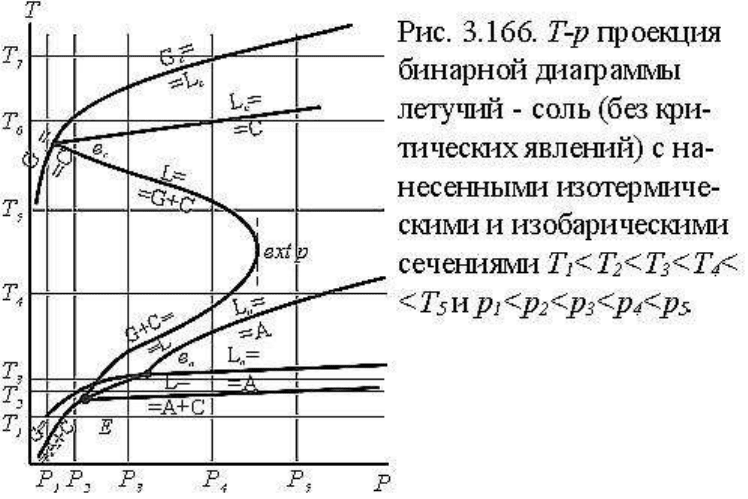
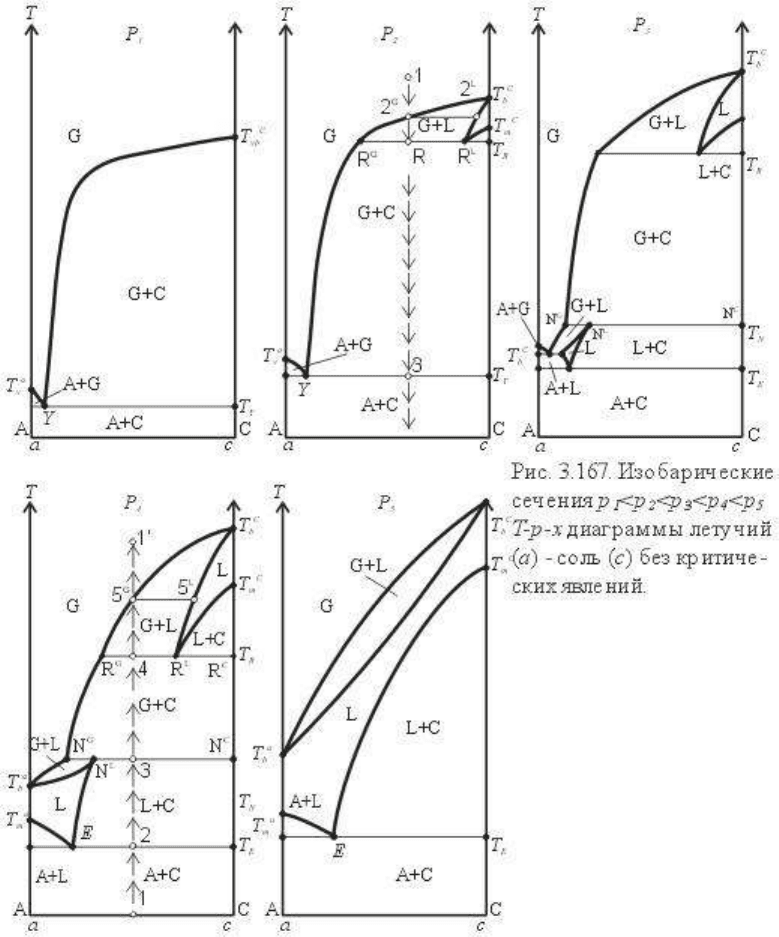
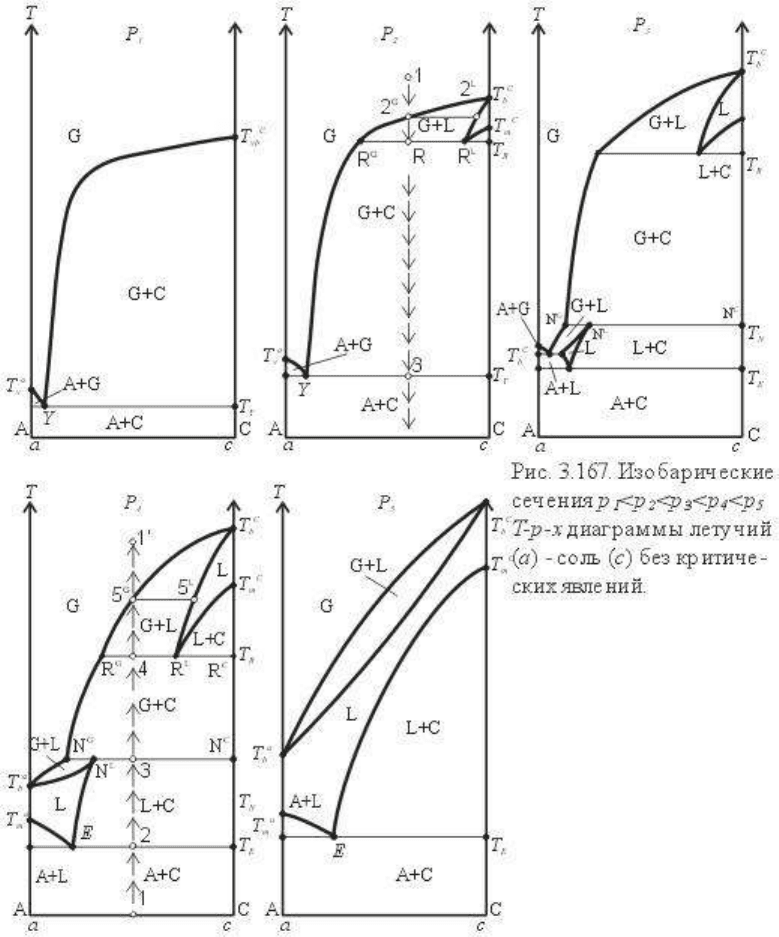
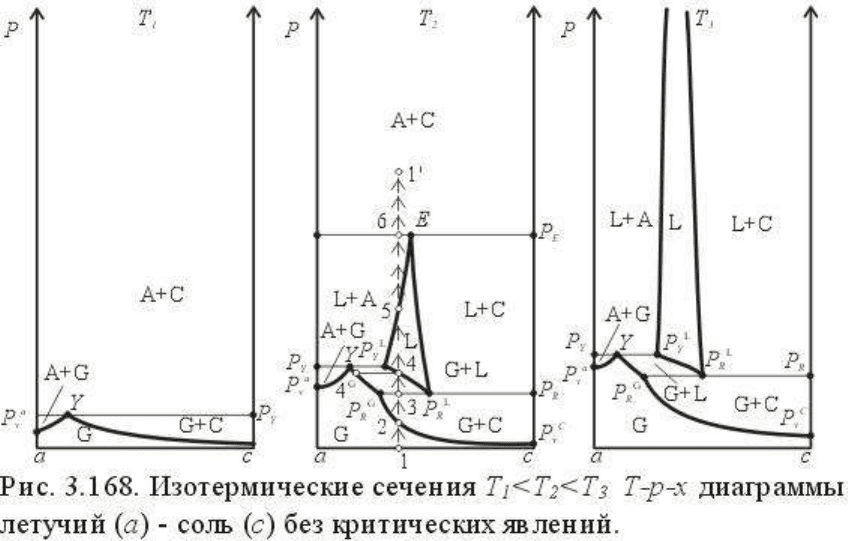
Наиболее рациональным способом раскрытия и исследования T-p-x диаграммы служит
построение и изучение изобарических (T-x) и изотермических (p-x) сечений. Построим
пять изобарических сечений диаграммы для давления p
1
< p
2
< p
3
< p
4
< p
5
и пять
изотермических сечений для температур T
1
< T
2
< T
3
< T
4
< T
5
, которые исчерпывают все
фазовые особенности диаграммы. На рис.3.166 повторена T-p проекция системы, на
которой показаны соответствующие сечения: пять изобарических и пять изотермических.
Рассмотрим сначала изобарические сечения, иначе говоря, T-x диаграммы, которые
показаны на рис.3.167. Построение их проводится следующим образом. Проводим
координатные оси T-x диаграммы, где ось x в барицентрических координатах и
произвольном масштабе отвечает составам a-c, масштаб оси T соответствует масштабу T-
p диаграммы. Проводим на T-p диаграмме сечение, например p
1
, и переносим на T-x
диаграмму температуры пересекаемых моновариантных линий. Эти температуры на T-x
диаграмме будут характеризовать соответствующие нонвариантные точки (изобарическое
сечение, согласно правилу фаз, понижает на единицу вариантность диаграммы, т.е. n = k +
1 - r).

Сечение p
1
отвечает наименьшему давлению, пересекает обе линии сублимации в
однокомпонентных системах a и c и линию сублимации смеси A и C. Обозначив через Y и
υ (ипсилон) точки сублимации смеси и отдельных фаз, наносим на ординате температуру
сублимации фазы A-T
υ
a
, температуру сублимации фаз C - T
υ
c
и температуру сублимации
смеси фаз A и C - T
Y
A+C
. В точке T
υ
A
в равновесии находятся две фазы: твердая A и газ
состава a Ga 18. В краевом сечении система нонвариантна, ΔG=0 и ΔH
υ
A
= TΔS
υ
A
, где
ΔH
υ
A
, ΔS
υ
A
, теплота и энтропия сублимации фазы A. Аналогичная ситуация при T
υ
c
для
фазы C. При температуре T
Y
A+C
- нонвариантная ассоциация трех фаз A+C+G. Проведем
конноду A-C, совпадающую с изотермой T
Y
A+C
. Состав газа, сублимирующего из смеси
A+C, т.е. точку Y можно определить, решая совместно уравнения линий сублимации фаз
A и C dlnx
a
G
= (ΔS
υ
a
/ RT) dT (3.58) и dlnx
c
G
= (ΔS
υ
c
/ RT) dT (3.59) для температуры T
Y
(аналогично тому, как определяется точка эвтектики). На рис. 3.167 точка Y выбрана
произвольно, сообразуясь с физическим содержанием системы: температура сублимации
для летучего A намного меньше, чем для фазы C, и, следовательно, точка Y расположена
вблизи координаты x
a
=1. Из точек T
υ
A
и T
υ
C
проведем линии сублимации в точку Y,
подпишем поля фазовых равновесий, и сечение T-x при p
1
построено.
Сечение p
2
отличается от сечения p
1
(см.рис.3.165 и 3.166, p2) тем, что в
высокотемпературной части оно пересекает линию кипения компонента c: L
c
=G
c
, линию
плавления компонента c: L
c
=C и линию трехфазового равновесия L = G + C. Все эти
пересечения образуют нонвариантные точки на T-x диаграмме: двухфазовые для
однокомпонентной системы c, соответственно, T
c
v
и T
m
c
, и трехфазовую для
двухкомпонентной системы a-c (T
R
). Нанесем на ординате x
c
= 1 температуру кипения c-
T
c
b
, для которой n = k + 1 - r = 1 + 1 - 2 = 0, ΔG=0 и ΔH
c
b
= T
c
b
.
ΔS
c
b
. Обозначим
температуру плавления T
m
c
, для которой также n=0, ΔG=0 и ΔH
m
c
= T
m
c.
ΔS
m
c
. Проведя
конноду GLC, совпадающую с изотермой T
R
, нанесем на ней состав газа (точка R
G
),
который, очевидно, наиболее богат летучим a и состав расплава (R
L
),равновесного при
данной температуре с твердой фазой C и газом. Обозначим линию состава газа, соединив
R
G
с T
c
v
, линию состава расплава в равновесии с газом, соединив R
L
с T
c
v
и линию состава
расплава в равновесии с твердой фазой C, соединив R
L
с T
c
m
. Остальная часть диаграммы
тождественна рассмотренному выше сечению p
1
: линия сублимации фазы C: R
G
-Y
отражает состав газа, равновесный с твердой фазой C, T
A
v
- линия сублимации фазы A, Y -
точка сублимации смеси АС с наименьшей температурой сублимации (при данном р
2
),
коннода A-SB-C ограничивает по температуре область солидуса A+C. Обозначив фазовые
составы в соответствующих полях (G, G+L, L, L+C, G+C, A+G, A+C) закончим
построение T-x сечения.
Рассмотрим несколько подробнее особенности фазовых соотношений в
высокотемпературной части диаграммы. Нанесем фагуративную точку 1 (состав ее ≅40%
а и 60% с). При понижении температуры в точке 2
G
начнется сжижение газа с выделением
расплава (2
L
). Сосуществующие составы газа и жидкости при понижении температуры от
T
2
до T
R
определяются по уравнениям Ван-Лаара или Ван-дер-Ваальса. Напомним их:
или
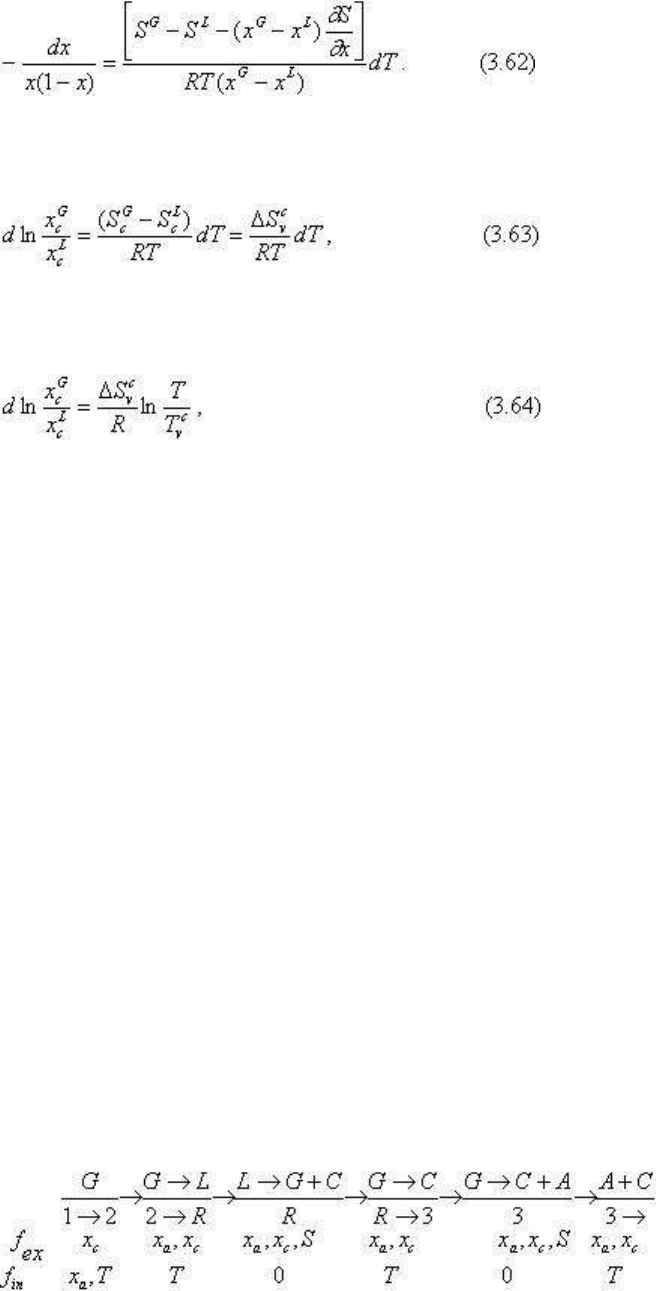
В случае зависимости S от x (уравнение Ван-дер -Ваальса):
В упрощенном виде - идеальные растворы и S не зависят от x и T:
в интегральной форме:
где x
G
c
, x
L
c
- мольные доли компонента c в газовой и жидкой фазе. Поскольку T
c
v
-
температура кипения компонента c - выше температур диапазона T (T
2
-T
R
), газ содержит
меньше компонента c, чем жидкость.
При достижении T
R
(точка R) в условиях отвода тепла в системе происходит реакция
исчезновения расплава с образованием равновесия твердая фаза - газ. Эта реакция
протекает нонвариантно вплоть до исчезновения расплава, когда в системе остается
двухфазовая ассоциация G+C и возможно моновариантное понижение температуры без
изменения фазового состава. Рассмотренная реакция L → G+C носит название реакции
ретроградного кипения, соответственно R, T
R
- точка и температура ретроградного
кипения. Само явление ретроградного кипения, т.е. превращение жидкости в газ при
понижении температуры - важная особенность систем летучий - соль. Используя свойства
барицентрических координат для точки R, легко определить составы системы, жидкости и
газа, их относительные количества и относительные изменения составов при
ретроградном кипении.
Дальнейшее понижение температуры вызoвет некоторую десублимацию системы G+C, а
при T
Y
A+C
- "эвтектоидное" осаждение из газа A+C вплоть до полного исчезновения его с
переходом к ассоциации твердых фаз A+C.
На сечении p
2
показано изменение фазовых соотношений при остывании фигуративного
состава, заданного точкой 1. Эти изменения хорошо видны из диаграммы и мы запишем
их краткой формулой, обозначая при этом факторы состояния системы:
Отметим два нонвариантных состояния - состояние ретроградного кипения и
эвтектоидного осаждения из газа (состава, отвечающего точке Y) твердых фаз A и C.
T-x диаграмма, отвечающая сечению при давлении p
3
, имеет наиболее сложное строение.
Изобара p
3
на T-p проекции (рис.3.166) пересекает моновариантные линии C
c
L
c
, L
c
C, LGC,
снова GCL, G
a
A, GLA и LAC. Нанесем на T-x диаграмму (рис.3.167, p
3
) температуры
соответствующих пересечений. Строим диаграмму начиная с высокотемпературной части.
Верхняя часть диаграммы, включая точку ретроградного кипения R, аналогична
высокотемпературной части сечения p
2
. Однако, при понижении температуры поле G+C в
сечении p
3
ограничено повторным пересечением трехфазовой кривой GLC с образованием
нонвариантного состояния, в котором происходит сжижение газа, и в результате реакции
его с твердой фазой образуется существенно водный расплав (или рассол) с содержанием
в нашем примере 25% c и 75% a. Состав газа существенно богаче летучим a (85% a в
нашем случае). Нонвариантная реакция G+C → L протекает до исчерпания c (в узком
диапазоне составов для фигуративной точки от N
G
до N
L
) или газа (при составах от N
L
до
N
c
).
Ниже по температуре точки N в сечении наблюдается еще два нонвариантных состояния:
при пересечении трехфазовой кривой G=A+L и трехфазовой эвтектики L → A+C. Нанеся
соответствующие конноды и точки, сообразуясь с относительным содержанием а и с в
газовой, жидкой фазе и эвтектике, а также линии ликвидуса и состава газа (в равновесии с
А и L) получим полную схему T-x диаграммы изобарического сечения p
3
. Это сечение
характеризует небольшую область T-p-x диаграммы и более подробное рассмотрение его
мы опустим.
Наиболее представительным для T-p-x диаграммы летучий - соль является T-x
изобарическое сечение p4. Оно охватывает значительную и наиболее интересную часть
диаграммы. От высоких температур к более низким в сечении представлены равновесия
кипения компонента c (G
c
=L
c
), плавление компонента c (L
c
=C), дважды пересекаемое
трехфазовое равновесие GLC (точка R - ретроградного кипения L → G+C и N -
конденсация G+C → L) кипения (G
a
=L
a
) и плавления (L
a
=A) компонента a, и эвтектика
системы (L=A+C). Нанесем на T-x диаграмму соответствующие нонвариантные точки и
конноды и проведем линии моновариантных равновесий.
От точек T
c
b
и T
c
m
к нонвариантной точке R проходят линии равновесия газа и расплава
(рассчитываемые по уравнению Ван-дер-Ваальса) и линия ликвидуса C (определяемая
уравнением Шредера). В точке R происходит нонвариантная реакция ретроградного
кипения жидкость → газ + твердая фаза С. Для этого состояния свободная энергия равна
нулю ΔG
R
= 0, а уменьшение энтальпии равно ΔH
R
= T
R
[(S
G
R
+ S
C
R
) - S
L
R
], которое лучше
записать, выражая изменение количества фаз: ΔH
R
= T
R
[(x
G
S
G
R
+ x
C
S
C
R
) - x
L
S
L
R
]. По
исчерпании L система становится моновариантной с двухфазовой ассоциацией газ +
твердая фаза (G+C). Кривая состава газа (R
G
→ N
G
) отражает уменьшение содержания
компонента c в газе при понижении температуры и описывается уравнением, имеющим
вид уравнения Шредера d ln x
c
G
= (ΔS
v
/ RT) dT, где x
c
G
- мольная доля c в газе.
При температуре T
N
- второе пересечение трехфазовой кривой (A) GLC, но уже с
обратной реакцией конденсации газа и растворением в образующейся жидкости
некоторого количества твердой фазы C (газ + твердое → жидкость). Реакция также
нонвариантна: ΔG
R
= 0, ΔH
N
= T
N
[ x
L
S
L
N
- (x
G
S
G
N
+ x
C
S
C
N
)], и протекает вплоть до
образования определенного (x
L
) количества жидкости. Дальнейший отвод тепла от
системы вызовет понижение температуры и распад нонвариантной трехфазовой
ассоциации на две двухфазовые: первая существенно водная G+L и вторая водно-солевая
L+C. Поле устойчивости первой ассоциации ограничивается точкой кипения (T
a
b
)
летучего. Вторая ассоциация ограничена эвтектикой L → A+C.
Проследим теперь фазовые изменения при повышении температуры для фигуративного
состава, заданного точкой 1. Эта точка расположена в области солидуса, состав ее
представлен двухфазовой ассоциацией A+C, которая моновариантна (n = k + 1 - r = 2 + 1 -
2 = 1) и сохраняется при повышении температуры до точки 2. Точка 2 расположена на
конноде эвтектики и при постоянной T
E
, при подводе тепла к системе происходит
выплавление эвтектики A+C → L. Если летучий (A) H
2
O, то состав эвтектики
существенно водный (79% H
2
O). Такие водно-солевые эвтектики в специальной
литературе обычно называют эвтоникой (эвтоническая точка, эвтонический состав,
эвтоническая температура и т.д.) В некоторых конкретных случаях мы также будем
использовать этот термин, но в основном предпочтительный и более общий - эвтектика.
Эвтектическое состояние для состава 2 сохраняется до полного выплавления фазы A.
После этого система становится моновариантной (фазы L и C) и при нагревании
происходит плавление фазы C (точнее растворение, поскольку жидкость - состав ее
показывает кривая EN
L
- сложена в основном летучим компонентом a). При температуре,
отвечающей точке 3, фиксирующей низкотемпературное пересечение трехфазовой кривой
(A) GLC, происходит нонвариантное кипение жидкости N
L
→ N
G
+N
C
вплоть до полного
исчезновения жидкости. Выше по температуре между точками 3 и 4 существует
моновариантная ассоциация газ + твердая фаза C. При температуре точки 4 -
высокотемпературное пересечение трехфазовой кривой - точка, названная нами выше
точкой ретроградного кипения. При подходе к этой точке со стороны более низких
температур реакция протекает обратно ретроградному кипению G+C → L и может быть
обозначена, как "ретроградная" конденсация. Обратим внимание на существенные
различия состава жидкости в точках N
L
и R
L
. В точке R
L
жидкость представляет расплав
твердой фазы C или, иначе говоря, солевой расплав, насыщенный в большинстве
изученных систем водой, как летучим компонентом. В точке N
L
жидкость - водный
раствор, содержащий компонент c в соответствии с его растворимостью при данных T и p.
В каждой из реальных систем составы жидкостей в точках R
L
и N
L
специфические (т.е.
присущие только этой системе), однако различие в составах R
L
и N
L
обычно более
существенное, чем это показано на схеме. После конденсации, при повышении
температуры заданный фигуративный состав попадает в поле G+L, где по мере
повышения температуры происходит выкипание жидкости. Состав газа при этом меняется
по кривой R
G
-5
G
, состав жидкости - по линии R
L
-5
L
. Сопряженная пара кривых R
G
-5
G
и
R
L
-5
L
описывается, как было показано выше, уравнением Ван-Лаара. После точки 5
G
заданный фигуративный состав будет существовать в виде гомогенной газовой фазы.
Изобарическое сечение p
5
пересекает пять моновариантных линий. В краевой системе c
линия кипения компонента c и линия плавления фазы c образуют на T-x диаграмме
нонвариантные точки кипения T
c
v
и плавления T
c
m
. В краевой системе a, аналогично,
существуют точки кипения T
a
v
и плавления T
A
v
. Наконец, в бинарной системе пересечение
эвтектической линии указывает нам температуру эвтектики T
E
, изотерма которой образует
нонвариантную конноду A+C → L
E
. Состав эвтектики сильно сдвинут в сторону
легкоплавкого компонента a. В большинстве систем существенно заметнее, чем показано
нами для наглядности на схеме (Е: 75% a, 25% c). Соединив эвтектическую точку E с T
A
m
и T
c
m
получим обычную диаграмму плавкости бинарной системы, подробно
рассмотренную выше. Для построения полного сечения осталось рассмотреть равновесие
газ = расплав. Нам известны точки кипения чистых компонентов, где составы жидкости и
пара совпадают. В бинарной системе от точки A к точке C пройдут две кривые,
описываемые уравнением Ван-Лаара. Верхняя - отражающая состав пара, равновесного с
жидкостью, ее можно обозначить, как кривую конденсации. Нижняя кривая обозначает
состав жидкости - кривая кипения. Мы уже неоднократно отмечали, что из уравнения
Ван-Лаара (3.60), или, более строго, из уравнения Ван-дер-Ваальса (3.61),
непосредственно вытекает первый закон Коновалова (иногда его называют законом
Гиббса-Коновалова): газовая фаза будет всегда содержать больше легколетучего и
легкоплавкого компонента, чем равновесная с газом жидкая фаза. Заметим, что
равновесиям газ = жидкость посвящена обширная физико-химическая и
термодинамическая литература, интересующиеся могут получить в ней дополнительные
детальные сведения: о законах Коновалова, законах Вревского, о строении сложных
диаграмм неидеальных растворов.