Вершигора А.Ю., Пастер Є.У., Колибо Д.В. Імунологія
Подождите немного. Документ загружается.


81
помітну його особливість. Клінічні мікробіологи намагаються знайти той мінімальний набір
біологічних характеристик, за допомогою якого можна буде гарантовано виявляти й ідентифікувати
патогенні мікроорганізми. Наприклад, деякі збудники виробляють специфічні біохімічні сполуки,
які й потрібно знайти в біологічному зразку. Часто подібну маркерну молекулу можна виявити
безпосередньо, провівши високоспецифічний біохімічний аналіз. Однак це надзвичайно
трудомісткий підхід. Більш придатні універсальні методи, що дають змогу виявити будь-яку
маркерну молекулу (діагностично значущий антиген) незалежно від її хімічної природи. Саме таким
є метод, що ґрунтується на застосуванні високоспецифічних антитіл до збудника або до його
діагностичних антигенів, та ідентифікація комплексів антиген – антитіло в тій чи іншій системі,
наприклад в імуноферментному чи імунофлуоресцентному аналізі.
Одним із підходів, що дає змогу визначити, чи відбулося зв'язування антитіла з антигеном-мішенню,
є серологічні методи. У них використовують або специфічні антигени для виявлення антитіл до
конкретного збудника в сироватці крові, або специфічні антитіла для виявлення власне збудника в
досліджуваному матеріалі.
Зі зростанням кількості робіт із вивчення антигенів різних збудників стало можливим створення
таких штучних антигенів, які б повністю відтворювали структуру природного білка і могли
використовуватись як компоненти діагностичних систем. Відомо, що в імунології штучні антигени
асоціюються з двома категоріями молекул:
1) модифіковані тими чи іншими хімічними групами природні високомолекулярні сполуки
(наприклад, антигени Ландштейнера);
2) істинно штучні антигени — синтезовані людиною комплекси, які повністю відтворюють
структуру природного антигену. Наприклад, після розшифрування групових антигенів еритроцитів
(Льюїс) їх одразу було синтезовано штучно. До таких молекул можна також віднести штучно
синтезований інсулін. Крім того, до них належать молекули, що не є точними аналогами природних
сполук (деякі синтетичні поліпептиди, штучні поліамінокислоти з розгалуженими ланцюгами), їх
будова імітує будову природних антигенів. Найбільший внесок у дослідження цих речовин зробили
Села і Бенацераф.
До синтетичних антигенів належать також молекули, що не мають аналогів у природі, їх
синтезували хіміки. Було встановлено, що такі молекули здатні стимулювати імунну відповідь.
Серед синтетичних молекул проводять пошук імуностимуляторів, аналогів вакцин, носіїв
детермінант різних збудників тощо.
Штучні антигени мали велике значення для розвитку імунології. За допомогою антигенів
Ландштейнера було вивчено молекулярні основи антигенності, визначено роль детермінантних
груп, установлено специфічність активних центрів антитіл (розмір, характер зв'язків антиген –
антитіло). За допомогою синтетичних поліпептидів Села та інших аналогів природних антигенів
вивчено закономірності генетичного контролю антитілогенезу, реакції гіперчутливості
сповільненого типу, відкрито перші гени контролю імунної відповіді. За допомогою антигенів, що
не мають аналогів у природі й побудовані на основі синтетичних поліелектролітів, виявлено
способи фенотипічної корекції імунної відповіді, яка дає можливість перетворити особини з
генетичне низькореагуючих на високореагуючі.
Синтетичні антигени мають не лише наукові, а й практичні переваги. Основними перевагами
застосування синтетичних антигенів є такі:
відпадає потреба у використанні інфекційного матеріалу (це важливо, коли збудник є особливо
небезпечним);
властивості продукту можна схарактеризувати точніше, тому не потрібна або спрощується система
контролю якості, препарати можна стандартизувати;
синтетичні пептидні реагенти зберігають стабільність необмежене тривалий час навіть за кімнатної
температури;
можна отримувати реагенти для діагностики таких інфекційних хвороб, збудники яких не
культивуються в штучних умовах;
вартість виробництва таких препаратів набагато нижча, ніж отримання звичайних антигенів.
На сьогодні штучні антигени знайшли широке затосування як компоненти діагностичних систем для
проведення діагностики на В-клітинному рівні. Визначення антитіл до збудника в сироватці крові
дає таку інформацію:
про епідеміологію інфекції; про стадію і перебіг інфекції у конкретного хворого;
про наявність інфекційних агентів у крові та продуктах крові;
про ступінь ефективності хіміотерапії при бактеріальних та паразитарних хворобах;
про використання їх у програмах вакцинації, особливо проти тих хвороб, за яких серологічна
ідентифікація збудника є найважливішою (наприклад, вірус грипу);
при визначенні етіології хвороб, які чають подібну симптоматику і діагностика яких іншими
методами складна (наприклад, гепатит і діарея);
про стадію хвороби, особливо при вірусних захворюваннях.
На відміну від В-клітинних, Т-клітинні діагностичні системи використовують ще недостатньо,
оскільки тести, що виявляють функції Т-клітин і розпізнавані ними антигени, надзвичайно складні й
не придатні для рутинного використання. Відомо, що Т-клітини розпізнають антиген тільки в
асоціації з МНС, тому для визначення потрібна наявність гістосумісних антигенпрезентувальних
клітин. Для Т-клітин характерна також значна генетична відмінність в імунореактивності. Є кілька
субпопуляцій Т-клітин, що відрізняються одна від одної за імунорегуляторними та ефекторними
функціями, наприклад, опосередковують шкірні реакції ГСТ, лізис АПК тощо. Т-клітини здатні
виконувати як захисні, так і патологічні функції. Потреба в захисних Т-клітинах визначається
природою патогену, його тропізмом та типом інфікованих клітин. Нині Т-тести є предметом
надзвичайно активних наукових досліджень.
ДНК-зонди. Діагностичні засоби на основі аналізу генетичних структур, що визначають
індивідуальність кожного організму, ґрунтуються на принципі комплементарності нуклеотидів
(праймерів), штучно синтезованих людиною. Серед методів визначення специфічного зв'язування
таких зондів з геномом збудника перше місце за чутливістю посідає полімеразна ланцюгова реакція
(ПЛР), яка дає можливість визначити одну молекулу ДНК. ПЛР замінила традиційну гібридизацію,
що в класичному варіанті використовувала як ДНК-зонди фрагменти ДНК з нанесеною
індикаторною частиною. ПЛР — це штучний процес багаторазового копіювання (ампліфікації)
специфічної послідовності ДНК, що здійснюється in vitro. Копіювання ДНК при ПЛР здійснюється
спеціальним ферментом — ДНК-полімеразою, як і в клітинах живих організмів. ДНК-полімераза,
рухаючись по одному ланцюгу ДНК (матриці), синтезує комплементарну їй послідовність ДНК.
Важливо, що ДНК-полімераза не може почати синтез ланцюга ДНК «з нуля», їй потрібен короткий
«затравковий» ланцюг РНК чи ДНК, до якого вона може почати приєднувати нуклеотиди. Основний
принцип ПЛР полягає в тому, що реакція полімеризації (синтезу полімерного ланцюга ДНК з
мономерних нуклеотидних ланок) ініціюється специфічними праймерами (короткими фрагментами
«затравкової» ДНК) у кожному з безлічі повторюваних циклів. Специфічність ПЛР визначається
здатністю праймерів «упізнавати» чітко визначену ділянку ДНК і зв'язуватися з нею відповідно до
принципу молекулярної комплементарності.
Універсальність, висока чутливість і відносна простота виконання зробили метод ПЛР незамінним
для вирішення різних завдань клінічної діагностики, таких як пряме виявлення та ідентифікація
збудників захворювань, молекулярне типування і дослідження властивостей патогенних
мікроорганізмів, аналіз мутацій, пов'язаних з генетичними захворюваннями людини, ідентифікація
особистості людини тощо.
22.2. ОТРИМАННЯ МОНОКЛОНАЛЬНИХ АНТИТІЛ.
Ефективність препаратів антитіл, отриманих при імунізації тварин, змінюється від однієї партії до
іншої, оскільки в одних випадках під час проведення імунізації антитілопродукувальні клітини
сильніше стимулюються одними детермінантами певного антигену, а в інших імунна система
активніше відповідає на інші епітопи того самого антигену. Це може впливати на здатність різних
препаратів антитіл сполучатися з антигенами, оскільки окремі епітопи мають різну ефективність
(стимулювальну здатність). Тому в одній партії поліклональних антитіл може міститися мало
молекул, спрямованих проти основного епітопа, і в результаті вона буде менш ефективною, ніж
інша. Щоб підвищити специфічність антитіл, для діагностики часто використовують моноклональні
антитіла. В-лімфоцити (В-клітини), що синтезують антитіла, не можуть тривалий час
культивуватися в культурі in vitro. Вирішення цієї проблеми дослідники бачили у створенні
гібридної клітини. Отримавши генетичну складову від В-клітини, вона могла б виробляти антитіла,
а отримавши здатність до поділу від клітин сумісного типу, — рости в культурі. Було відомо, що В-
лімфоцити іноді перероджуються і стають раковими (мієломними) клітинами, набуваючи здатності
до росту в культурі і зберігаючи разом з тим багато властивостей В-клітин. Так клітини мієломи,
насамперед ті, що не виробляють антитіл, стали кандидатами на злиття з антитілопродукувальними
В-клітинами.
Перший крок у процесі отримання гібридної клітинної лінії, що продукує антитіла однієї
специфічності, полягає у введенні мишам антигену – імунізації. Після циклу імунізації, проведеного
впродовж кількох тижнів, перевіряють, чи відбувся розвиток у тварин імунної відповіді. Якщо
відповідь розвинулася, то у тварин беруть селезінку, промивають її, подрібнюють і злегка
струшують для вивільнення одиничних клітин, серед яких знаходяться й антитілопродукувальні В-
клітини. Клітини селезінки змішують із суспензією спеціальних мієломних клітин, дефектних
(мутантних) за ферментом гіпоксантин-гуанін-фосфорибозилтрансферазою (ГГФРТ). Таку
суспензію впродовж кількох хвилин інкубують у 35 %-му розчині поліетиленгліколю, а потім
переносять у середовище, що містить гіпоксантин, аміноптерин і тимідин (середовище ГАТ).
Оброблення поліетиленгліколем сприяє злиттю клітин, проте воно відбувається рідко і є
здебільшого випадковою подією. У суміші містяться клітини мієломи, селезінки, а також гібридні
(ті, що злилися) клітини мієломи-селезінки. Однак у середовищі ГАТ ростуть тільки гібридні
клітини мієломи-селезінки, всі інші типи клітин гинуть. Клітини селезінки, що злилися, взагалі не
ростуть у культурі in vitro, а дефектні (мутантні) мієломні клітини ГГФРТ не можуть
використовувати гіпоксантин як попередник у процесі біосинтезу пуринових основ гуаніну й
аденіну, без яких неможливий синтез нуклеїнових кислот. Однак у них є інший природний шлях
синтезу пуринів — за участю дигідрофолатредуктази, тому до складу середовища і входить
аміноптерин, що інгібує активність цього ферменту. Отже, мієломні клітини ГГФРТ не можуть
синтезувати пурини в середовищі ГАТ і гинуть.
Клітини селезінки-мієломи, що злилися, ростуть у середовищі ГАТ, оскільки клітини селезінки
постачають функціональний фермент ГГФРТ, що надає гібридомі здатності утилізувати екзогенний
гіпоксантин середовища, незважаючи на блокування синтезу пуринів за участю
дигідрофолатредуктази аміноптерином, та за рахунок здатності клітин мієломи до активного поділу.
Тимідин потрібен для усунення блокування в синтезі піримідинів, зумовленого інгібуванням
дигідрофолатредуктази. На 10 —14-ту добу після злиття клітин у середовищі ГАТ залишаються і
ростуть тільки злиті гібридоми селезінки-мієломи. Їх потім вносять у заглиблення пластикових
мікротитрувальних планшетів і вирощують на повному культуральному середовищі без ГАТ.
Після проведення злиття й отримання гібридоми потрібно здійснити ідентифікацію (скринінг)
гібридних клітинних ліній, що секретують специфічні антитіла до антигену, який використали для
імунізації. Для цього зазвичай проводять скринінг культуральних середовищ, що містять антитіла,
які секретуються, наприклад, імуноферментним аналізом. Щоб отримати лінії, які походять від
однієї клітини (клони), клітинну суспензію з таких заглиблень розбавляють культуральним
середовищем і висівають в інші заглиблення. Після культивування отриманих клонів середовища
знову тестують, визначаючи, яка з клітинних ліній (гібридом) продукує моноклональні антитіла
(МкАТ), що розпізнають антиген-мішень. У тому разі, коли отримують більш як одну специфічну
гібридому, проводять подальші дослідження, що дають змогу визначити, чи спрямовані антитіла,
які виробляються різними клонами, проти однієї й тієї самої антигенної детермінанти. Кожний клон,
що продукує моноклональні антитіла, можна підтримувати в культурі практично нескінченно. Крім
того, зразки можна заморозити в рідкому азоті й використовувати їх надалі як джерело клітин.
Іноді використовують культивування гібридом в організмі мишей. Для цього гібридому вводять у
черевну порожнину мишей сумісної генетичної лінії після попереднього пригнічення їхньої імунної
системи, наприклад, введенням мінерального масла. Гібридома (власне злоякісна пухлина)
приживається у черевній порожнині миші, починає розмножуватися і синтезувати значну кількість
антитіл, які можна виділити із асцитної рідини.
Химерні молекули (гуманізовані ан|титіла). Отримані за гібридомною технологією МкАТ мають
абсолютно однакову специфічність, належать до одного класу, підкласу імуноґлобулінів і є
практично стандартними препаратами, характеристики яких не залежать від умов утримання
тварин, індивідуальних особливостей тощо. У зв'язку з цим нині МкАТ знайшли широке
застосування для виділення високоочищених препаратів деяких речовин, як компоненти
діагностичних препаратів, нові типи вакцин, імунотерапевтичні засоби.
Так, багато МкАТ були тестовані на здатність пригнічувати відторгнення пересаджених тканин та
впливати на перебіг аутоімунних хвороб. Однак виникла проблема отримання МкАТ, придатних для
терапії людей. Оскільки за своєю природою МкАТ є переважно мишачими, це значно обмежує їх
використання як терапевтичних препаратів через їх імуногенність для людини. При введенні
мишачих МкАТ в організмі людини утворюються антитіла проти них. Це не лише призводить до
блокування дії антитіл миші, а й може зумовити появу алергічної реакції і навіть анафілактичного
шоку.
Уникнути цих проблем вдалося лише з використанням сучасних методів генної інженерії. За
допомогою маніпуляцій з генами було отримано химерні молекули імуноґлобулінів – гуманізовані
антитіла. При створенні таких антитіл враховують імуногенність окремих ділянок молекули
імуноглобуліну та їх роль у здійсненні ефекторних функцій. Насамперед було замінено Fc-фрагмент
мишачих МкАТ відповідною ділянкою антитіла людини. Це пов'язано з тим, що Fc-фрагмент
мишачих МкАТ при введенні їх в організм людини виконує роль ефектора імунної відповіді
недостатньою мірою і саме він в основному відповідає за індукування синтезу антитіл проти
мишачих антитіл.
Для зменшення імуногенності методами генної інженерії провели також заміну послідовностей
ДНК, що кодують Fv-ділянки L- і Н-ланцюгів імуноглобуліну людини на аналогічні ділянки
мишачих специфічних МкАТ. Такі химерні молекули були протестовані як імунотерапевтичні
препарати, наприклад, при лікуванні раку товстої кишки. Ще більш перспективним напрямом
отримання гуманізованих антитіл є створення таких людських антитіл, у яких лише гіперваріабельні
(CDR) ділянки замінено відповідними фрагментами МкАТ мишей та щурів. Такі антитіла можуть
бути перспективними імунотерапевтичними засобами, оскільки можуть мати будь-яку
специфічність при збереженні практично повністю людського походження. З використанням
сучасних методів спрямованого мутагенезу можна замінити й деякі амінокислоти з каркасних
ділянок, що певною мірою беруть участь у формуванні активного центру поряд з
гіперваріабельними ділянками.
На сьогодні відомо понад 50 різних МкАТ, подібних до антитіл людини. Така досить невелика їх
кількість пов'язана з тим, що описані технології — ефективні й універсальні, проте є надзвичайно
затратними як за часом, так і за вартістю. Тому все актуальнішими стають нові технології
отримання функціональних антитіл у культурі рекомбінантних клітин Е. соlі.
22.3. БІОТЕХНОЛОГІЧНІ ПРОДУКТИ, ЯКІ ВИКОРИСТОВУЮТЬ ДЛЯ ВПЛИВУ НА
ІМУННУ СИСТЕМУ.
22.3.1. Інтерферони
Родину білків, ідентифікованих у риб, птахів, рептилій і ссавців як антивірусних аґентів широкого
спектра дії, називають інтерферонами. Ці білки було виявлено під час вивчення вірусної
інтерференції (тварина, інфікована одним вірусом, є стійкою до інфікування іншим неспорідненим
вірусом). Інтерферони впливають на ріст клітин і функції імунної системи. Така дія інтерферонів на
клітини зумовлена змінами в метаболізмі, що виникають після зв'язування інтерферону зі
специфічним рецептором. Інтерферони досліджували переважно як антивірусні агенти. Вони
сприяють лікуванню застудних захворювань, гепатитів, оперізувального лишаю тощо. Вважають,
що при вірусній інфекції клітини синтезують інтерферон і секретують його в міжклітинний простір,
де молекули інтерферону зв'язуються з рецепторами сусідніх неінфікованих клітин. У клітині під
дією інтерферону дерепресуються мінімум два гени і починається синтез двох ферментів —
протеїнкінази, що фосфорилює рибосомальний білок, та факторів ініціювання, потрібних для
трансляції. Таким чином, трансляція мРНК пригнічується. Другий фермент каталізує утворення
короткого полімеру аденілової кислоти, яка активує латентну ендонуклеазу, що призводить до
деградації мРНК як вірусу, так і клітини-хазяїна. В будь-якому випадку кінцевим результатом дії
інтерферону є утворення бар'єра з неінфікованих клітин навколо осередку вірусної інфекції.
Про ефективність дії інтерферону in vivo свідчать досліди з уведення інфікованим мишам
антисироватки до власних інтерферонів. При цьому летальна доза вірусу була в кількасот разів
меншою, ніж у контрольній групі. Було показано, що інтерферони важливі не тільки для лікування,
а й для профілактики цілої низки захворювань.
Інтерферони як система білків мають значно ширшу біологічну дію. Ферменти, синтез яких
індукують інтерферони, здатні пригнічувати поділ клітин хазяїна, модулювати активність інших
клітин (наприклад, НК), тобто розглядаються як перспективні протипухлинні препарати.
Інтерферони утворюються не лише в організмі людини, а й у інших хребетних. Доведено, що
інтерферони є чітко видоспецифічними білками. Тому інтерферони тваринного походження не
вдається успішне застосовувати для лікування людини.
Інтерферони продукуються, як правило, у відповідь на дію різних стимуляторів. Ці стимулятори
називають індукторами інтерфероногенезу. Ними можуть бути віруси, хімічні речовини, а також
імунологічні взаємодії.
За антигенними властивостями інтерферони поділяють на альфа (лейкоцитарний); бета
(фібробластний); гамма (імунний).
У людини формується значна кількість підтипів альфа-інтерферону (нині відомо 23), і вони є
найсильнішими антивірусними агентами, тоді як ідентифіковано один основний тип людського
бета-інтерферону, який є сильним противірусним агентом. Людський гамма-інтерферон має
незначну подібність до альфа- і бета-інтерферонів. Він є модулятором імунної відповіді. Природні
молекули бета- і гамма-інтерферонів глікозильовані.
Отримання альфа-інтерферону. Перші спроби отримання інтерферонів було здійснено в середині
50-х років минулого століття. Першим способом отримання альфа-інтерферону було добування
його з клітин периферичної крові людини, активованих вірусом Сендай. Проте цей спосіб
характеризувався надзвичайно низьким виходом. За його допомогою отримували невеликі кількості
інтерферону, не придатні для широкомасштабного клінічного використання.
Нині застосовують два способи: генно-інженерний, за якого альфа-інтерферон експресується
культурою клітин Е.соlі, трансформованої вектором, в який вбудовано послідовність ДНК, що кодує
зрілий білок, та отримання інтерферонів у культурі лімфобластоїдних клітин. За цим способом
грубий матеріал з культури лімфобластоїдних клітин, попередньо активованих вірусом Сендай,
очищали на імунохроматографічних колонках (імуно-афінна хроматографія із моноклональними
антитілами, специфічними до альфа-інтерферону). У зв'язку з використанням для вироблення
інтерферону лімфобластоїдних клітин виникло кілька запитань з прриводу можливості
використання трансформованих клітин у біотехнологічних процесах виробництва медичних
препаратів. Деякі лінії, особливо отримані з клітин лімфоми Беркіта, є злоякісними. Використання
трансформованих клітинних ліній, особливо пухлинного походження, для виробництва медичних
препаратів було вперше застосовано саме для отримання альфа-інтерферону. На сьогодні
загальновизнаним є те, що перещеплювані лінії можна використовувати для виробництва
фармацевтичних препаратів у разі достатнього очищення кінцевого продукту та виконання певних
вимог.
Особливу увагу під час отримання інтерферонів з культур лімфобластоїдних клітин звертають на
можливу наявність у готовому продукті таких домішок:
1) біологічно активних сторонніх агентів (ДНК, білки, сторонні інфекційні агенти, ендогенні
ретровіруси). Ці агенти можуть міститися в неочищеному препараті, але не в готовому продукті;
2) матеріалів з культурального середовища, речовин, які використовують для посилення
продукування інтерферону, індукторів інтерфероногенезу, а також речовин, що використовувались
для очищення препарату.
Відразу після отримання перших партій синтетичного альфа-інтерферону його почали досліджувати
на можливість використання для лікування онкологічних захворювань.
Бета-інтерферон (фібробластний) синтезується фібробластами. Фібробласти легко підтримувати в
культурі, однак вони ростуть лише у вигляді моношару. Для збільшення площі поверхні у
ферментери вносять спеціальні гранули субстрату. Фібробластний інтерферон також досліджували
на можливість використання для лікування множинної мієломи, раку молочної залози.
Гамма-інтерферон (імунний) отримують при культивуванні Т-лімфоцитів людини за наявності
мітогенів. Ця технологія також є традиційною, її характеризують низький вихід, висока вартість
очищення та низька чистота отриманих препаратів. Усі надії на масштабне виробництво
інтерферонів покладають на технології рекомбінантних ДНК.
Біосинтез інтерферонів у клітинах генетично модифікованих організмів. Клонувати гени
інтерферону було значно складніше, ніж у перших успішних експериментах, проведених за
допомогою генної інженерії. Для перших рекомбінантних молекул (інсулін, гормон росту) була
відома послідовність амінокислот. Для інтерферону таких відомостей не було. Тому було зроблено
спроби пошуку можливих способів отримання інтерферону на основі його противірусної
активності.
У 1989 р. Гілберт і Вайсман з Бостона повідомили, що їм вдалося отримати інтерферон людини в
генетично модифікованих мікроорганізмах. Цей дослід ґрунтувався на спостереженні, що при
ін'єкції мРНК з інтерферонпродукувальних лімфоцитів у гігантські ооцити Xenopus в останніх
синтезується інтерферон. Було визначено розмір матричної РНК альфа-інтерферону. Для цього полі-
А-вмісну РНК з інтерферонпродукувальних клітин фракціонували, окремі фракції вводили в ооцити
і визначали противірусну активність білкових продуктів. Активність було зафіксовано при ін'єкції в
ооцити 12S РНК, і саме цю фракцію було використано для конструювання бібліотеки кДНК в
плазміді pBR322. Було перевірено близько 20 000 клонів Е. соlі, отриманих при трансформації
плазмідами бібліотеки. Послідовності було ідентифіковано гібридизацією індивідуальних клонів
кДНК з альфа-інтерфероновою мРНК шляхом соузерн-блотингу. Спочатку виділяли великі групи, з
яких потім відбирали менші підгрупи в межах цього клону. Для доведення того, що кДНК кодує
саме інтерферон, її вбудовували в бактерію і реєстрували противірусний ефект продукту. Одразу
після отримання рекомбінантного альфа-інтерферону тими самими методами було клоновано кДНК
бета- і гамма-інтерферонів.
Було показано, що гени альфа- і бета-інтерферонів близькі за нуклеотидним складом. Гени альфа-
інтерферону належать до великої генної родини, яка кодує різні субтипи альфа-інтерферону, а
також його неактивні форми. Для бета-інтерферону було клоновано лише один ген. Усі гени й
псевдогени альфа-інтерферону, а також єдиний ген бета-інтерферону локалізовані в 9-й хромосомі.
Деякі з них тісно зчеплені між собою. Жоден з генів альфа-інтерферону і ген бета-інтерферону не
містять інтронів. Бета- і деякі альфа-інтерферони глікозильовані.
У перших успішних генно-інженерних експериментах синтез був малоактивним. Підвищити
активність можна було завдяки використанню інших векторів або потужніших промоторів. Це
вдалося здійснити, використовуючи конструкції, що включали промотор лак-оперону.
Продукування підвищилося в десятки разів, що дало змогу отримувати 1 мг інтерферону з 1 л
культури. Одразу після вдалих експериментів з Е. соlі було використано еукаріотичні моделі —
дріжджі Saccharomyces. Саме на прикладі альфа-інтерферону було показано можливість експресії
генів людини в клітинах дріжджів. При трансформації Saccharomyces використали конструкцію,
здатну ефективно реплікуватися як у клітинах дріжджів, так і в бактеріальних клітинах — так звані
човникові вектори. В цьому досліді ген альфа-інтерферону об'єднували з геном
алкогольдегідрогенази дріжджів, що має потужний промотор. Для дріжджової системи характерний
дуже високий вихід. Крім того, глікозилювання та дозрівання молекул білків у дріжджів
відбувається за тими самими принципами, що й в інших еукаріотів, що особливо важливо для
отримання білків людини.
Клонування генів гамма-інтерферону. Клонування генів гамма-інтерферону виявилося
найскладнішим. По-перше, важко було індукувати продукування гамма-інтерферону. Препарати
мРНК із селезінки людини, в яких за допомогою бактеріального токсину було індуковано
продукування гамма-інтерферону, розділяли за розмірами і вводили різні фракції в ооцити Xenopus.
Було отримано 18S мРНК, продукт трансляції якої мав антивірусну активність. На її основі було
створено кДНК, яку ввели Е. соlі в складі космідного вектора. Рекомбінанти розмножували в
клітинах Е. соlі і досягали експресії. Клони використовували для селекції відповідного
хромосомного гена в бібліотеці кДНК людини у векторах на основі фага лямбда. Таким чином було
ідентифіковано і секвеновано ген гамма-інтерферону. Він містить 3 інтрони і 4 екзони, є унікальним
і міститься в єдиній копії в 12-й хромосомі. Відсутність інтронів у генах альфа- і бета-інтерферонів
має велике значення, оскільки вони синтезуються в інфікованій вірусом клітині, їх синтез не
залежить від сплайсингу, який в інфікованій клітині може бути порушений.

82
При отриманні гамма-інтерферону було показано, що він ефективно продукується рекомбінантними
клітинами (Е. соlі — 25 000 од/л, дріжджі - 1 000 000 од/л). На сьогодні відомі роботи із синтезу
гамма-інтерферону в клітинах мавп, однак зі значно меншим виходом.
22.3.2. Вакцини.
Інфекційні хвороби були і практично залишаються головною причиною смертності. Вагомим
внеском у підтримання здоров'я населення за останні 100 років було введення в практику санітарних
норм та вакцинації, які значно знизили рівень смертності від інфекційних хвороб. Сучасна
імунологія розвинулася завдяки успіхам Е. Дженнера і Л. Пастера у вакцинації проти віспи та
курячої холери. Величезним її тріумфом є глобальне викорінення натуральної віспи, проголошене
Всесвітньою організацією охорони здоров'я в 1980 р. Нині триває глобальна кампанія щодо
знищення поліомієліту.
Індукування імунності проти інфекційних агентів можна досягти кількома шляхами. Найдавніший
підхід полягав в умисному спричинюванні слабкої інфекції при введенні незміненого патогену. Це
був принцип варіоляції, за якої інокуляція малої кількості сухого матеріалу з пустул віспи
зумовлювала слабку інфекцію, що супроводжувалась довготривалим періодом стійкості до
виникнення повторного захворювання. Однак не завжди при варіоляції інфекція, що виникла, була
слабкою: летальні випадки віспи становили близько 3 %, що не відповідає сучасним критеріям
безпеки. Досягненням Е. Дженнера було усвідомлення того, що інфекція, яку зумовлює коров'ячий
аналог віспи, вакцина (від лат. vacca — корова), названа коров'ячою віспою, може сформувати
захисну реакцію проти віспи у людей без ризику тяжкого перебігу захворювання. Він назвав цей
процес вакцинацією, а Л. Пастер на його честь поширив цей термін на стимулювання захисту від
інших інфекційних агентів. Людина не хворіє на природну форму захворювання при вакцинації, у
неї формується тільки короткотривала й обмежена інфекція, але антигени, які містить вакцина,
стимулюють імунну відповідь, що має перехресну реактивність з антигенами збудника натуральної
віспи, і тому виникає стійкість до людської форми захворювання.
Так сформувалися головні принципи безпечної та ефективної вакцинації. Розроблення вакцин на
початку XX ст. відбувалося двома емпіричними способами: перший — отримання атенуйованих
мікроорганізмів зі зниженою патогенністю, що могли б стимулювати протективну імунність; другий
— отримання вакцин, що ґрунтується на використанні вбитих мікроорганізмів та попередньо
очищених їх компонентів, які могли бути так само ефективними, як цілий живий організм, але
більш безпечними.
Нині імунізацію вважають настільки безпечною та важливою, що у більшості країн практично все
дитяче населення вакцинують (щеплюють) проти вірусів кору, епідемічного паротиту та
поліомієліту атенуйованими вакцинами, так само як проти правця (збудник Clostridium tetani),
дифтерії (збудник Corynebacterium diphtheriae) та коклюшу (збудник Bordetella pertussis) –
інактивованими токсинами або анатоксинами. Нещодавно почали застосовувати вакцини проти
Haemophilus В, одного з агентів, що спричинює менінгіт, проти вірусу гепатиту В.
Проте є ще багато хвороб, для яких немає ефективних вакцин. Крім того, навіть якщо
загальновживані вакцини можуть бути ефективно застосовані у розвинених країнах, технічні та
економічні проблеми можуть завадити повсюдному застосуванню їх у країнах, що розвиваються, де
смертність від цих хвороб утримується на високому рівні. Тому розвиток вакцинації залишається
важливою метою імунології, і друга половина минулого століття була присвячена пошуку більш
раціонального підходу, що ґрунтується на глибокому розумінні молекулярних основ патогенності
мікроорганізмів, аналізі захисної реакції хазяїна на патогенний організм та розумінні регуляції
імунної системи в генеруванні ефективної Т- і В-лімфоцитної відповіді.
Ефективність вакцинації залежить від природи збудника інфекції та реакції на нього імунної
системи людини. Антитіла забезпечують найважливіший механізм захисту хазяїна від
позаклітинних мікроорганізмів (наприклад, основна маса бактерій), тоді як для контролю
внутрішньоклітинних патогенів (віруси, деякі найпростіші) важливою є також відповідь CD8 Т-
лімфоцитів. Ідеальна вакцинація забезпечує захист хазяїна у точці вхідних воріт інфекції, тому
стимулювання місцевого імунітету є важливим моментом вакцинації проти тієї значної кількості
мікроорганізмів, які проникають крізь слизові оболонки.
Для формування ефективного захисту проти деяких мікроорганізмів на момент появи інфекції
потрібна наявність антитіл, що утворилися раніше. Наприклад, клінічна маніфестація правця й
дифтерії цілком зумовлена дією надзвичайно сильних екзотоксинів. Існуючі антитіла проти
бактеріального екзотоксину потрібні для забезпечення захисту від цих хвороб. Ці антитіла потрібні
також для захисту від деяких внутрішньоклітинних патогенів, таких як вірус поліомієліту, що
інфікують чутливі клітини хазяїна невдовзі після потрапляння в організм і при цьому погано
контролюються Т-лімфоцитами, тому потрібна їх елімінація ще до потрапляння в клітину.
Імунна відповідь на інфекційні аґенти зазвичай складається із синтезу антитіл, спрямованих на
велику кількість епітопів, однак тільки деякі з цих антитіл забезпечують захист. Особливі Т-
клітинні епітопи розпізнавання також можуть впливати на природу відповіді. Наприклад, домінуючі
епітопи, розпізнані Т-клітинами після вакцинації респіраторним синцитіальним вірусом, індукують
не тільки значну запальну реакцію, а й зумовлюють нейтралізацію антитіл, спричинюючи тим
самим патологію за відсутності захисної функції. Таким чином, ефективна вакцина має
спричинювати генерування антитіл і Т-клітин, спрямованих на певний епітоп інфекційного агента.
Для деяких сучасних препаратів вакцини, в яких використовують лише один чи кілька епітопів, це
положення особливо важливе. Є ще кілька дуже важливих умов, які має задовольняти дієва вакцина.
По-перше, вона має бути безпечною. Вакцину потрібно надати великій кількості людей, порівняно
невелика кількість з них може загинути або іноді захворіти на хворобу, якій вакцина мала б
запобігти. Все це означає, що вакцина не повинна мати навіть низький рівень токсичності. По-друге,
вакцина має бути здатною виробляти захисний імунітет у значного відсотка населення, на якому її
було застосовано. По-третє, оскільки неможливо охопити «стимулювальною» вакцинацією велику
або розосереджену сільську популяцію, вдала вакцина має стимулювати виникнення довготривалої
імунної пам'яті. Це означає, що Т- і В-лімфоцити мають бути стимульовані вакциною. По-четверте,
вакцина має бути дешева, якщо її застосовуватимуть на великих популяціях. Вакцини є одним із
найрентабельніших, з погляду їх вартості, заходів у збереженні здоров'я, проте ця перевага зникає,
коли зростає собівартість їх дози.
Вакцину вважають нешкідливою, якщо вона не спричинює в щепленому організмі патологічних
симптомів, погіршення загального стану та виділення з організму специфічного збудника, який
може інфікувати нещеплених і зумовити появу в них захворювання. Нешкідливість вакцин
оцінюють за такими параметрами:
живі та вбиті вакцини мають бути звільнені від будь-яких біологічних контамінантів і
непередбачених технологією вірусних продуктів;
усі типи вакцинних препаратів не повинні містити токсичних речовин вірусного або клітинного
походження;
живі вакцини мають бути достатньо імуногенними без проявів клінічних та інших сторонніх
реакцій.
Основні тести, які використовують для оцінювання нешкідливості вакцин, такі:
застосування високих доз у ветеринарії та апробація вакцин для людей на тваринах;
контроль на пірогенність in vitro або in vivo;
убиті вакцини досліджують на бактеріальну контамінацію;
ідентифікація сторонніх агентів у різних системах in vitro та in vivo, аналіз нешкідливості в умовах
епідеміологічного польового досліду;
для вакцин на основі полімерних імуностимуляторів крім традиційних методів контролю
біологічних і хімічних параметрів потрібно вивчати питання метаболізму та виведення з організму
після виконання вакцинами корисної функції.
Існує поділ на традиційні та нетрадиційні вакцини. Традиційними є такі типи вакцинних препаратів:
живі, інактивовані, хімічні та кон'юговані. Усі традиційні вакцини — це, як правило, суміш
антигенного матеріалу та цільових домішок: ад'юванту, консерванту, стабілізатора тощо.
Жива вакцина — це живі штами збудників у певному стабілізаторі (без ад'ювантів і консервантів).
Зазвичай живі вакцини описують як просту механічну суміш усіх компонентів із зазначенням
використаних штамів та їх кількісного вмісту. Титр антигену — умовний показник у серологічній
реакції. Живі штами можна ідентифікувати, використовуючи стандартні методи (методи чистих
культур, фізико-хімічні та ін.). Є специфічні ознаки, характерні тільки для штаму, що входить до
складу вакцини: антигенна структура, імуногенність, специфічна нешкідливість, залишкова
вірулентність, онкогенність, серологічні властивості та стабільність атедуації. Залежно від того,
скільком хворобам запобігає вакцина, їх можна поділити на моно- і полівалентні. Полівалентні
вакцини особливо цінні, оскільки в разі використання кількох вакцин одночасно спостерігається
синергізм їхньої дії.
Інактивовані вакцини за своїм принципом належать до композицій, отриманих шляхом
змішування таких компонентів: штам збудника, інактивованого хімічним чи фізичним способом;
засоби, що підвищують імуногенні властивості основного компонента (консервант і ад'ювант). Для
характеристики інактивованих вакцин використовують ті самі принципи, що й для живих, однак
потрібно зазначати й тип консерванту (особливо коли використовують хімічну інактивацію
патогену) та ад'юванту.
Хімічні вакцини — певна композиція антигенних матеріалів, отриманих тим чи іншим способом зі
збудника та цільових домішок. Антигенний матеріал може бути отримано зі збудника певною
обробкою або з культурального середовища (токсин). Як правило, він є молекулярним комплексом
часто невідомого складу й структури. Специфічна ідентифікація цих вакцинних препаратів
забезпечується застосуванням серологічних методів. Вони дають можливість ідентифікувати окремі
компоненти антигенної суміші. Для характеристики використовують також інші ознаки, наприклад:
призначення антигену (для профілактики якого захворювання використовується), джерело
виділення, методи виділення та очищення. У повному паспорті препаратів має бути зазначено
природу виділеного антигену, ознаки, що характеризують його якість: антигенну активність,
серологічну активність, імуногенність (здатність створювати гуморальний та клітинний імунітет).
Протективний ефект антигену — ще одна обов'язкова ознака. Крім того, для вакцин цього типу
зазначають токсичність, стійкість до протеолізу, термолабільність, імунохімічні або інші засоби
контролю гомогенності й пірогенності.
Кон'юговані вакцини — різновид хімічних вакцин. Вони різняться принципом сумісності
компонентів у складі препарату. У хімічних вакцинних препаратах антигенний матеріал і ад'ювант –
це проста механічна суміш компонентів, а в кон'югованих вакцинах антигенну молекулу
ковалентним зв'язком приєднують до імуностимулювального носія. Імуностимулювальний носій —
високомолекулярні полімери (білки, поліцукриди, синтетичні полімери). Кон'юговані вакцини
можна включити в групу іммобілізованих біологічно активних речовин. Ознаками їх є якісний та
кількісний склад, хімічний зв'язок між компонентами, призначення та корисні властивості.
Конструювання кон'югованих вакцин здійснюють на хімічній основі. Нині удосконалюють
технології в напрямі стабілізації антигенів, вибору носіїв, методів ковалентного (або іншого)
зв'язування носіїв.
Нетрадиційні вакцини — принципово нові вакцинні препарати, розроблені на основі передових
технологій з урахуванням знань механізмів імунної відповіді. Мішенню дії таких вакцин є
конкретна ланка імунної відповіді. Нині ці вакцини перебувають, як правило, на стадії дослідження.
До них належать такі типи: генно-інженерні, синтетичні, антиідіотипічні.
Синтетичні вакцини — індивідуальний макромолекулярний комплекс зі встановленою
структурою. Для опису цих вакцин використовують назву за хімічною номенклатурою, опис
радикалів і груп та їх значення, основні корисні властивості, насамперед імуногенність.
Антиідіотипічні вакцини є практично моноклональними антитілами, для яких характерна певна
сфера застосування. На сьогодні запатентовано всього кілька препаратів таких вакцин.
Генно-інженерні вакцини отримують за допомогою генно-інженерного конструювання живих
рекомбінантних вакцинних препаратів; генно-інженерного удосконалення традиційних вакцинних
препаратів; генно-інженерного отримання конкретних поліпептидів, що мають ту чи іншу
антигенну специфічність та ін. Особливим типом нових нетрадиційних вакцинних препаратів є
ДНК-вакцини, тобто привнесення ДНК, що кодує мікробний антиген, в організм людини, наприклад
у м'язи. Ці останні досягнення у вакцинації стали несподіванкою навіть для вчених, які
започаткували цей метод. Історія почалася зі спроб використання не здатних до реплікації
бактеріальних плазмід, що кодують білки для генної терапії: у білків, які експресуються in vivo з цих
плазмід, було виявлено здатність до стимулювання імунної відповіді. Коли ДНК, що кодувала
вірусний імуноген, вводили внутрішньом'язово, це призводило до появи відповіді у вигляді антитіл і
цитотоксичних Т-клітин, що давало змогу миші уникнути наступного ураження цілим вірусом. Ця
відповідь не позначається шкідливо на м'язовій тканині, вона безпечна та ефективна, оскільки
використовується тільки один мікробний ген (фрагмент мікробної ДНК), вона не несе ризику
виникнення активної інфекції. Цю процедуру було названо «ДНК-вакцинацією». Одним із способів
введення ДНК стало її внесення спеціальним «генним пістолетом», за допомогою якого
мікрочасточки, покриті ДНК, вводяться через шкіру і потрапляють у м'язи, розміщені під нею. Така
технологія виявилася ефективною при застосуванні на тваринах і, можливо, придатна для масової
імунізації людей, але ще перебуває на стадії випробування. Об'єднання в плазмідах (векторах) генів,
які кодують захисні антигени, з генами, що кодують деякі цитокіни, робить ДНК-вакцинацію значно
ефективнішою.
Досі лишається невідомим, як працює ДНК-вакцина. Чому ДНК-плазміди ефективно експресуються
в м'язовій тканині? Чи то м'язові клітини викликають імунну відповідь, чи тканинні дендритні
клітини захоплюють ДНК і починають експресувати її? Яким чином лімфоцити стикаються з
антигеном, якщо він експресується в м'язовій клітині? Наскільки безпечним є цей метод і наскільки
придатним він буде взагалі?
Перспективним засобом підвищення ефективності вакцин є спрямування їхньої дії на
антигенпрезентувальні клітини. Це є важливим механізмом впливу ад'ювантів, що входять до
складу вакцин. Існує трі підходи. Перший полягає в запобіганні протеолізу антигену на його шляху
до антигенпрезентувальної клітини. Збереження структури антигену є вагомою причиною того, що
багато вакцин вводять переважно ін'єкцією, а не перорально, коли вакцина перетравлюється в
кишках. Другий і третій підходи – надання вакцинам селективності в організмі до
антигенпрезентувальних клітин та розроблення методів генної інженерії для селективного
залучення вакцин до шляхів процесингу антигену в середині клітини.
ВИСНОВКИ.
Імунологія, як наука, що вивчає механізми функціонування імунної системи, стала науковою
основою однієї з найважливіших галузей сучасної біотехнології — імунобіотехнології. Її основне
завдання — отримання та широкомасштабне виробництво високоспецифічних речовин для впливу
на саму імунну систему з метою лікування та профілактики інфекцій, алергії, аутоімунних і ракових
захворювань, а також низки високоспецифічних речовин, насамперед для біоіндикації різних
сполук. Методичними підходами сучасної імунобіотехнології є генна та клітинна інженерія. На
сьогодні отримані й використовуються сучасні діагностичні препарати на основі синтетичних та
рекомбінантних антигенів, ДНК-зондів тощо. Гібридомна технологія отримання моноклональних
антитіл відкриває перспективи для створення високоспецифічних діагностичних засобів,
профілактичних і терапевтичних препаратів, наприклад гуманізованих антитіл та ін. Інтерферони,
отримані з культури клітин та з використанням генно-інженерних маніпуляцій, використовують для
лікування не лише вірусних хвороб, а й численних ракових захворювань. Створені нові
біотехнологічні препарати для підсилення імунної відповіді, насамперед вакцини, відкривають
перспективи ефективнішої профілактики багатьох інфекційних хвороб.
Контрольні запитання.
1. Дайте визначення біотехнології.
2. Назвіть сучасні діагностичні препарати.
3. Які біотехнологічні продукти використовують для впливу на імунну систему?
4. Які біотехнологічні препарати використовують для підсилення імунної відповіді?
5. Які є типи вакцинних препаратів?
6. Які тести використовують для оцінювання нешкідливості вакцин?
ДОДАТКИ.

83
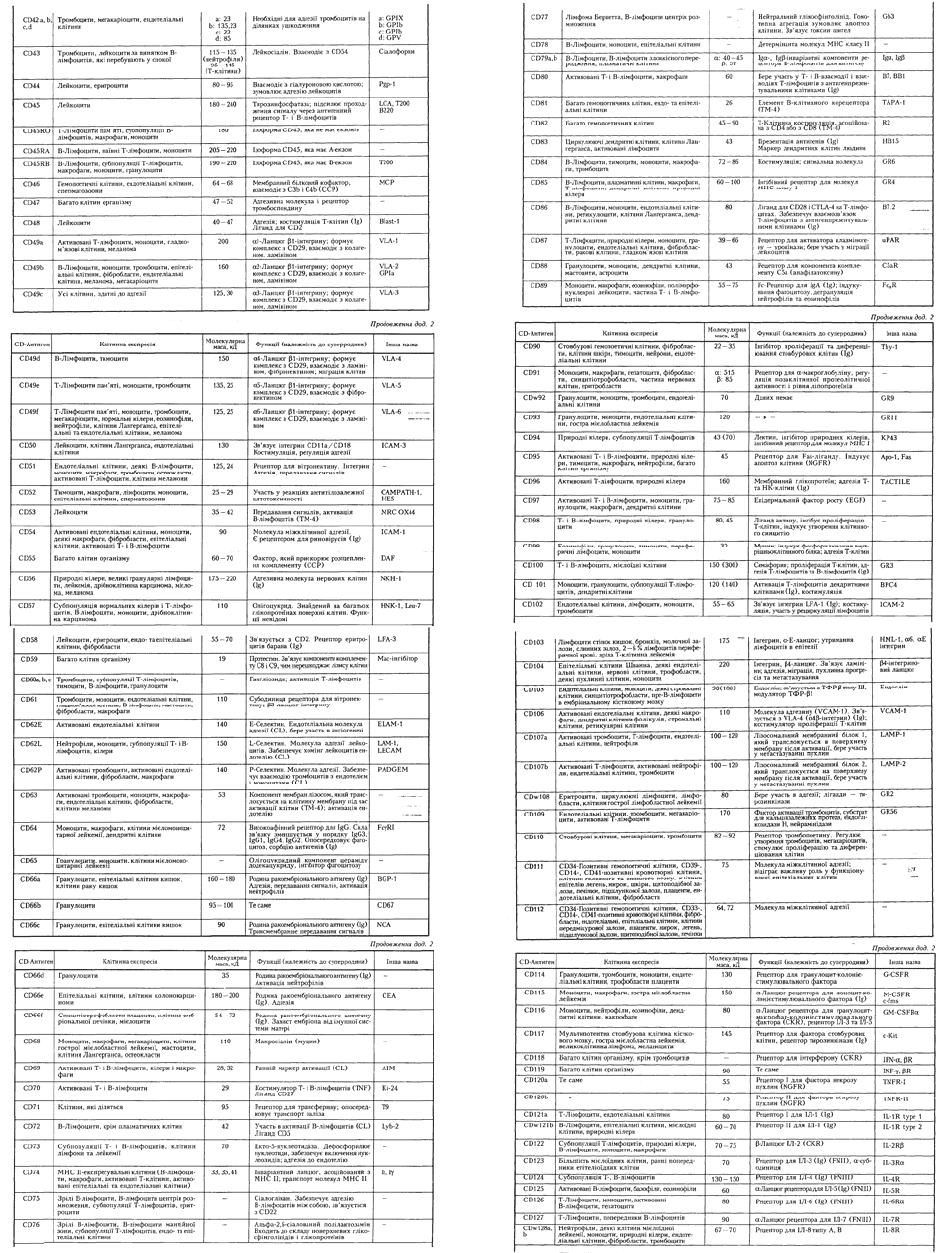
84
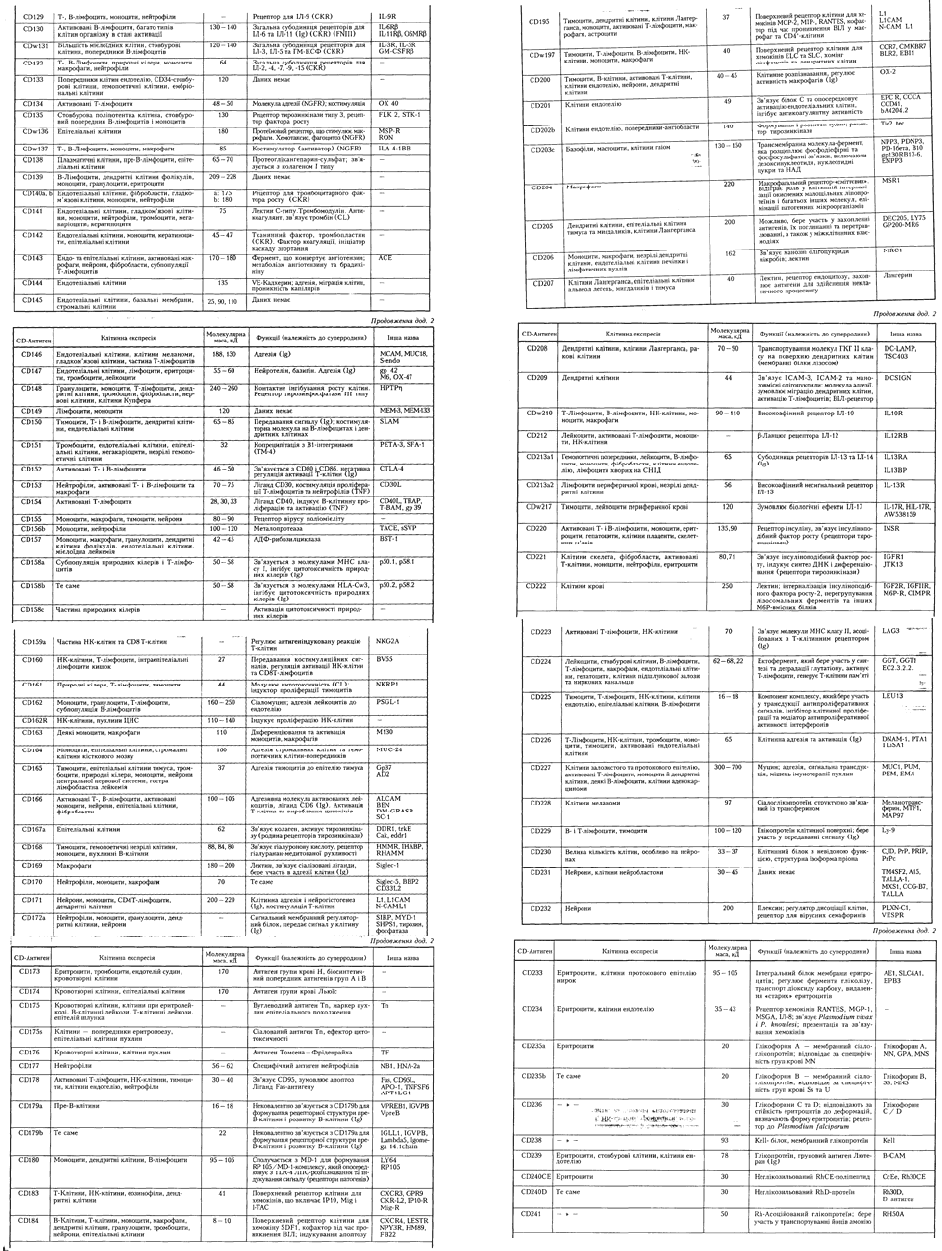
85

86

87
