Вершигора А.Ю., Пастер Є.У., Колибо Д.В. Імунологія
Подождите немного. Документ загружается.

21
Яскраво виражені антигенні властивості має білок флагелін, з якого складаються бактеріальні
джгутики. Це так званий джгутиковий (Н-антиген) бактерій. Для антигену цього типу характерна
термолабільність, висока типова варіабельність, відносно невисока протективна активність. Пілін,
або білок, з якого складаються пілі бактерій, також характеризується антигенністю, відмінною від
антигенності флагеліну.
Клітинна стінка бактерій містить кілька типів макромолекул з високою антигенною активністю.
Найвідоміший соматичний (О-антиген) грамнегативних бактерій з добре вираженими
антигенними, протективними, а також токсичними властивостями. О-антиген складається з
молекули ліпополіцукриду, антигенна специфічність якого визначається в основному поверхневими
олігоцукридними ланцюгами, а також меншою мірою коровим олігоцукридом. Токсичність
визначається молекулою ліпіду А, що входить до складу ЛПЦ. Порушення синтезу олігоцукридних
ланцюгів ЛПЦ призводить до втрати або зміни серологічної специфічності грамнегативних
бактерій. Ця специфічність визначає величезну кількість серогруп, сероварів та субсероварів у
грамнегативних бактерій Найбільш дослідженими й значущими для визначення антигенності
антигенами грампозитивних бактерій є пептидоглікан, білки, тейхоєві кислоти та інші біополімери,
що входять до складу клітинної стінки.
Численні у бактерій і цитоплазматичні антигени, які характеризуються білковим і
нуклеопротеїдним складом їхніх клітини Як правило, вони антигенно споріднені у філогенетично
близьких видів. Антигенна активність цих антигенів пов'язана з їх алергенною та толерогенною
активністю Антигенність притаманна ліпопротеїдам мембранних структур бактерій, рибосомам.
Деякі групи бактерій продукують позаклітинні антигени, до яких відносяті численні екзоферменти
й токсини.
Ще складніші й різноманітніші антигени мікроскопічних грибів та найпростіших.
За специфічністю антигени мікроорганізмів поділяють на видоспецифічні — такі, що виявляються в
усіх штамів того чи іншого виду і не виявляються у штамів інших видів, типоспецифічні —
трапляються в окремих варіантів того чи іншого виду, гетерофільні — спільні для штамів різних
видів, стадіоспецифічні — властиві певним стадіям розвитку представників одного виду,
штамоспецифічні — виявляються тільки в окремих штамів виду.
Антигени мікроорганізмів функціонально активні як у вільному вигляді, тобто відділені від клітини
або віріона певним методом, так і в складі мікроорганізмів. Тому термін «антиген» використовують
і для цілих клітин мікроорганізмів чи вірусів. Імунна відповідь на такі корпускулярні антигени
надзвичайно складна і виявляється в розвитку різних феноменів: клітинної й гуморальної імунної
відповіді, гіперчутливості, толерантності тощо.
Для антигенів мікроорганізмів характерна антигенна мінливість. Насамперед це кількісні зміни в
синтезі будь-якого антигену, утворенні такого самого, але деградованого антигену, порушення
синтезу або продукування нових додаткових антигенів. Антигенна мінливість має характер
модифікацій, зумовлених репресією або дерепресією генів, що кодують синтез конкретного
біополімеру, який є антигеном. Вони, як і всі модифікації, є адаптивними, відбуваються в більшості
особин популяції і в разі відновлення попередніх умов реверсують у вихідну форму. Зниження,
втрата здатності до синтезу або синтез деградованих антигенів відбувається при культивуванні
бактерій у лабораторних умовах, особливо при використанні для культивування незбалансованих
живильних середовищ. Бактерії з відмінними антигенними властивостями виділяються також з
навколишнього середовища та від реконвалесцентів. Антигенна мінливість бактерій виявляється і в
набутті нових антигенів. Це спостерігається в разі потрапляння бактерій у чутливі організми. У
цьому випадку більшість патогенних та деякі умовно-патогенні види розпочинають або підсилюють
синтез К-антигенів, екзотоксинів, ферментів, які дифундують в організм і ушкоджують клітини,
блокують ефектори імунної відповіді тощо. Це супроводжується зміною вірулентності, а також
інших властивостей: імуногенності, аглютинабельності, стійкості до фагоцитозу та фагів, характеру
росту на живильних середовищах. Антигенна мінливість мікроорганізмів виявляється і в
послідовному включенні генів, що кодують синтез усе нових і нових поверхневих антигенів, та
репресії синтезу вихідних антигенів. У результаті такої мінливості антигенна специфічність
мікроорганізмів у процесі інфекції періодично повністю або частково змінюється. Особливо це
характерно для найпростіших (трипаносом), деяких борелій та ін. Отже, змінюючи поверхневі
антигени, збудники протистоять розпізнаванню та елімінуючій дії імунних механізмів.
Доведено, що антигенна мінливість мікроорганізмів може настати внаслідок мутацій, кон'югації,
трансдукції, трансформації, при передаванні плазмід, мобільних генетичних елементів і
супроводжуватися втратою старих або набуттям нових антигенів у окремих особин популяції
мікроорганізмів. Ймовірність антигенної мінливості мікроорганізмів дуже важливо враховувати під
час їх виділення та ідентифікації, зберігання лабораторних культур, вибору штамів для отримання
діагностикумів, вакцин, імунних сироваток.
Імуногенність антигенів залежить від індивідуальної імунної реактивності організму реципієнта,
його видової належності, віку, статі, ступеня генетичної чужорідності донора антигенів і реципієнта.
Специфічність антигенів визначається структурними особливостями їхніх молекул, стереохімічних
ознак і просторового розміщення епітопів. Антигени, потрапляючи в організм, персистують,
зазнають змін та елімінації.
Контрольні запитання
1. Що таке антигени?
2. Як поділяють антигени за хімічною природою?
3. Якою мірою антигенність речовини залежить від фізико-хімічних параметрів молекули?
4. Що таке секвенційні та конформаційні антигенні детермінанти?
5. Які відкриття були зроблені в імунології при вивченні кон'югованих та синтетичних антигенів?
6. Що є хімічною основою групових антигенів крові?
7. Які особливості антигенної структури вірусів і бактерій?
8. Яке практичне значення мають антигени системи АВ0?
9. За яких умов Rh-антиген може бути причиною імунного конфлікту під час вагітності?
РОЗДІЛ 4. АНТИТІЛА. МОЛЕКУЛЯРНА СТРУКТУРА І БІОЛОГІЧНІ ФУНКЦІЇ.
Білки сироватки крові за рухливістю в електричному полі поділяють на альбуміни і глобуліни (три
фракції — α, β,γ). γ-глобуліни — найменш рухливі, під час електрофоретичного розділення білків
вони залишаються в місці нанесення сироватки (|мал. 32, 33). У 1939 р. А. Тизеліус і Е. Кебот
ідентифікували антитіла як γ-глобуліни. Було з'ясовано, що пік γ –ґлобулінів у гіперімунній
сироватці спадає після її адсорбції специфічним антигеном. Антитіла — це γ-глобуліни, які здатні
специфічно зв'язуватися з антигеном. Такі γ-глобуліни називають імуноґлобулінами. До
імуноноґлобулінів належать білки тваринного походження, які мають активність антитіл, а також
імуноглобулінові рецептори лімфоцитів та білки, подібні до антитіл за хімічною структурою і
антигенною специфічністю — мієломні білки, білки Бенс-Джонса та субодиниці імуноглобулінів.
Остаточно ще не з'ясовано, чи містяться у фракції γ-ґлобулінів лише специфічні антитіла, чи до її
складу входять і білки, які не мають специфічної імунної активності. Можливо, що всі γ-глобуліни є
антитілами. Непрямим підтвердженням цього є низькі показники вмісту γ-ґлобулінів у тварин,
вирощених у стерильних умовах (гнотобіонтів). Однак частина γ-ґлобулінів, що утворюються при
імунізації, не здатна зв'язуватися зі специфічним антигеном. У разі повторних імунізацій кількість
таких γ-ґлобулінів зменшується.
Антитіла виконують багато біологічних функцій, спрямованих на елімінацію чужорідного антигену
з організму: розпізнають і зв'язують антиген, допомагають у його презентації макрофагам і
лімфоцитам, зумовлюють ушкодження мастоцитів, лізують клітини, що містять специфічні
антигенні субстанції, зумовлюють опсонізуючу дію, активують систему комплементу. Первинна
функція антитіл — взаємодія з комплементарною структурою антигену — антигенною
детермінантою, а вторинні (ефекторні) — фіксація комплементу, опсонізуючий вплив,
цитотоксична, імунорегуляторна дії тощо. Зв'язування антитіл з антигеном прискорює елімінацію
чужорідної високомолекулярної речовини, сприяючи руйнуванню її ферментними системами
організму. Таке зв'язування зумовлюється високою специфічністю, яка виявляється як здатність
комплементарних з фізико-хімічного погляду структур активного центру молекули антитіла та
антигенної детермінанти антигену сполучатися між собою.
4.1. СТРУКТУРА АНТИТІЛ.
Розшифровування хімічної структури детермінантних груп антигену й рецепторних груп антитіл,
з'ясування природи факторів, що забезпечують їхню комплементарність, є ключем до розуміння
механізмів синтезу безмежної кількості видів антитіл та їх високої специфічності. Механізми
розпізнавання в системі антиген — антитіло, як і в системах гормон — рецептор, фермент —
субстрат, ґрунтується на принципі структурної комплементарності, яка створює можливість
зближення реагуючих структур на таку відстань, коли забезпечується встановлення
міжмолекулярних взаємодій.
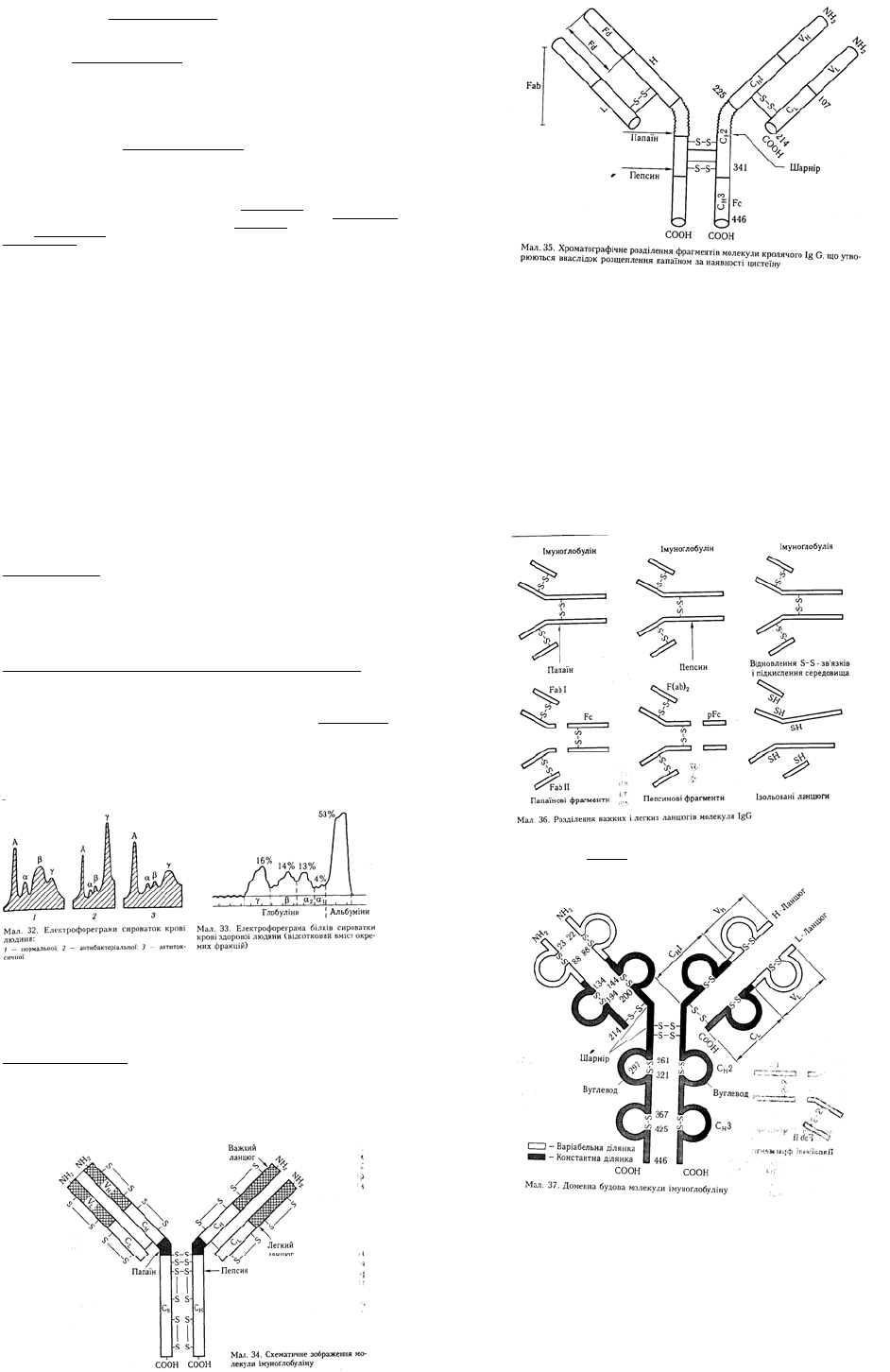
Для вивчення молекулярної структури антитіл використовують методи ферментативного
розщеплення молекул імуноґлобулінів на окремі фрагменти (мал. 34, 35).
Фрагментація ензимами. У 1959 р. Р. Портер, досліджуючи розщеплення кролячого IgG (який
містить лише один дисульфідний зв'язок між важкими ланцюгами) протеолітичним ферментом
рослинного походження папаїном за наявності цистеїну, виявив зниження його молекулярної маси з
7S до 3,5S. Під час діалізу цього матеріалу порівняно з фосфатним буфером і фільтрування на
колонці з карбоксиметилцелюлозою (рН = 5,2) було отримано три піки — фрагменти І, II, III, що
мали молекулярну масу по 50 000. З них 2/3 становили фрагменти І і ІІ, а 1/3 — фрагмент III.
Фрагменти І і II мали активність моновалентних антитіл, тобто зв'язували антиген (Fab), а фрагмент
III антиген не зв'язував (Fc). Пізніше А. Нісонов зі співробітниками (1960) розщепили кролячий IgG
пепсином за відсутності цистеїну і довели, що молекулярна маса отриманого продукту знижується
до 100 000. Цей продукт мав активність двовалентних антитіл. Під дією бромціану молекула IgG
розщеплювалася на велику кількість пептидів.
Використовуючи для руйнування міжланцюгових дисульфідних містків цистеїн за наявності
сечовини або гуанідину, Д. Едельман зі співробітниками (1960) показали, що в разі руйнування S —
S-зв'язків молекулярна маса γ-ґлобулінів знижується зі 150 000 до 50 000, а при хроматографічному
дослідженні матеріалу було виявлено компоненти з молекулярною масою 25 000. Це дало змогу
стверджувати, що молекула кролячого IgG має складатися з чотирьох ланцюгів — двох по 50 000 і
двох по 25 000. У 1962 p. P. Портер на основі даних розщеплення кролячих імуноглобулінів
меркаптоетанолом запропонував схему структури IgG, згідно з якою молекула імуноґлобулінів
складається з чотирьох ланцюгів — двох важких Н (hard) і двох легких L (light). Важкі ланцюги
сполучені між собою та з легкими ланцюгами дисульфідними зв'язками. Зв'язки між важкими
ланцюгами локалізуються приблизно посередині, в ділянці, яку називають шарнірною. Вона
відрізняється відносно лабільною структурою, зумовлює гнучкість молекули, можливість обертання
окремих її субодиниць і характеризується високою чутливістю до протеолітичних ферментів. У разі
розщеплення IgG папаїном у шарнірній ділянці молекула імуноглобуліну розпадається на три
фрагменти — два однакових Fab-фраґменти, які складаються з легкого і приблизно половини
важкого ланцюга, сполучених S —S-зв'язком, і один Fc-фраґмент, що складається з двох половинок
важких ланцюгів, сполучених S —S-зв'язком (мал. 36). За допомогою аналізу амінокислот у важких
і легких ланцюгах імуноґлобулінів виявлено константні частини, що характеризуються сталістю
амінокислотного складу, і варіабельні, яким притаманна значна мінливість амінокислот. За складом
і послідовністю амінокислот у константній частині важких ланцюгів розрізняють імуноґлобуліни
п'яти класів: IgM, IgG, IgA, IgE, IgD.
Варіабельні частини легких і важких ланцюгів локалізуються у Fab-фраґменті з NH
2
-кінця. Вони
беруть участь у формуванні активних центрів антитіл, що безпосередньо зв'язуються з
детермінантними групами антигену. Поліпептидні ланцюги імуноґлобулінів формують структурні
ділянки, які називають доменами. Вони утворені внутрішньоланцюговими S—S-зв'язками і
характеризуються значною гомологічністю щодо амінокислотного складу в межах константних і
варіабельних частин як легких, так і важких ланцюгів. Домени розрізняються своїмі біологічними
функціями в цілій молекул імуноґлобуліну (мал. 37).
Fab- і F(ab)
2
-фрагменти. При дії на імуноґлобуліни алкілувальних і відновних речовин, а також
протеолітичних ферментів можна отримати окремі ланцюги, різні фрагменти молекул антитіл та
їхніх ланцюгів. Протеолітичний фермент папаїн розщеплює важкий поліпептидний ланцю молекули
IgG з NH
2
-кінця, а пепсин — з СООН-кінця від дисульфідних зв'язків між важкими ланцюгами (див.
мал. 36).
Папаїн розщеплює молекулу IgG на три фрагменти: два, що не кристалізуються, Fab-фраґменти І та
II (fragments antigen binding), які містять рецепторні групи до антигену, і один, що кристалізується,
— Fc-фраґмент III (fragment crystallizable). Fab-фраґменти І і II подібні між собою за властивостями
та амінокислотним складом, але значно відрізняються від Fc-фраґмента. До складу Fc-фраґмента
входить легкий ланцюг і частина важкого ланцюга, яку називають Fd-фраґментом.
Fab-фраґменти молекул очищеного γ-ґлобуліну людини одновалентні, здатні зв'язуватися з
антигеном, однак не преципітують його, не зв'язують комплемент, не проходять крізь плаценту, але
можуть фіксуватися в шкірі. Якщо розщеплювати молекулу IgG пепсином, то утворюється F (аb)
2
-
фрагмент, що складається з двох Fab-фраґментів, сполучених дисульфідним зв'язком, і залишків
важких ланцюгів, які утворилися після відщеплення F(ab)
2
-фраґмента. F(ab)
2
-фраґмент має дві
рецепторні групи, що входять до складу Fab-фраґментів. Маючи дві рецепторні групи, F(ab)
2
-
фраґмент може зв'язуватися з двома детермінантами, розміщеними на двох різних ділянках
антигену. Це може забезпечити утворення великих конгломератів, які випадають в осад. Тому
фрагмент F(ab)
2
, на відміну від Fab-фрагмента, є двовалентним і здатний преципітувати антиген, як і
нерозщеплена молекула IgG. Дослідженнями Р. Портера було показано, що антисироватки до Fab-
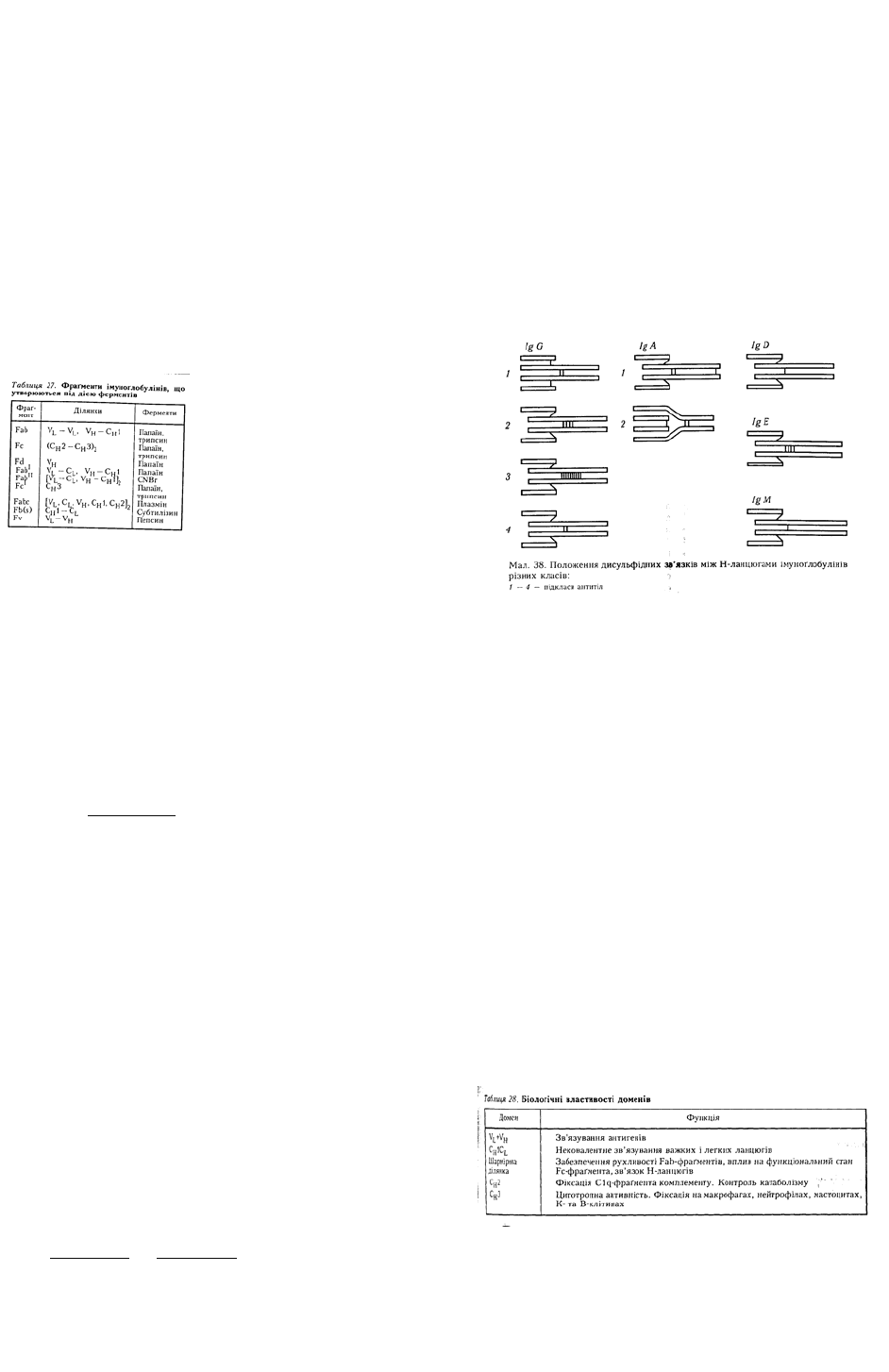
22
фраґментів реагували як з Н-, так і з L-ланцюгами, тоді як антисироватки до Fc-фраґменті в
реагували лише з Н-ланцюгами. Отже, Fab-фраґменти складаються як з Н-, так із L-ланцюгів, а Fc-
фраґмент — лише з Н-ланцюгів.
Константа седиментації F(ab)
2
-фраґмента становить 5S (молекулярна маса 100 000), а Fab-фраґмента
— 3,55 (молекулярна маса 50 000). Рецепторна група антитіл руйнується при розщепленні ланцюгів
поліпептидів. Під впливом відновних речовин — 0,01 М розчину цистеїну, 0,01 М розчину
меркаптоетанолу F(ab)
2
-фраґмент може розпадатися на два Fab-фраґменти, які вже не осаджують
антиген, проте можуть зв'язувати гаптен і гальмувати реакцію антигену з антитілом. Ці фрагменти
одновалентні та гомологічні з папаїновими Fab-фраґментами І і II, але їх Fd-фраґмент приблизно на
десять амінокислотних залишків довший.
Антитіла з двома рецепторними групами різної специфічності не синтезуються, однак їх можна
отримати, розщеплюючи пепсином суміші антитіл двох різних видів з наступним відновленням і
окисненням. У такому разі можливі випадкові сполучення двох різних Fab-фраґментів. F(ab)
2
-
фраґмент, що утворюється при цьому, здатний зв'язуватися з антигеном і утворювати преципітати за
наявності в суміші обох антигенів. Результати цих досліджень показали, що окремі Fab-фраґменти
антитіл моновалентні, тоді як F(ab)
2
-фраґменти й молекули IgG-антитіл двовалентні.
Fc-фраґмент. Фраґмент Fc — це сполучені дисульфідними зв'язками залишки двох важких
ланцюгів після відщеплення Fab-фраґментів папаїном. Fc-фраґмент молекули IgG має молекулярну
масу 50 000. При відщепленні фрагмента F(ab)
2
пепсином із залишків важких ланцюгів, що не
ввійшли до його складу, утворюється Fc-фраґмент. Антигенні детермінанти, специфічні для
кожного з класів і підкласів імуноґлобулінів, які не дають перехресних реакцій з антисироватками
проти інших класів, розміщені переважно в Fc-фраґменті. Антисироватка до Fc-фраґмента
кролячого IgG в реакції преципітації реагує з важкими, але не реагує з легкими ланцюгами, тобто у
складі Fc-фраґмента немає залишків легких ланцюгів.
Fc-Фраґмент не зв'язується з антигеном, оскільки не містить рецепторних груп. Відщеплення Fc-
фраґмента не впливає на специфічну антигензв'язувальну активність молекули антитіла. Fc-
фраґмент містить цитофільну частину, що забезпечує зв'язок цілої молекули антитіла з клітинами.
Від Fc-фраґмента залежать ефекторні функції антитіл: здатність зв'язувати комплемент,
забезпечувати фіксацію антитіл на цитомембранах, індукувати виникнення анафілактичних реакцій,
забезпечувати проникнення антитіл крізь плаценту. Здатність Fc-фраґмента фіксувати комплемент
визначається його NН
2
-кінцевою ділянкою, що прилягає до Fd-фрагмента. Від Fc-фраґмента
залежить індекс катаболізму імуноґлобулінів та рівень антитіл у крові. На ділянці Fc-фрагментів є
структури, за допомогою яких антитіла сполучаються з Fc-рецепторами клітин. Ці структури
розміщені в С
Н
3-С
н
4 -доменах і, якщо вони перебувають в ізольованому вигляді, то зберігають
здатність зв'язуватися з рецепторами — конкурують з антитілами за Fc-рецептори клітин. У Fc-
фраґменті молекули антитіла може бути два або три центри для зв'язування з різними типами
клітин. Це ділянки поліпептидного Н-ланцюга, які складаються з 4 — 10 залишків амінокислот
Імуноґлобуліни, як і інші білки сироватки крові, у клубочках нирок фільтруються у первинну сечу.
У звивистих канальцях нирок вони реабсорбуються. Цей процес, можливо, зумовлюється наявністю
на епітелії канальців рецепторів для Fc-фрагментів, оскільки ні Fab-, ні F(ab)
2
-фрагменти не
реабсорбуються.
Фрагменти Fab і Fc — компактні утвори, між якими в молекулах IgG та IgA poзміщені гідратовані
ділянки важкого ланцюга, завдяки чому молекули цих імуноглобулінів складаються з трьох
субодиниць, які незалежно обертаються навколо
шарнірної ділянки, розміщеної в центрі молекули,
і мають гнучку структуру (табл. 27)
Легкі ланцюги. Якщо γ-ґлобуліни обробити
меркаптоетанолом у концентрованому розчині
сечовини, дисульфідні зв'язки руйнуються і
молекула антитіла розпадається на окремі два
легкі L- і два важкі Н-поліпептидні ланцюги. У
легких і важких ланцюгах розрізняють NH
2
- т
СООН-кінцеві частини. L-ланцюги, які були
отримані з ланцюгів різних класів, здатні
рекомбінуватися як з гомологічними, так і з
гетерологічними Н-ланцюгами. Легкі ланцюги
бувають двох типів: κ-(каппа) та λ-(ламбда).
Однак в одній молекулі антитіл обидва ланцюги
можуть бути лише однозначними — або κ-, або λ-.
Вони різняться між собою за амінокислотним
складом у С-кінцевій ділянці та за антигенними
властивостями. У людини в молекулах IgG κ-
ланцюги становлять 70 %, а λ-ланцюги — 30 %. У
сироватці коней 95 % легких ланцюгів належить до λ-, у мишей — до κ-типу. У людини кінцева NH
2
-амінокислота λ-ланцюгів заблокована піролідонкарбоновою кислотою (циклічна похідна
глутамінової кислоти), а в κ-ланцюгах у цьому положенні знаходиться аспарагінова кислота. У С-
кінцевій частині L-ланцюгів розміщений цистеїн, що сполучається дисульфідним містком з
цистеїном Н-ланцюга. Ланцюг λ складається з 213 —216, а ланцюг κ — з 214 — 219 залишків
амінокислот. Молекулярна маса легких ланцюгів становить 23 000 — 25 000.
Серед імуноґлобулінів одного класу виявляються, як правило, молекули антитіл з легкими
ланцюгами обох типів. Кожний тип легких ланцюгів має специфічну первинну поліпептидну
структуру, і їх синтез контролюється певним чином.
У легкому ланцюзі міститься відносно велика кількість гліцину, що має інваріантне положення в
антитілах різних видів тварин і різної специфічності. Гнучкість поліпептидного ланцюга в ділянці,
де міститься багато гліцину, сприяє формуванню антигензв'язувального центру.
Важкі ланцюги. У людини відповідно до кожного класу імуноґлобулінів (М, G, A, D, Е)
розрізняють п'ять типів важких ланцюгів, які позначають грецькими літерами μ (мю), γ (гамма), α
(альфа), δ (дельта) і ε (епсилон). Важкі ланцюги ковалентно сполучені між собою і з одним легким
ланцюгом дисульфідними містками. Кожний тип Н-ланцюгів у молекулі антитіла відповідного
класу зв'язується з одним із типів L-ланцюгів. Отже, структуру молекули імуноґлобуліну класу G
можна зобразити так: κ-γ-γ-κ- або λ-γ-γ-λ. Важкі ланцюги імуноґлобулінів людини мають
молекулярну масу в межах 50 000 — 70 000. Вони різняться між собою за амінокислотним складом
та антигенними властивостями. Важкі ланцюги IgG складаються з 446, IgA — з 460 — 470, a IgM,
IgD та IgE - з 550-570 амінокислотних залишків.
Ізольовані важкі ланцюги антитіл і навіть Fd-ділянки зберігають здатність зв'язуватися з
гомологічним антигеном, хоча порівняно з інтактними молекулами їхня активність нижча. Здатність
важких ланцюгів взаємодіяти з антигеном підвищується в тому разі, коли вони сполучені з легкими
ланцюгами. Це дає змогу вважати, що активний центр антитіл утворений як легким, так і важким
ланцюгами. Вважають, що легкий ланцюг стабілізує рецепторні структури важкого ланцюга в
положенні, яке доступне для детермінанти антигену.
Варіабельні і стабільні ділянки. Як у легких, так і у важких ланцюгах існують V-ділянка, в якій
послідовність амінокислот є змінною (variable), і С-ділянка (constant), у якій в усіх ланцюгах цього
класу або типу певного виду тварин постійно знаходяться ті самі амінокислоти. Початок сталої
частини називають точкою перемикання. Варіабельність у послідовності амінокислот ланцюгів
імуноґлобулінів забезпечує можливість існування антитіл різної специфічності. Сталі частини
ланцюгів, спільні для одного класу антитіл, зумовлюють спільні властивості: здатність зв'язувати
комплемент, фіксуватися на клітинних рецепторах, проникати крізь плаценту. Варіабельні ділянки
важких і легких ланцюгів мають приблизно однакову довжину і за структурою більш подібні між
собою, ніж до постійних ділянок власних ланцюгів. V-ділянка легких ланцюгів містить 107 — 112, а
V-ділянка важких — 114 — 124 залишки амінокислот.
Незважаючи на варіабельність NH
2
-кінцевих половин легких ланцюгів, κ-ланцюги поділяють на 4, а
λ-ланцюги — на 5 підгруп. У кожній з підгруп подібність послідовностей за складом амінокислот
досягає 80 %, а між підгрупами — 50 %. У межах варіабельних частин легких ланцюгів за
стабільністю їхнього складу виявлено три типи ділянок: консервативні зі сталим складом
амінокислот; варіабельні, в яких розміщені ділянки, характерні для цієї групи; гіперваріабельні, в
яких заміни відбуваються досить часто. Різноманітність антитіл забезпечується насамперед за
рахунок різноманіття послідовностей у гіперваріабельній ділянці. Активний центр антитіла
формується залишками амінокислот гіперваріабельних ділянок. Основу його становлять
гіперваріабельні ділянки Н-ланцюгів, а легкі ланцюги забезпечують «тонке настроювання». Це дає
змогу тому самому активному центру зв'язувати, хоча й з різним ступенем афінності, не лише
специфічні, а й структурно подібні епітопи.
Під час вивчення мієломних білків людини в різних лабораторіях було з'ясовано, що відносно
сталими частинами V-ділянки важких ланцюгів є такі положення, які виконують роль каркасних
структур: 1-30, 38-50, 69-83, 92-100, 111-124. Усі вивчені білки за характером амінокислотних
послідовностей поділили на три підгрупи.
Виявилося, що у V-ділянці близько 65 % амінокислот важких ланцюгів мають обмежену мінливість,
а 20 % амінокислотних послідовностей абсолютно сталі, незалежно від того, до якої з підгруп вони
належать. Сталими були залишки амінокислот у таких положеннях: 2, 4, 8, 14, 22, 25, 26, 38, 40, 43,
47, 48, 49, 69, 79, 92, 93, 94, 96, 98, 117, 120, 122, 123. Положення 3, 9, 17, 19, 21, 23, 28, 29, 39, 42,
46, 50, 80, 81, 82 були специфічними для підгруп. Відмінності в ступені варіабельності є також і
всередині підгруп. Так, друга гіпермутабельна ділянка більш варіабельна в положеннях 51 — 60 для
другої підгрупи, тоді як перша підгрупа — більш варіабельна в положеннях 61—65. Найбільше
варіабельність виявляється всередині гіперваріабельних ділянок у третій підгрупі. Із 28 залишків
амінокислот цієї підгрупи 21 відрізнявся своїм положенням. У відносно маловаріабельній частині
V-ділянки третьої підгрупи ідентичними були 91 з 95 положень, тоді як у гіперваріабельній — лише
7 з 28. V
H
-підгрупи можуть перебувати в асоціації з С
н
-ділянками важкого ланцюга будь-якого класу
імуноглобулінів.
Константні положення як у V
H
-, так і у V
L
-ділянках пов'язані із забезпеченням функціональної
взаємодії субодиниць молекули, наприклад жорсткості або взаємодії між ланцюгами. Гліцин у
положенні 3 у Fab-фраґменті IgG до білка New забезпечує обертання фрагмента між V
L
—V
Н
.
Фенілаланін у положенні 99 і триптофан у положенні 107 V
H
-ділянки беруть участь у
міжланцюговому контакті.
У κ-ланцюгах людського й мишачого білка Бенс-Джонса виявлено 44 однакових залишки
амінокислот, що свідчить про достатньо високу консервативність цих структур у процесі еволюції.
Заміни амінокислотних послідовностей є і в сталих частинах легких і важких ланцюгів, однак на
відміну від замін у варіабельних ділянках вони поодинокі й стабільні.
У V-ділянці κ-ланцюгів близько 70 % положень варіабельні, тоді як у С-ділянці κ-ланцюгів варіації
є лише в положенні 191, де може знаходитись валін або лейцин. Аналогічно С-ділянка λ-ланцюгів
має дві заміни в положенні 190 — Ліз-Apг. Проте на відміну від положення 191 у κ-ланцюгах ця
заміна не успадковується, а той самий організм може синтезувати λ-ланцюги, що містять як Ліз, так
і Арг, тобто С-ділянка λ-ланцюгів кодується двома структурними генами. Гомологія варіабельних і
константних ділянок легких ланцюгів становить 15 %, а гомологія константних ділянок ланцюгів κ і
λ – 40 %.
Гарячі точки. Точки, в яких заміна амінокислот відбувається частіше, ніж в інших положеннях,
називають гіпермутабельними, або гарячими, точками. В легких ланцюгах мишей та людини
гіперваріабельними є 26-32, 48-55, 90-95, а у важких – 31-37, 51-68, 84-91 і 101-110 амінокислотні
залишки. Аналіз причин варіабельності свідчить про те, що близько 70 % замін зумовлюються
зміною одного нуклеотиду триплету, близько 25 % — двох нуклеотидів і незначна кількість —
змінами всього триплету, тобто мінливість послідовності амінокислот у легких ланцюгах є
наслідком точкових мутацій.
У гарячих точках заміни часто відбуваються тією самою амінокислотою, з чого можна зробити
висновок, що вони не випадкові, а закодовані в структурних генах. Отже, легкий ланцюг кодується
великою кількістю генів. Стимуляція певного клону лімфоїдних клітин антигеном зумовлює
«виникнення» всіх С-генів, крім одного, який, сполучаючись з одним із багатьох V-генів, утворює
VC-ген, що регулює синтез специфічного поліпептиду. Система з великої кількості генів забезпечує
високу пластичність адаптації залежно від зміни умов існування організму.
У варіабельних ділянках як важких, так і легких ланцюгів було виявлено каркасні детермінанти.
Каркасними називають відносно інваріантні частини V-ділянки, які не включені у гіперваріабельні
структури і займають близько 80 — 85 % усієї ділянки. Каркасні ділянки створюють стабільну
просторову структуру, яка забезпечує певне розміщення залишків амінокислот, від яких залежить
комплементарність до антигену. Мінливість каркасних ділянок становить менш як 5 %. Вони мають
однакові розміри і розміщені в легких і важких ланцюгах різних імуноґлобулінів та різних видів
тварин у тих самих місцях. Вони також ідентичні в антитілах будь-якої специфічності у тварин
одного виду.
Шарнірна ділянка. Показано, що важкі ланцюги молекул під впливом протеолітичних ферментів
розщеплюються в певному місці (посередині важкого ланцюга), що сполучає С
Н
1- та С
н
2-домени
або Fab- і Fc-фраґменти (див. табл. 24). Ця шарнірна частина молекули, яку називають талією, не
має вторинної й третинної структур. Це дає їй змогу виконувати роль шарніра, а субодиницям
молекули — обертатися. Талія забезпечує гнучкість молекули між Fab- і Fc-фраґментами. Завдяки
наявності шарнірної ділянки кут між Fab-фраґментами IgG може змінюватися від 0 до 180°.
Кожний клас імуноґлобулінів має своєрідну будову шарнірної ділянки. Ділянка талії складається з
15 — 60 амінокислот. Відрізок з 15 амінокислотних залишків може повторюватися. У молекулі IgG3
він дуплікований чотири рази. Шарнірна ділянка характеризується високим вмістом залишків
цистеїну, що забезпечує зв'язок між Н-ланцюгами через дисульфідні містки. Крім того, тут
міститься значна кількість залишків проліну. У ділянці талії відбувається розщеплення
полілептидного ланцюга папаїном, пепсином, трипсином, плазміном, катепсином (див. табл. 24).
Шарнірна ділянка впливає на конформацію і функціональну специфіку Fc-фрагментів підкласів IgG
та на властивості доменів С
Н
2 і С
Н
3. Вона також бере участь в утворенні низькомолекулярних
імуностимулювальних факторів. Останні відщеплюються протеазами фагоцитів з ділянок талії при
взаємодії молекули антитіла з антигеном і є «сигналом тривоги». Вони посилюють фагоцитоз,
антитілозалежну цитотоксичність, активують комплемент. Однак гомології ділянки талії з доменами
варіабельних і константних ділянок не виявлено. Тому зроблено припущення про незалежну
еволюцію гена, який кодує цю ділянку.
Дисульфідні зв'язки. У молекулах імуноґлобулінів є три типи дисульфідних зв'язків: 1)
міжланцюгові дисульфідні зв'язки між Н-ланцюгами та між Н- і L-ланцюгами; 2) міжланцюгові
дисульфідні зв'язки, зумовлені полімеризацією молекул IgM і IgA; 3) дисульфідні містки всередині
ланцюгів — два в легкому і чотири-п'ять у важкому (мал. 38). Дисульфідні зв'язки, що сполучають
Н-ланцюги між собою, розміщені в шарнірній ділянці. Кількість і положення дисульфідних зв'язків
між важкими ланцюгами різних класів та підкласів антитіл неоднакові. У першому й четвертому
підкласах IgG між важкими ланцюгами є по два дисульфідних зв'язки, однак положення їх різне.
Так, IgG2 містить чотири, a IgG3 — шість—десять таких зв'язків. У СООН-кінцевих положеннях
важких ланцюгів імуноґлобулінів різних класів дисульфідних зв'язків немає. Ланцюги тут сполучені
за допомогою нековалентних зв'язків двох типів. Дисульфідні зв'язки утворюються і між Н- і L-
ланцюгами. Легкі ланцюги сполучаються із залишками цистеїну важких ланцюгів у положенні 214
або поруч із залишком амінокислоти в положенні 131. Важкі й легкі ланцюги другого підкласу IgA
дисульфідними зв'язками між собою не сполучені, але контактування між ними забезпечується за
допомогою нековалентних взаємодій.
Розщеплення за низького рН дисульфідних зв'язків між двома важкими ланцюгами
супроводжується утворенням двох симетричних фрагментів, що складаються з Н- і L-ланцюгів, які
можуть реасоціювати в нейтральному середовищі. Якщо важкі й легкі ланцюги розділити на дві
групи, a S —S-зв'язки заблокувати йодацетамідом, то при змішуванні вони можуть реасоціювати за
рахунок нековалентних зв'язків, утворюючи спонтанно чотириланцюгові молекули, які за фізико-
хімічними та антигенними властивостями подібні до нативної молекули.
Полімеризацію мономерів у пентамер у молекулі IgM забезпечують дисульфідні зв'язки завдяки
сполученню напівцистеїнових залишків Н-ланцюгів двох сусідніх мономерів або, можливо, через
зв'язок з J-ланцюгом. Стабілізувальні дисульфідні зв'язки є також між С
μ
3-доменами.
Дисульфідні зв'язки всередині ланцюгів «замикають» петлі з 60 — 70 амінокислотних залишків,
утворюючи домени, які стабілізують структуру молекули та надають їй компактності. Проміжки
між петлями приблизно однакові (за винятком шарнірної ділянки), однак у варіабельних ділянках у
петлях міститься більша кількість залишків амінокислот.
Домени. Молекули імуноґлобулінів складаються з компактних, щільно з'єднаних глобулярних
ділянок — доменів, що включають від 100 до 110 залишків амінокислот, які стабілізовані
внутрішніми дисульфідними зв'язками. У легких ланцюгах як κ-, так і λ-типів є по два домени із 110
залишків амінокислот з одним внутрішньоланцюговим дисульфідним зв'язком, що утворює петлю
завдовжки близько 60 — 70 амінокислотних залишків (по одній петлі у варіабельних і сталих
ділянках ланцюга). Важкий ланцюг IgG і IgA можна поділити на чотири домени — лінійно
сполучені контактні ділянки, які містять по 100— 110 залишків амінокислот та один дисульфідний
зв'язок, що утворює петлю. Глобули С-доменів мають форму циліндрів, утворені сімома складками
ланцюга і є компактними структурами. У кожному V-домені є дев'ять поздовжніх (S-) ділянок і
вісім вигинів, зумовлених поворотами ланцюга. Домени з'єднані між собою поліпептидною ниткою
подібно до намистин так, що можуть бути розміщені під кутом один до одного.
V-домени упаковуються в такий спосіб, що їхні гіперваріабельні ділянки, які містяться в різних
місцях поліпептидного ланцюга, розташовані одна біля одної. Це дає їм змогу утворювати
(«вистилати») стінки порожнини активного центру.
Відмінності, що спостерігаються в структурі доменів, визначають специфіку їхньої функції. У μ-
ланцюзі один домен відповідає за розпізнавання антигену, другий утворює структуру, яка
комплементарна С-ділянці L-ланцюга, третій — забезпечує фіксацію комплементу, четвертий —
зв'язується з клітинною поверхнею і зумовлює розпізнавання рецепторів клітин, п'ятий —
забезпечує зв'язки мономерів молекули в складні агрегати. Гомологічні V
H
- і V
L
-домени беруть
участь в утворенні активних центрів антитіл. Домени важкого ланцюга С
Н
1, С
Н
2, C
H
3 подібні між
собою за первинною структурою і до С-домена L-ланцюга.
Структурна подібність ділянок доменів легких і важких ланцюгів, можливо, зумовлена
походженням їх від спільного предкового гена внаслідок дуплікацій — подвійної в локусі, що
контролює легкий ланцюг, і чотириразової в локусі, що контролює важкий ланцюг. Продукт
вихідного гена, очевидно, мав молекулярну масу 10 000 — 12 000. Можливо, що цим геном був ген
бета
2
-мікроґлобуліну. Після первинної його дуплікації виник ген легкого ланцюга, а після вторинної
– ген важкого ланцюга, що складається з чотирьох локусів. У процесі подальшої дивергентної
еволюції виникли гени μ-, γ-, α-, δ-, ε- важких ланцюгів та κ-, λ-гени легких ланцюгів.
Характер укладання V-доменів важких і легких ланцюгів такий, що при цьому утворюються дві
групи петель, з яких дистальні контактують з С-доменом, а проксимальні залишаються вільними,
отже, доступними для розчинника. Вільні петлі приблизно відповідають гіперваріабельним
ділянкам легкого й важкого ланцюгів. Ці ділянки розміщені в активному центрі антитіла, залишки
амінокислот, що їх утворюють, контактують з антигеном. Однак антиген може контактувати і з
залишками амінокислот, які не входять у гіперваріабельні ділянки.
Міждоменні ділянки ланцюгів чутливіші до дії протеаз, ніж домени. Під дією пепсину на Fab-
фрагменти мишачого IgA відщеплюються C
L
- і С
н
-домени, однак зв'язок між V
L
- і V
Н
- доменами
зберігається. Утворений фрагмент називають F
V
, причому він повністю зберігає гаптензв'язувальну
активність. С
Н
1- і C
L
-домени з'єднані між собою олігоцукридними ланцюгами, що містяться між
ними, утворюючи тандем.
Між доменами одного ланцюга, як і між доменами сусідніх ланцюгів, що прилягають один до
одного, відбувається певна взаємодія. Так, подібні домени Н- і L-ланцюгів утворюють тандемні
структури: V
L
-V
H
, C
L
-C
H
1, C
H
2-C
H
2, C
H
3-C
H
3, а ізольовані V
H
- і V
L
-домени гомологічних
моноклональних антитіл спонтанно об'єднуються в тандем V
L
— V
H
. Домени С
L
і С
н
забезпечують
взаємодію L- і Н-ланцюгів (табл. 28).
У молекулі IgG є 12 доменів, а в IgM і IgE — по 14. В α-ланцюгах за С
н
3-доменом і в μ-ланцюгах за
С
н
4-доменом розміщені додаткові «хвостові» ділянки. Вони гомологічні за амінокислотним
складом. У μ-ланцюгах до цієї ділянки приєднані J-ланцюги. Однак полімеризуються лише
ланцюги, які мають «хвостову» ділянку.
Дані рентгеноструктурного аналізу. З'ясуванню структури антитіл значною мірою сприяли дані
досліджень імуноґлобулінів методом кристалографії із застосуванням γ-випромінювання. За
допомогою дифракційного аналізу кристалів Fab-фраґментів IgG було виявлено наявність двох
доменів у легкому ланцюзі (V
L
і C
L
) і чотири — у важкому (V
H
, C
H
1, С
Н
2, С
Н
3). Інтактна молекула
IgG є структурою, що має 7 (12) доменів, складених у вигляді стопки ланцюгів, з яких три розміщені
на першому плані і чотири — на другому.
Розчинні комплекси, які утворюються кролячими антитілами до динітрофенолу, під електронним
мікроскопом мають вигляд трикутників з відростками, що виступають по кутах. Довжина бічних
сторін трикутників дорівнює довжині Fab-фраґментів. Латеральні виступи є Fc-фраґментами. У
комплексах, оброблених пепсином, їх немає. Комплекси бувають у вигляді тримерів чи пентамерів.
Молекула IgM під мікроскопом має вигляд зірки з центральним кругом діаметром 100 нм і п'ятьма
латеральними ніжками-відростками завдовжки 12,5 нм.

23
За даними електронно-мікроскопічних досліджень, розміри структурних частин молекули антитіл
такі: довжина Fab-фрагментів — 6 нм, Fc-фраґментів — 4,5 нм, ширина — відповідно 3,5 і 4,0 нм.
Рецепторна зона (активний центр антитіла) розміщена у верхній частині Fa фрагмента, розміри й
форма якої дуже коливаються. Наприклад, у різних молекулах вона має форму прямокутника і
розміри 2,0х1,5х1,2 нм; заглиблення відповідно 1,6х1,7х0,6 нм. Іноді ці заглиблення мають форму
конуса завглибшки 0,7 нм та діаметром 1,0 нм біля основи і 1,5 нм на поверхні. Кут між V
H
—С
Н
1 і
С
н
2-доменами становить 135° у кристалах Fab-фраґментів і 170° у кристалах IgG, тобто між V
H
—
С
Н
1 є лабільна ділянка ланцюга.
Вуглеводи. До поліпептидної молекули імуноґлобулінів приєднуються олігоцукриди, які
становлять 2,5—18 % її маси. Вони ковалентно сполучені з різними фрагментами, тому
імуноґлобуліни є глікопротеїнами. В молекулі IgG олігоцукриди, приєднані до важкого ланцюга,
можуть бути в ділянці Fc-фраґмента і в ділянці NH
2
-кінцевої частини легкого ланцюга. Вони
розміщені переважно в С-ділянці Н-ланцюгів у доменах С
Н
1 і С
Н
2. Вуглеводні компоненти, які
переважно складаються з галактози, манози, N-ацетилглюкозаміну, фукози й сіалової кислоти,
включаються ковалентно у пептидний ланцюг Fc-фраґмента через глікозидний зв'язок між
аспарагіном і N-ацетилглюкозаміном. Ці компоненти приєднуються до молекули імуноґлобуліну в
процесі біосинтезу ланцюгів і в момент проходження молекул через комплекс Гольджі. Глюкозамін
і галактоза включаються в ланцюги на початкових етапах синтезу, а сіалова кислота – наприкінці,
тобто в процесі секреції молекули з клітини. Вуглеводи можуть підтримувати функціональну
конформацію доменів та захищати чутливі ділянки від пошкодження протеолітичними ферментами
і, можливо, брати участь у портуванні й секреції імуноглобулінів.
У молекулах IgG вуглеводи, очевидно, розміщені на поверхні С
н
2-доменів. Вони прикріплені до
аспарагіну в положенні 297 в обох важких ланцюгах. Є дані про те, що позбавлені вуглеводів
моноклональні антитіла зберігають здатність зв'язуватися зі специфічним антигеном і білком А
стафілокока, однак втрачають здатність активувати комплемент, спричинювати антитілозалежну
клітинну цитотоксичність і взаємодіяти з Fc-рецепторами клітин.
4.2. АНТИГЕННІ ВЛАСТИВОСТІ ІМУНОҐЛОБУЛІНІВ.
У молекулах імуноґлобулінів розрізняють три типи антигенних детермінант: ізотипові, алотипічні
та ідіотипічні. Ізотипічні детермінанти ідентичні для імуноглобулінів усіх особин одного виду.
Алотипічні детермінанти — внутрішньовидові, вони є в імуноґлобулінах одних особин певного
виду і їх немає в інших. Ідіотипічні детермінати характерні лише для антитіл, синтезованих одним
конкретним клоном плазматичних клітин однієї особини.
Ізотип. Класо- та типоспецифічні антигенні детермінанти, які є в імуноґлобулінах особин певного
виду, називають ізотипами. Вони локалізовані на сталих ділянках поліпептидних ланцюгів і
специфічні для Н-ланцюгів цього класу та для L-ланцюгів цього типу (табл. 29, 30).
Отримання антиізотипічних антитіл, специфічних до імуноґлобулінів мишей, полегшується тим, що
для імунізації можна використати моноклональні антитіла мишачих плазмоцитів. Ізотипічні
сироватки проти імуноглобулінів людини використовують для кількісного дослідження антитіл
основних класів під час захворювань. Ізотипічні сироватки до імуноглобулінів людини дають
перехресні реакції з імуноглобулінами багатьох видів. У сироватці крові кожного індивіда містяться
всі п'ять ізотипів (антигенних детермінант) Н-ланцюгів, два ізотипи легких — κ- і λ-. Щоб отримати
ізотипічні сироватки, кролів імунізують мієломним імуноглобуліном людини цього класу і
отриману сироватку адсорбують імуноґлобулінами решти класів.
Алотипи. Антигенні детермінанти, за якими молекули імуноґлобулінів одних особин відрізняються
від молекул антитіл інших особин одного й того самого виду, називають алотипами. Ці
детермінанти є в одних особин і відсутні в інших. Вони локалізовані в сталій ділянці поліпептидних
Н- і L-ланцюгів, кодуються алельними генами і характеризують внутрішньовидовий поліморфізм
імуноґлобулінів.
Алотипи виявлено у тварин різних видів. Наприклад, є шість алотипів γ-ґлобулінів кроля. У людини
відомо три алотипічних маркери — G
m
, A
m
і K
m
, які відповідно кодуються локусами G
m
(γ-маркер),
А
m
(α-маркер) і К
m
(κ-маркер).
Фактори G
m
, A
m
розміщені на важких ланцюгах відповідно IgG і IgA, a K
m
– на легких ланцюгах
типу κ. Виявлено 25 алотипів системи G
m
, які у людини локалізовані переважно в Н-ланцюгах у
ділянці Fc-фраґмента. Наприклад, в особин G
lm(3)
у Н-ланцюгах у положенні 214 розміщений аргінін,
а в особин G
1rn(17)
— лізин (табл. 31).
Розрізняють прості і складні алотипи. Алотипічні варіанти γ-ланцюгів, які відрізняються однією-
двома амінокислотами на 100 залишків амінокислот, є простими алотипами. Складні алотипи
різняться між собою 15 — 20 амінокислотами на 100 залишків амінокислот. Прикладами складних
алотипів є алотипи К
m
κ-ланцюга і G
m
γ-ланцюга людини. Успадковуються алотипи як прості ознаки
і згідно із законами Менделя. У гетерозиготних особин гени, що кодують алотипи, є
кодомінантними, але на рівні клітини експресується один алель.
Явище синтезу В-лімфоцитами імуноґлобулінових ланцюгів лише одного типу з двох можливих
алотипів називають алельним виключенням. У сироватці крові особин, гетерозиготних за алотипами
імуноґлобулінів, виявлено обидва алотипи, проте кожна плазматична клітина синтезує
імуноґлобуліни лише одного класу, підкласу й алотипу, специфічні лише до одного антигену і лише
до однієї антигенної детермінанти.
Щоб отримати антисироватки до алотипічних детермінант, імуноґлобулінами певного класу
імунізують тварин того самого виду, які, проте, різняться за алотипами. Якщо така відмінність буде
за одним маркером, то можна отримати моноспецифічну сироватку. Алотипія не виявляється в тому
разі, коли для отримання імунних сироваток використовують гомозиготних тварин.
Наявність алотипів у людини можна виявити різними способами. Встановлено, що сироватки
хворих на ревматоїдний артрит містять антитіла, які реагують лише з імуноґлобулінами частини
здорових людей. Цим способом можна виявити алотипи G
m
. Антитіла до алотипів класу G матері,
яких немає в організмі дитини, виявляються у сироватці дітей, а також у сироватках після
переливання крові.
Ідіотипи. Антигенні детермінанти імуноґлобулінів, характерні для молекул імуноґлобулінів певної
специфічності, що синтезовані одним клоном плазматичних клітин, називають ідіотипами. Ідіотипи
розміщені в ділянці Fab-фрагментів і локалізуються в рецепторній зоні антитіл у ділянці, що
пов'язана з нею, оскільки гаптен блокує реакцію антигаптенових антитіл з антиідіотипами. Ідіотипи
формуються за участю легкого й важкого ланцюгів, оскільки антиідіотипічні сироватки не реагують
з ізольованими ланцюгами імуноґлобулінів, але взаємодіють з реасоційованими антитілами.
Ідіотипи (idios — індивідуальний) — це антигенні відмінності в структурі активних центрів антитіл
антитілосинтезувальних клонів в організмі різних особин (табл. 32). Ідіотипічні детермінанти
можуть виникати в активному центрі антитіл як у гіперваріабельних ділянках, так і в каркасній
структурі. Вони можуть бути спільними для різних варіабельних ділянок та унікальними, які
реагують з антиідіотипічними антитілами суворої специфічності. Оскільки та сама V-ділянка може
комбінуватися з константними ділянками Н-ланцюгів усіх класів, той самий ідіотип може
траплятися в антитілах різних класів. Однозначні ідіотипи можуть виявлятися у тварин різних видів.
Очевидно, що в цих випадках антигенні детермінанти подібні, але не повністю ідентичні.
Ідіотипи можна виявити в сироватці проти антитіл однієї особини, яку отримано імунізацією іншої
особини того самого виду й алотипу. Якщо антитілами кроля А проти пневмокока імунізувати кроля
В, то отримана сироватка реагуватиме з пневмококовими антитілами кроля А, однак не реагуватиме
з пневмококовими антитілами інших кролів та інших видів тварин, а також з антитілами того самого
кроля А, але інших специфічностей. Синтез антитіл з антиідіотипічними специфічностями можна
пояснити тим, що клон або група клонів, які виникли в результаті селекції мутантів або соматичного
диференціювання, синтезують унікальні за структурою V
L
—V
Н
-ланцюги. Найпростіший спосіб
виявлення ідіотипів — імунізація мієломними білками, що містять гомогенні антитіла.
Антисироватки до мієломних антитіл реагують з V-ділянкою імуноґлобулінів одних і не реагують з
V-ділянками інших особин.
Ці відмінності зумовлюються наявністю ідіотипічних детермінант, які визначають антигенну
специфічність ланцюгів імуноґлобулінів цієї особини. Якщо реконструювати молекулу антитіл
заміною легких і важких ланцюгів іншого мієломного глобуліну, то такі ідіотипічні антитіла не
реагуватимуть з антисироваткою, отриманою до вихідних мієломних білків.
Антигенні властивості антитіл виявляються, якщо імунізувати ними тварин інших видів і тварин тієї
самої інбредної лінії. У першому випадку виявляються спільні антигени, в другому — ідіотипічні.
До ідіотипічних детермінант активного центру в ізологічній антисироватці міститься значно більше
антитіл, ніж у гетерологічній.
В експерименті на тваринах показано, що антиідіотипічні антитіла утворюються при нормальній
імунній відповіді на багато антигенів: ксеногенні еритроцити, сироваткові білки, багато видів
бактерій. Антиідіотипічні антитіла в організмі можуть синтезуватися спонтанно. Феномен супресії
ідіотипів має біологічне значення, оскільки антиідіотипічні антитіла можуть виконувати роль
регуляторів імунної відповіді.
Ідіотипи, по суті, є антигенними субстанціями, або аутоантигенами молекул антитіл, які
розпізнаються імунною системою організму, що синтезує ці антитіла. Вони виконують функцію
імунорегуляторних структур унаслідок зворотного зв'язку ідіотип — антиідіотип. Наявність такого
механізму саморегуляції забезпечує автономність функціонування імунної системи (теорія
імунорегуляторної сітки).
4.3. АКТИВНИЙ ЦЕНТР АНТИТІЛ.
Специфічність антитіл зумовлюється відповідністю конфігурації рецепторної групи антитіла
детермінантній групі антигену, яка створюється певною послідовністю амінокислот у варіабельних
ділянках важких і легких ланцюгів. Реакція антигену з антитілом значно змінюється в разі заміни в
антигенній детермінанті тих залишків амінокислот, від яких залежить просторова конфігурація
пептиду.
Активним центром (або паратопом, антидетермінантою, рецепторною зоною) називають ділянку
молекули антитіла, структура якої комплементарна детермінантній групі антигену (епітопу).
Активний центр — це щілина, утворена варіабельними ділянками легкого й важкого ланцюгів (мал.
39). У формуванні активного центру антитіл крім
гіперваріабельних ділянок беруть участь інші
структури, які стабілізують конфігурацію і
представлені інваріантними ділянками
поліпептидних ланцюгів. Активний центр антитіл
характеризується функціональною автономією,
тобто здатний зв'язувати антигенну детермінанту
(ліганд) в ізольованому вигляді. Крім того, для
нього характерна здатність спонтанної
реконструкції з важких і легких ланцюгів. Після
сполучення V
Н
і V
L
-доменів утворюються
структури сферичної форми. Вільна поверхня
таких глобул оточена гіперваріабельними
петлями важких і легких ланцюгів. Глибина,
розміри й форма порожнин, що утворюються між
V
Н
- і V
L
-ланцюгами, бувають різними і залежать
від виду антитіл.
За даними Ф. Карума (1968), активний центр
антитіла має форму щілини завглибшки 1,2 нм,
яка розміщена між варіабельними доменами легкого й важкого ланцюгів і в яку входить антигенна
детермінанта. У будові активного центру антитіла беруть участь до 20 залишків амінокислот, які
становлять близько 2 % поверхні антитіла. Ці
розрахунки випливають зі спостережень, в яких
антисироватки до олігоцукридів із залишків
глюкози пригнічували преципітацію декстрану.
Оскільки найактивнішою була сироватка до
гексамеру, припустили, що розмір гексацукриду 2
— 4 нм відповідає розміру активного центру. Ця
структура варіює за розмірами й об'ємом, що
впливає на афінність антитіл до конкретного
антигену (табл. 33).
У побудові порожнини активного центру беруть
участь гіперваріабельні ділянки як важкого, так і
легкого ланцюгів, однак більшу роль відіграє
важкий ланцюг. Так, у створенні стінок
порожнини активного центру мієломного білка
МОРС 603, що зв'язує фосфорилхолін, беруть
участь дві гіперваріабельні ділянки легкого ланцюга і три — важкого. Утворена ними порожнина
активного центру має клиноподібну форму, розміри 1,5х2,0 нм і глибину 1,2 нм. Максимальна
площа поверхні рецепторної зони IgG становить близько 100 нм
2
при загальній поверхні всієї
молекули приблизно 70 000 нм
2
(мал.40).
Розміри активного центру антитіла трохи перевищують розміри антигенної детермінанти. Однак
через неоднорідність антитіл за структурою детермінанти розміри ці відхиляються в обидва боки.
Розміри активних центрів визначаються, очевидно, величиною антигенних детермінант. Так,
активний центр IgG до білка New має розміри 0,6х0,6х1,5 нм. Ліганд зв'язується як з важким, так і з
легким ланцюгом рецепторної зони антитіла. Площа контакту відносно невелика для малих лігандів
(фосфорилхолін), однак вона більша для великих лігандів. Рентгеноструктурними дослідженнями
було встановлено, що ліганд малих розмірів (фосфорилхолін), зв'язуючись з активним центром,
займає середину щілини, якщо він сполучений з 91—94-м залишками амінокислот легкого і з 33-м,
52-м і 102-м, 103-м залишками амінокислот важкого ланцюгів.
Ліганд, зв'язуючись з активним центром, стабілізує його структуру, що сприяє підвищенню
стійкості ліганду до протеолізу, який при цьому настає. Використовуючи як антиген кон'югати білка
з оліго-D-аланіном, було виявлено, що ефект блокування реєструється з ди-D-аланіном, але є
найінтенсивнішим з тетра-D-аланіном. Тетра-L-аланін ефекту блокування не виявляв. З цих даних
випливає, що антитіла розрізняють олігопептиди із залишків D- та L-амінокислот і що розміри
активного центру мають відповідати розмірам тетрапептиду. Антитіла разом з антигенною
детермінантою розпізнають також залишок амінокислот, з яким детермінанта кон'югована. При
заміні останнього афінність антитіл (константа зв'язування) зменшується.
Для вивчення активних центрів використовують метод під назвою «мітка за спорідненістю». Його
суть полягає в тому, що антитіла обробляють специфічним гаптеном, який здатний сполучатися
ковалентними зв'язками з деякими амінокислотами активного центру антитіл. Як мітку найчастіше
використовують групу діазонію, що утворює ковалентні зв'язки із залишками тирозину, гістидину
або лізину антигензв'язувальної ділянки антитіл. Після сполучення гаптену з антидетермінантою
здійснюють гідроліз імуноглобуліну, вивчають послідовність амінокислот і за положенням
реактивної групи в молекулі роблять висновок про місцезнаходження активного центру. Реакцію
мітки за спорідненістю контролюють за відсутністю мічених гаптенів у неспецифічних γ-глобулінах
та гальмуванням мітки немаркованим гаптеном. За результатамі досліджень, найбільшу роль у
зв'язуванні антигену відіграють тирозин, лізин і гістидин. Про специфічність реакції мітки за
спорідненістю свідчить те, що зв'язування антитіл зі специфічним антигеном пригнічується
гаптеном і реакція мічення не підсилюється надлишком реагенту — мітки. Мітку за спорідненістю
здійснюють також, добавляючи до антитіл мічений тритієм гаптен, здатний утворювати азозв'язки з
тирозином у рецепторній групі. Потім антитіла розщеплюють протеолітичними ферментами і
виявляють тритій методом пептидних карт. Так було доведено, що активні центри антитіл
утворюються варіабельними ділянками як важких, так і легких ланцюгів.
Дані останніх років свідчать про те, що як ще передбачав Бернет, той самий активний центр може
зв'язуватися з кількома антигенними детермінантами, які різняться за своєю фізико-хімічною
структурою, а до однієї антигенної детермінанти постійно виявляється багато типів
комплементарних антитіл.
В експериментальних дослідженнях і на основі статистичних розрахунків було показано, що до
кон'югованого з білком гаптену — НІФ (3-йод-4-окси-5-нітрофеніл) у середньому синтезується 5000
видів рецепторних груп, які утворені V
Н
- і V
L
- ланцюгами. Це свідчить про те, що гаптен активує
значну кількість В-клітинних клонів.
Активні центри антитіл можуть зв'язувати ліганди, які не подібні за структурою (мал. 41). Навіть
мієломні білки зв'язують кілька різних гаптенів. Оскільки при цьому гаптени виявляють
конкурентні властивості, вони зв'язуються з тією самою гіперваріабельною зоною антитіл. Так,
24
моноклональний мишачий IgG до ДНФ, що синтезується плазмоцитомою, крім динітрофенолу
зв'язує також динітронафтол і менадіон.
Детермінанта зазвичай займає лише частину
порожнини активного центру. Саме цим
зумовлюється здатність активних центрів
зв'язувати не лише специфічні, а й споріднені в
структурному відношенні детермінанти.
В активному центрі є просторово розділені
ділянки зв'язування різних антигенів. Так, у
мієломному білку ділянки зв'язування ДНФ і
менадіону розділені ділянкою поліпептидного
ланцюга завдовжки 1,2 — 1,4 нм. Передбачають,
що кожний з цих двох антигенів, які зв'язуються з
окремими рецепторними групами, може
самостійно індукувати синтез антитіл, що
зв'язуються з обома антигенами. Синтез таких
антитіл здійснює той самий клон лімфоцитів.
Однак досить високу стеричну відповідність рецепторної зони антитіл антигенній детермінанті
можна проілюструвати тим, що між орто-, мета- і пара-амінобензойними кислотами та D- і L-
ізомерами винної кислоти не відбувається перехресних реакцій. Виявлено відмінності в
послідовностях амінокислот у молекулах антитіл двох різних специфічностей — до ДНФ і арсенату.
З'ясовано структурну подібність V-ділянок антитіл до того самого антигену у тварин аутобредної
популяції і навіть у тварин різних видів. Крім того, гіперваріабельні ділянки антитіл, що різняться
між собою амінокислотним складом, можуть зв'язуватися з тією самою детермінантою, тобто з
певною детермінантою можуть зв'язуватися і неспоріднені антитіла.
Популяція антитіл, що утворюється в процесі імунізації, гетерогенна за антигензв'язувальними
центрами та афінністю навіть до окремого епітопу, що зумовлено гетерогенністю
антитілосинтезувальних клонів. Разом з тим окремий клон плазмоцитів синтезує високогомогенні
антитіла. Антигензв'язувальні центри молекул антитіл можуть зв'язувати кілька структурно
подібних антигенів, їх називають перехреснореагуючими антигенами. У деяких випадках молекули
гомогенних антитіл можуть зв'язувати і структурно відмінні антигени, що пояснюється утворенням
зв'язків з різними ділянками антигензв'язувального центру. Гетерогенність антитіл навіть до
окремого епітопу пояснюється тим, що специфічні до цього гаптену різні клони В-лімфоцитів
синтезують не абсолютно гомогенні антитіла.
Імунні сироватки можуть містити у своєму складі кілька популяцій антитіл з різною специфічністю,
хоча відомо, що є високоспецифічні антитіла, здатні розрізняти моно- та динітрофенольні
угруповання. Якщо припустити, що рецептор кожного з клонів імунокомпетентних В-лімфоцитів
комплементарний детермінанті А і ще кільком різним детермінантам, то при імунізації А-антигеном
усі специфічні клони проліферуватимуть і синтезуватимуть антитіла проти антигену А. Це
забезпечить високий рівень анти-А-антитіл. Оскільки антитіла кожного з клонів мають ще кілька
інших рецепторів, різних для різних клонів, то у високоспецифічній сироватці в низьких титрах
міститимуться антитіла ще до багатьох антигенних детермінант. Специфічність такої сироватки
визначатиметься середньою характеристикою популяцій антитіл, що в ній містяться.
4.4. СИНТЕЗ МОЛЕКУЛ ІМУНОҐЛОБУЛІНІВ.
Легкі та важкі ланцюги імуноґлобулінів синтезуються окремо і сполучаються в молекулу γ-
ґлобуліну перед виділенням з клітини. Молекула кролячого IgG утворюється в результаті
зв'язування готових ланцюгів, а не комбінацією легких ланцюгів з важкими в момент їх синтезу.
Легкі ланцюги IgG синтезуються на полірибосомах плазмоцитів, які складаються з 5 — 7 рибосом
(120 — 200 S), а важкі ланцюги — на полірибосомах, що складаються з 16-18 рибосом (280-300 S).
Полірибосоми, що синтезують як важкі, так і легкі ланцюги IgG, розміщені на ендоплазматичному
ретикулумі. Ланцюги переміщуються в щілини між цистернами шорсткого ендоплазматичного
ретикулуму і під час проходження крізь них у комплекс Гольджі збираються в молекули. У
комплексі Ґольджі до них за допомогою гексозотрансфераз прикріплюються вуглеводні
компоненти. Під час досліджень з радіоактивними вуглеводами було показано, що спочатку до
ланцюга приєднується глюкозамін, потім
маноза, галактоза та сіалова кислота. В момент
виділення з клітин до молекул приєднується ще
фукоза.
Секреція антитіл відбувається шорсткими
мембранами в пухирці, після чого вони
виділяються крізь гладенькі мембрани. З
цитоплазми антитіла вивільнюються внаслідок
секреції або при клазматозі. Дрібні пухирці
виділяються з мішечків ергастоплазми. У
подальшому молекула прикріплюється до
клітинної мембрани, де формується остаточно
(мал. 42). Крізь отвір, що утворився в мембрані,
відбувається секреція пухирців назовні та їх
лізис. При клазматозі без'ядерні частини
цитоплазми, що містять секретований γ-
глобулін, відокремлюються брунькуванням і
вивільнюють антитіла з ергастоплазматичних
мішечків після їх лізису. L-ланцюг синтезується
впродовж 30 — 45 с, а Н-ланцюг — упродовж
60 — 90 с. Об'єднання Н- і L-ланцюгів
відбувається в ендоплазматичному ретикулумі.
Приєднання вуглеводів, їх транспортування у
цитомембрані та секреція здійснюються
впродовж приблизно 30 хв. J-ланцюги також
синтезуються плазматичними клітинами і
об'єднують мономерні молекули IgM та IgA
безпосередньо перед початком секреції.
Молекули імуноґлобулінів утворюються в
результаті приєднання легких ланцюгів до
димеру Н — Н або димеризації Н — L-
структур. Вважають, що механізм секреції
імуноґлобулінів зумовлюється наявністю
специфічних послідовностей або вуглеводною
міткою. Однак зазначену послідовність не
виявлено, а в частині молекул антитіл немає
вуглеводів. Полімерні молекули містяться в цитоплазмі лише у вигляді слідів, з чого можна зробити
висновок, що вони сполучаються безпосередньо перед виділенням з клітини. Імуноґлобуліни
становлять близько 40 % білків, які продукуються плазматичними клітинами.
При імунізації не завжди виявляється паралелізм динаміки вмісту в сироватці крові γ-глобулінів і
специфічних антитіл. У клітині одночасно синтезуються імунні та неімунні γ-глобуліни. Появі
антитіл передує збільшення концентрації неспецифічних γ-глобулінів.
Антитіла всіх класів можуть існувати у вигляді мембранних рецепторів. Ці два види антитіл
різняться структурою кінцевих ділянок. Мембранні антитіла мають гідрофобний фрагмент,
вбудований у мембрану, і коротку ділянку в цитоплазмі.
Плазмоцит синтезує до 2000 молекул антитіл за секунду. Антитіла, які виділяються з клітин,
потрапляють у кров, лімфу й тканинну рідину. Половина всіх імуноглобулінів знаходиться
всередині судинного русла, а друга половина — у міжклітинній рідині та сполучній тканині. За добу
четверта частина імуноґлобулінів, що циркулюють у крові, внаслідок дифузії крізь капіляри
переходить у тканини, а на її місце в кровотік надходить з лімфою така сама кількість
імуноґлобулінів. Вважають, що надходження імуноґлобулінів у тканини залежить від коефіцієнта
дифузії. IgM, що має низький коефіцієнт проникності, у значних кількостях виявляється в сироватці
крові, a IgG, у якого цей коефіцієнт високий, — екстрацелюлярно. Рівень IgD відносно вищий у
судинах, що, очевидно, пояснюється його низькою здатністю до дифузії. IgA в більшій концентрації
міститься в лімфі, ніж у сироватці крові, оскільки, синтезуючись у значній кількості в кишках, він
дифундує в лімфу й грудну протоку.
Антитіла різної специфічності можуть бути представлені будь-яким з класів імуноґлобулінів. Щоб
з'ясувати можливість утворенння в одній клітині імуноґлобулінів двох класів, вивчали синтез
антитіл in vitro в лімфоїдних клітинах мишей різних ліній. Методом імунофлуоресценції було
доведено, що незначна частина клітин містить важкі ланцюги двох різних класів. Більшість
антитілоутворювальних клітин одночасно синтезують один клас важких і один тип легких ланцюгів
імуноґлобулінів. Водночас у лімфоїдній тканині синтезуються поліпептидні ланцюги різних класів і
типів на той самий антиген. Синтез імуноґлобулінів того чи іншого класу залежить від дози
антигену та інтенсивності антигенного стимулу. Відомо, що при одноразовій імунізації малими
дозами баранячих еритроцитів у кроля утворюється IgM, а при гіперімунізації — IgG.
4.5. ВЗАЄМОДІЯ АНТИТІЛ З АНТИГЕНАМИ.
Взаємодія антитіл з антигенами ґрунтується на принципі комплементарності. Це
загальнобіологічний принцип, що зумовлює взаємодію біоорганічних молекул. Здатність до
специфічного взаємного розпізнавання, як вважав М.Ф. Бернет, є найважливішою первинною
властивістю живої матерії. Достатній ступінь комплементарності молекул, що взаємодіють,
створюється різними способами: відповідністю поверхонь (виступ – заглибина), протилежними
електричними зарядами (проти позитивного розміщується негативний), комбінацією
електростатичної та конформаційної комплементарності і розміщенням одна навпроти одної
неполярних гідрофобних груп.
Стереспецифічне сполучення антиген —
антитіло гіпотетично може бути трьох типів:
1) одномоментна взаємодія за типом «ключ
—замок»; 2) послідовна взаємодія ліганд —
рецептор, за якої контактування спочатку в
одній точці зумовлює наступні
конформаційні зміни в рецепторних зонах
антитіл, унаслідок чого підвищується
комплементарність та міцність зв'язку
взаємодіючих поверхонь; 3) взаємодія, в
результаті якої настають конформаційні
зміни лігандів.
Крім безпосередньої взаємодії з антигенами,
внаслідок якої відбувається елімінація
антигенів з організму, антитіла виконують
функції специфічних рецепторів, які
сприймають і передають сигнали в клітину, в
результаті чого настає їх активація,
проліферація та диференціювання, або пряма
біологічна відповідь.
Антитіла та антигенрозпізнавальні рецептори
імуноґлобулінової природи розпізнають
поверхневі антигенні детермінанти. Для
ефективної взаємодії антитіла (їх активний
центр) та антигени (їх детермінантні групи)
повинні мати добру просторову відповідність.
Вважають, що молекули антигенів та антитіл
мають кулясту форму, яка зберігається і в
момент їх взаємодії. На поверхні їхніх
молекул є стереохімічне комплементарні
ділянки, які забезпечують можливість їх сполучення (мал. 43). За даними Е. Кabat і М. Meyer (1971),
антигенні детермінанти мають бути опуклими, а активний центр — утворювати комплементарну їм
угнутість (порожнину) розміром 3,4х1,2х0,7 нм і загальною площею 250 — 300 нм
2
. Виходячи з
цього, було зроблено припущення, що зв'язування антигенів з антитілами відбувається за
принципом зв'язку ферментів із субстратами. Реакція антиген — антитіло є моделлю
нековалентного зв'язку, який спостерігається також при взаємодії вірусів з клітинами, агрегації
клітин у процесі запліднення та при морфогенезі. К. Ландштейнер вважав, що комплекс антиген —
антитіло за характером зв'язків подібний до йонних і молекулярних сполук більше, ніж до сполук,
що утворюються в результаті виникнення ковалентних зв'язків.
Після зв'язування антигенів та антитіл у їхніх молекулах не відбувається глибокої перебудови
структури, такої як модифікація структури субстрату при дії ферменту, деградації або денатурації
їхніх молекул. Виділені з комплексу антигени і антитіла не відрізняються від нативних за здатністю
реагувати з відповідними компонентами in vitro та індукувати імунні реакції.
Однак є дані про те, що в процесі взаємодії антиген — антитіло відбувається глибока перебудова
третинної структури. Стереохімічні зміни антигену відіграють важливу роль у забезпеченні
конформаційної комплементарності. Ці процеси можуть відбуватися внаслідок змін внутрішньої
енергії при виникненні нових ділянок зв'язування.
Зв'язок між антигеном і антитілом оборотний. Константа дисоціації між ними визначається
співвідношенням комплексів антиген — антитіло до вільних компонентів. Константа швидкості
дисоціації реакції антиген — антитіло наближається до швидкості реакції фермент —субстрат.
Однак, на відміну від останньої, реакція антиген — антитіло в кінцевому підсумку незворотна і
комплекси антиген —антитіло, що утворюються в організмі, можуть бути еліміновані внаслідок
тривалого і складного процесу катаболізму.
Уявлення про те, що антитіла розпізнають антиген завдяки взаємній комплементарності, були
підтверджені цілою низкою експериментальних досліджень, у тому числі рентгеноструктурним
аналізом взаємодії специфічних антитіл з антигеном. Контактуючі залишки амінокислот
розміщуються здебільшого настільки близько один від одного, що молекули води між ними не
проникають. Саме цей факт має принципове значення для стійкого зв'язування антигену з
антитілами.
Відомо, що зі зменшенням міжмолекулярної відстані сила зв'язування антигену з антитілом зростає.
Сили, що утримують антиген з антитілами, принципово не відрізняються від сил, що беруть участь
у так званих неспецифічних взаємодіях, які виникають між будь-якими макромолекулами. Ці
міжмолекулярні сили поділяють на такі групи: 1) електростатичні сили; 2) водневі зв'язки; 3)
гідрофобні взаємодії; 4) вандерваальсові сили.
Електростатичні сили зумовлені притяганням між двома протилежно зарядженими йонізованими
групами, наприклад аміногрупою (—NН
2
) і карбоксильною (—СОО
–
) групами білків. Сила
притягання між такими зарядами обернено пропорційна квадрату відстані між зарядами. При
зближенні зарядів сила притягання значно зростає: якщо зменшити відстань удвічі, то сила
притягання зростає вчетверо. Крім того, оскільки діелектрична стала води дуже висока, то
видалення молекул води з простору між амінокислотними залишками, що взаємодіють, призводить
до значного збільшення сили притягання. Диполі, розміщені на поверхні молекул антигену й
антитіла, мають притягуватися один до одного. Електростатичні взаємодії можуть виникати і в
результаті перенесення заряду між молекулами антигенів та антитіл.
Водневі зв'язки. Утворення слабких водневих зв'язків між гідрофільними групами, наприклад ОН
–
,
NH
2
–
і СОО
–
, залежить насамперед від просторового зближення молекул, що мають ці групи.
Водневі зв'язки відносно слабкі, оскільки мають суто електростатичну природу, однак видалення
молекул води із зони, де знаходяться бічні групи амінокислот, що взаємодіють, значно збільшує
енергію зв'язування, оскільки при цьому різко зменшується діелектрична стала.
Гідрофобні взаємодії. Неполярні гідрофобні групи, наприклад бічні групи валіну, лейцину чи
фенілаланіну, у водному середовищі прагнуть зблизитися між собою. Така гідрофобна взаємодія
зумовлена певними причинами. Молекули води утворюють між собою сітку водневих зв'язків, і
якщо у воду ввести гідрофобні молекули, то кількість конфігурацій, за яких утворюватимуться
водневі зв'язки, зменшується порівняно з чистою водою. В результаті ентропія такої системи нижча.
Чим більша площа поверхні між гідрофобними молекулами і контактуючими з ними молекулами
води, тим менша ентропія і тим вища енергія системи. Якщо гідрофобні групи двох білків настільки
наближаються один до одного, що між ними не залишається молекул води, то загальна площа їх
контакту з водою зменшується і енергія системи нижча, ніж до їх взаємодії. Інакше кажучи, можна
говорити про притягання між білками. Гідрофобні зв'язки можуть забезпечувати до 50 % усієї
спорідненості між антигенами та антитілами.
Сили Ван дер Ваальса. Ці сили виникають у результаті взаємодії поверхневих електронних шарів
контактуючих ділянок молекул. Відомо, що відмінності між властивостями реальних та ідеальних
газів, згідно з кінетичною теорією, зумовлені ван-дерваальсовим притяганням між молекулами. Цей
факт має суто математичне пояснення. Проте описово можна уявити, що в результаті флуктуації
електронної густини в одній молекулі вона набуває властивостей диполя. Такий диполь індукує
перерозподіл електронної густини і утворення диполя в іншій молекулі, і ці два диполі взаємно
притягуються. Зміщені електрони, повертаючись у положення рівноваги, проскакують його, тобто
диполі осцилюють. Сила притягання між диполями обернено пропорційна відстані між ними в 7-му
степені, тобто вона швидко зростає при зближенні молекул, що взаємодіють.
Сили, що стабілізують комплекс антиген—антитіло, мають спільну властивість: тільки при
значному зближенні двох молекул і особливо в тому разі, коли в зону контакту вже не можуть
проникати молекули води, ці сили набувають високих значень. Взаємно комплементарні форми
електронних шарів антигензв'язу вального центру антитіла і поверхневої антигенної детермінанти
дають можливість цим двом молекулам зблизитись. Чим більша площа контакту, тим сильніше
взаємне притягання між антигеном і антитілом.
Реакція антиген — антитіло є екзотермічною, і підвищення температури сприяє дисоціації
комплексу антиген —антитіло. Оскільки взаємодія антиген — антитіло пов'язана з
електростатичними взаємодіями, то дисоціації комплексу сприяє високий рівень рН та зміни йонної
сили розчину, оскільки при цьому втрачаються як позитивні, так і негативні йони.
Афінність антитіл важлива для розуміння механізмів реакції антиген — антитіло і функціональної
ролі антитіл. Вона є сумою міжмолекулярних сил притягання й відштовхування, що діють між
активним центром антитіла і специфічним лігандом, тобто афінність антитіл — це ступінь
міцності, або величина взаємозв'язку, між одновалентним лігандом і одним антигензв'язувальним
центром антитіл. За визначенням Наукової групи ВООЗ, під афінністю, або афінітетом
(спорідненістю), розуміють активність антитіл у розрахунку на активний центр антитіла (або
середній активний центр гетерогенної популяції) незалежно від кількості активних центрів у
молекулі. Антитіло класу G (двовалентне) і його Fab-фрагменти (одновалентні) повинні мати
однакову афінність. Останню зазвичай оцінюють, вимірюючи ступінь зворотного зв'язування
одновалентного ліганду. Афінність виражають у вигляді середньої константи рівноваги. Цей
показник відповідає концентрації вільного ліганду (або її оберненій величині), за якої зайнята
половина всіх активних центрів антитіл. По суті, афінність є величиною сили взаємодії між
антигеном і антитілами.
Результати досліджень із застосуванням динітрофенільних кон'югатів з антитілами методами
електронної мікроскопії свідчать про те, що кожна ДНФ-група контактує з одним
антигензв'язувальним центром і є моновалентною. Під час діалізу суміші гаптенів зі специфічними
антитілами показано, що їх взаємодія оборотна і швидкість дисоціації комплексу антиген —
антитіло залежить від афінності. Афінність можна виразити через константу рівноваги К реакції
взаємодії:
За законом дії мас
де [Ат] - концентрація вільних антигензв'язувальних центрів; [Г] - концентрація вільних гаптенів;
[АтГ] — концентрація їхніх комплексів.
Якщо антитіла міцно зв'язуються з гаптеном, то рівновага реакції зміщується вправо. Такі антитіла
називають високоафінними. За певної концентрації вільного гаптену [Г
В
] в реакції візьме участь
половина антигензв'язувальних центрів:
тобто константа афінності К дорівнює зворотній величині концентрації вільного гаптену, за якої в
стані рівноваги зайнята половина антигензв'язувальних центрів. Інакше, якщо антитіла мають
високу константу афінності і міцно зв'язують гаптени, то для напівнасичення антитіл достатньо
невисокої концентрації гаптену. Індивідуальний епітоп на поверхні складного гаптену за
визначенням є моновалентним і міцність його зв'язування з одновалентним антитілом або Fab-
фраґментом також можна виразити через константу афінності.
Величина К визначається різницеї вільної енергії (ΔG) між станом антигенів та антитіл, коли вони
не взаємодіють між собою, і тим станом, коли вони утворюють комплекс антиген —антитіло. Ця
залеж ність описується рівнянням
де R — універсальна газова стала; Т -абсолютна температура.
Деяка кількість енергії може витрачатися на зміну конформації антигену, яка необхідна для
взаємодії контактуючих амінокислотних залишків. Така зміна конформації може бути потрібною
або для того, щоб забезпечити сам контакт, або для того, щоб вивести із зони контакту ті
амінокислотні залишки, які створювали б сили відштовхування, коли б залишилися в попередньому
стані. Для обчислення константи афінності можна скористатися методом рівноважного діалізу і
отримані результати перерахувати за рівнянням закону дії мас.
Для реакції антиген —антитіло, яка є прикладом високоспецифічних взаємодій, константа афінності
є дуже високою і може досягати 10
11
моль/л. Зазвичай цей показник становить 10
4
—10
10
. Афінність
визначається площею контакту між антитілом та гаптеном або епітопом, міжмолекулярними
відстанями в зоні контакту, розподілом заряджених та гідрофобних груп, а також тими
конформаційними змінами, що зумовлені перекриванням електронних шарів реагуючих хімічних
груп.
Зв'язування антигену з антитілами в комплек залежить не лише від афінності антитіл, а й від
кількості валентностей та епітопів. Чим більша валентність антигену, тим менша для нього
ймовірність розриву зв'язку з антитілами внаслідок дисоціації. Підсилювальний ефект залежить
також від валентності антитіл, якою визначається авідність. Теоретично авідність двовалентного
антитіла вдвічі перевищує авідність Fab-фраґмента, з звідність IgM вп'ятеро вища за авідність IgG.
Авідність (авідитет) — здатність антитіл міцно зв'язуватися з антигеном. Авідність залежить як від
афінності, так і від кількості активних центрів на одну молекулу антитіла. IgM, які мають 5 — 10
активних центрів на молекулу, з тією самою афінністю, що й 2 активних центри, матимуть уп'ятеро
більшу звідність. Більша авідність у цьому випадку зумовлюється наявністю великої кількості
зв'язків полівалентної молекули антитіла з детермінантами одночасної специфічності, розміщеними
на відносно великій часточці антигену. Якщо молекула IgM зв'язується з антигеном, що має малу
кількість детермінант, авідність зв'язку послаблюється. Авідність зростає при надлишку
детермінант унаслідок можливості утворення між молекулою антитіла та часточкою антигену
великої кількості зв'язків. У разі надлишку антитіл прояв полівалентності IgM ускладнюється. У
процесі гіперімунізації відмінності в авідності антитіл, що належать до різних класів, завдяки
зростанню афінітету зменшуються.
Термін «афінність» стосується зв'язування антитіла з моновалентним гаптеном або з однією
антигенною детермінантою. Здебільшого відбувається взаємодія антисироватки (сироватки крові
імунізованої тварини або людини) з полівалентними антигенами, якими є більшість природних
антигенів. Тому для опису взаємодії такого типу, яку схематично можна подати рівнянням
використовують термін авідність.
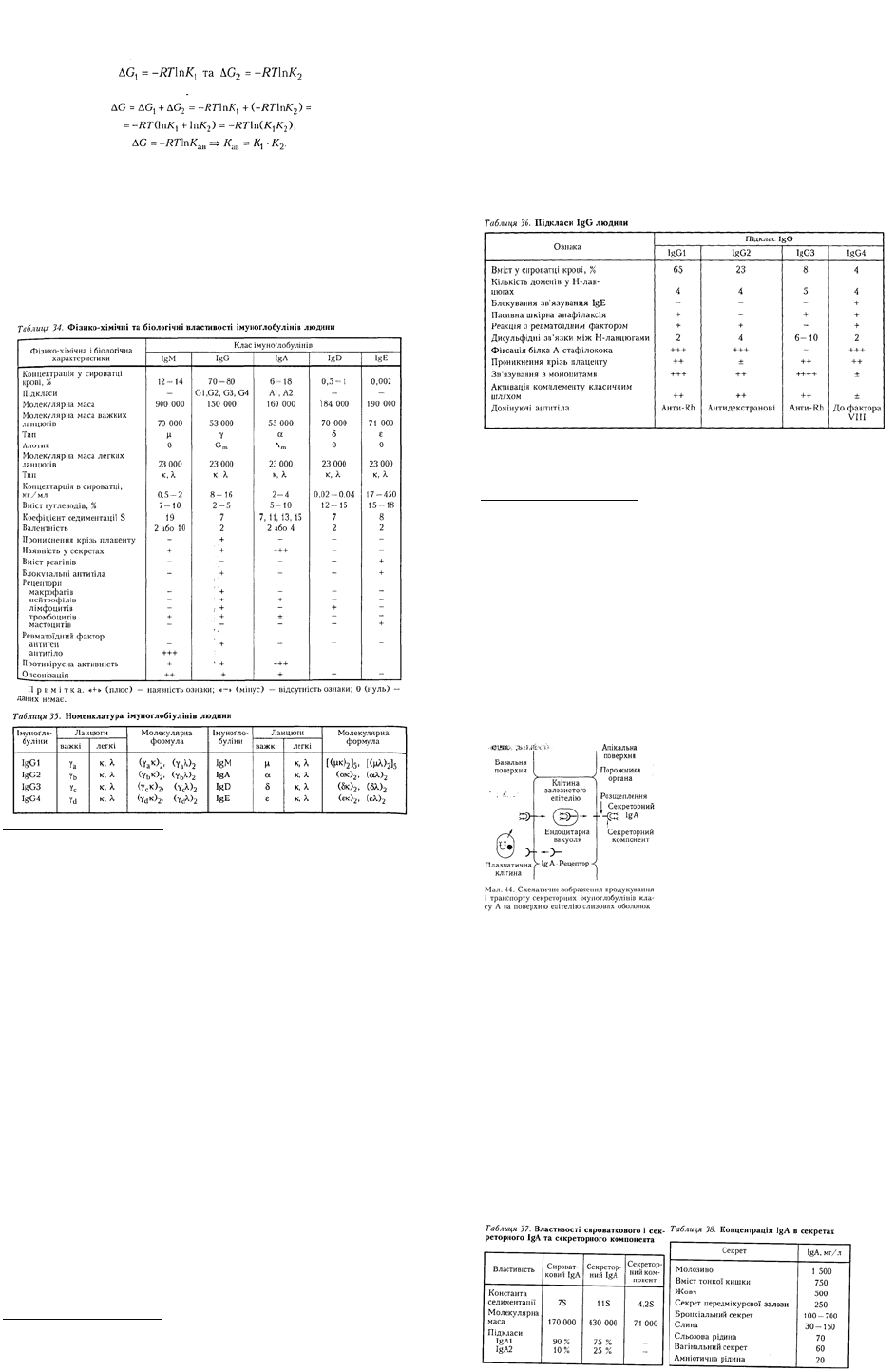
25
Авідність визначається багатьма складними факторами, зокрема гетерогенністю антитіл в імунній
сироватці, специфічних до певної антигенної детермінанти, а також гетерогенністю самих
детермінант. Крім того, полівалентність більшості антигенів призводить до «підсилювального
ефекту»: міцність зв'язку між двома молекулами антигену через молекули антитіл завжди в багато
разів вища, ніж міцність арифметичної суми зв'язків антигенів через кожне антитіло. Зв'язування
двох антитіл з антигенними детермінантами можна схарактеризувати зміною вільної енергії, яка
виникає при формуванні комплексу епітопу й паратопу з відповідними константами афінності:
Якщо зв'язування двох антитіл розглядати як єдиний процес, то константа авідності К
ав
визначатиметься загальною зміною вільної енергії:
Збільшення константи рівноваги, яке виникає через те, що складові афінності не додають, а
перемножують, забезпечує підсилювальний ефект полівалентності. При цьому чим більше
валентностей має антиген, тим менш імовірно, що він вивільниться з комплексу в результаті
дисоціації в якомусь «сайті» зв'язування.
Такі особливості авідності характерні для зв'язування антигенів, що містять повторювані
детермінанти (наприклад, овальбумін, кон'югований з кількома групами ДНФ), для більшості
бактеріальних поліцукридів, для еритроцитів, на поверхні яких містяться численні ідентичні
детермінанти групових антигенів крові. Саме авідність характеризує імунну відповідь in vivo і є
мірою функціональної афінності антисироваток до природних полівалентних антигенів. Висока
авідність має переваги перед низькою для здійснення багатьох імунних реакцій, зокрема елімінації
антигенів, нейтралізації вірусів, захисту від бактерій тощо.
У популяції антитіл, що синтезуються до однієї антигенної детермінанти, знаходяться антитіла
різного ступеня афінності з різною константою асоціації. Остання може змінюватися в широкому
діапазоні. За фізико-хімічною структурою, антигенністю й біологічною функцією імуноглобуліни
тварин поділяють на 3 — 5, а людини — на 5 основних класів: IgM, IgG, IgA, IgD, IgE (табл. 34, 35).
Антитіла однакової специфічності можуть належати до різних класів, разом з тим антитіла, що
належать до одного класу, можуть мати різну специфічність. У здорових людей кількість
імуноґлобулінів одного класу не залежить від кількості імуноґлобулінів інших класів і залишається
досить сталою.
4.6. ІМУНОҐЛОБУЛІНИ КЛАСУ М.
Система IgM — найбільш рання як філогенетично, так і онтогенетично. У плоду і новонародженого
синтезуються переважно IgM. Імунна відповідь на введення багатьох антигенів розпочинається з
продукування IgM (19S), а до деяких антигенів утворюються переважно антитіла класу М. Так,
антитіла до флагеліну сальмонел, які виявляють у сироватці майже 85 % здорових людей, є
переважно IgM. Корпускулярні антигени стимулюють синтез IgM. Імунна відповідь реалізується
швидко, однак імунна пам'ять у клонів клітин, що синтезують IgM, зберігається слабко або її зовсім
немає. Тому синтез IgM при повторному введенні того самого антигену здійснюється за первинним
типом імунної відповіді. Молекулярна маса IgM становить 900 000, константа седиментації — 19S.
Через великі розміри молекули IgM не дифундують у тканини, а перебувають у кров'яному руслі.
С
μ
2-домен — за структурою аналог шарнірної ділянки γ- і α-ланцюгів і, очевидно, є її
попередником. До кожного μ-ланцюга прикріплено по п'ять залишків олігоцукридів: один у С
μ
1-,
три в С
μ
3-ділянках і один у хвостовому залишку. Молекула IgM включає п'ять субодиниць,
сполучених дисульфідними зв'язками між цистеїновими залишками важких ланцюгів. Кожна
субодиниця має молекулярну масу 180 000 і константу седиментації 7S. Полімеризація IgM
відбувається в плазматичних клітинах до їх секреції під впливом полімеризуючого ферменту
сульфгідрилоксидази, що продукується зрілими лімфоцитами. Мономери в молекулі IgM розміщені
радіально: Fc-фраґменти до центра, Fab-фраґменти — назовні. Характер взаємодії IgM з антигеном
залежить від величини і концентрації антигену. Якщо часточок мало, то всі п'ять «ніжок» антитіла,
згинаючись, прикріплюються до однієї часточки антигену і молекула набуває форми круглого столу
або краба. При зв'язуванні кожної субодиниці антитіла з окремою часточкою антигену утворена
структура набуває форми павука з п'ятьма гнучкими «ніжками» різної довжини. На поверхні
еритроцита може адсорбуватися 90 000 молекул IgM і 600 000 молекул IgG.
Молекула IgM має десять активних центрів і здатна зв'язувати десять детермінантних груп, тобто є
десятивалентною. Так, IgM-антитіла до поліцукриду черевнотифозної палички є десятивалентними.
У деяких випадках молекула IgM зв'язує не десять, а лише п'ять детермінантних груп, що, можливо,
пояснюється стеричними перепонами, пов'язаними з великими розмірами приєднаних часточок
антигену. Антитіла класу М мають більш виражені аглютинувальні й літичні властивості.
Мономерні 7S-фраґменти, отримані в результаті м'якої дії ферментів на полімерну молекулу IgM,
втрачають здатність аглютинувати антиген, хоча їх афінність до гаптенів не змінюється, їх
валентність дорівнює 2.
Діючи на молекулу IgM пепсином, трипсином, хімотрипсином, папаїном і речовинами, що
відновлюють дисульфідні зв'язки, отримують фрагменти молекули, а також фрагменти ланцюгів
різних розмірів із різних ділянок. Отримані дані сприяли з'ясуванню молекулярної структури
імуноґлобулінів класу М.
У складі IgM виявлено J-ланцюг, який бере участь у полімеризації IgM. J-ланцюг за антигенними
властивостями відрізняється від інших ланцюгів. Вважають, що, зв'язуючи два 7S-мономери, J-
ланцюг модифікує їхню конформацію так, що вони стають здатними сполучатися нековалентними
зв'язками з іншими мономерами.
За здатністю Fc-фраґмента зв'язувати комплемент розрізняють два підкласи IgM : IgM1 — що
зв'язують і IgM2 — що не зв'язують комплемент. Структурні відмінності субкласів IgM не
встановлено.
Мембраноасоційовані IgM, які є рецепторами для антигену, мають коефіцієнт седиментації 8S і не
об'єднуються в пентамерні комплекси, коефіцієнт седиментації яких 19S. Важкі ланцюги
асоційованого з цитоплазматичною мембраною IgM на С-кінцевій ділянці мають додаткові
структури: пептид з 12 амінокислотних залишків, який зв'язує асоційований з мембраною
гідрофобний поліпептидний ланцюг з 20 амінокислотних залишків і занурений у цитоплазму С-
кінцевий трипептид. Ці структури кодуються додатковими генами. У μ-ланцюгах за Сμ4-доменом і
в α-ланцюгах за Сα3-доменом розміщені додаткові хвостові ділянки. Вони гомологічні за
амінокислотним складом. У μ-ланцюгах до цієї ділянки приєднаний J-ланцюг. Полімеризуються
лише молекули IgM та IgA, що мають у своєму складі хвостові ділянки. В молекулі IgM J-ланцюг,
можливо, зв'язує перший і п'ятий мономери у вигляді застібки.
Мономери IgM фіксують комплемент так само, як і IgG. Однак пентамер фіксує значно більші
кількості комплементу. Пояснюється це тим, що наявнівність у молекулі IgM додаткового домену
С
Н
4, який фіксує комплемент, сприяє швидкій стабілізації молекул комплементу відразу після
прикріплення їх до полімерної молекули IgM.
4.7. ІМУНОҐЛОБУЛІНИ КЛАСУ G.
Наступний, вищий етап гуморальної імунної реактивності — утворення молекул IgG. Цей клас
імуноґлобулінів синтезується впродовж тривалішого часу після антигенного стимулу і зв'язує вже
не лише корпускулярні, а й розчинні антигени. Афінність IgG зростає в тисячі й десятки тисяч разів.
Наявність імунної пам'яті щодо антитіл цього класу дає змогу організму в разі потреби різко
збільшувати продукування їх упродовж короткого періоду часу, тобто вже є можливість зберігати
імунітет тривалий час і забезпечувати вищий його рівень. IgG — основний клас антитіл і становить
у людини близько 70 % усіх імуноґлобулінів. Основна маса антитоксинів і противірусних антитіл
належить до IgG.
Значна кількість IgG синтезується у відповідь на вторинний антигенний стимул. У процесі імунної
відповіді відбувається переключення синтезу IgM на IgG. Переключення з IgM на IgG потрібне і з
метою регулювання рівня продукування специфічних антитіл, оскільки IgM, на відміну від IgG, не
виявляє гальмівного впливу на синтез імуноґлобулінів класу М. Молекулярна структура IgG
подібна до будови мономерів IgM. Молекулярна маса ІgG найменша серед усіх імуноглобулінів і
дорівнює 150 000. IgG термостабільні. Вони витримують нагрівання за температури 75 °С впродовж
30 хв, тоді як IgM при цьому повністю руйнується. У складі ІgG міститься велика кількість
дисульфідних зв'язків, що забезпечує високу стабільність структури. У сироватці крові IgG зберігає
нативну структуру і активність при 0°С протягом багатьох років.
Якщо денатуровані під впливом низького чи високого значення рН або розчину сечовини молекули
IgG помістити в ізотонічний розчин, то нативна структура відновлюється спонтанно. Відбувається
сполучення між собою важких і легких ланцюгів, відновлюються внутрішньоланцюгові дисульфідні
зв'язки. IgG здатні нейтралізувати віруси, токсини, виявляють опсонізувальну дію на бактерії,
зв'язують комплемент, зумовлюють реакцію аглютинації та преципітації in vitro. Нейтралізуюча
здатність IgG, що утворюються на пізніх стадіях імунної відповіді, щодо токсинів у сотні разів
вища, ніж IgM. Важливою властивістю IgG є вища порівняно з IgM активність їх щодо гаптенів.
Серед IgG виявлено чотири підкласи — IgGl, IgG2, IgG3, IgG4, які різняться за структурою важких
ланцюгів (a, b, c, d) та біологічними властивостями (табл. 36). У підкласах γ-ланцюгів понад 90 %
залишків амінокислот однакові. Це свідчить про те, що підкласи IgG еволюціонували від спільного
ланцюга відносно недавно — 20 — 30 млн років тому. Антисироватка до важких γ-ланцюгів дає
перехресні реакції з важкими ланцюгами всіх підкласів IgG, але не реагує з важкими ланцюгами
всіх інших класів. Кількість IgGl у сироватці крові людини становить 70 — 77 %, IgG2 — 23, IgG3 –
8-9, IgG4 – 2-4 % загальної кількості IgG.
В організмі на той самий антиген синтезуються одночасно антитіла різних класів. Однак можливий
також вибірковий синтез антитіл, які належать до певного типу або підкласу поліпептидних
ланцюгів. Антитіла людини проти тейхоєвої кислоти належать до підкласу IgG2, антитіла до
фактора VIII згортання крові — до IgG4, до дифтерійного і правцевого токсинів — IgGl, a холодові
аглютиніни класу IgG переважно містять κ-ланцюги. У добровольців, яких імунізували декстраном,
синтезувалися антитіла лише підкласу IgG2 навіть після тривалої імунізації. Антитіла проти Rh-
антигену належать переважно до підкласу IgGl.
4.8. ІМУНОҐЛОБУЛІНИ КЛАСУ А.
Уперше IgA виділив і описав Л. Хереманс із співробітниками в 1963 р. За структурою розрізняють
три типи імуноглобулінів класу А.
1. Сироваткові IgA, що мають мономерну структуру молекули.
2. Сироваткові димерні IgA, у складі молекули яких є ще додатковий J-ланцюг, спільний для IgM та
IgA.
3. Секреторний IgA, молекули якого складаються зі сполучених між собою за допомогою J-ланцюга
і секреторного фрагмента (S-компонента) кількох (частіше двох) мономерних молекул IgA.
IgA становлять близько 10 — 20 % усіх сироваткових імуноґлобулінів. Молекула IgA складається з
двох легких ланцюгів λ- або κ-типу і двох важких ланцюгів. Молекулярна маса мономерного IgA —
160 000, димерного – 380 000.
Гіпотетична структура секреторного IgA така. Дві молекули мономерного IgA обернені одна до
одної СООН-фрагментами і сполучені між собою за допомогою вставленого між ними J-ланцюга. S-
компонент ніби охоплює кінцеві ділянки ланцюгів Fc-фраґментів, переходячи з однієї молекули на
іншу. Секреторний IgA становить близько 1 % усього сироваткового IgA, але є основною масою
імуноґлобулінів, які виділяються на поверхню слизових оболонок і містяться в слині, кишковому
соку та інших секретах.
Молекулярні формули мономерного, димерного сироваткового і димерного секреторного IgA
відповідно такі: κ(λ) – α – α(λ)κ; [κ(λ) – α – α(λ)κ]
2
+J; [κ(λ) – α – α(λ)κ]
2
+ J +S.
Молекулу IgA, як і молекули імуноґлобулінів інших класів, а також J-ланцюг продукують
плазмоцити, а S-компонент — епітеліальні клітини слизових оболонок. Секреторний компонент
синтезується епітеліальними клітинами як рецепторний мембранний білок, специфічний щодо
комплексу (IgA)
2
. Комплекси секреторного компонента та IgA, що утворилися на внутрішній
поверхні епітеліальної клітини, внаслідок ендоцитозу надходять усередину клітини і рухаються до
поверхневої її мембрани, де секреторний компонент частково руйнується протеолітичними
ферментами. S-компонент — це глікопротеїн з молекулярною масою 71 000. Молекулярна маса J-
ланцюга становить 15 000— 18 000. Він приєднаний до передостаннього напівцистеїнового залишку
важкого ланцюга за допомогою дисульфідних
зв'язків. Однак не з'ясовано, чи з'єднується він з
важкими ланцюгами обох або лише одного
мономера. S-компонент, з'єднуючи два мономери у
Fc-ділянці, стабілізує конформацію молекули і
захищає її від руйнування протеолітичними
ферментами слини й кишок. Резистентність до
папаїну IgA молозива людини зменшується після
вивільнення S-компонента. Сироватковий
мономерний IgA синтезують плазмоцити кісткового
мозку, лімфатичних вузлів і селезінки, димерний
сироватковий IgA — плазмоцити секреторних залоз,
а секреторний IgA — плазмоцити лімфоїдної
тканини слизових оболонок верхніх дихальних
шляхів, сечостатевого апарату і кишок (мал. 44).
Діти народжуються без IgA, оскільки цей
імуноґлобулін, як і IgM, не проникає крізь плаценту.
Завдяки цьому імунологічні конфлікти, що
зумовлюються несумісністю матері й плоду за
еритроцитарними антигенами, трапляються рідше.
Якби крізь плаценту проникали не лише IgG, а й
IgM, то конфлікти при несумісності за АВ0-
антигенами спостерігалися б частіше і відбувалися б тяжче, оскільки антиеритроцитарні IgM мають
високу гемолітичну активність.
Серед IgA за структурними властивостями важких ланцюгів виокремлено два підкласи: IgA1 та
IgA2. У молекулі IgA2 дисульфідних зв'язків між Н- і L-ланцюгами немає, але вони є між L-
ланцюгами.
Автономність секреторної системи IgA. Секреторний IgA міститься в слизовій оболонці носа,
рота, бронхів, кишок, піхви, канальців нирок, сечового міхура, слинних залоз як здорових, так і
хворих на різні захворювання людей. Співвідношення sІgA та імуноґлобулінів інших класів у
секретах становить 3:1...5:1, однак воно може коливатися в значних межах. sІgA має антивірусну
активність за відсутності комплементу і є першим противірусним і протибактеріальним бар'єром.
Ідея О. Безредка (1932) про існування локальної імунної системи обгрунтована під час вивчення
місцевого імунітету слизових оболонок дихального, травного й сечостатевого шляхів. Доведено, що
основним імуноґлобуліном секретів є sІgA, який утворюється в разі місцевої імунізації, хоча в
секретах містяться імуноґлобуліни інших класів. Введений внутрішньовенно антиген не стимулює
синтез секреторних антитіл. Якщо вводити його в порожнину носа, бронхи або кишки,
продукування секреторного імуноґлобуліну спостерігатиметься відповідно лише в носі, бронхах або
кишках. Локалізація імунної відповіді на тій ділянці, де був аплікований відповідний антиген, є
специфічною реакцією секреторної системи імуноґлобулінів. В експериментальних дослідженнях на
кролях з ізольованими петлями кишок було доведено, що при введенні різноманітних мікробних
антигенів у різні петлі синтезуються лише sІgA до того антигену, який було введено в цю петлю.
Важливою особливістю секреторної системи IgA є її незалежність від IgA сироваткової системи.
IgA в сироватці крові може виявлятися в разі відсутності sІgA, і навпаки, за наявності IgA в секретах
його може не бути в сироватці крові. Зареєстровано випадки, коли у хворих в біопсованому
матеріалі тонкої кишки зовсім не виявляли sІgA- та IgA-синтезувальних клітин, однак виявляли IgA
в сироватці крові, що також свідчить про незалежність систем секреторних і сироваткових IgA.
Отже, існують дві відносно незалежні системи IgA — сироваткова і слизових оболонок. Такий
висновок підтверджується клінічними даними. Так, Л. Хереманс спостерігав випадки мієломної
хвороби, коли в сироватці крові виявляли значну кількість IgA, тоді як sІgA у кишках не виявляли.
Однак IgA зі слизових оболонок і секреторних залоз можуть надходити в кров. Зокрема, у собак
вміст IgA в мезентеріальній лімфі у 20 разів вищий, ніж у крові. Після опромінення кишок мишей
вміст IgA в крові кишок знижувався.
Титри як сироваткових, так і sІgA збільшуються при інфекційних захворюваннях слизових
оболонок. Властивості сироваткового і секреторного IgA та концентрацію IgA в секретах наведено в
табл. 37, 38.
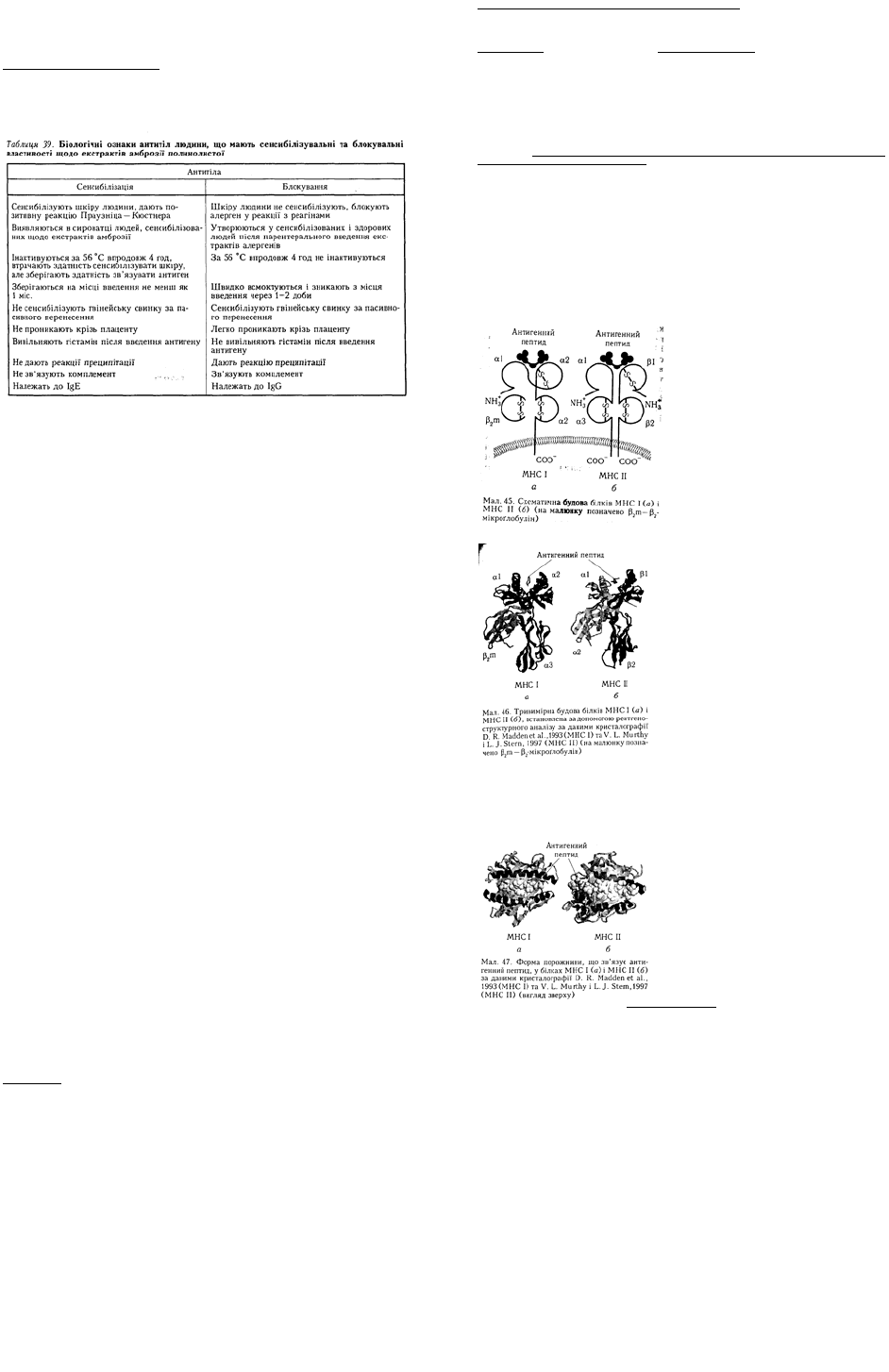
26
Захист слизових оболонок. Резистентність до респіраторних вірусів залежить від титру
секреторних антитіл, які утворюються локально в тій ділянці, крізь яку збудник проникає в
організм, і практично не залежить від титрів сироваткових антитіл. При зараженні імунізованих
добровольців риновірусом ступінь резистентності корелювала з кількістю секреторних, але не
сироваткових антитіл. Аналогічні дані було отримано при імунізації інактивованими культурами
або атенуйованою вакциною респіраторно-синцитіального вірусу, а також живою культурою
мікоплазм пневмонії.
4.9. ІМУНОҐЛОБУЛІНИ КЛАСУ Е.
Початком вивчення імуноґлобуліну Е є класичні досліди К. Праузніца і Г. Кюстнера (1921) з
перенесення негайної гіперчутливості введенням сироватки крові хворих на атонічне захворювання
здоровим реципієнтам, що дало змогу достовірніше виявляти антиген, який сенсибілізує організм.
Цей метод упродовж багатьох років застосовують як діагностичний тест при полінозах. Здоровому
реципієнту внутрішньошкірно вводять сироватку хворого, а через добу в цю саму ділянку вводять
алерген (табл. 39). У позитивних випадках на шкірі одразу видно специфічну реакцію, зумовлену
наявністю в сироватці антитіл, які називають реагінами.
Синтез IgE відбувається переважно в лімфоїдній тканині шкіри, дихальних шляхів, кишок і
лімфатичних вузлах, які їх дренують.
IgE є глікопротеїном з молекулярною масою 190 000. Молекулярна маса важкого ланцюга становить
71 000. Від імуноґлобулінів інших класів він відрізняється більшим вмістом поліцукридів,
спричинює реакцію Праузніца —Кюстнера у людини та реакцію анафілаксії шкіри у мавп, не фіксує
комплемент. Fc-Фраґмент IgE має вдвічі більшу молекулярну масу порівняно з Fc-фраґментом IgG -
100 000. Зумовлюється це тим, що Fc-фраґмент IgE приблизно на 100 амінокислотних залишків
довший, тобто містить додатковий четвертий С
н
-домен. Ця особливість є однією з причин
своєрідності біологічних властивостей IgE, оскільки він фіксується на мастоцитах за допомогою Fc-
фрагмента. Fс-фраґмент IgE блокує пасивну сенсибілізацію реагінами. Однак ця властивість
втрачається, якщо сироватку прогріти за температури 56 °С. Проте активний центр антитіл при
цьому не пошкоджується, і вони зберігають здатність реагувати зі специфічним антигеном.
IgE зв'язується з рецепторами тканинних базофілів. Наступне зв'язування адсорбованими
антитілами антигену супроводжується виділенням мастоцитами гістаміну, який підвищує
проникність судин, що сприяє виникненню місцевої запальної реакції, видаленню з організму
імунних комплексів та антигену.
IgE, зв'язуючись за допомогою Fc-фраґментів з рецепторами мастоцитів, зумовлюють фіксацію
реагінів у тканинах. До Fab-фраґментів фіксованих реагінів приєднуються алергени, які проникають
в організм, що зумовлює вивільнення мастоцитами біологічно активних речовин, які запускають
алергічні реакції. До рецепторів клітин для Fc-фраґментів IgE можуть приєднуватися IgE, агреговані
антигеном. Зв'язування IgE з мастоцитами здійснюється структурою, розміщеною в домені Сε3, а
саме в амінокислотній послідовності 320 — 324. Цей фрагмент в ізольованому стані блокує
фіксацію IgE тканинними базофілами. Він чутливий до термічних впливів і денатурується при 56°С.
Ділянка зв'язування IgE мастоцитами розміщена в доменах Сε2 і Сε3. Кількість базофілів і
мастоцитів, які зв'язують IgE, збільшується при алергічних захворюваннях та при глистних інвазіях
у тварин і людини.
При алергічній реакції мастоцити пошкоджуються комплексом антиген — антитіло і виділяють
гранули, які містять біологічно активні речовини. Пошкодження мембран обмежене ділянкою, де
сформувалися комплекси антиген — антитіло. При цьому функція клітини зберігається і вона не
гине, тобто під дією комплексу антиген — антитіло клітина не руйнується, а настає активація її
функції. Розвиток алергічної реакції негайного типу можна перервати пригніченням функції
мастоцитів.
Рівень IgE у здорових людей коливається в значних межах — від повної відсутності до значного
підвищення порівняно з середніми показниками. Концентрація IgE підвищується до періоду
статевої зрілості, а потім поступово знижується. У сироватці здорової людини міститься 0,0002 г/л
IgE. Підвищення рівня IgE в сироватці крові спостерігається при бронхіальній астмі, екземі,
контактному дерматиті, полінозах, а також у сироватці хворих у початковий період
десенсибілізувальної терапії.
Клітини, що синтезують IgE, у приматів у найбільшій кількості містяться в лімфоїдній тканині
травного каналу й дихальних шляхів: піднебінних мигдаликах, аденоїдах, лімфатичних вузлах
грудної й черевної порожнин, у слизовій оболонці носа, стравоходу і бронхів, їх відносно мало в
селезінці та підшкірних скупченнях лімфоїдних клітин.
Вважають, що основна роль IgE — захист слизових оболонок унаслідок індукції місцевої запальної
реакції. Мастоцити, фіксовані в тканинах, виділяють медіатори, які приваблюють фагоцити. Це
зумовлює виникнення запальної реакції. Таким чином IgE готують мастоцити і базофіли до участі в
алергічних реакціях. Можливо, IgE і мастоцити захищають організм від гельмінтів, оскільки
медіатори, що вивільнюються під час алергічних реакцій, приваблюють навантажені IgE
еозинофіли, які здатні уражувати паразитів. Генетичні лінії мишей різняться між собою здатністю
синтезувати реагіни, що свідчить про роль антитіл цього класу в адаптації ізолятів. Є дані про те, що
IgE беруть участь у відторгненні пухлин.
4.10. ІМУНОҐЛОБУЛІНИ КЛАСУ D.
Концентрація IgD у сироватці крові не постійна і зазвичай не перевищує 1 %. Молекулярна маса IgD
становить 184 000, константа седиментації — 7S. Молекулярна маса важкого ланцюга — 70 000.
Молекула IgD, як і молекули імуноґлобулінів інших класів, складається з двох легких і двох важких
поліпептидних ланцюгів, сполучених дисульфідними містками. У людини в δ-ланцюгах міститься
шарнірна ділянка між СδІ- та Сδ2-доменами, вона має 64 залишки амінокислот. Сегмент шарніра
багатий на вуглеводи, завдяки чому стійкий до перетравлювання протеолітичними ферментами.
Локалізація вуглеводів не характерна, що може мати значення для прояву біологічних функцій IgD.
Вміст вуглеводів у молекулі IgD становить 12—15 %. На відміну від імуноґлобулінів інших класів
вони містять N-ацетилгалактозамін. Лише близько 9 % молекул IgD містять κ-ланцюги, тоді як у
всіх інших класів імуноґлобулінів людини більший відсоток легких ланцюгів належить до κ-типу.
IgD комплемент не фіксує.
У відносно більшій кількості IgD міститься в судинах, ніж екстраваскулярно, що пояснюється,
очевидно, низьким коефіцієнтом дифузії. У 100 % здорових людей IgD не виявляється, тоді як в
окремих особин їх вміст може досягати 0,4 г/л при нормі 0,01—0,02 г/л. Концентрація IgD зростає у
вагітних та під час приймання оральних протизаплідних препаратів. Клітини, що синтезують IgD у
великій кількості, виявляються в слизовій оболонці товстої кишки при колітах. Однак роль IgD
остаточно ще не з'ясовано. Рівень IgD підвищується при мієломній хворобі та хронічних запальних
процесах. Швидкість синтезу IgD при мієломній хворобі може підвищуватися в сотні разів. Серед
IgD виявляються й антинуклеарні антитіла проти тканин щитоподібної залози. З цього можна
зробити висновок, що вони можуть бути причетними до розвитку аутоімунних процесів.
Імуноґлобулінові рецептори для антигену на зрілих В-клітинах містять переважно IgD. На
лімфоцитах в онтогенезі IgD з'являються значно пізніше за інші імуноґлобуліни. Це дало змогу
припустити, що зв'язування антигену рецепторами IgD лімфоїдних клітин перешкоджає
виникненню толерантності. Рецептори IgD для антигену не відрізняються від відповідних антитіл у
сироватці крові. В 90 % клітин дорослих мишей виявлено одночасно імуноґлобуліни класів М і D
тієї самої специфічності. За наявності цих рецепторів клітина може переключатися на синтез
антитіл інших ізотипів.
ВИСНОВКИ.
Антитіла — глікозильовані білки — гаммаглобуліни, які здатні специфічно з'єднуватися з
антигенами та виконувати ряд ефекторних функцій: фіксацію комплементу, опсонізувальний вплив
та рецепторну і цитотоксичну дії тощо. Мономерні молекули імуноґлобулінів складаються з 4
поліпептидних ланцюгів (2 важких та 2 легких), кожний з яких має варіабельну ділянку в N-кінцевій
частині та константну — в С-кінцевій частині молекули. В організації доменної структури
поліпептидних ланцюгів та їх взаємодії під час складання молекул імуноґлобулінів вирішальну роль
відіграють відповідно внутрішньоланцюгові та міжланцюгові дисульфідні зв'язки. Варіабельні
домени, організовані варіабельними ділянками важких і легких ланцюгів, організовують активний
центр — рецепторну зону молекули антитіла, в якій відбувається зв'язування з антигенною
детермінантою. Порожнина активного центру (паратоп) утворена гіперваріабельними ділянками
важкого і легкого ланцюгів, у якій і відбувається специфічна взаємодія з антигенною детермінантою
(епітопом) завдяки силам міжмолекулярного притягання. Антитіла, що утворюються у відповідь на
проникнення антигенів, гетерогенні за антигензв'язувальними центрами, афінністю до окремого
епітопу, що зумовлено гетерогенністю антитілосинтезувальних клонів В-лімфоцитів. Динаміка
синтезу антитіл залежить від особливостей і доз антигенів, шляхів їх потрапляння в організм та
генетичних особливостей і стану імунореактивності реципієнта. Проліферація і диференціювання
лімфоїдних клітин, що спостерігається у відповідь на антигенний стимул, потрібні для збільшення
клітин клону В-лімфоцитів, преадаптованого до цього антигену, перетворення їх на плазмоцити, які
продукують специфічні антитіла, та на клітини імунної пам'яті. За фізико-хімічною структурою,
антигенністю й біологічними функціями імуноґлобуліни людини поділяють на п'ять класів: IgG,
IgM, IgA, IgE, IgD. Антитіла однакової специфічності можуть належати до різних класів, а антитіла,
що належать до одного класу, можуть мати різну специфічність.
Контрольні запитання
1. Які білки належать до імуноґлобулінів?
2. Які основні методи використовують для дослідження структури антитіл?
3. Які основні фізико-хімічні параметри та біологічні властивості фрагментів молекули
імуноґлобулінів, отриманих під час розщеплення нативної молекули різними ферментами?
4. Яку будову мають константні та варіабельні фрагменти молекули антитіла?
5. Що стабілізує структуру молекули антитіла?
6. Що є основою антигенної різноманітності молекул антитіл?
7. Де і як синтезуються молекули антитіл?
8. Що таке афінність та звідність антитіл?
9. Які характерні особливості молекул антитіл різних класів?
РОЗДІЛ 5. ГОЛОВНИЙ КОМПЛЕКС ГІСТОСУМІСНОСТІ.
Головний комплекс гістосумісності МНС (від англ. Major histocompatibility complex) був
ідентифікований як система генів, що контролюють синтез антигенів, які визначають несумісність
клітин, тканин і органів при трансплантації. Відповідно глікопротеїнові молекули, які розміщені на
поверхні мембран клітин та індукують реакції відторгнення трансплантатів, називають антигенами
гістосумісності, а гени, що їх кодують, — генами гістосумісності. З урахуванням їхньої ролі при
трансплантаціях ці антигени і відповідні їм гени описані, особливо в ранній літературі, як
трансплантаційні.
Комплекс МНС представлений значною кількістю генів гістосумісності і має розмір приблизно 4
млн пар нуклеотидів. Головну систему гістосумісності мишей називають системою Н-2 (від англ.
Histocompatibility), а у людини — системою HLA (від англ. Human leukocyte antigens). МНС є
основною генетичною системою, що визначає функціонування імунної системи, насамперед
системи клітинного імунітету.
Хоча історично антигени гістосумісності були ідентифіковані саме за здатністю індукувати
відторгнення трансплантата, виявилось, що вони виконують в організмі важливі імунобіологічні
функції. Молекули МНС є поверхневими маркерами «свого», які розпізнаються Т-кілерами і Т-
хелперами на поверхні мембран інших клітин у комплексі з чужорідними антигенами (антигенними
пептидами). Отже, основною, первинною функцією антигенів гістосумісності є презентація
антигенів для розпізнавання Т-клітинами. Завдяки цьому МНС кодує здатність розпізнавати «своє»
і «чуже», відторгати уражені вірусами або перероджені клітини, відповідати на Т-залежні антигени
тощо. Крім того, МНС визначає генетично зумовлений ступінь прояву спадкових хвороб і
схильність до інфекційних захворювань.
Продукти генів МНС поділяють на три класи. Власне функцію презентації антигенів виконують
молекули МНС класів І і II (далі МНС І та МНС II). Крім того, саме ці молекули беруть участь в
індукуванні реакцій відторгнення трансплантантів. Однак виявилось, що в середині локусу генів
гістосумісності знаходяться й інші гени, продукти яких не беруть безпосередньої участі у
презентації антигенів. Історично такі гени було віднесено до генів МНС класу III, проте слід
підкреслити, що їхні продукти відрізняються один від одного і від МНС І та МНС II за будовою і
можуть виконувати зовсім інші функції, не пов'язані з імунним розпізнаванням.
5.1. БУДОВА МОЛЕКУЛ МНС I I MHC II.
Продукти генів МНС класів І і II мають деякі спільні особливості, що визначаються їхніми
функціями. По-перше, вони складаються з двох субодиниць, тобто є гетеродимерами. На мембрані
клітин вони представлені тільки в «зібраному» вигляді. По-друге, антигени гістосумісності мають
активний центр — місце зв'язування антигенного пептиду. Антигенний пептид власне і є продуктом
обробки антигенної інформації, що подається для розпізнавання Т-клітинам (див. розд. 7). Деталі
структурної організації МНС І та МНС II дещо різняться.
Будова молекул МНС І. Антигени МНС І — це комплекси, що складаються з важкого α-ланцюга
(43 кД) і β
2
-мікроґлобуліну (11 кД). Важкий α-
ланцюг перетинає мембрану, а β
2
-мікроґлобулін
розміщений тільки в позаклітинній частині МНС
(мал. 45, а). Внутрішньоклітинна С-кінцева
ділянка α-ланцюга дуже невелика (не більше як 30
амінокислотних залишків). Позаклітинна частина
α-ланцюга складається з трьох доменів — α1, α2 і
α3, з яких другий і третій мають дисульфідні
зв'язки. Домени α1 і α2 утворюють порожнину,
що зв'язує антигенний пептид. До аспарагінів 86 і
176 домену α3 приєднані олігоцукридні
компоненти. β
2
-мікроґлобулін представлений
лише одним доменом, що містить дисульфідний
зв'язок, і нековалентно приєднується до домену
α3. Вважають, що β
2
-мікроґлобулін стабілізує
просторову структуру антигенів МНС І, сприяє
транспорту молекул до комплексу Гольджі, а
потім до поверхні клітини. Домен α3 і β
2
-
мікроглобулін за будовою дуже подібні до
константних імуноґлобулінових доменів. Вони є
дуже консервативними, тоді як домени α1 і α2 є
варіабельними і мають будову, що відрізняється
від будови імуноґлобулінових доменів (мал. 46,
а).
Будова молекул МНС II. Продукти генів МНС II теж є гетеродимерами і складаються з ланцюга α
(34 кД), який містить два домени — α1 і α2, та
ланцюга β (28 кД), який відповідно містить два
домени β1 і β2. Кожний ланцюг перетинає мембрану
і має невеликий цитоплазматичний С-кінцевий хвіст
(мал. 45, б). Домени α2 і β2, розміщені ближче до
мембрани, є консервативними і належать до
імуноґлобулінової суперродини, а домени α1 і β1 є
варіабельними і утворюють місце зв'язування
антигенного пептиду (мал. 46, б).
Отже, незважаючи на відмінності в субодиничній
будові МНС І та МНС II, тривимірна структура
антигенів гістосумісності обох класів дуже подібна.
Антигени МНС складаються з 4 доменів, два з яких
належать до імуноґлобулінової суперродини,
характеризуються високою консервативністю і
розміщені біля мембрани клітини. Консервативність
примембранних доменів МНС має велике значення
для взаємодії з Т-клітинами, оскільки існують
високоспоріднені до цих доменів структури — так
звані корецептори Т-клітин CD4 і CD8. Взаємодія
константних доменів МНС з корецепторами Т-клітин
(МНС І з CD8 Т-кілерів, а МНС II — з CD4 Т-
хелперів) є однією з важливих функцій антигенів
гістосумісності. Вона підвищує надійність
розпізнавання клітин — партнерів по взаємодії з Т-
лімфоцитами, сприяє активації останніх і реалізації
ними властивих їм ефекторних функцій (див. розд. 11). Два інших, дистантних домени, мають
будову, що принципово відрізняється від будови імуноґлобулінових доменів. Вони утворюють сайт
зв'язування антигенного пептиду — пептидзв'язувальну порожнину. Ця частина молекул МНС
характеризується найбільшою варіабельністю, тобто серед усіх відомих алелів МНС найбільше
амінокислотних замін спостерігається саме в цій ділянці.
Особливості будови антигензв'язувальної порожнини МНС. Найістотніші відмінності між МНС
І та МНС II спостерігаються в структурі місць зв'язування антигенного пептиду. Характерними
ознаками варіабельних доменів МНС є наявність α-
спіралей, якими вони оточують пептидзв'язувальну
порожнину (мал. 47). Кожний варіабельний домен
має дві α-спіралі: одну коротшу (5 — 10 залишків) і
другу довшу (40 — 50 залишків), сполучені під кутом
110—130°. Антигенний пептид зв'язується з
порожниною між варіабельними доменами за
допомогою водневих, гідрофобних, електростатичних
та інших нековалентних взаємодій. Саме залишки, що
входять до складу цієї порожнини, і є найбільш
варіабельними, оскільки біологічною функцією МНС
є представлення якомога більшої кількості різних
пептидів.
Порожнина для зв'язування пептиду в молекулі МНС
І є стабільною, щільною і зімкненою з боків, тому що
вона утворена доменами одного поліпептидного
ланцюга. Зв'язаний з МНС І пептид цілком
розміщується в порожнині, а його N- та С-кінцеві
залишки не виходять за краї порожнини і утворюють
найміцніші зв'язки саме з краями цієї порожнини. Ці
амінокислотні залишки назвали якірними залишками, оскільки, як вважають, вони ніби
«заякорюють» пептид у порожнині молекули МНС І, завдяки чому відіграють важливу роль в
утворенні комплексу пептид — МНС. Довжина пептиду, що зв'язується в порожнині МНС І, не
перевищує 10 амінокислотних залишків, а якірні залишки знаходяться, як правило, на кінцях
пептиду.
Порожнина молекули МНС II для зв'язування пептиду, навпаки, є менш щільною, незамкненою,
оскільки вона утворена варіабельними доменами двох різних поліпептидних ланцюгів. Тому краї
такої порожнини відкриті, а зв'язаний пептид може виходити за її межі. Це і пояснює той факт, що
зв'язані з МНС II пептиди завжди довші, ніж пептиди, зв'язані з MHC І. Теоретично довжина таких
пептидів може бути будь-якою, однак розрахунки ентальпії зв'язування показали, що
найстабільнішими є комплекси МНС II з пептидом, що складається з 12—17 амінокислотних
залишків. Молекула МНС II утримує пептид у порожнині завдяки взаємодії з якірними
амінокислотними залишками, які знаходяться не на кінцях, а в середині пептиду.
Особливості структури антигенних пептидів. Антигенні пептиди, що зв'язуються з МНС,
утворюються внаслідок обмеженого протеолізу нативних білків. Які ж ознаки повинні мати
продукти такого протеолізу, щоб стати антигенними пептидами і зв'язатись з МНС? Відповідь на це
запитання вдалося отримати під час аналізу амінокислотної послідовності антигенних пептидів,
виділених за допомогою методів кислотної елюції з порожнини МНС. Виявилося, що з МНС одного
алельного варіанта може зв'язуватись велика кількість варіантів різних антигенних пептидів, однак
усі вони мають певні спільні ознаки будови. Так, пептиди, що зв'язуються з МНС І, мають довжину
8—10 амінокислотних залишків, а пептиди, що входять до складу комплексів з МНС II, є дещо
довшими: 12 — 17, а іноді навіть до 25 амінокислотних залишків. Більше того, пептиди, які були
отримані при дисоціації комплексу з МНС І або МНС II певного алельного варіанта, мають однакові
чи дуже подібні якірні амінокислотні залишки, розміщені в певних позиціях амінокислотної
послідовності. Які саме амінокислотні залишки є якірними, залежить від конкретного алеля МНС.
Пептиди, що зв'язуються з МНС І, як правило, мають 2 —3 якірних залишки, причому один із них
майже завжди є гідрофобним або позитивно зарядженим і знаходиться на С-кінці пептиду.
Наприклад, усі пептиди, що зв'язуються з певним алелем МНС І, мають консервативні залишки
лейцину в 3-й позиції та залишки аргініну—у 8-й, а для іншого алеля МНС І усі пептиди, що можуть
з ним зв'язатися, мають залишки тирозину в 2-й позиції та лізину — в 9-й (мал. 48, а).
Якірні залишки для антигенних пептидів, що зв'язуються з МНС II, тривалий час не вдавалося
знайти. Це пояснюється тим, що пептиди, які зв'язуються з МНС II одного алеля, можуть значно
відрізнятися за довжиною. Однак якщо комплекс МНС II з пептидом попередньо обробити
екзопептидазами, які здатні відщеплювати вільні амінокислотні залишки з обох кінців зв'язаних
пептидів, то потім методом кислотної елюції можна отримати антигенні пептиди однакової довжини
(близько 9 амінокислотних залишків), які відповідають мінімальній послідовності, що здатна
зв'язатися з МНС II. Такі мінімальні пептиди мають чітко визначені позиції якірних залишків, як
правило, у 1-му, 4-, 6- та 9-му положеннях. Якщо визначити положення цих якірних залишків у
складі довших пептидів, то виявляється, що вони знаходяться в середині цих пептидів (див. мал. 48,
б). Отже, пептиди, що зв'язуються з МНС II, на відміну від пептидів, що зв'язуються з МНС І, мають
вільні кінці, які виходять назовні. Це було також підтверджено за допомогою рентгеноструктурного
аналізу комплексів МНС з антигенним пептидом (див. мал. 47).
27
За даними рентгеноструктурного аналізу позаклітинних частин МНС, у порожнині МНС пептид
перебуває у витягнутій конформації, яка нагадує конформацію, характерну для полі-L-проліну (хоча
залишки проліну можуть взагалі не входити до складу антигенних пептидів). Ознаками такої
конформації є те, що на кожний виток спіралі пептиду припадають 3 амінокислотних залишки. Така
конформація здається дуже доцільною, оскільки забезпечує можливість кожному з трьох сусідніх
амінокислотних залишків, що припадають на один виток спіралі, взаємодіяти з різними
структурами.
Із даних аналізу комплексів МНС з пептидами випливає важливий висновок, що частина залишків у
молекулі пептиду не залучена до взаємодії з МНС, а отже, потенційно здатна до взаємодії з ТкР. Які
саме залишки взаємодіятимуть з МНС, залежить від конкретного алельного варіанта МНС.
Імуногенність білкового антигену для певного організму залежить від наявності необхідних алелів
МНС, здатних зв'язати антигенні пептиди цього білка. До речі, вже є комп'ютерні програми, які
дають змогу передбачати імуногенність білків за їх амінокислотною послідовністю, враховуючи
вибірковість зв'язування різних пептидів конкретними алелями МНС людини (наприклад, в
Інтернеті на сайті http://bimas.dcrt.nih.gov/molbio/hla_bind/ можна ознайомитись з подібною
програмою «HLA Peptide Binding Predictions»).
Із кожним алелем МНС можуть зв'язатися лише певні антигенні пептиди, проте сумарна кількість
пептидів, які можуть бути представлені з одним варіантом МНС, дуже велика. За допомогою
комбінаторики можна підрахувати, що сумарна кількість пептидів, які можуть зв'язатися з одним
алелем МНС І за умови, що пептид складається з 9 амінокислотних залишків і що можна міняти всі
залишки, крім двох якірних, становитиме 20
7
•2
2
=4•10
10
варіантів. Отже, кожний алель МНС І може
специфічно і з високою афінністю зв'язуватися з широким спектром пептидів, які мають 2 — 3
однакових амінокислотних залишки на певних позиціях. Якщо врахувати те, що в кожному геномі
антигени МНС представлені багатьма генами, то стає зрозумілим, що на поверхні клітини може
з'явитися багато варіантів молекул гістосумісності. Очікується, що кожна окрема клітина може
представити понад 10 різних антигенних пептидів. Цього достатньо, щоб представити більшість
можливих білкових антигенів.
5.2. ФУНКЦІЇ АНТИГЕНІВ ГІСТОСУМІСНОСТІ.
Як видно зі структури антигенів гістосумісності класів І і II, головною їх функцією є зв'язування
антигенних пептидів. Антигенні пептиди — це фрагменти тих білкових антигенів, для розвитку
імунної відповіді на які потрібна участь Т-клітин. По суті, антигенні пептиди являють собою
епітопи Т-залежних антигенів. Для того щоб рецептори Т-клітини могли розпізнати антиген, Т-
епітопи цього антигену мають бути представлені належним чином на поверхні АПК. Саме цю
функцію презентації антигенних пептидів і виконують молекули МНС. Відомо, що Т-клітини можна
поділити на дві великі субпопуляції: Т-хелпери і Т-кілери (ЦТЛ). Виявилося, що для представлення
антигенів різним субпопуляціям Т-клітин потрібні різні молекули МНС. Таким чином, різні класи
антигенів гістосумісності мають дещо різну функціональну спеціалізацію. Порівняльну
характеристику МНС І і II класів наведено в табл. 40.
Функції антигенів гістосумісності класу І. Антигени МНС І кодуються генами локусів Н-2К і H-
2D/L комплексу Н-2 миші та генами локусів HLA-A, HLA-B і HLA-C комплексу HLA людини. Ці
гени контролюють експресію SD-антигенів (seroloqical determination) гістосумісності, які
визначаються серологічними методами. Антигени гістосумісності МНС класу І з'являються на
клітинах відразу після імплантації зиготи в стінці матки. Продукти генів МНС класу І містяться
практично на поверхні всіх типів клітин, за винятком клітин трофобласта та еритроцитів. Щільність
молекул МНС класу І на поверхні лімфоцитів становить близько 10
5
молекул на клітину, що
відповідає приблизно 1 % клітинної поверхні. Проте експресію цих молекул можна підвищити дією
інтерферонів.
Для молекул МНС І характерний консерватизм у структурному відношенні, вони мало змінилися в
процесі філогенезу і мають великий набір алелів у будь-якого виду тварин, що свідчить про їхню
важливу біологічну роль.
Показано, що гени МНС І відповідають за індукцію цитотоксичних Т-клітин та їхню функціональну
активність. Антигени МНС І, що синтезуються під контролем цих генів, здатні індукувати сильні
імунні реакції на алотрансплантати у реципієнтів. Крім того, вони індукують Т-клітинну імунну
відповідь проти власних клітин, що інфіковані вірусами або злоякісно трансформовані.
Антигени гістосумісності І класу представляють антигенні пептиди для розпізнавання Т-кілерами.
Тому функція цих молекул тісно пов 'язана з функцією цитотоксичних лімфоцитів. Як відомо, Т-
кілери захищають організм від власних клітин, які можуть становити небезпеку для організму,
тобто клітин, у яких виникли зміни в геномі внаслідок мутацій або вірусної інфекції. Для «контролю
за якістю» клітин існують молекули МНС класу І. Вони експресуються на поверхні майже всіх
клітин організму, за винятком тих, що не можуть ділитися. В нормі ці молекули є «знаком якості»
для здорових клітин і можуть стати «маркерами смерті» для клітин з порушеннями метаболізму.
МНС І можуть представляти як фрагменти власних внутрішньоклітинних білків, так і фрагменти
чужорідних білків внутрішньоклітинних патогенів (див. розд. 6). З МНС І, що представляють
чужорідні антигенні пептиди, взаємодіють рецептори Т-кілерів. У разі приєднання до антигенів
МНС І антигенного пептиду вірусного чи будь-якого чужорідного походження на поверхні клітини
з'являється комплекс МНС — пептид. Цей комплекс розпізнають Т-кілери, а клітини, що містять
цей комплекс, стають клітинами-мішенями, які можуть знищуватися Т-кілерами. Реакція Т-кілерів
рестриктується (обмежується) антигенами гістосумісності, тобто рецептор Т-кілерів розпізнає
чужорідні пептиди лише разом з власними молекулами МНС І.
Клітини, що несуть молекули гістосумісності з чужорідними антигенними пептидами, будуть
знищені активованими Т-кілерами шляхом індукції у мішеней апоптозу або цитолізу. Отже,
молекули МНС І потрібні для того, щоб активовані Т-кілери могли виявляти свої клітини-мішені.
Крім того, МНС І необхідні для активації наївних Т-кілерів. Функцію активації наївних Т-кілерів
виконують головним чином дендритні клітини та активовані макрофаги, в яких підвищена експресія
молекул МНС І. Самі уражені клітини не можуть активувати наївні ЦТЛ.
Існує ще одна цікава функція молекул МНС І — гальмування активності натуральних кілерів. Ця
функція притаманна в основному некласичним молекулам МНС І, таким як HLA-E та HLA-G (див.
далі). З молекулами МНС І взаємодіє гальмівний рецептор KIR цих клітин (див. розд. 2). Підвищена
експресія генів HLA-E та HLA-G спостерігається на клітинах трофобласта і плаценти, завдяки чому
ці клітини захищені від натуральних кілерів.
Отже, головною функцією МНС І є забезпечення за потреби контакту між цитотоксичними
лімфоцитами та всіма клітинами організму.
Функція антигенів гістосумісності класу II. Антигени МНС II кодуються генами, які в системі Н-
2 представлені локусами 1-А та 1-Е, а в системі HLА – локусами DR, DP і DQ. Продукти генів МНС
класу II опосередковують кооперативну взаємодію Т- і В-лімфоцитів, а також Т-лімфоцитів і
макрофагів відповідно в процесах синтезу антитіл і активації фагоцитозу. Ці антигени регулюють
імунну відповідь і тому відіграють важливу роль у реакціях відторгнення трансплантата. Антигени
МНС II також поліморфні, тобто існують у кількох алельних формах. Додатково різноманіття
створюється комбінуванням в одній молекулі α- і β-ланцюгів — продуктів батьківських і
материнських генів.
Молекули МНС II мають значення переважно для регуляції імунних реакцій і слугують для
презентації антигенних пептидів рецепторам Т-хелперів. Отже, функція антигенів гістосумісності
класу ІІ тісно пов'язана з функцією Т-хелперів. Молекули МНС II експресуються тільки
спеціалізованою групою клітин — антигенпрезентувальними клітинами (АПК): макрофагами,
дендритними клітинами та В-клітинами. Антигенні пептиди, що зв'язуються з МНС II, походять з
антигенів, які були поглинуті АПК. На мембрані кожної субпопуляції АПК експресується лише
частина набору антигенів МНС II даної особини. Білки, які кодуються різними частинами ділянки
МНС II, виконують різні функції, однак досі ще не з'ясовано, у чому полягає функціональна
відмінність між антигенами І-А та І-Е або антигенами HLA-DQ, HLA-DR та HLA-DP. Очевидно,
головна функція антигенів МНС ІІ – презентація Т-залежних антигенів Т-лімфоцитам. У разі
блокування антигенів класу II імунна відповідь на тимусзалежні антигени не «запускається».
Важливо, що чужорідні антигенні пептиди не можуть бути специфічно розпізнаними в комплексі з
чужорідними молекулами МНС класу II. Так, стимульовані in vivo Т-клітини відповідають in vitro на
антиген лише тоді, коли його представляють АПК, які мають молекули МНС того самого типу, що й
донор Т-клітин. Це явище називають рестрикцією клітинної взаємодії за антигенами гістосумісності
(див. розд. 7). Антигенам МНС класу II належить вирішальна роль на всіх етапах функціонування
імунної системи. МНС II необхідні для активації АПК активованими Т-хелперами. Наслідком
активації макрофагів є підсилення фагоцитозу, В-клітин — антитілогенез, дендритних клітин —
підвищення здатності їх активувати наївні ЦТЛ. Таким чином, від МНС II залежить функціонування
всіх ефекторних ланок імунної відповіді. Крім того, молекули МНС II необхідні для активації
наївних Т-хелперів активованими АПК, тобто для індукції імунної відповіді на Т-залежні антигени.
Таким чином, основним носієм МНС II є В-клітини, макрофаги та макрофагоподібні (дендритні)
клітини. Цікаво, що на поверхні деяких Т-лімфоцитів людини після активації починають
експресуватися молекули МНС II. Функціональне значення такої експресії невідоме. На Т-клітинах
мишей антигенів МНС II взагалі не виявлено. У незначній кількості МНС II містяться на клітинах
епітелію слизових оболонок та ендотелії судин, а також на фібробластах, кератиноцитах та деяких
гранулоцитах, а саме мастоцитах. Однак роль експресії МНС II на клітинах цих типів остаточно ще
не з'ясовано. γ-інтерферон підвищує вміст антигенів МНС II на клітинах різних типів, навіть тих, що
не належать до класичних АПК.
Цікаво, що серед СD4Т-клітин знайдено невелику субпопуляцію, яка має кілерну активність. Тому,
можливо, у деяких випадках молекули МНС II, аналогічно МНС І, можуть бути «маркером смерті»
для клітин, що їх представляють.
Різноманітність проявів дії антигенів МНС класу II ілюструють дані про вплив антисироваток до
МНС II на імунокомпетентні клітини та імунну відповідь. Антисироватка проти МНС II інгібує in
vitro імунну відповідь на ксеногенні еритроцити, проліферацію Т-лімфоцитів, індуковану антигеном
активацію В-клітин, Т-хелперів. Антисироватка до антигенів МНС II елімінує за наявності
комплементу майже всі В- і А-клітини. Отже, антигени МНС II беруть участь у реалізації функції
імунного розпізнавання та в міжклітинній взаємодії.
Функція антигенів МНС II пов'язана з їхньою здатністю взаємодіяти з фрагментами чужорідних
білків (антигенними пептидами) та рецепторами власних Т-клітин. Отже, молекули МНС II можуть
виконувати функцію як «первинного розпізнавання» чужорідних субстанцій, так і посередників між
субпопуляціями лімфоцитів у кооперативних процесах під час індукції клітинної імунної відповіді
та синтезу антитіл. Імунна відповідь на будь-який Т-залежний антиген залежить від наявності
відповідних алелів МНС, що здатні взаємодіяти з пептидними фрагментами цього антигену. У
особин, у яких відповідь не індукується, є клітини, не здатні представляти антиген або розпізнавати
комплекси цього антигену з власними МНС II. У таких мишей виявляються дефекти в репертуарі
МНС або дефекти в репертуарі рецепторів Т-клітин.
Отже, головною функцією МНС II є забезпечення контакту між Т-хелперами та іншими клітинами
імунної системи в процесі імунної відповіді. Поява антигенів МНС II є результатом спеціалізації
популяцій і субпопуляцій клітин, що кооперуються. Тому система антигенів МНС II має велике
біологічне значення.
5.3. ГЕНЕТИЧНІ ДОСЛІДЖЕННЯ СИСТЕМИ ГІСТОСУМІСНОСТІ.
Генетику головного комплексу гістосумісності почали вивчати досить давно, що пов'язано з
інтересом до трансплантаційного імунітету. Тому всі перші дослідження генетичної карти системи
гістосумісності проводились саме на моделях трансплантації.
Інбредні лінії тварин, гаплотип. Важливою експериментальною моделлю для вивчення функцій і
генетики антигенів гістосумісності виявились інбредні тварини. Було помічено, що однояйцеві
близнюки не відторгають трансплантати один одного. Це було переконливим свідченням того, що
здатність відторгати трансплантат зумовлена генетично. Отже, для вивчення функцій генів
гістосумісності важливо було отримати велику кількість лабораторних тварин, які генетично не
різнилися б між собою. Зрозуміло, що в середині минулого століття, коли почали інтенсивно
вивчати трансплантаційний імунітет, ніхто ще не уявляв можливості клонування вищих тварин.
Тому ідентичні за генотипом лінії тварин отримували шляхом багаторазового інбридингу
(братерсько-сестринських схрещувань). Інбридинг дає змогу переводити гени в гомозиготний стан.
Через 20 таких схрещувань 99,999 % генів будуть переведені в гомозиготний стан. Отримані
шляхом інбридингу лінії тварин називають інбредними лініями. Усі тварини інбредних ліній мають
однакові гени, аналогічно однояйцевим близнюкам.
Нині отримано й вивчено понад 200 інбредних ліній мишей, які підтримуються братерсько-
сестринськими схрещуваннями в більш як 100 генераціях. Найширше в імунологічних
дослідженнях використовують мишей ліній BALB/c (білі), СВА (сірі), Black (чорні). Крім того,
виведено інбредні лінії інших тварин: курей, гвінейських свинок, щурів тощо.
За допомогою інбредних тварин стало можливим картувати гени гістосумісності, дослідити
закономірності їх успадкування та прояву в трансплантаційному імунітеті. Виявилося, що МНС має
полігенну будову, тобто реакції відторгнення контролюються цілим комплексом генів, розміщених у
кількох локусах, але на одній хромосомі. Оскільки гени МНС розміщені поруч на одній хромосомі,
при успадкуванн вони виявляються зчепленими, тобто успадковуються як один ген.
Набір генів на одній хромосомі, які кодують антигени гістосумісності, називають гаплотипом.
Гаплотип містить по одному алелю кожного гена. Кожний ген кодує один поліпептидний ланцюг.
Гаплотипи системи антигенів Н-2 позначають символами Н-2
а
, Н-2
b
і т. д. Оскільки чисті лінії
гомозиготні, то гаплотипи, отримані від батька і матері, які належать до однієї лінії, будуть
гомологічними, тобто кожна особина потомства матиме лише один гаплотип, наприклад, миші лінії
BALB/c мають гаплотип H-2
d
. Тому іноді гаплотип визначають як набір генів гістосумісності
інбредної лінії. Всі інші, не інбредні, тварини мають два гаплотипи: один від матері, другий — від
батька.
Гени гістосумісності кодомінантні, тобто на поверхні клітин організму експресуються антигени
гістосумісності, що ycпадковуються від батька і від матері. Якщо схрестити дві інбредні лінії — А і
В, то гібриди першого покоління F1 фенотипу (АхВ) експресують гени обох гаплотипів і толерантні
до антигенів обох батьківських ліній — А і В. Гени, що кодують антигени гістосумісності,
успадковуються за законом Менделя. При схрещуванні між собою особин першого покоління (АВ)
F1 гени у нащадків другого покоління F2 розподіляються так: АА, АВ, АВ, ВВ. Тварини другого
покоління F2 АА, АВ і АВ не відторгатимуть трансплантати від вихідної лінії А, а тварини ВВ, АВ,
АВ не будуть відторгати трансплантати від лінії В. Таким чином, продукти генів А і В відторгають
тварини, які не успадкували ці гени. Отже, при схрещуванні двох чистих ліній Н-2
а
і Н-2
b
усі
лімфоцити гібридів першого покоління F1 матимуть одночасно поверхневі антигени Н-2
а
або Н-2
b
(антитіла проти Н-2
а
або Н-2
b
за наявності комплементу лізують 100 % лімфоцитів мишей F1). При
схрещуванні між собою гібридів першого покоління F1 у другому поколінні F2 буде виявлено
гаплотипи Н-2
а
, Н-2
а/b
і Н-2
b
у співвідношенні 1:2:1.
Конгенні лінії тварин. Для того щоб дослідити функції окремих локусів МНС або навіть окремих
генів, важливим інструментом виявились конгенні тварини. Конгенними називають тварин двох
інбредних ліній, що переважно мають ідентичні гени, але різняться між собою чітко обмеженим
невеликим локусом хромосоми, який зумовлює відторгнення трансплантатів шкіри після взаємного
їх пересадження. Щоб вивести конгенну лінію, наприклад таку, що ідентична за всіма генами вже
існуючій лінії В, але містить один ген гістосумісності геному інбредної лінії А, самця лінії А
схрещують із самкою лінії В. Гібриди першого покоління F1 від такого схрещування будуть
гетерозиготними за всіма генами, за якими ці лінії різняться. Якщо шкіру від гібридів першого
покоління F1 пересадити самці лінії В, то вона відторгатиме трансплантат, оскільки він містить
алелі гістосумісності лінії А. Цю ознаку надалі можна використовувати для відбору тварин, що
успадкували алелі генів гістосумісності від лінії А.
Конгенні лінії мишей отримують зворотним схрещуванням. Для цього нащадків F1 схрещують з
одним із гомозиготних батьків, у нашому випадку з лінією В. Таке схрещування знижує в них
частку геному лінії А. Однак серед нащадків відбирають лише тих, що успадкували гени
гістосумісності від лінії А, тобто тих, трансплантати шкіри яких відторгаються в батьківській лінії
В. Проведення низки послідовних зворотних схрещувань з лінією В та постійний відбір за здатністю
індукувати реакції відторгнення трансплантата шкіри призводить до того, що в дванадцятому
поколінні майже весь спадковий матеріал мишей, яких селекціонують, має геном лінії В, за
винятком однієї ознаки лінії А, за якою здійснюють добір. Зрозуміло, що ця ознака лінії А
перебуватиме в гетерозиготному стані.
Для переведення ознаки в гомозиготний стан отримані гетерозиготи схрещують між собою і
відбирають особин, які відторгають трансплантат лінії В та індукують реакції відторгнення в лінії В.
Ці особини будуть гомозиготними й матимуть лише один ген лінії А, що визначає гістосумісність,
тобто буде отримано нову конгенну лінію.
5.4. МЕТОДИ ІДЕНТИФІКАЦІЇ РІЗНИХ АЛЕЛІВ МНС.
Головна система гістосумісності дуже поліморфна, тобто кожний ген має велику кількість алелів у
популяції. Очевидно, високий поліморфізм молекул МНС підвищує надійність механізмів імунного
розпізнавання на популяційному рівні. У зв'язку з великою поліморфністю генів МНС важко
добрати сумісну пару донор-реципієнт для трансплантацій.
Існування значної кількості алелів МНС потребувало розробки методів ідентифікації їхніх
продуктів. Методи визначення антигенів МНС in vitro було названо МНС-типуванням.
За допомогою серологічних методів та клітинних тестів було встановлено, що молекули МНС
мають певну кількість антигенних детермінант. Ці детермінанти є різними в різних алельних форм
МНС.
Антигенні властивості продуктів МНС. Під час обробки лімфоцитів протеїназами можна
видалити молекули антигенів МНС з поверхні клітин, повністю зберігаючи при цьому їхні
антигенні властивості.
Більшість антигенних детермінант МНС І розміщена в NH
2
-кінцевій частині важкого ланцюга
поліпептиду. СООН-кінцева частина поліпептидного ланцюга занурена в ліпідний шар клітинної
мембрани. Оскільки ділянка, чутлива до папаїну, розміщена біля поверхні мембрани, то під час
обробки мембран папаїном молекули антигенів гістосумісності вивільняються разом з β
2
-
мікроглобуліном без зміни їхньої антигенності.
Гомологія між молекулами МНС І у межах виду становить понад 90 %, а у тварин різних видів — 70
—80 %. Антигени МНС І у представників одного виду різняться між собою 10 — 40
амінокислотними залишками в доменах α
1
і α
2
, чим і визначається антигенна різноманітність
молекул МНС класу І. β
2
-мікроґлобулін у межах виду порівняно інваріантний.
На позаклітинних частинах молекул МНС І містяться детермінанти, які визначають сироватками,
специфічними до цих детермінант, що не дають перехресних реакцій з іншими детермінантами
антигенів МНС.
Детермінанти МНС є двох видів: загальної та індивідуальної специфічності. Детермінанти загальної
специфічності можуть виявлятися на молекулах МНС, що є продуктами різних алелів, тоді як
детермінанти індивідуальної специфічності містяться лише на продуктах одного конкретного алеля.
Наприклад, молекула Н-2К — продукт одного алеля, має 10 — 18 антигенних детермінант, однак
лише одна з них унікальна для цього алеля. Алель Н-2К
d
кодує поліпептидний α-ланцюг, який має
індивідуальну антигенну детермінанту з порядковим номером 31, специфічну тільки для цього
алеля, а також 3-тю, 8-му, 34-ту, 46-ту і 47-му неспецифічні (загальні) антигенні детермінанти, які
визначаються і в інших алелях (табл. 41). Продукти К- і D-генів у серологічному відношенні
гомологічні приблизно на 50 %.

28
Антигени гістосумісності класу І виявляються переважно за допомогою сироваток, тобто належать
до SD-антигенів. Серед антигенів МНС II є як SD-антигени, так і LD-антигени (від англ. lymphocyte
determination — ті, що визначаються за допомогою лімфоцитів), тобто для ідентифікації їх
використовують як серологічні методи, так і реакції клітинного імунітету.
Антигенні властивості білків МНС II визначаються в основному N-кінцевими доменами α1 і β1.
Зміни антигенної специфічності МНС II зумовлені замінами однієї-двох амінокислот у молекулі
глікопротеїну і можуть бути виявлені серологічно або за допомогою типувальних клітин.
Встановлені зміни антигенності використовують для нумерації алелів МНС II в популяції.
Антигенна різноманітність алельних форм МНС II значною мірою пов'язана з β-ланцюгом. У
хімічному відношенні певні детермінанти МНС II антигенів є олігоцукридними, тоді як у антигенів
МНС І вони розміщені в поліпептидній частині молекули. Антитіла до олігоцукридних компонентів
антигенів МНС II можуть бути отримані при імунізації певними молекулами МНС тварин інших
видів. У антигенів МНС II за допомогою серологічного аналізу виявлено також два види
детермінант – індивідуальної та загальної специфічності.
Методи МНС-типування. Для ідентифікації різних алелів МНС можна використовувати антитіла.
Зазвичай антигени гістосумісності визначають цитотоксичним тестом. Суспензію лімфоцитів
змішують із сироваткою певного антигену (HLA-В8, НLA-B27), добавляють комплемент та
інкубують при 18 °С, потім добавляють трипановий синій (або еозин) і підраховують відсоток
мертвих клітин, забарвлених у синій (або червоний) колір.
Антигенний фенотип локусів HLA можна визначати за допомогою сироваток крові жінок, які
народили багато дітей. У сироватці таких жінок містяться антитіла до антигенів плоду, що
успадкувалися від батька. Крім того, антитіла до антигенів МНС можна отримувати від донорів, що
перенесли трансплантацію органів. При цьому добирають сироватки, що реагують як
моноспецифічні. Нині для типування МНС все частіше використовують моноклональні антитіла.
Деякі алелі МНС виявляють лише за допомогою клітинних реакцій. Для цього використовують
реакцію бласттрансформації у змішаній культурі лімфоцитів (ЗКЛ) або реакцію клітинної
цитотоксичності. Одну з ліній клітин, яку застосовують у клітинних реакціях, називають
стимулювальною, іншу — реагуючою. Як правило, стимулювальну лінію клітин пригнічують
йонізуючим випромінюванням або мітоміцином С і добавляють лімфоцити другої лінії. У ЗКЛ
реагують переважно Т-хелпери, які стимулюються антигенами класу II на дендритних клітинах,
макрофагах і В-лімфоцитах. Реакції в однонапрямленій ЗКЛ можна призупинити антисироваткою
до білків МНС II стимулювальної популяції клітин. Якщо обидві лінії лімфоцитів не відрізняються
за специфічністю МНС II, вони не реагують у ЗКЛ. Клітини з іншою специфічністю розвивають
проліферативну відповідь, яку визначають за включенням
3
Н-тимідину. Цитотоксичність щодо
клітин-мішеней визначають за вивільненням
51
Сr, що був попередньо накопичений клітинами-
мішенями, стимульованими мітогеном.
Іноді для МНС-типування застосовують реакцію лейкоаглютинації, суть якої полягає в тому, що
лейкоцити під впливом специфічних імунних сироваток склеюються в конгломерати.
Окремі алельні варіанти МНС, які можна ідентифікувати за допомогою імунних методів, називають
МНС-специфічностями. Різні МНС-специфічності мають установлені індивідуальні антигенні
детермінанти або унікальний набір загальних антигенних детермінант, за яким їх можна
ідентифікувати специфічними антитілами або рецепторами Т-клітин. У межах однієї встановленої
МНС-специфічності можуть знаходитися кілька дуже близьких алельних варіантів МНС, які не
відрізняються за антигенними властивостями.
Значний прогрес у вивченні будови системи HLA відбувся при впровадженні методу полімеразної
ланцюгової реакції (ПЛР), який дає можливість проводити аналіз молекулярного поліморфізму цієї
системи, тобто йдеться про молекулярне типування, або виявлення алелів HLA на рівні ДНК. Так, за
допомогою мікроцитотоксичного тесту в локусі DR виявлено 14 антигенів, тоді як за допомогою
методу полімеразної ланцюгової реакції визначено понад 300 алелів. Загальна кількість HLA-алелів,
виявлених за допомогою методів ПЛР, на сьогоднішній день більш ніж у 6 разів перевищує
кількість HLA-специфічностей, що виявляються імунологічними методами. Ці дані стали підставою
для перегляду номенклатури HLA-системи, і нещодавно прийнято чотиризначне позначення алелів.
Так, кожний алель МНС позначають літерою, що відповідає локусу, і чотирма цифрами, наприклад
А0101.
Організація МНС подібна у різних видів ссавців. В усіх ссавців у головній системі гістосумісності є
три або чотири локуси, з яких два-три локуси контролюють SD-антигени й визначаються
серологічними методами та один-два локуси кодують LD-антигени й визначаються за допомогою
лімфоцитів. Кожний локус має певну кількість зчеплених генів.
5.5. КОМПЛЕКС Н-2-ГЕНІВ.
У мишей система Н-2 розміщена в 17-й хромосомі. Використання конгенних мишей і ліній,
отриманих у результаті рекомбінацій у межах Н-2, дало змогу з'ясувати деякі ознаки, що
контролюються цим комплексом, і скласти генетичну карту (лінійна послідовність генетичних
ділянок). Нині методами молекулярної біології практично повністю встановлений геном миші, тому
стала відома локалізація навіть тих генів, які ніколи не експресуються. Всього комплекс Н-2 займає
приблизно 4-10 пар основ і до його складу входить понад 200 генів. Його можна умовно поділити на
локуси генів класу І (локуси К, D/L), II (локус І) і класу III (локус S). Локуси генів класу І розміщені
на периферії МНС, тобто оточують з обох боків гени класів II і III (табл. 42, мал. 49).
Гени Н-2 класу І. (Гени, що кодують антигени МНС І у мишей, представлені локусами К, D і L).
Власне в цих локусах кодуються α-ланцюги молекул. β
2
-мікроґлобулін кодується хромосомою 2,
тобто його ген розміщений поза межами МНС. У кожному локусі може знаходитись кілька генів
залежно від гаплотипу миші, проте, як правило, експресується лише один ген кожного локусу.
Продукти генів МНС І мишей позначають Н-2К, H-2D, H-2L відповідно до генів, що їх кодують.
Продукти К- і D-генів містять антигенні детермінанти, що здатні викликати сильну імунну відповідь
у реципієнтів трансплантата іншої генетичної лінії.
У К- і D-ділянках розміщені гени, які кодують синтез Н-2 антигенів клітинних мембран, що
містяться на більшості клітин організму, але кількість їх різна (найбільша кількість їх міститься на
мембранах лімфоцитів).
Експресія генів класу І на клітинах підвищується за дії α-, β- і особливо γ-інтерферонів.
Некласичні гени Н-2 класу І. В районі генів Н-2 класу І знаходяться також гени, які гомологічні
генам локусів К, D і L, однак їх функція, в цілому раді випадків, ще не встановлена. Такі гени
називають некласичпими генами класу І, або МНС Іb. У різних ліній мишей може бути від 40 до 60
різних МНС генів Іb. У мишей некласичні гени МНС розміщені в локусах Qa, Tla та М. Експресія
цих генів різна в різних тканинах і органах, але для багатьох із них взагалі невідомі білкові
продукти. Такі гени називають «мовчазними», або псевдогенами. Вони, очевидно, є «запасним»
генетичним матеріалом для створення в еволюції різноманітності функціонуючих генів.
У тих випадках, коли експресія генів МНС І відбувається, білкові продукти мають структуру,
аналогічну МНС І. Вони представлені на поверхні мембран клітин у комплексі з β
2
-
мікроґлобуліном. Можливо, вони також беруть участь у презентації антигенів, однак лише
обмеженого спектра. Наприклад, молекула Н2-М3 представляє лише антигенні пептиди, що мають
N-кінцевий залишок формілметіоніну, тобто походять з білків бактерій.
Гени Н-2 класу II. У 1973 р. у мишей було відкрито систему антигенів Іa (Immune active), які
експресовані переважно на макрофагоподібних клітинах, макрофагах та В-лімфоцитах. Антигени Іа
є продуктами генів МНС класу II. Тому район генів МНС II, що кодує антигени Іа, названий І-
районом.
Антигени МНС класу II у мишей кодуються двома сублокусами — А та Е. В кожному сублокусі є
гени для α- і β-ланцюгів МНС II. Відповідно продукти сублокусів А та Е позначають І-А та І-Е (або
Н-2А та Н-2Е). Деякі лінії мишей зовсім не експресують α-ланцюг білка І-Е, а отже, мають лише
білки І-А.
Некласичні гени Н-2 класу II. В районі генів Н-2 класу II знаходяться гени М і О, які кодують
молекули, аналогічні МНС II. Однак продукти цих генів не з'являються на мембранах клітин, а
локалізовані всередині клітини, їхня функція — регулювання зв'язування антигенних пептидів з
класичними молекулами МНС II під час процесингу антигенів, причому продукт гена М каталізує, а
продукт гена О — гальмує цей процес.
Інші гени, розміщені в І-районі Н-2. У районі генів Н-2 класу II знаходиться також кілька генів,
які не кодують власне молекули МНС II, а кодують білки, необхідні для процесингу антигенів.
Серед них гени імунопротеосоми LMP2 і LMP7, гени транспортеру антигенних пептидів ТАР та ін.
їхні функції будуть детально розглянуті в розділі, присвяченому процесингу антигенів (див. розд. 6).
Експресія генів МНС класу II контролюється γ-інтерфероном. Останній спричинює активацію в
клітинах транскрипційного фактора СІІТА, який зв'язується з промотором, що є спільним для всіх
генів МНС класу II. Тому внаслідок дії γ-інтерферону в клітинах не тільки збільшується експресія
молекул МНС II, а й посилюється інтенсивність процесингу антигенів.
Гени Н-2 класу III. У мишей локус S об'єднує гени МНС класу III, які розміщені між генами МНС
класів II та І. Він кодує С2- і С4-компоненти комплементу, фактор В, фактор некрозу пухлин (ФНП-
α) і лімфотоксин (ФНП-β ), а також багато інших білків.
5.6. КОМПЛЕКС HLA-ГЕНІВ.
У людини аналогом комплексу Н-2 мишей є система HLA. Система HLA займає велику ділянку
(4▪10
6
пар основ) 6-ї хромосоми, яка, як і комплекс Н-2 мишей, складається з різних локусів. До її
складу входить три локуси генів МНС класу І: HLA-A, HLA-B, HLA-C, три локуси генів МНС класу
II – HLA-DR, HLA-DQ, HLA-DP, а також розміщений між генами МНС І і МНС II комплекс генів
МНС класу III (табл. 43, мал. 50). У 2001 р. було повністю завершено виконання глобального
наукового проекту «Геном людини», в результаті чого з'явилась можливість точно встановити
положення всіх генів HLA у хромосомі.
У людській популяції кожний локус генів МНС представлений великою кількістю алелів.
Номенклатуру локусів системи HLA наведено в додатках. Кількість виявлених алелів поступово
зростає, що пов'язано з появою нових молекулярно-генетичних методів МНС-типування.
Гени HLA класу І. Гени HLA класу І кодують три типи антигенів гістосумісності: HLA-A, HLA-B,
HLA-C. На сьогодні в людській популяції встановлено більш як 395 алелів для локусу А, 195 — для
В, 93 — для С. У кожному локусі знаходяться лише гени α-ланцюгів молекул МНС. Як і у мишей,
β
2
-мікроґлобулін людини кодується за межами комплексу МНС — хромосомою 15. На відміну від
генів МНС класу І миші гени локусів А, В і С людини розміщені один біля одного в послідовності
В-С-А.
Антигени HLA — продукти локусів А, В і С, так само, як і антигени Н-2К та H-2D, експресовані на
всіх клітинах і тканинах. У великій кількості вони містяться в лімфоїдних органах і на білих
клітинах крові, значно менше їх у легенях, нирках, м'язах та мозку і найменше — на кришталику
ока та еритроцитах.
Відомі також некласичні локуси МНС людини — Е, F, G. їхніми продуктами є молекули МНС класу
І, які не беруть участі в презентації антигенів Т-лімфоцитам. Можливо, вони взаємодіють з
рецепторами натуральних кілерів або з γδ-рецептором окремих субпопуляцій Т-лімфоцитів.
Гени HLA класу II. На відміну від мишей, у людини знайдено 3 типи молекул антигенів класу II:
HLA-DR, HLA-DQ і HLA-DP. Кожний тип молекул кодується відповідним сублокусом, у якому
знаходяться гени α- і β-ланцюгів. Цікаво, що локус HLA-DR полігенний, тобто до його складу
входить один ген α-ланцюга і кілька генів β-ланцюга (не більше десяти). Проте, як правило, клітина
не експресує більш ніж чотири різних варіанти HLA-DR. Локуси HLA-DQ і HLA-DP представлені
однією парою функціональних генів.
За допомогою методів МНС-типування було доведено, що генам HLA, які кодують β-ланцюги
молекул МНС класу II, властивий більший поліморфізм, ніж генам α-ланцюга. Так, ген β-ланцюга
HLA-DR має 323 алельних варіанти, HLA-DP — 89, HLA-DQ — 45, тоді як гени α-ланцюгів мають
відповідно 2, 19 і 20 алельних форм.
Як і в геномі миші, в геномі людини разом з генами МНС класу II розміщені гени, що контролюють
процесинг антигену (кластер LMP-TAP), а також гени некласичних молекул класу II HLA-DM і
HLA-DO, які відповідно каталізують та інгібують зв'язування антигенного пептиду з МНС II.
Експресія цих генів, як і всього локусу МНС II, перебуває під контролем γ-інтерферону.
Гени HLA класу ІІІ. Локус генів МНС класу III у людини розміщений між локусами генів класів II
і І. До його складу входять ті самі гени, що й у миші. Продукти генів цього локусу відіграють
ключову роль в активації С3-компонента комплементу як класичним, так і альтернативним шляхом.
Вони беруть участь у формуванні С3-конвертази та продукуванні анафілактичних і протеолітичних
субстанцій. Як це не дивно, деякі з антигенів МНС класу III людини достатньо поліморфні,
наприклад, С4-компонент комплементу має десятки алелів.
Серед народів різних рас частота виявлення різних антигенів HLA неоднакова. Так, у людей
монголоїдної раси частіше трапляються антигени HLA-A9, HLA-A11, HLA-B5, але відносно рідко
— антигени HLA-A1, HLA-A3, HLA-B8, а в африканців частіше трапляються антигени HLA-A23,
HLA-A30, HLA-B17 і рідше —антигени HLA-A1, HLA-A2, HLA-B27.
Хвороби людини, асоційовані з генами HLA. Зі специфікою наборів антигенів системи АВО і
HLA пов'язані деякі захворювання (табл. 44). Антиген HLA-B5 часто виявляється при хворобі
Ходжкіна. Антиген В27 трапляється у 9 % здорових людей та у 96 % хворих на хронічний
анкілозивний спондилоартрит. Можливо, це пов'язано з тим, що наявність антигену HLA-B27
зумовлює недостатність імунної відповіді, і тому збудники цього захворювання Klebsiella,
Enterobacter і Yersinia enterocolitica спричинюють тяжчі інфекції в осіб з антигеном HLA-B27. При
хворобі Рейтера, що характеризується запаленням судинної оболонки ока, сечовипускального
каналу й синовіальних оболонок суглобів, антиген HLA-B27 трапляється у 76—80 %, а при псоріазі
та мієломній хворобі — у 35 —45 % хворих. Сильна імунна відповідь на патогенний стафілокок
зчеплена з антигенами HLA-B15, а слабка — з антигенами HLA-A28. Антиген HLA-B8 виявляється
у 80 % людей з хворобою Аддісона (ураження надниркових залоз), у 60 % хворих на підлітковий
(ювенільний) діабет і у 40 % людей — із системним червоним вовчаком. Причини існування
патогенетичного зв'язку деяких захворювань з наявністю певних генів гістосумісності ще не
з'ясовано, а припущення щодо цього мають абстрактний характер.
При повторних переливаннях лейкоцитарної і тромбоцитарної маси можуть виникати негемолітичні
трансфузійні реакції, зумовлені сенсибілізацією антигенами гістосумісності. Щоб запобігти
постгемотрансфузійним ускладненням, добирають донорів лейкоцитарної й тромбоцитарної маси з
подібним за антигенами гістосумісності фенотипом. Донора легше добрати серед кровних родичів.
5.7. ОСОБЛИВОСТІ АНТИГЕНІВ ГІСТОСУМІСНОСТІ.
Молекули антигенів Н-2 і HLA відрізняються від інших рецепторних молекул цитоплазматичної
мембрани деякими характерними особливостями.
1. Антигени гістосумісності, що кодуються МНС, експресовані на мембрані клітин, хоча, як
вважалося, вони «не важливі» для життєдіяльності клітини і не виконують рецепторної функції.
Проте останнім часом з'являються дані, що антигени МНС, можливо, здатні сприймати сигнал з
навколишнього середовища, зокрема сиґнал про зв'язування їх з рецепторами Т-клітин. На користь
цього припущення свідчить той факт, що на поверхні АПК, зокрема на В-лімфоцитах, молекули
МНС II експресуються разом з молекулами Iga/Igβ, які є передавачами сигналу від В-клітинного
рецептора. Сигнал, який іде в клітину від МНС, ймовірно, може спричинювати активацію клітини,
що представляє антиген.
2. Антигени гістосумісності зв'язують на мембранах клітин Т-епітопи — антигенні пептиди
тимусзалежних антигенів. Утворення комплексів МНС — пептид є необхідною умовою
розпізнавання їх Т-клітинами і стимуляції імунної відповіді.
3. Антигени гістосумісності характеризуються дуже високим внутрішньовидовим поліморфізмом —
понад 100 алелів для деяких локусів. Поліморфізм підсилюється гетерозиготністю (наявністю різних
алелів у батьківській і материнській хромосомах) та полігенністю (наявністю кількох гомологічних
генів в одному локусі). Поліморфізм і полігенність МНС дають змогу представляти якнайбільшу
кількість різних пептидів.
4. Структурна організація молекул МНС у вищих хребетних подібна. Гомологія амінокислотної
послідовності антигенів гістосумісності спостерігається у людини, миші та інших видів, що
свідчить про еволюційну консервативність цієї генетичної ланки. За амінокислотною послідовністю
й третинною структурою примембранні домени антигенів МНС гомологічні константним доменам
імуноґлобулінів, що підтверджується подібністю нуклеотидних послідовностей відповідних генів.
Це дає змогу припустити, що антигени МНС походять від предкового гена імуноґлобулінів.
ВИСНОВКИ.

29
Система генів головного комплексу гістосумісності всіх ссавців характеризується полігенністю та
поліморфізмом. Полігенність зумовлена існуванням у геномі кількох копій аналогічних генів,
наприклад кількох β-ланцюгів HLA-DR. Полігенність дає можливість кожній особині мати
достатній арсенал молекул МНС для представлення значної кількості різних білків.
Поліморфізм МНС ґрунтується на множинності алелів, тобто на наявності в популяції
альтернативних варіантів генів кожного локусу. В процесі еволюції алельні форми генів можуть
утворюватися внаслідок точкових мутацій, рекомбінацій, кросинговеру, конверсії генів та внаслідок
перенесення послідовностей з генів, які «мовчать» і являють собою резервну генетичну інформацію.
Алельний поліморфізм МНС створюється в результаті змін в амінокислотній послідовності
варіабельних доменів. Очевидно, зміни в цих доменах зумовлюють специфічність
антигензв'язувальної порожнини. Поліморфізм МНС сприяє виживанню виду, оскільки дає змогу
хоча б деяким особинам популяції бути стійкими проти певних збудників. Однак через велику
кількість алелів МНС у популяції майже неможливо підібрати цілком сумісну пару донор —
реципієнт для трансплантації органів.
Загальною функцією антигенів гістосумісності класів І і II є представлення антигенів Т-лімфоцитам.
За допомогою антигенів гістосумісності класу І всі клітини організму представляють Т-кілерам
фрагменти внутрішньоклітинних білків, а за допомогою МНС класу II АПК «спілкуються» з Т-
хелперами. МНС II беруть участь у первинному розпізнаванні антигенів. Комплекс, який вони
утворюють з антигеном, розпізнається антигенреактивними клітинами та індукує імунну відповідь.
Можливо, що МНС — це самостійна, одна з наймолодших систем розпізнавання, що на всіх етапах
реалізації імунної відповіді бере участь у розпізнаванні антигенів, індукції проліферації та
диференціюванні імунокомпетентних клітин, а також у забезпеченні клітинної взаємодії.
Контрольні запитання.
1. Що таке головний комплекс генів гістосумісності? Яка основна функція цього комплексу?
2. Порівняйте будову молекул МНС класу І і МНС класу II. Які особливості будови
антигензв'язувальних порожнин і відповідно антигенних пептидів, які вони представляють, ви
можете назвати?
3. На яких клітинах організму експресовані молекули МНС класу І та на яких МНС класу II?
4. Назвіть і порівняйте функції антигенів гістосумісності класів І та II.
5. Як було досліджено генетичну карту системи гістосумісності?
6. Порівняйте комплекси генів HLA людини та Н-2 миші.
7. Як пов'язана імуногенність антигенів з репертуаром Н-2 або HLA?
8. Яка роль антигенів гістосумісності в реакціях трансплантаційного імунітету?
9. Як, на вашу думку, можна пояснити асоціацію деяких захворювань людини з генами HLA?
РОЗДІЛ 6. ПРОЦЕСИНГ І ПРЕЗЕНТАЦІЯ АНТИГЕНІВ.
Основною функцією білків головного комплексу гістосумісності є представлення антигенних
пептидів у такій формі, в якій їх можуть розпізнати рецептори Т-клітин. Як саме антигенні пептиди
потрапляють у порожнину, утворену варіабельними доменами МНС? Можна припустити, що
молекули МНС, експресовані на поверхні клітини, захоплюють антиген з позаклітинного
середовища. Однак виявилося, що молекули МНС без антигенного пептиду здебільшого дуже
нестабільні. У 1981 р. Е. Унанью зі співавт. (Гарвардський університет) уперше переконливо
довели, що процес зв'язування антигенних пептидів з МНС відбувається за активною участю
клітини і потребує часу та енергії. Вони інкубували АПК з антигеном упродовж різних проміжків
часу, після чого «фіксували» їх за допомогою формальдегіду, який припиняє клітинний метаболізм,
а потім перевіряли здатність цих клітин представляти антиген Т-лімфоцитам і зумовлювати їх
проліферацію. Виявилося, що коли АПК фіксували до чи безпосередньо після добавляння антигену,
вони не могли представляти його Т-клітинам. Однак після інкубації з антигеном понад одну годину
АПК набували такої здатності. Ці дані свідчили про те, що потрібен певний час після контакту АПК
з антигеном для того, щоб АПК здійснили якусь модифікацію антигену і представили його на
поверхні.
Як виявилося, асоціація МНС з антигенним пептидом відбувається всередині клітини, і цей процес
тісно пов'язаний з біосинтезом та експресією молекул MНС. Антигенні пептиди, що зв'язуються з
MНС утворюються в результаті процесингу білкових антигенів. Процесинг — обмежене
розщеплення білкових антигенів за допомогою специфічних протеїназ, яке відбувається в клітинах.
Утворення комплексів МНС з антигенними пептидами та експресію цих комплексів на поверхні
клітин називають презентацією, або представленням, антигенів.
Які ж клітини здатні презентувати антигени? Спочатку помилково вважали, що з процесованими
антигенами зв'язуються лише МНС II, тоді як МНС І можуть експресуватися у вільному стані або
утворювати комплекс з нативними антигенами. Тому групу клітин, які експресують МНС було
названо антигенпрезентувальними клітинами (АПК). Нині встановлено, що МНС І, подібно до
МНС ІІ, можуть експресуватися на поверхні клітини лише в комплексі з процесованим антигеном.
Отже, майже всі клітини в організмі здатні до процесингу і презентації антигенів, однак назва АПК
залишилась тільки за тими клітинами, що представляють антигени в комплексі з МНС II.
Процесинг антигену та формування пулу антигенних пептидів, а також фopмування комплексів
пептидів з МНС істотно різняться серед МНС різних класів. Це пов'язано з різною функцією МНС І
і МНС II та клітин, що їх експресують. Як відомо, МНС II відіграють роль переважно в регуляції
імунних реакцій і слугують для того, щоб АПК могли представити поглинуті антигени для
розпізнавання Т-хелперам. МНС І представляють пептидні фрагменти внутрішньоклітинних білків
для розпізнавання Т-кілерам. Отже, МНС І є «знаком якості» для здорових клітин і можуть стати
«маркерами смерті» для клітин з порушеннями метаболізму. Таким чином, антигенні пептиди, що
входять до складу МНС І і МНС II, мають різне походження. За місцем біосинтезу антигени можна
розподілити на екзогенні та ендогенні. Антигени, які потрапляють у клітину ззовні в результаті
активного захоплення та поглинання, називають екзогенними, а антигени, що синтезуються в
клітині, — ендогенними. Екзогенні антигени представляються переважно з МНС II, а ендогенні — з
МНС І, хоча існують важливі винятки з цього правила (див. нижче). Процесинг екзо- і ендогенних
антигенів відбувається в різних компартментах клітини за участю різних протеїназ. Екзогенні
антигени розщеплюються у фагосомально-лізосомальному апараті клітини, ендогенні — в цитозолі,
а біосинтез молекул МНС обох класів здійснюється в шорсткому ендоплазматичному ретикулумі.
Де саме відбувається поєднання білків МНС з відповідними антигенними пептидами, розглянемо
окремо для кожного класу МНС.
Слід зазначити, що процесинг відбувається за певними правилами і є процесом специфічним, тобто
антигенні пептиди, які утворюються внаслідок процесингу, мають характерні спільні особливості
будови, необхідні для їх зв'язування з МНС. Механізм процесингу здійснює вибір саме тих
пептидів, які потенційно можуть стати Т-епітопами. Тому процесинг антигену клітиною можна
порівняти з роботою референта-перекладача, який з великої кількості чужорідної інформації має
відібрати найістотнішу і подати її в належній, легкій для сприйняття формі. Таким чином,
процесинг антигену є першим етапом обробки антигенної інформації, а отже, й першим пунктом
«контролю якості» представленої Т-клітинам інформації про антиген.
Як уже зазначалося, білковий продукт кожного алеля МНС зв'язується зі своїм унікальним набором
пептидів, який характеризується наявністю певних якірних амінокислотних залишків на певних
місцях. Крім того, з антигенами МНС класу І зв'язуються антигенні пептиди завдовжки 8—10
амінокислотних залишків, а МНС II може зв'язувати значно довші пептиди (12—17 залишків). Як
саме формується необхідний репертуар пептидів і чим саме забезпечується його специфічність?
Зрозуміло, що репертуар пептидів залежить від протеїназ, що беруть участь у процесингу антигену,
та від специфічності транспортних систем, які доставляють пептиди безпосередньо до МНС.
Отже, для з'ясування в деталях механізмів процесингу антигенів треба визначити особливості
біосинтезу МНС, джерело походження антигенів, специфічність протеїназ, що розщеплюють
антиген, та місце, де МНС зв'язується з антигеном. Потрібно також визначити, які допоміжні
структури беруть участь у регуляції цих процесів. Прогрес у вирішенні цих питань пов'язаний із
застосуванням методів інгібування певних ланок процесингу за допомогою специфічних інгібіторів,
а також з використанням методу нокаутування генів, продукти яких беруть участь у процесингу
антигенів. Важливу інформацію надало застосування імуноелектронної мікроскопії, під час
проведення якої за допомогою антитіл, мічених колоїдним золотом, визначали локалізацію певних
молекул у клітині. За допомогою використання вищезазначених новітніх методів вдалося майже
повністю з'ясувати механізми процесингу ендо- та екзогенних антигенів. Це відкриває нові
можливості для коригування імунітету і розроблення нових терапевтичних підходів.
6.1. БІОСИНТЕЗ МОЛЕКУЛ МНС І І ПРОЦЕСИНГ ЕНДОГЕННИХ АНТИГЕНІВ.
Біосинтез МНС І та презентація ендогенних антигенів відбуваються майже в усіх клітинах
організму, що дає можливість Т-кілерам контролювати якість білків, синтезованих кожною
клітиною. За відомим порівнянням антигени гістосумісності класу І є «вікнами, через які імунна
система може подивитися, чи все в порядку всередині клітини». Ці вікна є постійно «прозорими»,
тобто будь-яка здорова клітина організму завжди експресує на поверхні молекули МНС І.
Молекули МНС класу І мають представляти антигени, що синтезуються в цитоплазмі клітини, тобто
ендогенні антигени. Ендогенними антигенами можуть бути також будь-які білки, що потрапили в
цитозоль. Так, якщо за допомогою мікрокапіляра або електроосмосу в клітину ввести будь-який
білок, то через деякий час фрагменти деградації цього білка з'являться на поверхні в комплексі з
МНС І. Нині можна вважати доведеним, що в нормі антигени гістосумісності І класу зв'язують
антигенні пептиди, які походять з власних білків організму. Т-кілери залишаються байдужими до
МНС І з процесованими власними білками, оскільки аутореактивні ЦТЛ знищуються під час
селекції в тимусі, де також представлені аналогічні комплекси МНС І з пептидами. У разі патології,
скажімо, за мутаційних перероджень певних клітин, з МНС І крім власних антигенів
представлятимуться також мутантні білки. Те саме відбувається при вірусних інфекціях —
продукти вірусних генів у процесованому вигляді будуть представлені на мембранах уражених
клітин. До таких «нових» комплексів МНС І з чужорідними пептидами серед популяції лімфоцитів
можуть виявитись специфічні ЦТЛ, оскільки вони не підпали під негативний відбір у тимусі. Отже,
уражені або трансформовані клітини відрізнятимуться від здорових клітин за структурою
представлених пептидів, а тому будуть розпізнані й знищені. У цьому й полягає біологічний сенс
процесингу ендогенних антигенів усіма клітинами організму.
Формування пулу антигенних пептидів — похідних ендогенних антигенів Перший етап
процесингу антигену — убіквітинування. Система убіквітину часто бере участь у регулюванні
тривалості життя цитоплазматичних та мембранних білків. Убіквітин — це невеликий білок
цитоплазми, здатний формувати олігомерні ланцюжки, приєднуючись до білків-субстратів.
Зв'язування будь-якого білка з ланцюжком убіквітинів (убіквітинування) є сигналом для його
деградації.
У процесі приєднання убіквітину до специфічного субстрату беруть участь кілька ферментів, таких
як убіквітин-протеїнлігаза (ЕЗ), убіквітин-кон'югуючий фермент (Е2) і убіквітин-активуючий
фермент (Е1), що розпізнають субстрат і каталізують ковалентне приєднання до нього ланцюга
поліубіквітинів. У розпізнаванні білків-мішеней під час убіквітинування беруть участь убіквітин-
протеїнлігази. Відомі на сьогодні убіквітин-протеїнлігази різняться за специфічністю та способами
розпізнавання білкових cyбстратів. N-кінцевий домен лігаз бере участь у розпізнаванні білкових
субстратів, а С-кінцевий каталітичний домен відповідає за утворення тіоефірного зв'язку між
серином білка-мішені та цистеїном убіквітину. Вважають, що убіквітин-лігази розпізнають свої
субстрати шляхом виявлення помилок в укладанні третинної структури білків. Ознаками такого
помилкового укладання можуть бути розгорнуті структури, відкриті гідрофобні поверхні, залишки
проліну з неадекватною цис-, транс-ізомерією тощо.
Після убіквітинування білки потрапляють до спеціалізованої клітинної структури — протеасоми, де
відбувається їх розщеплення на амінокислоти. Причому частина білків може розщеплюватись не
повністю, а лише до пептидних фрагментів, які можуть стати антигенними пептидами.
Деградація ендогенних антигенів протеасомою. Процесинг більшості ендогенних антигенів
починається в протеосомі, функціонування якої тісно пов'язане з системою убіквітину. Протеасома є
універсальним апаратом для деградації цитоплазматичних та частини мембранних білків. Навіть у
найпримітивніших живих організмів, таких як археобактерії, протеасоми дуже подібні за
структурою до протеасом вищих ссавців.
Кожний внутрішньоклітинний білок проходить шлях «від рибосоми до протеасоми». Принциповим
є питання про тривалість життя окремих білків та про ефективність їх синтезу, а саме: яка частина
всіх поліпептидів, що синтезуються на рибосомі, досягає функціонального стану? Нефункціональна
фракція дефективних рибосомальних продуктів може бути одним із важливих джерел надходження
антигенних пептидів для презентації в комплексі з МНС І. Обробка клітин інгібіторами протеасом
підвищує кількість щойно синтезованого білка порівняно з необробленими клітинами на 30 — 50 %.
І навпаки, блокування синтезу білків істотно знижує експорт молекул МНС І на поверхню клітини,
який залежить від кількості зв'язаних антигенних пептидів. Отже, частина поліпептидних ланцюгів
ще під час синтезу на рибосомі убіквітинується і потрапляє в протеасому. Це підтверджується також
даними електронної мікроскопії, які свідчать, що протеасоми в клітині перебувають у тісній
асоціації з полірибосомами. Крім того, в протеасомі утворюються переважно пептиди, які мають
певні С-кінцеві амінокислотні залишки, що можуть бути «якірними» при зв'язуванні з МНС І, хоча
для утворення антигенних пептидів, які цілком придатні для зв'язування з МНС І, здебільшого
необхідне додаткове розщеплення утворених у протеасомі пептидів амінопептидазами.
Структура протеасоми. Пептиди, що можуть зв'язатися з МНС І, утворюються внаслідок
деградації протеасомою внутрішньоклітинних білків. Протеасома являє собою великий
багатосубодиничний комплекс з протеолітичною активністю, головною функцією якого є
контрольована деградація білків, мічених убіквітином. У зібраному вигляді протеасома ссавців має
константу седиментації 26S і називається 26S-
протеасомою. Вона складається з каталітично
активної серцевини та двох регуляторних частин.
Серцевина 26S-протеасоми має константу
седиментації 20S і називається 20S-протеасомою.
Вона має форму бочки, що складається з 4
замкнених кілець, кожне з яких, у свою чергу,
складається з 7 субодиниць. Два α-кільця розміщені
по краях бочки, а два β-кільця становлять середню
частину (мал. 51). Протеолітичну активність мають
три субодиниці кожного β-кільця, які позначають
β1, β2 і β5. Активні центри цих субодиниць
спрямовані до порожнини бочки. Така структура
дає змогу зосередити всю протеолітичну активність
протеасоми в порожнині циліндра, що запобігає
неконтрольованому розщепленню білків цитозолю.
Отже, кожна 20S-протеасома має 6 каталітично
активних субодиниць з трьома різними
протеолітичними активностями, тобто до складу
протеасоми входить три різних протеїнази. До
кожного типу каталітично активних субодиниць
можна підібрати відповідні інгібітори, за
допомогою яких можна досліджувати функції
протеасом не тільки in vitro, а й in vivo.
Під час аналізу великої кількості пептидів, що
з'являються внаслідок деградації в протеасомі, було
помічено, що більшість пептидів мають певні С-
кінцеві залишки, які відповідають якірним
залишкам антигенних пептидів, знятих з МНС І,
тобто субстратна специфічність протеасоми
зумовлює розщеплення пептидних зв'язків з
утворенням С-кінцевого лізину або аргініну.
Доступ до активних центрів каталітичних
субодиниць 20S-протеасоми контролюється двома
додатковими 19S-cap-peгуляторними частинами, які
розміщуються «на вході» і «на виході» з порожнини
протеасоми і в комплексі з 20S-протеасомою
утворюють 26S-протеасому. Вони нагадують два
капелюхи, натягнуті з обох боків на бочку (звідси їхня назва «cap» — від англ. cap — капелюх).
Кожна з 19S-peгуляторних частин складається з 15 різних субодиниць, головною функцією яких є
розпізнавання поліубіквітинової мітки та розгортання третинної структури білків, що потрапляють
до протеасоми і зазнають деградації.
Структура імунопротеасоми. Істотною особливістю протеасом вищих хребетних є те, що вони
можуть змінювати свою структуру під дією цитокінів. Так, при дії інтерферону ІФН-γ на клітини
три каталітичні субодиниці протеасоми заміщуються на їхні гомологи: β1-субодиниця заміщується
на LMP2, β2 – на MECL1 і β5 – на LMP7 (гени LMP2, MECL1 та LMP7 локалізовані в межах
комплексу МНС.) Це заміщення призводить до утворення так званої імунопротеасоми. ІФН-γ також
індукує появу нової регуляторної частини РА28, яка називається активатором протеасоми (від англ
proteasome activator). PA28 складається з 3 субодиниць РА28α і 4 субодиниць РА28β, які в
зібраному стані мають константу седиментації 11S. Активатор РА28 може заміщувати одну з 19S-
регуляторних частин, що підвищує протеолітичну активність протеасоми. РА28, можливо, сприяє
також ефективнішому збиранню імунопротеасоми. Внаслідок такої модифікаці 26S-протеасоми
змінюється її активність та специфічність протеолітичної дії і відповідно змінюється спектр
пептидів, які вона продукує. В останні роки було з'ясовано, що ряд білків по-різному процесуються
звичайною протеасомою та імунопротеасомою.
Певні перетворення в протеасомі також можуть індукувати не тільки ІФН-γ, а й інші цитокіни. Так,
ФНП-α може зумовлювати синтез LMP7, а ІФН-α та ІФН-β можуть індукувати синтез LMP2 у
деяких типах клітин. Однак, швидше за все, така експресія окремих субодиниць не може
зумовлювати формування повноцінної імунопротеасоми, оскільки заміщення всіх субодиниць
відбувається кооперативно, тобто LMP2 не може увійти до складу протеасоми без MECL1, і
навпаки. Лише субодиниця LMP7 може самостійно заміщувати субодиницю β5. Тому можна
припустити, що існують клітини, в яких до складу протеасоми входить LMP7 разом із
субодиницями β1 і β2, хоча функціональне значення такої протеасоми невідоме. Найімовірніше, це
сприяє утворенню великого різноманіття протеасом, які по-різному процесують антигени.
Функції імунопротеасоми. К. Таnaka з колегами (1994) вперше описали імунопротеасому як
протеасому, що має здатність генерувати пептиди, які зв'язуються з МНС І з високою ефективністю.
Це спостереження було підтверджено на мишах, нокаутних за генами LMP2 і LMP7, у яких
презентація деяких антигенів відбувалася з меншою ефективністю. Однак ці миші мали здатність
ефективно представляти епітопи інших антигенів — свідчення того, що імунопротеасома не є
винятково необхідною для процесингу взагалі. І справді, більшість відомих антигенних пептидів,
зв'язаних з МНС І, експресуються клітинами, які мають стандартну протеасому. Нині добре
схарактеризовано антигени, які ефективніше процесуються імунопротеасомою, ніж стандартною
протеасомою. Це, як правило, вірусні білки та білки різних внутрішньоклітинних паразитів.
За допомогою біохімічного аналізу фрагментів деградації білків протеасомами різного типу було
виявлено два різних механізми, що лежать в основі підсилення процесингу антигенів
імунопротеасомою. По-перше, імунопротеасома активніше виділяє епітопи з деяких білків, ніж
стандартна протеасома, тобто має більшу каталітичну активність. По-друге, було помічено, що для
деяких білків, особливо вірусного походження, стандартна протеасома, на відміну від
імунопротеасоми, розщеплює додаткові пептидні зв'язки всередині пептидів, які могли б стати
готовими Т-епітопами. Отже, імунопротеасома не здатна руйнувати готові Т-епітопи, що забезпечує
ефективнішу презентацію антигену в цьому випадку. Детальний механізм цього явища залишається
нез'ясованим, однак існує припущення, що активатор протеасоми РА28 полегшує вивільнення
пептидів з протеасоми, внаслідок чого вони не встигають повністю розщепитись.
Нещодавно було виявлено, що імунопротеасома бере участь у презентації власних білків клітини з
меншою ефективністю, ніж стандартна протеасома. Вперше це було показано в експериментах на
лінії аутореактивних ЦТЛ, які специфічно розпізнавали МНС І з антигенним пептидом – похідним
білка RU1. Ген RU1 експресується в багатьох нормальних і пухлинних клітинах, з якими
взаємодіють ці аутореактивні ЦТЛ in vitro. Проте було помічено, що така лінія ЦТЛ не була здатна
розпізнавати В-лімфоцити, трансформовані вірусом Епштейн-Барр, незважаючи на те, що в цих В-
лімфоцитах ген RU1 був експресований. Виявилося, що внаслідок ураження вірусом у цих В-
клітинах замість стандартної протеасоми була експресована імунопротеасома, яка не здатна
процесувати продукт гена RU1. Крім того, при обробці пухлинної лінії карциноми впродовж
кількох днів ІФН-γ імунопротеасома заміщувала в цих клітинах стандартну протеасому, внаслідок
чого специфічні до епітопу RU1 ЦТЛ не розпізнавали клітини цієї пухлинної лінії. Після того, як
вплив ІФН-γ на клітини пухлинної лінії припинявся, вони через кілька діб відновлювали здатність
представляти процесовані продукти гена RU1 і могли знищуватись специфічними до RU1 ЦТЛ.
Отже, стандартна протеасома є дуже важливою для презентації власних антигенів, її повне
заміщення імунопротеасомою може призвести до неповної презентації власних
внутрішньоклітинних білків. З цих даних можна зробити припущення, які мають практичне
значення. По-перше, слід обережно ставитись до застосування ІФН-γ в протипухлинній терапії,
оскільки це може знизити розпізнавання деяких антигенів пухлин цитотоксичними Т-лімфоцитами.
По-друге, можна очікувати, що в деяких випадках буде доцільним використовувати ІФН-γ для
терапії аутоімунних хвороб, що зумовлені аутореактивними ЦТЛ. Однак слід підкреслити, що наші
знання про специфічність дії різних типів протеасом недосить повні, тому остаточні висновки
робити ще рано.
Розщеплення ендогенних антигенів у дендритних клітинах. Важливо, що дендритні клітини
конститутивно, тобто незалежно від дії ІФН-γ, експресують імунопротеасому. Було також показано,
що імунопротеасома конститутивне експресована в клітинах різних лімфоїдних органів:
лімфовузлів, селезінки, тимуса. Незрілі дендритні клітини, отримані з мононуклеарних клітин крові
після обробки ГМ-КСФ разом з ІЛ-4, експресують однакову кількість стандартних протеасом та
імунопротеасом, тоді як зрілі дендритні клітини мають лише імунопротеасому. Саме тому зрілі й
незрілі дендритні клітини здатні презентувати різний набір антигенних пептидів з одних і тих самих
антигенів.
Деякі теоретичні аспекти функціонування імунопротеасом викликають неабияке зацікавлення.
Наприклад, той факт, що зрілі дендритні клітини експресують лише імунопротеасому, тривалий час
залишався непоясненим. Нині стає зрозумілим, що це є одним із засобів підтримання толерантності
до власних антигенів та запобігання аутоімунним хворобам. На зрілих дендритних клітинах істотно
знижена експресія епітопів власних білків організму. А дендритні клітини — це єдиний тип клітин,
здатних активувати наївні CD8T-лімфоцити. Отже, активація на периферії за допомогою
дендритних клітин потенційно аутореактивних ЦТЛ, які не були усунуті внаслідок негативної
селекції в тимусі, є досить малоймовірною. Цю властивість дендритних клітин нині починають
інтенсивно вивчати у зв'язку з можливістю корекції імунітету при онкологічних та аутоімунних
захворюваннях.
Одним з напрямів, що активно розвивається, є розробка протипухлинних вакцин. Наприклад,
установлено, що більшість протективних Т-епітопів антигенів, характерних для меланоми, в нормі
не представляється на дендритних клітинах. Це пов'язано з тим, що імунопротеасома не процесує ці
антигени. Проте, якщо вже готові антигенні пептиди ввести безпосередньо в цитоплазму
дендритних клітин, такі дендритні клітини починають експресувати МНС І у комплексі з цими
пептидами і активують ЦТЛ, які здатні знищувати клітини меланоми. Були також успішно
застосовані мінімальні гени (міні-гени), які кодують ці антигенні пептиди, у складі генетичних
векторів. Трансфекована такими векторами дендритна клітина набувала здатності активувати
необхідні ЦТЛ. Іншим підходом є застосування незрілих дендритних клітин, які експресують як
імунопротеасому, так і стандартну протеасому. Ці клітини можуть фагоцитувати специфічні для
меланоми антигени і після активації здатні самі активувати ЦТЛ.
Отже, імунопротеасома є компетентнішою порівняно зі стандартною в процесингу вірусних
антигенів, а також антигенів інших інфекційних агентів, що паразитують у цитоплазмі клітин. Вона
генерує спектр пептидів, які добре відповідають вимогам для зв'язування з МНС І. Однак більшість
епітопів власних білків організму, а також білків, специфічних для певних пухлин, не процесуються
імунопротеасомою. Конститутивна експресія імунопротеасоми в зрілих дендритних клітинах
пояснює неефективність ЦТЛ у боротьбі з деякими пухлинами і відкриває можливості для
створення протипухлинних вакцин та імунотерапії пухлинного росту.
Слід зазначити, що, можливо, протеасома — це не єдина структура, яка може продукувати
антигенні пептиди. Презентація деяких пептидів не змінюється під дією інгібіторів протеасоми.
Можливим кандидатом на участь у процесингу ендогенних антигенів є трипептидил-пептидаза II
(ТРРІІ), яка також є мультисубодиничним комплексом, що має ендопептидазну активність. Крім
30
того, важливо, що ТРРІІ залишає пептиди з С-кінцевим аргініном чи лізином, тобто з такими С-
кінцевими залишками, які відповідають вимогам до антигенних пептидів, що зв'язують ся з МНС І.
Деякі пептиди, що утворюються в результаті дії протеасоми, потребують додаткового видалення
певних N-кінцевих амінокислотних залишків, для того щоб бути здатними зв'язатися з МНС І. Це
процес називають амінокінцевим тримінгом пептидів, і до нього залучені певні амінопептидази
цитозолю та ендоплазматичного ретикулума.
Транспорт антигенних пептидів та їх асоціація з МНС І. Формування комплексів ендогенних
пептидів з молекулами МНС І відбувається в місці синтезу МНС, тобто в шорсткому
ендоплазматичном ретикулумі. Цьому процесу сприяє набір спеціалізованих білкових молекул, які
транспортують пептиди з цитозолю в ЕПР, підтримують необхідну конформацію щойно
синтезованих α-ланцюгів МНС, беруть участь у приєднанні β2-мікроґлобуліну тощо. Всі ці
допоміжні білки відносять до шаперонів (білків-«няньок»).
Сформовані в протеасомах пептиди проникають в ендоплазматичний ретикулум з цитозолю через
спеціалізований транспортер ТАР (від. англ. transporter associated with antigen processing). TAP
знаходиться в мембрані ЕПР і являє собою канал, по якому переносяться пептиди. Важливо, що
ТАР транспортує не будь-які пептиди, а тільки ті, що мають необхідні С-кінцеві залишки і певну
довжину. Гени ТАР знаходяться в межах комплексу МНС. В ЕПР пептиди асоціюються зі щойно
синтезованими молекулами МНС, а потім мігрують у складі утворених комплексів на поверхню
клітини (мал. 52).
Залишається відкритим питання, чи існує спеціалізований переносник пептидів від протеосоми до
ТАР. Є підстави вважати, що функцію такого переносника можуть виконувати білки теплового
шоку HSP (від англ. heat-shock proteins) та певні олігопептидази (можливо, олігопептидаза ТОР —
від англ. thimet oligo-рeptidase). Було показано, що пептиди, які кодувалися введеними в клітину
міні-генами, асоціювалися з цими білками. Крім того, D. Chen і М.І. Androlewicz (2001) показали,
що один з білків теплового шоку, а саме HSP70, значно підсилює функцію TAP in vitro, а обробка
клітин специфічними інгібіторами білків теплового шоку HSP70, HSP90 та HSP110 повністю блокує
презентацію ендогенних антигенів.
Біосинтез МНС І. Синтез молекул МНС І
відбувається в ендоплазматичному ретикулумі і
контролюється за допомогою білків-шаперонів.
Спочатку щойно синтезований α-ланцюг утворює
комплекс з шапероном калнексином (мал. 53).
Після зв'язування з β
2
-мікроґлобуліном комплекс
стабілізується калретикуліном. У зв'язуванні
МНС І з ТАР бере участь інший шаперон —
тапасин. Після приєднання до ТАР МНС І може
зв'язувати антигенні пептиди, які надходять в
ЕПР. Можливо, ТАР, калнексин, калретикулін і
тапасин — це не повний перелік шаперонів, які
сприяють формуванню комплексів МНС І з
пептидами в ЕПР. Останнім часом з'явилися
докази участі білків теплового шоку ERP57 та
gp96 у цьому процесі. Таким чином,
внутрішньоклітинна система, яка відповідає за
презентацію ендогенних антигенів, складається з багатьох компонентів. У цитозолі вона
представлена 26S-протеасомою та білками теплового шоку (HSP70, HSP90, HSP110), а в
ендоплазматичному ретикулумі — МНС І, калнексином, калретикуліном, тапасином, ERP57 та
gp96. Ці складові системи пов'язані між собою за допомогою переносника пептидів ТАР. Оскільки
зазначені компоненти обох підсистем близько розміщені в просторі, а їх функціонування
спрямоване на досягнення спільної мети — презентації ендогенних антигенів, усіх їх можна
об'єднати в єдину систему, яка дістала назву презентосоми. Після зв'язування МНС І з антигенним
пептидом утворений комплекс виходить з презентосоми і надходить в апарат Гольджі, де
відбуваються завершальні етапи глікозилювання, і транспортується на поверхню клітини (див. мал.
52).
З якою ж інтенсивністю відбуваються процесинг і презентація антигенів? Підрахувати кількість
різних антигенних пептидів, представлених однією клітиною в комплексі з МНС І, досить складно.
Тому для визначення того, відбулася презентація певного пептиду на поверхні чи ні,
використовують клони специфічних ЦТЛ. Знищення клітини Т-кілером свідчить про експресію на
ній відповідного пептиду. Біохімічними методами можна виявити експресію пептиду, якщо він
представлений у кількості не менш як 100 копій на клітину. В середіьому для ендогенного білка
інтенсивність презентації антигенів упродовж 7 год становить не більш як 40 комплексів пептидів з
МНС І. Взагалі кожна клітина презентує на своїй поверхні близько 100 000 комплексів МНС І з
різноманітними пептидами. При цьому частка пептидів, які специфічно розпізнаються рецептором
окремого Т-кілера, становить не більш як 0,1 %, тобто їх число не перевищує 100. Зрозуміло, що
гіперекспресія будь-якого білка в клітині, скажімо, вірусного походження, збільшує частку
представлених на поверхні пептидів з цього білка. Можливо, що саме це і є головною ознакою, яка
дає змогу Т-кілерам розпізнавати уражені клітини завдяки більшій авідності контакту з клітиною-
«мішенню».
6.2. БІОСИНТЕЗ МОЛЕКУЛ МНС II І ПРЕЗЕНТАЦІЯ ЕКЗОГЕННИХ АНТИГЕНІВ.
На відміну від МНС І антигени МНС II представлені тіліки на деяких типах клітин, що
спеціалізуються на взаємодії з Т-хелперами. Горвною функцією антигенів гістосумісності класу II є
презентація антигенних пептидів рецепторам Т-хелперів (див. розд 5). Молекули МНС II
експресуються антигенпрезентувальними клітинами (АПК), які здатні активно поглинати антигени
навколишнього середовища та процесувати їх. АПК потребують для активації тісної взаємодії з
активованими Т-хелперами, і навпаки, активовані АПК можуть активувати Т-клітини, що
перебувають у стані спокою. Саме для цього вони й експресують МНС II з фрагментами екзогенних
антигенів.
Клітини, що представляють антиген, дещо різняться за функціями:
дендритні клітини — найважливіший тип АПК, який відповідає за індукцію Т-клітинної відповіді
та дотримання толерантності;
макрофаги — важливі ефекторні клітини, що перебувають під контролем Т-хелперів і в
активованому стані здатні також активувати Т-клітини;
В-клітини — клітини, здатні за допомогою молекул МНС II вступати в контакт із Т-хелперами і
перетворюватися на плазматичні клітини під дією хелперних факторів.
Крім вищезгаданих типів клітин молекули МНС II завжди експресують на поверхні епітеліальні
клітини тимуса, головною функцією яких є відбір тимоцитів, здатних зв'язувати власні молекули
МНС.
Під дією певних факторів навколишнього середовища молекули МНС II можуть з'являтися на
деяких інших, неспеціалізованих типах клітин: на фібробластах, клітинах ендотелію, кератиноцитах
та ін. Як правило, це відбувається в місцях запалення або в разі злоякісної трансформації цих
клітин, однак роль експресії МНС II у таких випадках залишається нез'ясованою.
Існує три основних шляхи потрапляння екзогенних антигенів до АПК:
макропіноцитоз — процес неспецифічного поглинання антигенів з позаклітинного середовища,
пов'язаний з поглинанням позаклітинної рідини через спеціальні канали. Важливу роль у цьому
процесі відіграють канали, сформовані білком аквапорином. Макропіноцитоз є головним типом
поглинання антигенів незрілими дендритними клітинами (клітинами Лангерганса);
ендоцитоз — процес поглинання з поверхні клітини рецепторів, зокрема рецепторів у комплексі з
антигеном (характерний для всіх типів АПК, але для В-клітин він є головним шляхом поглинання
антигенів). На відміну від макропіноцитозу ендоцитоз є процесом специфічного поглинання
антигенів;
фагоцитоз — процес посиленого поглинання корпускулярних антигенів (розміром понад 0,5 мкм)
після опсонізації, спрямований на елімінацію та деградацію антигенного матеріалу (характерний
переважно для макрофагів).
Усі три типи поглинання антигену супроводжуються формуванням інвагінацій плазматичної
мембрани та утворенням ранніх ендоцитозних вакуолей. Як правило, ендоцитозні вакуолі вкриті
зовні шаром білка клатрину. Клатрин розміщений під плазматичною мембраною клітини в контакті
з цитоплазматичними частинами мембранних рецепторів. Він відповідає за взаємодію фагоцитарних
або ендоцитозних вакуолей з цитоскелетом і спрямовує їхній рух усередині клітини. Саме тому
ендоцитоз залежить від активності цитоскелета.
Формування пулу антигенних пептидів — похідних з екзогенних антигенів. Пізні ендосоми і
МІІС-компартмент. У перших дослідженнях процесів презентації екзогенних антигенів було
помічено, що слабкі основи значно зменшують експресію МНС II на поверхні АПК. З цього було
зроблено висновок, що процесинг екзогенних антигенів потребує кислого середовища і, ймовірно,
відбувається в ендосомально-лізосомальному апараті клітин. Ці дані були підтверджені й тим, що
додавання інгібіторів протеолітичних ферментів ендосом також знижувало процесинг. Отже,
антигенні пептиди утворюються з поглинутих антигенів під дією протеїназ, які мають оптимум
функціонування в межах низьких значень рН.
Після поглинання антигену в ранніх ендоцитозних вакуолях клітин починають працювати протонні
помпи, які закислюють рН ендосом. Далі до них надходять протеолітичні ферменти в спеціальних
везикулах (лізосомах), які зливаються з ендоцитозною вакуолею. Утворюються фаголізосоми, або
пізні ендоцитозні вакуолі. Саме в них і відбувається процесинг поглинутих антигенів, тобто
обмежене протеолітичне розщеплення їх на пептидні фрагменти. Частина пептидів, що з'являються
внаслідок деградації поглинутих білків, можуть ставати антигенними пептидами і сполучатися з
МНС II. Поєднання молекул МНС II з антигенними пептидами відбувається в спеціалізованому
компартменті, який сполучений з ендосомальним апаратом. Цей компартмент дістав назву МІІС (від
англ. МНС II class compartment). Він являє собою пізні ендосоми, в які надходять синтезовані
молекули МНС II. Цей компартмент вперше було виявлено за допомогою методу імуноелектронної
мікроскопії з використанням антитіл з різними мітками до поглинутих антигенів та МНС II. Було
показано, що ці дві мітки разом виявлялися тільки в одному компартменті — мультиламелярному
ендосомальному комплексі МІІС.
Біосинтез молекул МНС II та їх асоціація з антигенними пептидами. Як і молекули МНС І,
молекули МНС II синтезуються в ЕПР. Цей процес відбувається під контролем шаперонів. Ланцюги
α і β синтезуються окремо, а їх фолдинг контролюється білком калнексином. Після об'єднання
ланцюгів вони утримуються разом за допомогою
інваріантного ланцюга І (від англ. Invariant).
Ланцюг І являє собою тример (мал. 54), кожна
субодиниця якого має молекулярну масу 31 кДа і
складається з цитоплазматичної й трансмембранної
частин, а також МНС ІІ-зв'язувальної частини,
розміщеної в ЕПР. Тример ланцюга І може
об'єднати три молекули МНС II. Інваріантний
ланцюг є шапероном і виконує важливі функції,
пов'язані з об'єднанням ланцюгів α і β та
транспортом готових молекул МНС II в МІІС-
компартмент. Крім того, І-ланцюг заповнює
порожнину МНС для зв'язування антигенного
пептиду з метою запобігання передчасному
зв'язуванню з MHC II сторонніх пептидів,
наприклад тих, що проникли в ЕПР через ТАР.
Ланцюг І залишається в ЕПР, доки не зв'яже три
молекули МНС II. Такий комплекс
транспортується в апарат Гольджі, потім в
ендосомальний МІІС-компартмент. В ендосомах
містяться протеолітичні ерменти, необхідні для
обмеженого протеолізу поглинутих антигенів. Ці
ферменти частково розщеплюють ланцюг І, внаслідок чого з МНС II залишається зв'язаним лише
той його фрагмент, який заповнює порожнину для зв'язування антигенного пептиду. Цей пептидний
фраґмент ланцюга І називають CLIP (від англ. Сlass II associated invariant peptide). На відміну від
ланцюга І CLIP має меншу спорідненість до МНС II. Це пояснюється тим, що ланцюг І утворює ще
два додаткових контакти з неполіморфними частинами молекули МНС II. Тому ланцюг CLIP може
бути легко заміщений на відповідний антигенний пептид, що знаходиться в компартменті МІІС.
Неполіморфні (некласичні) молекули МНС класу II HLA-DM і HLA-DO у людини (відповідно Н2-М
і Н2-О у миші) регулюють заміщення пептиду CLIP на антигенний пептид. Можливо, вони якимось
чином стабілізують «відкриту» конформацію МНС II. Важливо, що асоціація пептиду з МНС II
відбувається в кислому середовищі, а комплекс виходить на поверхню клітини, де середовище
нейтральне. Зрозуміло, що рН впливає на конформацію МНС і стабільність зв'язку з пептидом. Саме
тому в презентуванні антигенів беруть участь шаперони. Однак слід зазначити, що деякі алелі МНС
II можуть нормально експресуватися без участі І-ланцюга та молекул Н2-М і Н2-О, що було
показано на нокаутних за цими генами мишах. Після зв'язування з антигенним пептидом молекула
МНС II транспортується на поверхню клітини. Схематично цей процес зображено на мал. 55.
Протеїнази, що відповідають за процесинг екзогенних антигенів. Протеїнази, що відповідають за
процесинг екзогенних антигенів та розщеплення ланцюга І, називають катепсинами. Існує кілька
різних видів катепсинів, кожний з яких має певну субстратну специфічність і оптимум рН для
каталітичної активності. Найважливішими для процесингу поглинутих антигенів є катепсини D і В,
а для гідролізу І-ланцюга — S і L. Нині відомо кілька десятків протеолітичних ферментів, що беруть
участь у процесингу антигенів в ендосомально-лізосомальному апараті, і, можливо, їх число ще
збільшиться. Тому наведемо їх перелік лише для загального ознайомлення.
Протеїнази, що входять до складу компартменту МІІС, розрізняють за типом каталітичної
активності та спектром субстратної специфічності. Частина катепсинів є цистеїновими
протеїназами, що подібні за механізмом каталізу до папаїну. Це катепсини В, Н, L, S, F, Z, V, О, С і,
можливо, К. Також серед катепсинів є аспартанові протеїнази — це катепсини D, Е — і аспарагініл-
ендопептидаза (АЕР). Інші катепсини належать до серинових протеїназ і до металопротеїназ. Різні
типи АПК експресують різні типи протеїназ, а отже, різняться і за спектром пептидів, які вони
можуть генерувати з однакових антигенів. Деякі катепсини (наприклад, J і W) знайдено в клітинах,
що не належать до АПК. У таких клітинах вони відіграють іншу, не пов'язану з процесингом
антигенів, роль. Цікаво, що для деяких катепсинів знайдено гомологи серед різних рослинних
білків. Тому, ймовірно, первинною функцією катепсинів була участь у «перетравлюванні» білків,
поглинутих клітиною.
