Вершигора А.Ю., Пастер Є.У., Колибо Д.В. Імунологія
Подождите немного. Документ загружается.


31
Як правило, катепсини мають широку субстратну специфічність, за винятком аспарагініл-
ендопептидази, та низький оптимум рН для прояву каталітичної активності. Більшість катепсинів є
ендопептидазами, хоча катепсини Н і С є карбоксиекзопептидазами, а катепсини В і Z —
аміноекзопептидазами. Екзопептидази, ймовірно, зменшують ті частини зв'язаних з МНС II
пептидів, що виступають назовні.
Інгібітори протеїназ та регуляція процесингу екзогенних антигенів. Головними природними
інгібіторами протеїназ, що беруть участь у процесингу антигену, є цистатини. Серед них найбільш
вивченим є цистатин С — інгібітор катепсину S, експресія якого залежить від стану активації
клітини. Інгібітором катепсину може виступати інваріантний ланцюг І. Він представлений двома
ізоформами — р31 і р41, що мають різну молекулярну масу. Ізоформа р41 інваріантного ланцюга
містить у своєму складі інгібітор катепсину L.
Отже, найретельніше в клітині регулюються функції саме тих катепсинів, які зумовлюють останні
ланки деградації ланцюга Іі та звільнення пептиду (CLIP). Біологічний сенс цього процесу полягає в
тому, що за наявності таких інгібіторів може значно знизитись презентація клітинами антигену. Це
призведе до накопичення великої кількості молекул МНС II в ендосомах, які будуть готові швидко
представити антиген при зниженні експресії інгібіторів. Саме такий механізм регуляції презентації
антигенів використовують дендритні клітини (див. далі).
Експресія й активність важливих для процесингу антигенів катепсинів може регулюватися різними
цитокінами, серед яких найважливішим регулятором виступає ІФН-γ. Цитокіни можуть також
впливати на активність катепсинів, змінюючи рН ендосом. Зокрема, було помічено, що пептиди, які
з'являються на оброблених і необроблених ІЛ-6 дендритних клітинах, різняться між собою. Це
пояснюється тим, що ІЛ-6 знижує рН ендосом унаслідок інгібування Na
+
, К
+
-АТФази, яка лімітує
закислення ендосом.
Презентація власних пептидів молекулами МНС II. На деяких клітинах молекули МНС II можуть
експресуватися ще до того, як клітина поглинула антиген. Крім того, наприклад, епітеліальні
клітини тимуса взагалі не поглинають чужорідні антигени. Зрозуміло, що на таких клітинах МНС II
експресується в комплексі з власними антигенними пептидами. Походження цих пептидів у
багатьох випадках ще не з'ясовано, але є певні припущення.
Молекули МНС II і пептиди, що не утворили комплексів, деградують до амінокислот у лізосомах.
Отже, лізосоми є «кінцевою зупинкою» для поглинутих антигенів. Що ж відбувається при
недостатній кількості антигенного матеріалу в компартменті МІІС? Певна частина щойно
синтезованих молекул МНС II зазнає обмеженого протеолізу, внаслідок чого можуть з'явитися
пептиди, які здатні зв'язатися з іншими молекулами МНС II. За цих умов відбувається презентація
на поверхні АПК пептидних фрагментів власних молекул МНС II. Це характерно для наївних В-
клітин, які ще не зв'язали і не поглинули антиген, але вже експресують молекули МНС II на своїй
поверхні. Активація таких В-лімфоцитів не може відбутися в нормі, оскільки відсутні Т-клітини з
рецепторами, здатними розпізнавати такі комплекси МНС II з власними пептидами. Це, можливо,
зумовлено тим, що епітеліальні клітини тимуса також можуть презентувати пептидні фрагменти
власних МНС II в комплексі з МНС II, що призводить до негативної селекції тимоцитів, які
розпізнають ці комплекси.
Залишається відкритим питання, чи може МНС II в комплексі з пептидом CLIP або ланцюгом І
з'являтися на поверхні АПК (ймовірно, що так). І, нарешті, є дані, що антитіла, специфічні до МНС
II без будь-якого зв'язаного пептиду, здатні взаємодіяти з незрілими дендритними клітинами, тобто,
можливо, певні алелі МНС II можуть експресуватися у вільному від пептиду стані. Слід
підкреслити, що конкретні деталі процесингу антигенів та етапи деградації ланцюга І залежать як
від алельних форм МНС II, так і від певних антигенних субстратів.
Таким чином, протеолітична система компартменту МИС виконує дві важливі функції в презентації
антигенів. По-перше, вона генерує набір пептидів, що можуть зв'язатися з МНС II; по-друге, вона
розщеплює інваріантний ланцюг, щоб надати можливість пептидам зв'язуватися з МНС.
Кожний тип АПК має свої унікальні особливості біосинтезу МНС II, процесингу й презентації
антигену, які можуть відрізнятися від наведеної схеми, що пов'язано з конкретними функціями цих
клітин, розглянемо, наприклад, особливості процесингу антигенів дендритними клітинами —
головними регуляторами імунної відповіді.
Особливості презентації антигенів дендритними клітинами. Дендритні клітини є
найефективнішими АПК. Вони поглинають антигени в тканинах із навколишнього середовища,
презентують їх з МНС, мігрують у вторинні лімфоїдні органи, де й відбувається стимуляція
специфічних до цих антигенів Т-клітин. Дендритні клітини — це єдиний тип АПК, здатний
активувати Т-лімфоцити в стані спокою. Отже, дендритні клітини є ініціаторами імунної відповіді.
Вони відповідають також за дотримання імунної толерантності до власних антигенів. Для того щоб
виконувати такі важливі функції, денритні клітини мають унікальні механізми контролю за
поглинанням антигену та його процесингом.
Зрілі дендритні клітини відрізняються від незрілих за функціями. Незрілі дендритні клітини
поглинають антигени з навколишнього середовища, а зрілі — активують у лімфатичних вузлах
наївні Т-клітини. Дозрівання дендритних клітин супроводжується зниженням процесів поглинання
антигенів і набуттям здатності презентувати раніше поглинуті ними антигени. Зрілі дендритні
клітини майже не здатні поглинати антигени, однак представляють у комплексі з МНС II фраґменти
антигенів, поглинутих раніше. На відміну від інших типів АПК процес біосинтезу МНС II та
презентації антигену в дендритних клітинах розділені в часі.
У незрілих дендритних клітинах відбувається інтенсивний процес біосинтезу МНС II, однак
експресія цих молекул на поверхні клітини дуже незначна. Більшість щойно синтезованих молекул
МНС II залишаються в компартменті МІІС в асоціації з інваріантним ланцюгом. Це пов'язано з тим,
що функція катепсину S, який відповідає за протеоліз інваріантного ланцюга, у незрілих дендритних
клітинах знижена завдяки експресії специфічного інгібітора. Внаслідок цього ланцюг І деградує не
до пептиду CLIP, а до довшого пептиду Іір10, який, як і ланцюг І, має в цитоплазматичній частині
сиґнал утримання в ендосомах. При дозріванні дендритних клітин експресія інгібітора катепсину S
знижується, внаслідок чого Іір10 деградує до CLIP, і далі відбуваються всі процеси, необхідні для
зв'язування антигенного пептиду і транспорту комплексів з МНС на поверхню клітини.
Установлено, що на поверхні незрілих дендритних клітин людини може накопичуватися велика
кількість молекул МНС ІІ з ланцюгом І. В разі отримання сигналу для дозрівання відбуваються
ендоцитоз цих молекул, деградація ланцюга І, зв'язування з антигенними пептидами та
транспортування комплексів МНС II з пептидами на поверхню клітини, тобто здійснюється
рециркуляція молекул МНС II Отже, формування комплексів МНС II з антигенними пептидами та
транспортування їх на клітинну поверхню індукуються при дозріванні дендритних клітин.
Не виключено, що дендритні клітині мають ще один механізм, який забезпечує зв'язування
антигенних пептидів з МНС II Результати досліджень свідчать про те, що на незрілих дендритних
клітинах можуть експресуватися «відкриті» молекулі МНС II без І-ланцюга або антигенного
пептиду. На поверхні цих клітин спостерігається також експресія HLA-DM(H2-M) молекул та
певних протеїназ. Тому, можливо, деякі антигенні пептиди можуть зв'язуватися з МНС II на
поверхні дендритних клітин.
6.3. ПЕРЕХРЕСНА ПРЕЗЕНТАЦІЯ АНТИГЕНІВ.
Нині вважається загальноприйнятим, що більшість антигенів, які синтезувалися в клітині і
знаходяться в цитозолі або ядрі, презентуються з молекулами МНС І, а ті антигени, що були
поглинуті клітиною, як правило, представляються з МНС II. Однак існують важливі винятки з цих
правил. Так, ряд ендогенних антигенів може представлятися з МНС II, а екзогенних — з МНС І.
Таку презентацію називають перехресною, або кроспрезентацією. Вважається, що вона не є
результатом помилок у презентації антигенів та біосинтезі МНС. Очевидно, перехресна презентація
має велике біологічне значення і необхідна для активації CD4- та CD8-клітин.
Презентація ендогенних антигенів з МНС II може спостерігатися при гіперпродукції певних білків у
АПК. Як правило, гіперпродукція білка свідчить про наявність вірусної інфекції в клітині. Тому такі
АПК представляють вірусний білок і Т-хелперам, і Т-кілерам. Експресія МНС II на певних типах
клітин, не спеціалізованих на презентації екзогенних антигенів, може також бути індукована
цитокінами запалення. Це дає можливість СD4Т-клітинам з кілерною активністю знищувати
уражені вірусом клітини-мішені в осередку запалення.
Для дендритних клітин здатність до перехресної презентації екзогенних антигенів є найголовнішою
ознакою. Завдяки цьому дендритні клітини мають унікальну .можливість активувати попередників
цитотоксичних Т-клітин, представляючи їм поглинуті антигени.
Молекулярні механізми, що лежать в основі перехресної презентації антигенів, вивчені ще
недостатньо. Де саме відбувається перетинання шляхів біосинтезу МНС І та МНС II, і де саме
відповідні МНС зв'язуються з антигенними пептидами для перехресної презентації? Цей процес
може відбуватися за двома гіпотетичними механізмами — за допомогою транспорту антигенних
пептидів з компартменту МІІС у цитозоль або транспорту молекул МНС І у компартмент МІІС. Уже
отримано певні докази існування обох механізмів.
Вважають, що в процесах перехресної презентації беруть участь білки теплового шоку, які в разі
стресових умов у_великій кількості синтезуються в клітині. Їх функцією є підтримання розгорнутої
структури білкових молекул, що захищає їх від агрегації. Певні білки теплового шоку можуть
зв'язуватися з клатрином, тому вони перебувають в асоціації з компартментом МІІС і спрямовують
транспорт денатурованих білків в ендосоми. Можливо, вони здатні також виконувати функцію
транспорту екзогенних пептидів з компартменту МІІС у цитозоль і, навпаки, ендогенних пептидів з
цитозолю в компартмент МІІС.
Нині активно вивчають ретроградний транспорт ендоцитованих молекул, за якого ендосома
зливається з транс-стороною апарату Гольджі і потім її вміст може виходити в цитоплазму чи ЕПР.
Таким шляхом екзогенні пептиди також можуть потрапляти в ендоплазматичний ретикулум і
зв'язуватися з МНС І. Однак який саме шлях перехресної презентації обирає клітина, залежить від її
типу, функціонального стану, типу антигену та, можливо, інших чинників.
ВИСНОВКИ.
Для процесингу антигенів клітини використовують протеолітичний апарат, що спеціалізується на
деградації білків. Оскільки поглинуті антигени деградують в ендосомах, а синтезовані клітиною —
в протеасомах, відповідно різняться й механізми процесингу екзогенних та ендогенних антигенів.
Важливо, що МНС І зв'язують антигенні пептиди в ЕПР, а МНС II повинні транспортуватися до
ендосомального апарату. Велика кількість допоміжних молекул бере участь у регуляції процесингу
антигенів, серед яких найголовнішими є протеолітичні ферменти, шаперони та білки теплового
шоку. В деяких випадках виникає потреба перехресної презентації антигенів. Така презентація
особливо важлива для того, щоб з молекулами МНС І і МНС II могли бути представлені епітопи
одного й того самого антигену. Це дає можливість дендритним клітинам вступати в контакт з Т-
хелперами й Т-кілерами, які мають рецептори, специфічні до одного й того самого антигену, тобто
виконувати роль «містка» між цими клітинами (див. розд. 11).
Контрольні запитання.
1. Які антигени називають екзогенними, а які — ендогенними?
2. Схарактеризуйте і порівняйте основні етапи процесингу антигенів ендо- та екзогенного
походження.
3. Які органели беруть участь у продукуванні антигенних пептидів? Схарактеризуйте їхні
властивості.
4. Запропонуйте можливі механізми уникнення знищення імунною системою зараженої вірусом
клітини.
5. Які є механізми підсилення ефективності презентації чужорідних антигенів?
6. Що таке перехресна презентація і в яких клітинах вона відбувається?
7. Які особливості презентації екзо- та ендогенних антигенів дендритними клітинами?
РОЗДІЛ 7. РОЗПІЗНАВАННЯ «ЧУЖОГО» І «СВОГО».
Для виконання своєї головної функції — елімінації чужорідних агентів, що з'являються в організмі,
імунна система повинна вміти розпізнавати чужорідні структури (субстанції) цих агентів, тобто
відрізняти їх від власних молекул організму. Таке розпізнавання здійснюється за допомогою
рецепторів — спеціальних молекул, що можуть безпосередньо зв'язуватися з чужорідними
субстанціями. Тому процес розпізнавання можна визначити як взаємодію чужорідних структур з
рецепторами імунної системи. Слід зазначити, що деякі рецептори можуть перебувати як у зв'язаній
з мембраною клітини, так і в розчинній формах.
Розпізнавання антигену є ключовим моментом функціонування імунної системи, який є необхідним
як для індукції імунної відповіді, так і для прояву майже всіх ефекторних функцій системи. Крім
того, процеси розпізнавання антигену важливі для підтримання толерантності до власних антигенів,
для позитивної й негативної селекції лімфоцитів, їх диференціювання в ефекторні клітини та
клітини пам'яті. На різних етапах свого розвитку лімфоцити по-різному реагують на розпізнавання
антигену: можуть активуватися, диференціюватися, гинути або переходити у функціонально
неактивний стан. Системи природного і набутого імунітету використовують принципово різні
підходи для розпізнавання чужорідних субстанцій. Тому рецептори, за допомогою яких вони
розпізнають чужорідні субстанції, також різняться.
7.1. ОСОБЛИВОСТІ РОЗПІЗНАВАННЯ ЧУЖОРІДНОГО СИСТЕМАМИ ПРИРОДНОГО І
НАБУТОГО ІМУНІТЕТІВ.
Вважають, що імунна система еволюційно виникла як система захисту від інфекцій. У процесі
еволюції вона набула також здатності захищати організм від перероджених власних клітин, що
несуть змінену генетичну інформацію. Ця властивість імунної системи, напевно, тісно пов'язана зі
здатністю протидіяти внутрішньоклітинним інфекціям.
Імунна система може впізнати чужорідне за двома критеріями: за наявністю певних хімічних
структур, не характерних для «свого», а також за відсутністю певних структур, властивих
«своєму». Обидва ці підходи використовують системи як природного, так і набутого імунітету.
Однак ступінь прояву ознак «свого» та «чужого», що є достатнім для розпізнавання чужорідного
цими системами, дещо різний. Система природного імунітету реагує тільки на яскраво виражені
загальні ознаки наявності «чужого» або відсутності «свого», а система набутого імунітету може
виявляти навіть замасковані індивідуальні ознаки наявності «чужого», наприклад певного патогену.
Представники різних систематичних груп (бактерії, віруси, найпростіші, гельмінти та паразитичні
гриби) можуть бути інфекційними агентами і становити небезпеку для життя організму. Кожний
окремий вид патогенів має свій генетичний апарат, який кодує синтез власних білків. Очевидно, що
більшість білків патогенів дуже відрізняються від білків організму хазяїна. Особливістю імунного
розпізнавання, характерною лише для системи специфічного набутого імунітету, є здатність до
виявлення відмінностей між амінокислотним складом чужорідних і власних білків.
Проте чи завжди потрібна специфічна імунна відповідь для захисту від патогенів? У більшості
випадків організм може перемогти інфекцію та запобігти виникненню пухлинних клітин,
використовуючи лише систему природного, або неспецифічного, імунітету. До речі, термін
«неспецифічний» здається не дуже вдалим, оскільки реакції системи природного захисту також
мають певну специфічність. Однак їхня специфічність широка і насамперед спрямована на
консервативні хімічні угруповання, які є характерними для низки різних патогенів. Річ у тім, що
певні антигени інфекційних агентів можуть мати загальні особливості хімічної будови, за якими
вони істотно відрізняються від антигенів організму хазяїна. Існує кілька таких загальних ознак, які
притаманні інфекційним агентам і є сигналом для запуску механізмів природного імунітету. Це
насамперед наявність клітинної стінки або вірусного капсиду, що, на відміну від мембран власних
клітин хазяїна, є достатньо жорсткими структурами. В цих структурах певні однакові хімічні
угруповання (як правило, залишки вуглеводів) трапляються з однаковою періодичністю і розміщені
на фіксованій відстані один від одного. Разом з тим мембранні білки клітин макроорганізму здатні
до латерального переміщення в площині мембрани, внаслідок чого відстань між ними може
змінюватися. Саме періодичне розміщення певних угруповань у структурі клітинних стінок і
вірусних капсидів є ознакою, за якою система природного захисту може їх виявляти. Таке
розпізнавання просторового розміщення певних вуглеводних залишків називають розпізнаванням
молекулярних патернів (розпізнаванням «за зразком»). А рецептори системи природного захисту,
які здійснюють цей тип розпізнавання, називають рецепторами, що розпізнають молекулярні
патерни PRR (від англ. pattern recognition receptors). Істотною ознакою PRR є наявність кількох
однакових активних центрів, розміщених на певній відстані один від одного.
Іншою ознакою патогенів може бути наявність біополімерів, яких немає в організмі хазяїна,
наприклад ліпополіцукридів, пептид or ліканів, тейхоєвих кислот, хітину тощо. Крім того, до складу
біополімерів патогенів часто входять вуглеводні залишки, яких немає в складі біополімерів хазяїна.
Наприклад, N-ацетилглюкозамін є характерним для пептидогліканів бактерій та хітину грибів.
Часто глікокон'югати інфекційних агентів містять короткі олігоцукридні ланцюги з кінцевими
залишками манози, що є нетиповим для вищих хребетних. Більшість бактеріальних білків мають N-
кінцевий залишок формілметіоніну внаслідок того, що їх синтез починається саме з цього залишку.
Тому на багатьох лейкоцитах є рецептори до формілметіоніну та інших хімічних угруповань, не
притаманних організму хазяїна. Крім того, для деяких вірусів на певному етапі розвитку характерна
наявність дволанцюгової РНК. Така РНК також може розпізнаватися в цитоплазмі клітини й
індукувати синтез клітиною інтерферону.
Отже, чужорідні речовини, які належать патогенам, а також індуковані ними певні ознаки
інфекційного процесу, якими можуть бути пошкодження тканин, активація систем згортання крові
та комплементу, некроз клітин, вивільнення білків теплового шоку та ін., можуть розпізнаватися
певними рецепторами системи природного захисту, індукувати процеси запалення в тканинах,
активувати лімфоцити й фагоцитарні клітини. Вони можуть також бути сигналом для хемотаксису
лейкоцитів, вивільнення цитокінів, розширення судин та інфільтрації прилеглих тканин. Клінічна
симптоматика цього процесу включає набрякання, почервоніння, біль та підвищення температури.
Реакції системи природного імунітету у відповідь на проникнення чужорідних антигенів називають
реакціями запалення. Запалення є першою захисною реакцією організму та необхідною
передумовою для індукування специфічних імунних реакцій (див. розд. 2).
Існують певні механізми природного захисту для боротьби з внутрішньоклітинними інфекціями та
пухлинним переродженням власних клітин. Значну роль у цьому захисті відіграють інтерферони, які
продукуються активованими макрофагами або ураженими клітинами. Інтерферони припиняють
синтез білка в клітині, активують ендонуклеази, зупиняють поділ клітин. У розпізнаванні
перероджених клітин, можливо, беруть участь γδТ-клітини, які, ймовірно, розпізнають білки
теплового шоку на їхній поверхні. Уражені або трансформовані власні клітини можуть
розпізнаватися за принципом «відсутності свого», а саме за відсутністю або недостатнім рівнем
експресії на поверхні антигенів головного комплексу гістосумісності. Саме цю ознаку
використовують великі гранулярні лімфоцити — природні кілери для знищення небезпечних
власних клітин хазяїна.
Слід зазначити, що механізми природного імунітету виникли еволюційно дуже давно у нижчих
безхребетних тварин і майже без змін перейшли до хребетних. Система природного імунітету
спеціалізована на захисті організму від більшості інфекційних агентів, оскільки вона використовує
для їх розпізнавання ознаки, що є спільними для більшості патогенів. Головними молекулами, які
здійснюють функцію розпізнавання в системі природного захисту, є різні рецептори, що
розпізнають молекулярні патерни. Ця система реагує на кожне потрапляння інфекційного агента
дуже швидко, однак інтенсивність цього реагування не залежить від кількості попередніх контактів
організму з цим патогеном, оскільки вона не запам'ятовує його. Система природного імунітету
першою вступає у боротьбу з патогенним аґентом, що потрапив в організм, і є достатньо потужним
засобом протидії інфекціям.
Однак ця система захисту має слабкі місця, що дає змогу деяким патогенам уникати контролю з її
боку. Внаслідок еволюційної консервативності системи природного захисту більшість патогенних
мікроорганізмів пристосувалися до боротьби з нею і виробили певні механізми, що запобігають
знешкодженню їх факторами неспецифічної резистентності (див. розд. 15). Відсутність у системи
природного захисту імунної пам'яті не дає їй можливості реагувати інтенсивніше під час наступного
проникнення збудника в організм. Тому певні інфекційні аґенти при проникненні в організм у
великій дозі долають захисний бар'єр, зумовлений факторами природного захисту, тобто
випереджають завдяки розмноженню процеси, спрямовані на їх елімінацію. Крім того, оскільки
система природного захисту недостатньо специфічна, вона залишає для мікроорганізмів можливість
антигенної мімікрії — копіювання антигенами мікроорганізмів антигенів хазяїна. Ще однією
проблемою, яку не може «вирішити» система природного захисту, є необхідність розрізняти
патогенні бактерії і представників нормальної мікрофлори. Усі ці недоліки системи неспецифічного
(природного) захисту і зумовили виникнення в процесі еволюції системи специфічного (набутого,
або адаптивного) імунітету.
Характерними особливостями системи адаптивного імунітету є наявність імунної пам'яті та великої
кількості специфічних до різних антигенів клітинних рецепторів, що різняться за будовою активних
центрів. Під час першого контакту з антигеном система набутого імунітету реагує дуже повільно.
Вона встигає взяти участь лише у звільненні організму від тих збудників, що уникли контролю з
боку системи природного захисту. Як правило, на момент розвитку імунних реакцій залишається не
більш як 1 — 10 % первинної кількості антигену. Однак ці реакції спрямовані на знищення саме
того інфекційного агента, який їх зумовив. Система набутого імунітету спеціалізується на виявленні
особливих ознак, притаманних лише певному збуднику, які вона запам'ятовує і переходить у стан
повної готовності до захисту організму від цього збудника в разі можливих майбутніх контактів.
Отже, система набутого імунітету характеризується здатністю формувати імунну пам'ять на кожний
антиген. У розпізнаванні антигену цією системою беруть участь спеціалізовані молекули
інуноґлобулінової суперродини — антитіла та рецептори Т-клітин, які істотно відрізняються від
рецепторів системи природного захисту. Важливою ознакою таких молекул є надзвичайна
мінливість їхніх активних центрів, що дає змогу знаходити до кожного антигену такі рецептори, які
за будовою активного центру комплементарне підходять до нього, як «ключ до замка».
Головні індивідуальні ознаки кожного виду патогенів зосереджені в структурі білків, оскільки білки
є продуктом геному. Саме за структурою білків імунна система виявляє генетичні розбіжності між
різними видами патогенів і відрізняє молекули збудника від власних молекул організму.
Безпосередньо структуру білків розпізнають рецептори Т-клітин. Рецептори В-клітин можуть
розпізнавати антигенні детермінанти не тільки білкової природи. Однак для своєї активації
більшість В-клітин потребують допомоги Т-клітин, для яких вони представляють у комплексі з
МНС II розпізнаний і поглинутий антиген. Тому можна зазначити, що всі реакції системи набутого
імунітету залежать від розпізнавання в структурі білків амінокислотних послідовностей, які відсутні
в структурі власних білків організму.
Оскільки система набутого імунітету виникла на фоні вже існуючої системи природного імунітету,
обидві системи функціонують у взаємозв'язку, доповнюючи одна одну. Система набутого імунітету
взяла на себе функцію спрямування реакцій систем природного захисту, тобто частково
підпорядкувала їх собі. Наприклад, активація комплементу безпосередньо на клітинних стінках
бактерій є еволюційно більш давнім типом активації (альтернативний шлях). Проте після
виникнення антитіл став можливим також інший механізм активації комплементу — комплексами
антигену й антитіл (класичний шлях). Іншим прикладом може бути посилення фагоцитарної
активності фагоцитів при опсонізації бактерій антитілами. Функцію фагоцитів можуть регулювати
також Т-хелпери, оскільки фагоцити здатні представляти їм поглинуті антигени, а Т-хелпери —
розпізнавати ці антигени та активувати фагоцити.
Система природного імунітету, навпаки, може ініціювати специфічні імунні реакції. Наприклад,
дендритні клітини, які активуються в зоні запалення переважно після розпізнавання молекулярних
патернів чужорідних структур, здатні активувати Т-хелпери, що є пусковим механізмом для
багатьох реакцій імунітету.
Отже, системи природного й набутого імунітету використовують різні механізми, за якими
визначають, належить певна хімічна субстанція до речовин власного організму чи є чужорідною.
Система природного захисту спрямована на пошук обмеженої кількості хімічних угруповань, що не
входять до складу речовин власного організму, або на розпізнавання певних молекулярних патернів
на поверхні патогенів. Система специфічного імунітету може розпізнавати індивідуальні ознаки
кожного виду і навіть штаму патогенів, які відображають особливості організації його геному.
Функції систем природного і набутого імунітету тісно пов'язані, то розглядати ці системи потрібно у
взаємодії та взаємозв'язку.
7.2. РЕЦЕПТОРИ, ЩО РОЗПІЗНАЮТЬ ЧУЖОРІДНІ СУБСТАНЦІЇ.
Рецептори, що розпізнають чужорідні субстанції, можна розподілити на два великих класи. Перший
клас – це рецептори, що розпізнають молекулярні патерни. Як правило, це лектини та
лектиноподібні молекули, пентраксини, фіколіни. Тоll-like- і scavenger-рецептори, які є головними
рецепторами системи природного захисту і здатні розпізнавати регулярні залишки біополімерів.
Другий клас — це антигенспецифічні рецептори імуноґлобулінової суперродини, до яких належать
антитіла та рецептори Т-клітин. Головною особливістю другого класу рецепторів є надзвичайна
мінливість їхніх активних центрів. Такі рецептори використовує система набутого імунітету для
специфічного розпізнавання антигенів.

32
Виникнення системи специфічного захисту в процесі еволюції пройшло певні проміжні етапи
становлення специфічності. Тому існують рецептори з різним ступенем специфічності. Розглянемо
окремі класи цих рецепторів та їх представників у порядку зростання специфічності.
7.2.1. Рецептори, що розпізнають молекулярні патерни.
Лектини і лектиноподібні рецептори. Часто функцію розпізнавання молекулярних патернів
виконують лектини та лектиноподібні рецептори. Ці рецептори спеціалізуються на розпізнаванні
вуглеводних залишків у структурі біополімерів. Слід зазначити, що зв'язування вуглеводних
залишків лектинами може бути важливим не тільки для розпізнавання патогенних мікроорганізмів,
а й для міжклітинної взаємодії.
Елементарною функціональною одиницею таких рецепторів є лектиновий або лектиноподібний
домен С-типу. Лектиновий домен складається приблизно зі 120 амінокислотних залишків і є дуже
консервативним, тобто лектинові домени, що входять до складу різних білків, дуже подібні за
первинною та просторовою структурою. Цей домен входить до складу приблизно 5 %
лейкоцитарних рецепторів. Характерною особливістю лектинових доменів, що відрізняє їх від
лектиноподібних доменів, є здатність до зв'язування з лігандами лише за наявності йонів кальцію.
До лектинів С-типу належать такі рецептори системи неспецифічного захисту, як колектини, а
також деякі нші білки, наприклад манозний рецептор макрофагів.
Цікаво, що лектиновий домен С-типу може входити до складу рецепторів, які не беруть участі в
імунному розпізнаванні, наприклад, до складу селектинів. Селектини та колектини — великі групи
споріднених білків, які виконують зовсім різні функції. Селектини експресуються на лейкоцитах
різних типів і беруть участь у клітинній адгезії та міжклітинній взаємодії. Вони зумовлюють
взаємодію лейкоцитів з ендотелієм судин, завдяки чому контролюють міграцію лейкоцитів до
різних органів та в місця запалення. Селектини взаємодіють з вуглеводними залишками різних
глікопротеїнів лейкоцитів та ендотеліальних клітин (наприклад, з антигеном Льюїса). Функцію цих
білків детально розглянуто в розділах, присвячених рециркуляції, розвитку та міграції клітин
імунної системи.
Колектини (колагенові лектини) спеціалізуються на розпізнаванні патогенних мікроорганізмів і
відіграють важливу роль у захисті організму від інфекцій. На відміну від селектинів колектини не
зв'язані з мембраною лейкоцитів, а перебувають у розчинній формі. На поверхні багатьох
лейкоцитів є рецептори до колектинів, що
свідчить про те, що колектини можуть виконувати
функцію опсонінів й підсилювати фагоцитоз.
Колектини здатні також активувати комплемент.
Цей шлях активації комплементу відкритий
досить недавно і названий лектиновим шляхом.
Колектини являють собою гомоолігомери, що
складаються з кількох однакових субодиниць.
Кожна субодиниця складається з трьох
поліпептидних ланцюгів, кожний з яких містить
С-кінцевий лектиновий домен і колагеноподібний
«хвіст». Тому структура кожної субодиниці
нагадує косу з хвостиком або букет квітів, у яких
переплетені стеблинки (мал. 56).
Нині відомо кілька представників колектинів, що
беруть участь у процесах природного захисту:
сироватковий білок, який зв'язує манозу (МВР —
від англ. mannose-binding protein), та сурфактанти
легень (SP-A і SP-D). Певною мірою до
колектинів можна віднести перший фактор
активації комплементу C1q. Білки МВР та SP-A
складаються з трьох розміщених у формі букета
субодиниць, причому всі лектинові домени розміщуються на одному кінці молекул. Сурфактант SP-
D складається з чотирьох субодиниць і має
хрестоподібну структуру (мал. 57).
Колектини розпізнають залишки вуглеводів у
складі глікокон'югатів на поверхні клітин
мікроорганізмів та вірусних часточок.
Наприклад, лектинові домени колектинів
взаємодіють із залишками D-манози, N-ацетил-
D-глюкозаміну та L-фукози. Взаємодія одного
лектинового домену зі своїм лігандом
характеризується невисокою афінністю
(константа дисоціації становить приблизно 2
мМ). Однак сумарна звідність взаємодії всіх
доменів значно більша. Це дає колективам
можливість розпізнавати з високою
ефективністю клітинні стінки бактерій та вірусні
капсиди.
Чому ж селектини взаємодіють з клітинами
власного організму, а колектини зв'язують
потенційні патогени? Вибірковість взаємодії
селектинів і колектинів пояснюється
особливостями будови їхніх молекул та
щільністю лігандів до них на клітинній поверхні.
В колективах кілька лектинових доменів
розміщені в одній площині на фіксованій
відстані один від одного. Це дає змогу
колектинам взаємодіяти з високою звідністю з
клітинними стінками мікроорганізмів та
вірусними капсидами, у яких ці вуглеводні
залишки характеризуються жорстим
розміщенням з певною періодичністю. З
клітинами власного організму колектини,
навпаки, взаємодіють слабко, оскільки на їхніх мембранах вуглеводні залишки мають меншу
щільність, входять до складу різних молекул глікопротеїнів, які, до того ж, можуть переміщуватися
в площині мембрани. На відміну від колектинів селектини мають лише один лектиновий домен.
Тому кожна молекула селектину повинна знайти саме свій ліганд на мембранах відповідних клітин
власного організму.
Зв'язування колектинів з клітинними стінками мікроорганізмів забезпечує розпізнавання цих
інфекційних агентів та їх фагоцитоз макрофагами й гранулоцитами. Крім того, МВР і C1q, зв'язані з
клітинними стінками, можуть активувати комплемент. Сурфактанти легень опосередковують
аглютинацію мікроорганізмів та виведення їх з мокротинням. Колектини мають широку
специфічність до цілого спектра патогенних мікроорганізмів. Наприклад, МВР здатний зв'язувати
клітини Escherichia, Salmonella, Mycobacterium, Candida, Cryptococcus. Сурфактанти легень
зв'язують клітини Haemophilus, Streptococcus, Klebsiella, Escherichia, Pneumocystis. C1q у вільній
формі (тобто без взаємодії з антитілом) може зв'язуватися з поверхнею мікоплазм та деяких
ретровірусів.
Важливим представником лектинів С-типу є манозний рецептор макрофагів. На відміну від
колектинів, які складаються з кількох поліпептидних ланцюгів, кожний з яких несе по одному
лектиновому домену, манозний рецептор макрофагів представлений одним поліпептидним
ланцюгом, по всій довжині якого один за одним юзміщено кілька лектинових доменів. Як і в МВР,
лектинові домени манозного рецептора специфічні до залишків D-манози, N-ацетил-D-глюкозаміну
та L-фукози. Манозний рецептор макрофагів зумовлює розпізнавання та фагоцитоз макрофагами
багатьох патогенів.
Частина лейкоцитарних рецепторів мають лектиноподібні домени. Такі домени входять до складу
рецепторів натуральних кілерів (НК-клітин) та деяких типів Fс-рецепторів.
Інші типи рецепторів, здатних розпізнавати молекулярні патерни. Окремий клас рецепторів, що
розпізнають молекулярні патерни, представляють пентраксини. Білки родини пентраксинів
характеризуються циклічною пентамерною структурою та радіальною симетрією. До їх складу
входить п'ять нековалентно зв'язаних однакових
доменів з молекулярною масою 24 кДа, що
складаються приблизно з 200 амінокислотних
залишків (мал. 58). Найважливішими
представниками пентраксинів є С-реактивний
білок CRP (від англ. C-reactive protein) і
сироватковий амілоїдний білок SAP (від англ.
serum amyloid protein).
Пентраксини, як і колектини, зв'язуються за
наявності йонів кальцію з клітинними стінками
патогенних агентів. Головним лігандом для
зв'язування пентраксинів є фосфорилхолін, який
входить до складу ліпополіцукридів клітинних
стінок багатьох бактерій та грибів. Свою назву
С-реактивний білок дістав завдяки здатності
зв'язуватися з С-поліцукридом Streptococcus
pneumoniae. Фосфорилхолін не тільки входить
до складу клітинних стінок, а й міститься на
мембранах власних клітин організму у складі
фосфоліпідів. Проте з власними клітинами
пентраксини взаємодіють слабко з тих самих
причин, що й колектини. Отже, пентраксини, як
і колектини, розпізнають чужорідні субстанції
завдяки підвищеній звідності зв'язування з
лігандами, які знаходяться в жорсткій структурі
клітинних стінок мікроорганізмів або вірусних капсидів.
Пентраксини здатні активувати фагоцитоз і комплемент, однак на відміну від колектинів, вони
активують комплемент не безпосередньо, а за участю C1q, тобто класичним шляхом.
Разом з колектинами пентраксини відносять до білків гострої фази запалення. У відповідь на
інфекцію або травму їх концентрація в сироватці крові може зростати на два-три порядки.
Синтезуються білки гострої фази клітинами печінки у відповідь на стимуляцію ІЛ-6, ІЛ-1, ФНП-α та
іншими цитокінами запалення, що виділяються активованими макрофагами. Підвищена
концентрація пентраксинів у крові може бути фактором ризику для розвитку деяких захворювань
серцево-судинної системи, таких як атеросклероз, ревматизм та ін. Вважають, що тривале
підвищення їх концентрації навіть в 1,5 — 7 разів збільшує ризик розвитку цих захворювань.
Крім лектинових рецепторів і пентраксинів в останні роки активно вивчають функції інших
рецепторів, що розпізнають молекулярні патерни. Серед таких рецепторів на особливу увагу
заслуговують так звані Toll-like рецептори, scavenger-рецептори (рецептори-двірники) та фіколіни
(назва останніх походить від перших літер назв фібриногену і колагену). Існують також інші
молекули, що зв'язуються з клітинними стінками мікроорганізмів. Наприклад, лізоцим специфічно
зв'язується і розщеплює пептидоглікан. Пропердин і С3-компонент комплементу зв'язуються з
клітинними стінками мікроорганізмів та індукують активацію комплементу альтернативним
шляхом. Природа вибіркового зв'язування цих молекул з клітинними стінками в різних випадках
може бути різною. Проте важливо, що головним механізмом розпізнавання чужорідних субстанцій
системою природного захисту є розпізнавання великих просторових структур — молекулярних
патернів, характерних для різних груп патогенів.
7.2.2. Антигенспецифічні рецептори імуноґлобулінової суперродини.
У 1975 p. Davies і Padlan провели перші дослідження просторової структури молекули
імуноглобуліну. Саме тоді стало зрозуміло, що молекула антитіла складається з доменів, які мають
однакову просторову будову. Ці домени було названо імуноґлобуліновими (мал. 59). Пізніше, коли
було отримано дані про просторову будову більшості рецепторів лімфоцитів, виявилося, що
імуноґлобулінові домени входять до складу майже половини з них.
Ці рецептори об'єднані в так звану
імуноґлобулінову суперродину рецепторів. До
складу цієї суперродини входить багато білків, які
беруть участь у міжклітинних контактах і
забезпечують адгезію клітин до різних субстратів,
а також рецептори, що виконують функцію
імунного розпізнавання. До останніх належать
антигенспецифічні рецептори Т- і В-клітин, а
також антитіла, які, власне, і є секретованою
формою рецепторів В-клітин.
Антитіла і рецептори В-клітин. Антитіла та
рецептори В-клітин здатні специфічно
зв'язуватися з нативними антигенами (див. розд.
10). Рецептори наївних В-клітин представлені
мономерною формою імуноґлобуліну класу IgM
та IgD, які асоційовані з допоміжними
молекулами Igα/Igβ, що беруть участь у
передаванні сиґналу від цього рецептора. В
процесі імунної відповіді В-клітини експресують
рецептори інших класів (IgG, IgA, IgE). Антитіла
є важливою ефекторною ланкою системи специфічного імунітету. За ступенем прояву
специфічності імуноґлобуліни поділяють на нормальні та імунні.
Нормальні імуноґлобуліни. Серед антитіл найпримітивнішими є нормальні, або природні, антитіла
сироватки крові, які ще називають поліспецифічними, або поліреактивними, імуноґлобулінами.
Нормальні антитіла синтезує особлива субпопуляція В-клітин — В1-клітини. Для цих клітин
характерна наявність на поверхні маркерів CD5 та Мас-1, а також відсутність соматичних
гіпермутацій, внаслідок чого різноманітність активних центрів поліреактивних антитіл визначається
лише структурою ембріональних V, D і J-генів і може підвищуватись тільки завдяки реаранжуванню
цих генів.
Вважають, що синтез природних антитіл відбувається ще до контакту організму з антигеном, хоча,
можливо, їх появу ініціюють представники нормальної мікрофлори та продукти активації
комплементу. У відповідь на проникнення антигену рівень природних антитіл зростає в кілька разів,
однак В1-клітини не здатні утворювати клітини пам'яті. Тому кількість нормальних антитіл при
вторинній імунній відповіді істотно не збільшується.
Нормальні антитіла мають широку специфічність відносно деяких антигенів, як правило, —
компонентів клітинних стінок бактерій. Вони здатні також розпізнавати різні глікопротеїни, навіть
рецептори власних клітин організму, хоча константа їх взаємодії з антигенами дуже низька
Іриблизно 10
3
— 10
5
М
-1
). Оскільки нормальні антитіла належать переважно до ІgМ-класу, тобто
мають пентамерну форму, сумарна звідність їх взаємодії з бактеріальними клітинними стінками
значно зростає порівняно зі спорідненістю до власних глікопротеїнів, що дає їм змогу вибірково
розпізнавати чужорідні субстанції (аналогічно колектинам і пентраксинам).
Нормальні антитіла є одним з первинних факторів захисту від інфекцій. За різними підрахунками
кількість цих антитіл у плазмі крові становить від 5 до 60 % усіх імуноглобулінів. Головними
функціями нормальних антитіл є опсонізація бактерій, стимулювання фагоцитозу та
комплементзалежного лізису. Припускають, що нормальні антитіла можуть виконувати ще одну
функцію, не пов'язану з імунним захистом, — спричинювати базальну стимуляцію глікопротеїнових
рецепторів власних клітин організму. Хоча вагомих доказів цієї гіпотези поки що не отримано.
Таким чином, нормальні антитіла та Bl-клітини, що їх продукують, мають деякі ознаки, притаманні
системі природного захисту, а саме: неспецифічну реактивність до різних антигенів та відсутність
імунної пам'яті. Тому їх часто відносять до факторів неспецифічної резистентності. Напевно, В1-
лімфоцити є еволюційно найдавнішою популяцією лімфоїдних клітин. Отже, еволюційно
імуноґлобуліни з'явилися як рецептори, що розпізнають молекулярні патерни, й їхні активні центри
були специфічні насамперед до детермінант клітинних стінок бактерій.
У відповідь на стимуляцію В-клітин полімерними Т-незалежними антигенами, наприклад
поліцукридами бактеріальних стінок, утворюються антитіла класу М, дуже подібні до нормальних
антитіл. Імунна пам'ять при відповіді на Т-незалежні антигени формується дуже слабко. На ці
антигени відповідає переважно також популяція В1-клітин. Отже, відповідь В1-клітин на Т-
незалежні антигени, очевидно, можна розглядати як перехідну форму захисту між системою
природного та набутого імунітету.
Імунні антитіла. На відміну від природних антитіл імунні антитіла мають дуже високий ступінь
поліморфності активних центрів, їх різноманітність забезпечується як реаранжуванням генів, так і
соматичними гіпермутаціями цих генів, завдяки чому вони можуть зв'язувати речовини будь-якої
хімічної природи. Імунні антитіла продукуються CD5
–
В-клітинами субпопуляції В2 і можуть
належати до різних класів: IgM, IgD, IgG, IgA та IgE. CD5
–
В-клітини здатні формувати клітини
пам'яті, тому під час кожного наступного потрапляння антигену в організм концентрація
специфічних до нього антитіл збільшується. В ході імунної відповіді афінність антитіл зростає
внаслідок соматичних гіпермутацій в активному центрі антитіл. Цей процес, названий дозріванням
афінності рецепторів, відбувається в зародкових центрах вторинних лімфоїдних органів.
Головними функціями антитіл є утворення імунних комплексів з антигеном, опсонізація
корпускулярних антигенів, інактивація токсинів та активація комплементу класичним шляхом. Крім
того, для окремих класів і підкласів антитіл характерні свої особливі функції. У мембранозв'язаній
формі імуноґлобуліни виконують функцію антигенспецифічних рецепторів В-клітин.
Рецептори Т-клітин. На відміну від рецепторів В-клітин рецептори Т-клітин перебувають тільки в
мембранозв'язаній формі. Головними функціями ТкР є активація Т-клітин під час взаємодії з АПК,
розпізнавання Т-кілерами своїх «мішеней», а також розпізнавання Т-хелперами клітин, які треба
активувати. За будовою ТкР нагадує Fab-фраґмент антитіл. Він утворений двома поліпептидними
ланцюгами — α і β (або γ і δ), кожен з яких складається з двох доменів імуноґлобулінового типу —
N-кінцевого варіабельного V-домену і С-кінцевого константного С-домену. Варіабельні домени
різних ланцюгів ТкР позначають α1 і β1, а константні — відповідно α2 і β2. Розрізняють два типи Т-
клітинного рецептора — αβ і γδ відповідно до назв субодиниць, що входять до його складу.
γδ-ТкР вважають еволюційно більш давньою формою. Для Т-клітин з таким рецептором
характерний, як правило, фенотип CD4
–
CD8
–
, тобто у більшості їх відсутні маркери CD4 і CD8.
Вважають, Що γδ-ТкР розпізнає певні нативні білкові антигени, білки теплового шоку, а також
гліколіпідні антигени, представлені з молекулами CD1.
αβ-ТкР характерний для клітин з фенотипом CD4 або CD8. Такий рецептор здатний розпізнавати
пептидні фрагменти білкових антигенів у комплексі з власними молекулами МНС. Таким чином,
для того щоб розпізнати антиген, αβ-ТкР потребує попередньої його обробки — процесингу; (див.
розд. 6). Цей тип імунного розпізнавання можна вважати еволюційно наймолодшим, оскільки він
потребує для своєї реалізації додаткових механізмів.
Механізми утворення різноманітності антигенспецифічних рецепторів. Велика різноманітність
антигенспецифічних рецепторів створюється в результаті низки унікальних генетичних механізмів,
які буде детально розглянуто в наступному розділі. Забігаючи наперед, зазначимо, що гени
імуноглобулінів і ТкР побудовані аналогічно і складаються з кількох генних сегментів (V, D, J і С),
кожний з яких представлений значною кількістю подібних, але не ідентичних копій. Особливо
велика різноманітність варіабельних V-сеґментів. Об'єднання певних варіантів генних сегментів
призводить до утворення функціональних генів ланцюгів рецепторів. Саме комбінація різних
генних сегментів, що дістала назву реаранжування генів, є одним із механізмів утворення великої
кількості антигенспецифічних рецепторів. Додаткова різноманітність імуноґлобулінів і Т-клітинних
рецепторів зумовлена вставками нуклеотидів, зміною рамок зчитування для сегмента D,
комбінацією різних легких і важких ланцюгів. Завдяки існуванню цих механізмів у геномі людини
потенційно може міститися інформація для синтезу 10
14
— 10
16
різних варіантів антитіл і 10
9
варіантів ТкР.
Генам антитіл властивий ще один унікальний механізм утворення різноманітності — так звані
соматичні гіпермутації. Ці соматичні гіпермутації відбуваються, головним чином, у трьох
позиціях, що відповідають гіперваріабельним ділянкам V-доменів. У результаті соматичних
гіпермутацій генів важких і легких ланцюгів імуноґлобулінів кількість різних варіантів антитіл
зростає ще на кілька порядків. Якщо врахувати те, що кожний активний центр може зв'язувати
кілька різних хімічних структур, стає зрозумілим, що такої кількості різних варіантів рецепторів
достатньо, щоб розпізнати майже всі можливі антигени.
7.3. СПОСОБИ РОЗПІЗНАВАННЯ АНТИГЕНУ СПЕЦИФІЧНИМИ РЕЦЕПТОРАМИ.
З наведеного випливає, що у вищих хребетних існують два принципово різних типи специфічного
імунного розпізнавання антигенів. Перший тип характерний для антитіл і рецепторів В-клітин,
другий — для рецепторів Т-клітин.
Розпізнавання антигену антитілами та рецепторами В-клітин. Антитіла та рецептори В-клітин
не потребують додаткових структур для взаємодії з антигеном. При цьому вони можуть
розпізнавати антигени як розчинні, так і корпускулярні, нативні й денатуровані, вільні та
асоційовані з мембраною клітини або фіксовані на штучному інертному носії (пластику, нейлоновій
ваті тощо). Антитіла та рецептори В-клітин потенційно здатні взаємодіяти з антигенами будь-якої
хімічної природи. Наприклад, описано моноклональні антитіла, які здатні селективне розпізнавати
катіони важких металів.
Ділянки молекули антигену, з якими :пецифічно зв'язуються рецептори В-клітин і відповідні
антитіла, називають антигенними детермінантами, або В-епітопами. В-епітопи складаються
приблизно з 5—15 амінокислотних залишків, що, як правило, експоновані на поверхні молекули
антигену. В-епітопи білкових антигенів можуть бути лінійними й конформаційними (просторовими,
розривними). Конформаційні епітопи, на відміну від лінійних, утворені залишками амінокислот, що
розміщені не в одній, а в різних частинах амінокислотної послідовності білка, але просторово
наближені один до одного.
Розпізнавання антигену рецепторами Т-клітин. Рецептори Т-клітин можуть розпізнавати лише
білкові антигени, причому ТкР взаємодіє з короткими пептидами, що містяться в певних ділянках
поліпептидного ланцюга антигену. Пептиди, що розпізнаються рецепторами Т-клітин, називають Т-
епітопами. Т-епітопи є послідовними (секвенційними) і не залежать від просторової конфігурації
нативного білка. Вони утворюються внаслідок процесингу вихідного поліпептидного антигену та
зв'язування його фрагментів з відповідними молекулами МНС.
Антигени, в розпізнаванні яких беруть участь Т-клітини, називають Т-залежними антигенами.
Тільки такі антигени є імуногенними, тобто здатними формувати повноцінну специфічну імунну
відповідь та імунну пам'ять. Т-залежні антигени можуть взаємодіяти як з рецепторами В-клітин, що
розпізнають поверхневі епітопи, так і з рецепторами Т-клітин, що розпізнають пептидні фрагменти,
локалізовані всередині молекули антигену. Представлення Т-залежних антигенів на поверхні В-
клітин дає можливість Т-хелперам індукувати диференціювання В-клітин в антитілопродуценти.
Оскільки Т-епітопи містяться тільки в структурі білкових антигенів, то необхідною умовою
імуногенності антигену є наявність у його структурі поліпептидного ланцюга. Отже, серед
природних біополімерів імуногенними можуть бути білки, глікопротеїни, нуклеопротеїни та
ліпопротеїни. Цей феномен був відомий імунологам уже давно і широко використовувався на
практиці. Так, класичним методом для отримання імунної відповіді до будь-якого неімуногенного
антигену (гаптену) є кон'югація цього антигену з імуногенним білком-носієм.
Кількість Т-епітопів у молекулі білка менша, ніж кількість В-епітопів. По-перше, це пов'язано з тим,
що репертуар рецепторів Т-клітин більш обмежений, ніж репертуар рецепторів В-клітин. По-друге,
не всі пептидні фрагменти антигену можуть бути представлені з молекулами МНС на поверхні
клітини.
На відміну від В-клітинних рецепторів ТкР можуть розпізнавати тільки антигени, представлені на
поверхні живих клітин, що здатні до попереднього розщеплення антигену. Саме тому методи, які
були успішно використані для демонстрації зв'язування В-рецепторів з антигеном (метод адсорбції
розчинних радіоактивно мічених антигенів на поверхні лімфоцитів і метод адсорбції лімфоцитів на
нейлоновій ваті чи латексних кульках із сорбованим антигеном), виявилися непридатними для
ідентифікації рецепторів Т-лімфоцитів.

33
Зв'язування Т-клітин з антигеном уперше було продемонстровано при використанні методу
адсорбції імунних лімфоцитів на моношарі клітин-мішеней. Принцип методу полягає в тому, що
лімфоцити, взяті від імунізованих певним антигеном тварин, додають до обробленого цим самим
антигеном моношару макрофагів. Лімфоцити, що зв'язалися з антигеном, знімають з моношару,
змінюючи рН або обробляючи його розчином трипсину. Специфічність зв'язування рецепторів з
антигеном визначають, досліджуючи функціональну активність знятих з моношару клітин,
наприклад кілінговий ефект або продукування інтерлейкінів. Виявилося, що зв'язування Т-
лімфоцитів з антигеном на моношарі клітин не блокується ні антитілами до антигену, ні самим
антигеном, але блокується антитілами до антигенів системи МНС.
Так було встановлено унікальну особливість Т-рецепторів, яка полягає в тому, що об'єктом їх
розпізнавання є не сам вилучений у результаті процесингу антигенний пептид, а його комплекс з
аутологічними молекулами МНС. Рецептор Т-клітин розпізнає як процесований антиген, так і
проксимальні (N-кінцеві) домени білків гістосумісності, що його зв'язують. Тому розпізнавання за
таким механізмом називають подвійним розпізнаванням.
Як вже зазначалося в попередніх розділах, рецептор Т-хелпера розпізнає пептиди у складі
комплексів з МНС II, а рецептор Т-кілерів — у складі комплексів з МНС І. Отже, Т-епітоп, який
розпізнається Т-хелпером, і Т-епітоп, що розпізнається Т-кілером, як правило, не збігаються за
амінокислотною послідовністю. Пептиди, що зв'язуються з молекулами МНС різних класів, мають
різні розміри і складаються з 12 — 25 амінокислотних залишків для МНС II і з 8— 10 залишків для
МНС І. Крім того, з МНС І представляються, як правило, пептиди ендогенних, а з МНС II —
пептиди екзогенних антигенів (див. розд. 6).
Отже, ТкР розпізнає антигенні пептиди білкових антигенів ендо- або екзогенного походження та
антигени гістосумісності, які є продуктами генів власних клітин організму. Необхідність асоціації
антигенних пептидів на АПК з молекулами МНС власного або генетично ідентичного організму
називають МНС-рестрикцією (обмеженням за МНС). Цей феномен уперше виявили Р. Цінкернагель
і П. Догерті (1974-1976 pp.) під час вивчення цитотоксичної дії Т-лімфоцитів тварин, заражених
вірусом лімфоцитарного хоріоменінгіту, на інфіковані цим вірусом клітини-мішені різних
гаплотипів, а дослідженнями Б. Бенацеррафа з невірусними антигенами поширений на більшість
найрізноманітніших антигенів.
МНС-рестрикція формується внаслідок позитивної селекції Т-лімфоцитів у тимусі, під час якої
відбираються ті клітини, що несуть рецептор, здатний взаємодіяти з представленими на
епітеліальних клітинах власними молекулами МНС (див. розд. 12). Феномен МНС-рестрикції
еволюційно виник для розпізнавання експресованих на поверхні інфікованих клітин організму
антигенів внутрішньоклітинних інфекційних агентів, таких як віруси та деякі бактерії (лістерії,
мікобактерії та ін.). Одночасне розпізнавання чужорідного антигену і власного МНС робить
неможливою блокаду рецепторів Т-лімфоцитів вільним антигеном, що циркулює в крові. Крім того,
завдяки МНС-рестрикції Т-лімфоцити здатні розрізняти ендо- та екзогенні антигени, оскільки вони
представляються в комплексі з молекулами МНС різних класів, і розвивати ефективну відповідь
адекватного типу. А здатність багатьох патогенів до антигенної мімікрії (маскування під антигени
макроорганізму з метою уникнення контролю з боку імунної системи) не загрожує виду в цілому
завдяки значному поліморфізму системи МНС.
Слід зазначити, що здатність розпізнавати антигени в комплексі з МНС властива αβТ-клітинам, які
характеризуються широким спектром специфічних рецепторів. Особливості розпізнавання
антигенів γδ-Т-клітинами остаточно не з'ясовані. Є дані, що вони можуть розпізнавати нативні
антигени або антигени в комплексі з деякими іншими молекулами, які не є ні МНС І, ні МНС II,
зокрема CD1 у людини і Тlа — у миші.
Отже, Т- і В-рецептори, характеризуючись високою специфічністю до антигену і подібністю
структури, значно різняться за механізмами розпізнавання антигену. Однак незважаючи на
принципову відмінність у розпізнаванні антигенів імуноґлобулінами та рецепторами Т-клітин,
молекулярні механізми, що лежать в основі такого розпізнавання, однакові. Ці механізми
ґрунтуються на одних і тих самих типах нековалентних взаємодій: вандерваальсових,
електростатичних, гідрофобних, водневих.
Прогрес у вивченні молекулярних основ імунного розпізнавання пов'язаний насамперед з
дослідженням просторової структури комплексів антиген — антитіло та комплексів ТкР-антигенний
пептид — МНС за допомогою методів ядерного магнітного резонансу та рентгеноструктурного
аналізу.
7.4. СТРУКТУРНІ ОСНОВИ СПЕЦИФІЧНОСТІ РЕЦЕПТОРІВ, ЩО РОЗПІЗНАЮТЬ
АНТИГЕНИ.
Структурні особливості імуноґлобулінових доменів виявились еволюційно дуже вдалими для
виконання імунними рецепторами Т- і В-клітин функції специфічного розпізнавання антигену.
Прогрес у вивченні просторової структури активних центрів антитіл і ТкР дав відповідь на
запитання, як саме забезпечується специфічність взаємодії їх з антигеном.
Як уже зазначалося в попередніх розділах, кожний імуноґлобуліновий домен складається приблизно
зі 100 амінокислотних залишків і має внутрішньодоменний дисульфідний зв'язок. Структурною
основою імуноґлобулінового домену є антипаралельні β-смуги, які утворюють два β-листки. Ці два
β-листки трохи вигнуті та розміщені один навпроти одного. Вони об'єднані дисульфідним зв'язком і
утворюють структуру, яка за зовнішнім виглядом нагадує бочку або бутерброд, тому в літературі її
часто так і називають — «β-бочкою» (β-barrel) або «β-сандвічемм».
На основі спільних ознак в амінокислотній послідовності та просторовій будові всі
імуноґлобулінові домени, що входять до складу рецепторів імуноґлобулінової суперродини,
поділено на два типи: перший (V-тип) нагадує варіабельний домен імуноглобулінів, а другий (С-
тип) подібний до константних доменів антитіл.
Будова активного центру ТкР і ВкР. Структура активних центрів Т- і В-клітинних
антигензв'язувальних рецепторів дуже подібна. Домен α1 ТкР є аналогічним VL-домену ВкР і
антитіл, а домен β1 — VH-домену. Два варіабельні домени ТкР утворюють активний центр,
аналогічний активному центру ВкР або антитіла.
Характерні ознаки варіабельних доменів (V-muny). V-домени відрізняються від С-доменів
кількістю антипаралельних β-смуг, що входять до їх складу. Якщо структуру імуноґлобулінового С-
домену розгорнути на площині, то дістанемо картину, зображену на мал. 60, а. Кожну β-смугу, що
входить до складу імуноглобулінового домену, позначають відповідною літерою латинської абетки,
починаючи від N-кінця. С-домени складаються з
розміщених на двох β-листках семи β-смуг:
відповідно d, е, b, а та g, f, с. Листок g, f, с
називають внутрішнім, оскільки при збиранні
молекули імуноглобуліну два імуноґлобулінові
домени різних ланцюгів розміщуються один
навпроти іншого, контактують сторонами, що
утворені смугами g, f, с. Відповідно листок d, e,
b, а називають зовнішнім, оскільки він
розміщений на зовнішній поверхні зібраної
молекули імуноґлобуліну. Головнок
структурною особливістю V-доменів, що
відрізняє їх від С-доменів, є наявність на
внутрішньому листку додаткових смуг с' та с",
розміщених безпосередньо за смугою с (мал. 60,
б).
Варіабельні домени мають певні ділянки, в яких
спостерігається найбільша частота
амінокислотних замін. Ці ділянки були виявлені
при порівнянні первинних структур ряду
моноклональних антитіл, а також рецепторів Т-
клітин одного клону. Вся мінливість
варіабельних доменів зосереджена в трьох
локусах, які названі гіперваріабельними
регіонами (HVR — hypervariable regions). Існує
загальнобіологічне правило, що найбільша
варіабельність білкової молекули може бути
зосереджена у невпорядкованих структурах,
таких як петлі, згини тощо, які розміщені на
поверхні цієї молекули. Виявилося, що
гіперваріабельні ділянки імуноґлобулінових
доменів відповідають саме петлям, розміщеним
на внутрішньому β-листку V-домену.
Гіперваріабельні петлі знаходяться з одного
торця β-бочки. Залишки, що входять до складу
гіперваріабельних петель, беруть безпосередню
участь у взаємодії з антигеном, а отже,
забезпечують специфічність цієї взаємодії. Тому
їх називають CDR (від англ. complementarity-
determining regions — регіони, що визначають
комплементарність) і позначають відповідно
CDR1, CDR2 та CDR3 (див. мал. 60, б). Зверніть
увагу, що CDR та HVR — це різні назви одних і
тих самих районів, але CDR належить до
молекули білка, a HVR, як правило, позначає
відповідну ділянку гена. CDR1 утворений петлею
між β-смугами b і с, CDR2 — між смугами с' і с",
а CDR3 — петлею між смугами f і g. Наявність
додаткових двох β-смуг с' і с" у структурі V-
домену дає можливість утворити ще одну петлю,
якої немає в С-доменах. Усі три CDR-петлі одного варіабельного домену розміщені з одного краю
внутрішнього β-листка. Отже, активний центр антитіл і ТкР складають шість петель CDR. При
розміщенні V-доменів обох ланцюгів поруч усі шість CDR-петель збираються разом і утворюють
активний центр рецептора.
Таким чином, активні центри антитіл і ТкР мають принципово подібну організацію, однак
взаємодіють з антигенами, що перебувають у різних станах. Які ж саме особливості їх будови
забезпечують участь у різних процесах імунного розпізнавання? Поки що не існує остаточної
відповіді на це запитання, проте виявлено певні відмінності у будові активних центрів ТкР та
антитіл, які, можливо, пояснюються їх різною функціональною спеціалізацією.
Відмінності в будові активних центрів ТкР і ВкР. На сьогодні виявлено кілька основних
відмінностей у будові ТкР і ВкР, однак залишається з'ясувати, які саме з цих відмінностей
зумовлюють специфіку функцій цих двох молекул.
1. Активний центр антитіла має 6 гіперваріабельних ділянок, а активний центр ТкР — ще по одній
додатковій гіперваріабельній ділянці в кожній субодиниці. Ці ділянки називають HVR4. Вони
належать до зовнішнього β-листка варіабельних доменів, їх функція залишається нез'ясованою.
Можливо, вони беруть певну участь у взаємодії з МНС.
2. ТкР на відміну від ВкР і антитіл не зазнає соматичних гіпермутацій. Тому головне джерело
різноманітності для ТкР — це рекомбінація сегментів VJ для α-ланцюга і VDJ — для β-ланцюга.
Місце рекомбінації цих сегментів відповідає тій послідовності, яка кодує CDR3-петлі обох
субодиниць. Тому найбільша варіабельність ТкР спостерігається саме в СDR3-ділянках.
3. У варіабельному домені антитіла додаткові смуги с' та с" належать внутрішньому листку, а в
структурі ТкР смуга с" — зовнішньому, а с' — внутрішньому листку. Тому для ТкР зовнішній і
внутрішній β-листки називають відповідно d е b а с" і g f с с'. Структура V-доменів γδТкР, який, як
вважають, може взаємодіяти з нативним антигеном, така сама, як і V-доменів антитіл. Можливо, це
пов'язано з тим, що γδТкР є примітивнішою формою рецептора Т-клітин.
4. Оскільки між смугами с' і с" розміщена петля CDR2, то різне розміщення цих β-смуг у структурі
ТкР та ВкР призводить до різної орієнтації петель CDR2. Найбільша відмінність між активними
центрами ВкР і ТкР полягає саме в тому, що СDR2-петлі ТкР розміщені перпендикулярно до
порожнини активного центру, а в антитіла вони паралельні їй. Саме тому СDR2-петлі антитіл
можуть вступати в контакт з антигеном, а СDR2-петлі ТкР не можуть взаємодіяти безпосередньо з
антигенним пептидом і контактують лише з МНС. На мал. 61 наведено будову активних центрів
ТкР і ВкР, якщо їх розглядати зверху, тобто з
боку CDR-петель.
7.5. МНС-РЕСТРИКЦІЯ І БУДОВА
ПОТРІЙНОГО КОМПЛЕКСУ.
αβТ-клітини здатні розпізнавати лише ті
антигенні пептиди, які представлені на АПК
власного або генетично ідентичного організму,
що зумовлено, як вже зазначалося вище,
сформованим в онтогенезі феноменом МНС-
рестрикції.
На молекулярному рівні МНС-рестрикція
пояснюється тим, що ТкР має специфічність не
тільки до антигенного пептиду, а й до
варіабельних частин МНС. У процесі імунного
розпізнавання утворюється потрійний комплекс:
Т-клітинний рецептор — Т-епітоп — МНС (мал.
62). Істотною особливістю потрійного комплексу
є те, що всі три його компоненти взаємодіють
один з одним, тобто між рецептором і Т-
епітопом, між рецептором і МНС, між МНС і Т-
епітопом установлюються нековалентні зв'язки.
Інакше кажучи, в потрійному комплексі
варіабельні петлі ТкР утворюють нековалентні
зв'язки зі всією поверхнею зайнятої антигенним пептидом порожнини МНС. По краю порожнини
МНС знаходяться α-спіралі, які є дуже поліморфними для різних алелів МНС. Можна сказати, що
вони несуть свої власні детермінанти, за якими рецептор Т-клітини впізнає молекули МНС власного
організму. У МНС І це спіралі, що належать α1 і α2-доменам, а в МНС II — α1 і β2-доменам.
Детально розглянути, як відбувається взаємодія
ТкР з МНС, дають змогу результати
рентгеноструктурного аналізу потрійного
комплексу. На сьогодні відомі дані такого
аналізу понад 10 різних комплексів ТкР з МНС І
та МНС II. Робити остаточні висновки поки що
рано, однак певні особливості розпізнавання
антигену ТкР вже можна з'ясувати. Нині точно
відомо, що щілини активних центрів МНС і ТкР
мають діагональну орієнтацію одна відносно
одної. Не було помічено ніяких змін у
конформації пептиду, зв'язаного з МНС, після
утворення потрійного комплексу з ТкР. У
контакт із ТкР вступають як поліморфні, так і
консервативні залишки амінокислот у структурі
МНС. Проте залишається відкритим питання
про те, чи мають залишки амінокислот, які
зумовлюють контакт з іншими компонентами
потрійного комплексу, постійне положення в
різних алелях МНС, тобто чи є вони
консервативними. В контакт з ТкР вступають
приблизно 15 залишків амінокислот, причому
12 з них мають однакове положення як для
МНС І, так і для МНС II.
Пептид, зв'язаний з МНС II, перебуває в більш
розгорнутій конформації, ніж пептид, зв'язаний
з МНС І. Тому в першому випадку ТкР може
утворювати контакт з пептидом завдовжки 2,5
нм, тоді як у другому випадку — тільки з
пептидом завдовжки 2,0 нм.
Як свідчать результати рентгеноструктурного
аналізу, при розпізнаванні Т-клітинним
рецептором МНС І і МНС II CDR1- та CDR3-
петлі встановлюють контакти як з пептидом, так і з МНС. Причому одна з CDRl-петель контактує з
С-кінцем, інша — з N-кінцем пептиду. Це пов'язано з тим, що ТкР і МНС знаходяться відповідно в
діагональній орієнтації один відносно одного. СDR2-петлі контактують лише з МНС, оскільки вони
розміщуються перпендикулярно до щілини активного центру ТкР. Найбільше «навантаження» в
розпізнаванні комплексу МНС — пептид беруть на себе CDR3-петлі, які встановлюють зв'язки як з
антигенним пептидом, так і з МНС. Слід зазначити, що процеси розпізнавання МНС І і МНС II
істотно не різняться.
Підсумовуючи всі дані рентгеноструктурного аналізу потрійних комплексів МНС —пептид —ТкР,
можна зробити висновок, що взаємна орієнтація МНС II — ТкР є більш перпендикулярною, ніж
МНС І — ТкР. Так, кути взаємного розміщення досліджених комплексів МНС І — ТкР становлять
45-70°, а МНС II-ТкР -відповідно 70 — 80°. Ці дані заперечують отримані раніше результати
моделювання взаємодії МНС і ТкР, у яких ТкР було замінено на Fab-фраґмент антитіла. За такого
моделювання МНС і Fab-фраґмент розміщувались під прямим кутом, при цьому СDR3-петлі
контактували лише з пептидом, a CDR1- та СDR2-петлі утворювали контакти лише з МНС.
Отже, різні CDR-петлі мають різну функціональну спеціалізацію в розпізнаванні антигену. Одні з
них переважно розпізнають поверхневі структури МНС, інші — структурні елементи антигенного
пептиду. Цей висновок, який було зроблено завдяки даним про тривимірну будову комплексу ТкР—
антигенний пептид—МНС, має велике значення, оскільки пояснює біологічний сенс різної
варіабельності різних CDR-петель. Зрозуміло, що найбільшою варіабельністю мають
характеризуватися петлі CDR, спеціалізовані переважно на взаємодії з антигенним пептидом, а
більш консервативними мають бути петлі, які взаємодіють виключно з МНС. І справді, як уже
зазначалося, поліморфність CDR3-петель ТкР на кілька порядків вища, ніж інших варіабельних
частин цієї молекули.
Таким чином, розпізнаватиметься чи ні представлений з МНС антиген, залежить від двох
властивостей ТкР — від його специфічності до певного антигенного пептиду та його специфічності
до певної молекули МНС. Причому теоретично можливо, що недостатня афінність до антигенного
пептиду може бути компенсована високою афінністю до МНС і навпаки.
7.6. РОЗПІЗНАВАННЯ ЧУЖОРІДНИХ МОЛЕКУЛ МНС (АЛОРЕАКТИВНІСТЬ).
Відкриття молекулярних механізмів імунного розпізнавання дало змогу пояснити феномен
алореактивності — здатності Т-лімфоцитів відповідати на стимулювання алогенними клітинами, що
лежить в основі відторгнення трансплантатів та реакції трансплантат проти хазяїна.
Алореактивність пов'язана з феноменом розпізнавання Т-клітинами чужорідних («не своїх»)
молекул МНС, за якими різняться особини одного виду (алогенні молекули МНС). Загадковість
цього феномену полягає в тому, що в природі не існує процесу, аналогічного трансплантації тканин.
На перший погляд, феномен алореактивності суперечить феномену МНС-рестрикції, оскільки
внаслідок позитивного відбору в тимусі формуються Т-лімфоцити, які здатні розпізнавати лише свої
молекули МНС. Т-клітини, які зазнали позитивного й негативного відбору в тимусі, мають середню
афінність до власних МНС з власними антигенними пептидами. Якщо антигенні пептиди в
структурі власних МНС будуть чужорідними, то частина Т-клітин зв'язуватиметься з такими
мішенями більш афінно, що й зумовить активацію імунної відповіді. Таке явище дістало назву
«розпізнавання «чужого» за принципом зміненого «свого». Як же Т-клітини розпізнають чужорідні
молекули МНС при відторгненні трансплантата? Нині вважають, що частина Т-клітин може за
допомогою своїх рецепторів «випадково» сприймати чужорідні МНС як «свої з чужорідним
пептидом», а отже, розвивати відповідь на ці антигени. Цю особливість Т-клітин було виявлено в
процесі копітких експериментальних досліджень in vivo та in vitro. Для пояснення явища
алореактивності було запропоновано три моделі.
Згідно із запропонованою Єрне (1971) першою моделлю алореактивності, Т-клітини, що розпізнають
чужорідні, «не свої» молекули МНС і експресують, як вважали, специфічні рецептори до них та
функціонують на периферії як алореактивні, розглядалися як окрема субпопуляція клітин, що не
підлягає відбору під час дозрівання в тимусі. Проте вже в ранніх дослідженнях реакції трансплантат
проти хазяїна (трансплантації лімфоцитів однієї особини іншій) та реакції змішаної культури
лімфоцитів (культивування лімфоцитів двох особин) на тваринах одного виду, але різних гаплотипів
МНС було доведено, що близько 1 — 10 % Т-лімфоцитів є алореактивними. Така висока частота Т-
клітин, здатних розпізнавати молекули МНС інших особин виду, не узгоджувалася за тодішніми
уявленнями з клонально-селекційною теорією імунітету Бернета. Якщо брати до уваги кількість
існуючих гаплотипів МНС, то за теоретичними розрахунками весь репертуар Т-лімфоцитів повинен
обмежуватися розпізнаванням лише алогенних молекул МНС. Виходячи з цього, було висловлено
припущення, що на кожному Т-лімфоциті (принаймні на більшості з них) експресуються два
рецептори, один з яких специфічний до алоантигену, другий — до іншого чужорідного антигену
(друга модель алореактивності). Арґументом на користь такого припущення були дослідження, в
яких специфічні до чужорідних антигенів Т-лімфоцити активувалися алогенними клітинами. Однак
і ця теорія виявилася помилковою.
Після відкриття феномену МНС-рестрикції було запропоновано третю модель алореактивності,
згідно з якою один і той самий Т-клітинний рецептор здатний розпізнавати як чужорідний антиген у
комплексі з власними молекулами МНС, так і певні алогенні молекули МНС. Існування Т-клітин зі
специфічністю до алоантигену МНС та до інших чужорідних антигенів в асоціації з власними
молекулами МНС вперше було продемонстровано на нерозділеній популяції алореактивних Т-
кілерів при дослідженні їхньої цитотоксичної активності щодо клітин-мішеней методом холодного
(конкурентного) гальмування. Принцип цього методу полягає в культивуванні цитотоксичних Т-
лімфоцитів одночасно з міченими
51
Сr і неміченими (холодними) мішенями за значного
переважання останніх. У такій системі спостерігається помітне пригнічення цитотоксичної
активності Т-лімфоцитів, що реєструється за гальмуванням виходу
5І
Сr (показник лізису) з мічених
клітин-мішеней. Отже, відбувається конкуренція немічених
51
Сr-«мішеней» з міченими за
зв'язування зі специфічними рецепторами Т-лімфоцитів.
Алореактивні Т-кілери отримували внаслідок стимуляції in vitro клітин селезінки мишей лінії А
опроміненими алогенними клітинами селезінки мишей лінії А опроміненими алогенними клітинами
селезінки мишей лінії Q. Виявилося, що отримані Т-кілери лінії А лізували мічені
51
Сr не тільки
алогенні клітини лінії Q, якими вони були активовані, а й модифіковані гаптеном (ТНФ) клітини
лінії А. Лізис мічених
51
Сr модифікованих мішеней лінії А гальмувався холодними мішенями лінії Q
в такому самому ступені (> 50 %), що й модифікованими ТНФ мішенями лінії А. З даних
експериментів випливало, що ті самі Т-клітини специфічні як до модифікованих гаптеном власних
молекул МНС лінії А, так і алогенних молекул МНС лінії Q і, отже, несуть рецептори, специфічні
до двох антигенних детермінант МНС: ТНФ-модифікованих власних і немодифікованих. Однак
залишалося не з'ясованим питання, чи розпізнаються ці дві детермінанти одним чи двома
незалежними рецепторами? У разі експресії на клітинній поверхні двох незалежних рецепторів
зв'язування холодної мішені лінії Q з одним рецептором буде стерично блокувати взаємодію
другого рецептора з міченими
51
Сr ТНФ-модифікованими мішенями лінії А.
Здатність Т-клітин, специфічних до чужорідного антигену в асоціації з власними молекулами МНС,
вибірково реагувати на певні алогенні молекули МНС було чітко підтверджено на клонованих Т-
лімфоцитах у системі клітинної проліферації. Антигенспецифічний проліферувальний Т-клітинний
клон отримували методом клонування в м'якому агарі вторинно стимульованих in vitro антигеном
(ДНФ-А) імунних Т-лімфоцитів лімфатичних вузлів мишей лінії В10. А. Ріст клону можна було
підтримувати in vitro, стимулюючи клітини цим самим антигеном за наявності сингенних АПК
(клітини селезінки В10.А). Однак виявилося, що ріст цього клону були здатні підтримувати також
алогенні АПК (клітини селезінки мишей лінії B10S). При цьому клітини клону не потребували

34
наявності антигену для проліферації, тобто розпізнавали МНС іншого гаплотипу як свої, що
представляють чужорідний антиген.
У подальших дослідженнях із використанням клонованих Т-лімфоцитів різних конгенних за МНС
ліній мишей було виявлено, що частота алореактивних Т-клітин серед клітин з детермінованою
специфічністю до чужорідного антигену добре корелює із загальною частотою алореактивних
клітин до будь-якого алогенного гаплотипу в усій популяції Т-лімфоцитів. Це свідчить про те, що
алореактивні Т-клітини і Т-клітини, специфічні до чужорідних антигенів в асоціації з власними
молекулами МНС, не є окремими популяціями, як вважали раніше, а значною мірою
перекриваються.
Таким чином, існують антигенспецифічні Т-лімфоцити, здатні виявляти також алореактивність.
Незаперечні докази того, що той самий Т-рецептор розпізнає і чужорідний антиген в асоціації з
власними молекулами МНС, і алогенну молекулу МНС, було отримано при використанні
клонотипічних моноклональних антитіл. Специфічні до певного Т-клону антитіла, зв'язуючись із
ним, пригнічують його реакцію не лише на відповідний чужорідний антиген, а й на певну алогенну
молекулу МНС.
На основі результатів цих досліджень зроблено висновок про подвійну специфічність рецепторів Т-
лімфоцитів — здатність розпізнавати чужорідний антиген у комплексі з власною молекулою МНС і
один з алоантигенів того самого класу МНС (МНС І — для рецепторів Т-кілерів, МНС II — для
рецепторів Т-хелперів). Отже, Т-клітини розпізнають чужі молекули МНС як змінені антигеном
власні.
Як нині пояснюють розпізнавання алоантигенів Т-лімфоцитами з позиції МНС-рестрикції? В
експериментах на клітинах трансгенних мишей, які не експресують молекули МНС І і МНС II, було
показано, що здатність розпізнавати ці молекули, ймовірно, не залежить від відбору розпізнавання
МНС під час розвитку Т-клітин у тимусі, а швидше зумовлена генетичне. Тому алореактивність
пов'язують із перехресною реактивністю (крос-реактивністю) Т-клітинних рецепторів, які
специфічні до різних чужорідних пептидів в асоціації з власними молекулами МНС.
Як уже зазначалося, ТкР установлює нековалентні зв'язки як з МНС, так і з антигенним пептидом.
При цьому недостатню афінність зв'язування з МНС може компенсувати висока афінність до
пептиду, і навпаки. Запропоновано два можливих механізми крос-реактивного розпізнавання.
Перший механізм полягає в досить сильному зв'язуванні Т-рецепторів з пептидом, що асоційований
з алогенною молекулою МНС. При цьому афінність зв'язування власне з молекулою МНС може
бути низькою. Такий тип зв'язування (більш поширений) відбувається у разі значної спорідненості
пептиду до Т-рецептора і називається пептид-домінуючим зв'язуванням. Інший тип крос-
реактивного розпізнавання (менш поширений) більше залежить від спорідненості Т-рецептора до
алогенних молекул МНС. Існування такого типу зв'язування було продемонстровано на клітинах-
мішенях з дефектами процесингу антигенів. При цьому так званому МНС-домінуючому зв'язуванні
Т-рецептор сполучається з унікальними структурами алогенних молекул МНС.
Обидва ці механізми крос-реактивного розпізнавання можуть реалізуватися під час розвитку
імунної відповіді на трансплантат, причому другий, очевидно, може генерувати досить сильний
сигнал, оскільки алогенні молекули МНС представлені в значній кількості на АПК. Вважають, що
пептидзалежна алореактивність призводить до хронічного відторгнення трансплантата, тоді як
МНС-залежна — до гострого.
На природу алореактивності проливають світло результати рентгеноструктурного аналізу
комплексу МНС І з алореактивним ТкР, які було отримано в 2000 р. Reisser зі співавт. Виявилося,
що, на відміну від звичайного розпізнавання ТкР своїх МНС з чужорідним пептидом, при
розпізнаванні алогенних МНС СDR3-петля α-ланцюга ТкР не бере участі у взаємодії з антигенним
пептидом. На жаль, це єдина встановлена на час написання цього підручника структура комплексу
ТкР з алогенним МНС, тому робити остаточні висновки поки що зарано, однак, певно, алогенні
МНС «помилково» розпізнаються ТкР, специфічними до власних МНС, що презентують пептиди
чужорідних антигенів.
ВИСНОВКИ.
Імунна система вищих хребетних може розпізнавати чужорідні субстанції за груповими та
індивідуальними ознаками. Для певних груп мікроорганізмів характерна низка спільних ознак,
таких як наявність клітинної стінки, певних хімічних угруповань тощо. Система природного
імунітету спеціалізована на розпізнаванні саме цих ознак. Головними рецепторами цієї системи є
лектинові та лектиноподібні PRR-рецептори, здатні взаємодіяти з вуглеводними залишками, а також
PRR-рецептори, що розпізнають інші періодичні угруповання. Зазвичай ці рецептори мають низьку
афінність до чужорідної субстанції, яка компенсується високою звідністю.
Система набутого імунітету спеціалізована на розпізнаванні індивідуальних ознак кожної
чужорідної субстанції, що потрапила в організм або виникла в ньому. Головною ознакою системи
набутого імунітету, на відміну від системи природного імунітету, є її специфічність, тобто здатність
формувати імунну пам'ять після першого контакту з антигеном. Для розпізнавання антигенів
система специфічного імунітету використовує структурні особливості варіабельних доменів білків
імуноґлобулінової cyпepродини. Завдяки певним генетичним механізмам, які розглядатимуться в
наступному розділі, може формуватися велика різноманітність рецепторів Т- і В-клітин, причому
вся їхня мінливість зосереджена в CDR-петлях, які утворюють активний центр.
ВкР і антитіла здатні розпізнавати антигени у вільному стані, а ТкР — тільки в комплексі з МНС.
Розпізнавання Т-клітинами найрізноманітніших чужорідних антигенів завжди рестриктується
(обмежується) антигенами гістосумісності. Т-клітини розпізнають Т-епітопи — пептиди
тимусзалежних антигенів в асоціації з власними (сингенними) молекулами МНС. Наявність у
структурі антигенів Т-епітопів є необхідною передумовою їх імуногенності, а асоціація Т-епітопів з
молекулами МНС та представлення відповідних комплексів на мембранах власних клітин –
передумовою їх розпізнавання Т-клітинами і стимулювання імунної відповіді. Алогенні антигени
МНС є об'єктом розпізнавання при трансплантаціях.
Контрольні запитання.
1. Назвіть особливості розпізнавання чужорідних агентів системами природного і набутого
імунітету.
2. Які є класи рецепторів, що впізнають чужорідні агенти? Схарактеризуйте їх.
3. Схарактеризуйте рецептори В- і Т-клітин.
4. Які є способи розпізнавання антигену специфічними рецепторами? Проведіть порівняльний
аналіз.
5. Які структурні особливості забезпечують специфічність рецепторів, що впізнають антиген?
6. Проведіть порівняльний аналіз будови ТкР- та Fab-фраґментів антитіл.
7. Поясніть терміни «МНС-рестрикція» та «алореактивність», а також існування обох цих явищ.
РОЗДІЛ 8. ГЕНЕТИКА РІЗНОМАНІТНОСТІ АНТИГЕНСПЕЦИФІЧНИХ РЕЦЕПТОРІВ.
Пояснення механізмів утворення різноманітності спектра антитіл та рецепторів Т-клітин є одним з
основних досягнень сучасної імунології. Виявилося, що основою диверсифікації цих рецепторів є
принципово подібні генетичні механізми, які полягають у змінах у геномній ДНК у процесі
розвитку лімфоцитів. Такі зміни ДНК характерні лише для клітин імунної системи і не
спостерігаються в інших соматичних клітинах, тому з'ясування механізмів перебудови ДНК у
лімфоцитах стало визначним відкриттям біології двадцятого століття, яке потребувало певного часу
для його визнання науковою спільнотою. Історично генетичні основи утворення різноманіття
спочатку були описані для антитіл, а потім для рецепторів Т-клітин.
8.1. ТЕОРІЇ УТВОРЕННЯ РІЗНОМАНІТНОСТІ АНТИТІЛ.
Упродовж життя організм має бути здатним специфічно розпізнавати будь-які антигенні субстанції,
що можуть потрапити до його внутрішнього середовища. Для цього білки імунної системи, що
виконують функцію розпізнавання антигенів, мають бути представлені мільйонами чи навіть
мільярдами різних форм. Основною догмою сучасної імунології є селекційно-клональна теорія
Бернета, згідно з якою в лімфоїдній системі ще до зустрічі з антигеном містяться імунокомпетентні
клітини, детерміновані до імунної відповіді на будь-які антигени. Після стимулювання ці клітини
утворюють клони, кожний з яких синтезує один вид антитіл або несе рецептор однієї специфічності.
Однак теорія Бериета не дає відповіді на запитання, яким чином виникає різноманітність генів, що
кодують безліч варіантів рецепторів. Тому впродовж тривалого часу інтенсивно вивчали питання
про те, як в організмі створюється інформація, потрібна для синтезу мільйонів варіантів антитіл, які
особина потенційно здатна продукувати.
На початку другої половини минулого століття існували дві протилежні теорії, які намагалися
пояснити явище різноманіття антитіл. Перша теорія стверджувала, що для кожного з варіантів
антитіл ще в зародковому геномі є свій власний ген. Така теорія дістала назву теорії «зародкового,
або гаметного, різноманіття» генів імуноглобулінів (germ-line theory). Прихильники другої теорії
наполягали на тому, що кількість генів імуноґлобулінів обмежена, але вони певним чином можуть
змінюватися під час дозрівання В-лімфоцита. Цю теорію було названо теорією «соматичного
різноманіття» (somatic diversification theory). Згідно з нею передбачалося існування раніше не
відомих механізмів перебудови ДНК під час розвитку В-лімфоцитів.
Відповідно до теорії «зародкового різноманіття», в геномі мали міститися мільйони генів антитіл,
що трохи непокоїло прибічників цієї теорії і надихало прибічників іншої. (Нині відомо, що під час
реалізації програми «Геном людини» в 2001 р. у людини виявлено не більш як 50 тис.
функціональних генів загалом.)
У 1965 р. В. Дрейєр і Дж. Беннет висловили припущення про те, що синтез кожного поліпептидного
ланцюга імуноґлобулінів кодується окремо двома структурними генами — V і С. Згідно з цією
теорією, в геномі існує дуже багато V-генів (по одному для кожного можливого варіабельного
домену імуноґлобулінів) і кілька С-генів для константних ділянок легких і важких ланцюгів
імуноґлобулінів (по одному С-гену для κ- і λ.-ланцюгів і по одному С-гену для константних ділянок
важких ланцюгів кожного класу). У процесі дозрівання В-лімфоцита будь-який V-ген може
з'єднуватися з відповідним С-геном, унаслідок чого формується повноцінна ДНК, що кодує певний
поліпептидний ланцюг імуноґлобулінів. Модель Дрейєра і Беннета видавалася дуже привабливою,
оскільки описувала економніше використання геному, ніж вимагала теорія «зародкового
різноманіття». Однак вона йшла всупереч із центральною догмою молекулярної біології — «один
ген — один поліпептидний ланцюг», запропонованою Бідлом і Татемом (G. Bidl і Е. Tatem) у 1943 р.
і загальноприйнятою на той час.
Після того як було розроблено молекулярно-біологічні методи, що дають змогу підрахувати
кількість генів і визначити локалізацію їх у клітині, питання про механізми утворення різноманіття
антитіл було вирішено остаточно. Так, важливі дані отримано в дослідженнях із застосуванням
методів генної інженерії, зокрема клонування генів важких і легких ланцюгів імуноґлобулінів за
допомогою плазмід або фагів у бактеріях. Це дало змогу отримати гени в кількості, достатній для
проведення аналізу нуклеотидної послідовності та для гібридизаційних досліджень. Застосування
цих методів дало можливість вивчити молекулярні механізми організації генів імуноґлобулінів і
дослідити їх зміни під час дозрівання В-лімфоцитів.
Нині вважають загальноприйнятим, що синтез імуноґлобулінів кодують певні генетичні сегменти,
які об'єднуються разом ще в геномі під час розвитку лімфоцита й утворюють функціональний ген.
Процес перерозподілу генних сегментів у геномній ДНК називають реаранжуванням (від англ.
rearrangement — реконструкція) генів імуноґлобулінів. Як з'ясувалося пізніше, процес
реаранжування генних сегментів характерний не лише для утворення функціональних генів, що
кодують антитіла, а й для генів Т-клітинного рецептора.
8.2. МЕТОДИ ДОСЛІДЖЕННЯ ГЕНІВ ІМУНОҐЛОБУЛІНІВ І АНТИГЕНСПЕЦИФІЧНИХ
РЕЦЕПТОРІВ.
Під час вивчення будови та функції генів імуноґлобулінів було застосовано методи молекулярної
біології та генетичної інженерії. Це дало змогу встановити, що ланцюги імуноґлобуліну кодуються
генними сегментами, згрупованими в кластери. У процесі дозрівання В-лімфоцитів з певних
сегментів формується єдиний ген, що експресується в зрілих В-лімфоцитах. Необхідною умовою
для з'ясування механізмів утворення різноманіття антитіл було виділення мРНК різних ланцюгів
імуноґлобулінів та зіставлення геному В-лімфоцитів з геномом інших клітин організму.
Отримання мРНК важких і легких ланцюгів імуноґлобулінів. Методи виділення мРНК
ґрунтуються на фракціонуванні полірибосомних (полісомних) фракцій з лізату клітин методом
ультрацентрифугування. Далі ланцюги мРНК можна очистити за допомогою афінного сорбенту з
олігодезокситимідином (оліго-дТ-целюлози), який зв'язує мРНК завдяки наявності олігоаденілатної
послідовності в 3'-кінці мРНК.
Наступним етапом є проведення in vitro експресії виділеної мРНК у безклітинному трансляційному
середовищі, яке містить усі необхідні для синтезу білка амінокислоти, тРНК, рибосоми, АТФ, ГТФ
тощо. Для ідентифікації мРНК, що кодують певні ланцюги імуноглобулінів, С. Тонегава вперше
запропонував використовувати антиімуноглобулінові антисироватки, які зв'язують комплекс
полірибосом з частково синтезованими ланцюгами імуноґлобулінів.
Отримання кДНК генів антитіл. За допомогою зворотної транскриптази ретровірусів на матриці
мРНК антитіл можна отримати копії ДНК (кДНК). Далі отримують дволанцюгову кДНК за
допомогою РНКази Н, яка відщеплює рибонуклеотиди, та ДНК-полімерази II Е.соli, що добудовує
комплементарний ланцюг ДНК на одноланцюговій ДНК-матриці.
Клонування ДНК виділених генів. Отриману кДНК можна клонувати, тобто збільшити її кількість
у сотні разів, за допомогою відповідного вектора. Вектор — це молекула ДНК плазміди або вірусу,
в яку можна вбудувати потрібний ген для його перенесення в інші клітини, наприклад Е.соli. Цим
способом було отримано гени всіх класів і підкласів імуноґлобулінів мишей та людини, тобто
утворено бібліотеки цих генів.
У 1963 р. Арбер виявив явище рестрикції фагів, суть якого полягає в тому, що продуктивність фага
знижується в разі інфікування ним іншого штаму бактерій. Вивчення цього явища зумовило
відкриття у бактерій ферментів рестриктаз, які розрізають чужорідну ДНК на фрагменти у певних
місцях, що містять відповідну послідовність нуклеотидів. Деякі рестриктази розщеплюють
послідовність дволанцюгової ДНК з утворенням так званих «липких кінців», які здатні з'єднуватися з
аналогічними «липкими кінцями» будь-яких генів. Відкриття рестриктаз дало змогу розробити
підходи для генно-інженерних маніпуляцій з фрагментами ДНК, їх специфічного вирізання та
вбудовування у векторні молекули.
Як правило, копії кДНК певного гена вбудовують у плазміди, що містять селективні гени стійкості
до антибіотиків. Тому на середовищі з відповідним антибіотиком відбувається ріст тільки тих
бактерій, що отримали плазміду.
Плазміди виділяють з лізату клітин після вирощування культури з однієї колонії, розрізають їх
рестриктазами і вирізають ген-вставку. Таким чином можна отримати достатню кількість генів для
аналізу нуклеотидної послідовності.
Молекулярна гібридизація. При нагріванні розчину ДНК до точки плавлення (95 — 96 °С) її
ланцюги розділяються й залишаються розділеними в разі швидкого охолодження розчину. За
температури на 20 — 30 °С нижчої за точку плавлення відбувається молекулярна гібридизація —
специфічна реасоціація комплементарних одноланцюгових ДНК з утворенням дволанцюгових
молекул. Якщо до середовища додати радіоактивно мічені короткі ДНК- або РНК-зонди, які
комплементарні певним ділянкам досліджуваної молекули ДНК, то зі зниженням температури
можуть утворюватися комплекси зонда з геномною ДНК. Швидкість гібридизації зонда з геномною
ДНК залежить від кількості комплементарних зонду послідовностей у геномній ДНК. Результати
оцінюють, вимірюючи радіоактивність фільтрів після фільтрування крізь гідроксіапатит (гель
фосфату кальцію), який адсорбує лише подвійні спіралі ДНК.
Саузерн-блотинг (Southern blotting). Електрофоретичне розділення фрагментів ДНК дає змогу
визначити розміри кожного досліджуваного фрагмента. Для ідентифікації тих чи інших генетичних
фрагментів, розділених за допомогою електрофорезу, використовують метод Саузерн-блотингу.
Суть цього методу полягає в тому, що розділені електрофорезом фрагменти ДНК переносять на
мембрану і виявляють положення певного гена за допомогою гібридизації з радіоактивно міченим
зондом.
Для аналізу методом Саузерн-блотингу плазмідну ДНК розрізають рестриктазою і залежно від виду
рестриктази отримують певну кількість фрагментів ДНК. Фрагменти ДНК можна розділити в
електрофоретичному гелі відповідно до їхніх розмірів у зв'язку з тим, що в гелі дрібніші фрагменти
рухаються швидше. Розділені фрагменти ДНК переносять на нітроцелюлозну або нейлонову
мембрану, при цьому зберігається загальна схема їхнього взаємного розміщення в гелі. Положення
певного гена на мембрані визначають за допомогою радіоактивного зонда, комплементарного цьому
гену. ДНК зонда, що не зв'язалася, відмивають, а зв'язану з геном визначають радіоавтографією з
використанням рентгенівської плівки.
Дослідження С. Тонегави, які покладено в основу сучасних уявлень про реорганізацію генів
антигенспецифічних рецепторів. Першими, хто навів переконливі свідчення того, що в геномі В-
лімфоцитів дійсно відбувається перебудова генів імуноглобулінів, були С. Тонегава та Н. Хозумі (S.
Tonegawa та N. Hozumi, 1976), які працювали разом в Інституті імунології в Базелі. Вони за
допомогою рестрикційного аналізу довели, що в ембріональних клітинах і зрілих В-клітинах
(клітинах мієломи) V- і С-гени розміщені на різних відстанях один від одного. Цьому відкриттю
передували кілька років досліджень матричної РНК легких ланцюгів імуноґлобулінів, які С.
Тонегава розпочав у 1973 р. Йому вдалося виділити мРНК легкого ланцюга імуноґлобулінів,
провести його експресію в безклітинному середовищі in vitro, розщепити за допомогою рестриктаз
кДНК на сегменти, що кодують V- та С-частини ланцюга, гібридизувати різні фрагменти кДНК з
геномною ДНК і встановити приблизну кількість копій V-генів у хромосомі.
Метод молекулярної гібридизації був використаний С. Тонегавою і співавт. (1974) для визначення
кількості V
λ
- і С
λ
-генів у клітинах мієломи мишей. З лізатів клітин мієломи вони осаджували
полісоми, з яких отримували мРНК, що кодує λ-ланцюги імуноглобулінів. На матриці такої мРНК
отримували радіоактивно мічену комплементарну кДНК, яку використовували як зонд для
визначення кількості λ-генів у геномній ДНК методом молекулярної гібридизації. В результаті
виявилося, що кількість V
λ
-генів у гаплоїдному наборі зародкових клітин значно менша (приблизно
25), ніж передбачалося за теорією «зародкового різноманіття». Однак через відносно високу
похибку методу не вдалося зробити точніших висновків.
Методом Саузерн-блотингу під час гібридизації міченої мРНК λ-ланцюга з розщепленою
рестриктазами ДНК ембріональних і зрілих лімфоїдних клітин мишей було встановлено, що в
зрілих клітинах V- і С-гени виявлялися в одному рестрикційному фрагменті, а в ембріональних
клітинах — у різних. У дослідах використовували клітини мієломи – пухлинної лінії В-клітин, які
краще культивуються in vitro. Таким чином було доведено, що в ембріональних клітинах V- і, С-
гени розміщені на великій відстані (понад 5 тис. пар основ), а в геномі зрілих В-клітин у процесі
дозрівання вони об'єднуються в єдиний функціональний ген, однак все-таки залишаються
розділеними приблизно 1250 парами некодуючих нуклеотидів. Отже, в ході перебудови генів
імуноґлобулінів під час дозрівання В-клітин відбуваються делеції значної частини ДНК, розміщеної
між відповідними генними фрагментами. Такі делеції відбуваються внаслідок гомологічної
рекомбінації між поліндромними послідовностями, які фланкують (оточують) кожний генний
сегмент.
Клонування генів λ-ланцюгів несподівано виявило, що ділянки ДНК, яка кодує останні 13
амінокислот (послідовність 96—108) варіабельного домену λ-ланцюгів, у зародкових V-генах немає.
Цей загублений маленький фрагмент кодуючої послідовності ДНК було знайдено на відстані
кількох тисяч пар нуклеотидів від кінця V-гена і за 1300 кілобаз перед С-геном і названо J-геном
(від англ. joining — сполучний ген). Отже, варіабельний домен легких ланцюгів імуноґлобулінів
формується з двох генних сегментів — V- і J-, які певним чином об'єднуються з С-геном під час
дозрівання лімфоцитів. Це відкриття Тонегави і Брек стало істотним доповненням до моделі,
запропонованої Дрейєром і Беннетом. Аналогічними методами доведено, що формування генів, які
кодують V-домени важких ланцюгів, йде з трьох незалежних генетичних сегментів — V, D і J.
У 1987 p. C. Тонегава отримав Нобелівську премію в галузі фізіології та медицини за відкриття
«генетичних принципів утворення різноманітності антитіл» (for the discovery of the genetic principle
for generation of antibody diversity).
8.3. ОРГАНІЗАЦІЯ ГЕНІВ ІМУНОҐЛОБУЛІНІВ.
Із застосуванням методів молекулярної біології та генетичної інженерії було доведено, що важкі й
легкі ланцюги імуноґлобулінів кодуються трьома локусами (кластерами) генів: двома локусами —
κ і λ легких ланцюгів і локусом Н важких ланцюгів. Ці локуси розміщені на різних хромосомах, і
тому генетичний обмін між ними неможливий. Локус генів важких ланцюгів утворений з чотирьох
груп генетичних сегментів: V, D, J і С. Локуси генів легких ланцюгів побудовані простіше — вони
утворені трьома групами генетичних сегментів: V, J і С кожний.
Гени ланцюгів κ і λ у мишей розміщені відповідно на 6-й і 16-й хромосомах, а ланцюга Н — на 12-й.
У людини гени κ-ланцюгів знаходяться на 2-й, λ-ланцюгів – на 22-й, а важких ланцюгів – на 14-й
хромосомі (мал. 63). Гени імуноґлобулінів мишей і людини організовані принципово подібно.
Відмінність полягає лише в кількості функціональних генетичних сегментів того чи іншого типу.
Організація локусу λ-генів. Локус генів X-ланцюгів імуноґлобулінів миші побудований простіше
за інші і тому був досліджений першим. У мишей знайдено всього 2 V
λ
- і 4 С
λ
-сеґментів. Кожному
V
λ
-сеґменту передує лідерний L-сеґмент. Поруч з V
λ
1-сеґментом розміщені С
λ
1- і С
λ
3-сеґменти
генів, а поруч з V
λ
2- – С
λ
2- і С
λ
4-сегменти. Перед кожним С
λ
- є свій J
λ
-сеґмент.
У геномі людини локус λ-ланцюгів побудований складніше (табл. 45). У людини є близько 30 V
λ
-
генних сегментів, 7 J
λ
- і 7 С
λ
-сеґментів, однак серед останніх функціональними є лише чотири пари
J
λ
-і С
λ
-сеґментів. Інші J
λ
- і С
λ
-сегменти ніколи не експресуються і належать до «псевдогенів».
Функціональний ген легкого λ-ланцюга формується шляхом приєднання певного V- до J-сеґмента.
До складу первинного транскрипту такого гена (пре-мРНК) входять як кодуючі (екзони), так і
некодуючі (інтрони) послідовності нуклеотидів. Функціональний λ-ген, який здатний
транскрибуватися, складається з таких частин: невеликого екзона, що кодує лідерну або сиґнальну
послідовність λ-ланцюгів (L-сеґмент), інтрона з 93 нуклеотидів, що відокремлює лідерну
послідовність від V-сеґмента, з екзона, що кодує 95 перших амінокислот NH
2
-кінцевої ділянки λ-
ланцюга (V-сеґмент), ще одного екзона з 39 нуклеотидів, що кодує наступну послідовність 96—108
амінокислот λ-ланцюга (J-сеґмент), інтрона з 1250 пар нуклеотидів, який відокремлює VJ-фраґмент
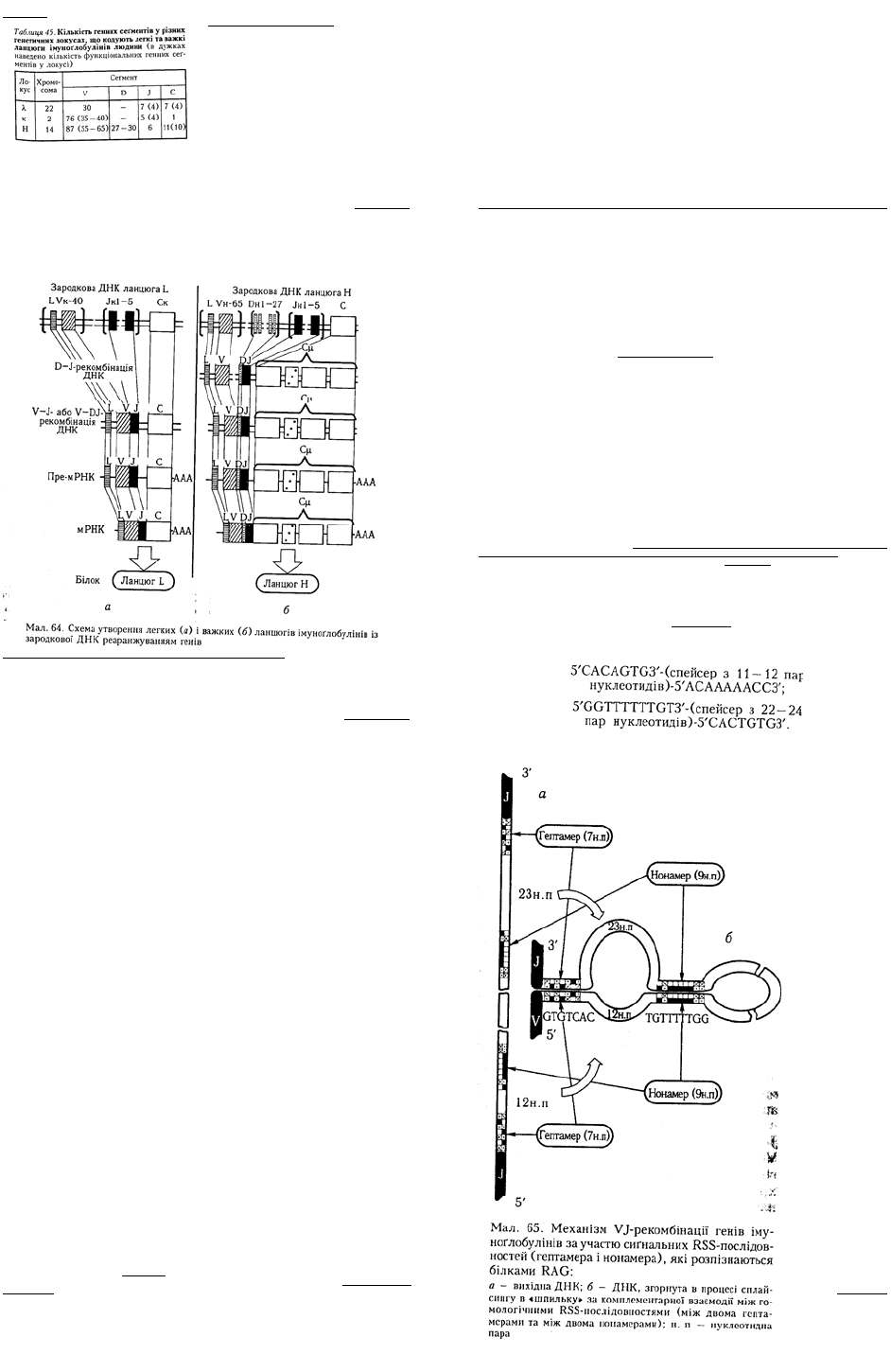
35
від генного сегмента С, та власне екзона, що кодує константну ділянку (С-сеґмент). Під час
сплайсингу пре-мРНК інтрони вирізаються.
Організація локусу κ-генів. Гени κ-ланцюгів
імуноґлобулінів побудовані принципово подібно
до генів λ-ланцюгів, але дещо складніше. Дані
експериментальних досліджень алотипів і
клонування V-генів свідчать про наявність у
мишей великої кількості V
κ
-сеґментів, які
належать до кількох груп. Кожному V
к
-сеґменту
передує лідерний L-сеґмент. У складі кластеру κ-
генів мишей є п'ять гомологічних (але не
однакових) J-сеґментів, з яких функціональними є
лише чотири. Будь-який V
κ
-сеґмент може
сполучатися з будь-яким J-сеґментом, що
збільшує варіабельність гіперваріабельної
ділянки вчетверо, оскільки J-сеґмент кодує
частину третьої гіперваріабельної ділянки легкого
ланцюга (СDR3-петлі). J-сегменти розміщені разом, але розділені інтронами по 300 пар нуклеотидів
і знаходяться на відстані 4,5 тис. пар нуклеотидіі від V-сеґментів генів та 2,5 тис. пар нуклеотидів
від С
к
-сеґмента. V
κ
-сеґмент кодує послідовність з перших 95 амінокислот NН
2
-кінцевої ділянки
легкого κ-ланцюга. Наступні 96—108-ма амінокислоти кодуються J-сеґментом. С
к
-сеґмент, що
кодує константний домен κ-ланцюга (амінокислотну послідовність 109 — 213), відокремлений від J-
сеґмента інтроном у 2,5 тис пар нуклеотидів.
У людини знайдено приблизно 76 – 80 V
κ
-генних сегментів, багато з яких (понад 30) є псевдогенами,
оскільки мають у своїй структурі стоп-кодони або не мають необхідних промоторів. Кількість J
κ
-
сегментів у геномі людини, як і в геномі мишей, дорівнює 5, функціональними з яких є лише 4, а С
κ
-
генний сеґмент представлений тільки однією копією (див. табл. 45).
Гени легких ланцюгів імуноглобулінів перебудовуються в певній послідовності. Спочатку
об'єднуються відповідні сегменти VJ, а потім транскрибується сумарний ген L-iнтpoн-VJ-інтрон-С.
Далі йде формування зрілої мРНК, яка складається тільки з екзонів LVJC. Після синтезу білка від
нього відщеплюється N-кінцева лідерна послідовність, яка утримувала щойно синтезований білок
заякореним у мембрані ендоплазматичного ретикулуму (мал. 64, а).
Організація локусу генів важких ланцюгів імуноґлобулінів. Різноманітна функціональна
специфіка Н-ланцюгів та їхня значна довжина зумовили складну організацію їхніх генів. Подібно до
локусів λ- і κ-генів, локус Н-генів побудований з великої кількості генних сегментів. «Зрілий» ген,
що утворюється після об'єднання потрібних генетичних сегментів, також складається з екзонів та
інтронів.
У мишей і людини близько півтисячі V
H
-генних сегментів, але функціональними з них є не більш як
100. Інші V
H
-ceгменти називають псевдогенами. Вони ніколи не експресуються, але, можливо,
можуть бути джерелом додаткової генетичної різноманітності завдяки процесам генної конверсії.
Існування генної конверсії у людини й мишей не доведено, однак у кролів та деяких видів птахів
вона є головним джерелом різноманіття імуноґлобулінових рецепторів.
Різні класи та підкласи антитіл різняться за будовою константної частини важкого ланцюга, яка
кодується певними С
н
-генними сегментами. Специфіка організації С
Н
-генних сегментів полягає в
тому, що при диференціюванні антитілоутворювальної клітини можливе послідовне переключення
синтезу різних класів антитіл (наприклад, з Сμ-сегмента гена на Сγ- і Сα-сегменти генів), а також
переключення з мембранних форм імуноґлобулінів на секреторні. Усі С
н
-сегменти генів в
ембріональних клітинах розміщені окремою групою на відстані кількох тисяч пар основ від V
H
-
сегментів генів. Ділянки ДНК між окремими С
н
-сегментами генів мають довжину в кілька десятків
тисяч пар основ.
Кожний С
н
-генний сегмент, у свою чергу, побудований з екзонів та інтронів. Кількість екзонів
відповідає кількості константних доменів певного важкого ланцюга. Наприклад, у Сγ-сегменті
міститься чотири екзони: по одному для С
Н
1-, С
Н
2-та С
Н
3-доменів і один для шарнірної ділянки між
С
Н
1- і С
н
2-доменами. Кожний з екзонів, що кодує імуноглобуліновий домен константного типу,
складається приблизно з 320 пар основ, а інтрони С
Н
-генів містять 100 — 300 пар нуклеотидів.
Група ембріональних V
Н
-генних сегментів розміщена на відстані 12 — 16 тис. пар нуклеотидів від
С
Н
-сегментів. Кожний V
H
-сегмент, як правило, кодує від 1 до 99 амінокислотних залишків важкого
ланцюга. Решта кодується сегментом D (від англ. diversity — різноманіття), який складається з
кількох пар нуклеотидів, що кодують послідовність приблизно в межах 100 — 107 варіабельного
домену важких ланцюгів, і сегментом J, який кодує послідовність 108—123 цього самого домену.
Сумарно D- і J-сеґменти кодують послідовність третьої гіперваріабельної петлі важкого ланцюга
(СDR3-регіон). Як і в локусі генів κ-ланцюгів, у локусі генів Н-ланцюгів миші є п'ять пар
гомологічних J-сеґментів, з яких функціонують лише чотири (у людини функціональні шість J-
сеґментів). У генах Н-ланцюгів близько 30 D-сеґментів (функціональними є не більш як 15). У
геномній ДНК кластери D- і J-сеґментів розміщені між кластерами V
Н
- і С
Н
-сегментів генів. Отже, у
створенні функціонального гена, який кодує варіабельний домен важкого ланцюга імуноглобулінів,
беруть участь три генних сегменти: V
H
, D
H
і J
H
.
Встановлено послідовність розміщення С
Н
-генних сегментів у геномі миші (5'-Сμ-Сδ-Сγ3-Сγ1-Сγ2b-
Сγ2а-Сε-Сα-3') та в геномі людини (5'-Сμ-Сδ-Сγ3-Сγ1-ψСε-Сα1-Сγ2-Сγ4-Сε-Сα2-3'). Отже, в геномі
людини міститься на два С
Н
-генних сегменти більше, ніж у геномі миші, причому генний сегмент
ψСε, ймовірно, є псевдогеном. Перед кожним генним сегментом, який кодує синтез константної
частини важких ланцюгів імуноґлобулінів, містяться характерні послідовності, так звані S-райони
(від англ. switch - переключення), що забезпечують процес переключення синтезу різних класів
антитіл.
Загалом зрілий функціональний ген Н-ланцюгів складається з 7 — 8 екзонів і 5 — 6 інтронів. При
утворенні PHК-копії цього гена інтрони транскрибуються разом з кодуючими послідовностями гена.
Вони вирізаються під час дозрівання РНК у процесі сплайсингу (див. мал. 64, б).
Переключення генів важких ланцюгів. Важливі дані про механізми реґулювання синтезу антитіл
було отримано в результаті аналізу закономірностей успадкування алогенних маркерів антитіл.
Наявність алотипових маркерів на Н- і L-ланцюгах дала змогу встановити, що однакова варіабельна
ділянка може бути асоційована з константними ділянками різних класів, наприклад Сμ, Сγ, Сα і Сε.
Отже, один і той самий сформований V
Н
-ген може об'єднатися з різними С
Н
-генними сегментами.
V
Н
і С
Н
-генні сегменти роміщені на одній хромосомі, в результаті чого в середині локусу Н-генів
виникають певні перебудови і формується один функціональний ген, який кодує важкий ланцюг
імуноґлобулінів певного класу чи підкласу. В ембріональних клітинах J-сеґменти містяться лише
перед Сμ-генним сегментом. Тому внаслідок рекомбінації та об'єднання V
Н
-, D
H
- і J
H
-генних
сеґментів з Сμ-сегментом В-клітина спочатку експресує лише важкий ланцюг μ-типу і синтезує
тільки IgM. Переключення синтезу з імуноґлобулінів класу М на всі інші типи імуноґлобулінів
здійснюється після перенесення V-D-J сегмента від Сμ-генного на інші С
Н
-генні сегменти внаслідок
наступних рекомбінацій між послідовностями, які передують іншим ембріональним С
Н
-сеґментам.
Ділянки, за допомогою яких відбувається таке переключення (S-райони), позначають за
відповідними сегментами, що кодують константні фрагменти важких ланцюгів антитіл, наприклад
Sμ, Sγ, Sα, Sε. Структура кожного з цих районів різна. Більше того, молекулярні механізми
переключення класів імуноґлобулінів здебільшого залишаються ще не з'ясованими. Вважають, що
попередньо об'єднані V
H
-D
H
-J
H
-сегменти спочатку сполучаються з послідовністю Sμ-Сμ, а потім
відбувається рекомбінація ділянки всередині J-Sμ і з прилеглою ділянкою іншого С
Н
-гена, в
результаті V
H
-D
H
-J
H
-сегмент з більшою частиною S-сеґмента переміщується ближче до наступного
С
Н
-сегмента, після чого експресується наступний об'єднаний ген.
Переключення синтезу ІgМ та IgD. Комплекс, що складається з об'єднаних генних сегментів VDJ,
може експресуватися з будь-яким із десяти С-сеґментів, однак спочатку перебудований комплекс
VDJ розміщується поблизу Сμ- і Сδ-генних сегментів, чим і зумовлено те, що на поверхні наївних
В-лімфоцитів експресуються IgM та IgD. Під час транскрипції утворюється первинна РНК, яка
відповідає VDJСμСδ-гену, що включає екзони, здатні кодувати константну частину як М-, так і D-
важкого ланцюга. У процесі сплайсингу під час формування зрілої мРНК вирізаються ділянки гена,
що кодують константну частину або μ-, або δ-ланцюга. Цей процес називають альтернативним
сплайсингом. Альтернативний сплайсинг зумовлює одночасну експресію мембранних молекул IgM
та IgD однією клітиною.
Після експресії IgM та IgD В-клітина може переключитися на синтез інших класів імуноґлобулінів
залежно від типу С
Н
-сегмента, з яким далі з'єднається VDJ-фраґмент. Переключення на синтез
антитіл іншого класу зумовлюється транслокацією фрагмента VDJ з положення 5' щодо генного
сегмента Сμ в аналогічне положення щодо іншого генного сегмента константної частини важкого
ланцюга. Переключення синтезу імуноґлобулінів з IgM (IgD) на інші класи незворотне, оскільки
клітина втрачає частину геному, що відповідає С
Н
-генним сегментам, які експресувалися раніше.
Переключення з мембранної на секреторну форму імуноґлобулінів. Певні генетичні механізми
контролюють переключення синтезу мембранних m-імуноґлобулінів (тих, що є рецепторами В-
клітин) на s-імуноґлобуліни (секреторні). Синтез різних форм імуноґлобулінів кодується
відповідними варіантами мРНК-транскрипту генів Н-ланцюгів певного класу чи підкласу антитіл.
Для створення мРНК-мембранних і тих, що секретуються, імуноґлобулінів використовується
механізм альтернативного сплайсингу (аналогічно для переключення синтезу IgM та IgD). Цей
процес був детально описаний для переключення синтезу різних форм IgM. Суть процесу полягає в
тому, що при транскрипції Сμ-гена і 187 нуклеотидів, які прилягають до нього, утворюється мРНК
для мембранозв'язаних важких ланцюгів. Разом з тим при транскрипції Сμ-гена і додаткових кількох
сотень нуклеотидів, що прилягають до нього, після перебудови гена в результаті вирізання двох С-
кінцевих інтронів створюється мРНК для секреторних ланцюгів. Цим способом у клітині можуть
синтезуватися дві різні молекули важких μ-ланцюгів. Як правило, наївні В-клітини синтезують
лише мембранні форми антитіл, які виконують функцію їхніх антигенспецифічних рецепторів. Вони
відрізняються тим, що на СООН-кінці мембранні імуноглобуліни містять 41 залишок гідрофобних
кінцевих амінокислот, а секреторні — 20 залишків гідрофільних амінокислот. Механізм
альтернативного сплайсингу використовується також для переключення експресії мембранних
імуноґлобулінових рецепторів на синтез відповідних антитіл будь-якого класу (крім IgD, які можуть
бути лише мембранними). Після антигенної стимуляції В-клітини перетворюються на плазматичні
клітини і продукують лише секреторні форми імуноґлобулінів. Таким чином, при диференціюванні
В-клітин у плазмоцити відбуваються певні зміни в механізмах, що контролюють сплайсинг
первинного мРНК-транскрипту.
Перегрупування генів різних ланцюгів імуноґлобулінів має ієрархічний і впорядкований характер.
Наприклад, у пре-В-клітинах процеси рекомбінації відбуваються спочатку в межах локусу Н-генів, а
потім у межах локусів κ- та λ-генів. Такий порядок свідчить про наявність у межах різних хромосом
спільної координуючої системи сигналів.
8.4. МЕХАНІЗМИ УТВОРЕННЯ РІЗНОМАНІТНОСТІ АНТИТІЛ І В-КЛІТИННИХ
РЕЦЕПТОРІВ.
Під час диференціювання В-клітин відбувається реаранжування генів імуноґлобулінів. Для синтезу
молекули імуноґлобуліну формується функціональний ген кожного ланцюга після транслокації
певного генного сегмента V до відповідного С-сеґмента. Цей процес здійснюється внаслідок
перенесення й приєднання V
κ
- або V
λ
-сеґментів до J-сеґментів, a V
H
-сеґментів — до попередньо
об'єднаних DJ-ceгментів. Утворення різних комбінацій V
K
J-або V
λ
J-сегментів та V
H
DJ-сеґментів
призводить до створення функціональних генів, що кодують варібельні домени відповідно легких і
важких ланцюгів імуноґлобулінів. При цьому місце з'єднання різних генних сеґментів кодує третю
гіперваріабельну ділянку V-домену кожного ланцюга імуноґлобулінів. Вважають, що будь-який V
K
-
сегмент може рекомбінувати з будь-яким J
K
-сегментом, V
λ
-сегмент — з будь-яким J
λ
-сеґментом, а
будь-який V
Н
-сеґмент — з будь-яким попередньо об'єднаним D
H
J
H
-сегментом (див. мал. 64).
У процесі розвитку В-клітин спочатку перебудовуються гени важкого ланцюга імуноґлобулінів. У
разі непродуктивності перебудови генів на одній хромосомі включається перебудова генів на іншій.
Цікаво, що перший етап перебудови, а саме D-J-рекомбінація, відбувається паралельно в обох
хромосомах. Далі цей процес в одній хромосомі зупиняється, «очікуючи свого часу». В нормі
клітина має експресувати лише один тип функціонально перебудованих генів важкого й легкого
ланцюгів. Це явище називають алельним виключенням генів імуноґлобулінів. Біологічний сенс
алельного виключення зводиться до того, щоб кожна лімфоїдна клітина несла рецептори лише
однієї специфічності. Природа алельного виключення довго залишалась невідомою. Нині вважають,
що, можливо, алельне виключення генів імуноґлобулінів можна пояснити механічними
перешкодами для одночасної Деконденсації хроматину двох гомологічних хромосом, яке є
необхідною умовою перебігу реаранжування (в нормі відбувається перебудова генів лише однієї з
пари гомологічних хромосом).
Після вдалої перебудови генів важкого ланцюга починається перебудова генів легкого κ-ланцюга на
одній із батьківських хромосом. Аналогічно, якщо така рекомбінація виявиться невдалою,
відбувається рекомбінація генів κ-ланцюга в іншій гомологічній хромосомі. Останніми до
рекомбінації залучаються гени λ-ланцюга. Це відбувається лише в разі, якщо не відбулося успішної
рекомбінації генів κ-ланцюга. Якщо будь-яка рекомбінація не формує функціональний ген важкого
чи легкого ланцюгів з правильними рамками зчитування, то клітина гине шляхом апоптозу.
Молекулярні механізми з'єднання V- і J-сеґментів генів легких ланцюгів або V-, D-, J-генних
сеґментів важких ланцюгів можуть бути зумовлені внутрішньохромосомними делеціями. Процес
об'єднання генних сеґментів забезпечується наявністю на краях кожного сегмента необхідних
специфічних послідовностей нуклеотидів, що призводить до їх рекомбінації.
Молекулярні механізми перебудов генів антитіл та ВкР. І. Кебат (Е. Kabat, 1980) висловив
гіпотезу, згідно з якою реорганізація генів імуноґлобулінів зумовлена певними міні-
послідовностями, які розміщені по краях сеґментів, що рекомбінують. Експериментальні дані
свідчать про те, що реорганізація генів здійснюється переважно за рахунок консервативних
маленьких поліндромних повторів, представлених двома невеликими блоками нуклеотидів з 7 та 9
пар основ (гептамер і нонамер), які розміщені на 3'-кінці V-ceгментів, і такими самими
інвертованими блоками (нонамер і гептамер) 9 і 7 нуклеотидів на 5'-кінці J-сегментів. Гептамер і
нонамер розділені ділянками сталої довжини, які називають спейсерами, що складаються з 11 — 12 і
22 — 24 пар нуклеотидів. Така рекомбінація може відбуватися за правилом, яке дістало назву
«правило 11/23», тобто в рекомбінацію вступають лише такі гептамер і нонамер, які розділені
спейсерами різної довжини. Рекомбінацію зумовлюють ферменти рекомбінази RAG1 і RAG2, які є
продуктами генів rag1 і rag2 (від англ. recombination activiry genes), що активуються лише при
дозріванні лімфоцитів (як Т-, так і В-клітин). Фактично V-, D- і J-генні сегменти нагадують
транспозони, оскільки можуть переміщуватися в межах геномної ДНК під дією RAG-рекомбіназ.
Сегменти генів, що вступають у рекомбінацію, на своїх кінцях містять спейсери різної довжини. Так,
ембріональні V
K
-гени на 3'-кінцях містять блок зі спейсерами з 11 — 12 пар нуклеотидів, а на 5'-
кінцях J-генів знаходиться спейсер з 22—24 пар нуклеотидів (мал. 65). Фланкувальні послідовності,
що оточують V-, D- і J- генні сегменти, називають RSS-послідовностями (від англ. recombination
signal sequences):
У V-сегментах генів λ-ланцюгів на 3'-кінцях містяться спейсери з 22—24, а на 5'-кінцях J-сеґментів
— спейсери з 11 —
12 пар нуклеотидів.
У генах важких
ланцюгів на 3'-кінцях
V-сеґментів і 5'-
кінцях J
Н
-сегментів
гептамер і нонамер
розділені спейсерами
по 22 пари
нуклеотидів, D-
сегменти мають
спейсери з обох
боків, що
складаються з 11
нуклеотидів.
Рекомбінація V-J- і
V-D-J-генів
відбувається після
зближення їхніх
взаємно інвертованих
комплементарних
кінців. Зі з'єднаних
спейсерів
утворюється
структура, в якій
відповідні ферменти
вирізають непотрібні
ділянки, внаслідок
чого формується
єдиний
функціональний ген.
Рекомбінази RAG1 і
RAG2 складаються з
двох субодиниць
кожна. Однією
субодиницею вони
розпізнають
відповідні
послідовності RSS, а
за допомогою іншої
— наближаються
одна до одної. Це і
призводить до
просторового
наближення
послідовностей, що
рекомбінуються, та
формування петлі
між ними. Крім
ферментів RAG1 і
RAG2 до
рекомбіназного
комплексу залучені
інші білки, наприклад
екзонуклеази, які
відщеплюють
нуклеотиди в
надрізаній ДНК, та
термінальна
дезоксинуклеотидтра
нсфераза (TdT), яка
«випадково»
добудовує
нуклеотиди. Ці
ферменти вносять
певні «помилки» у
процес рекомбінації,
що істотно збільшує
варіабельність CDR3-
paйону кожного ланцюга. Механізм об'єднання генних сегментів у локусах генів легких і важких
ланцюгів аналогічний.
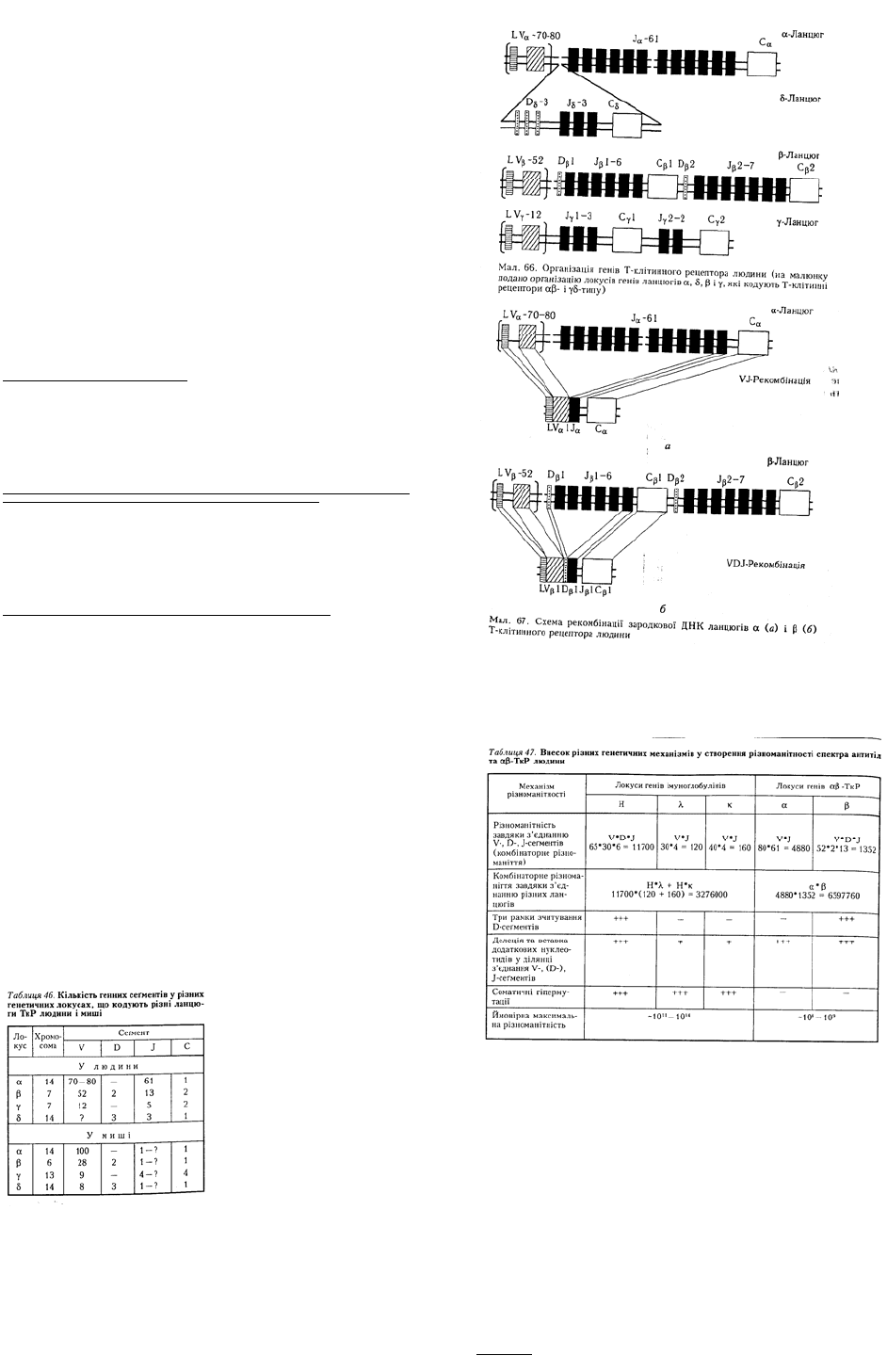
36
У процесі дозрівання лімфоцитів ДНК цих соматичних клітин реорганізується, після чого V-
сеґменти генів об'єднуються з J- і D-сеґментами, але між ними й С-сеґментами залишається великий
інтрон. Транскрибується єдиний V-J-C-ген, а «непотрібна» ділянка РНК між V-J і С-сегментами
вирізається й видаляється під час сплайсингу пре-мРНК. Сплайсинг здійснюється на рівні пре-
мРНК, в якій V-J-С-генні сегменти з'єднуються безпосередньо. Після синтезу білка видаляється його
N-кінцева лідерна послідовність, яка є продуктом L-генного сегмента.
Антигеннезалежна перебудова генів імуноґлобулінів відбувається під час розвитку В-клітин у
первинних лімфоїдних органах (кістковому мозку), а антигензалежна — у вторинних.
Антигеннезалежна перебудова призводить до формування функціональних IgM- та IgD-рецепторів
наївних В-клітин. Після стимуляції антигеном відбувається переключення синтезу з мембранної на
секреторну форму IgM або переключення синтезу на інші класи антитіл. Крім того, переключення
класів антитіл супроводжується процесами дозрівання афінності активних центрів антитіл.
Дозрівання афінності зумовлено соматичним мутагенезом і відбором найбільш афінних рецепторів.
Соматичні гіпермутації в генах імуноґлобулінів. Нині вважають, що створення різноманітності
антитіл забезпечується не тільки значною кількістю різних генних сегментів V, D, J та їхньою
комбінаторикою, а й може бути результатом точкових соматичних мутацій та «помилок» під час V-
D-J-рекомбінацій.
У 70 —80-х роках XX ст. у багатьох лабораторіях світу було проведено порівняння первинної
структури генів зрілих В-лімфоцитів, які кодують імуноглобуліни, з відповідними генетичними
сегментами, що містяться в геномі ембріональних клітин. Доведено, що поряд з послідовностями,
що знаходяться в геномі ембріональних клітин, у генах зрілих В-лімфоцитів є також послідовності,
зумовлені соматичними мутаціями V-сегментів і помилками, які виникають під час рекомбінацій V-
D-J генних сегментів.
Роль соматичних мутацій у генах імуноглобулінів вперше показали М.Вайгерт і співавт. (1970) при
порівнянні амінокислотних послідовностей легких λ-ланцюгів, що продукуються мієломними
клітинами однієї інбредної лінії мишей. У 12 з 18 досліджуваних мієломних білків λ-ланцюги були
ідентичними, а у 6 — було виявлено заміни однієї, двох і чотирьох амінокислот у гіперваріабельних
ділянках. Пізніше Брек і Бернард (1977) показали, що в ембріональному геномі мишей цієї інбредної
лінії насправді є лише один V-ген λ-ланцюгів. Він кодує саме такі ланцюги, які М. Вайгерт виявив у
12 мієломних білках. Таким чином було доведено, що інші 6 варіантів мієломних білків виникли
внаслідок соматичних мутацій. Соматичні мутації практично не відбуваються в ділянках, що
кодують сталі ділянки імуноґлобулінових ланцюгів, а стосуються зазвичай гіперваріабельних
ділянок.
Соматичні мутації виявлено не тільки в генах, що кодують V
H
-домени мієломних білків, а й у генах
гібридомних білків, наприклад тих, що кодують антитіла проти субстанції клітинних стінок
багатьох бактерій — фосфорилхоліну. Мутації виникають як в екзонах, так і в інтронах, однак
частіше відбуваються в першій і другій гіперваріабельних ділянках (CDR1 і CDR2). Отже, можна
припустити, що в геномі має бути спеціальний механізм, який забезпечує гіпермутабельність CDR-
ділянок. Певні експериментальні дані свідчать про те, що процеси гіпермутагенезу перебувають у
корелятивній залежності від переключення синтезу важких ланцюгів з μ-ланцюга на інші класи
імуноглобулінів. У зрілих наївних В-клітинах, у яких не активуються гени RAG1 і RAG2, процеси
переключення класів імуноглобулінів, а також дозрівання афінності імуноґлобулінових рецепторів
В-клітин не відбуваються. Процеси соматичного гіпермутагенезу також залежать від ферменту —
індукованої активацією дезамінази цитидину (AICD, від англ. activation-induced cytidine deaminase).
Вважають, що цей фермент вносить зміни в певні ділянки ДНК, які потім репаруються з помилками.
Це і призводить до підвищення мінливості певних ділянок ДНК, що кодують варіабельні домени
імуноґлобулінів.
Нині з'являються дані, що, ймовірно, процес гіпермутагенезу відбувається складніше: дезаміназа
цитидину модифікує певну РНК, яка набуває після цього ендонуклеазної каталітичної активності і
розрізає геномну ДНК в кількох місцях. Під час репарації розривів відбувається внесення певних
змін у структуру ДНК. Що саме зумовлює специфічність помилок під час гіпермутагенезу,
остаточно ще не з'ясовано, однак вважають, що біля точок, в яких відбуваються мутації, є певні
сигнальні послідовності нуклеотидів у геномній ДНК. Нещодавно було з'ясовано, що найбільш
«уразливими» для гіпермутацій є послідовності нуклеотидів певного зразка: A(G)-G-C(T)-A(T).
«Помилки» під час рекомбінації. Під час рекомбінації різноманітність активних центрів антитіл
істотно збільшується внаслідок «помилок» при об'єднанні V-генів з відповідними D- і J-сеґментами.
Оскільки місця з'єднання V-D-, D-J- і V-J-ceгментів точно не детерміновані, вони можуть
зміщуватися в частину 5'- і 3'-ділянок «сусідніх» генетичних сегментів. Крім того, під час
об'єднання V-сеґментів з відповідними D- і J-сегментами можуть виникати вставки додаткових
нуклеотидів між сегментами, що об'єднуються, а також втрати нуклеотидів через активність певних
екзонуклеаз. Якщо при цьому не порушується «рамка зчитування» для константної частини
ланцюга, то виникає додаткова варіабельність у третій гіперваріабельній ділянці V-доменів. При
цьому D-сеґменти в сформованому гені важкого ланцюга імуноґлобулінів потенційно здатні
зчитуватися в усіх трьох можливих рамках зчитування, що також підвищує варіабельність СDR3-
реґіону.
Усі продукти генів важких і легких ланцюгів імуноґлобулінів мають імуноґлобуліновий тип
укладання V-доменів. Каркасні послідовності формують антипаралельні β-складчасті структури,
між якими утворюються варіабельні петлі. Саме в зоні цих петель і спостерігається найбільша
частота амінокислотних замін, зумовлених соматичними мутаціями та помилками під час
рекомбінацій.
8.5. ОРГАНІЗАЦІЯ І ПЕРЕБУДОВА ГЕНІВ Т-КЛІТИННИХ РЕЦЕПТОРІВ.
Серед клітин імунної системи специфічні до антигену рецептори мають крім В-лімфоцитів також Т-
лімфоцити. Як уже зазначалося, рецептори Т-клітин розпізнають антигенні пептиди в комплексі з
молекулами гістосумісності класів І і ІІ. Рецептори Т-клітин, очевидно, також можуть бути
представлені великою кількістю варіантів, оскільки антигени МНС можуть представляти значну
кількість антигенних пептидів. Оскільки Т-клітини мають бути специфічними до конкретного
антигенного пептиду та конкретного алелю МНС, сумарна кількість їхніх варіантів має бути
приблизно такою самою, як і кількість варіантів антитіл. Це було з'ясовано вже в 60-х роках, однак
рецептори Т-клітин довго не вдавалося ідентифікувати, оскільки вони представлені лише
мембранозв'язаними формами.
Специфічність Т-клітин до певних антигенів спонукала також до пошуку генетичних механізмів, які
збільшують різноманіття їхніх рецепторів. Багато дослідників передбачали, що гени, які кодують
рецептори Т-клітин, побудовані аналогічно генам антитіл. Проте довгий час не вдавалося
ідентифікувати поверхневі структури, які б зумовлювали здатність Т-клітин розпізнавати антигени.
Експериментально виявити рецептори Т-клітин уперше вдалося Дж. Аллісону, Дж. Каплеру і Е.
Рейнгерц. Вони отримали антитіла, які зв'язувалися лише з поверхнею певних Т-лімфоцитів, але не
В-лімфоцитів чи інших клітин. За допомогою таких антитіл вдалося виділити певний білок з
мембран Т-лімфоцитів і встановити, що молекулярна маса цього білка становить близько третини
маси імуноґлобулінів. Нині встановлено, що рецептор Т-клітин утворений двома субодиницями і
нагадує Fab-фрагмент антитіла.
У 1984 р. Т. Мак і М. Девіс клонували ген, який перебудовувався лише в Т-клітинах, але не у В-
клітинах. Такого гена не було в інших соматичних клітинах, що свідчило про те, що він кодує саме
ті структури, які є різними в різних клонах Т-лімфоцитів. Цікаво, що Т. Мак виділив цей ген з
лейкозних Т-клітин людини, а М. Девіс — з Т-клітинної гібридоми. Виявилося, що гени, які були
клоновані обома дослідниками, кодують один і той самий білок. Установлення нуклеотидної
послідовності цих генів виявило їхню гомологію до генів, що кодують синтез імуноґлобулінів.
Першим клонованим геном ТкР виявився ген, що кодує β-ланцюг ТкР. Потім X. Саіто і Д. Кранц
клонували гени Т-клітин, що кодують γ-ланцюг ТкР. Пізніше було ідентифіковано гени, що кодують
синтез α-ланцюгів, які разом з β-ланцюгами утворюють гетеродимерний комплекс — αβ-ТкР.
Функціональне значення γ-ланцюгів залишалось певний час невідомим, аж доки в межах локусу
генів α-ланцюгів не було ідентифіковано гени, що кодують δ-ланцюги Т-клітинного рецептора.
Виявилося, що γ- і δ-ланцюги утворюють гетеродимерний комплекс, який є альтернативним
варіантом Т-клітинного рецептора і який називають γδ-ТкР. Т-клітини, що експресують γδ-ТкР,
представляють окрему популяцію лімфоцитів, функцію яких ще остаточно не з'ясовано.
Виявилося, що гени Т-клітинних рецепторів, як і гени імуноґлобулінів, в ембріональному геномі
також представлені значною кількістю генних сегментів, які рекомбінують під час розвитку Т-
клітин. Відповідно генні сеґменти V, D і J кодують варіабельні домени ТкР, а С-сегменти —
константні домени. До константного домену кожного ланцюга рецептора Т-клітин приєднана
послідовність гідрофобних амінокислот, які заякорюють його в мембрані Т-клітин. Отже, рецептори
Т-клітин представлені лише в мембранозв'язаній формі і під час дозрівання Т-клітин переключення
різних С-сеґментів не відбувається.
Гени ТкР людини і миші побудовані принципово подібно. Вони складаються з чотирьох локусів, що
кодують α-, β-, γ- і δ-ланцюги Т-клітинного рецептора. В геномі людини локус генів β-ланцюгів ТкР
розміщений на 7-й хромосомі, α-ланцюгів —
на 14-й, γ-ланцюгів на 7-й хромосомі і гени δ-
ланцюгів ТкР розміщені в середині локусу
генів α-ланцюгів, тобто на 14-й хромосомі
(табл. 46).
У мишей локус генів β-ланцюгів ТкР
розміщений на 6-й хромосомі, α-ланцюгів —
на 14-й, γ-ланцюгів — на 13-й хромосомі і
гени δ-ланцюгів ТкР розміщені в середині
локусу генів α-ланцюгів, тобто на 14-й
хромосомі (див. табл. 46).
Локуси генів α- і γ-ланцюгів представлені
сегментами V, J і С, а отже, подібні за
організацією до генів легких ланцюгів
імуноґлобулінів. При цьому локус γ-ланцюгів
містить кілька варіантів Сγ-сеґментів,
кожному з яких передує кілька Jγ-сегментів
(аналогічно до організації генів λ-ланцюгів
імуноґлобулінів), а локус α-ланцюгів містить
значну кількість (близько сотні) Vα-
сегментів, кілька Jα-сеґментів і один Сα-
сегмент (нагадує організацію локусу генів κ-
ланцюгів імуноґлобулінів) (мал. 66).
Локуси генів β-, і δ-ланцюгів складаються з
чотирьох кластерів генних сегментів V, D, J і
С (подібно до організації локусу Н-ланцюгів
імуноґлобулінів). Тому СDR3-реґіони β- і δ-
ланцюгів більш мінливі, ніж α- і γ-ланцюгів, оскільки місце з'єднання трьох генетичних сегментів V,
D і J кодує третю гіперваріабельну петлю в активних центрах ТкР.
Характерно, що локус генів δ-ланцюгів розміщений на тій самій хромосомі, що й локус генів α-
ланцюгів, і знаходиться між кластерами Vα і Jα -сеґментів, тому його було ідентифіковано останнім.
Молекулярні механізми перебудови генів ТкР аналогічні механізмам перебудови генів антитіл (мал.
67). Об'єднання генних сегментів відбувається в результаті соматичної рекомбінації поліндромних
послідовностей RSS гептамерів і нонамерів на кінцях цих сегментів. Уся частина геномної ДНК між
об'єднаними сегментами видаляється. Цей механізм здійснюється за участю ферментів-рекомбіназ
RAG1 і RAG2, тому мутація за цими генами призводить до відсутності у мишей зрілих Т-і В-
лімфоцитів.
Під час утворення Т-клітин, що несуть αβ-ТкР, спочатку перебудовуються гени β-ланцюга, а потім
α-ланцюга, а в процесі утворення клітин, що несуть γδ-ТкР, — відповідно гени δ- і γ-ланцюгів.
Завдяки тому, що локус генів δ-ланцюгів знаходиться в середині локусу генів α-ланцюгів, жодна Т-
клітина не може одночасно експресувати αβ- і γδ-ТкР. Крім того, кожний ланцюг синтезується
тільки з однієї пари гомологічних хромосом, тобто при експресії генів ТкР відбувається явище
алельного виключення.
Найістотнішою відмінністю організації генів ТкР від імуноґлобулінових генів є те, що під час
розвитку Т-клітин не відбувається соматичний гіпермутагенез у генах ТкР. Отже, найбільший
внесок у різноманітність ТкР вносять явища рекомбінації V-, D- і J-сеґментів і «помилки», що
виникають під час такої рекомбінації, тобто найбільш варіабельними частинами активних центрів Т-
клітин є треті гіперваріабельні петлі (особливо β-ланцюгів).
У кожній клітині організму міститься кілька сотень V-сеґментів генів легких і важких ланцюгів і
кілька десятків J- та D-сеґментів, між якими можлива рекомбінація. Те саме стосується генів, що
кодують рецептори Т-клітин. Крім того, в генах імуноґлобулінів виникають соматичні мутації.
У людини 65 V
H
-, 30 D
H
- і 6 J
H
-ceгментів генів створюють ймовірність появи 11 700 варіантів
послідовностей, які кодують V-домени важких ланцюгів імуноґлобулінів (табл. 47). Різноманітність
підвищується також унаслідок зміщення рамки зчитування при об'єднанні сегментів генів під час V-
D-J-рекомбшації генів важких ланцюгів. Додатковим джерелом різноманітності є соматичні точкові
мутації в ділянці V-генних сегментів у гіперваріабельних ділянках, де вони відбуваються з високою
частотою і становлять від 2 до 4 % порівняно з 0,0001 % у неімуноґлобулінових (інших) генах. Цей
процес є важливим джерелом різноманітності та підвищення афінності антитіл і рецепторів В-
клітин пам'яті.
Різноманітність підвищується також після приєднання до того самого Н-ланцюга різних L-ланцюгів.
Оскільки з'єднання варіабельних ділянок V
κ
-, V
λ
- і V
H
- з D- і J-генними сеґментами відбувається
випадково, то теоретично кількість можливих комбінацій з урахуванням соматичних мутацій
досягає десятків мільйонів і мільярдів. Кількість можливих варіантів рецепторів Т-клітин дещо
менша внаслідок відсутності соматичних гіпермутацій у генах ТкР. Крім того, гени антитіл, на
відміну від генів рецептора Т-клітин, здатні до перебудов у ділянці, що кодує константну частину
важких ланцюгів: переключення класів і підкласів антитіл, а також переключення мембранної та
секреторної форм імуноґлобулінів.
Різноманітність збільшується також у зв'язку з існуванням трьох способів зчитування D-сеґмента
при зміщенні рамки зчитування та вбудовування нуклеотидів з 5'-кінця D- і J-сеґментів
термінальною дезоксинуклеотидилтрансферазою (TdT). Особливо активна термінальна
дезоксинуклеотидилтрансфераза у протимоцитів, де вона сприяє вбудовуванню додаткових
нуклеотидів у D- і J-сеґменти β-ланцюгів ТкР.
Вивчення механізмів створення різноманітності антигенрозпізнавальних структур в інших тварин,
крім людей та мишей, показало, що природа може використовувати інші механізми диверсифікації
рецепторів. Вражає той факт, що утворення різноманітності рецепторів Т-клітин відбувається майже
за однаковими законами у різних видів хребетних – від риб до людини. І навпаки, утворення
різноманітності антитіл у різних видів тварин може відбуватися трьома різними шляхами:
соматичним гіпермутуванням, соматичною рекомбінацією та генною конверсією.
Вищі тварини мають усі особливості будови імунної системи, потрібні для створення специфічного
імунітету: реаранжування рецепторів, соматичне гіпермутування, поліморфізм МНС І і МНС II,
тимічний розвиток та відбір Т-клітин, під час якого відбувається формування МНС-рестрикції
імунної відповіді та набуття толерантності до власних антигенів.
Дозрівання афінності рецепторів до антигену під час вторинної імунної відповіді — це процес,
характерний передусім для імунної системи вищих хребетних — ссавців й іноді птахів. Це пов'язано
насамперед із тим, що в лімфоїдних органах холоднокровних хордових не формуються зародкові
центри, в яких іде процес дозрівання афінності рецепторів. Характерно, що у більшості птахів і
ссавців не використовується механізм V-D-J-рекомбінації для створення різноманітності
антигенспецифічних рецепторів. У них використовуються лише механізми генної конверсії та
гіпермутагенезу для внесення змін у послідовності, що кодують варіабельні ділянки рецепторів.
При цьому гени різних ланцюгів імуноґлобулінів представлені іноді лише одним набором V-D-J-
сеґментів. Навіть у кролів, досить поширених лабораторних тварин, головним механізмом
утворення різноманітності антитіл є генна конверсія.
Тому можна вважати «щасливим випадком», що вивчення процесів рекомбінації генів
імуноґлобулінів почали саме з мишей, у яких вони відбуваються так само, як і у людини.
ВИСНОВКИ
Згідно з гіпотезою Дж. Бідла і Е. Татема (1943) «один ген — один фермент», один ген контролює
структуру одного поліпептидного ланцюга. Дослідження механізмів утворення антитіл і рецепторів
37
Т-клітин, виконані пізніше, показали, що синтезом однієї молекули можуть керувати кілька генів,
які об'єднуються в один структурний ген. Розроблені методи досліджень генів імуноґлобулінів
створили нові можливості для вивчення структури та функцій усіх інших генів, а отримані дані
стали значним внеском у розвиток загальної біології.
В ембріональній конфігурації гени імуноґлобулінів і Т-клітинних рецепторів залишаються
неактивними. Експресія імуноґлобулінових генів відбувається лише після їхньої перебудови, що
зумовлено активацією відповідних промоторів перед V-сегментами перебудованих генів.
Реорганізація генів, що відбувається в процесі диференціювання Т- і В-клітин, буває двох типів.
Перший тип перебудови забезпечує утворення зрілих V-генів шляхом об'єднання V- та J-сеґментів,
другий потребує для створення функціональних V-генів об'єднання трьох генетичних сегментів —
V, D і J. З'єднання перебудованих генів варіабельних доменів з С-генами створює той чи інший
функціональний ланцюг рецепторів. У перебудові генів імуноґлобулінів бере участь ще один тип
перебудов генних сегментів, а саме, механізм переключення С
Н
-генних сеґментів, що кодують різні
класи та підкласи імуноґлобулінів. Переключення С-генних сегментів ТкР не відбувається, оскільки
ТкР завжди перебувають у мембранній формі.
Під час диференціювання В-лімфоцитів певний VDJ-сеґмент може бути асоційований з будь-яким
іншим С
Н
-сегментом, що досягається внаслідок делецій усієї послідовності ДНК між цими
сегментами. Імуноґлобуліни двох класів одночасно не експресуються клітиною, за винятком
рецепторних форм IgM та IgD.
Велика кількість різних V-, D- та J-генних сегментів створює умови для виникнення численних
варіантів антитіл і ТкР завдяки комбінації між ними. Доведено також, що в ділянці з'єднання V-
генних сегментів із J- або D-сеґментами спостерігається висока частота нуклеотидних замін саме в
тих ділянках, що кодують CDR3-реґіони ланцюгів антитіл та ТкР. Клонально-селекційна теорія
передбачає появу значної кількості рецепторів у процесі онтогенезу лімфоцита ще до зустрічі з
антигеном. Доведено, що після антигенної стимуляції кількість різних варіантів генів антитіл
істотно збільшується час наступного дозрівання афінності рецепторів завдяки процесам
соматичного мутагенезу. У Т-клітинах ці процеси не відбуваються, очевидно, для запобігання
ризику утворення аутоспецифічних Т-клітин.
Контрольні запитання
1. Сформулюйте основні теорії,які висувалися для пояснення існування великої кількості різних
антиген специфічних рецепторів.
2. Як у людини організовані гени, що кодують легкі та важкі ланцюги антитіл; α-, β-, γ- та δ-
ланцюги ТкР?
3. Що розуміють під терміном «реаранжування генів»?
4. Опишіть послідовно процеси, що відбуваються під час перебудови генів легких і важких
ланцюгів імуноглобулінів. У якій послідовності відбувається переключення синтезу антитіл різних
класів?
5. Порівняйте організацію генів, що кодують антитіла і ТкР. Чому під час дозрівання Т-клітин не
відбувається переключення різних С-сегментів?
6. Які механізми забезпечують різноманітність антитіл у людини? Порівняйте механізми
забезпечення різноманітності антигенспецифічних рецепторів у різних класів тварин.
7. Яке значення має той факт, що під час дозрівання рецепторів антитіл відбувається соматичний
гіпермутагенез, а для Т-клітин цей процес нехарактерний?
РОЗДІЛ 9. ЦИТОКІНИ
Загальна характеристика. Цитокіни — це численна група різних за місцем утворення, структурою
та біологічною активністю білкових молекул, синтез яких індукується екзо- або ендогенними
антигенами та які регулюють утворення, розвиток, ріст і функціонування різних клітин організму,
насамперед клітин імунної системи. Цитокіни є основним фактором взаємодії між клітинами
імунної системи та між соматичними клітинами і клітинами імунної системи. Відомо їх понад 100.
У міру відкриття цитокінів їх називали за ефектом дії на певні клітини (наприклад, В-клітинний
ростовий фактор), а групову назву давали залежно від клітини-продуцента. Так, цитокіни, що
синтезувалися лімфоцитами, називали лімфокінами, моноцитами, макрофагами — монокінами,
нейтрофілами — нейтрофілокінами. Після детального вивчення біологічної активності та
визначення первинної структури запропоновано називати їх інтерлейкінами — медіаторами
міжлейкоцитарної взаємодії й надавати їм відповідний номер. Нині відомо понад 30 інтерлейкінів.
Однак деякі цитокіни зберегли свою первинну назву (інтерферони, фактори некрозу пухлин,
Колонієстимулювальні фактори, онкостатин М, фактори росту та ін.). Окрему групу цитокінів
складають речовини, які регулюють міграцію лейкоцитів в організмі, їх називають хемокінами.
Класифікувати цитокіни досить складно, оскільки вони мають різну структуру, можуть
синтезуватися багатьма клітинами різної тканинної диференціації, мати плеотропну дію, тобто
впливати одночасно на різноманітні клітини, чинити ефекти, які можуть бути навіть протилежними
залежно від оточення, взаємодії з іншими факторами, стадії розвитку реакцій тощо, а один і той
самий ефект може бути індукований кількома цитокінами. Нерідко спостерігається синергізм дії
цитокінів, а також виявляється каскадний характер утворення цитокінів. При цьому новоутворені
цитокіни індукують синтез інших цитокінів, які, в свою чергу, стимулюють продукування ранніх
цитокінів, що сприяє ампліфікації процесу і залученню до нього більшої кількості клітин.
Продуценти цитокінів. Цитокіни можуть синтезуватися різноманітними клітинами, серед яких
виділяють три відносно автономні групи клітин-продуцентів, що виробляють основну масу
цитокінів. Це стромальні клітини кісткового мозку (ендотеліоцити, фібробласти), що продукують
переважно цитокіни, які регулюють гемопоез, - ГМ-, Г-, М-КСФ, інтерлейкіни 6, 7, 8, 11, інтерферон
β, трансформівний фактор росту β. Індукторами цих цитокінів є бактеріальні антигени та контактна
взаємодія клітин. Рівень продукування цитокінів стромальними клітинами в нормі невеликий і
зумовлений, можливо, контактом цих клітин з кровотворними клітинами. Синтез цих цитокінів
значно збільшується при дії продуктів мікробного походження і не тільки в кровотворних органах, а
й у місцях агресії або ушкоджень. Після індукування цитокіни виробляються дуже швидко, мРНК
з'являється впродовж першої години, а пік секреції спостерігається через 3 – 4 год.
Другою групою клітин-продуцентів є моноцити/макрофаги, які у відповідь на взаємодію з
мікроорганізмами та їх продуктами синтезують інтерлейкіни 1, 6, 10, 12, 15, ФНП-α, М-, Г-, М-КСФ,
ТФР-β, ІФН-α, хемокіни, які беруть участь у регуляції запальних процесів. мРНК виявляється
впродовж першої години, а пік синтезу цитокінів спостерігається через 6-14 год.
До третьої групи клітин-продуцентів належать усі лімфоцити, проте основними виробниками
цитокінів є СD4Т-лімфоцити — Тх0, Тх1 і Тх2. Тх0 активно продукують ІЛ-2 і менш активно — ІЛ-
3, -4, -5, -6,-10, -13, ІФН-γ, ФНП-α і ФНП-β, ГМ-КСФ. Індукція синтезу цитокінів (ІЛ-2, ІЛ-3, ІНФ-γ,
ФНП-α і ФНП-β, ГМ-КСФ, хемокіни) лімфоцитами Тх1 відбувається після зв'язування антигену або
мітогену через ТкР (CD3/CD28) за наявності ІЛ-12; пік секреції цитокінів спостерігається через 10
— 48 год, а мНРК виявляється через 5 — 8 год. Тх2 синтезують цитокіни (ІЛ-4, -5, -6, -9, -10, -13, -3,
ГМ-КСФ, хемокіни) після зв'язування антигену або мітогену за наявності інтерлейкіну 4; пік
синтезу спостерігається через 24 — 48 год, а мРНК виявляється через 5 — 8 год.
Джерелом природних цитокінів є культуральне середовище стимульованих поліклональними
активаторами (фітогемаглютиніном, конконаваліном А, ліпополіцукридами) мононуклеарних клітин
крові, селезінки, лімфовузлів. Для багатьох цитокінів зиявлено суперпродуценти — трансформовані
лінії клітин. Оскільки нормальні слітини виробляють цитокіни в незначній кількості, розроблено
промислове отримання так званих рекомбінантних форм цитокінів за допомогою рекомбінантних
ДНК шляхом перенесення генів цитокінів людини в різні клітини: бактеріальні, дріжджові, комах та
ін.
Характерною ознакою цитокінів є відсутність здатності депонуватися; їх синтез відбувається тільки
короткочасно, імпульсно у відповідь на дію індукторних факторів, матрична їх РНК дуже коротко-
живуча. Винятком є ФНП-α і ІЛ-1, які здатні депонуватися відповідно в мастоцитах і кератоцитах.
Визначають цитокіни за проявом їх біологічної активності або на цитокінзалежних лініях клітин,
або за допомогою МкАТ.
Слід зазначити, що процеси, які індукуються в клітинах цитокінами, запрограмовані в клітинах, і
цитокіни під час взаємодії з відповідними зовнішніми структурами рецепторів тільки запускають ці
процеси.
Рецептори цитокінів. Взаємодія цитокінів з клітинами-мішенями опосередковується відповідними
високоспецифічними мембранними рецепторами, які можуть бути двох типів — високо- і
низькоафінними. Роль низькоафінних рецепторів невідома, оскільки тільки високоафінні рецептори
(Кd=10
-10
-10
-11
) здатні занурюватися разом з цитокіном усередину клітини й викликати відповідь.
Високоспецифічні рецептори складаються з декількох одиниць, які самостійно здатні зв'язувати
відповідні цитокіни, але з меншою афінністю. Всі рецептори цитокінів є трансмембранними
глікопротеїнами, позаклітинна частина яких зумовлює зв'язування певного цитокіну.
Цитоплазматичні ділянки рецепторів для цитокінів зв'язані з кіназами родини Janus — Jak 1, Jak 2,
Jak 3, Tyk 2. Після приєднання цитокіну до відповідного рецептора відбувається гомо- або
гетероолігомеризація субодиниць рецептора і просторове зближення цитоплазматичних ділянок, що
сприяє приєднанню кіназ та індукції фосфорилювання у місці залишків тирозину. Це створює умови
для приєднання провідників сигналу й активаторів транскрипції — молекул з родини STAT (від
англ. signal transducer and activators of transcription). Відомо сім молекул STAT — 1, 2, 4, 5a, 5b, 6. У
місці залишку тирозину кінази Janus фосфорилюють молекули STAT, які після димеризації
переміщуються в ядро та активують транскрипцію. Виділяють кілька груп рецепторів для цитокінів.
Суперродина рецепторів цитокінів першого типу. Це гетеродимери. До цієї суперродини
належить більшість рецепторів, що функціонують в імунній і гемопоетичній системах, та ряд
рецепторів ростових гормонів і пролактину. В родині цих рецепторів існує консервативна
амінокислотна послідовність в екстрацелюлярному домені — 4 цистеїнових залишки (СССС) і
консервативна послідовність WSXWS, де W — тирозин, S — серин, X — неконсервативна
амінокислота. Для цитокінових рецепторів характерна 4-альфа-спіральна структура. Рецептор
складається з двох (альфа- і гамма-) або трьох (альфа-, бета- і гамма-) субодиниць: цитокін
специфічної субодиниці (альфа-) і сиґналіндукувальних субодиниць (бета- і гамма-), які зазвичай
неспецифічні до цитокінів. Субодиниця, що індукує сигнал, необхідна для високоафінного
зв'язування цитокіну. Виділяють кілька субродин цих цитокінів.
Субродина рецепторів типу ІЛ-2 включає рецептори інтерлейкінів 2, 4, 7, 9, 13, 15, 21. До складу
рецепторів ІЛ-2 і ІЛ-15 входить одна цитокінспецифічна (альфа-) і дві (бета- і гамма-)
сиґналіндукувальні субодиниці. Для димерних форм рецепторів цієї родини гамма-ланцюг (CD132)
рецептора ІЛ-2 є відповідальним за трансдукцію сигналу.
Субродина рецепторів гемопоетичних цитокінів включає рецептори ІЛ-3, ІЛ-5 і ГМ-КСФ.
Цитокінспецифічною субодиницею є α-субодиниця з низькою афінністю. Сигналіндукувальною
одиницею є β-ланцюг (CD131). Всі три низькоафінні субодиниці можуть нековалентно зв'язуватися
з β-одиницею. Такий кластер має підвищену афінність і ефективно передає індукований сигнал
через мембрану після зв'язування цитокіну.
Субродина рецепторів ІЛ-6 включає ІЛ-6, ІЛ-11, ІЛ-12, ІЛ-31, онкостатин М, лейкемієінгібівний
фактор (ЛІФ). Кандидатами в цю групу є рецептори ІЛ-23, ІЛ-27, ІЛ-30. Загальна
сиґналіндукувальна субодиниця (CD130) зв'язана з однією або двома різними цитокінспецифічними
субодиницями. Цитокіни цієї групи здатні перекривати власні біологічні властивості.
Суперродина рецепторів цитокінів другого типу містить два їх типи: фібронектин ІІІ-подібні
домени і два імуноґлобулінподібні домени. До цієї суперродини входить дві групи рецепторів —
інтерферонові та рецептори типу рецепторів ІЛ-10. Для останніх характерна будова молекул, до
складу яких входить дві альфа- і дві бетасубодиниці. До інтерферонових рецепторів входять
рецептори інтерферонів альфа-, бета- і гамма-. Група рецепторів ІЛ-10 включає рецептори ІЛ-10, ІЛ-
19, ІЛ-20, ІЛ-22, ІЛ-24, ІЛ-26 ІЛ-28, ІЛ-29.
Суперродина рецепторів типу ФНП. Ця суперродина включає рецептори ФНП-α, ФНП-β, ЛТ-β,
CD40, Fas (CD95), фактор росту нервів, TRAIL (TNF-receptor appoptosis-inducing ligand) та ін. Для
ФНП характерні рецептори двох типів: 1 — 55 кД (CD120 альфа-) і II - 75 кД (CD120 бета-). У
термінальній частині ці рецептори мають багату на цистеїн ділянку завдовжки близько 40
амінокислотних залишків. ЛТ-β і ФНП-α зв'язуються з субодиницями р55 і р75. Кілінг-ефект ФНП-α
здійснюється через CD120-альфа, яка містить консервативну послідовність, що називається
«доменом смерті» (TRADD) і залучається в апоптоз. CD120-бета містить домен, який визначає
родину білків — фактори, зв'язані з ФНП (TRAFs). Вони активують фактор транскрипції NFkB і
протеїнкіназу, що регулює фактор транскрипції АР-1.
Суперродина Ig-подібних рецепторів. До цієї суперродини входять рецептори ІЛ-1, ІЛ-18, М-КСФ,
СКФ.
Суперродина хемокінових рецепторів. За своєю структурою ці рецептори належать до G-
білокзв'язаних семидоменних трансмембранних рецепторів.
Рецептори ряду цитокінів (ІЛ-14, ІЛ-16, ІЛ-17, ІЛ-20, ІЛ-25) не входять до жодної суперродини. До
складу рецептора ІЛ-16 входить білок родини CD4, а ІЛ-25 у своєму складі містить тимусзагальний
антиген TSА-1.
Клітини, що перебувають у спокої, як правило, містять на своїх мембранах невелику кількість
цитокінових рецепторів і тільки в процесі активації збільшується їх кількість, що зумовлює активну
взаємодію клітин з цитокінами.
Деякі рецептори мають спільні субодиниці. Так, інтерлейкіни 2, 4, 7, 9, 13, 15, 21 мають спільну для
них γ-субодиницю (CD132), а інтерлейкіни 3, 5 і ГМ-КСФ – β-субодиницю (CD131). Рецептори для
ІЛ-6, ІЛ-11, ІЛ-31, онкостатину М і фактора, що інгібує лейкозні клітини, мають спільний
компонент — CD130. Білки суперродини імуноґлобулінів, характерні для рецепторів до ІЛ-1,
входять до складу спільного α-ланцюга рецепторів до ІЛ-3, ІЛ-5, ГМ-КСФ, М-КСФ і фактора
стовбурових клітин β.
На відміну від позаклітинних ділянок рецепторів внутрішньоклітинні ділянки рецепторів однієї
родини значно різняться за структурою та розмірами.
Слід зазначити, що в процесі росту і диференціації клітин крові, а також при формуванні імунної
відповіді відбувається модуляція (індукування, посилення, послаблення) експресії рецепторів, що
змінює чутливість клітин до певних цитокінів. Самі цитокіни можуть змінювати експресію різних
рецепторів, і нерідко власних.
Механізми дії цитокінів. Більшість цитокінів, на відміну від гормонів, є молекулами ближньої,
місцевої (паракринної) дії — вони продукуються, виявляють свою дію і утилізуються клітинами, які
близько розміщені. Нерідко виявляють і аутокринну дію, тобто діють на ті клітини, що їх
продукують. У поодиноких випадках деякі цитокіни (ФНП-α, ІЛ-1, ІЛ-6, ГМ-КСФ) здатні впливати
на інші клітини ендокринним шляхом — мігрувати на деякі відстані від клітин-продуцентів і
викликати певні ефекти у віддалених клітинах. Секреція цитокінів має короткостроковий характер.
Як правило, вони синтезуються dе novo внаслідок активації гена, при цьому мРНК швидко
інактивується. Мала тривалість транскрипції генів цитокінів і нестабільність мРНК зумовлюють
короткий період біосинтезу цитокінів. Продукція і біологічна активність різних цитокінів
взаємопов'язані. Вони утворюють так звану цитокінову сітку, в якій регулюються утворення і
властивості окремих цитокінів. Так, за відсутності антигенного подразнення імунної системи
цитокінова сітка функціонує на мінімальному рівні — більшість цитокінів не синтезується, за
винятком гемопоетичних і ряду цитокінів, які продукуються моноцитами/макрофагами — ІЛ-6 і ІЛ-
10 та кератиноцитами — ІЛ-1. Це зумовлено в основному тим, що для активації більшості генів
цитокінів потрібні індуктори, тобто транскрипційні фактори. У клітинах, що перебувають у стані
спокою, транскрипційних факторів немає; вони формуються тільки в процесі активації клітин.
Активувальні фактори клітин є одночасно й індукторами синтезу цитокінів, і факторами експресії
рецепторів цих цитокінів. Цей факт, а також значно довший період експресії відповідних рецепторів
порівняно з періодом синтезу цитокінів зумовлюють місцевий характер дії цитокінів і швидку їх
утилізацію. Умовно цитокіни залежно від індукованих ними біологічних ефектів розподіляють на
такі групи:
1. Гемопоетичні фактори — фактор стовбурових клітин (ФСК), колонієстимулювальні фактори,
інтерлейкіни 3, 7, 11, еритропоетин. Продуценти — клітини строми кісткового мозку, а також
активовані макрофаги і лімфоцити.
2. Регулятори природної резистентності — інтерферони α і β, інтерлейкіни 1, 6 і 12, ФНП-α,
хемокіни (ІЛ-8, МСР-1, RANTES та ін.). Ці фактори є основними активаторами й регуляторами
неспецифічних реакцій організму з його захисту від колонізації носіями чужорідної генетичної
інформації. Основними мішенями цих факторів є макрофаги, ПМЯЛ, ПК. Продуцентами в
основному є тканинні макрофаги у відповідь на контакт з мікроорганізмами.
3. Цитокіни, які регулюють запальний процес, — це прозапальні (ІНФ-α і ІНФ-γ), ФНП-β,
інтерлейкіни 1, 2, 3, 6, 9, 11, 12 та антизапальні (ІЛ-4, ІЛ-10). Основна функція — активація або
гальмування цитотоксичних макрофагів, НК, цитотоксичних Т-лімфоцитів. Продуценти — зрілі
імунні Т-лімфоцити та деякі антигенпрезентувальні клітини.
4. Цитокіни, що регулюють специфічні імунні реакції, - ІЛ-2, ІЛ-4, ІЛ-10, ІЛ-13, ТФР-β через
регуляцію росту, диференціацію і активацію зрілих лімфоцитів. Продукують їх в основному
активовані Т-лімфоцити.
5. Цитокіни, що гальмують ріст клітин пухлин, — ФНП, ЛТ, онкостатин М, ІЛ-2, ІЛ-12, 15, 21, 24.
6. Окрему групу становлять цитокіни, що регулюють рух лейкоцитів — хемокіни. Відомо їх понад
40, основні — ІЛ-8, ІЛ-10, CXCL1-3, МІР-1, 3, RANTES та ін.
Поділ цитокінів на групи дуже умовний, оскільки окремий цитокін може діяти на різні клітини-
мішені і викликати різноманітні ефекти.
Цитокіни беруть участь у регуляції багатьох процесів (мал. 68), однак особливо важлива їхня роль у
регуляції кровотворення, формуванні запалення та імунної відповіді. Різні етапи кровотворення
контролюються послідовно кількома факторами, серед яких виділяються основні (домінуючі) і
допоміжні, як кофактори. Можна виділити ранні цитокіни (ФСК, ІЛ-3 та ін.), що діють на
стовбурові клітини та недиференційовані попередники кровотворних клітин, і пізні, або лінійно-
специфічні, цитокіни, що діють на уже диференційовані в різних стадіях клітини. У міру дозрівання
кровотворних клітин змінюються й домінуючі цитокіни. Так, для стовбурових і
недиференційованих попередників домінуючими виступають ІЛ-3 та ФСК, для юних мієлоїдних
клітин — ГМ-КСФ, для недиференційованих лімфоїдних клітин — ІЛ-7 і т.д. Слід зазначити, що
ранні цитокіни відіграють певну роль на всіх стадіях кровотворення, а також впливають на зрілі
клітини, виступаючи як кофактори лінійно-специфічних цитокінів.
Дія цитокінів на кровотворення спрямована в основному в двох напрямах — регуляція проліферації
клітин і забезпечення їх виживання шляхом блокади програми апоптозу. Поряд з активувальними
цитокінами існують супресорні, що гальмують розмноження клітин або блокують активність інших
цитокінів.
Індукування запального процесу зумовлене насамперед цитокінами, що продукуються
активованими макрофагами, НК та ендотеліоцитами на місці виникнення травми й появи
мікроорганізмів. Надалі в процесі розвитку запальної реакції синтезуються цитокіни, які регулюють
становлення запального процесу шляхом індукування міграції лейкоцитів у зону запалення, їх
активації та продукування ними ряду цитокінів, дія яких спрямована на знешкодження інфекційних
агентів і відновлення гомеостазу.
Цитокіни відіграють активну роль у формуванні специфічної імунної відповіді шляхом стимуляції
експресії молекул МНС класу І і II, які беруть участь у розпізнаванні й презентації антигену Т-
лімфоцитам (інтерферони α, β й особливо інтерферони γ). Цитокіни також збільшують на клітинах
імунної системи експресію адгезивних молекул, що стимулює міжклітинну взаємодію (ІЛ-1, ІЛ-6,
ФНП-α, інтерферони), активують моноцити/макрофаги (так звані запальні цитокіни – ІЛ-1, ІЛ-6,
ФНП-α, ГМ-, Г- і М-КСФ, хемокіни, інтерферони). Деякі цитокіни сприяють міграції різних клітин:
дендритних клітин — ГМ-КСФ, ФНП-α; макрофагів і лімфоцитів — β-хемокіни, ІЛ-1 та ін.
Ряд цитокінів стимулюють проліферацію Т-клітин — в основному ІЛ-2, а також ІЛ-4, ІЛ-7, ІЛ-9, а
сумісно з іншими цитокінами – ІЛ-1, ІЛ-6, ІЛ-12, ФНП-α. ІЛ-2 і ІФН-γ сприяють диференціюванню
Тх0 на Тх1, а ІЛ-4 – на Тх2. Ріст В-лімфоцитів стимулюють інтерлейкіни 1, 2, 4, 5, 6, 10, 13, а
сумісно з іншими – інтерферони, ФНП-α і ФНП-β, ІЛ-3 і ІЛ-7. ІЛ-4 індукує переключення синтезу
імуноґлобулінів на IgG1 і на IgE; ІФН-γ — на IgG2a і IgG3; ТФР-β1 - на IgG2b та IgG2a.
Цитокіни беруть активну участь у формуванні цитотоксичних клітин (ІФН-γ, ІЛ-2, ІЛ-12). Велике
значення для прояву активності цитотоксичних Т-клітин і ПК мають виділювані ними цитокіни —
ФНП-α і ФНП-β, ІФН-γ, які здатні індукувати апоптоз.
Нині проводяться широкі експериментальні роботи із застосування цитокінів у лікуванні різних
захворювань, особливо онкологічних. Отримано певні позитивні результати. Одночасно при
застосуванні великих доз цитокінів (інтерферонів, ІЛ-1, ІЛ-2, ІЛ-3, ГМ- і Г-КСФ, ФНП-α та ін.)
виявлено їх здатність зумовлювати токсичні ефекти у хворих — грипоподібний синдром, значне
підвищення проникності капілярів, що спричинює набряки, втрати рідинної частини крові,
токсичноподібний синдром зі зниженням кров'яного тиску, пропасницею та іншими проявами. Це
пояснюється в основному широкою взаємодією цитокінів і здатністю їх зумовлювати каскадний
цикл індукції цитокінів, серед яких утворюються цитокіни, здатні спричинювати токсичні ефекти,
— ІЛ-1, ІЛ-6, ФНП-α, хемокіни та ін.
Завдяки досягненням генної інженерії останнім часом отримано рекомбінантні форми цитокінів, що
дало змогу детальніше вивчити їх будову, біологічну активність і проводити експерименти із
застосування цитокінів у медичній практиці. Ряд цитокінів, особливо їх рекомбінантні форми,
знайшли широке застосування при лікуванні онкозахворювань, деяких анемій та інших хвороб. Дія
антипухлинних цитокінів спрямована як безпосередньо на пухлинні клітини — цитотоксична й
цитостатична дія, гальмування проліферації, індукування апоптозу, так і регулювання різних
реакцій природної резистентності та специфічного імунітету з метою активації НК, цитотоксичних
Т-клітин, туморінфільтрівних лімфоцитів і макрофагів. Цитокіни здатні також підвищувати
імуногенність пухлинних клітин, змінювати експресію антигенів МНС та специфічних пухлинних
антигенів. Застосування рекомбінантних препаратів ІФН-α та ІЛ-2 дало позитивні результати при
лікуванні хворих на рак нирок. Особливо відчутні позитивні результати отримано при застосуванні
рекомбінантного ІФН-γ людини в онкогематології, рекомбінантних ГМ- та Г-КСФ при лікуванні
різного роду мієлосупресивних станів, зумовлених застосуванням цитостатиків, променевого
лікування, аварією на ЧАЕС, пересаджуванням кісткового мозку тощо.

38
Про важливу роль цитокінів у гомеостазі організму свідчать результати, отримані при так званому
«нокауті» (блокаді, інактивації, видаленні) певних генів цитокінів та генів їхніх рецепторів. При
цьому отримані результати не завжди відповідають очікуваним, отриманим in vitro (табл. 48). Це
зумовлено широкою взаємодією цитокінів, здатністю їх замінювати один одного, каскадним
характером їх активації.
Далі наведено коротку характеристику окремих цитокінів.
9.1. ІНТЕРЛЕЙКІНИ.
Інтерлейкін 1 (ІЛ-1). ІЛ-1 відомий з 1972 р. як фактор, що підтримує проліферацію тимоцитів
(костимулятор) і продукується макрофагами при їх активації мітогенами. Колишні назви —
«фактор, який активує лімфоцити», «ендогенний піроген», «мітогенний фактор макрофагального
походження», «фактор, який активує В-лімфоцити», «В-клітинний диференціальний фактор» та інші
свідчать про широкий спектр його активності. Відомо дві форми ІЛ-1 людини — ІЛ-1α і ІЛ-1β, що
мають ідентичний спектр біологічної активності, але значно різняться за нуклеотидною та
амінокислотною послідовністю — гомологія за амінокислотною послідовністю становить лише
22—26%, а за нуклеотидною — 40—45%. Вони також різняться за ізоелектричною точкою — ІЛ-lα
належить до кислих, а ІЛ-1β — до нейтральних білків.
Обидві форми ІЛ-1 контролюються розміщеними близько один від одного неалельними генами в
другій хромосомі й синтезуються у вигляді незрілих великих білків-попередників, що містяться в
цитоплазмі клітин, а також на поверхні макрофагів. У позаклітинному просторі ІЛ-1 може
з'являтися тільки після протеолізу молекул-попередників сериновими протеазами — каспазами.
Домінуючою формою в людини є ІЛ-1β, у мишей — ІЛ-1α.
У здорових людей обидві форми ІЛ-1 у крові не виявляються; вони можуть з'являтися тільки під час
стресів або сильних фізичних навантажень. ІЛ-1β виявляється в крові при різних захворюваннях —
опіках, септичних процесах, після тяжких операцій і травм. ІЛ-1α при різних захворюваннях у крові
майже не виявляється. Це пов'язано з фактом тісного зв'язку ІЛ-1α з цитозолем клітини і
можливістю виходу його в міжклітинний простір тільки після загибелі клітини.
ІЛ-1 продукується в основному активованими моноцитами й макрофагами. Крім того, ІЛ-1 може
продукуватися багатьма іншими клітинами (клітинами Лангерганса, нормальними й
трансформованими Т- і В-лімфоцитами, епітеліальними й ендотеліальними клітинами,
фібробластами, нейтрофілами та ін.). Індукторами продукування ІЛ-1 може бути необмежена
кількість речовин: антигени різної природи, мітогени, імунні комплекси, а також різні речовини, які
можуть у тій чи іншій формі взаємодіяти з фагоцитами або іншими клітинами. Сильним індуктором
ІЛ-1 є ФНП, ще сильнішим — ФНП разом з комплексом Аг—Ат.
Експресія відповідних генів у клітин — продуцентів ІЛ-1 відбувається в разі їх активації певними
стимуляторами уже в першу годину після активації, і максимум досягається через 6 год для ІЛ-1α і
через 12 — 16 год — для ІЛ-1β. Інгібують синтез ІЛ-1 простагландини Е2, глюкокортикоїди, а
також фактори, що підвищують рівень цАМФ.
Чутливими до дії ІЛ-1 є багато клітин, що мають рецептори до нього. Виявлено два різновиди
рецепторів до ІЛ-1: ІЛ-1Р І типу (CD121a) та ІЛ-1Р II типу (CD121b). Обидва рецептори є
загальними для α- і β-форм ІЛ-1 і належать до суперродини імуноґлобулінів. Цитоплазматичні
ділянки помітно різняться за довжиною — рецептор І типу має 213, рецептор II типу — 29
амінокислотних залишків.
CD121a виявляється здебільшого на тимоцитах, Т-клітинах, фібробластах, ендотеліальних клітинах,
гепатоцитах тощо, а CD121b — на В-лімфоцитах, моноцитах, макрофагах, ПМЯЛ, кісткомозкових
клітинах-попередниках. Зв'язування рецептора CD121b не призводить до активації клітин. Кількість
рецепторів до ІЛ-1 на Т-лімфоцитах залежить від стану клітини: на Т-клітині, яка перебуває в
спокої, їх виявлено близько 40, а на активованій — близько 350.
Важливу роль у регуляції активності ІЛ-1 відіграє рецепторний антагоніст ІЛ-1 — Р ІЛ-1, який
відміняє біологічний ефект ІЛ-1. Він належить до родини білків, до якої належать також ІЛ-1α та ІЛ-
1β, має споріднення до рецепторів ІЛ-1, його ген розміщений на 2-й хромосомі поряд з генами ІЛ-1α
та ІЛ-1β.
ІЛ-1 має дуже широкий спектр біологічної активності in vivo та in vitro і діє як на клітини імунної
системи, так і на інші типи клітин. Найвідоміші біологічні ефекти ІЛ-1 — участь в індукції та
регуляції імунної відповіді, у формуванні запальної реакції, регуляції кровотворення, міжсистемних
взаємодіях.
У культурі in vitro він здатний індукувати проліферацію тимоцитів, фібробластів, ендотеліальних та
інших клітин, підвищує секрецію імуноґлобулінів В-лімфоцитами. In vivo він бере участь в ініціації
формування імунної відповіді, насамперед через залучення Тх2. У свою чергу, Тх2 після взаємодії з
ІЛ-1 продукують ІЛ-3, -4, -5. Мембранний ІЛ-1 забезпечує контакт Т-лімфоцитів з макрофагами. ІЛ-
1 стимулює синтез простагландинів і колагеназ фібробластами.
ІЛ-1 стимулює продукування різними клітинами ряду цитокінів — ІЛ-2, -3, -4, -5, -6, -7, -10, -12, і в
багатьох випадках біологічний ефект зумовлений не тільки його прямою взаємодією з клітинами-
мішенями, а й дією індукованих ним біологічно активних речовин. ІЛ-1β при введенні разом з
антигеном стимулює антитілоутворення, ІЛ-1α такого ефекту не має. ІЛ-1 стимулює експресію
рецептора ІЛ-2β.
ІЛ-1 є одним з основних медіаторів запуску неспецифічних факторів захисту, передусім при
запаленні. ІЛ-1 активує ендотелій судин, що сприяє підвищенню здатності клітин ендотелію
зв'язувати лейкоцити крові і цим самим сприяти їх міграції в осередок запалення, підвищує
рухомість нейтрофілів, активність фагоцитів та ПК, генерацію бактерицидних речовин, активує ряд
клітин у зоні запалення, що призводить до посиленого продукування багатьох цитокінів,
простагландинів, колагену, фібронектину. Він індукує утворення деяких білків гострого запалення –
С-реактивного, манозозв'язувального та ін. ІЛ-1 є пірогенним фактором й індукує пропасницю. Він
відміняє летальний ефект у мишей з нейтропенією, яка індукована циклофосфаном при введенні їм
Саndida albicanus або Pseudomonas aeruginоsа, а також захищає нормальні клітини – гемопоетичні
попередники — від дії хемотерапевтичних агентів (циклофосфану), а лейкозні клітини не захищає.
Слід зазначити, що позитивний результат впливу ІЛ-1 спостерігається при короткочасній його дії. У
разі довготривалої надмірної дії він може спричинити негативні наслідки аж до ушкодження органів
та збільшення числа смертельних випадків.
ІЛ-1 стимулює ранні фази еритропоезу, в пізніші фази гальмує його, оскільки є антагоністом
еритропоетину. Він стимулює мієлопоез. ІЛ-1 підвищує активність НК і лімфокінактивованих
клітин (ЛАК); можливо, це зумовлено не лише прямою дією ІЛ-1, а й деякими цитокінами, що
індукуються ІЛ-1.
Відносно впливу ІЛ-1 на пухлинні процеси отримано суперечливі дані. Виявлено, що пухлинні
клітини здатні продукувати ІЛ-1. Показано, що ІЛ-1 може як гальмувати ріст пухлинних клітин, так
і активувати їх проліферацію та метастазування. ІЛ-1 має виражений радіозахисний ефект, що
виявляється як при введенні перед опромінюванням, так і після нього.
ІЛ-1 відіграє важливу роль у реалізації міжсистемної взаємодії, особливо з нейроендокринною
системою. Він може синтезуватися ендотеліоцитами судин і клітинами глії в центральній нервовій
системі, а також проникати з крові в зони III та IV шлуночків головного мозку. На клітинах різних
ділянок головного мозку виявлено рецептори до ІЛ-1. ІЛ-1 здатний збільшувати утворення багатьох
гормонів гіпоталамуса, гіпофіза, стимулювати продукування тимуліну тимусом. ІЛ-1 разом з
іншими цитокінами бере активну участь у регулюванні поведінки, сну.
Відомо кілька інгібіторів ІЛ-1, які виділені із сечі людей з різними захворюваннями. Від хворих з
підвищеною температурою виділено так званий фебріальний інгібітор ІЛ-1 з молекулярною масою
30 кД, який відміняє біологічний ефект ІЛ-1 при взаємодії з рецептором ІЛ-1. Від хворих на
моноцитарний лейкоз виділено інгібітор ІЛ-1 з молекулярною масою 26 кД, який є структурним
аналогом рецептора для ІЛ-1 Т-лімфоцитів та фібробластів і при взаємодії з ним відміняє
біологічний ефект ІЛ-1.
Виявлено інгібіторну дію кортикостероїдів на синтез і продукування ІЛ-1.
Тестування — здатність за наявності малих концентрацій мітогену індукувати проліферацію
тимоцитів.
Інтерлейкін 2 (ІЛ-2). Вперше ІЛ-2 описано в 1976 р. Раніше ІЛ-2 позначали як «Т-лімфоцитарний
фактор росту», «мітогенний фактор тимоцитів», «тимоцитактивувальний фактор»,
«тимоцитстимулювальний фактор», «хелперний фактор кілерів», «фактор, що індукує вторинні
цитотоксичні клітини», «лімфоцитарний мітогенний фактор», «фактор диференціації Т-клітин і
НК». Усі ці назви ІЛ-2 свідчать про певний спектр його біологічної активності. Ген ІЛ-2 включає 4
екзони і знаходиться в 4-й хромосомі. ІЛ-2 людини — це мономерний глікопротеїн з молекулярною
масою близько 15 кД, містить 133 амінокислотних залишки.
Зрілий ІЛ-2 формується в процесі трансляції з попередника ІЛ-2, який містить 153 амінокислотних
залишки, в тому числі 20, що формують сигнальну послідовність, яка зникає в процесі виходу
молекули ІЛ-2 з цитоплазми. Молекула інтерлейкіну містить один дисульфідний зв'язок, який
відіграє вирішальну роль у збереженні біологічної активності, в конформації молекул. Молекула ІЛ-
2 виявляє значну стійкість до рН в інтервалі 2—10. Біологічна активність зумовлена
амінокислотними залишками, які розміщені по всій довжині молекули.
ІЛ-2 синтезується переважно Т-лімфоцитами: Т-хелперами (CD4) — близько 90 % та Т-кілерами
(CD8) – близько 10 % у процесі активації антигенами або мітогенами. Серед Т-хелперів основними
продуцентами ІЛ-2 є Тх1. НК та макрофаги також можуть продукувати ІЛ-2.
ІЛ-2 людини має певну видову специфічність — він стимулює Т-клітини мишей та щурів, але не
навпаки. Активність ІЛ-2, очевидно, дублюється іншими цитокінами, найвірогідніше — ІЛ-15,
оскільки у мишей, які позбавлені гена ІЛ-2, відмічається нормальне функціонування імунної
системи.
Експресія гена ІЛ-2 відбувається паралельно з активацією клітини і досягає максимуму через 8—16
год. In vitro ІЛ-2 секретується через 3 — 4 год після стимуляції, досягає максимуму секреції через
8—12 год і припиняється через 24 год. In vivo після імунізації максимум секреції ІЛ-2
спостерігається на 3 —4-ту добу, і цей рівень зберігається впродовж 12 діб. Синтез ІЛ-2
активованими лімфоцитами регулюється широким набором біологічно активних речовин. Так,
низка цитокінів, таких як ІЛ-1, ІЛ-6, ФНП, ІНФ-γ, гормони тимуса (тимозин, сироватковий фактор
тимуса), лейкотрієни і фактори, що інгібують активність фосфоліпази й циклоксигенази,
опромінення в дозі 10—15 Гр, стимулюють продукування ІЛ-2 або сприяють диференціюванню
незрілих тимоцитів у клітини — продуценти ІЛ-2. Циклогексамід, який інгібує синтез регуляторних
білків ядра, спричинює суперіндукцію ІЛ-2. Крім того, ряд речовин, таких як глюкокортикоїди,
гангліозиди, простагландини та інші, які здатні підвищувати рівень цАМФ, пригнічують
продукування ІЛ-2.
Рецептор для ІЛ-2 побудований з трьох нековалентно сполучених ланцюгів-поліпептидів — CD25
(α-ланцюг), CD122 (β-ланцюг) і CD132 (γ-ланцюг). І тільки об'єднання всіх трьох ланцюгів створює
високоафінний рецептор для ІЛ-2 (Кд = 10-11 М), який здатний ефективно передавати сигнали у
середину відповідних клітин і активувати їх. Високоафінний ІЛ-2 виявляється на активованих Т- і
В-лімфоцитах, макрофагах, при цьому в процесі активації клітин експресується відсутній до цього
α-ланцюг. α-ланцюг виявляється на субпопуляціях тимоцитів. Субодиниці β і γ належать до
суперродини цитокінових рецепторів, а α-субодиниця не належить до жодної відомої родини
рецепторів. Ген α-ланцюга ІЛ-2Р людини знаходиться в 10-й хромосомі, β-ланцюга — в 22-й
хромосомі, γ-ланцюга — в 10-й хромосомі.
Кількість рецепторів до ІЛ-2 в процесі активації збільшується з 85 на одну клітину до 3 — 20 тисяч.
При цьому молекули α-ланцюга синтезуються в 10-кратному надлишку, що зумовлює утворення
низькоафінних рецепторів з невизначеною функцією. Високоафінні рецептори становлять 5—10 %
загальної кількості рецепторів до ІЛ-2, але в основному тільки вони забезпечують активувальну дію
ІЛ-2 на Т-клітини.
Після дії активатора синтез α-ланцюга рецептора починається через 6 год, на 3—4-ту добу
досягається максимум синтезу і припиняється через 5 діб. Експресію ІЛ-2-рецептора стимулює γ-
інтерферон і гальмують ІЛ-4, активатори протеїнкінази С, інгібітори глікозилювання. НК та
моноцити експресують тільки βγ-димер рецептора до ІЛ-2.
У деяких випадках у сироватці, сечі та інших біологічних рідинах виявляється розчинний рецептор
для ІЛ-2, який є скороченим β-ланцюгом, що може зв'язувати ІЛ-2. Його поява пов'язана з
гематологічними неоплазіями, вірусними захворюваннями, трансплантаціями органів,
грануломатозними та аутоімунними захворюваннями. Надлишок рецептора до ІЛ-2 в біологічних
рідинах призводить до розвитку імунодепресії. Все це свідчить про те, що рівень ІЛ-2 в сироватці
може бути діагностичним показником при багатьох захворюваннях.
ІЛ-2 стимулює проліферацію Т-лімфоцитів, НК, ЛАК, еозинофілів, тромбоцитів. Кількість
попередників кілерів після культивування спленоцитів мишей з ІЛ-2 збільшується в 75—80 разів. За
відсутності ІЛ-2 Т-лімфоцити гинуть через 24 год. ІЛ-2 сприяє диференціюванню Т-кілерів,
особливо за сумісної дії з ІЛ-6, ІЛ-4, ІЛ-7, ІЛ-12. За своєю дією ІЛ-2 є одним з ростових факторів
попередньо активованих В-лімфоцитів; він також підвищує синтез IgM, IgG і IgA.
При культивуванні in vitro великих гранулярних лімфоцитів ІЛ-2 необхідній для підтримання
проліферативної й цитотоксичної активності. ІЛ-2 захищає активовані клітини від апоптозу,
перешкоджає розвитку імунологічної толерантності і навіть відміняє її.
In vitro та in vivo виявлено антипухлинну дію ІЛ-2. Вона зумовлена головним чином активацією ІЛ-2
НК і формуванням за допомогою ІЛ-2 ЛАК, основою яких є активовані НК.
Дія ІЛ-2 на природні кілери багатогранна. Це й підсилення проліферативної активності та
диференціювання НК, і сильна активація їх цитотоксичності як проти чутливих, так і стійких до дії
НК клітин-мішеней.
Нині активно ведуться експериментальні роботи з активації in vitro інтерлейкіном-2 виділених
лімфоцитів з крові хворих на онкозахворювання з подальшим введенням їх донорам цих клітин з
лікувальною метою. У деяких випадках отримано позитивні результати. Це перспективний шлях
пошуку імунобіологічних підходів до лікування онкозахворювань.
Тестування — оцінка рівня проліферації клітин лінії цитотоксичних Т-лімфоцитів.
Інтерлейкін 3 (ІЛ-3). Інтерлейкін-3 відомий з 1981 р. Він мав такі назви: «фактор детермінування
В-лімфоцитів», «фактор росту макрофагів», «фактор росту поліморфноядерних лейкоцитів»,
«фактор росту мастоцитів», «мультипотентний колонієстимулювальний фактор». ІЛ-3 називають
«ростовим фактором для мультипотентних гемопоетичних клітин». Ці назви свідчать про широкий
спектр його імунобіологічної активності.
ІЛ-3 — це сильно глікозильований білок з молекулярною масою 21—36 кД. Коливання маси
молекул ІЛ-3 зумовлені вмістом різної кількості вуглеводів (в основному сіалових кислот). Білкова
частина включає 133 амінокислотних залишки з молекулярною масою 15 кД. У молекулі ІЛ-3
міститься дисульфідний зв'язок, який відіграє важливу роль у прояві активності. ІЛ-3 людини має
29% гомології амінокислотних залишків з ІЛ-3 мишей, але не має її з іншими цитокінами людини.
Вуглеводна частина молекули ІЛ-3 не відіграє помітної ролі в прояві біологічної активності. Ген ІЛ-
3 локалізований у 5-й хромосомі в одній копії і складається з 5 екзонів.
Основними продуцентами ІЛ-3 є Тх1 і Тх2, а також деякі інші клітини (В-лімфоцити, мієлоїдні
клітини, кератиноцити, астроцити головного мозку, мастоцити, еозинофіли). Активація гена ІЛ-3
відбувається через 4 год після дії стимулятора клітин і триває кілька діб; максимум секреції ІЛ-3
спостерігається на 16-ту годину після стимуляції і триває близько 2 діб. Інгібується активація
глюкокортикоїдами, циклоспорином А.
Клітинами-мішенями ІЛ-3 є в основному юні кровотворні, зокрема поліпотентні попередники, що
містяться в кістковому мозку, а також попередники гранулоцитів, моноцитів і мегакаріоцитів.
Рецептори до ІЛ-3 також виявлено на еозинофілах, нейтрофілах, моноцитах, макрофагах,
ендотеліальних клітинах, однак на нейтрофілах у міру їх дозрівання вони зникають.
Рецептор інтерлейкіну 3 складається з двох субодиниць — α і β. Сиґналіндукувальна β-субодиниця
(CD131) має 360 амінокислотних залишків з молекулярною масою 70 кД і є спільною для
рецепторів ІЛ-3, ІЛ-5, ГМ-КСФ. Цитокінспецифічна α-субодиниця (CD123) містить 881
амінокислотний залишок з молекулярною масою 120 — 140 кД, має гомологію перших 100
амінокислотних залишків з α-ланцюгом рецепторів до ІЛ-5 та ГМ-КСФ і сама по собі не зв'язує ІЛ-
3, однак сумісно з β-ланцюгом формує високоафінний рецептор для ІЛ-3.
ІЛ-3 діє як гемопоетичний фактор росту, який стимулює проліферацію і функцію клітин всіх ростків
кровотворення. Він, очевидно, забезпечує зв'язок імунної системи з кровотворенням з метою
здійснення захисних і репаративних процесів унаслідок стимуляції та функціонування
гемопоетичних клітин. Дія його спрямована фактично на всі ростки кровотворення. Однією з
характерних активностей ІЛ-3 є гальмування утворення НК з кістково-мозкових попередників. Він
діє тільки на клітини — попередники НК, які перебувають на ранніх стадіях диференціювання, і
може повністю блокувати індукування НК у кістковому мозку. ІЛ-3 стимулює ріст мастоцитів, а
також стимулює і підтримує тривалий час культивування in vitro нейтрофілів, еозинофілів,
базофілів, моноцитів, ендотеліальних клітин. Таким чином, ІЛ-3 можна віднести до поліпоетинів,
які регулюють кровотворення різних популяцій клітин на ранніх етапах кровотворення, особливо в
екстрених випадках.
Тестування —здатність ІЛ-3 індукувати утворення в рідкому агарі клітинами кісткового мозку
змішаних колоній клітин або спричинювати проліферацію ІЛ-3-залежних клітинних ліній.
Інтерлейкін 4 (ІЛ-4). ІЛ-4 відкрито в 1981 р. Раніше він був відомий як «колонієстимулювальний
фактор В-лімфоцитів», «фактор росту В-лімфоцитів І», «колонієстимулювальний фактор», «В-
клітинний диференціювальний фактор γ», «фактор, що індукує синтез IgG1».
ІЛ-4 належить до глікопротеїнів, молекулярна маса 19 — 22 кД, в тому числі білкової частини — 15
кД. Зрілий ІЛ-4 має 129 амінокислотних залишків. Вуглеводні компоненти молекули ІЛ-4 помітної
ролі в біологічній активності не відіграють. Ген, який кодує ІЛ-4, тісно зв'язаний з геном для ІЛ-5 і
разом з генами для ІЛ-3 і ГМ-КСФ утворює цитокіновий кластер у довгому плечі 5-ї хромосоми
людини або в 11-й хромосомі мишей.
ІЛ-4 характеризується видовою специфічністю — ІЛ-4 людини активує тільки клітини людини, а
ІЛ-4 мишей — тільки клітини мишей.
Основними продуцентами є Тх2. Пік експресії гена ІЛ-4 спостерігається на 6-ту годину після
активації клітини, а синтез — через 48 год. Крім Тх2 ІЛ-4 продукують мастоцити, базофіли, В-
клітинні лінії, клітини строми кісткового мозку. Стимуляторами синтезу ІЛ-4 є ІЛ-2,
глюкокортикоїди; при старінні збільшується синтез ІЛ-4.
Рецептори до ІЛ-4 виявлено на багатьох клітинах — В-лімфоцитах, Т-клітинах, макрофагах,
мастоцитах, природних кілерах, фібробластах, кістково-мозкових попередниках. Рецептор до ІЛ-4
(ІЛ-4Р) складається з двох субодиниць — цитокінспецифічної α-субодиниці (CD124, молекулярна
маса 140 кД, 800 амінокислотних залишків, може активно зв'язувати ІЛ-4) і сиґналіндукувальної γ-
субодиниці (CD132, молекулярна маса 64 кД, 347 амінокислотних залишків). Існують високо- і
низькоафінні рецептори, а також розчинні форми ІЛ-4Р. Кількість рецепторів на одній клітині при
активації може збільшуватися в 4 —10 разів і досягати 3 — 5 тис. на клітину. ІЛ-4 стимулює
гемопоез і сприяє виживанню клітин крові.
ІЛ-4 є одним з основних найбільш ранніх ефективних ростових факторів для В-лімфоцитів. Він
реалізує свої ростові потенції переважно на активовані В-клітини, однак може і самостійно
активувати і викликати проліферацію В-клітин, які перебувають у спокої. ІЛ-4 індукує синтез IgG4,
IgЕ і гальмує синтез IgG2, IgG3 IgM та IgA.
Характерною особливістю активності ІЛ-4 є його участь у розвитку алергічних реакцій. Це
зумовлено його здатністю переключати С-гени імуноглобулінів із синтезу IgG на синтез IgE,
підвищувати експресію на В-лімфоцитах і мастоцитах і секрецію низькоафінного рецептора до IgE
—CD23 — ефективного стимулятора продукування IgE та стимулювання проліферації мастоцитів
серозних порожнин.
ІЛ-4 є важливим фактором регуляції формування й активності деяких популяцій Т-лімфоцитів. Так,
він є основним фактором диференціювання СD4-лімфоцитів у Тх2, а також CD8-клітин — у

39
цитотоксичні лімфоцити, які виробляють однакові з Тх2 цитокіни. ІЛ-4 також спричинює
проліферацію тимоцитів і активованих Т-лімфоцитів, в основному СD8-лімфоцитів; серед Тх-
лімфоцитів він діє тільки на Тх2. Дія ІЛ-4 на Т-лімфоцити є антагоністичною до дії ІЛ-2. ІЛ-4
гальмує хелперний ефект ІЛ-2, пригнічує утворення і функцію ІЛ-2-активованих НК.
ІЛ-4 підвищує експресію ряду антигенів МНС класу II, а також антигенпрезентувальну активність
АПК. Він підвищує цитотоксичність макрофагів, міграцію нейтрофілів у зону запалення.
ІЛ-4 має протизапальну активність, яка зумовлена його здатністю пригнічувати секрецію
макрофагами прозапальних цитокінів – ІЛ-1, ІЛ-6, ФНП. В експериментах виявлено його
антипухлинну дію, а також цитотоксичну активність відносно деяких бактерій та протозойних
паразитів.
Тестування — оцінка росту Т-клітинних бластів за наявності антитіл до ІЛ-2 або оцінка
проліферативної активності ІЛ-4-залежних ліній Т-клітин (МО7).
Інтерлейкін 5 (ІЛ-5). Уперше ІЛ-5 описано в 1982 р. Його колишні назви – «фактор росту В-клітин
II», «фактор диференціювання В-лімфоцитів», «фактор диференціювання еозинофілів», «фактор, що
замінює Т-клітини». Це глікопротеїн, гомодимер, значно гліколізований, має ділянки
глікозилювання, молекулярна маса зрілого ІЛ-5 становить 45 — 60 кД, білкового компонента —
22,5 кД, складається з 115 амінокислотних залишків. Ген ІЛ-5 розміщений в одному кластері з
генами ІЛ-3, ІЛ-4 і ГМ-КСФ у 5-й хромосомі людини. Гомологія між ІЛ-5 людини й миші становить
70 %.
Клітинами — продуцентами ІЛ-5 є стимульовані мітогенами або антигенами лімфоцити. Експресія
гена ІЛ-5, а також його секреція виявляються запізно — після взаємодії клітини з активаторами,
максимум спостерігається через 3 доби. Клітини, які перебувають у спокої, не експресують ген ІЛ-5
і не синтезують ІЛ-5.
Рецептор для ІЛ-5 (ІЛ-5Р) складається з α- і β-субодиниць. Цитокінспецифічна α-субодиниця
(CD125) складається з 400 амінокислотних залишків з молекулярною масою 60 кД, може
зв'язуватися самостійно з ІЛ-5, однак у сукупності з β-субодиницею ефективність зв'язування ІЛ-5
зростає. Сигналіндукувальна β-субодиниця з молекулярною масою 120 кД складається з 881
амінокислотного залишку, є спільною для рецепторів до ІЛ-3, ІЛ-5, ГМ-КСФ. Обидві субодиниці
належать до суперродини цитокінових рецепторів першого типу. Трапляється розчинна форма
рецептора до ІЛ-5. Відомі високо- і низькоафінні рецептори, число яких різко зростає після
активації клітин. Клітинами-мішенями для ІЛ-5 є В-лімфоцити, еозинофіли, цитотоксичні Т-
лімфоцити, базофіли, попередники еозинофільного, гранулоцитарного і моноцитарного рядів
кровотворення.
ІЛ-5 сприяє диференціюванню В-лімфоцитів у плазматичні клітини, які в основному синтезують
IgM. ІЛ-5 збільшує утворення IgА і меншою мірою — IgМ, IgG1, IgE. У результаті активації росту і
диференціювання попередників еозинофілів, а також активації зрілих еозинофілів ІЛ-5 виявляє
протиґельмінтну активність. ІЛ-5 може блокувати у еозинофілів антиген, який відповідає за
апоптозну активність (CD95), а також індукувати утворення цитотоксичних Т-лімфоцитів, особливо
за сумісної дії з ІЛ-2.
Тестування — оцінка здатності індукувати диференціювання еозинофілів або за підсиленням
проліферації ІЛ-5-залежних ліній клітин мишей (BCL1), або людини (TF1).
Інтерлейкін 6 (ІЛ-6). ІЛ-6 відомий під різними назвами завдяки своїй поліфункціональності:
«інтерферон β2», «В-клітинний стимулювальний фактор 2», «фактор росту гібридом і плазмоцитів»,
«колонієстимулювальний фактор В-клітин», «фактор диференціювання В-клітин»,
«гепатоцитостимулювальний фактор», «стимулятор продукування імуноґлобулінів».
ІЛ-6 людини — це глікопротеїн з молекулярною масою 20 — 30 кД, білкова частина має 19 кД. ІЛ-6
включає 183 амінокислотних залишки. Гомологія з ІЛ-6 мишей становить 42 %, і ІЛ-6 людини може
активувати клітини мишей, але не навпаки. В структурі ІЛ-6 виявлено гомологію окремих ділянок з
інтерфероном β та Г-КСФ. Ген ІЛ-6 людини знаходиться в 6-й хромосомі.
Основними продуцентами є моноцити, макрофаги, фібробласти, а також широкий спектр різних
клітин — Т- і В-лімфоцити, гепатоцити, кератиноцити, ендотеліальні, кровотворні клітини, клітини
пухлин різного походження.
Індуктором ІЛ-6 є в основному інфікуючі агенти — бактерії, віруси та інші мікроорганізми й
продукти їх життєдіяльності, мітогени різного походження, а також ІЛ-1, ФНП-α, ІФНи, КСФи. ІЛ-6
виявляють у сироватці крові людей при інфекційних захворюваннях, які індуковані
грамнегативними бактеріями, при значних опіках, при ревматоїдних артритах, після
пересаджування нирок, складного хірургічного втручання, а також у синовіальній рідині хворих на
ревматоїдний артрит і в сечі після пересаджування нирок, що свідчить про певну роль ІЛ-6 у
запальних процесах.
Після активації клітин експресія мРНК для ІЛ-6 відбувається впродовж першої години, а секреція
ІЛ-6 — через кілька годин. Рівень ІЛ-6 у сироватці крові після внутрішньовенного введення ЛПЦ
збільшується через 2 год в 1000 разів.
Як бачимо, ІЛ-6 належить до ранніх цитокінів, що підкреслює його значну роль у швидкому
реагуванні на агресію патогенів або пошкодження тканин і формуванні відповідних захисних
реакцій.
Рецептор для ІЛ-6 виявлено на різноманітних клітинах — стовбурових кровотворних клітинах,
клітинах крові, на різних сполучнотканинних клітинах, клітинах імунної та нейроендокринної
систем, на гепатоцитах, епітеліальних, ендотеліальних та інших клітинах. Високоафінний рецептор
ІЛ-6 складається з 2 субодиниць, які ковалентно не зв'язані, — α і β. Цитокінспецифічна α-
субодиниця (CD126) має 449 амінокислотних залишків з молекулярною масою 80 кД, зв'язується з
високою афінністю з ІЛ-6. Сиґналіндукувальна β-субодиниця (CD130), молекулярна маса якої 130
кД, містить 896 амінокислотних залишків. Характерною ознакою обох субодиниць рецептора є
наявність Ig-подібного домену і характерної для суперродини цитокінових рецепторів
послідовності. β-субодиниця рецептора ІЛ-6 є загальною для групи цитокінів родини ІЛ-6. Кількість
рецепторів на одній клітині залежить від типу клітин — у середньому виявляється близько 1,5 тис.
рецепторів на клітину. В сечі виявлено розчинну форму рецептора ІЛ-6. Установлено, що α-
макроґлобулін сироватки крові є носієм ІЛ-6, він також захищає його від протеаз, проте не впливає
на біологічні функції та здатність зв'язуватися з відповідними рецепторами.
ІЛ-6 має широкий спектр біологічної активності і бере участь у регуляції майже всіх фізіологічних
параметрів захисних реакцій організму при різних патологічних процесах. У здійсненні більшості
регуляторних захисних реакцій ІЛ-6 взаємодіє з іншими цитокінами.
ІЛ-6 сприяє формуванню та функціонуванню запального процесу, розвитку імунної реакції,
регуляції кровотворення. Спектри біологічних ефектів ІЛ-6, ІЛ-1 та ФНП-α значною мірою подібні,
нерідко перекриваються і часто їх важко розрізнити. ІЛ-6 виділяється трохи пізніше за ІЛ-1 та ФНП
і гальмує їх утворення, а ІЛ-1 і ФНП стимулюють його утворення.
ІЛ-6 бере участь у дерепресії генів клітин печінки, які контролюють синтез ряду білків гострої фази
при запаленні — СРБ, фібронектину та ін. ІЛ-6 відіграє певну роль як у хронізації гострих запалень,
так і в загостренні хронічних форм запалень. ІЛ-6 бере участь у підвищенні температури тіла.
Однією з основних мішеней для ІЛ-6 є В-лімфоцити та їх попередники. Він є активним кофактором
проліферації і окремим диференціювальним фактором В-клітин. Він стимулює плазмоцити, що
зумовлює синтез імуноґлобулінів усіх класів ІЛ-6 також підсилює ріст гібридом, мієлом і може бути
аутокринним фактором росту пухлинних клітин.
ІЛ-6, як диференціювальний фактор, зумовлює перехід попередників антигенспецифічних
цитолітичних Т-лімфоцитів у зрілі ефекторні клітини. ІЛ-6 як костимулятор, бере участь у
підготовці проліферативної відповіді Т-клітин на мітогени й антигени, підсилює продукцію Т-
хелперами, які розпізнали антиген, ІЛ-2. Він підвищує цитотоксичний ефект ФНПα, разом із ІФН-γ-
активує НК, з ІЛ-2 сприяє утворенню ЛАК.
Деякі автори відносять ІЛ-6 до гемопоетичних ростових факторів. Він виступає в основному як
фактор стимулювальної активності ІЛ-3, ГМ- і М-КСФ. ІЛ ефективно стимулює колонієутворення
всіх типів на пізніх стадіях кровотворення, прискорює дозрівання мегакаріоцитів і тромбоцитів.
ІЛ-6 сприяє проліферації тимоцитів, фібробластів, ендотеліальних клітин. Може діяти на клітини
мозку і зумовлювати синтез і викид адренокортикотропних гормонів та викликати диференціювання
нервових клітин.
Показано, що ІЛ-6 виробляється також фолікуло-зірчастими клітинами передньої частки гіпофіза.
Ці клітини за деякими властивостями подібні до макрофагів. Припускають, що ІЛ-6 бере участь у
регуляції секреторної активності гіпофіза і, можливо, є одним з медіаторів, за допомогою яких
відбувається взаємодія імунної та ендокринної систем.
Тестування — оцінка здатності підсилювати проліферацію ІЛ-6-залежної лінії В9 або збільшення
секреції імуноглобулінів В-клітинами людини, що трансформовані вірусом Епштейн-Барр.
Інтерлейкін 7 (ІЛ-7). Відомий із 1988 р. як фактор, що спричинює проліферацію попередників В-
лімфоцитів, інша назва — «лімфопоетин 1».
ІЛ-7 людини є глікопротеїн розміром 152 амінокислотних залишки з молекулярною масою 25 кД.
Білкова частина має 17 кД. Має 60 % гомології з ІЛ-7 мишей, що свідчить про відсутність видової
специфічності. Ген ІЛ-7 розміщений у 8-й хромосомі людини. Продуцентами ІЛ-7 є стромальні
клітини кісткового мозку та тимуса — фібробласти, ендотеліальні клітини, а в тимусі й епітеліальні
клітини, макрофаги. Клітинами-мішенями для ІЛ-7 є кістково-мозкові попередники лімфоцитів,
зрілі Т-лімфоцити, тимоцити, моноцити.
Рецептор ІЛ-7 (ІЛ-7Р) складається з двох субодиниць — α і β. Цитокінспецифічна α-субодиниця з
молекулярною масою 68 кД має 439 амінокислотних залишків. Сигналіндукувальний γ-ланцюг
(CD132) є спільним для рецепторів ІЛ-2, ІЛ-4 та інших цитокінів. Виявлено високо- і низькоафінні
ділянки зв'язування ІЛ-7.
ІЛ-7 є одним з основних лімфопоетинів. Він сприяє комітуванню і розвитку клітин крові в бік В-
лімфоцитів, а також зумовлює виживання і ріст попередників В-клітин; є стимулятором
проліферації внутрішньотимусних попередників Т-лімфоцитів і зумовлює антигеннезалежне
розмноження Т-лімфоцитів за межами тимуса. Він спричинює проліферацію зрілих активованих Т-
клітин і диференціювання Т-кілерів, може індукувати утворення лімфокінактивованих лімфоцитів.
ІЛ-7 здатний підсилювати експресію інгібітора апоптозу bсl-2 і так само сприяти виживанню
попередників Т-лімфоцитів. На моноцитах людини ІЛ-7 індукує експресію запального цитокіну
МІР-1β.
ІЛ-7 не має біологічно активних аналогів, тому відсутність або блокада гена ІЛ-7 чи його рецептора
моноклональними антитілами призводить до спустошення тимуса, формування лімфопенії та
тяжкого імунодефіциту.
Тестування — за рівнем проліферації попередників В-лімфоцитів або мітогенстимульованих Т-
клітин.
Інтерлейкін 8 (ІЛ-8). Інтерлейкін 8, або «фактор хемотаксису нейтрофілів»,
«нейтрофілактивувальний фактор», «фактор хемотаксису Т-лімфоцитів», «хемотаксичний пептид
для гранулоцитів», «фактор атракції нейтрофілів», є бетатромбоглобуліновий протеїн з
молекулярною масою близько 8 кД, містить 72 амінокислотних залишки з двома дисульфідними
зв'язками. Ген ІЛ-8 розміщений на 4-й хромосомі. Продуцентами ІЛ-8 є макрофаги, моноцити, Т-
лімфоцити, фібробласти, гепатоцити, ендотеліальні та інші клітини. Індукторами ІЛ-8 є мітогени
(особливо ЛПЦ) або ендогенні фактори: ІЛ-1, ІЛ-3, ФНП-α, ГМ-КСФ та ін. Виділяється він через 4
год після активації. Клітинами-мішенями є нейтрофіли, еозинофіли, макрофаги, лімфоцити,
базофіли, меланомні клітини.
Виявлено два типи рецепторів до ІЛ-8 — високо- та низькоафінний, які мають 77% гомології.
Високоафінний рецептор містить 350 амінокислотних залишків з молекулярною масою 44 —58 кД,
а низькоафінний рецептор має 355 амінокислотних залишків і молекулярну масу 67 — 70 кД.
Рецептори ІЛ-8 сім разів пронизують мембрану клітин і належать до суперродини родопсинів.
Високоафінний рецептор зв'язує тільки ІЛ-8, а низькоафінний здатний зв'язувати й інші цитокіни.
На одному нейтрофілі виявлено близько 20 тисяч рецепторів до ІЛ-8.
Основна функція ІЛ-8 — індукувати хемотаксис нейтрофілів, лімфоцитів, макрофагів, еозинофілів
та інших клітин у зону запалення. Крім того, ІЛ-8 зумовлює підсилення адгезивних властивостей
нейтрофілів, їх активацію та секрецію нейтрофілами й макрофагами лізосомальних ферментів та
інших БАР, активацію експресії інтегринів та інших адгезивних молекул на відповідних клітинах. In
vivo ІЛ-8 індукує нейтрофільний лейкопоез. ІЛ-8 активує нейтрофіли in vitro дуже швидко — уже в
перші секунди після добавляння ІЛ-8 у нейтрофілах у цитозолі збільшується кількість кальцію,
змінюється форма клітин і активується система їх руху. Через 15с актин мікрофіламентів
накопичується в субкапсулярній ділянці, а через 1 — 2 хв змінюється полярність нейтрофілів і вони
стають гудзикоподібними. ІЛ-8 підтримує ріст меланомних клітин in vitro.
Тестування — за здатністю індукувати хемотаксис і активацію нейтрофілів.
Інтерлейкін (ІЛ-9). Відомий як «Т-клітинний фактор росту», «цитокін Ph». Він являє собою
лужний глікопротеїн з молекулярною масою 30 — 40 кД, має 126 амінокислотних залишків, 5
дисульфідних зв'язків. Гомологія з мишачим ІЛ-9 становить 55 %, ІЛ-9 мишей активує відповідні
клітини людини, але ІЛ-9 людини не активує відповідні клітини мишей.
Ген ІЛ-9 локалізований у хромосомі 5 людини. Продуцентами ІЛ-9 є стимульовані СD4Т-лімфоцити
типу Тх2. Ефективним індуктором синтезу ІЛ-9 є ІЛ-1; ІЛ-9 утворюється пізніше від інших
цитокінів — експресію мРНК виявляють через 24 год після стимуляції клітин.
Клітинами-мішенями є активовані хелперні лімфоцити, макрофаги, мастоцити, клітини —
попередники кровотворення.
Рецептором до ІЛ-9 є глікопротеїн, який складається з двох субодиниць. Цитокінспецифічний α-
ланцюг з молекулярною масою 64 кД має 482 амінокислотних залишки, а сиґналіндукувальний γ-
ланцюг (CD132), який є спільним для ІЛ-2, має 347 амінокислотних залишків з молекулярною
масою 64 кД. Зв'язування ІЛ-9 з клітинами індукує фосфорилювання ряду клітинних білків.
Основна функція ІЛ-9 — підтримання проліферації активованих Т-хелперів. Крім того, він бере
участь у підтриманні росту мастоцитів, сприяє кровотворенню, особливо еритропоезу, є ефективним
індуктором проліферації тимічних лімфом мишей. ІЛ-9 здатний захищати клітини тимуса від
апоптозу, зокрема й індукованого кортикостероїдами, що свідчить про його можливу роль у
регуляції запрограмованої смерті клітин.
Інтерлейкін 10 (ІЛ-10). Відомий із 1989 p., мав назви «фактор, який інгібує синтез цитокінів»,
«інгібітор активності Тх1». ІЛ-10 — білок, гомодимер з молекулярною масою 35 — 40 кД і 160
амінокислотними залишками. ІЛ-10 людини і мишей мають високий рівень гомології: за
нуклеотидною послідовністю — 80 %, за амінокислотною — 73 %. Проте якщо ІЛ-10 людини
активний відносно клітин і людини, і мишей, то мишачий неактивний у людини.
ІЛ-10 людини і мишей мають значну гомологію з геномом вірусу Епштейн-Барр. Ця ділянка у
вірусу експресується в пізній, літичній стадії розвитку вірусу і відома як вірусний ІЛ-10, який має
супресорну активність, як і ІЛ-10. Ген ІЛ-10 розміщений у 1-й хромосомі людини і мишей.
ІЛ-10 продукується в основному активованими СD8-Т-лімфоцитами, крім того, його синтезують
активовані ЛПЦ моноцити. Біосинтез ІЛ-10 починається пізніше від біосинтезу ІЛ-6, ІЛ-8, ФНП-α,
Г-КСФ.
Рецептор до ІЛ-10 належить до групи інтерферонових рецепторів, поліпептидний ланцюг якого
містить 557 амінокислотних залишків з молекулярною масою 90 — 110 кД і виявляється переважно
на В-лімфоцитах, тимоцитах, макрофагах.
Основний напрям біологічної дії ІЛ-10 — сприяння розвитку гуморальної імунної відповіді. Це
здійснюється за рахунок як активувального, так і супресорного впливу на окремі ланки індукування
та формування імунної відповіді. Так, ІЛ-10 стимулює проліферацію незрілих В-клітин, тимоцитів і
мастоцитів, синтез IgM, IgA, IgG4, захищає їх від апоптозу, виступає як кофактор ІЛ-2 і ІЛ-7.
З іншого боку, він пригнічує синтез цитокінів Тх1 (виступає як антагоніст γ-інтерферону), знижує
антигенпрезентувальну та ефекторну функцію макрофагів, гальмує окисний метаболізм і синтез
ФПН-α, ІЛ-1, ІЛ-8, ІЛ-12, колонієстимулювальних факторів, пригнічує експресію молекул МНС
класу II, макрофагозалежну проліферацію Т-клітин та гіперчутливість сповільненого типу. Крім
того, ІЛ-10 є сильним інгібітором протипухлинної цитотоксичності циркулюючих моноцитів і
альвеолярних макрофагів. Він стимулює ріст деяких пухлин і його підвищена концентрація в крові
при онкозахворюваннях свідчить про несприятливий прогноз. У поєднанні з іншими цитокінами він
стимулює ріст і диференціювання попередників багатьох клітин.
Виражена протизапальна дія ІЛ-10 дала підставу дослідникам застосовувати його при лікуванні
хронічних запальних процесів.
Тестування — за впливом на проліферацію мишачої лінії мастоцитів МС/9, яка реагує на цитокіни
миші й людини.
Інтерлейкін 11 (ІЛ-11). Відомий також як «фактор, що стимулює утворення колоній
мегакаріоцитів». ІЛ-11 належить до глікозильованих поліпептидів, складається з 179—199
амінокислотних залишків, молекулярна маса 23 кД, його ген локалізований на 19-й хромосомі
людини. Продукується ІЛ-11 клітинами строми кісткового мозку, фібробластами після стимуляції
ІЛ-1.
На клітинах-мішенях існують відповідні рецептори, які мають подібність із рецептором до ІЛ-6,
оскільки до складу обох рецепторів входить β-субодиниця (CD130).
Клітинами-мішенями є широке коло різних за походженням та функціями клітин. Насамперед ІЛ-11
є гемопоетичним фактором для найбільш ранніх кровотворних кістково-мозкових попередників,
стимулює мієло- та еритропоез, дозрівання мегакаріоцитів і тромбоцитів, диференціювання
нейтрофілів, вироблення білків гострої фази запалення.
Експериментальними дослідженнями на тваринах показано, що ІЛ-11 підвищує в крові кількість
клітин — попередників лейкоцитів, передусім нейтрофілів та тромбоцитів, завдяки збільшенню
відповідних клітин-попередників. Він також сприяє дозріванню клітин — попередників нейронів та
інших клітин. Отже, за деякими активностями ІЛ-11 подібний до ІЛ-6. Однак ІЛ-6 має ширший
спектр біологічної активності.
Тестування — оцінка проліферативної активності відносно клітин ІЛ-6-залежних плазмоцитом
(наприклад, Т1165).
Інтерлейкін 12 (ІЛ-12). Попередні його назви «фактор, який стимулює НК», «фактор дозрівання
цитотоксичних Т-лімфоцитів». Біологічні ефекти ІЛ-12 відомі з 1989 p., а в 1994 р. його включено
до групи інтерлейкінів.
ІЛ-12 є гетеродимером з молекулярною масою близько 70 кД, утворений двома поліпептидними
ланцюгами, які сполучені ковалентним дисульфідним зв'язком. Одна з субодиниць із молекулярною
масою 40 кД складається з 196 амінокислотних залишків (її ген локалізований на 5-й хромосомі
людини) і гомологічна позаклітинній ділянці рецептора ІЛ-6. Інша субодиниця з молекулярною
масою 36 кД складається з 306 амінокислотних залишків (ген її локалізований на 3-й хромосомі
людини) і має певну гомологію з ІЛ-6 і Г-КСФ. ІЛ-12 нагадує лігандорецепторний комплекс і має
фрагменти, подібні до гемопоетичних факторів.
Основними клітинами — продуцентами ІЛ-12 є активовані бактеріальними продуктами В-
лімфоцити та моноцити, оскільки лише вони здатні синтезувати субодиницю з молекулярною
масою 36 кД, а інша субодиниця, з молекулярною масою 40 кД синтезується багатьма клітинами.
Клітинами-мішенями для ІЛ-12 є Т-лімфоцити, НК, а також В-лімфоцити. На клітинах-мішенях
виявлено три типи рецепторів для ІЛ-12, які різняться за афінністю. Високоафінним рецептором є
білок з молекулярною масою 180 кД, який складається з цитокінспецифічного ланцюга і
сиґналіндукувальних β1 і β2-ланцюгів. β1-ланцюг асоційований з Jak2, β2-ланцюг — з Tyk2. β2-
ланцюг експресований на Тх1 і відсутній на Тх2. Субодиниця β2 є основою для проведення сигналу
в середину СD4Тх0-лімфоцитів для диференціації їх у Тх1. Рецептори до ІЛ-12 виявлено на
активованих Т-клітинах, серед яких понад 90 % є CD3 Т-клітинами, а також на активованих НК, В1-
клітинах.
ІЛ-12 належить до ефективних регуляторів формування і функціонування природних факторів
стійкості, є посередником між природженим і набутим імунітетом, між макрофагами та
лімфоцитами при захисті від проникнення патогенів. У разі агресії патогенів ІЛ-12 сприяє
формуванню клітинної імунної відповіді — стимулює диференціювання Тх0 в хелпери запалення
Тх1, проліферацію і активність НК, диференціювання і розвиток цитотоксичних Т-лімфоцитів; при
цьому індукується синтез Т-клітинами і НК γ-інтерферону, який підвищує ефективність дії ІЛ-12.
ІЛ-12 збільшує утворення ЛАК, а також сприяє активації В-1 популяції В-лімфоцитів, підвищує
кількість залежного від γ-інтерферону IgG2a. Він діє як костимулятор лімфоцитів, які інфільтрують
пухлини, особливо разом з ІЛ-2.
Водночас ІЛ-12 пригнічує утворення IgE, гальмує індукування Тх2, сприяє виходу стовбурових
кровотворних клітин у кров'яне русло і формуванню гепато- і спленомегалії при частому його
введенні. Разом з іншими цитокінами ІЛ-12 бере участь у регуляції кровотворення. ІЛ-12 ефективно
стимулює антимікробну активність організму при різних бактеріальних, паразитарних та вірусних
інфекціях. При підшкірному введенні ІЛ-12 індукує розсмоктування деяких пухлин і метастазів.
Припускають, що протипухлинний ефект ІЛ-12 може бути зумовлений низкою його ефектів:
індукуванням синтезу γ-інтерферону, активацією цитоцидної активності НК, цитотоксичних Т-
лімфоцитів CD8, пухлиноінфільтруючих лімфоцитів, макрофагів, ЛАК.
ІЛ-12 бере участь у здійсненні апоптозу індукуванням синтезу ІФН-γ і ФПН-α, які беруть
безпосередню участь у запуску апоптозу.
Отже, ІЛ-12 є перспективним для застосування його як ефективного антимікробного й
протипухлинного агента, зважаючи на його незначну токсичність порівняно з ІЛ-2.
Тестування — оцінка впливу на проліферацію фітогемаглютинінактивованих лімфобластів; для
нейтралізації дії ІЛ-2 в систему вводять антитіла до нього.
Інтерлейкін 13 (ІЛ-13). Інтерлейкін 13 — це глікозильований, з двома дисульфідними зв'язками
поліпептид з молекулярною масою 17 — 24 кД, містить 112 амінокислотних залишків.
Послідовність aмінокислот інтерлейкіну 13 на 30% гомологічна такій інтерлейкіну 4. Гомологія з
інтерлейкіном мишей становить 58 %. Ген інтерлейкіну-13 локалізований на хромосомі 5q людини
поряд з геном ІЛ-4 і входить до спільного для ІЛ-4, ІЛ-5 і ГМ-КС генного кластера. Клітинами —
продуцентами ІЛ-13 в основному є активовані CD8T-лімфоцити, Тх2 та мастоцити.
Хоча рецептор до ІЛ-13 ще повністю не ідентифікований, проте показано, що за своєю
функціональною активністю він відрізняється від рецептора до ІЛ-4 і складається із загального γ-
ланцюга (CD132) і, можливо, CD24.
Клітинами-мішенями є моноцити, В-лімфоцити. За деякими параметрами біологічної дії ІЛ-13
подібний до ІЛ-4 та ІЛ-10. ІЛ-13 гальмує синтез активованими моноцитами прозапальних цитокінів
– ФНП-α, ІЛ-1β, ІЛ-6, ІЛ-8, а також супресує синтез ІЛ-2. Він збільшує експресію на моноцитах
людини хемокінових рецепторів у 20 разів на рівні транскрипції гена, ряду мембранних молекул
(CD23, антигенів гістосумісності класу II) на моноцитах та В-клітинах і підвищує їх
антигенпрезентувальну активність, він сприяє також росту В-клітин, стимулює їх активність за
секрецією IgM, IgE, IgG4, яка індукується антиімуноґлобулінами або антитілами до СD40-антигену.
Під впливом ІЛ-13 наївні В-лімфоцити проліферують активніше, ніж В-лімфоцити пам'яті.
ІЛ-13 індукує синтез рецептора — антагоніста ІЛ-1α, що зумовлює його можливу роль у реалізації
протизапальних механізмів захисту організму. ІЛ-13 залучає в зону запалення еозинофіли, отже, він
є важливим медіатором у патогенезі астми та захищає мишей від летального кінця при інфікуванні
шистосомами.
Тестування — оцінювання комітогенної активності ІЛ-13 відносно В-лімфоцитів.
Інтерлейкін 14 (ІЛ-14). Інша назва — «високомолекулярний В-клітинний ростовий фактор». ІЛ-14
— це великий глі-козильований білок з молекулярною масою 60 кД і 483 амінокислотними
залишками. Він має певну гомологію з Вb-компонентом системи комплементу, який здатний
зв'язуватися з рецептором до ІЛ-14. Продуцентами ІЛ-14 є Т-лімфоцити, а також деякі В-клітинні
пухлини, особливо лімфома Burkitt.
Рецептор до ІЛ-14 виявлено на В-лімфоцитах. ІЛ-14 підсилює проліферацію активованих В-
лімфоцитів та клітин В-лімфом; сприяє формуванню В-клітин пам'яті, підвищує стійкість В-клітин
до апоптозу підсиленням експресії bcl-2, пригнічує продукування антитіл. Припускають, що дія ІЛ-
14 в основному здійснюється в зародкових центрах.
Тестування — оцінювання стимулювання проліферації активованих Staphylococcus aureus В-клітин.
Інтерлейкін 15 (ІЛ-15). ІЛ-15 – це поліпептидний глікозильований ланцюг з молекулярною масою
15 кД, містить 114 амінокислотних залишків. За своєю структурою, а також за функцією ІЛ-15
близький до ІЛ-2. Продуцентами ІЛ-15 є широкий набір клітин — макрофаги, стромальні клітини
кісткового мозку, епітеліальні клітини.
Рецептор ІЛ-15 складається з цитокін-специфічного α-ланцюга та сиґналіндукувальних β-(CD122 –
75 кД, 525 амінокислотних залишків) і γ-(CD132 — 64 кД, 347 амінокислотних залишків)
субодиниць. Відсутність передавання сигналу з рецептора ІЛ-15 зумовлює нестачу в організмі НК.
ІЛ-15 підтримує проліферацію активованих Т-клітин, зокрема цитотоксичних, активує
цитотоксичну активність НК і продукування ними багатьох важливих цитокінів (γ-інтерферону,
ФНП-α, ГМ-КСФ), сприяє проліферації й активації нормальних В-клітин. ІЛ-15 індукує експресію
на товерхні культивованих ендотеліальних клітин лімфовузлів рецептора ІЛ-15 (β- і γ-ланцюги
рецептора ІЛ-2) і сприяє виходу із судин активованих Т-лімфоцитів. ІЛ-15 виявляє виражену
антипухлинну активність, яка, можливо, зумовлена активацією цитоцидної активності НК та
моноцитів.
Тестування — оцінка проліферації лінії мишачих цитотоксичних лімфоцитів при індукції ІЛ-15.

40
Інтерлейкін 16 (ІЛ-16). Одна з перших назв — «фактор хемоатракції лімфоцитів». ІЛ-16 —
поліпептид-гомотетрамер з молекулярною масою 56 — 80 кД і 130 амінокислотними залишками.
Містить 4 ланцюги з молекулярною масою по 14— 17 кД. Клітинами — продуцентами ІЛ-16 є в
основному Т-лімфоцити CD8 і CD4, а також еозинофіли, мастоцити, епітеліальні клітини. Гістамін
стимулює секрецію цими клітинами ІЛ-16. Показано, що в CD4 і CD8T-лімфоцитах при активації
специфічним антигеном або антитілами проти CD3 накопичується мРНК ІЛ-16 і білка —
попередника ІЛ-16, а також відбувається секреція зрілих молекул ІЛ-16. При цьому в CD4 (але не в
CD8) активується каспаза 3, яка формує перехід молекули попередника в зрілий ІЛ-16.
Інгібітори каспази гальмують синтез ІЛ-16. Фібробласти людини різного походження синтезують
мРНК ІЛ-16, але білкових молекул ІЛ-16 не виявляється. Стимуляція фібробластів ІЛ-1 Р індукує
синтез мРНК ІЛ-16 і власних молекул ІЛ-16; інгібітори каспази 3 відміняють стимулювальну дію
ІЛ-1β.
Рецептор для ІЛ-16 належить до білків родини CD4, однак низка експериментальних даних свідчить
про наявність у рецепторі ще й іншої молекули. ІЛ-16 є сильним хемоатрактантом для СD4Т-
лімфоцитів, моноцитів, макрофагів, еозинофілів, однак не впливає на міграцію нейтрофілів. ІЛ-16
захищає від апоптозу Т-лімфоцити, які активовані ІЛ-2. Він індукує синтез прозапальних цитокінів.
Встановлено, що ІЛ-16 здатний гальмувати реплікацію ВІЛ-1 у мононуклеарах крові, що зумовлює
необхідність детального вивчення його противірусної дії.
Тестування — індукування хемотаксису СD4Т-лімфоцитів, яка відміняється антитілами до ІЛ-16.
Інтерлейкін 17 (ІЛ-17). ІЛ-17, або mСТ4А-8, — мономер, має 155 амінокислотних залишків, на
72% ідентичний із НVS-13 і на 63% — з мишачим аналогічним цитокіном (CTLA-8). Виявлено
кілька різновидів ІЛ-17: В, С, D, Е, F і відповідні рецептори.
Основні клітини-продуценти — CD4Т-лімфоцити — Тх0, Tx1, CD4Т-лімфоцити пам'яті.
Синтезується також синовіальними клітинами за ревматоїдного артриту; при цьому ІЛ-17 сприяє
розвитку запальної реакції.
Рецептор ІЛ-17 людини (CDw217) кодується геном хромосоми 22. На 76% ідентичний з відповідним
мишачим рецептором і не належить до будь-якої родини цитокінових рецепторів.
Біологічний ефект — стимуляція секреції ряду цитокінів (ІЛ-6, ІЛ-8, ГМ-КСФ) епітеліальними,
ендотеліальними і фібробластними клітинами. ІЛ-17 активує ПМЯЛ, збільшує секрецію
моноцитарного хемоатрактичного білка (МХБ-1), індукує експресію мРНК ІЛ-8 і МХБ-1, індукує в
фібробластах здатність підсилювати проліферацію попередників CD-34 гемо-поетичних клітин і
сприяє їх диференціюванню на нейтрофіли, стимулює ангіогенез як прискоренням міграції
епітеліальних клітин, так і індукуванням ряду ростових факторів.
Інтерлейкін 18 (ІЛ-18). ІЛ-18, або фактор індукції γ-інтерферону, — мономер, неглікозильований
білок з молекулярною масою 24 кД, містить 193 амінокислотних залишків у людини і 192 у мишей,
має 65 % гомології з аналогічним цитокіном мишей. ІЛ-18 мишей і щурів гомологічний на 91 % за
амінокислотним складом і нуклеотидною послідовністю.
ІЛ-18 синтезується як біологічно малоактивний білковий попередник. У формуванні біологічно
активного ІЛ-18 беруть участь каспаза 1 і незалежно від каспази — протеїназа 3 нейтрофілів
(мієлобластин).
Клітини-продуценти — активовані макрофаги і насамперед купферовські та дендритні клітини,
зокрема незрілі кератиноцити, Т- і В-лімфоцити. Моноцити і макрофаги продукують багато різних
видів ІЛ-18, чимало з яких є неактивними димерами. ІЛ-18 типу 2 є фрагментом ІЛ-18, має незначну
здатність індукувати інтерферон, у крові зв'язується з IgM і в значній концентрації виявляється в
30% людей. ІЛ-18 експресується на багатьох клітинах — моноцитах, макрофагах, Т- і В-лімфоцитах,
дендритних та ендотеліальних клітинах, кератиноцитах, астроцитах, клітинах мікроглії. Його
експресія виникає під час активації фактора NFkB.
Рецептор ІЛ-18 належить до родини Ig-подібних рецепторів.
Основні клітини-мішені — Т-лімфоцити, НК.
ІЛ-18 належить до прозапальних цитокінів і має широкий спектр біологічної активності. Він індукує
утворення γ-інтерферону, регулює ріст та диференціювання Тх1, розвиток імунної відповіді за Tx1-
типом, активує НК, є частиною комплексу, що спричинює апоптоз клітин. Він індукує
продукування ІФН-γ В-лімфоцитами, що зумовлює гальмування секреції IgE; збільшує синтез
інтерферону γ Т-лімфоцитами, а разом з ІЛ-12 — НК; стимулює продукування багатьох цитокінів —
ФНП-α, ІЛ-β, ІЛ-8, МІР-α, ІЛ-5, ІЛ-6, ГМ-КСФ, Г-КСФ. За відсутності ІЛ-12 він разом з ІЛ-2 і ІЛ-3
індукує вироблення ІЛ-4, що сприяє розвитку імунної відповіді за Тх2-типом та формування
алергічних реакцій. ІЛ-18 може виявляти нейромодуляторну активність, бере активну участь у
формуванні захисних реакцій проти різних патогенів завдяки продукуванню ІФН-γ, особливо проти
внутрішньоклітинних патогенів (лістерій, шигел сальмонел, мікобактерій), а також виявляє
протипухлинну активність, зумовлену індукцією апоптозу внаслідок підсилення взаємодії Fas/FasL
через стимуляцію ІЛ-18 продукування мРНК Fas L. Введення гена ІЛ-18 у пухлинні клітини мишей
гальмує їх проліферацію. Він здатний відміняти у мишей розвиток хронічної хвороби «трансплантат
проти хазяїна», підтримувати запальний процес унаслідок стимуляції синтезу γ-інтерферону, ФНП-
α, ІЛ-1β, ІЛ-8, МІРα. Разом (але не окремо) з ІЛ-12 він зумовлює токсичні ефекти через залежні й
незалежні від γ-інтерферону механізми; нейтралізація ІЛ-18 у разі летальної ендотоксемії захищає
мишей від летального кінця. За гіперпродукування ІЛ-18 виникають деструктивні запальні процеси,
зокрема аутоімунні захворювання Т-клітинного типу.
Видалення гена ІЛ-18 значно не впливає на життєздатність та плодючість мишей, на перебіг
інфекційних захворювань.
Виявляють ІЛ-18 в ЕЛІЗА-тестах, а також у цитокінзалежній лінії культури клітин KG-1 людини.
Інтерлейкін 19 (ІЛ-19). ІЛ-19, або ІЛ-10С, містить 177 амінокислотних залишків, має молекулярну
масу 20 кД, належить до родини цитокінів ІФН/ІЛ-10. Існує у двох ізоформах. Виявлено два
різновиди мРНК. Експресія мРНК ІЛ-10 у стимульованих моноцитах проявляється через 2 год, а
мРНК ІЛ-19 — через 4 год. Ген ІЛ-19 має п'ять екзонів, розташований у хромосомі Iq32 людини.
Структури генів ІЛ-19 та ІЛ-10 подібні, а цитокіни мають близько 25 % гомології за
амінокислотними залишками, однак ІЛ-19 не зв'язується з рецептором ІЛ-10. ІЛ-19 синтезується
моноцитами після оброблення їх бактеріальними ЛПЦ і його синтез збільшується за наявності ІЛ-4
або ІЛ-13 і гальмується ІФН. ГМ-КСФ індукує в моноцитах експресію гена ІЛ-19. ІЛ-19 стимулює
продукування ІЛ-6 і ФНП-α та індукує апоптоз через ФНП-α, зв'язується з рецептором ІЛ-20,
активує сиґнальний індуктор та активатор транскрипції (STAT3).
Інтерлейкін 20 (ІЛ-20). ІЛ-20, або ІЛ-10D, — димер, містить 176 амінокислотних залишків,
кодується геном хромосоми 1 людини поряд із генами ІЛ-10, ІЛ-19, ІЛ-24. Має за амінокислотними
залишками 26 % гомології з ІЛ-10 і 41 % - і ІЛ-19. За структурною організацією ІЛ-20 подібний до
ІЛ-10. ІЛ-20 синтезується кератиноцитами і належить до аутокринних факторів — регулює участь
кератиноцитів у запальних реакціях. Надлишкове продукування ІЛ-20 у трансгенних мишей індукує
загибель новонароджених через пошкодження шкірного покриву внаслідок порушення
епідермальної диференціації. Рецептор цього інтерлейкіну — гетеродимер, який складається з двох
субодиниць (α і β), містить 553 амінокислотних залишки, має 21 % гомології з рецептором ІЛ-10,
кодується геном у хромосомі 6q22 людини. Рецептор експресується на кератиноцитах шкіри і в
особливо великій кількості при псоріазі шкіри. Вбудовування рецептора в клітини лінії
кератиноцитів сприяє активації одного з членів STAT-білків — STAT3. Рецепторний комплекс ІЛ-
20 зв'язує також ІЛ-19 та ІЛ-24.
Інтерлейкін 21 (ІЛ-21). ІЛ-21 має молекулярну масу 18,6 кД, містить 131 амінокислотний залишок і
значною мірою споріднений з ІЛ-2 та ІЛ-15.
Ген ІЛ-21 міститься на хромосомі людини 4q 26-27 біля гена ІЛ-12. Після активації клітин мРНК ІЛ-
21 експресується на СD4Т-лімфоцитах і не виявляється в CD8T-клітинах, моноцитах, В-лімфоцитах.
Рецептор ІЛ-21 — гетеродимер, має молекулярну масу 59 кД, 538 амінокислотних залишків і значну
спорідненість до β-субодиниці рецептора людського ІЛ-2 (CD 122), знаходиться в хромосомі
людини 16р11. Рецепторний комплекс ІЛ-21 містить спільний для рецепторів ІЛ-2, ІЛ-4, ІЛ-7, ІЛ-9,
ІЛ-15 γ-ланцюг (CD132). Рецепторний комплекс ІЛ-21 активує Janus кінази JaK1, JaK3 та STAT-
протеїни — STAT1, STAT3. Рецептор експресується на лімфоїдній тканині, особливо в тимусі й
селезінці, НК, Т-лімфоцитах. Моноклональні антитіла до CD3 збільшують експресію рецептора ІЛ-
21.
ІЛ-21 ефективно стимулює проліферацію CD8T-клітин і значно меншою мірою — СD4Т-клітин
пам'яті та стимулює проліферацію В-клітин, які активовані перехресним зв'язуванням СD40-
антигену, гальмує проліферацію, стимульовану ІЛ-4 і анти-IgM, збільшує стимуляцію проліферації
наївних Т-клітин (CD45 RA) і не впливає на клітини пам'яті (CD45 RO) Т-лімфоцитів у разі
приєднання CD3, за наявності ІЛ-15 стимулює проліферацію кістковомозкових CD16 та CD3 клітин-
попередників, експресію маркера природних кілерів CD56. За наявності ІЛ-21 в культурі клітин
кісткового мозку людини або мишей число кровотворних клітин-попередників збільшується вдвічі,
при цьому також удвічі збільшується і число попередників макрофагів.
ІЛ-21 виявляє антипухлинну активність на мишах, і рекомендується провести дослідження щодо
застосування його для лікування онко- та інфекційних захворювань.
Інтерлейкін 22 (ІЛ-22). Відомий раніше як Т-клітинний індукований фактор (TIF), що має
спорідненість до ІЛ-10, — це глікозильований білок з молекулярною масою 25 кД і 180
амінокислотами, має 20 % гомології з ІЛ-10 людини і 79 % гомології з ІЛ-22 мишей. Синтез ІЛ-22
регулюється Тх1.
Гени ІЛ-22 людини і мишей складаються з шести екзонів; ген людини розміщений у хромосомі
12q15 (недалеко від гена ІНФ-γ та ІЛ-26). У мишей ген ІЛ-22 також розміщений у ділянці гена ІНФ-
γ. Ген ІЛ-22 у мишей деяких ліній існує в одиночних копіях, а в інших — у подвоєній формі. ІЛ-22 з
двома копіями позначаються як ІЛ-22α, а з однією — ІЛ-22β. Обидві форми мають 98 %
нуклеотидної ідентичності, а ген ІЛ-22β має делецію 658 нуклеотидів і може бути неактивним.
Експресія ІЛ-22 може індукуватися ІЛ-9 у Т-клітинах, клітинах тимусних лімфом, мастоцитах, а при
індукуванні лектинами — у свіжовиділених спленоцитах. ІЛ-22 постійно експресується в тимусі та
головному мозку. Експресія ІЛ-22 в клітинах не потребує синтезу білка і залежить від активації
Janus-кіназ і STAT-білків. ІЛ-22 належить до прозапальних цитокінів — при його ін'єкції
індукується синтез білків гострої фази та базофілія нирок, і його синтез зумовлюється
бактеріальними ЛПЦ. На відміну від ІЛ-10, ІЛ-22 не інгібує вироблення прозапальних цитокінів
моноцитами при дії ЛПЦ. ІЛ-22 інгібує продукування ІЛ-4 Тх2.
Рецептор ІЛ-22 належить до родини цитокінових рецепторів типу 2 і містить два ланцюги, один з
яких є бета-ланцюгом рецепторного комплексу ІЛ-10, а другий належить до групи рецепторів CRF2-
4, що експресується в нормі на клітинах печінки та нирок, містить 574 амінокислотних залишки.
Антитіла до бета-ланцюга ІЛ-10 блокують зумовлене ІЛ-22 індукування білків гострої фази. Деякі
клітини, що не відповідають на ІЛ-10, взаємодіють з ІЛ-22 активацією STAT1, STAT3 і STAT5.
Обидва ланцюги рецептора можуть самостійно зв'язуватися з ІЛ-22, але зв'язування ІЛ-22 з
рецепторним комплексом значно ефективніше. Такі сумісні використання рецепторних субодиниць
подібні до сумісного використання спільного гамма-ланцюга такими цитокінами, як ІЛ-2, ІЛ-4, ІЛ-7,
ІЛ-9, ІЛ-15.
Виявлено і розчинний рецептор, який позначено як ІЛ-22-зв'язувальний білок (22ВР) з 231
амінокислотою і 34 % гомології амінокислотних залишків з позаклітинним доменом бета-ланцюга
рецептора ІЛ-22. Ген, що кодує цей рецептор, міститься на хромосомі людини 6q24, недалеко від
гена рецептора 1 ІНФ-γ. Він експресується на різних клітинах, значна його кількість виявляється на
клітинах молочної залози, легень, товстої кишки. Розчинний рецептор зв'язує ІЛ-22 та інгібує його
активність і таким чином виступає як антагоніст цього цитокіну.
Інтерлейкін 23 (ІЛ-23). Цей інтерлейкін складається із субодиниці р40 ІЛ-12 і білка р19
(молекулярна маса 19 кД), який споріднений до ІЛ-6, Г-КСФ і субодиниці р35 ІЛ-12. Окремо р19 не
активний, а в комплексі з р40 — активний. Повноцінний ІЛ-23 секретується активованими
дендритними клітинами.
ІЛ-23 людини стимулює індуковане ФГА продукування ІНФ-γ бластними Т-клітинами і Т-
клітинами пам'яті. Він індукує проліферацію цих клітин. Вірус Сендай (але не вірус ґрипу А)
індукує продукування ІЛ-23 макрофагами людини.
Рецептор ІЛ-23 складається з двох субодиниць — білка рецептора ІЛ-23 і 6ета-1 субодиниці
рецептора ІЛ-12. Рецептор ІЛ-23 зв'язується з бета-1 (але не з бета-2) субодиницею ІЛ-12 і при
цьому зумовлює активацію STAT4 на ФГА-індукованих Т-бластах. Ген рецептора ІЛ-23 розміщений
у 1-й хромосомі людини.
Експресія білка 19 у трансгенних мишах призводить до карликовості, системного запалення,
безплідності і летальності в тримісячному віці. В сироватці виявляється високий рівень
прозапальних цитокінів — ФНП-α та ІЛ-1, кількість нейтрофілів збільшена, постійно виявляються
білки гострої фази. У тварин, у яких білок 19 експресується в печінці, ніяких порушень не виявлено.
Експресія р19, очевидно, існує на гемопоетичних клітинах, оскільки трансплантація клітин
кісткового мозку з експресією р19 зумовлює той самий ефект, що і в трансгенних тварин.
Інтерлейкін 24 (ІЛ-24). Відомий раніше у людей як білок — супресор здатності зумовлювати
пухлини — 16 (ST16), або продукт гена, пов'язаний з диференціюванням меланоми (МДА-7); у
щурів — mob 5, С49а, у мишей — FISP.
Ген ІЛ-24 розміщений на хромосомі людини 1q32 і тісно зв'язаний з генами, які кодують ІЛ-10, ІЛ-
19, ІЛ-20. ІЛ-24 має 206 амінокислотних залишків, значно гальмує ріст меланомних клітин і ріст
колоній цих клітин, вибірково супресує ріст ракових клітин грудної залози людини внаслідок
стимуляції апоптозу. Індукція експресії ІЛ-24 реплікацією дефектного аденовірусу сприяє
підвищенню супресивної активності та індукуванню апоптозу ряду пухлинних клітин — меланом,
різних форм гліобластом, остеосарком, карцином грудної залози, легень, товстої кишки та ін. Будь-
якого несприятливого ефекту не спостерігали після експресії ІЛ-24 на нормальних епітеліальних та
фібробластних клітинах. У гемопоетичних клітинах людини експресія ІЛ-24 індукується в процесі
диференціювання мегакаріоцитів. Рецептором для ІЛ-24 є рецепторний комплекс ІЛ-20, він зв'язує
також ІЛ-19. ІЛ-24 in vitro індукує апоптоз у пухлинних клітинах.
Інтерлейкін 25 (ІЛ-25). ІЛ-25 з молекулярною масою 18,5 кД містить 161 амінокислотний залишок,
кодується геном хромосоми 14q11 людини. Раніше відомий як стимулювальний фактор клітинної
проліферації 20 (SF20), виділяється стромальними клітинами кісткового мозку. Він був виявлений
під час пошуку факторів, що стимулюють клітинну проліферацію. ІЛ-25 підтримує проліферацію
клітин лімфоїдного походження, але не має мієлопоетичної активності.
Рецептор ідентифікований як тимусний загальний антиген 1 (TSA-1). Антитіла до рецептора ІЛ-25
відміняють індуковану ІЛ-25 проліферацію як клітин з постійною наявністю цього рецептора, так і
клітин з відсутністю експресії рецептора ІЛ-25, але штучно індукованої. ІЛ-25 після введення у ніс
мишам індукує продукування ІЛ-4, ІЛ-5, ІЛ-13, мРНК еотаксину в легенях і значну еозинофілію в
бронхоальвеолярному леважі та в легеневій тканині. У цих тварин розвивається також гіперплазія
епітеліальних клітин, збільшується секреція слизу та гіперреактивність дихальних шляхів.
Позбавлення мишей експресії спільної гамма-субодиниці рецептора ІЛ-25 відміняє появу
еозинофіли на введення ІЛ-25.
Інтерлейкін 26 (ІЛ-26). ІЛ-26 з молекулярною масою 20 кД містить 171 амінокислотний залишок.
Відомий раніше як білок АК155 і ML-1, але амінокислотна послідовність АК155 і ML-1 не
однакова. ІЛ-26 і ІЛ-10 характеризуються певною гомологією — ІЛ-26 має 25 % ідентичної і 47 %
подібної послідовності амінокислот з ІЛ-10. ІЛ-26 є гомодимером, подібним до ІЛ-10.
Ген ІЛ-26 розташований на хромосомі 12q15 недалеко від гена ІФН-α та гена ІЛ-22. У
трансформованих вірусом герпесу Т-клітинах виявляється значно збільшена кількість генів ІЛ-26.
ІЛ-26 незначною мірою транскрибується деякими лініями Т-клітин та нативними клітинами
периферичної крові, але не В-клітинами.
Інтерлейкін 27 (ІЛ-27). ІЛ-27 (ІЛ-17D) -гетеродимер, містить 202 амінокислоти, має молекулярну
масу 22 кД, до його складу входять білок ЕВІ-3, що має спорідненість до р40-субодиниці ІЛ-12, і
білок р28, який має спорідненість до р35-субодиниці ІЛ-12. Ген ІЛ-27 розміщений у хромосомі
13q11 та експресується в мозку.
Рецептор ІЛ-27 належить до родини цитокінових рецепторів — WSX-1 (TCCR). ІЛ-27 є продуктом
активованих АПК і стимулює швидку клональну експансію наївних СD4Т-клітин, за винятком
клітин пам'яті. Відмічається синергізм ІЛ-27 та ІЛ-12 у запуску продукування ІФН наївними СD4Т-
клітинами. Він має протипухлинну активність.
Інтерлейкін 28 (ІЛ-28). Внаслідок інфікування вірусами ряду ліній культур клітин в останніх
продукуються подібні до інтерферонів першого типу білки, які мають значну гомологію і були
позначені як ІЛ-28 та ІЛ-29. Вони кодуються генами, розміщеними в 19-й хромосомі людини, поряд
з генами інтерферонів першого типу. ІЛ-28 існує в двох формах — ІЛ-28 А (раніше описаний як
ІФН-λ2) і ІЛ-28В (раніше описаний як ІФН-λ3). ІЛ-28 має 200 амінокислот і належить до родини
інтерферонів першого типу. За послідовністю амінокислот обидві форми ІЛ-28 ідентичні на 96 %, а
з ІЛ-29 – на 81 %. Невеликий рівень гомології виявляється між ІЛ-28 та ІЛ-10, ІФН-α2 та ІЛ-22. ІЛ-
28 експресується на клітинах багатьох типів після обробки їх дволанцюговою РНК або у відповідь
на вірусну інфекцію. Обробка клітин ІЛ-28 захищає їх від вірусної інфекції, але не індукує
антипроліферативну активність. Для обох форм ІЛ-28 і для ІЛ-29 характерні різні рецепторні
композиції субодиниць α-ланцюга Р ІЛ-28 (CRF2- 12) та субодиниці β-ланцюга Р2 ІЛ-10 (CRF2 -14).
α-ланцюг належить до родини цитокінових рецепторів типу 2 і має різну кількість амінокислот —
описані варіанти з 211, 491 і 520 амінокислотами. α-ланцюг з 211 амінокислотними залишками
буває у розчинній формі. Рецептор ІЛ-28 постійно експресується на клітинах багатьох людських
ліній і тканинах та активується через Jak-STAT-систему. Така система рецептор — ліганд є одним з
механізмів антивірусного захисту, але не залежного від індукованого інтерферонами першого типу.
Інтерлейкін 29 (ІЛ-29). Раніше описаний як ІФН-λ1, молекулярна маса 22 кД, містить 200
амінокислотних залишків. Він на 81% ідентичний з обома формами ІЛ-28, кодується геном
хромосоми 19q13. Всі властивості його такі самі, як ІЛ-28. Три гени (ІЛ-28А, ІЛ-28В і ІЛ-29) у 19-й
хромосомі людини формують цитокіновий генний кластер.
Інтерлейкін 30 (ІЛ-30). ІЛ-30 містить розчинну форму субодиниці р28 ІЛ-27 (вона є субодиницею
р35 ІЛ-12). Ген ІЛ-30 розміщений у хромосомі людини 16, взаємодіє з вірусом Епштейн-Барр,
стимулює проліферацію наївних СD4Т-клітин, але не клітин пам'яті, індукує синтез ІНФ-γ, регулює
диференціювання Тх1, зв'язується рецептором ІЛ-27.
Інтерлейкін 31 (ІЛ-31). Рецептор ІЛ-31 має дві субодиниці — ІЛ-31РА (GLMR, CRL3) і
субодиницю рецептора цитокіну OSM - OSMP. ІЛ-31Р експресується в активованих моноцитах і
постійно в епітеліальних клітинах. Субодиниця ІЛ-31РА є сигналіндукувальною — потенціює
функції моноцитів і макрофагів і є спільною для цитокінових рецепторів родини ІЛ-6, Ген ІЛ-31 РА
міститься в хромосомі 5q11.2 людини і в 13-й хромосомі мишей. Продукується ІЛ-31 в основному
активованими Тх2, стимулює розвиток запального процесу, інфільтрацію його клітинами відіграє
певну роль у розвитку атопічних захворювань шкіри. У мишей, позбавлених ІЛ-31Р, виникає
алопеція, ураження шкіри.
Інтерлейкін 32 (ІЛ-32). ІЛ-32, раніше відомий як NK-4 (natural killer сеll transcript 4) існує в НК у
чотирьох варіантах – α, β, δ, γ. Ген ІЛ-32 локалізований; хромосомі 16р13.3 мРНК ІЛ-32
експресується в основному на клітинах імунної системи. ІЛ-32 відіграє важливу роль у регуляції
запальних і аутоімунних процесів, значно збільшує продукування ФНПα, ІЛ-8, МІР-2.
9.2. ІНТЕРФЕРОНИ.
Інтерферони (ІФН) — велика група біологічно активних білків (глікопротеїнів), які синтезуються
різними клітинами макроорганізму в процесі активації вірусами, бактеріями, мітогенами. Вперше
ІФНи було виявлено під час вивчення вірусної інтерференції, зумовленої, як виявилося пізніше,
ІФНами. Інформація про структуру молекул ІФН-α і ІФН-β людини (ІФНи І типу) — закодована в
клітинному геномі в 9-й, а ІФН-γ (ІФНи II типу) — у 12-й хромосомі. У мишей гени ІФН- α і ІФН-β
знаходяться в 4-й, а ген ІФН-γ — у 10-й хромосомі.
Нині відомо понад 20 різновидів ІФНів, які за структурою, біологічними властивостями і місцем
утворення об'єднані в 3 види (α, β γ): ІФН-α синтезується лейкоцитами під дією вірусів і називається
ще лейкоцитарним; ІФН-β синтезується фібробластами та іншими соматичними клітинами під дією
вірусів, і його ще називають фібробластним, ІФН-γ, або імунний, або ІФН II типу, синтезується
сенсибілізованими активованими Тх1, цитотоксичними Т-лімфоцитами та НК. ІФН-α та ІФН-β —
білки з молекулярною масою 20 — 40 кД, які мають високу стійкість до рН, осаджуються
насиченим розчином сульфату амонію, α- та β-ІФНи на 40 — 50 % гомологічні і зв'язуються
спільними для них рецепторами. γ-ІФН термолабільний і не витримує рН = 2. ІФНи мають видову
специфічність. Рецептори до ІФН-α та ІФН-β виявляються на більшості клітин організму і
відрізняються від рецепторів до ІФН-γ (CD119), які виявляються переважно на моноцитах,
макрофагах, ендотеліальних клітинах.
ІФНи і за складом, і за біологічною активністю відрізняються від антитіл — дія їх неспецифічна.
Вони мають видову специфічність, діють в основному на внутрішньоклітинні процеси і мають
широкий спектр захисних реакцій. Вони можуть перешкоджати розмноженню вірусів, гальмувати
розвиток бактеріальних інфекцій, підвищувати активність багатьох ланок неспецифічної
резистентності та специфічних реакцій.
Противірусна активність зумовлена не прямою дією ІФНів, а дією їх на клітини. Під час вірусної
інфекції інфіковані клітини виділяють у позаклітинний простір ІФН, який зв'язується з
відповідними рецепторами незаражених клітин і проникає в них. Під впливом ІФНів у клітинах
синтезується 2,5-олігоаденілатсинтетаза, що активує латентну ендорибонуклеазу, яка руйнує
вірусну РНК. Крім цього, ІФНи активують серинтреонінову протеїназу, яка фосфорилює фактор
ініціації білкового синтезу eTF2, що і зумовлює пригнічення реплікації вірусу. Особливо важливу
роль відіграє ІФН-γ у формуванні захисних реакцій при запаленні. Він різко підвищує активність
фагоцитів, природних кілерів, активує ендотеліальні клітини і цим самим сприяє прискоренню
міграції лейкоцитів у зону запалення.
При онкозахворюваннях ІФНи можуть інгібувати пухлинний ріст прямою блокадою проліферації
пухлинних клітин, лізувати пухлинні клітини, активувати онкоцидну активність природних кілерів
та макрофагів шляхом імуномодуляції.
ІФН-α і ІФН-β чинять цитостатичну дію на пухлинні клітини в усіх фазах клітинного циклу,
меншою мірою вони виявляють цитотоксичну дію. ІФН-γ цитотоксично діє у фазі G1 клітинного
циклу. Слід зазначити, що сумісна протипухлинна дія α-, β- і γ-ІФН ефективніша, ніж одного з них.
Так, з 6 видів пухлин ІФН-α інгібує 2, а ІФН-β — 4; за сумісного введення ІФН-α і ІФН-β
пригнічується ріст усіх шести видів пухлин та гальмується ріст трьох типів клітин пухлин легень,
які нечутливі до окремо взятих ІФНів. У разі зниження рівня ІФНів під час різних патологічних
процесів введення препаратів ІФНу призводить до нормалізації ІФНогенезу. ІФНи мають широкий
спектр імуномодуляційної дії під час різних патологічних процесів, що спричинюють порушення
функціонування різних ланок захисних систем. Основні з них — рекрутування ефекторних клітин
шляхом модуляції процесів їх диференціювання, дозрівання й проліферації; активація ефекторних
клітин — макрофагів, моноцитів, природних кілерів; збільшення експресії антигенів, насамперед
антигенів МНС, які підвищують ефективність імунного розпізнавання.
ІФНи захищають нормальні фібробласти від дії природних кілерів, але не захищають інфіковані
вірусами клітини.
Слід мати на увазі, що останнім часом отримано багато форм рекомбінантних ІФНів, які знайшли
широке застосування в профілактиці та лікуванні вірусних і бактеріальних інфекцій, а також при
онкозахворюваннях та деяких видах імунодефіциту.
9.3. ФАКТОРИ РЕГУЛЯЦІЇ ГЕМОПОЕЗУ.
Гранулоцито-макрофагальний колонієстимулювальний фактор (ГМ-КСФ). ГМ-КСФ, або
колонієстимулювальний фактор α(КСФ-α), людини — це глікопротеїн, близько 50 % якого
становлять вуглеводи, розміщені в N-глікозидних ланцюгах, містить 127 амінокислотних залишків і
має молекулярну масу білкової частини 22 кД. Виявлено ряд форм, які відрізняються ступенем
глікозилювання. Цитокін має видову специфічність, і гомологія з мишачим аналогом становить
56%. За просторовою будовою ГМ-КСФ належить до родини чотириспіральних цитокінів – ІЛ-2, -4,
-5 і М-КСФ.
Рецептори до ГМ-КСФ виявлено на гранулоцитах, моноцитах, фібробластах, ендотеліоцитах.
Рецептор до ГМ-КСФ складається з α- і β-субодиниць. Цитокінспецифічна α-субодиниця (CDw 116)
— білок з молекулярною масою 88 кД і 378 амінокислотними залишками. Сиґналіндукувальна (CD
131) β-субодиниця з масою 120 — 140 кД має 882 амінокислотних залишки і є загальною для
рецепторів ГМ-КСФ, ІЛ-3 та ІЛ-5, гомологічними є і N-кінцеві ділянки їх α-субодиниць. Зв'язування
ліганду індукує фосфорилювання за тирозином деяких клітинних білків. Ген ГМ-КСФ
локалізований у 5-й хромосомі поряд з генами ІЛ-3 і рецептора М-КСФ.
Клітинами — продуцентами ГМ-КСФ є стимульовані лімфоцити, макрофаги, фібробласти,
ендотеліоцити. В крові фактор не виявляється. Клітинами-мішенями є гемопоетичні попередники
мієлоїдних клітин, гранулоцити, моноцити, еозинофіли. Разом з ІЛ-3 ГМ-КСФ належить до ранніх
поліпотентних гемопоетичних факторів. Біологічна функція — підтримання проліферації та
диференціювання ростків мієлопоезу та моноцитопоезу в кістковому мозку, а також прискорення
проліферації й диференціювання ряду лейкоцитів — нейтрофілів, моноцитів та дендритних клітин.
Він підтримує ріст колоній ПМЯЛ, макрофагів у напівтвердому агарі, разом з еритропоетином
індукує утворення колоній еритроцитів і змішаних колоній з мегакаріоцитами.
