Вершигора А.Ю., Пастер Є.У., Колибо Д.В. Імунологія
Подождите немного. Документ загружается.


11
У нормі компоненти комплементу неактивні, однак під час різних патологічних процесів
активуються комплексом антиген—антитіло, а також деякими неспецифічними факторами,
внаслідок чого індукуються різні біологічні ефекти. Винятком є С3-компонент комплементу, який
постійно активується в незначній кількості, при цьому зв'язується з певними поверхневими
структурами чужорідних клітин, запускаючи в такий спосіб альтернативний шлях активації
комплементу.
У спеціальній літературі активовані компоненти комплементу позначають горизонтальною лінією
над їхньою назвою, наприклад, активовані С1, С2, СЗ, С4 позначають
1C
,
2C
,
3C
,
4C
. Слід
зазначити, що прийнятий порядок написання компонентів комплементу зумовлений не черговістю
їх вступу в реакцію, а порядком їх відкриття.
Активація комплементу (тобто окремих його компонентів) відбувається у певній послідовності у
вигляді каскаду ферментних реакцій, при цьому продукт попередньої реакції є каталізатором або
ефектором для вступу в реакцію наступних компонентів. При активації компоненти комплементу
стають біологічно активними і набувають функції різних ферментів, активаторів, які відіграють
важливу роль в імунному цитолізі, реакції фагоцитозу та інших функціях захисту організму.
Нині відомо два основних шляхи активації (запуску) системи комплементу: класичний і
альтернативний, хоча за деяких умов комплемент може бути активований іншими шляхами. Етапи
активації комплементу обома шляхами наведено на мал. 20. Слід зазначити, що активація
комплементу відбувається лише у місцях утворення комплексу АГ — АТ та приєднання С3b або
С3(Н
2
О) до відповідних структур чужорідної клітини.
Класичний шлях активації комплементу. Основою активації комплементу класичним шляхом є
участь компонентів С1, С4, С2 з утворенням С3-конвертази — С1С4bС2а. Головним механізмом
цього процесу є утворення комплексу АГ—АТ імуноґлобулінами IgM, IgG1, IgG3 і IgG2 (мал. 20, а).
У складі доменів Сm4, Сα2 цих імуноглобулінів, міститья ділянка, що має спорідненість до C1q,
однак вона стає доступною тільки після утворення комплексу АГ – АТ.
За наявності комплексу АГ —АТ C1q-компонент своєю глобулярною частиною приєднується до
СН-домену Н-ланцюга глобуліну в ділянці N-кінцевої половини Fc-фрагмента IgGl, IgG2, IgG3 або
IgМ. Обов'язковою умовою активації комплементу є наявність у комплексі АГ — АТ не менш як
двох молекул IgG, що щільно прилягають одна до одної, або однієї молекули IgM щонайменше з
двома валентностями, що прореагували з антигеном. Компонент С1 комплементу людини
складається з п'яти субодиниць — однієї C1q, двох C1r і двох C1s і в плазмі крові міститься у
вигляді комплексу двох слабовзаємодіючих субодиниць — C1q і тетраметра Сlr
2
— Сls
2
. Компонент
C1q має зв'язувальний центр для активатора. Окремі субодиниці утримуються разом у вигляді
комплексу завдяки наявності йонів Са
2+
.
Субодиниця C1q – це колагеноподібний білок, що складається з шести комплектів А-, В- і С-
ланцюгів. Кожна трійка ланцюгів (А, В і С) у своїй колагеновій частині утворює потрійну спіраль, а
на С-кінці ланцюги утворюють загальну глобулярну структуру у вигляді головок, які містять
відповідальні за зв'язування з імуноґлобулінами 1—3 активні ділянки. C1q має значну стійкість і
зберігає свою нативність у процесі зв'язування комплементу з імуноґлобулінами, звільняється при
руйнуванні комплексу комплемент — антиген — антитіло і може ще до трьох разів зв'язуватися з
новими імунними комплексами.
Під час взаємодії C1q з комплексом АГ —АТ відбуваються його конформаційні зміни, в результаті
чого C1q набуває активності серинової протеїнази (естерази), субстратом якої є молекули С1r та
C1s. Під дією C1q-естерази ланцюги спочатку С1r, а потім C1s розщеплюються на контактні й
каталітичні фрагменти, які не вивільнюються у навколишнє середовище завдяки наявності
дисульфідних зв'язків. У результаті попарної взаємодії контактних і каталітичних фрагментів С1r та
C1s вони вбудовуються в молекулу C1q, що призводить до утворення за наявності йонів Са
комплексу C1q — r2s2 з активністю трипсинової естерази (С1-естерази), який може існувати в
розчиненій та зв'язаній на мембрані клітин формі. Специфічність новоутвореного комплексу
складається зі специфічностей С1r та C1s, субстратом для С1r є C1s, а для C1s-C4 і С2.
При розщепленні С4-компонента утворюється два фрагменти — легкий С4а зі слабкою
анафілактичною активністю та важкий С4b. Фрагмент С4b дуже нестабільний, він швидко,
впродовж мілісекунд зазнає атаки різних ферментних груп, однак має властивість швидко
зв'язуватися з аміно- та гідроксигрупами на клітинній мембрані й таким чином стабілізуватися.
Компонент С4 існує в двох ізотипах — С4А та С4В, які кодуються тандемно розміщеними генами
МНС. У процесі активації С4А зв'язується з аміногрупами білків, а С4В — з гідроксигрупами
вуглеводів. С4b взаємодіє з комплексом C1qr2s2, внаслідок чого С2 може оборотне зв'язуватися з
С4b і стає субстратом для естерази C1s. Внаслідок дії С1-естерази від С2 відщеплюється менший
фрагмент C2b, a більший фрагмент С2а, що залишився, є трипсиноподібною протеазою.
Магнійзалежний комплекс C1qrs4b2a є С3-конвертазою — ключовою ланкою класичного шляху
активації комплементу.
Комплекс C1qrs4b2a здатний ковалентно фіксуватися на клітинній мембрані завдяки наявності в
структурі С4b тіоскладноефірного зв'язку між залишками цистеїну та глутаміну. Не зв'язаний
комплекс С12а4b швидко інактивується.
Мішенню для С3-конвертази є СЗ-компонент комплементу. Під дією С3-конвертази від N-ділянки
α-ланцюга С3-компонента комплементу відщеплюється фрагмент С3а і залишається фрагмент С3b.
До фіксованого комплексу С14b2а приє нується С3b-компонент, внаслідок чо формується С5-
конвертаза — С14b2а3b. Компонент С3а залишається в рідинній фазі, має хемотаксичну активність.
Розщеплення С3-компонента комплементу з утворенням С3b-фраґмента є найважливішим
загальним процесом як для класичного, так і для альтернативного шляхів активації системи
комплементу.
Незв'язаний фрагмент С3b швидко розщеплюється в рідинній фазі з утворенням низки біологічно
активних фрагментів С3-компонента комплементу — іС3b, С3d, С3с, С3е, C3q, які мають певну
біологічну активність, проте швидко інактивується в сироватці крові.
С5-конвертаза — С14b2а3b — відщеплює від N-кінця α-ланцюга С5 фраґмент С5а, який має значну
анафілактичну активність і швидко (як й інші анафілатоксини — С4а, С3а) інактивується
ферментом крові карбоксипептидазою N. Більші фрагмент С5b, який може зв'язуватися комплексом
С14b2а3b на клітинній мембрані або перебувати в розчині, є ініціатором самозбирання
мембраноатакуючого комплексу, яке відбувається без участі ферментів як на клітинних мембранах,
так і в рідинній фазі. Компонент С5b може безпосередньо фіксуватися на комплексі С1423,
внаслідок чого виникає здатність приєднувати С6, а потім С7 і утворювати гідрофобний комплекс
С567.
За допомогою β-ланцюга С7-компонента комплекс С567 приєднується до клітинної мембрани
недалеко від місця первинної активації комплементу, стабілізується і набуває здатності приєднувати
С8-компонент. Комплекс С5678 набуває незначної літичної активності завдяки здатності його
пронизувати наскрізь мембрану і формувати пори діаметром 3 нм, що забезпечує проникнення в
клітину низькомолекулярних речовин. Крім того, комплекс С5 —8 набуває здатності зв'язувати і
вбудовувати в клітинну мембрану кількох (від 12 до 21) молекул компонента С9, що збільшує
літичну дію комплексу в тисячу разів. С9-компонент є особливим білком, гомологічним перфорину,
здатний полімеризуватися при контакті з фосфоліпідними структурами. Еліпсоїдальні молекули С9
набувають витягнутої форми, пронизують наскрізь двошарову ліпідну мембрану клітин і формують
лійкоподібний канал діаметром 8—12 нм. Через канал надходять йони Н
+
, Na
+
і вода (але не білки),
що спричинює розрив мембрани і загибель клітини. Зовнішня поверхня літичного комплексу
утворена гідрофобними, внутрішня — гідрофільними структурами. Фактично комплекс С5 —8 є
каркасом, на якому будується літична конструкція з молекул С9.
Активація комплементу класичним шляхом без участі комплексу АГ—АТ. У процесі еволюції
виробилися механізми активації комплементу класичним шляхом без участі комплексу антиген —
антитіло як захисна реакція при різних хворобах, за яких відсутні чужорідні антигени (неінфекційні
хвороби) або відбувається сильне пригнічення антитілоутворення (при вираженій патогенності
збудника), або є інші причини, пов'язані з відсутністю комплексів антиген —антитіло. Ціла низка
факторів активують комплемент за участю С1-компонента без комплексу АГ—АТ за класичним
шляхом.
Агреговані імуноґлобуліни. В процесі агрегації імуноглобулінів унаслідок різних захворювань, під
впливом різних ліків, токсинів у них з'являються зони, які можуть приєднувати C1q-компонент, що
індукує активацію комплементу за класичним шляхом.
С-Реактивний білок (СРБ) з'являється в організмі при патологічних станах. На СРБ в процесі
взаємодії з фосфохолінами мікроорганізмів та фосфоліпідами ушкоджених власних клітин
фіксується С1-компонент, що сприяє активації системи комплементу.
Продукти активації системи згортання крові, фібринолітичної та кінінової систем здатні
зв'язувати С1-компонент і в такий спосіб запускати активацію комплементу без участі комплексу
антиген — антитіло.
Лізосомальні ферменти лейкоцитів. У здоровому організмі їх у вільному стані майже не буває. Під
час різних патологічних процесів їх кількість збільшується внаслідок зростання продукування та
виділення лізосомальних ферментів або руйнування лейкоцитів. Лізосомальні ферменти можуть
фіксувати С1-компонент і активувати комплемент.
Ряд РНК-вірусів (вірус лейкозу Молоні, вірус везикулярного стоматиту) та мікоплазми можуть
приєднувати С1-компонент і запускати активацію комплементу. Відомі також способи активації
комплементу класичним шляхом без участі комплексу антиген — антитіло та компонентів
комплементу С1, які зумовлені манозозв'язувальним білком та реактивним фактором Ra.
Манозний шлях активації комплементу зумовлений наявністю на мембранах бактеріальних клітин
кінцевих манозних груп і манозозв'язувальних лектинасоційованих серинових протеаз 1 і 2,
гомологічних за структурою С1r- і C1s-компонентам комплементу. В плазмі крові існує
манозозв'язувальний білок. Слід зазначити, що на клітинних мембранах макроорганізмів манозних
груп немає або вони замасковані залишками сіалових кислот. У разі появи в організмі бактерій
манозозв'язувальні білки взаємодіють з манозними залишками, що призводить до ініціювання
здатності манозозв'язувальних лектинасоційованих серинових протеаз активувати С4- і С2-
компоненти комплементу і запускати активацію комплементу.
Ra-реактивний фактор, виявлений в організмі всіх хребетних, розпізнає ЛПЦ стінки
грамнегативних бактерій і після приєднання до них може активувати С4 та С2, запускаючи
активацію комплементу.
Ліпополіцукриди (ендотоксини) грамнегативних бактерій можуть активувати комплемент і за
класичним шляхом зі зв'язуванням C1q-компонента за допомогою ліпіду А, і за альтернативним,
зумовленим здатністю поліцукриду фіксувати С3(Н
2
О).
Альтернативний шлях активації комплементу. За альтернативним (обхідним, пропердиновим)
шляхом активація комплементу розпочинається з активації С3-компонента без участі комплексів АГ
—АТ і компонентів С1, 2, 4 (див. мал. 20, б). Цей шлях ініціюється речовинами й факторами, які
можуть фіксувати С3-конвертазу (С3bВb) і активувати С3-компонент за наявності пропердину без
залучення ранніх компонентів С1, С2, С4. Це деякі речовини клітинної поверхні бактерій (глюкан,
зимозан, мураміл-пептид, поліцукриди, ЛПЦ), поліцукриди рослинного походження, деякі речовини
на вірусних частинках, інфікованих вірусом клітинах, пухлинних клітинах, паразитах, комплекси
АГ—АТ IgA і IgE (які не мають ефекторних центрів до C1q), агреговані IgG і комплекси F(аb)
2
-
фраґментів антитіл з антигеном, еритроцити кролів (але не інших тварин), патогенні білки
(нефротичний фактор), отрута кобри.
Однією з умов ініціювання альтернативного шляху активацій комплементу є виникнення
активованого С3, тобто С3b-компонента, що з'являється постійно у невеликій кількості внаслідок
розщеплення С3 протеолітичними ферментами, які циркулюють у крові, або через спонтанний
гідроліз тіоефірного зв'язку в молекулі С3, яка тимчасово може мати розгорнуту конфігурацію. При
цьому відбувається взаємодія тіоефірного зв'язку з водою, що зумовлює гідроліз зв'язку і
стабілізацію розгорнутої конформації. В результаті цього відбувається спонтанна активація С3 з
утворенням незначної кількості активної С3b-подібної сполуки — С3(Н
2
О), яка може запускати
активацію комплементу. За наявності йонів магнію до С3(Н
2
О)-компонента, який може перебувати
в рідинній фазі або бути фіксованим на поверхні клітин, приєднується фактор В і утворюється
комплекс С3(Н
2
О)В.
Фактор В (проактиватор С3) — це одноланцюгова β-ґлобулінова серинова протеаза. У людини він
кодується геном у 6-й хромосомі, який тісно пов'язаний з геном для компонента комплементу С2. За
розміром, будовою, природним субстратом (С3) і механізмом дії сам фактор В подібний до С2-
компонента. В результаті зв'язування фактора В з С3 (Н
2
О)-комплексом ділянка молекули фактора В
оголюється, внаслідок чого стає доступною для протеолітичної дії фактора D.
Фактор D — це одноланцюговий глікопротеїн із серин-естеразною активністю; у сироватці він може
циркулювати в неактивному й активному стані і активуватися під дією трипсиноподібних ферментів
лейкоцитів та пропердину. В результаті протеолітичної дії фактора D від фактора В у складі
комплексу С3(Н
2
О)В відокремлюється фактор Ва, а в комплексі лишається Bb-фактор.
Новоутворений бімолекулярний комплекс С3(Н
2
О)Вb діє як С3-конвертаза і фіксується на
вуглеводних структурах клітинної поверхні. Ферментативна активність комплексу С3(Н
2
О)Вb
зумовлена Вb-компонентом. С3(Н
2
О)Вb утворюється в незначній кількості, однак ініціює фазу
ампліфікації шляхом розщеплення С3 і утворення С3b, який після приєднання Вb формує комплекс
С3bВb. Під дією на С3 комплексу С3bВb (С3-конвертази) прискорюється утворення С3b-
компонента. В розчині комплекс С3bВb швидко інактивується фактором Н (він витісняє Вb з
комплексу) і фактором І, який розщеплює α-ланцюг С3-компонента. Основним фактором, який
стабілізує С3bВb-комплекс, є пропердин (Р). За наявності пропердину складання цього комплексу
прискорюється, а після приєднання він захищає його від дії фактора Н. Захищають також комплекс
C3bВb від інактивації фактором Н розміщені на поверхні бактеріальних клітин ліпополіцукриди,
поліцукридні токсини, зимозан та інші структури. Пропердин здатний зв'язуватися зі структурами
клітинної мембрани і сприяти фіксації на ній С3-конвертази. При фіксації надлишку С3b-
компонентів утворюються комплекси PC(3b)nBb, які є С5-конвертазами альтернативного шляху
активації комплементу. Ферментативна активність С5-конвертаз пов'язана з фрагментом Вb.
С3- і С5-конвертази альтернативного шляху активації комплементу розщеплюють компоненти
комплементу С3 і С5, внаслідок чого утворюються біологічно активні речовини, які за своєю
функцією однакові як для класичного, так і для альтернативного шляхів активації комплементу.
Кінцевий етап альтернативного шляху активації комплементу — утворення мембраноатакуючого
комплексу МАК-С56789.
Реляція процесу активації комплементу. На різних етапах активації комплементу в ній беруть
участь різноманітні регулювальні фактори (табл. 8). Певну роль у регуляції відіграє те, що всі
компоненти комплементу містяться в крові у формі неактивних попередників, які здатні
активуватися тільки за наявності відповідних субстратів, а також висока лабільність і
короткоживучість активованих компонентів та комплексів комплементу. Крім того, в плазмі крові
та на клітинних мембранах існує кілька факторів, які регулюють активність багатьох компонентів і
комплексів комплементу.
На перших етапах в активації комплементу класичним шляхом беруть участь два інгібітори C1q —
розчинний C1qІ та мембранний MC1qІ, які можуть блокувати зв'язування C1q-компонента з
комплексом антиген —антитіло.
На етапі утворення С1-естерази регулятором є інгібітор С1-естерази, С1І, який перешкоджає
необмеженій дії С1-естерази на С4 і С2 в рідинній фазі. Цей глікопротеїн зв'язується з активним
центром активованих С1r і C1s і пригнічує їх протеазну активність. Нестача цього інактиватора
призводить до появи захворювання, відомого як природжений ангіоневротичний шок.
12
Інактиватор C4b/C3b, або фактор І, пригнічує утворення С3-конвертази шляхом перетворення С3b
на іС3b, який не може брати участі в наступних етапах активації комплементу. На мембрані клітин
фактор І розщеплює С4b, а в рідинній фазі він може розщеплювати С4b тільки за наявності С4b-
зв'язувального білка С4bр. Після приєднання до С3-конвертази (С4b2а) C4bp сприяє її дисоціації.
У процесі активації комплементу утворюється ряд анафілатоксинів (С4а, С3а, С5а), які можуть
зумовлювати каталітичні процеси. Вони інактивуються карбоксипептидазою N внаслідок
відщеплення від С-кінця аргінази. При цьому лише в С5а зберігається хемотаксична активність.
При активації комплементу альтернативним шляхом фактор Н ініціює дисоціацію комплексу С3bВb
відщепленням Вb-компонента, а також є кофактором фактора І при розщепленні α-ланцюга С3.
Важливу роль в обмеженні активності мембраноатакуючого комплексу в рідинній фазі відіграє S-
білок, який при приєднанні до С567 гальмує його здатність проникати в подвійний ліпідний шар і
брати участь у формуванні структури мембранного каналу.
Виявлено зворотний зв'язок у регуляції синтезу С3-компонента комплементу продуктами його
розпаду. Такий механізм регуляції активності комплементу є особливо важливим при хронічних
захворюваннях, в умовах підвищеної активації комплементу. Одним з важливих способів регуляції
активності комплементу є дія імуноконглютинів, тобто аутоантитіл до прихованих детермінант
комплементу, які оголюються тільки в процесі їх активації.
Біологічна активність окремих компонентів комплементу. При активації комплементу
активується і заново утворюється значна кількість речовин з різними біологічними властивостями.
Біологічна активність системи комплементу зумовлена наявністю на чутливих клітинах відповідних
рецепторів до окремих компонентів комплементу. Дані про основні рецептори до компонентів
комплементу на клітинах людини наведено в табл. 9.
Коротко схарактеризуємо основні біологічні активності системи комплементу та окремих
компонентів.
Лізис клітин — комплекс С56789 і з меншою ефективністю С5678.
Хемотаксична активність — основний фактор С5а, менш виражена здатність у С3а, С567, Ва; при
зв'язуванні з фагоцитами вони активують їх.
Опсонізуюча активність — найбільш виражена у С3b, менше — у С4b, іС3b, C5b, C2; вони також
сприяють виділенню лізосомних ферментів із макрофагів.
Підвищення проникності судин — С5а, С3е.
Посилення лейкоцитозу — С3е.
Стимуляція внутрішньоклітинних процесів – С5а, С3b.
Анафілактична активність — С3а, С5а, С4а, C4d, C4dg; найвища у С5а-компонента. Вони
активують мастоцити, а також індукують агрегацію і дегрануляцію тромбоцитів. У результаті цього
у навколишнє середовище виділяється багато біологічно активних речовин (гепарин, гістамін,
хемотаксичні речовини, продукти активації арахідонової кислоти та ін.), які можуть зумовлювати
різні біологічні ефекти — розширення кровоносних капілярів, активацію тромбоцитів тощо. При
нанесенні на шкіру вони спричинюють почервоніння.
Активація фагоцитозу — C1q, С3b.
Стимуляція експресії рецепторів до С3b — С5b. На фагоцитувальних клітинах є великий пул
латентних рецепторів до С3b і при стимуляції поліморфно ядерних лейкоцитів компонентом С5b їх
кількість збільшується з 5 до 10 тисяч.
Регуляція імунної відповіді. С3а пригнічує продукування імуноґлобулінів (шляхом індукції
супресорів CD8) на ранніх стадіях імунної відповіді, а С5а підсилює імунну відповідь унаслідок
взаємодії з Іа
+
- макрофагами, які мають поверхневі рецептори для С5а, в результаті чого виділяється
ІЛ-1. Разом з тим С3b підсилює синтез ДНК у В-лімфоцитах мишей та ІЛ-2-залежну проліферацію
Т-лімфоцитів.
Антипухлинна дія. C3d і С3b людини значно підсилюють цитоліз клітин-мішеней збільшенням
продукування ІЛ-2. С3 активує макрофаги, і вони набувають цитотоксичності до пухлинних клітин.
С5а зв'язується з макрофагами мишей через специфічний рецептор та індукує секрецію ІЛ-1, який
сприяє руйнуванню пухлинних клітин.
Нейтралізація вірусів. С4b самостійно здатний нейтралізувати вірусні частинки. За субоптимальної
концентрації С4b в реакцію вступають С2 і СЗ, які зв'язуються з поверхнею вірусних частинок і
блокують рецептори, що відповідають за проникнення вірусу в клітини-мішені.
Фактори захисту клітин від власного комплементу. В процесі еволюційного розвитку в організмі
виробилася система захисту власних клітин від дії активованих компонентів комплементу, як
розчинних, так і фіксованих на клітинних мембранах.
Фактор, який прискорює дисоціацію С3-конвертази, — CD55 (DAF) взаємодіє з С3b-компонентом,
що призводить до дисоціації С3/С5-конвертази на С2а і С4b. Мембранний кофакторний білок CD46
зв'язується з С3b і С4b і стимулює їх деградацію фактором І.
Рецептор комплементу 1 типу CD35(CRI) зв'язує С3b і С4b і тим самим пригнічує зв'язування С2 з
С4b, прискорює дисоціацію С4b2а і стимулює руйнування С4b і С3b під дією фактора І.
Деякі білки плазми крові під час взаємодії з незв'язаними мембраною комплексами С5b67
запобігають їх фіксуванню на мембрані клітин. До цих білків належать ліпопротеїни низької
щільності та регуляторний S-білок (вітронектин). При утворенні комплексів цих білків з С5b67 до
них можуть ще приєднуватися С8- і С9-компоненти комплементу, однак новоутворені комплекси не
здатні фіксуватися на клітинній мембрані і формувати мембранний канал та лізувати клітини.
Певну роль у захисті власних клітин від приєднання мембраноатакуючого комплексу відіграють
деякі видоспецифічні мембранні глікопротеїди, названі факторами гомологічної рестрикції. Один з
них — білок CD59, або протектин, МАС-інгібітор — при зв'язуванні з С5b678 та з С9 обмежує
число молекул С9, які здатні зв'язуватися з комплексом, та інгібує занурення С9 у ліпідний шар.
Аналогічну активність має і С8-зв'язувальний білок (8bр) та фактор гомологічної рестрикції, але з
меншою активністю. Трансмембранний глікопротеїд глікофорин А інгібує приєднання комплексу
С5b6 до клітинної мембрани.
Стійкість клітин до дії власного комплементу може бути зумовлена також здатністю клітин активно
вилучати мембраноатакуючий комплекс шляхом ендо- й екзоцитозу фрагментів мембрани з
активованими компонентами комплементу.
На клітинних мембранах макроорганізму захисну роль відіграють залишки сіалових кислот, без
яких інгібітор Н неактивний і дія якого спрямована на дисоціацію фіксованих на поверхні клітин
комплексів С3bВb.
Методи виявлення активації комплементу і дефіциту компонентів комплементу. Кількісне
визначення рівня окремих компонентів комплементу проводять за допомогою імуноферментних
методів, методами радіальної імунодифузії, рокетімуноелектрофорезу або лазерної нефелометрії з
широким застосуванням моноклональних антитіл. Проте визначення концентрації компонентів не
дає інформації про функціональну цілісність молекул компонентів або системи комплементу. Для
цього визначають загальну гемолітичну активність класичного шляху активації комплементу СН50;
її немає в разі дефіциту будь-якого компонента комплементу, за винятком компонента С9. Низьке
значення рівня СН50 може бути зумовлене природним дефіцитом окремих компонентів
комплементу або дефіцитом, зумовленим неправильним зберіганням та зв'язуванням низки
компонентів у процесі згортання крові. Вид дефіциту комплементу визначають за допомогою
очищених компонентів комплементу, які додають у гемолітичну систему.
2.1.2. Білки гострої фази.
Важливу захисну роль на початкових етапах виникнення інфекційного процесу відіграють так звані
білки гострої фази. Після проникнення в організм патогенів продукти їхньої життєдіяльності та
руйнування стимулюють синтез макрофагами і природними кілерами ІЛ-1, ІЛ-6, ФНП-α, які
індукують вироблення печінкою білків гострої фази. Основними представниками цих білків є С-
реактивний білок (СРБ), манозозв'язувальний білок (МЗБ), амілоїди сироватки А і Р, фібриноген, β-
глобуліни, транспортні білки, компоненти систе комплементу та ін. Ці білки інтенсивно
синтезуються впродовж перших двох діб інфекційного процесу і за інтенсивних запальних процесів
їх концентрація може збільшуватися в десятки і сотні разів. Вони мають різну біологічну активність,
основна з яких — нейтралізація і знешкодження патогенів, відіграють надзвичайно важливу роль на
перших етапах формування захисних реакцій, коли ще відсутні специфічні імуноґлобуліни та
клітинні фактори.
С-реактивний білок належить до родини пентраксинів (білків, до складу яких входять п'ять
однакових субодиниць) і володіють властивостями С-лектинів — здатні зв'язувати вуглеводи. У
нормі концентрація СРБ становить близько 1 мкг/мл, а за гострого запалення — до 1 — 2 мг/мл
сироватки. СРБ має спорідненість до фосфорилхоліну будь-яких клітин. Фосфорилхоліни клітинної
мембрани макроорганізму, що входять до складу фосфоліпідів, перебувають у формі, що не
розпізнаються СРБ. У більшості патогенів, особливо у грампозитивних бактерій, фосфорилхоліни
відкриті. При фіксації СРБ на фосфорилхоліні мікроорганізмів чи пошкоджених клітин оголюються
ділянки, здатні взаємодіяти з комплементом і запускати його активацію за класичним або
альтернативним шляхом. СРБ під час зв'язування з мікроорганізмами можуть відігравати poль
хемоатрактантів для ПМЯЛ і опсонінів – для фагоцитів. Певну роль в активації фагоцитозу
відіграють фрагменти молекул СРБ, що звільняються після взаємодії з фосфорилхоліном.
Амілоїд Р сироватки за структурою подібний до СРБ і може активувати комплемент. Амілоїд
сироватки А — ліпопротеїн, володіє функціями хемоатрактантів ПМЯЛ, моноцитів, лімфоцитів.
Манозозв'язувальний білок — лектин С-типу — належить до родини колектинів, має подібну до
C1q структуру («букет тюльпанів»), але не гомологічний йому і має спорідненість до манози.
Маноза часто трапляється на поверхні мікроорганізмів, але вона відсутня або замаскована на
поверхні клітин макроорганізму. МЗБ може також зв'язуватися із залишками фукози, глюкозаміну.
В сироватці крові у нормі його концентрація становить 0,1 — 1,0 мкг/мл, за гострого запалення вона
збільшується в 5 — 10 разів. У разі приєднання МЗБ до манози активується зв'язана з МЗБ серинова
протеаза, яка розщеплює С4 і С2 і таким чином запускає активацію комплементу класичним шляхом
без участі С1-компонента комплементу.
До родини колектинів належать білки сурфактанту легень, які, можливо, беруть участь в опсонізації
Pneumocystis carіnіі.
Певну захисну роль відіграють білки сироватки крові, що регулюють транспорт іонів металів —
трансферин, лактоферин, церулоплазмін, які зв'язують вільні йони металів, і вони стають
недоступними для мікроорганізмів. Крім того, церулоплазмін прямо гальмує проникнення вірусів у
клітини внаслідок утворення комплексів з глікопротеїнами віріонів, що утруднює їх проникнення.
Такі протеїни, як α-антитрипсин, α-2-макроглобулін, α-1-кислий глікопротеїд по-різному
модулюють активність імунних клітин та цитокінів.
Деякі з інгібіторів протеаз крові (антитрипсин, антихімотрипсин, макроґлобулін) та СРБ за гострих
запалень здатні перешкоджати руйнуванню тканин протеазами нейтрофілів.
2.1.3. Цитотоксичні фактори.
Клітини імунної системи, а також соматичні клітини під час їх активації можуть продукувати різні
цитотоксичні фактори. Так, активовані лімфоцити та макрофаги синтезують цитокіни з
антипухлинною активністю (ФНП-α і ФНП-β, лімфотоксин бета, онкостатин М, ЛІФ, ІЛ-2, -12, -15, -
18, -24). Детальніше ці фактори описано в розд. 10. Активовані лімфоцити продукують нормальний
глобулін людини (нормальний глобулін людини-3, людський антипухлинний фактор) з
тумороцидною активністю, моноядерні фагоцити продукують аргіназу — протеазу з вираженою
цитоцидною активністю до клітин пухлинного походження. Відомі й інші цитотоксичні фактори, які
синтезуються соматичними клітинами. У процесі здійснення позаклітинного фагоцитозу, а також
під час руйнування фагоцитів і природних кілерів у міжклітинний простір потрапляють різні
цитоцидні фактори, зокрема і лейкіни — термостабільні білки, які з'являються в організмі після
руйнування поліморфноядерних лейкоцитів.
Важливими цитотоксичними факторами є β-лізини та лізоцим. β-лізини вивчені ще мало. β-лізини
— це низькомолекулярні пептиди з молекулярною масою 6 кД, термостабільні, витримують
нагрівання до 60 — 65 °С впродовж 30 хв, найбільш активні при рН = 5,7...5,8 за наявності йонів
кальцію. Очевидно, вони синтезуються в супроптичному і паравентрикулярному ядрах
гіпоталамуса, потім надходять у гіпофіз, де і всмоктуються в кров. У крові вони здебільшого
депонуються в тромбоцитах. За активації тромбоцитів або їх руйнування β-лізини знову
потрапляють у кров, де і виявляють свою бактерицидну активність. Основна мішень β-лізинів —
цитоплазматична мембрана переважно спороутворювальних грампозитивних бактерій. β-лізини
незалежні щодо утворення і дії від макрофагів, ПМЯЛ, лімфоцитів і стоять осторонь від системи
імунітету. Кількість їх свідчить про загальний стан гомеостазу — збільшення її в сироватці
спостерігається у разі перевтоми, під час пологів, при різних болях тощо.
Лізоцим (мурамідаза). Лізоцим виявив П. Лащенков у 1909 р. у яйцях курей. Потім лізоцим
виявили у слизі, в слині, носовій порожнині, мокротинні, крові, молоці людини і тварин. Він є
одним із найдавніших у філогенезі факторів протимікробного захисту. За хімічною структурою
лізоцим — це поліпептид, який містить близько 180 залишків амінокислот. Молекулярна маса — 15
— 29 кД, стійкий до високої температури, витримує короткочасне кип'ятіння. Добре розчиняється в
слабкокислому середовищі. У новонароджених рівень його значно вищий; цим, напевне,
компенсується недостатня активність інших факторів резистентності (фагоцитарної реакції, системи
комплементу). Синтезується лізоцим макрофагами та моноцитами, надходить у рідинні субстрати
— слиз, слину, кров, молоко і накопичується в ПМЯЛ. Виводиться через нирки. Основою механізму
дії лізоциму є його здатність розщеплювати мурамову кислоту, одну з важливих субодиниць
пептидоглікану, який є основою клітинної стінки грампозитивних бактерій. У результаті цього
порушується цілісність клітинної стінки бактерій і вони стають чутливими до осмотичного шоку.
Літична дія лізоциму значно підсилюється компонентами комплементу та гістонами.
2.1.4. Природні імуноглобуліни.
У сироватці крові здорових людей і тварин постійно виявляються неспецифічні, так звані природні,
нормальні антитіла за відсутності антигенної стимуляції. Основну частину природних
імуноґлобулінів становлять антитіла, які постійно синтезуються в організмі, і їх специфічність
спрямована в основному проти антигенів власного організму. Вони належать до імуноґлобулінів
класу М, G і А, однак у дорослих більшість із них належать до класу IgG. Природні антитіла класу
IgM виявляються вже в пуповинній крові новонароджених, і спектр їх активності зберігається
впродовж усього життя. Усі природні антитіла умовно можна розподілити на три групи.
Імуноґлобуліни першої групи містяться в крові у високій концентрації (понад 1 мкг/мл), мають, як
правило, вузьку специфічність, належать в основному до IgM. До цієї групи відносять
ізоаглютиніни, антитіла до антигену Форсмана, до аутологічних IgG та ін.
До імуноґлобулінів другої групи належать антитіла до ДНК, пептидів, білкі цитоскелета,
сироваткового альбуміну різних білків, ферментів, фосфоліпідів серотоніну та інших сполук. У
крові вони містяться в невеликій концентрації і, що характерно, мають виражену поліспецифічність.
Так, природні антитіла до багатьох власних антигенних структур (актину, міоґлобуліну, альбуміну
та ін.) поліспецифічні, разом з тим індуковані антитіла до актину суворо вузькоспецифічні Це
свідчить про наявність поліспецифічності в антитіл, а не наявності загальних епітопів у
перехреснореагуючих антигенів Очевидно, активні центри природних антитіл мають багато
паратопів до різних епітопів.
До третьої групи природних антитіл належать антиідіотипічні антитіла.
Встановлено, що більшість природних антитіл є продуктами ембріональних Vн-генів, що свідчить
про універсальний характер їх утворення, а індуковані антитіла є продуктами мутованих генів.
Показано, що природні антитіла є в основному аутоантитілами і виявлені фактично до всіх груп
ендогенних антигенів — нуклеотидів, ДНК, білків цитоскелета й сироватки крові, ферментів,
фосфоліпідів, рецепторів та інших структур.
Підвищений вміст таких антитіл може свідчити про наявність захворювання аутоімунного
характеру. За даними деяких авторів, важливу роль у спонтанному синтезі природних антитіл
відіграють В-1-лімфоцити (СD5
+
В-лімфоцити), які спонтанно здатні продукувати природні антитіла
до певних бактеріальних антигенів і багатьох клітинних антигенів. У людини СD5
+
В-лімфоцити
часто виявляють у крові новонароджених, у мишей — у черевній порожнині.
Фізіологічну роль природних антитіл недостатньо вивчено, привертає увагу їхня роль як факторів
«упізнавання», а також гомеостатична (захисна) і патогенетична ролі. На перших етапах
формування імунної відповіді природні антитіла можуть виступати як опсоніни і таким чином
сприяти фагоцитозу. Вони також можуть бути джерелом появи в організмі різних біологічно
активних речовин, що виникають під дією на імуноглобуліни деяких ферментів. Однією з відомих
таких речовин є тафтсин — продукт розщеплення трипсиноподібними ферментами природних
антитіл. Тафтсин є сильним стимулятором фагоцитозу. Утворення тафтсину тісно пов'язане із
селезінкою, оскільки в сироватці крові спленектомованих тварин він не виявляється.
2.1.5. Кініки, ейкозаноїди, кейлони.
Важливу роль у регуляції природної резистентності та специфічної імунної відповіді відіграють
продукти активації кінін-калікреїнової системи, арахідонової кислоти, продукти деградації
мастоцитів, тромбоцитів.
Кініни (найвідоміші представники — брадикінін і калідин) утворюються в плазмі крові внаслідок
розщеплення кініногенів протеазою — калікреїном плазми при згортанні крові. Нейтрофіли
синтезують кініногенази, які генерують утворення кінінів у плазмі. Вони також продукують кіназу,
що інактивує брадикінін. Кініни беруть участь у реалізації запалення — розширюють венули,
підвищують проникність судинних стінок, що сприяє набряку та міграції лейкоцитів, підсилюють
синтез арахідонової кислоти й утворення ейкозаноїдів.
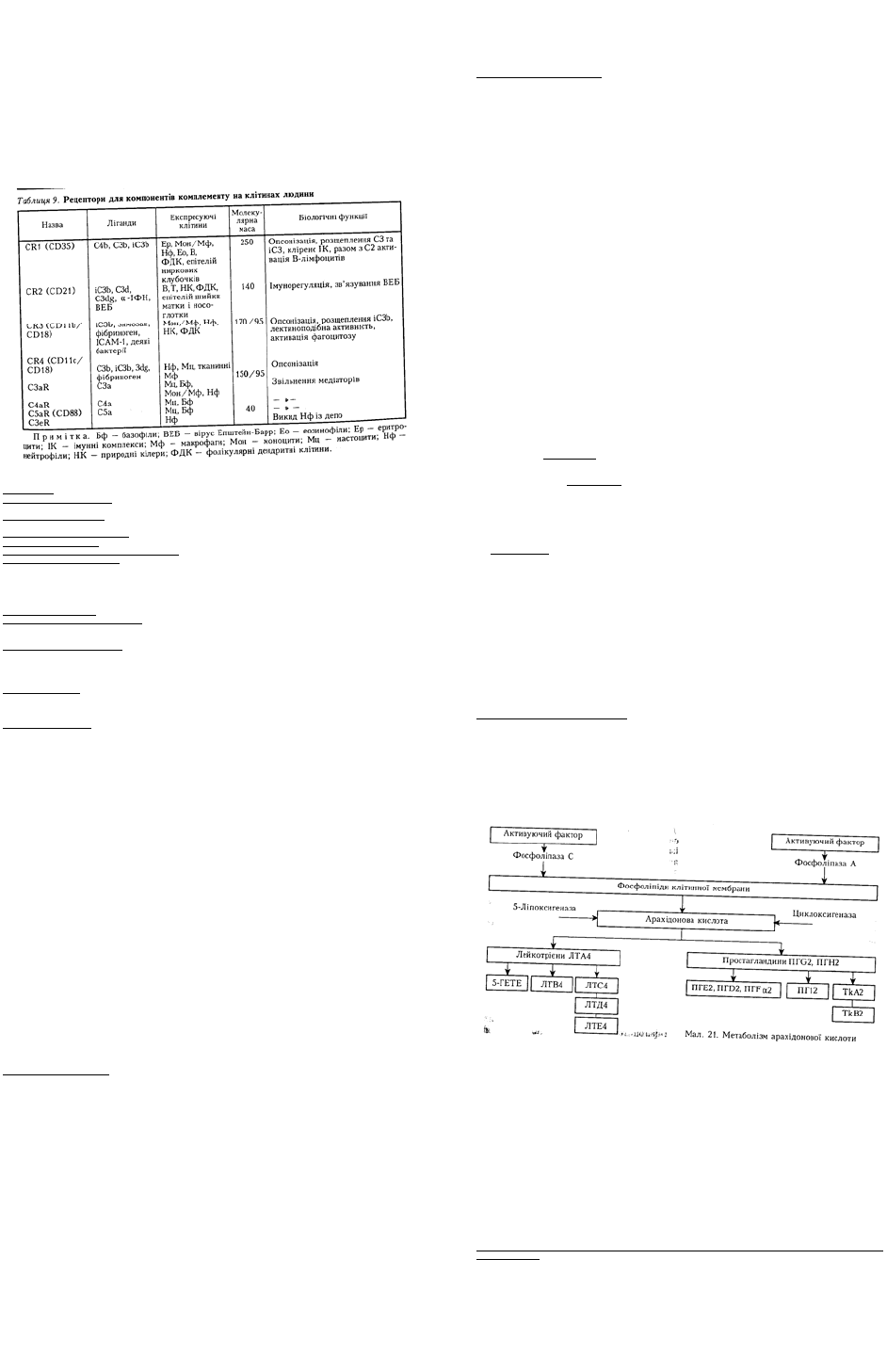
Продукти метаболізму арахідонової кислоти (ейкозаноїди) — лейкотрієни та простагландини
беруть участь у регулюванні функціонування певних ланок природної резистентності та багатьох
інших функцій організму. Схему метаболізму арахідонової кислоти наведено на мал. 21.
У процесі активації різних типів клітин, особливо тих, що беруть участь у запаленні, —
ендотеліальних, макрофагів, мастоцитів, базофілів, нейтрофілів фосфоліпази А і С набувають
здатності індукувати утворення арахідонової кислоти з фосфоліпідів клітинної мембрани. В свою
чергу, арахідонова кислота зазнає дії двох ферментів — циклоксигенази та ліпоксигенази, що
призводить до утворення лейкотрієнів, простагландинів і тромбоксанів. Лейкотрієни й
простагландини за своїми фізіологічними ефектами мають нерідко протилежні активності.
Лейкотрієни (ЛТА4, ЛТВ4, ЛТС4, ЛТD4, ЛТЕ4) продукуються активованими мастоцитами,
макрофагами, нейтрофілами, базофілами. Вони виділяються в навколишнє середовище через 5 — 10
хв після активації клітин. ЛТD4, ЛТС4, ЛТЕ4, ЛТВ4 здатні підвищувати проникність судин, мають
хемотаксичну активність, яка найбільше виражена в ЛТD4.
Простагландини (ПГG2, ПГН2, ПГЕ2, ПГD2, ПГFα2, ПГ12) з'являються в місці запалення значно
пізніше — через 6 — 24 год після активації і продукуються макрофагами, нейтрофілами,
мастоцитами й ендотеліоцитами. Вони здатні знижувати цитоцидну активність нейтрофілів,
макрофагів, лімфоцитів, природних кілерів, продукування цитокінів, сприяють диференціюванню
незрілих лімфоцитів, інгібують агрегацію тромбоцитів. ПГ12 разом з брадикініном зумовлюють
відчуття болю при запаленні.
Кейлони — низькомолекулярні пептиди, які продукуються окремими клітинами і пригнічують їх
ріст — зупиняють ці клітини в мітотичному циклі. Вони виявлені в більшості клітин. Кейлони є
двох типів, що діють на різні фази клітинного циклу — одні у фазі G
1
, другі у фазі G
2
. Дія кейлонів
чітко тканиноспецифічна, однак не видоспецифічна. Вони не ушкоджують клітинні мембрани, а
діють місцеве, дифузно. Кейлони продукуються також пухлинними клітинами, проте ця функція у
них певною мірою інгібована, що й сприяє росту пухлин. В експериментальних умовах кейлони
гальмують ріст різних пухлин, але ця активність є чітко тканиноспецифічною.
2.1.6. Роль транспортних білків крові та мікроелементів і вітамінів у неспецифічній
резистентності
Трансферин, лактоферин. Певну роль у захисті організму від проникнення й розмноження
мікроорганізмів відіграють залізозв'язувальні білки — трансферин і лактоферин, які відповідають за
транспорт заліза в організмі. Трансферин — білок крові, глікопротеїн β-ґлобулінової фракції
сироватки, становить близько 3 % загального вмісту білка в сироватці; трапляється також в інших
рідинах організму. Синтезується в печінці. Трансфери – досить поліморфна система білків
сироватки крові, відомо близько 20 його варіантів.
У молоці виявлено інший залазозв'язувальний білок — лактосидерофілін). За електрофізіологічною
рухливістю, молекулярною масою (90 кД) та функцією лактоферин подібний до трансферину, проте
ці ферменти різняться за структурою та антигенними властивостями. Лактоферин виявляється в
біологчних рідинах — молоці, бронхіальному секреті, специфічних гранулах нейтрофілів,
макрофагах, синтезується апінозними клітинами молочної, слинних і бронхіальних залоз, епітелієм
ендометрія та спермовивідних проток. Афінність лактоферину до заліза в лужному середовищі
значно вища, ніж трансферину. При руйнуванні нейтрофілів лактоферин надходить у міжклітинний
13
простір разом з іншими ферментами гранул і є джерелом йонів феруму в процесі утворення
біоцидних форм кисню.
Основна функція цих білків – унікальна властивість зв'язувати практично всі йони феруму, що
робить його недоступним для патогенів. Одна молекула трансферину може зв'язати 2, а
лактоферину – 2 — 6 атомів феруму. Трансфери здатний також зв'язувати йони інших металів: Cu
2+
,
Zn
2+
, Cr
2+
, Мn
2+
, Со
2+
.
Залізо (ферум) потрібне для нормального функціонування будь-якої живої клітини, особливо для
синтезу ДНК. Зв'язуючи залізо, трансферин і лактоферин пригнічують або зовсім гальмують
розмноження мікроорганізмів як in vitro, так й in vivo і таким чином здійснюють свою
бактеріостатичну дію.
Слід зазначити, що в процесі еволюції деякі мікроорганізми виробили певні системи для
забезпечення своїх потреб у залізі. Так, одна група патогенних бактерій може синтезувати аґенти-
сидерофори, які хелатують залізо і які здатні «віднімати» його у цих білків, завдяки чому
створюються сприятливі умови для розмноження бактерій. Інші мікроорганізми (стафілокок,
стрептокок, вірус гепатиту тощо) в процесі проникнення й розмноження виділяють фактори, які
руйнують багаті на залізо клітини (еритроцити, що містять гемоглобін, клітини печінки, що містять
феритин та ін.), у результаті чого в крові з'являється певна кількість доступного для мікроорганізмів
заліза.
Лактоферин також бере участь у реакції утворення одного з бактерицидних метаболітів кисню —
гідроксильного радикала — ОН
–
, оскільки йони Fe
3+
, зв'язані з лактоферином нейтрофілів, у 500 —
1000 разів ефективніші під час формування гідроксильного радикала, ніж йонів Fe
3+
, що входить до
складу FеС1
3
.
Церулоплазмін. Певну захисну роль у природній резистентності відіграє церулоплазмін. Це
глікопротеїд α-глобулінової фракції сироватки крові, синтезується в печінці. Він виконує дві
важливі функції – транспортування й утилізацію міді і є ферооксидазою — переводить
двовалентний ферум (недоступний для трансферину і лактоферину) в доступний тривалентний. Він
також має антиоксидантну активність і бере участь у регуляції рівня біогенних амінів.
З'являється багато інформації про вплив на природну резистентність організму деяких
мікроелементів, таких як Zn, Co, Cu, Мn та ін. Більшість із них входить до складу активних центрів
ферментів, гормонів та інших біологічно активних речовин, і їх нестача призводить до зниження
природної резистентності.
Вітаміни. Важливу роль у підтриманні нормального функціонування системи природної
резистентності організму відіграють вітаміни. Підвищення вмісту вітаміну А підсилює природну
резистентність організму проти багатьох інфекцій, а зменшення його — знижує її. Вітаміни А і Е, як
антиоксиданти, підвищують ефективність ІФНγ при лікуванні онкологічних захворювань у 4 —14
разів. Вітамін С активно підсилює бактерицидність фагоцитів.
2.2. КЛІТИННІ ФАКТОРИ НЕСПЕЦИФІЧНОЇ РЕЗИСТЕНТНОСТІ
Основними клітинними факторами неспецифічної резистентності є фагоцитарні клітини та природні
кілери.
2.2.1. Фагоцитоз і фагоцитарні клітини.
Однією з найважливіших захисних реакцій організму з розпізнавання, ізоляції та знешкодження
носіїв чужорідної генетичної інформації та підтримання гомеостазу організму є фагоцитоз.
Фагоцитоз — загальнобіологічне неспецифічне явище, властиве тією чи іншою мірою всім живим
клітинам. Найвираженіша фагоцитарна й біоцидна активність, що має захисне значення, притаманна
мононуклеарним фагоцитам – моноцитам, макрофагам, ДК, поліморфноядерним лейкоцитам
(гранулоцитам), зокрема нейтрофілам та еозинофілам. Еозинофіли переважно здійснюють
позаклітинний фагоцитоз.
Власне явище фагоцитозу (фаго — пожирання, поглинання, цито — клітина), тобто поглинання
клітинами, відоме з середини XIX ст. У багатоклітинних організмах було виявлено спеціальні
клітини, здатні поглинати й виводити з крові бактерії та різні чужорідні речовини.
Загальновизнаний внесок у вивчення фагоцитозу та його ролі в захисних реакціях зробив І.І.
Мечников — автор фагоцитарної теорії імунітету.
Одночасно П. Ерліх створює гуморальну теорію імунітету, основою якої є положення про те, що
головну роль у захисті організму відіграють розчинні гуморальні фактори — антитіла. У 1908 р. за
розробку питань імунітету сумісно І.І. Мечникову і П. Ерліху було присуджено Нобелівську
премію. Цим самим було підтверджено однакову роль обох учених у вивченні імунітету.
У 10 —20-х роках минулого століття низка відкриттів про роль у захисних реакціях організму
антитіл, розвиток вакцинації серотерапії тощо дали привід більшості вченим дійти висновку, що
основними факторами імунітету є гуморальні, тобто антитіла, а фагоцитам відводилась роль
«санітарів» організму — поглинати й перетравлювати чужорідні речовини. І лише з початку 60-х
років XX ст. було показано важливу роль макрофагів в індукції, формуванні та прояві імунних
реакцій (як специфічних, так і неспецифічних).
Роль фагоцитарних клітин у захисних реакціях організму багатогранна. Основні характеристики
фагоцитів наведено в табл. 10. З одного боку, вони виконують функцію санітарів організму:
розпізнають, поглинають і знешкоджують або лізують без захоплення різні чужорідні агенти, а
також власні клітини, що змінили свій рецепторний склад. З іншого — макрофаги і моноцити
беруть участь не лише у руйнуванні чужорідних клітин, а й після часткового перетравлювання
експресують їхні антигени на своїй поверхні для представлення лімфоцитам для індукування
імунної відповіді. Крім того, макрофаги беруть участь у регулюванні багатьох життєво важливих
функцій: репаративних процесів, проліферації та диференціювання багатьох клітин, синтезу низки
біологічно активних речовин. Макрофаги відіграють також важливу роль у детоксикації
бактеріальних токсинів і продуктів некрозу тканин.
Походження фагоцитів. Незважаючи на те що про існування макрофагів відомо ще з кінця XIX ст.,
їх походження стало відомим лише в другій половині XX ст., коли в 1968 р. було встановлено, що
макрофаги походять з циркулюючих у крові моноцитів. Фагоцитарні клітини є найдавнішими
факторами захисту організму від вторгнення чужорідних агентів. Вони першими виникають у
філогенезі. Так, у безхребетних немає імуноґлобулінів і лімфоцитів, і всі захисні функції виконують
макрофагоподібні клітини. В період нормального ембріогенезу в процесі онтогенезу, до початку
лімфопоезу макрофагам властивий примітивний механізм пізнавання та елімінації аберантних
клітин. І вже в пізнішому періоді ембріонального та постембріонального розвитку, коли з'являються
Т- і В-лімфоцити, макрофаги кооперуються з ними для індукування специфічної імунної відповіді.
Усі клітини крові походять із плюрипотентної гемопоетичної (кровотворної) стовбурової клітини.
Під впливом ряду сигналів плюрипотентна клітина може ставати частково детермінованою і давати
початок диференціюванню клітин у двох великих напрямах: лімфопоезу і мієлопоезу.
Клітини — попередники мієлопоезу диференціюються в клітини — попередники гранулоцитів,
макрофагів, еритроцитів і мегакаріоцитів. На сьогодні відомі фактори, що спричинюють
диференціювання клітин — попередників мієлопоезу: МГ-КСФ, Г-КСФ, М-КСФ, еритропоетин і
тромбоцитопоетин та інші цитокіни.
Під впливом колонієутворювальних факторів попередники гранулоцито-макрофагального ряду
диференціюються в напрямі ПМЯЛ або макрофагів.
Диференціювання макрофагів. Під впливом, М-КСФ та інших цитокінів у кістковому мозку
утворюється комітована стовбурова клітина, з якої формується монобласт. Клітинний цикл
монобласта становить 12 год. Монобласт перетворюється на промоноцит. Після ряду перетворень
він упродовж 12 — 19 год у мишей і 29 — 48 год у людини перетворюється на моноцит і надходить
в кров'яне русло. За своєю морфологією та функціональною активністю монобласт і промоноцит є
малозрілими клітинами порівняно з моноцитами і в нормі виявляються тільки в кістковому мозку.
Лише під час деяких патологічних процесів монобласти й промоноцити виявляються в кров'яному
руслі, що є діагностичною ознакою. Моноцити крові також є малозрілими клітинами, циркулюють у
крові недовго — 24 — 72 год виходять через кровоносні капіляри у навколишнє середовище:
міжклітинний простір, різні органи, тканини й порожнини (перитонеальну, плевральну, суглобів),
на поверхню слизових і стають тканинними макрофагами.
В організмі людини міститься 81 • 10
6
моноцитів на 1 кг маси тіла. З них 18 • 10
6
клітин циркулює в
крові, а 63 • 10
6
клітин на 1 кг становить маргінальний пул, який у нормі не бере участі в циркуляції,
а прилягає до внутрішньої стінки мікросудин. У нормі баланс між кількістю моноцитів, які
мігрують з кісткового мозку в кров, та їх виходом з кров'яного русла в тканини з подальшим
диференціюванням у макрофаги постійно підтримується. Позасудинний пул моноядерних фагоцитів
у 25 разів перевищує циркулюючий.
У процесі дозрівання клітин одноядерних фагоцитів (промоноцит кісткового мозку, моноцит крові,
макрофаг тканин) відбувається ряд змін — морфологічних, структурних, біохімічних,
функціональних. Розміри клітин у процесі цих перетворень збільшуються до 25 — 30 мкм, ядерно-
цитоплазматичне відношення становить менше одиниці, збільшується кількість нерівностей на
зовнішній поверхні, ускладнюється структура лізосомально-вакуолярного апарату, підвищується
активність лізосомальних ферментів, поступово знижується кількість і активність пероксидази. За
активністю пероксидази можна робити висновок про ступінь диференціювання моноядерних
фагоцитів — багато гранул цього ферменту містять промоноцити, менше — моноцити, а в
макрофагах пероксидаза виявляється в незначній кількості, причому не в гранулах, а в мембрані
ендоплазматичного ретикулума. Макрофаги існують більше місяця, а за даними деяких авторів
можуть існувати понад 6 — 12 міс.
Диференціювання ПМЯЛ. Із комітованих стовбурових клітин утворюються мієлобласти. З
мієлобластів під впливом факторів диференціювання Г-КСФ та інших цитокінів утворюються
попередники гранулоцитів — промієлоцити, з яких формуються мієлоцити. Мієлоцит
перетворюється на ПМЯЛ — нейтрофіли, еозинофіли, базофіли. Тривалість дозрівання
гранулоцитів у кістковому мозку — 8 — 14 діб. Нейтрофіли мають характерне паличкоподібне або
полісегментарне ядро зі специфічною зернистістю в цитоплазмі. Розмір клітин — 9 — 15 мкм.
Зрілі ПМЯЛ затримуються в синусах кісткового мозку 3 — 4 доби. Близько 95 % нейтрофілів
міститься в кістковомозковому пулі і створюють так званий кістково-мозковий резерв.
Частина зрілих нейтрофілів мігрує в кров'яне русло і формує циркулюючий та маргінальний
(пристінковий) пули, які перебувають у динамічній рівновазі. Тривалість циркуляції нейтрофілів у
крові становить 6 — 7 год. У кров'яному руслі нейтрофіли тісно взаємодіють з ендотелієм і
створюють пристінковий пул. Особливо багато, а деякі автори вважають, що більшість нейтрофілів
знаходиться в пристінковому пулі кровоносних судин легень. Контактуючи з ендотелієм,
нейтрофіли постійно мігрують у тканини і перебувають там 2 — 5 діб, після чого гинуть. Міграція в
тканини незворотна. Під час запальних процесів нейтрофіли з кістково-мозкового й пристінкового
пулів швидко надходять у кров, звідти в місця запалення, де й виконують свої захисні функції.
Щодня з кісткового мозку в кров виходить приблизно 10
9
нейтрофілів, а під час гострих запальних
процесів — у 10 — 20 разів більше; при цьому можуть з'являтися й незрілі клітини.
Нейтрофіли відіграють визначальну і постійну роль у протиінфекційному захисті. Активність
нейтрофілів тісно пов'язана з гранулами, що містять ряд ферментів і біологічно активних речовин.
Виділяють два основних види гранул — азурофільні (первинні) та специфічні (вторинні).
Азурофільні гранули виникають у промієлоцитах шляхом відбрунькування з внутрішнього боку
апарату Гольджі і містять бактерицидні речовини (мієлопероксидазу, лізоцим, катіонні білки,
дефенсини, нейтральні протеази — еластазу, колагеназу, катепсин G, кислі гідролази — N-ацетил- β
-глюкозамінідазу, β-глюкуронідазу та ін.). Специфічні гранули з'являються пізніше, на стадії
мієлоцита, відбруньковуючись від зовнішньої опуклої частини апарату Гольджі, і містять лізоцим,
колагеназу, лактоферин, білок, який зв'язує вітамін В
12
, у невеликій кількості катіонні білки й
дефенсини. Виділено дуже маленькі С-часточки, що містять катепсини, серинпротеазу, желатиназу.
Гетерогенність фагоцитарних клітин. Макрофаги — це велика, дуже поширена в організмі
морфологічно й функціонально гетерогенна група клітин, які існують як вільні, що виявляються в
різних органах, тканинах, порожнинах, так і фіксовані, тісно пов'язані з клітинами тих органів, у
яких вони локалізуються.
Гетерогенність макрофагів може бути вертикальною й горизонтальною. Вертикальна гетерогенність
зумовлена існуванням макрофагів в організмі на різних стадіях диференціювання, що зумовлює
різні форми та розміри клітин, ядерно-цитоплазматичне співвідношення, структуру мембран,
кількість пероксидази та її розміщення. Горизонтальна гетерогенність (морфологічна і частково
функціональна) макрофагів зумовлена місцевим оточенням. Форма клітин макрофагів нерідко
подібна до форми клітин, які їх оточують.
Залежно від місцезнаходження макрофагів розрізняють: макрофаги серозних порожнин, макрофаги
легень — альвеолярні, макрофаги сполучної тканини – гістіоцити, макрофаги печінки —
купферівські клітини, макрофаги нервової тканини — клітини мікроглії, макрофаги кісткової
тканини — остеокласти, макрофаги кісткового мозку в еритропоетичних острівцях — клітини-
«няньки», макрофаги лімфовузлів, макрофаги селезінки.
Функціональна гетерогенність макрофагів залежить передусім від місця їх локалізації, а також від
стадії дозрівання та диференціювання. Так, макрофаги селезінки активні в представленні
антигенного матеріалу Т- і В-лімфоцитам, тоді як у альвеолярних макрофагів ця функція слабко
виражена, проте вони мають підвищену здатність фагоцитувати й знешкоджувати мікроорганізми.
Під час розподілу окремих популяцій перитонеальних макрофагів у градієнтах густини виявлено їх
функціональну і морфологічну гетерогенність.
У нормі макрофаги перебувають в неактивному стані і позначаються як «нормальні», «інтактні».
Резидентні макрофаги — це клітини, які постійно містяться у певних органах, тканинах,
порожнинах неімунних тварин і людини й перебувають у стані спокою. Резидентні макрофаги
беруть активну участь у спонтанній клітинній цитотоксичності. Вони можуть бути фіксованими й
вільними.
Під впливом різних факторів — антигенних субстанцій мікроорганізмів, біологічно активних
речовин, що виробляються лімфоцитами та іншими клітинами в разі їх активації або в процесі
виникнення та формування запального процесу, змінюється морфологія й функціональна активність
макрофагів. Такі макрофаги швидко прикріплюються до субстрату і розпластуються. В них
збільшуються кількість і розміри лізосом, підвищується метаболічна активність, здатність
фагоцитувати, виникає цитотоксична активність до певних клітин-мішеней. Такі макрофаги
називають активованими, стимульованими (праймованими, індукованими, запальними), імунними,
озброєними.
Активовані макрофаги — широкий термін, яким нерідко позначають всі форми фагоцитів з
підвищеною функціональною активністю. Проте найчастіше цей термін вживають для позначення
фагоцитів з підвищеною функцією різних систем унаслідок дії різних антигенів та біологічно
активних речовин.
Слід зазначити, що на перших стадіях активації макрофагів здебільшого з'являється і антимікробна,
і протипухлинна активності, однак у процесі дозрівання клітин зберігається тільки антимікробна
цитотоксичність.
Стимульовані макрофаги. Терміном «стимульовані макрофаги» нерідко позначають усі форми
фагоцитів з посиленою активністю, однак частіше його вживають для характеристики стану
макрофагів перитонеальної порожнини після індукування стерильного запалення для збільшення
кількості фагоцитів.
Праймовані макрофаги — це клітини перших етапів взаємодії макрофагів з активаторами, коли в
них ще немає антипухлинної цитотоксичності, але підвищена чутливість до імуномодуляторів. У
разі подальшої стимуляції цих макрофагів відповідними активаторами в них з'являються
антимікробна й протипухлинна цитотоксичності, а за відсутності подразників вони
трансформуються в резидентні макрофаги.
Імунні макрофаги — це клітини, отримані від імунних донорів. Вони мають підвищену
функціональну активність, але у них відсутня специфічність фагоцитозу.
Озброєні макрофаги — це клітини, до Fc-рецепторів яких приєднані цитофільні антитіла класів
IgGl, IgG3 і меншою мірою — IgM, внаслідок чого вони здатні специфічно розпізнавати відповідні
клітини-мішені, в тому числі й пухлинні, і лізувати їх фагоцитозом або апоптозом. Крім того,
цитофільні антитіла можуть прикріплюватися до поверхні пухлинних клітин і сприяти таким чином
взаємодії з фагоцитами.
Запальні макрофаги. Цей термін вживають у двох випадках: для характеристики макрофагів
запального процесу і макрофагів стерильного запалення. У першому випадку макрофаги
активуються як бактеріями та продуктами їх життєдіяльності, так і цитокінами, які синтезуються
різними клітинами в разі їх активації в процесі розвитку запального процесу. У другому випадку
макрофаги активуються стерильним подразником; вони слабко активовані і належать до
стимульованих макрофагів.
Індуковані макрофаги накопичуються в певних місцях унаслідок дії деяких екстремальних
факторів.
Одним з важливих маркерів для ідентифікації мононуклеарних фагоцитів є фермент неспецифічна
естераза, вона розміщена в макрофагах дифузно в цитоплазмі. Другим важливим маркером є
лізоцим.
Популяція гранулоцитів також гетерогенна за структурою та функцією, здатністю фарбуватися
певними барвниками. За здатністю фарбуватися ПМЯЛ поділяють на нейтрофіли, еозинофіли,
базофіли (див. розд. 1). Вони також відрізняються за функціональною активністю, рецепцією. Так,
фагоцитарна активність найбільш виражена у нейтрофілів, менше — у еозинофілів і майже відсутня
у базофілів. Еозинофілам притаманний позаклітинний фагоцитоз, і вони відіграють важливу роль у
протипаразитарному захисті. Популяція нейтрофілів є гетерогенною, однак меншою мірою, ніж
серед макрофагів. Серед нейтрофілів виявлено гетерогенність за функціональною активністю та
рецепцією.
Рецептори фагоцитів. Фагоцити мають на своїй поверхні дуже багато рецепторів, які зумовлюють
їхню активність. Це рецептори до хемотаксинів (С5а, формілметіонілпептидів, лектинів, протеаз),
до речовин, що забезпечують акт поглинання (Fc-фраґмента IgG , IgM, C3b, фібронектину,
пептидоглюкану, цукридів, ЛПЦ); до речовин, що активують функціональну активність фагоцитів
(ІФНів α, β, γ цитокінів), до речовин, що забезпечують кооперативні взаємодії з іншими клітинами
для підтримання гомеостазу. Окрему групу становлять рецептори, що контролюють зв'язок
мононуклеарних фагоцитів з нервовою та ендокринною системами. Це рецептори до
глюкокортикоїдів, гістаміну, інсуліну, естрогенів (стероїдних гормонів), нейропептидів
(енкефалінів, ендорфінів та ін.). Деякі автори виділяють рецептори запального процесу — до α-
мікроґлобулінів, С-реактивного білка, протеаз та ін.
Функціональна активність фагоцитарних клітин. Макрофаги та ПМЯЛ мають широкий спектр
біологічної активності. Однак основною функцією їх, як факторів природної резистентності, є
фагоцитарна активність, яка відбувається в кілька стадій — хемотаксис фагоцитів, розпізнавання
ефекторними клітинами об'єктів фагоцитозу та адгезія до них, поглинання їх, секреція біологічно
активних речовин, інактивація поглинених об'єктів, ферментативне розщеплення та видалення їх
залишків.
Хемотаксис. Міграція фагоцитів і зустріч їх з об'єктами фагоцитозу може бути спонтанною, яка
більш характерна для нейтрофілів, і цілеспрямованою, що зумовлено дією на фагоцити
хемотаксичних факторів. Одним з основних пускових механізмів фагоцитарної реакції є
розпізнавання хемотаксичних сигналів (сигнали, що спричинюють міграцію фагоцитів) з
подальшою індукцією хемотаксису (рухом клітин до місця концентрації хемотаксинів), який може
бути позитивним — рух у бік вищої концентрації або негативним — рух у бік меншої концентрації
хемотаксинів. Хемотаксис слід відрізняти від хемокінезу — індукованого хімічними речовинами
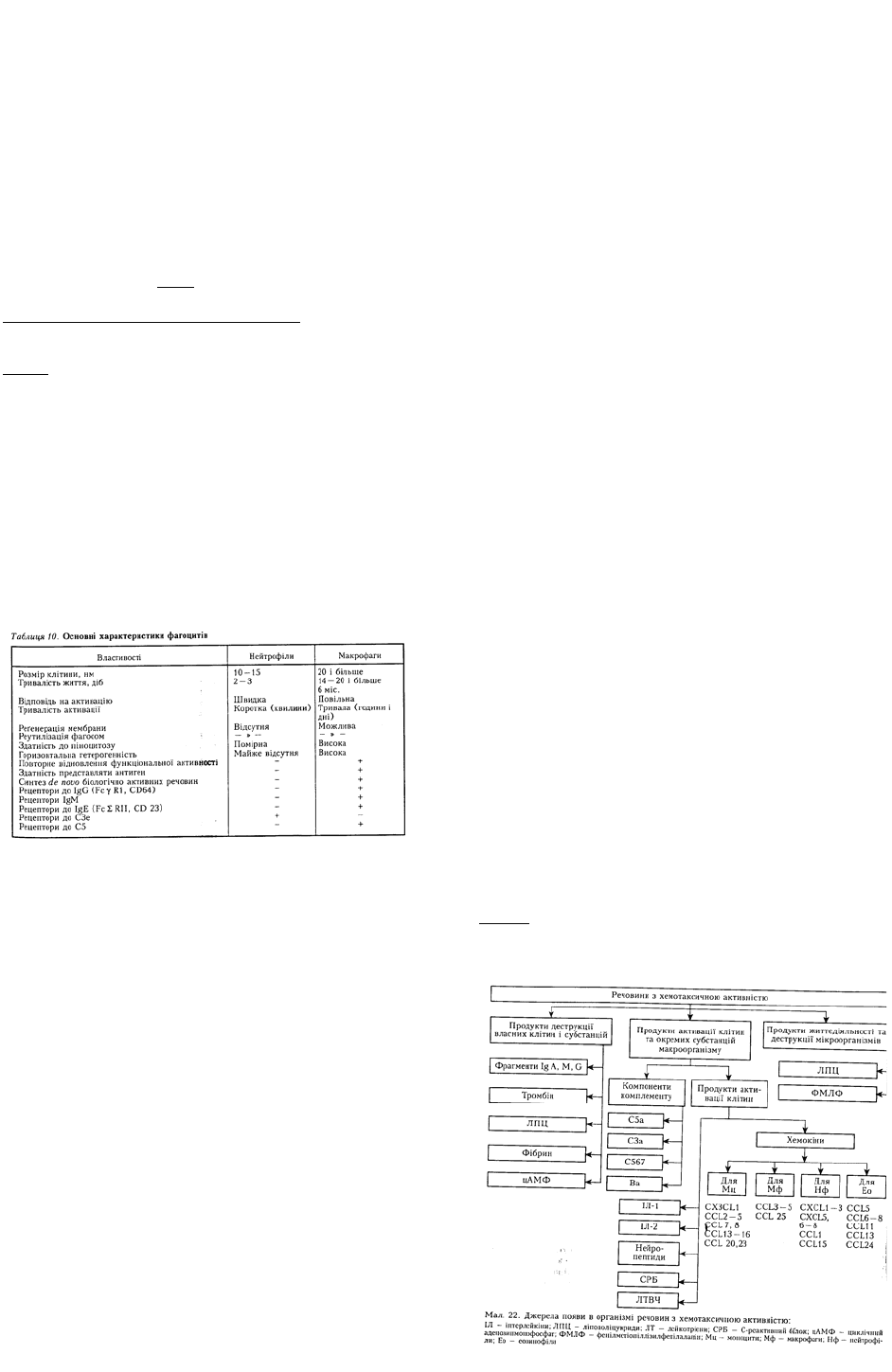
неспрямованого руху клітин. Основні джерела появи в організмі хемотаксинів наведено на мал. 22.
Речовини, які індукують хемотаксис, називають хемотаксинами, або хемоатрактантами, або
хемокінами. До цієї групи належить значна кількість різноманітних речовин різного походження.

14
На поверхні фагоцитів існують відповідні рецептори, які реагують із хемотаксинами. Здебільшого
вони належать до білків родини родопсинів. Усі ці рецептори, а також рецептори для ФМЛФ
(форміл-L-метіоніл-L-лейцил-L-фенілаланін) і лейкотрієну В4 зв'язані з білком G, який бере участь
у передаванні сигналу в клітину та її активації.
Найпотужнішим хемотаксином є С5а-компонент комплементу, менш ефективний С3а.
Хемотаксичну активність має ІЛ-1β. Найефективнішими хемотаксинами є хемокіни — короткі
поліпептиди з молекулярною масою 8—10 кД (див. розд. 1, 9). Специфічними для моноцитів є
хемокіни CX3CL1, CCL2- 5, 7, 8, 13-16, 20, 23; для макрофагів — CCL 3 — 5 та 25; для дендритних
клітин — CXCL12, CCL3, 13, 15 і 25; для нейтрофілів — CXCL 1 – 3, 5 — 8, CCL 1 і 15; для
еозинофілів — ССL 5, 7, 8, 11, 13 та 24.
В основі руху фагоцитів лежить активність певних білків цитоскелета — актину й міозину. Форма
переміщення фагоцитів амебоподібна. Комплекс хемотаксису з рецептором забезпечує орієнтоване
переміщення скоротливих елементів та індукує рух клітини. Локомоторна функція фагоцитів
реалізується за допомогою складної системи цитоскелета — густої сітки активних філаментів і
зв'язаних з ними білків (фібрилярний F-актин та мономерний G-актин). Основою рухомості
фагоцитів є полімеризація і деполімеризація актину, яка регулюється деякими білками (профілін,
гемозолін, акументин, міозин). В основі механізмів запуску та регуляції руху фагоцитів є протеїн-
кіназа С, яка активується інозилтрифосфатом і діацилгліцеролом, активність яких запускається
комплексом хемотаксин — рецептор. Протеїнкіназа С та йони кальцію ініціюють локомоторну
функцію певних білків. Орієнтація руху фагоцитів здійснюється полімеризацією мікро трубочок, а
рух — скороченням мікрофіламентів. Руху фагоцитів сприяють інтегрини β
1
і β
2
, які розпізнають
мембранні рецептори клітин ІСАМ-1, 2, 3, а також білки міжклітинного матриксу – фібронектин,
ламінін, колаген та ін.
Важливим етапом хемотаксису є вихід фагоцитів із судинного русла в місця появи хемотаксичних
сигналів. Цьому передує адгезія фагоцитів на ендотелії судин, яка різко зростає в осередках
запалення і зумовлена дією біологічно активних речовин як на власні фагоцити, так і на
ендотеліальні клітини. Результатом такої дії є активація ендотеліальних і фагоцитувальних клітин,
що індукує на їхній поверхні експресію різних адгезивних молекул — селектинів, інтегринів,
адгезинів суперродини імуноґлобулінів, муциноподібних молекул.
Розпізнавання чужого та адгезія. Наступним і ключовим етапом фагоцитарної реакції є
розпізнавання чужорідних об'єктів і адгезія до них. Прикріплення об'єктів фагоцитозу до мембрани
фагоцитів відбувається різними способами. Об'єкти з гідрофобними або позитивно зарядженими
поверхнями зв'язуються на мембрані самі, без допомоги рецепторів. У разі контакту з неживими
об'єктами фагоцити заздалегідь готують їх до поглинання шляхом виділення та обгортання їх
власними продуктами, в тому числі й компонентами міжклітинного матриксу, що сприяє
ефективній адгезії та поглинанню. Деякі види бактерій і клітин, глікопротеїни, поліцукриди можуть
зв'язуватися прямо з мембраною фагоцитів завдяки лектиноподібній активності білків мембрани і
таким чином фагоцитуватись. На живих об'єктах фагоцити за допомогою відповідних рецепторів
розпізнають чужорідні хімічні структури або групи структур, які не властиві клітинам цього
організму, і адгезуються до них. До цих структур належать бактеріальні ЛПЦ, пептидоглікани, а
також кінцеві цукриди мембранних глікопротеїдів. Особливу роль відіграють манозовмісні
структури, які містяться на мембранах більшості бактерій і яких немає на клітинах хребетних. У
процесі трансформації або старіння відбуваються конформаційні й структурні зміни на клітинних
мембранах, які розпізнаються фагоцитами як чужі. Певну роль у розпізнаванні чужого відіграє
метіонін, який у прокаріотів, на відміну від еукаріотів, є ініціаторною амінокислотою при трансляції
білків і виконує роль простого специфічного сигналу для розпізнавання мікроорганізмів
фагоцитами.
Серед рецепторів, що розпізнають чужорідні структури, виділяють лектиноподібні рецептори, в
першу чергу манозозв'язувальний білок, селектин — СD62L та β
1
- і β
2
-інтегрини. Інтегрини
розпізнають крім рецепторів клітин до CD11a/CD18 (LFA-1), CD11b/CD18 (Мас1), CD54, CD102
також фібронектин, ламінін, колаген та інші білки. Проте найважливішими факторами, що
сприяють пізнаванню, фіксації та поглинанню фагоцитами об'єктів фагоцитозу, є опсоніни.
Опсонізація (від грец. «робити їстівним») — це процес приєднання до об'єктів фагоцитозу речовин,
які розпізнаються і зв'язуються відповідними рецепторами фагоцитів, що сприяє їх поглинанню.
Усі опсоніни є біфункціональними молекулами, оскільки одним із своїх фрагментів вони
фіксуються на об'єктах фагоцитозу, а другим зв'язуються з рецепторами фагоцитів, унаслідок чого
індукується активація фагоцитуючих клітин. Відомо багато речовин з активністю опсонінів,
найважливішими з них є імуноглобуліни G і М (специфічні опсоніни) та похідні комплементу,
переважно С3b-компонент (неспецифічні опсоніни).
Найбільш виражена опсонізуюча активність у С3b-компонента, менша – у С4b, С5b, комплексу
С5b67, фактора Н. Опсонізуюча активність С3b різко підвищується після протеолітичної
трансформації в іС3b під дією сироваткових протеїназ.
Однак найефективнішими опсонізуючими факторами є специфічні імуноглобуліни класів G і М. В
опсонізації можуть брати участь неспецифічні імуноглобуліни завдяки перехресному реагуванню.
На фагоцитах існують відповідні рецептори як до компонентів комплементу, так і до
імуноглобулінів. Крім компонентів комплементу та імуноґлобулінів у ролі опсонінів можуть
виступати деякі білки, такі як фібронектин, С-реактивний білок, α-глобулін, аргінінзбагачені
пістони, катіонні білки, МСР-1, МСР-2 та ін. У результаті дії хемотаксичних факторів, опсонізації,
адгезії до субстрату, роз пластування фагоцити активуються, що сприяє поглинанню зафіксованих
на поверхні фагоцитів чужорідних об'єктів. Вирішальну роль в активації фагоцитів відіграє білок G,
зв'язаний з рецепторами, що беруть участь в індукції хемотаксису, опсонізації, адгезії та
розпластуванні фагоцитів.
Фагоцити активуються тією чи іншою мірою вже при отриманні перших сигналів про наявність
чужорідних об'єктів в організмі, при виході з кров'яного русла, в процесі хемотаксису, але
найбільше – в процесі розпізнавання, адгезії та поглинання.
Механізми активації макрофагів і нейтрофілів подібні, хоча й мають свої особливості. Першим,
вирішальним етапом активації фагоцитів є дисоціація білка G при активації зв'язаних з ним
рецепторів, що призводить до активації фосфоліпази С. Фосфоліпаза каталізує розщеплення
фосфоінозитидів до діацилгліцерину, який активує протеїнкіназу С та інозитом-3-фосфат, який
зумовлює мобілізацію йонів Са
2+
з внутрішньоклітинних депо. Важливу роль на перших етапах
активації відіграють цитокіни — ІФН-γ та ГМ-КСФ, які активують протеїнкіназу С без включення
йонів Са
2+
, що прискорює активацію фагоцитів ліпополіцукридами.
У результаті активації протеїнкінази С та мобілізації йонів Са
2+
частина білків цитоскелета
переміщується до рецепторів адгезії, особливо до інтегринів, і накопичується біля поверхні клітини.
В результаті цих процесів низькомолекулярний G-актин перетворюється на ниткоподібний F-актин,
що стає складовою частиною цитофіламентів псевдоподій, які формуються в процесі взаємодії з
об'єктом фагоцитозу. В основі механізму формування псевдоподій, здатності їх захоплювати об'єкти
фагоцитозу, інвагінації клітинної мембрани лежить процес желатинізації (зміни в'язкості
цитоплазми) та скорочення актинових волокон. Желатинізація здійснюється завдяки здатності білка
актиногеліну перехресно зв'язувати актин, що призводить до злиття ниток філаментів і переходу F-
актину в желеподібний стан. Завдяки наявності міозину F-актин здатний скорочуватися, і
псевдоподії обхоплюють об'єкт фагоцитозу, а зона адгезивного контакту зазнає желатинізації.
Об'єкти фагоцитозу разом з частиною мембрани занурюються в середину клітини, ізолюються і
стають фагосомами. Внутрішня поверхня фагосоми є зовнішнім шаром інвагінованої мембрани. В
нейтрофілах фагосоми спочатку зливаються з вторинними гранулами (впродовж 30 с), а невдовзі –
через 1 — 2 хв — з азурофільними гранулами.
Біоцидні фактори фагоцитів. Фагоцити мають широкий спектр бактерицидних і
бактеріостатичних факторів. Частина з них і в нормі має певну активність, яка різко зростає при
взаємодії фагоцитів з чужорідними об'єктами, інша частина з'являється тільки після стимулювання
клітин (табл. 11). Розрізняють кисневозалежні і кисневонезалежні фактори біоцидності.
Кисневозалежні фактори біоцидної активності. Кожний етап взаємодії фагоцитів з чужорідними
об'єктами супроводжується активацією певних ланок захисних і регулювальних систем фагоцитів,
що призводить до значного збільшення споживання кисню та глюкози — формування так званого
респіраторного (дихального, кисневого) вибуху (спалаху), внаслідок якого утворюються нестабільні
продукти відновлення кисню — супероксидний аніон O
-
2
, пероксид гідрогену Н
2
О
2
, гідроксильний
радикал ОН
–
та синглентний кисень —
1
О
2
, які є високотоксичними для мікроорганізмів і клітин
речовинами. У нейтрофілах зростання поглинання кисню й утворення його високореактивних
метаболітів відбувається через 30 — 60 с після стимулювання поверхні клітин і не потребують ні
фагоцитозу, ні секреції лізосомальних ферментів, хоча всі ці процеси відбуваються одночасно.
Кисневі метаболіти виробляють нейтрофіли, моноцити, макрофаги, еозинофіли, базофіли.
У процесі формування респіраторного вибуху збільшується споживання глюкози за механізмом
гексозомонофосфатного шунта за участю НАДФН
+
, у результаті чого вивільняється енергія, що
запасається у формі двох сполук — АТФ та НАДФН, і генерується відновна здатність.
Стимулювання фагоцитів супроводжується індукуванням фосфорилювальних реакцій у системі
протеїнкінази С, що зумовлює активацію НАДФ-оксидази, яка в нормі міститься в азурофільних
гранулах і плазматичній мембрані. При утворенні фаголізосом цей фермент виявляється в них.
У результаті спонтанної дисмутації із залученням йонів гідрогену (водню) утворюються аґенти з
бактерицидною активністю — пероксид гідрогену Н
2
О
2
, синглентний кисень
1
О
2
і гідроксид-
радикал ОН
–
:
Утворення пероксиду гідрогену внаслідок дисмутації супероксидного аніона відбувається як
спонтанно, так і за участю супероксиддисмутази, яка каталізує перенесення електрона з НАДФН на
молекулярний кисень. У результаті цього утворюється супероксидний аніон О
2
—
— ефективний
біоцидний фактор:
НАДФН-оксидаза своїм НАДФН- зв'язувальним центром спрямована всередину клітини, a О
2
–
–
зв'язувальний центр розміщений на зовнішній мембрані клітини.
Більш виражену біоцидність мають гіпогалоїди, які можуть утворюватися як за участю, так і без
участі мієлопероксидази. За участю мієлопероксидази в нейтрофілах і моноцитах за наявності
галогенів та активних форм кисню можуть утворюватися високотоксичні галогеновмісні сполуки —
галіди:
За відсутності мієлопероксидази в макрофагах, а також у фаголізосомах нейтрофілів, що містять
мієлопероксидазу, за наявності Fe і галогенів та участі кисневих метаболітів можуть утворюватися
високотоксичні речовини (ОН
–
, О
2
–
, Сl
–
):
Біоцидні метаболіти кисню здатні не тільки руйнувати мікроорганізми, а й ушкоджувати власні
клітини, що є причиною ускладнень при запальних процесах та виникненні інших патологічних
процесів. У свою чергу, клітини виробили систему захисту від біоцидної дії метаболітів кисню —
комплекс антиоксидантних ферментів — каталази, супероксиддисмутази, глутатіонпероксидази,
глутатіонредуктази та ін. Важливу роль як окисники відіграють вітаміни С і Е, а також ненасичені
жирні кислоти:
Слід зазначити, що деякі мікроорганізми також мають власні антиоксидантні ферменти, завдяки
чому виявляють стійкість до бактерицидної дії кисневих метаболітів. Токсичність утворених
вільних радикалів зростає в такій послідовності: О
2
—
→
1
О
2
→ ОН
—
. Результатом дії токсичних
кисневих метаболітів може бути окиснення мембранних ліпідів, інактивація ферментів та їх
інгібіторів, пригнічення синтезу РНК і ДНК. Процеси утворення активних метаболітів кисню та
галогенів відбуваються дуже швидко – впродовж кількох секунд, і їх позначають як «вибух»; вони
виявляються у фагосомах та на поверхні клітин і можуть виділятися в міжклітинний простір.
Для виявлення стану клітин і ступеня їх активації (у зв'язку з утворенням вільних радикалів)
застосовують тест відновлення тетразолію синього та метод хемолюмінесценції.
Привертає увагу азотозалежний механізм бактерицидності фагоцитів, основними компонентами
якого є оксид нітрогену NO та його закиснені стабільні продукти (NO
2
—
, NО3
—
). Вирішальну роль в
утворенні цих сполук відіграє NО-синтетатаза, яка міститься в клітинах, що перебувають у спокої, в
двох формах — активній і неактивній — iNO-синтетаза. Неактивна iNO-синтетаза активується
продуктами бактеріального походження та запальними цитокінами ІЛ-1α, ІЛ-1β, ФНГ-α і особливо
ІФН-γ.
NO-синтетаза за участю йонів Са
2+
, лейкотрієну В4 та НАДФ каталізує розщеплення аргініну до
цитруліну, в результаті чого утворюються бактерицидні сполуки азоту. Взаємодія NO-радикала із
супероксидом оксигену зумовлює утворення високотоксичної вільнорадикальної сполуки —
пероксинітриту ONOО
—
, який стабільний у лужному середовищі, а за фізіологічного значення рН
швидко розщеплюється, однак виявляє при цьому сильну окисну дію на різні внутрішньоклітинні
мішені. Утворені сполуки, що містять нітроген (NO, NО
2
–
, NО
3
–
, ONOО
–
), мають сильну
мікробоцидну та пухлиноцидну активність. Метаболіти азоту особливо важливі для руйнування
мікобактерій, які стійкі до інших бактерицидних факторів. Здатність фагоцитів знешкоджувати
мікобактерії корелює з активністю NО-синтетази.
Одним із механізмів протипухлинної активності метаболітів азоту є індукування ними апоптозу як
прямим, так і непрямим шляхом, через індукцію проапоптозного білка р53 або індукцію виходу з
мітохондрій цитохрому с — ефективного активатора апоптозу.
Кисневонезалежні фактори біоцидності — це низка факторів різного походження — лізоцим,
аргіназа, катепсин G, білок ВРІ, який підвищує проникність бактеріальних стінок. Особливе місце
посідають катіонні білки, серед них — дефензини (в основному низькомолекулярні катіонні білки).
Лактоферин і трансферин виявляють свій бактеріостатичний ефект через зв'язування вільного заліза,
лактоферин також бере участь в активації кисневозалежної біоцидності.
Низьке значення рН (4,5 — 5) у фаголізосомах крім прямої бактеріостатичної та бактерицидної дії
сприяє активації значної кількості ферментів фаголізосом, які беруть участь у кілерному ефекті та
руйнуванні поглинутих клітин (протеази, нуклеази, ліпази, ферменти, що розщеплюють вуглеводи)
та ін. Усього в фаголізосомах виявлено понад 60 різновидів ферментів.
Секреторна активність фагоцитів. Секреторна активність лейкоцитів поряд з хемотаксисом і
поглинанням є однією з основних функцій фагоцитарної системи. Дані про основні компоненти
секреторної активності макрофагів наведено в табл. 11. Механізми синтезу та виділення біологічно
активних речовин у макрофагах і ПМЯЛ різні. Макрофаги можуть постійно синтезувати й
спонтанно виділяти деякі біологічно активні речовини, однак їх продукування різко зростає після
активації.
Зрілі нейтрофіли та еозинофіли, на відміну від макрофагів, здебільшого не здатні синтезувати
молекули біологічно активних речовин, вони синтезуються в апараті Гольджі в попередниках
лейкоцитів у процесі їх дозрівання в кістковому мозку. Нейтрофіли містять в основному біологічно
активні речовини, активність яких спрямована на інактивацію, деградацію та утилізацію
чужорідних об'єктів, а макрофаги мають крім перелічених факторів ще широкий набір речовин, які
беруть участь у регулюванні багатьох ланок діяльності організму, як захисних (формування імунної
відповіді та запального процесу), так і тих, що регулюють різні функції багатьох клітин, тканин,
органів. Речовини, функція яких спрямована на інактивацію, деградацію та утилізацію поглинутих
об'єктів, містяться в основному в ґранулах фагоцитів.
Секреція здійснюється або внаслідок дегрануляції, тобто втрати зернистості (трапляється в усіх
фагоцитів), або після виділення біологічно активних речовин за участю ендоплазматичного
ретикулума й апарату Гольджі, що характерно тільки для макрофагів. Нейтрофіли, як правило, після
дегрануляції виснажують свою секреторну здатність і гинуть. Крім цитоцидних факторів гранули
ПМЯЛ та лізосоми макрофагів містять великий набір різних ферментів, здатних деградувати білки,
вуглеводи, жири, нуклеїнові кислоти та їхні сполуки багатьох мікроорганізмів, а також інших клітин
як усередині фагоцитів, так і зовні.
Специфічні гранули містять ферменти з нейтральним значенням рН. Вони найважливіші в
позаклітинних ефектах. Азурофільні гранули містять в основному кислі ферменти, які відіграють
ефективну роль у кілінговому ефекті та деградації мікроорганізмів у фаголізосомах та
позаклітинному просторі в місцях лізису клітин, тканин і формування гною. У разі значної кількості
фагоцитарних стимулів гранули можуть зникати, але не одночасно.
Протеолітичні ферменти беруть участь в утворенні вазоактивних речовин, що зумовлює їх значення
у формуванні судинних реакцій під час розвитку запальних процесів.
Звільненню гранулярних ферментів нейтрофілами в позаклітинний простір і прояву їх
бактерицидної активності сприяють комплекси антиген — IgG, компоненти комплементу С3а і С5а
та деякі інтерлейкіни. Афінність рецепторів нейтрофілів до мономерного IgG дуже низька, однак
вона різко зростає до агрегованого або зв'язаного з антигеном. Виділення ферментів зі специфічних
гранул відбувається інтенсивніше, ніж з азурофільних. При активації макрофагів і нейтрофілів у них
продукуються метаболіти арахідонової кислоти — ейкозаноїди: простагландини, лейкотрієни,
тромбоксан, які індукують хемотаксис лейкоцитів і беруть активну участь у регулюванні функцій
фагоцитів та інших клітин.
15
Деякі протеїнази фагоцитів розщеплюють компоненти комплементу С3, С5 і В на а- і b-фраґменти і
беруть участь в утворенні кінінів, активації згортання крові, фібринолізі. Крім того, нейтрофіли та
макрофаги мають ще низку характерних бактерицидних факторів. Так, нейтрофіли містять
мієлопероксидазу, катіонні білки — дефензини, які мають виражену біоцидну активність відносно
бактерій, грибів, найпростіших. А еозинофіли виділяють головний лужний білок, токсичний для
паразитів.
Макрофаги можуть синтезувати й секретувати біологічно активні речовини, які не продукують
поліморфноядерні лейкоцити. Серед них певне місце посідають компоненти системи комплементу,
білки позаклітинного матриксу й клітинної адгезії — фібронектин, желатинзв'язувальний білок,
протеоглікани.
Макрофаги після дегрануляції здатні відновлювати лізосоми, синтезувати біологічно активні
речовини та брати участь у презентації антигену імунокомпетентним клітинам. Макрофаги можуть
багаторазово активуватися, а також синтезувати й секретувати біологічно активні речовини
тривалий період, що є важливим фактором ефективного підтримання захисних сил організму на
певному рівні під час затяжних процесів.Секреція макрофагів пов'язана не лише з бактерицидною та
утилізуючою активністю, а й значною мірою з регуляторними функціями як локально (у місцях
формування запалення), так і на рівні організму.
При активації макрофаги синтезують і виділяють низку БАР, таких як інтерлейкіни 1, 6, 8, ФНП-α,
ІФН-α та ІФН-β, КСФ для ПМЯЛ і макрофагів, трансформівний фактор росту, еритропоетин,
фібробластоактивуючий фактор, деякі гормони, зокрема адренокортикотропний гормон, β-
ендорфін, тимозин та регулятори біохімічних процесів — інгібітори протеаз — α
2
-макроґлобуліни,
α-антитрипсин, інгібітор плазміну, інгібітор активатора плазміногену та ін.
2.2.2. Природна клітинна цитотоксичність.
Природна клітинна цитотоксичність — це автономна природна система, не пов'язана з імунізацією,
філогенетично найбільш давня система захисту організму від вторгнення носіїв чужорідної
генетичної інформації, основними клітинами-ефекторами якої є НК, макрофаги, моноцити,
нейтрофіли, еозинофіли.
Кілерна активність фагоцитів. Установлено, що фагоцитарні клітини — макрофаги, нейтрофіли,
еозинофіли здатні вбивати пухлинні клітини, при цьому основний тумороцидний ефект зумовлений
прямим міжклітинним контактом ефекторних клітин з клітинами-мішенями. В тканині пухлин
містяться так звані пухлиноасоційовані макрофаги. З одного боку, ці макрофаги шляхом виділення
факторів росту можуть сприяти росту пухлин, а з другого — при відповідній активації можуть
інгібувати і навіть руйнувати пухлинні клітини.
Виділяють кілька можливих механізмів контакту фагоцитів з пухлинними клітинами. Це
неспецифічний контакт, зумовлений взаємодією адгезивних молекул інтегринів, наприклад,
CD11a/CD18 (LFA-1) — CD54 (ICAM-1), CD11b /CD18 (CR3) -CD54 (ICAM-1), або CD50 (ICAM-3).
Іншим механізмом прямої взаємодії фагоцитів з пухлинними клітинами є, можливо, взаємодія Fc- і
CR-рецепторів, а також інших рецепторів з опсонізуючими субстанціями на мембранних структурах
клітин-мішеней. І, очевидно, найефективнішим механізмом взаємодії фагоцитів з клітинами-
мішенями є зв'язування фагоцитами специфічних антитіл до пухлинних клітин. Специфічні антитіла
розпізнають відповідні структури на пухлинних клітинах, і фагоцити тісно контактують з
клітинами-мішенями.
В основі кілерного ефекту фагоцитів лежить кілька різних механізмів: індукування апоптозу,
занурення в мембрану клітин-мішеней цитоцидних факторів фагоцитів. Певну роль при цьому
відіграють біоцидні фактори, що секретуються фагоцитами в міжклітинний простір, зокрема ФНП-
α.
Одним із механізмів протипухлинної дії активованих макрофагів є синтез NO
–
з аргініну. Синтез
NO
–
корелює з цитолітичною активністю макрофагів. Його синтез регулюють Т-хелпери першого й
другого типів через лімфокіни: ІФН-γ разом з ФНП-α сприяє посиленню синтезу NO
–
макрофагами,
а ІЛ-4 і ТФР-β пригнічують цей процес.
Певну роль у кілерному ефекті відіграють еозинофіли, базофіли, мастоцити і тромбоцити.
Еозинофіли активно убивають паразитів шляхом позаклітинного фагоцитозу, а у базофілів важливу
роль у цитоцидному ефекті відіграють серотонін та специфічна протеаза.
Природні, або натуральні, кілери (НК). НК нині розглядають як основні клітини, що здійснюють
протиклітинний, переважно протипухлинний і противірусний, захист. Вони активні фактично проти
будь-яких клітин-мішеней — аутологічних, алогенних і ксеногенних, зокрема й мікроорганізмів.
Проте найефективніші вони відносно пухлинних та вірусінфікованих клітин. Крім того, НК
виконують важливу регуляторну функцію — вони виділяють низку цитокінів, що мають широкий
спектр біологічної дії, в тому числі беруть участь у контролі проліферації гемопоетичних клітин.
Перші відомості про існування НК з'явилися в 1976 р. після виявлення в лімфоїдній тканині щурів і
мишей цитотоксичної активності, яка не була зумовлена імунізацією і проявлялася відносно
широкого спектра пухлинних клітин-мішеней. До останнього часу НК виявлено в лімфоїдній
тканині майже всіх досліджуваних видів хребетних.
НК належать до групи великих гранулярних (зернистих) лімфоцитів (ВГЛ). Ці клітини виникають у
філогенезі, і припускають, що вони є родоначальницями сучасної імунокомпетентної клітини. Так, у
дощового черв'яка за відсутності спеціалізованої імунної системи природну цитотоксичну
активність виявляють лімфоцитоподібні клітини, морфологічно подібні до ВГЛ.
НК становлять близько 15 % лімфоцитів крові, вони є тимуснезалежними лімфоцитами і не здатні
формувати імунну пам'ять. Більшість ВГЛ утворює кон'югати з клітинами-мішенями. Слід
зазначити, що близько 20 % малих лімфоцитів також утворюють кон'югати з такими клітинами,
проте лізисного ефекту не спостерігається.
Природну кілерну активність різної ефективності виявлено в різних органах і тканинах.
Найяскравіше виражена вона в периферичній крові та селезінці, найменше — у кістковому мозку.
Окремі популяції НК виявлено в епітелії кишок і матки. Ці клітини мають високу цито-токсичність,
однак найбільш виражений лізис відбувається не через 2 — 3 год, як у НК крові, а через 18 год. Ця
внутрішньоепітеліальна популяція НК захищає організм від виникнення пухлин і проникнення
патогенних мікроорганізмів. Можливо, кожний орган чи тканина мають свої популяції НК, які
відіграють важливу роль у місцевому імунному захисті. НК у пейєрових бляшках не виявлено. В
тимусі гвінейських свинок також не виявлено активності НК, а в тимусі нормальних мишей —
тільки незначну цитотоксичну активність. Проте у безтимусних мишей кількість НК збільшена.
За морфологією НК подібні до моноцитів: діаметр клітини становить 16 — 20 мкм, мають
ниркоподібну форму ядра, високе значення ядерно-цитоплазматичного відношення. Однак існує й
низка відмінностей від моноцитів — це нездатність прилипати до скла або пластмаси, відсутність
поглинальної активності, неспецифічної естерази, C3R.
Такі факти, як експресія на НК різноманітних маркерів ранніх попередників Т-клітин і моноцитів,
наявність у промоноцитах кісткового мозку мишей високої неспецифічної кілерної активності, а
також різке підвищення активності НК за відсутності диференціювання Т-клітин, є підставою для
припущення про належність їх до малодиференційованих клітин, які походять з ранніх нащадків
плюрипотентних стовбурових кровотворних клітин з припиненням диференціювання на ранніх
стадіях.
НК не мають фагоцитарної активності, вони радіорезистентні, на своїй мембрані не мають
імуноґлобулінів, С3-рецептора, МНС ІІ-антигенів, мають слабку афінність до еритроцитів барана,
гетерогенні за здатністю прилипати до нейлонової вати.
Активність НК людини контролюється генами, розміщеними в 4-й і 17-й хромосомах.
Маркери природних кілерів і механізми розпізнавання та лізису клітин-мішеней. Природні
кілери — це велика самостійна популяція лімфоцитів, гетерогенна як за функціональною
активністю, так і за антигенними маркерами. На поверхні НК виявлено низку антигенів ранніх
стадій диференціювання лімфоїдних клітин. На своїй поверхні вони мають частину спільних
антигенів, які виявляються на Т- і В-лімфоцитах, моноцитах і ПМЯЛ. Однак найбільше спільних
антигенів НК мають з Т-лімфоцитами й моноцитами. Так, у них виявлено спільні з Т-клітинами
лейкоцитарні антигени диференціювання: CD2, CD7, CD8, CD11b, CD16, CD25, CD57, CD45R.
Характерними маркерами для НК є CD 16 (FсγРІІІ-рецептор для Fc-фраґмента IgG), CD56 (NKH-1) і
CD57 (HNK-1), CD158. Рецептор CD158 має понад 12 різновидів (CD158a —к). Клітини з маркером
CD57 з'являються у людини в ембріональному періоді і з моменту народження до зрілого віку
популяція НК з цим маркером зростає. Проте наявність СD57-антигену не завжди корелює з
цитотоксичною активністю НК. Так, у деяких випадках у здорових дорослих осіб або в
онкологічних хворих за наявності підвищеної кількості клітин з маркером CD57 виявлено незначну
цитотоксичну активність НК, а у новонароджених, навпаки, — за значної наявності природної
кілерної активності виявлено мало клітин з маркером CD57. Цей маркер виявляється не тільки на
поверхневій мембрані, а й у цитоплазмі НК
Показано також, що в цитоплазматичній фракції ВГЛ є антигени, характерні для Т- і В-лімфоцитів
та моноцитів. Ці антигени секретуються ВГЛ у навколишнє середовище, але не експресуються на
поверхні клітинних мембран. На клітинній мембрані НК є рецептори до багатьох біологічно
активних речовин, зокрема до інтерферонів, інтерлейкінів 1 і 2.
За результатами дослідження антигенного спектра НК можна дійти висновку що для них
характерний такий фенотип CD16
+
, CD56
+
, CD158
+
.
ПК позбавлені специфічних антигенрозпізнавальних рецепторів, проте мають примітивні функції
розпізнавання чужорідного, в основі яких лежить здатність розпізнавати вільні вуглеводи, манозні
залишки, що виявляються на юних або старих, а також на вірусінфікованих та злоякісно
трансформованих клітинах.
На поверхні НК існує багато рецепторів, які беруть участь у розпізнаванні чужорідності, запуску й
регуляції цитолітичної активності та утворенні цитокінів. Найвідомішими рецепторними
молекулами є CD2, CD16, CD44, CD69, NKR-P1, 2В4, NKp30, NKp44, NKp46, рецептор інгібування
pAIRMI. Однак відомо тільки кілька фізіологічних лігандів на клітинах-мішенях, які зв'язуються з
певними рецепторами. Це фрагмент FcIgG для CD16, CD58 для CD2, CD48 для 2В4. Певний інтерес
становлять рецептори NКр30, NKp44, NKp46, які розпізнають певні ліганди на деяких пухлинних і,
можливо, є основними активуючими рецепторами НК людини. Крім того, NKp46 розпізнає клітини,
інфіковані вірусом ґрипу, можливо, через пряму взаємодію з вірусними гемаглютинінами.
Однак при детальному дослідженні було виявлено, що розпізнавання чужорідного шляхом детекції
вільних манозних залишків на клітинній мембрані є недостатнім для індукування кілінгу. Існують
ще механізми, які обмежують контакт НК з клітинами-мішенями й інгібують або активують їх
літичну дію. Головну роль у регулюванні цитоцидної активності НК відіграють рецептори,
специфічні до лігандів МНС-І (HLA-A, -В, -С алелі) або їх структурних гомологів (таких як MICA,
RAF-1, Н-60), які виявлені на НК, моноцитах, деяких популяціях Т-клітин та інших гемопоетичних
клітинах. Інгібування або активація цитотоксичної дії НК залежить від сиґналів, що надходять від
клітин-мішеней у процесі взаємодії рецепторів НК з лігандами МНС І клітин-мішеней. Рецептори
НК, які зв'язуються з відповідними лігандами HLA-A, -В, -С, належать до двох великих родин білків
— суперродини імуґлобуліноподібних білків і родини лектиноподібних рецепторів С-типу. Серед
родини Ig-подібних рецепторів, які відрізняються від антитіл та Ig-подібних рецепторів Т-клітин,
виділяють Ig-подібні рецептори — KIR (killing Іg-lice receptors), характерні для НК, і LIR (leukocite
Іg-licе receptors, або ILT, або CD85a-k), що виявляються на деяких лейкоцитах. Слід зазначити, що
на НК людини виявляються в основному Ig-подібні рецептори (KIR — СD258а —k), а у мишей —
лектиноподібні рецептори С-типу (переважно родини Ly49). Цитоплазматичні домени рецепторів
можуть бути або довгими (L) з інгібіторною функцією (ці рецептори НК називають кілер-
інгібівними -KIR), або короткими (S) з активаторною функцією. Інгібіторні рецептори містять одну
або дві тирозиновмісні імунорецепторні послідовності з інгібіторною активністю (ІТІМ).
Під час взаємодії з клітинами, що мають нормальну експресію МНСІ-залежних структур
інгібіторних рецепторів, в останніх фосфорилюється тирозин із залученням і активацією SHP-1-
фосфатази, що зумовлює виникнення сигналу заборони лізису інтактних клітин. У разі порушень
експресії HLA-A, -В, -С алелів МНС І-комплексу, що трапляється при трансформації та інфікуванні
клітин вірусами, в процесі взаємодії з KIR-активуючими рецепторами останні нековалентно
зв'язуються з молекулами, що містять тирозиновмісний імунорецептор з активуючою здатністю. Це
є сигналом для запуску лізису. Інгібівні та активуючі рецептори часто розміщені на НК поряд, і в
таких випадках інгібівний сигнал домінує. Про місця розпізнавання KIR-рецепторами структур у
МНС-І ще недостатньо відомо. Нещодавно показано, що KIR-рецептори групи 2D розпізнають
HLA-C-алель, а 3D — А- і В-алелі; KIR3DL2 (СD158к) розпізнає HLA-A3, a KIR2DS1 (CD158h) -
HLA-Cw4.
Процесу зближення НК з клітинами-мішенями активно сприяють деякі адгезивні молекули
(CD11a/CD18, CD54, CD50, CD102, CD57, CD2, гангліозиди), а їхньому контакту сприяють
рецептори до IgG3 та IgGl (CD16), які є на більшості НК (понад 75 %) і які розпізнають опсонізовані
імуноґлобулінами класу G клітини-мішені. В цьому разі відбувається так званий антитілозалежний
цитоліз і НК, що беруть у цьому участь, називають К-клітинами.
У процесі контакту з клітинами-мішенями НК активуються, звільняються азурофільні гранули і
секретуються деякі цитокіни у ділянці контакту з клітиною-мішенню. Гранули містять дві
субстанції, які відіграють головну роль у формуванні літичного ефекту, — перфорин і гранзими.
Перфорин за структурою та механізмом дії подібний до С9-компонента комплементу. Це білок з
молекулярною масою 66 — 70 кД. За наявності йонів Са він змінює свою конформацію, що
призводить до появи гідрофобних ділянок, завдяки яким білок проникає в мембрану клітини-мішені.
Рецепторами для перфо-рину є молекули фосфорилхоліну. При зануренні в мембрану перфорин
полімеризується, в результаті чого утворюються пори в мембрані клітин-мішеней. Об'єднання 3 — 4
молекул перфорину в мембрані зумовлює утворення функціонального каналу. Як правило,
ефективний канал діаметром 10 — 20 нм утворюється завдяки об'єднанню й полімеризації 10 — 20
молекул перфорину. Утворення такого каналу ще не зумовлює руйнування клітин-мішеней.
Ефективний лізис клітин-мішеней відбувається в разі проникнення в них гранзимів. Гранзими,
компоненти гранул, — це серинові протеїнази — естерази трипсин-хемотрипсинового типу, при
проникненні всередину клітини вони активують клітинні цистеїнові протеїнази — каспази. Каспази
зумовлюють активацію ендонуклеаз, які індукують апоптоз — розрив ниток ДНК між
нуклеосомами, що призводить до деградації ДНК, конденсації хроматину та загибелі клітини.
Одночасно зі здійсненням процесу апоптозу реалізуються й механізми руйнування клітин,
зумовлені осмотичним ефектом.
Загальна тривалість цитолізу становить 1,5 — 2 год; з них на формування контакту між клітинами
припадає 0,5—1,5 хв, на стабілізацію контакту та здійснення лізису потрібно до 2 год. З
максимальною інтенсивністю лізис відбувається за температури 37 °С.
Секреторна активність природних кілергв і механізми регулювання їх активності. НК у процесі
активації та взаємодії з клітинами-мішенями виділяють низку біологічно активних речовин.
Найважливіші з цих цитокіни — ІФНи α, β, γ, ФНП-α і ФНП-β, ІЛ-1 та ІЛ-2, колонієстимулювальні
й хемотаксичні фактори, а також простагландини, β-ендорфін, серотонін, мелатонін. Одна з
важливих функцій секретованих цитокінів — активація макрофагів, цитокіни яких беруть участь в
активації НК на перших етапах появи їх подразників. Основну роль у цьому відіграють ІФН-γ і
ФНП-α. Слід зазначити, що ІФН- γ активує значною мірою і своїх продуцентів — НК, він у 5 разів
прискорює лізис клітин-мішеней. ІФН- γ збільшує експресію мембранних протеаз на НК і відновлює
цитолітичну активність кілерів для повторного лізису. Крім того, ІФН- γ у високій концентрації
може брати участь і в зворотній саморегуляції активності НК — інгібувати надмірно активовані
клітини.
Активність НК регулюється багатьма факторами: клітинними, гуморальними, нейроендокринними.
Одним з найважливіших регулювальних факторів є група ІФНів α, β, γ. Показано, що чутливість
багатьох ліній клітин-мішеней до лізису НК корелює з їх здатністю продукувати ІФНи, які
прискорюють процес лізису клітин-мішеней. Так, внесення екзогенного ІФН-γ зменшує тривалість
лізису клітин у кілька разів.
Слід зазначити, що серед популяції НК існує значна кількість їх попередників, які можуть
розпізнавати чужорідні клітини, контактувати з ними, однак не здатні здійснювати літичну дію.
ІФНи прискорюють диференціювання попередників у зрілі НК з вираженим цитолітичним ефектом.
Крім того, ІФНи можуть змінювати чутливість клітин-мішеней до дії НК. Так, преінкубація з ІФНом
нечутливих до дії НК клітин підвищує здатність ефекторних клітин прикріплюватися до цих клітин
і лізувати їх. Активуюча дія ІФНу відносно лізису природними кілерами стійких клітин-мішеней
зумовлена, очевидно, з одного боку, появою нових рецепторів на клітинах-мішенях, які
прискорюють і зміцнюють адгезію НК, а з другого боку, підсилюють їхню літичну активність.
До факторів, що регулюють лізис клітин НК, належать також деякі біологічно активні речовини, які
продукуються активованими макрофагами та лімфоцитами. Так, лейкотрієн В4,
тромбоцитактивуючий фактор стимулюють лізис, а простагландини, інгібітори протеїназ,
кортикостероїди, адреналін, прогестерон, циркулюючі імунні комплекси —пригнічують його.
Взагалі, фактори, які через β-адренергічні рецептори діють на природні кілери й підвищують рівень
внутрішньоклітинного цАМФ, інгібують кілерну активність. Інгібують активність НК також
активовані ПМЯЛ і макрофаги.
Надзвичайно важливим фактором, що активує НК, є ІЛ-2, який продукується активованими
лімфоцитами, в основному Тх1. ІЛ-2 прямо, без попередньої активації, індукує проліферацію НК,
підвищує цитолітичну активність, значно розширює спектр чутливих клітин-мішеней і відміняє
інгібівний ефект розпізнавання аутологічних молекул МНС І класу, які часто містяться на юних та
пухлинних клітинах. Дія ІЛ-2 на НК здійснюється за допомогою рецепторів CD 122 (β-ланцюга
рецептора для ІЛ-2) і CD 132 (γ-ланцюга рецептора для ІЛ-2).
НК, активовані ІЛ-2 і в деяких випадках ІЛ-4, становлять основу так званої фракції
лімфокінактивованих кілерів — ЛАК. In vitro цю фракцію отримують культивуванням лейкоцитів
крові за наявності ІЛ-2 впродовж 3 — 5 діб. Утворенню фракції ЛАК за допомогою ІЛ-2 сприяють
ІЛ-1, ІЛ-3 та ІЛ-7, ГМ-КСФ, ІФНи. Лімфокінактивовані НК характеризуються високою біологічною
активністю, насамперед цитоцидною, збільшеною в 100 разів і більше.
Біологічна роль природних кілерів. Біологічні функції, які виконують НК в організмі, різноманітні.
Основні з них — знешкодження на ранніх стадіях розвитку клітин зі зміненим фенотипом; контроль
за ростом первинних і метастазованих пухлин; ініціювання трансплантаційного імунітету; контроль
за мікробними інфекціями; регулювання імунної відповіді; контроль за проліферацією й
диференціюванням гемопоетичних клітин; продукування біологічно активних речовин; модуляція
розвитку аутоімунних та інших захворювань.
Цитотоксична активність НК найбільше виражена відносно малодиференційованих клітин —
пухлинних або нормальних, які походять з кісткового мозку. Штучно індуковане диференціювання
пухлинних клітин in vitro підвищує їх стійкість до НК. Цитолітична дія НК інгібується молекулами
МНС І класу HLA-B та HLA-C, які здебільшого зникають у трансформованих, пухлинних та
вірусінфікованих клітинах.
У процесі взаємодії з кілерами інфіковані вірусами клітини-мішені виділяють ІФН, що значно
підсилює цитолітичний ефект.
Істотну роль у здійсненні ефекторних функцій природних кілерів відіграють йони кальцію,
особливо їх рівень усередині клітини. Показано, що чим більше йонів кальцію накопичується в
цитоплазмі кілерів, тим міцніший їхній контакт з мішенями та ефективніший лізис.
Цитотоксична активність НК залежить від багатьох факторів, насамперед вона є генетично
зумовленою. Так, у мишей різних генотипів виявлено залежність природної кілерної активності від
належності до певних ліній.
Виявлено також певну відмінність у чутливості різних ліній клітин, що використовуються як
клітини-мішені, до цитотоксичної дії НК. Однією з основних мішеней для НК крім пухлинних
клітин є інфіковані вірусами або деякими внутрішньоклітинними мікроорганізмами клітини.
Природні кілери не діють на віруси прямо, однак розпізнають інфіковані вірусом клітини і швидко
лізують їх.
Активність НК швидко підвищується при різних вірусних інфекціях, досягає максимуму вже через 2
— 3 доби і зумовлена в основному прискоренням перетворення попередників НК на зрілі ефекторні
клітини. Введення мишам перед їх інфікуванням вірусом простого герпесу суспензії лейкоцитів,
збагаченої НК, захищає тварин від летального ефекту, і навпаки, зменшення кількості або
активності НК значно прискорює летальний кінець.
Як бачимо, НК відіграють вирішальну роль у лізисі чужорідних клітин, які з'являються в організмі
внаслідок різної природи трансформацій, індукції пухлинного росту, вірусних та деяких
внутрішньоклітинних інфекцій. Дія НК обмежується молекулами МНС І класу HLA-B і HLA-C, які
зникають у трансформованих і пухлинних клітинах, а також під час інфекцій, що індукуються
вірусами (аденовіруси, віруси герпесу) та деякими внутрішньоклітинними мікроорганізмами
(лістеріями).
2.3. ЗАПАЛЕННЯ.
Роль факторів природного імунітету в розпізнаванні чужорідних об'єктів, у захисті організму від
вторгнення та розмноження їх, ініціюванні та формуванні специфічної імунної відповіді, взаємодії
неспецифічних і специфічних факторів добре простежується під час розгляду індукування та
формування запальної реакції.
Запалення — пристосовна захисна реакція організму, спрямована на мобілізацію захисних сил і
концентрацію їх у місцях ушкодження й появи патогенів та антигенної стимуляції з метою
відновлення порушеного ними гомеостазу.
Залежно від природи індуктора виокремлюють стерильне і нестерильне запалення. Стерильне
запалення індукується при закритих травмах, при потраплянні в тканини й органи чужорідних тіл
різної природи (шовний матеріал, штучні замінники певних органів і тканин, пил, деякі лікарські
речовини тощо), при аутоімунних процесах. Нестерильне запалення зумовлюється патогенами
різної природи. За характером перебігу запалення можуть бути гострими і хронічними. Розрізняють
також доімунне та імунне запалення. Доімунне запалення виявляється від індукції запалення до
появи специфічних факторів імунної відповіді, імунне — коли індуковані специфічні гуморальні та
клітинні фактори беруть активну участь у знешкодженні індуктора запалення. Основними
клітинами — учасниками гострого запалення є нейтрофіли; доімунного — нейтрофіли, макрофаги,
НК, ендотеліоцити, еозинофіли; імунного — дендритні клітини, макрофаги, Т- і В-лімфоцити;
хронічного — макрофаги, фібробласти, Т- і В-лімфоцити тощо.
Основними компонентами запалення є наявність зони ушкодження та патогенного фактора, зміна
кровообігу, переважно мікроциркуляторного, підвищення проникності судин, міграція гуморальних
факторів плазми і лейкоцитів у зону ушкодження, активація резидентних і прибулих факторів
природного імунітету, поява великої кількості різних біологічно активних речовин (БАР). Джерелом
БАР є продукти деградації власних клітин і патогенів, продукти життєдіяльності патогенів та
активації багатьох клітин і систем у зоні запалення. Вони здатні активувати різні клітини і системи,
залучати в зону запалення нові клітини. Осередок запалення пов'язаний з кістковим мозком: БАР
активують кровотворення і стимулюють вихід імунокомпетентних клітин у кров. Вони постійно
взаємодіють з нейроендокринною та іншими системами.
Перші етапи запалення характеризуються почервонінням, припухлістю, появою болю, місцевим
підвищенням температури. Больовий синдром індукується ліпідним фактором ПМЯЛ разом з
брадикініном і простагландином Е.
Після ушкодження клітин ендотелію в навколишнє середовище виділяються біологічно активні
речовини — активований фактор Хагемана, компоненти комплементу, фактори активації
тромбоцитів та інші, які одночасно активують і лейкоцити та спричинюють ушкодження ендотелію.
Ушкодження ендотелію активує його і речовини, які сприяють згортанню крові, фібринолізу,
активації калікреїн-кінінової системи, що сприяє ізоляції чужорідних агентів. Під впливом БАР
активується комплемент, що зумовлює появу активованих компонентів комплементу, та
активується арахідонова кислота з утворенням лейкотрієнів і простагландинів.
БАР є також сигналом для масового надходження ПМЯЛ з депо – кістково-мозкового і легеневого
та збільшення утворення і виходу із кісткового мозку ПМЯЛ, моноцитів, лімфоцитів. Під впливом
БАР активуються ендотеліальні клітини, що індукує в них властивості високого ендотелію
лімфоїдних органів, унаслідок чого вони можуть взаємодіяти з адгезивними молекулами лейкоцитів
і пропускати їх у зону запалення. Міграція лейкоцитів має кілька стадій: гальмування руху
лейкоцитів у капілярах, адгезія на ендотеліоцитах, активація, міграція між клітинами ендотелію і
рух у зону запалення (мал. 23). Всі ці процеси регулюються наявними на лейкоцитах інтегринами
(CD11a/CD18, CD11b/CD18, CD11c/CD18, CD49d/CD29, селектином CD62L, вуглеводними
лігандами, які зв'язуються з відповідними структурами на ендотеліоцитах (селектинами CD62E і
CD62P, молекулами суперродини імуноґлобулінів CD54, CD102, CD106, а також CD34, MadCAM,
GlyCAM). Ефективність міграції залежить як від типу клітини, так і від стадії її диференціації та
рівня активації. Взаємодія інтегринів з відповідними лігандами вилежить від наявності
двовалентних йонів магнію та кальцію. Основними факторами індукції міграції є цитокіни, які
продукуються активованими макрофагами — ФНП-α та ІЛ-8. Під впливом ФНП-α у зоні запалення
збільшується діаметр судин і посилюється їх проникність, що призводить до місцевого накопичення
рідини, внаслідок чого формується припухлість. Після взаємодії ендотелію з ФНП-α клітини
зморщуються, міжклітинні щілини збільшуються. За допомогою молекул інтегрину СD11b/CD18 та

16
CD34 лейкоцити проходять крізь міжклітинні щілини ендотелію в зону запалення. Лейкоцити
здебільшого мігрують із венул, а розчинні молекули плазми — з капілярів. Інтегрини в нормі
частково розміщені на поверхні клітин, основна їх частина перебуває у внутрішньоклітинних
гранулах у неактивному стані. Активація інтегринів відбувається під впливом сигналів, які можуть
бути продуктом або самих ендотеліоцитів, або фіксованих на них пептидів, які надходять із
навколишнього середовища.
Лейкоцити, що проникли через ендотелій,
прямують у поле запалення за градієнтом
концентрації, який створюється
хемотаксинами. Більшість хемотаксинів
вивільняються в зоні запалення, але деякі з
них, такі як CXCL8 (ІЛ-8) і хемотаксичний
для макрофагів білок CCL2 МСР-1, можуть
синтезуватися і ендотеліальними клітинами.
Компоненти комплементу С3а і С5а
підвищують проникність ендотелію, як
хемотаксини активують міграцію фагоцитів і
насамперед мобільніших нейтрофілів,
сприяють їх концентрації у місцях запалення.
Зазвичай у зону появи подразників першими
проникають нейтрофіли із пристінкового
пулу і в першу добу становлять понад 90 %
клітин запального процесу. Через добу
починають надходити макрофаги і
лімфоцити. В нейтрофілах активуються ряд
бактерицидних факторів —
мієлопероксидаза, біоцидні форми кисню, катіонні білки, які переважно знешкоджують й
утилізують поглинуті патогени. Частина цитоцидних факторів виділяється за межі клітин і там
виявляють свою активність. Реакція нейтрофілів має вибуховий характер. Нейтрофіли з
поглинутими і найчастіше вбитими й перетравленими патогенами гинуть на місці і руйнуються
впродовж кількох діб. Зі зруйнованих лейкоцитів у навколишнє середовище надходить ще більше
БАР, що призводить до більш вираженої активації клітин та різних факторів. Активуються
простагландинова і кінінова системи. Отже, в осередку запалення накопичується значна кількість
регулювальних і біоцидних речовин та активованих клітин, здатних знешкоджувати і руйнувати
патогени, а також підвищувати активність клітинних і гуморальних факторів природного імунітету.
У разі гострого запалення нейтрофіли і особливо продукти їх деградації можуть зумовити
деструкцію прилеглих клітин і таким чином розширювати зону запального процесу та сприяти
виходу патогенів за його межі. Одним з елементів гострого запалення є абсцес — ізольована
порожнина, заповнена ексудатом, основу якого складають нейтрофіли та продукти їх деградації.
Утворенню абсцесу сприяє недостатнє надходження макрофагів. Заміщення нейтрофілів на
макрофаги забезпечує формування репараційного процесу. На слизових важливу роль у
функціонуванні запалення відіграють еозино- і базофіли та мастоцити.
Активовані макрофаги, НК, ендотеліоцити та інші клітини виділяють ряд БАР, зокрема цитокіни
доімунного запалення — інтерлейкіни 1, 6, 8 та 12, ФНП, ІФН, хемотаксичні фактори —
компоненти комплементу (С3а, С5а), хемокіни, білки гострої фази тощо. Істотну роль в
ефективності запального процесу відіграють цитокіни ІЛ-1 та ІЛ-6. Вони здатні зумовлювати
пірогенний ефект — підвищувати температуру тіла, індукувати синтез білків гострої фази,
мобілізувати нейтрофіли. ІЛ-12 та ФНП-α стимулюють секрецію НК ІФН-γ, який, у свою чергу, є
сильним активатором макрофагів. Компоненти комплементу синтезуються переважно макрофагами
і гепатоцитами, але важливе біологічне значення має синтез їх саме макрофагами, оскільки цим
забезпечується локальний синтез та активація комплементу в місці ушкодження.
Значну роль у формуванні запалення відіграють Т-лімфоцити субпопуляції CD4Txl — лімфоцити
запалення. Диференціюванню так званих «наївних лімфоцитів» — CD4O на CD4Tx1 сприяють
продуковані активованими макрофагами й НК ІФН-γ та ІЛ-12. Лімфоцити запалення розпізнають
антигени на поверхні макрофагів, активуються і самі синтезують цитокіни ІФН-γ і ФНП-α. Заново
синтезовані цитокіни накопичуються в мікровезикулах Тх1 і проникають у макрофаги в місці
контакту їх з лімфоцитами, зумовлюючи ефективне злиття фагосом з лізосомами, активацію
кисневого вибуху, збільшення експресії молекул II класу МНС та рецептора ФНП-α, що сприяє
залученню додаткових «наївних» Т-клітин. У процесі взаємодії з макрофагами Тх1-клітини самі
активуються і ще більше сприяють формуванню ефективних захисних реакцій. Активація
макрофагів Тх1-лімфоцитами відіграє вирішальну роль у знешкодженні внутрішньоклітинних
патогенів. Крім того, Тх1 синтезують низку факторів, важливих для індукування запалення, —
ФНП-β (лімфотоксин), ІЛ-3, ГМ-КСФ, MXФ, МІФ. Ці фактори сприяють поглинанню бактерій
макрофагами, прискоренню диференціювання моноцитів у кістковому мозку, міграції моноцитів з
кров'яного русла в зону запалення і накопиченню в ній макрофагів.
Слід зазначити, що в міру усунення негативної дії подразника стає простішим ланцюг індукованих
ним реакцій, і навпаки. Після знешкодження патогену зникають подразники, що індукують
відповідні реакції, і запальний процес набуває зворотного розвитку.
У поєднанні ізоляція чужорідного агента, концентрація в зоні запалення гуморальних і клітинних
факторів природного імунітету, фагоцитарна та бактерицидна активність лейкоцитів, активуюча і
біоцидна дія здебільшого інактивують патоген та сприяють видужуванню впродовж кількох діб.
Однак у деяких випадках, коли патоген протистоїть захисним силам організму завдяки своїй
високій вірулентності чи недостатності окремих ланок природного імунітету, запальний процес
буде розвиватися далі. Через 24 год в зону запалення мігрують переважно макрофаги та лімфоцити,
які активуються БАР у місці запалення. Поява специфічних антитіл можлива вже через 48 год після
контакту з антигеном субпопуляції СD5В-клітин. Синтезовані ними антитіла фіксують С1-
компонент комплементу і таким чином запускають його активацію класичним шляхом.
У міру заповнення зони запалення моноядерними лейкоцитами макрофаги та інші
антигенпрезентувальні клітини представляють антигенні пептиди патогенів Т- і В-лімфоцитам для
запуску імунної відповіді. Патогени і макрофаги через лімфу можуть потрапляти в лімфовузли, а з
кровотоком — у селезінку, де індукують клітинну і гуморальну імунну відповідь. Імунні лімфоцити
та деякі АПК продукують велику групу цитокінів — регуляторів імунного запалення — ІФН, ЛТ,
інтерлей-кіни 5, 9, 10, 12 тощо. Специфічні гуморальні й клітинні фактори безпосередньо
включаються в захисні реакції і значно підвищують захисну функцію природного імунітету.
Результатом цього може бути або повна інактивація патогенів, і запальний процес розвивається у
зворотному напрямі, або відбувається його хронізація.
При рівновазі захисних сил організму і патогенних властивостей збудника запальний процес може
набути затяжного характеру і перейти в хронічну форму.
Активовані Т-лімфоцити виділяють низку факторів, таких як макрофагоінгібівний і
макрофагоагрегувальний та інші, які залучають і затримують у зоні запалення моноцити-макрофаги
та індукують їх агрегацію. Цим досягається, з одного боку, концентрація макрофагів у місці
запалення та обмеження їх руху, щоб вони не стали джерелом поширення поглинутих ними
патогенів, а з іншого боку, — агреговані навколо осередку запалення макрофаги створюють
механічний бар'єр, який протидіє виходу патогену за його межі. Активовані макрофаги, лімфоцити,
ендотеліальні клітини виділяють фактори, що сприяють росту фібробластів, ендотеліальних та
нервових клітин, і разом з агрегованими макрофагами — ізоляції осередку запалення.
За наявності постійного подразника в зоні запалення формується межа відчуження, основою якого є
агреговані макрофаги та багатоядерні клітини. Активовані макрофаги, лімфоцити та інші клітини
виділяють речовини, які стимулюють міграцію і розмноження фібробластів, ендотеліоцитів,
нервових клітин у зоні відчуження, що сприяє утворенню навколо запалення компактного
ізольованого утвору — гранульоми, яка значною мірою (або повністю) ізолює патогени. Ці утвори
можуть звапнюватися. Здебільшого такі утвори зберігаються тривалий час, а в деяких випадках —
усе життя. При знешкодженні патогену ці утвори можуть заміщатися фібробластами. Гранульоми,
або гранульомоподібні утвори, відіграють і негативну роль — зменшують кількість активних клітин
в органах або в тканинах, що знижує їх функціональну активність. Утворення гранульом характерно
для багатьох внутрішньоклітинних інфекцій (туберкульоз, лепра, актиномікоз, шистосомоз та ін.).
ВИСНОВКИ
Першою і нерідко основною лінією захисту організму від вторгнення і розмноження різних
патогенів є фактори природного (природженого) імунітету. Від його стану залежать наслідки
взаємодії організму з патогенами — або фактори природного імунітету негайно нейтралізують
збудників, або внаслідок певних вад системи природного імунітету чи вираженої патогенності
збудників останні не інактивуються, що призводить до активації факторів природного імунітету
(активація системи комплементу, фагоцитів, індукування синтезу біологічно активних речовин
різними клітинами, індукування міграції гуморальних і клітинних факторів у місця знаходження
патогенів). Здебільшого це призводить до знешкодження патогенів. Однак у разі значної
патогенності збудника або наявності вад факторів природної резистентності патоген продовжує
виділяти агресивні фактори, що зумовлює формування запального процесу, який супроводжується
концентрацією і активацією в місцях знаходження патогену гуморальних і клітинних факторів
стійкості, стимулюванням синтезу клітинних і гуморальних факторів стійкості, індукуванням
формування специфічного імунітету (антитіл та ефекторних Т-клітин). Це переважно сприяє
виникненню специфічної ланки імунної відповіді, знешкодженню патогену і розвитку запального
процесу в зворотному напрямі.
Нездатність природних і специфічних факторів імунітету знешкодити патоген може зумовити такі
наслідки: встановлення рівноваги між патогенами і захисними силами організму - хронічна форма
інфекції- патоген може бути ізольований гранульомами або гранульомоподібними утворами;
збудник проникає через бар'єри в кров або міжклітинний простір і поширюється по всьому
організму. При цьому можливі максимальна активація всіх факторів імунітету, знешкодження
патогенів і одужання або пригнічення захисних факторів, що може призвести до летального кінця.
Контрольні запитання
1 Які складові системи природного імунітету?
2. Що таке місцеве оточення і які його основні фактори?
3. Які є способи активації комплементу та їхні характерні особливості?
4. Які способи регуляції активації комплементу вам відомі?
5. Які біологічні ефекти мають компоненти комплементу?
6. Що таке білки гострої фази і яка їхня функція в захисних реакціях організму?
7. Яка роль у захисних реакціях лізоциму?
8. Природні антитіла – їх природа і функція.
9. Яка роль макрофагів і нейтрофілів у захисних реакціях організму?
10. Природні кілери та їхня роль у системі природної резистентності.
11. Що таке запалення? Які особливості його формування і роль у захисних реакціях організму?
РОЗДІЛ 3. АНТИГЕНИ. МОЛЕКУЛЯРНА СТРУКТУРА І БІОЛОГІЧНІ ВЛАСТИВОСТІ.
Функціональні елементи імунної системи здатні розпізнавати будь-який чужорідний матеріал (чужі
клітини й тканини, бактерії, найпростіші, віруси, окремі біополімери) і розгорнути ланцюг
відповідних реакцій, що призведуть до його знищення або елімінації. Для цього вони проникають у
будь-яку ділянку організму, де за допомогою спеціальних розпізнавальних рецепторних структур
аналізують кожну клітину і реагують не лише на чужі клітини та їх скупчення, а й на чужі молекули
та невеликі хімічні угруповання, якщо вони не є звичайною складовою клітин свого організму.
Чужорідні або змінені «власні» структури, проти яких розвивається реакція імунної системи, є
антигенами. Антигени — це біополімери, що входять до складу структурних елементів клітин або
відділені від них, які здатні зумовлювати імунні реакції: синтез антитіл, активацію клітинного
імунітету, підвищену чутливість, імунну пам'ять або імунологічну толерантність.
Антигенами є органічні речовини мікробного, рослинного й тваринного походження. Хімічні
елементи, прості та складні неорганічні речовини антигенність не виявляють. Антигенами можуть
бути як шкідливі, так і нешкідливі для організму сполуки. Антигенами є віруси, бактерії, гриби,
найпростіші, клітини й тканини, що потрапили в організм унаслідок інфекції, ін'єкції або
трансплантації, а також клітинні стінки, цитоплазматичні мембрани, рибосоми, мітохондрії, окремі
біополімери, що входять до їх складу, мікробні токсини, екстракти гельмінтів, отрути змій та комах,
природні білкові речовини, деякі поліцукриди мікробного походження, рослинні токсини тощо.
Вірусні частинки, бактеріальні й тваринні клітини містять у своєму складі велику кількість різних за
хімічною природою біополімерів, а тому є дуже складними в антигенному відношенні. Різноманіття
антигенів у природі зростає завдяки тому, що багато неантигенних субстанцій набувають
антигенних властивостей у суміші або при сполученні з іншими речовинами. Оскільки природні
антигени, як правило, досить складні за хімічною структурою, вони викликають одночасно не один,
а кілька видів специфічної імунної відповіді, хоча зазвичай у нормальних тварин домінує один із
них. Відповідь залежить від цілої низки факторів: видових та індивідуальних (стать, вік, генетичний
статус) особливостей тварин, а в разі інфекції — і від біологічних властивостей збудника.
Існує функціональна відмінність між поняттями «антиген» та «імуноген». Антигеном є будь-який
аґент, що специфічно зв'язується з функціональними елементами імунної відповіді — рецепторами
лімфоцитів та антитілами. Імуногеном є будь-який аґент, здатний індукувати імунну відповідь.
Відмінність між цими поняттями є важливою, оскільки багато субстанцій не здатні самостійно
індукувати імунну відповідь, але здатні зв'язуватися з антитілами чи рецепторами лімфоцитів, які
були специфічно індуковані. Отже, всі імуногени є антигенами, але не всі антигени можуть бути
імуногенами. Ця відмінність особливо важлива для низькомолекулярних субстанцій, таких як
антибіотики, деякі лікарські препарати, наркотики, токсичні речовини, окремі хімічні радикали.
Вони не здатні самостійно викликати імунну відповідь, однак набувають цієї здатності після
кон'югації з високомолекулярними, наприклад білковими, молекулами або в суміші з деякими
речовинами. Такі субстанції називають гаптенами. Структуру, до якої кон'югують гаптен,
називають носієм, а антигени в цьому випадку називають кон'югованими. Гаптенами також можуть
бути речовини складної хімічної природи з великою молекулярною масою: деякі бактеріальні
поліцукриди, регулярні поліпептиди, нуклеїнові кислоти, ліпіди.
Існує поділ антигенів на повні антигени — ті, що здатні самостійно індукувати синтез специфічних
антитіл і взаємодіяти з ними in vitro та in vivo, та неповні антигени (гаптени) (мал. 24).
Гаптени є частиною повного або кон'югованого антигену. Антитіла, що утворюються до кон'югату
білка з гаптеном, можуть також реагувати і з вільними гаптенами (табл. 12).
Імунну відповідь індукують лише повні антигени.
Гаптени імунної відповіді не викликають, однак
вони взаємодіють із сироватками, які містять
специфічні до них антитіла. Якщо в сироватці
міститься надлишок гомологічного гаптену, то
при дальшому добавлянні повного антигену
реакція не відбувається, оскільки рецепторні
групи антитіл заблоковані гаптеном — так звана
реакція затримки. Її широко застосовують для
вивчення природи і хімічного складу антигенів та
сил взаємодії антигену й антитіл.
Деякі бактеріальні субстанції, в тому числі й
макромолекулярні, в ізольоваму вигляді не
антигенні, однак антигенні в складі бактеріальної
корпускули, де вони включені в полімерні структури (капсульна речовина палички — збудника
сибірки, яка складається з полі-D-глутамінової кислоти, не антигенна в очищеному стані, але
антитіла до неї утворюються при імунізації кролів суспензією бактерій сибірки).
Ефектори імунної відповіді (антиген-специфічні
лімфоцити, антитіла) взаємодіють не з усією
площею молекули біополімеру, а лише з її
невеликими ділянками, які утворені кількома
залишками амінокислот або вуглеводів. Тому
повні антигени у складі своєї молекули містять,
як правило, не одну, а кілька таких однотипних
груп — антигенних детермінант, або епітопів.
Такі антигени є полівалентними. Неповні
антигени (гаптени) зазвичай мають лише одну
детермінант-ну групу, тому вони є
моновалентними (мал. 25).
Антигенність визначається переважно хімічним
складом і структурою антигену, а імуногенність,
крім того, зумовлена індивідуальною
імунологічною реактивністю організму, а також
його видовою належністю.
3.1. АНТИГЕННІСТЬ РЕЧОВИН І ВИДОВІ ОСОБЛИВОСТІ РЕЦИПІЄНТА.
Антигенність речовин зумовлюється багатьма факторами. Зокрема, вона залежить від видових та
індивідуальних особливостей реципієнта.
1. Сила антигену пропорційна частці імунокомпетентних клітин у лімфоїдній тканині реципієнта,
здатних реагувати на цей антиген. Чим менше клітин, реактивних щодо цього антигену, тим він
слабкіший. Контроль за імунною реактивністю кожної окремої особини здійснють гени (IR-гени),
що локалізуються в головному комплексі гістосумісності — МНС або зчеплені з ним.
2. Антигенність речовин залежить від виду тварин: чим далі у філогенетичному відношенні
перебувають види тварин, тим більш взаємочужорідними є їхні тканини і тим вони більш антигенні.
Наприклад, кролі утворюють у високих титрах преципітувальні антитіла до сироваток котів.
Преципітини до сироватки курей значно легше отримати імунізацією кролів, ніж качок. Різні види
тварин і окремі особини одного виду розпізнають різні детермінанти на молекулі одного антигену.
Так, гвінейські свинки однієї генетичної лінії синтезують антитіла на детермінанти N-кінцевої, а
другої лінії — на детермінанти С-кінцевої частини молекули інсуліну. Для одних видів тварин одна
й та сама субстанція може бути високоантигенною і зовсім неантигенною для інших. Стрептокок,
збудник пневмонії, індукує синтез специфічних антитіл у мишей, котів, собак і людини, однак не
зумовлює утворення антитіл у щурів, гвінейських свинок і кролів. Декстрани (поліозиди, що є
полімерами глюкози і синтезуються деякими бактеріями роду лейконосток) є антигенними для
людини, але не для кролів.
3. Білки, що виконують однакові функції в організмі різних тварин, мають відносно низький ступінь
антигенності через подібність їхніх хімічних структур. Так, гемоглобін ссавців зазвичай не викликає
утворення антитіл у людини. Антисироватки до нього можна отримати імунізацією птахів.
3.2. ХІМІЧНА ПРИРОДА АНТИГЕНІВ
Антигенами є чужорідні для реципієнта речовини, насамперед білки, поліцукриди, меншою мірою
нуклеїнові кислоти та ліпіди, їх комплекси, а також синтетичні аналоги цих біополімерів (табл. 13).
Речовини зі складною хімічною структурою мають вищу антигенність. Найбільш вираженими
антигенними властивостями характеризуються білки. Теоретично з 20 основних амінокислот можна
побудувати 1020 різних сточленних поліпептидів, що характеризуються антигенністю (див. 3.4.
Макромолекулярність). Антигенні властивості білків відкрив Р. Краус у 1897 р. Більшість білків
тваринного походження, мікробні екзотоксини, які є білками, а також деякі рослинні білки мають
виражені антигенні властивості.
Такі білки тваринного походження, як сироватковий альбумін, глобуліни, ферменти, є добрими
антигенами. Водночас деякі тваринні білки, наприклад кератин, желатин, казеїн, фібриноген, є
слабкими антигенами. Для багатьох видів ссавців сильними антигенами є білки рослинного
походження, наприклад глутеніни. Мікробні екзотоксини (дифтерійний, правцевий, ботуліновий,
гангренозний) характеризуються дуже високою антигенністю. Під впливом формаліну вони
перетворюються на анатоксини, тобто втрачають токсичність, зберігаючи при цьому антигенність.
Це дає змогу отримати специфічні до них імунні сироватки з високими титрами антитіл імунізацією
тварин високими дозами анатоксину. Такі сироватки повністю нейтралізують токсини, тому їх
використовують для лікування дифтерії, правця, ботулізму, газової гангрени. Крім названих
використовують сироватки, що нейтралізують токсини змій, павуків, отруйних грибів.
Найпоширенішими мікробними антигенами є О-стрептолізин і стафілолізин, оскільки антитіла до
них виявляються в сироватці крові всіх індоєвропейських народів.
Антигенність властива не лише продуктам природного синтезу, а й деяким синтетичним полімерам.
Для поліпептидів, побудованих з D-ізомерів амінокислот, характерна низька антигенність, а у
великих дозах вона зовсім відсутня. Відсутність антигенності у пептидів, що складаються з D-
амінокислот, можливо, зумовлюється тим, що в макрофагах немає протеолітичних ферментів для
розщеплення таких білків. Однак D-тирозин за антигенністю не відрізняється від L-тирозину.
17
Імунну відповідь у кролів отримано щодо поліпептиду, який складається з D-тирозину, D-лізину і
D-глутамінової кислоти. Поліпетид, основний ланцюг якого складається з L-амінокислот, а бічні —
з D-амінокислот, має слабку імуногенність.
Порівняно з білками поліцукридам у чистому вигляді рідко притаманні антигенні властивості.
Поліцукриди виявляють антигенні властивості у складних сполуках з білками та ліпідами, а
очищені поліцукриди поводять себе як гаптени. Антигени поліцукридної природи мають велике
значення, оскільки вони входять до складу капсули і клітинної стінки бактерій, визначаючи їх
антигенну специфічність. Виражені антигенні властивості мають поліцукриди рослинного
походження. Крім того, поліцукриди є складовою частиною цитоплазматичної мембрани тваринних
клітин і значною мірою впливають на формування їх антигенної структури. Вуглеводні компоненти
складних білків також мають істотний вплив на їх антигенність. Більшість поліцукридів стійкі до
розщеплення ферментами, а це є одним з істотних факторів виявлення антигенних властивостей усіх
біополімерів.
Розрізняють гомо- та гетерополімерні поліцукридні антигени. Гомополімерні поліцукриди — це
лінійні або розгалужені ланцюги, які складаються із залишків одного моноцукриду (декстрани,
манани, левани). Так, декстрани — екзопродукти поліцукридної природи деяких грампозитивних
бактерій — є лінійними полімерами молекул глюкози, сполучених альфа-1, 6-глікозидним зв'язком,
до яких приєднані короткі бічні ланцюжки із залишків глюкози за допомогою альфа-1, 3- та альфа-1,
4-глікозидних зв'язків.
До складу гетерополімерних поліцукридів входить два і більше моноцукридів. Гетерополімерами є
поліцукриди — антигени грамнегативних бактерій, що являють собою О-ланцюги молекул
ліпополіцукриду (ЛПЦ) — структурного елемента зовнішньої мембрани їхньої клітинної стінки. У
різних видів цих бактерій вони складаються з різних моноцукридів, що повторюються. Вони
значною мірою визначають антигенну специфічність грамнегативних бактерій. Якісний
моноцукридний склад О-антигенів визначає хемоваріант бактерій, а їх антигенна різноманітність
визначає їх сероваріанти. Антигенними є олігоцукриди, що складають кор — основний структурний
елемент молекули ЛПЦ. При імунізації тварин ЛПЦ утворюються антитіла до його поліцукридної
частини.
Капсульні поліцукриди мають істотний вплив на прояв антигенних властивостей бактерій. Для
мишей, великої рогатої xудоби і людини капсульні поліцукриди пневмококів мають властивості
повноцінних антигенів. Вони стимулюють синтез антитіл, що зумовлюють виражений протективний
ефект. На основі антигенних властивостей капсульних поліцукридів ідентифіковано понад 70
сероваріантів пневмококів.
Антигенні властивості притаманні й поліцукридам тваринного походження, наприклад глікогену,
речовинам, що визначають групи крові людини. Для людини, гвінейських свинок і кролів
антигенними й алергенними є також поліцукриди аскарид і трихінел.
Ліпіди в очищеному вигляді, очевидно, не антигенні, однак деякі білково-ліпідно-поліцукридні
комплекси втрачають антигенність у разі відщеплення ліпідів. При імунізації кролів клітинами
кишкової палички, обробленими спочатку кислотою, а потім ліпідом А, вдається отримати антитіла
до ліпіду.
Деякі стероїди й фосфоліпіди можуть бути гаптенами. У комплексі з білками як гаптенові
субстанції, що індукують синтез специфічних антитіл, можуть функціонувати такі ліпіди, як
кардіоліпін, холестерин, лецитин, кефалін. Антитіла до кардіоліпіну дають перехресні реакції з
антигенами збудника сифілісу, що дає змогу застосовувати їх для діагностики цієї хвороби. Імунні
сироватки, що реагують з лецитином і холестерином, отримано при імунізації тварин цими ліпідами
в суміші з сироваткою свині.
Нуклеїнові кислоти, як правило не імуногенні, однак набувають властивостей повних антигенів у
комплексі з метильованим альбуміном, який, очевидно, захищає їхню молекулу від розщеплення
ферментами. Антитіла до нуклеїнових кислот можна отримати при імунізації тварин
нуклеопротеїдами або нуклеїновими кислотами, ковалентно зшитими з білком-носієм. Такі антитіла
реагують з нетиповими формами нуклеїнових кислот: дволанцюговою РНК, денатурованою або
одноланцюговою ДНК. Синтетичні дволанцюгові дезоксирибонуклеотиди є добрими імуногенами.
При деяких захворюваннях (вірусної етіології, системному червоному вовчаку, множинній мієломі)
в сироватці крові людини з'являються антитіла проти РНК та нативної дволанцюгової ДНК.
3.3. ГЕНЕТИЧНА ЧУЖОРІДНІСТЬ.
Кожній особині властива генетично детермінована специфічність і стабільність фізико-хімічної
будови макромолекул речовини, а отже, і набору антигенів. Імунна система є своєрідним «відділом
технічного контролю», який стежить за тим, щоб в організмі зберігалися лише макромолекули й
клітини, що відповідають заданій генетичній програмі. Р.В. Петров (1976) визначав антигени як
речовини, що мають ознаки генетично чужорідної інформації і при введенні в організм зумовлюють
імунні реакції, а імунітет — як спосіб захисту організму від живих тіл і речовин, що мають ознаки
чужорідної генетичної інформації. Механізм такого захисту полягає в тому, що імунна система
організму толерантна до власних структур, а екзогенні речовини, що потрапили в організм, так само
як і власні макромолекули, змінені внаслідок мутацій, генетичних помилок і ушкоджувальних
впливів є для неї чужорідними, а тому вони руйнуються і видаляються.
Отже, першою умовою антигенності речовини є її чужорідність у генетичному відношенні (табл.
14).
Забезпечення антигенного гомеостазу — біологічна доцільність, спрямована на збереження
структурної, морфологічної та функціональної цілісності кожної особини.
Антигенні відмінності існують між видами та між окремими особинами всередині виду, зокрема
між батьками та нащадками. Відмінності в антигенному відношенні між окремими особинами того
самого виду зникають лише в штучно виведених інбредних лініях тварин та при спеціальному
клонуванні тканин, органів та організмів за найсучаснішими технологіями.
Речовина антигенна для певної тварини тоді, коли вона генетичне чужорідна для її лімфоїдної
системи. Ступінь чужорідності є важливим фактором імуногенності антигену. За фізико-хімічною
структурою антигени відрізняються від подібних речовин реципієнта. Якщо у складі чужорідних
речовин є хімічні структури, спільні зі структурами тканин реципієнта, антигенність їх знижується.
Субстанції, подібні в хімічному відношенні до власних, слабкоантигенні або ж не антигенні зовсім.
Так, на ізоантигени імунна відповідь буває слабкою, за винятком антигенів гістосумісності.
Гемоглобін та інсулін різних видів тварин слабкоантигенні через подібність їхньої хімічної
структури. Речовини не антигенні для власного організму та інших особин інбредної лінії. Однак
таке твердження справедливе лише щодо речовин, які циркулюють у крові і контактують із
лімфоїдними клітинами. Казеїн, що синтезується в молочній залозі й у нормі не надходить у кров,
антигенний для того організму, в якому він синтезувався. Тому антитіла до казеїну виявляються в
сироватці крові жінок, які раптово припинили годувати дитину грудним молоком, що зумовило
надходження казеїну в кров. Речовини деяких тканин і органів, які за нормальних умов не
контактують з клітинами лімфоїдної системи (кришталик, щитоподібна залоза), у разі пошкодження
бар'єрних механізмів стають антигенними для власного організму, тобто є аутоантигенами. Однак у
нормі антитіла можуть синтезуватися проти власних «незабар'єрених» структур, наприклад проти
ідіотипічних детермінант молекул імуноґлобулінів.
Антигенні речовини можуть з'являтися в організмі при зміні нормальної структури власних
макромолекул під дією деяких фізичних факторів (холодові та опікові антигени), мікробних
токсинів та внаслідок вікових змін і мутацій. Навіть незначні зміни структури речовини можуть
трансформувати її в антиген для власного організму. Наприклад, ацетилювання сироваткового
альбуміну кроля перетворює його на антиген для цього виду тварин.
3.4. МАКРОМОЛЕКУЛЯРНІСТЬ.
Антигени — це, як правило, високомолекулярні речовини, молекулярна маса яких становить
десятки і сотні тисяч дальтон. Для речовин одного
класу між розмірами молекули та її антигенними
властивостями існує пряма залежність. Декстрани з
молекулярною масою менш як 100 000 не антигенні.
Так, декстран, який продукує Leuconostoc
mesenteroides, з молекулярною масою 70 000 не
виявляє мітогенної активності щодо клітин селезінки
сенсибілізованих мишей. Мітогенна дія декстранів
зростає прямо пропорційно логарифму їх
молекулярної маси.
Антигенні властивості притаманні білковим
речовинам з молекулярною масою, як правило,
вищою за 10 000, і з її збільшенням антигенність
білків підвищується. У прямій залежності від
молекулярної маси антигенної речовини перебуває її
валентність (табл. 15), однак ця закономірність не
абсолютна. Валентність антигену — це кількість
детермінант на молекулі антигену або, точніше,
кількість молекул антитіл, які можуть з нею
сполучатися. Антигенність речовин залежить від
складності їхніх молекул та кількості детермінантних груп. На тій самій молекулі одночасно може
бути велика кількість детермінант, а тому антигенність речовин залежить не лише від нижнього, а й
від верхнього рівня кількості детермінант. У разі перевищення оптимальної кількості детермінант,
приєднаних до молекули носія, антигенність кон'югованих антигенів зменшується.
Високозаміщені кон'югати, а також природні високомолекулярні антигенні речовини залежно від
дози можуть індукувати не лише імунну відповідь, а й толерантність. У мишей високополімерний
Vi-антиген у дозі 1 мкг індукує синтез антитіл, а в дозі 10 мкг — часткову толерантність. Полімерні
білки сироватки з осаду, що утворюється під час ультрацентрифугування, також мають значно
більшу антигенність, ніж їхні мономерні форми, які можуть впливати й толерогенно. Пептиди, що є
фрагментами високоантигенної речовини флагеліну, з молекулярними масами 4000 і менше взагалі
не стимулюють синтез антитіл.
На індукцію синтезу антитіл впливає також агрегатний стан антигенів: розчинні антигени
стимулюють менш інтенсивну імунну відповідь, ніж агреговані. Антигенність мономерних білків
підвищується при їх агрегації нагріванням, під дією глутаральдегіду та в разі їх ковалентного
сполучення хімічними містками. Гемоціанін, олігомерний білок крові молюсків, у слабколужному
середовищі розщеплюється на мономери, які мають ту саму специфічність, що й вихідна форма, але
значно меншу антигенність. Мономерний флагелін, що утворюється внаслідок дисоціації молекули
при низьких значеннях рН, менш антигенний порівняно з полімеризованим флагеліном. Однак ще
більш антигенні нативні джгутики, що складаються з великих полімерів флагеліну. Джгутики,
полімерний та мономерний флагеліни мають однакову специфічність, проте антигенність їх значно
зменшується зі зниженням полімерності молекул.
Пряма залежність між полімерністю молекул і антигенністю характерна як для білків, так і для
поліцукридів. Полімери D-глюкози, добуті з декстрану з молекулярною масою 200 000, більш
імуногенні для людини, ніж добуті з декстрану з молекулярною масою 51 300 або 90 700, хоча ті й
інші індукують синтез антитіл однакової специфічності. Антигенність різних фрагментів
зменшується пропорційно зниженню їхньої молекулярної маси. Відомо, що в препараті Vі-антигену
(суміш біополімерів з палички черевного тифу, яку застосовують для щеплень) виявлено
низькомолекулярний слабкоімуногенний антиген, що пригнічує активність високоімуногенної
фракції.
Незважаючи на те що антигенність, як правило,
залежить від молекулярної маси, відомі природні
й синтетичні антигенні полімери з молекулярною
масою 2000 — 4000. Гормон підшлункової залози
глюкагон з молекулярною масою 3500 і гормон
парієтальних клітин шлунка гастрин з
молекулярною масою 1800 при імунізації з
ад'ювантами індукують синтез антитіл. Гормон
підшлункової залози інсулін з молекулярною
масою 6000 при введенні з ад'ювантами набуває
антигенності. Однак без ад'юванту він практично
не антигенний і хворим на діабет вводять
тваринний інсулін упродовж багатьох років, як
правило, за повної відсутності імунних реакцій.
Антигенним є арсаніл-N-ацетил-L-(D)-тирозин з
молекулярною масою 450, тоді як деякі
високомолекулярні полімери антигенності не
мають (табл. 16).
Слід пам'ятати, що між молекулярною масою біополімерів та їхньою антигенною активністю існує
зв'язок. Однак встановити такий зв'язок можна, лише порівнюючи речовини одного класу,
наприклад різні білки з однотипною вторинною і третинною структурами, глобулярними чи
фібрилярними. Цей зв'язок не абсолютний і залежить від цілої низки інших властивостей антигену,
як біологічних, так і хімічних.
3.5. ЖОРСТКІСТЬ СТРУКТУРИ. ПОВЕРХНЕВІ УГРУПОВАННЯ.
Антигенність білків залежить від наявності в їхніх молекулах ароматичних амінокислот, що
визначають жорсткість структури, та від розміщення на поверхні молекули полярних груп.
Желатин — білок з високою молекулярною масою, має слабко виражені антигенні властивості. Це,
очевидно, пояснюється лабільністю внутрішньої структури молекули в зв'язку з її денатурацією при
нагріванні в процесі добування. До складу желатину входить значна кількість амінокислоти гліцину,
яка не має фіксованої жорсткої структури. Молекули з лабільною структурою здатні обертатися
навколо своєї осі і, очевидно, не можуть індукувати синтез антитіл, активний центр яких є
дзеркальним відображенням детермінантної групи антигену. Ймовірність такого припущення
підтверджується тим, що слабкоантигенний білок — желатин набуває більш виражених антигенних
властивостей при введенні до його складу амінокислот з жорсткою структурою — тирозину,
триптофану, фенілаланіну. Крім того, від вмісту тирозину, наприклад, залежить алергенна
активність білкових речовин різних штамів стафілокока.
Антигенність білків і пептидів визначається розміщеними на поверхні їхніх молекул
амінокислотами, шо утворюють антигенні детермінанти. Однак під дією протеолітичних ферментів
можуть відкриватися, тобто виявлятися на поверхні, і прикриті детермінанти. Обов'язковою умовою
наявності антигенних властивостей білків є доступність залишків амінокислот для рецепторів
імунокомпетентних клітин.
Численні дослідження антигенності синтетичних полімерів дають змогу зробити висновок, що
антигенність детермінантного угруповання залежить від наявності в його складі амінокислот з
жорсткою структурою за умови, що вони розміщені на поверхні молекули і доступні для клітин
мікрооточення, які беруть участь в імуннії відповіді.
Не всі угруповання макромолекул однаковою мірою відповідають за антигенні властивості. У
формуванні антигенних властивостей молекул важливу роль відіграють полярні групи.
Найактивнішими кінцевими угрупованнями є — СООН-, -ОН-, - SO
3
H-, - NH
2
-групи, які не беруть
участі у формуванні пептидного зв'язку в молекулі білка, не відіграють істотної ролі в антигенності,
оскільки вона мало змінюється при їх блокуванні.
Одним із факторів, що впливає на антигенність, є жорсткість структури, зумовлена
електростатичним взаємним притяганням позитивних зарядів залишків лізину і негативних зарядів
карбоксильних бічних груп залишків глутаміну.
Для прояву антигенності має значення не лише хімічний склад білків, а й їхній фізичний стан. Так,
білки антигенні лише в колоїдному стані.
3.6. ВПЛИВ ФІЗИЧНИХ І ХІМІЧНИХ ФАКТОРІВ НА АНТИГЕННІСТЬ.
Під дією різних фізичних і хімічних факторів змінюються властивості антигенів. Розщеплення
білкових молекул протеазами чи денатурація знижують або повністю змінюють антигенні
властивості білків. Білки повністю втрачають антигенність після тривалої обробки сильним лугом, а
такі ферменти, як рибонуклеаза, пепсин і папаїн, - після денатурації сечовиною. Втрачаючи нативну
конформацію, вони не реагують з імунними сироватками, специфічними до відповідних природних
молекул.
Антигенність білків змінюється під дією високої температури, хімічних реаґентів — спиртів,
ацетону, ефірів, солей важких металів, лугів і кислот унаслідок зміни нативної конформаційної
структури їхніх молекул. Так, луги, кислоти, спирти, ацетон зумовлюють денатурацію білка, під
якою розуміють зміни в структурі, що призводять до переходу білків у нерозчинний стан. Суть цих
змін полягає в тому, що в молекулі зберігаються лише пептидні зв'язки, тоді як інші втрачаються.
При цьому порушується природна конформація білкової молекули, що сформувалася завдяки
вторинній і третинній струтурі (мал. 26). Такі порушення призводять до зміни антигенності.
Антигенність денатурованих відрізняється від антигенності нативних білків. Антитіла до одного
денатурованого білка часто взаємодіють з іншим денатурованим білком навіть тоді, коли ці білки в
нативному стані не мають і антигенної спорідненості. При денатурації білків тварин різних видів,
зумовленій нагріванням, спостерігаються перехресні реакції. Це пояснюється тим, що під час
денатурації молекули білків набувають конформаційної подібності (конформація на зразок
хаотичного клубка), яка не залежить від їх первинної структури. Антисироватки до нативних білків
можуть не реагувати з денатурованими білками. Так, у людей, сенсибілізованих до яєчного білка,

18
реакція виникає на нативний, однак не виявляється на варений яєчний білок. Крім того,
антисироватки до денатурованих білків реагують, хоча й слабко, з нативними білками у зв'язку зі
збереженням у денатурованому препараті частини детермінант у незміненому стані.
У практиці широко використовують здатність фізичних і хімічних факторів знижувати токсичні
властивості розчинних мікробних антигенів і токсинів зі збереженням їхньої імуногенної
активності.
3.7. СПЕЦИФІЧНІСТЬ АНТИГЕНІВ.
Специфічність антигенів визначається структурними особливостями їхніх молекул. Під
специфічністю антигенів розуміють здатність їх індукувати виникнення сенсибілізованих
лімфоцитів і синтез антитіл, комплементарних до цього антигену, які активніше взаємодіють з цим
антигеном порівняно зі спорідненим.
У біополімерів, що мають подібний хімічний склад, спостерігаються перехресні серологічні реакції,
тоді як у білків та поліцукридів, що різняться за хімічним складом, спостерігаються серологічні
відмінності. Прикладом може бути серологічна різноманітність капсульних поліцукридів окремих
типів стрептокока, збудника пневмонії, яка визначається хімічними відмінностями між ними:
поліцукридний антиген стрептокока першого типу містить галактуронову кислоту, фруктозу і
глюкозу, другого типу — глюкуронову кислоту, рамнозу і глюкозу.
Специфічність антитіл спрямована проти невеликих хімічних угруповань молекули антигену —
детермінантних груп. Це було чітко продемонстровано на прикладі кон'югованих антигенів.
Антитіла, отримані до азопротеїну, в складі якого є азобензоларсенат, реагують із цим білком та
іншими білками, кон'югованими з азобензоларсенатом. Однак сам азобензоларсенат синтез антитіл
не індукує, він є гаптеном. К. Ландштейнер (1949) показав, що азобензоларсенат може гальмувати
реакції з антитілами проти азобензоларсенату, тоді як інші ароматичні аміни цю реакцію не
пригнічують. Навіть невеликі зміни поверхневих груп, такі як уведення в молекулу білка деяких
радикалів (хімічна модифікація молекул), наприклад нітрування, галогенування, етерифікація,
метилування, ацетилування, що зумовлює блокування поверхневих карбоксильних та інших груп на
поверхні білка, призводить до зміни антигенної специфічності. Хімічна модифікація бічних
амінокислотних залишків у молекулі білка призводить, як правило, до зміни конформації молекули,
а отже, до зміни деякої частини антигенних, так званих конформаційних, детермінант. Крім того, ще
в дослідах Ф. Обермейєра та Е. Піка (1905) було показано, що антитіла, отримані до білка, в
молекулу якого введено нітрогрупу, реагують із ним, але не реагують з нативним білком. Ці автори
також установили, що йодування білкових антигенів спричинює зміну видової специфічності.
Йодовані білки набувають здатності індукувати синтез антитіл, які взаємодіють з йодованими і
навіть бромованими білками інших видів тварин. Антигенними детермінантами таких білків є
йодовані залишки амінокислот (насамперед, тирозину та гістидину), що є спільними для білків
різних видів тварин.
Наявність внутрішньовидови і міжвидових відмінностей у хімічному складі окремих речовин,
тканин і органів зумовлюють існування видових, тканинних та органних антигенів.
Видова специфічність. Антигени, що виявляються лише у тварин одного виду, називають
видовими. Вони містяться в усіх тканинах і органах. Антигени з різко вираженою видовою
специфічністю містяться в сироватці крові, печінці, селезінці. Гемоглобини, протеолітичні
ферменти пепсин і трипсин, білки яєць і молока та деякі інші характеризуються видовою
специфічністю. М'язи, шкіра та головний мозок різних видів тварин менш диференційовані в
антигенному відношенні, оскільки вони побудовані з білків з відносно низькою антигенністю.
Видоваспецифічність виявляється в антигенних відмінностях навіть тих білків, що виконують
однакову функцію у різних видів. Ця специфічність зумовлюється ocoбливостями структури білків,
що виникли в процесі еволюції. Видова специфічність менш виражена серед білків організмів
таксономічно близьких видів.
Під час вивчення антигенності окремих білків сироватки крові було встановлено, що антисироватки
до однотипних білків двох різних видів, наприклад гаммаглобуліну або альбуміну, дають перехресні
реакції, тоді як антисироватки проти різних білків того самого виду прехресних реакцій не дають.
Отже, було з'ясовано, що функціонально однотипні біополімери різних видів мають антигенну
подібність і що різні білки однієї особини різняться за антигенністю.
Однотипні білки різних особин одного й того самого виду вищих тварин мають різну антигенність.
Ці відмінності називають алотиповими. Вони є генетично детермінованими і свідчать про
популяційний поліморфізм. Більшість білків мають видові ознаки, однак хімічний склад деяких з
них у процесі еволюції змінився мало (гемоґлобін) або практично не змінився (кристалін
кришталика).
Гетероспецифічність. Хімічна подібність структур та їхніх антигенних властивостей виявляється
іноді у віддалених видів, а отже, є випадковою. Так, паличка Фрідлендера типу В і пневмокок
другого типу, які не мають близької
філогенетичної спорідненості, дають
перехресні серологічні реакції. Антигени, які
мають однозначну антигенну специфічність і
виявляються у представників філогенетичне
віддалених видів, називають
гетерофільними. Спільні антигени часто
містять тканини тварин і мікробні клітини
(табл. 17). Антиген Форсмана, наприклад,
виявляється в еритроцитах барана, нирці
гвінейської свинки, деяких сальмонелах.
Органна специфічність. Органоспецифічні
антигени виявлено в легенях, печінці,
нирках, у щитоподібній та підшлунковій
залозах, нервовій тканині й кришталику ока.
Водночас ті самі органи різних видів тварин
мають антигени однакової специфічності.
Тому імунні сироватки до тканин одного
виду тварин реагують з тканинами того
самого органа інших видів. Антисироватки
до спиртових екстрактів мозку перехресно
реагують з екстрактами мозку навіть
філогенетично віддалених тварин та
екстрактами сім'яників, що, очевидно,
зумовлюється наявністю в мозку й
сім'яниках спільних ліпідних субстанцій.
Однак екстракти з органів містять переважно
видоспецифічні, а не реагуючі перехресно
органоспецифічні антигени.
Тканинна специфічність. Антигени, які
виявляються лише в одному виді тканини,
називають тканиноспецифічними. Наприклад, гаммаглобулін — специфічний антиген сироватки
крові, альбумін — специфічний антиген печінки. Однак обидва ці сильні антигени надходять у кров,
і тому їх можна виявити в клітинах різних тканин. Це ускладнює ідентифікацію специфічних
антигенів конкретної тканини, у зв'язку з чим перший тканиноспецифічний антиген було виявлено
лише на початку XX ст. в кришталику ока бика, в якому немає сироваткових антигенів.
Антисироватка кролів до кришталика реагує не лише з гомологічним антигеном кришталика ока
бика, а й з антигенами кришталика всіх хребетних, що дало змогу визнати цей антиген
тканиноспецифічним. У подальшому в кришталику було виявлено антигени двох видів:
філогенетичне старі, спільні для всіх видів, та сформовані на різних етапах еволюції, внаслідок чого
вони набули видоспецифічних ознак.
Диференціювальні антигени. У процесі
диференціювання на цитоплазматичній мембрані
клітин з'являються нові антигени. За допомогою
цих антигенів визначають напрям розвитку,
функціональну специфіку або ступінь зрілості
клітин. Отже, диференціювальні антигени є
специфічними маркерами. За такими антигенами
диференціюють, зокрема, субпопуляції
лімфоцитів (CD-маркери), наприклад TL-антиген,
що з'являється в кортикальних і зникає в більш
зрілих медулярних тимоцитах. Існують
стадіоспецифічні антигени — антигени, що
з'являються на певній стадії ембріонального
розвитку. Так, у людини альфа-фетопротеїн
синтезується в ембріональному періоді, а в
зрілому віці в нормі його немає або він
виявляється у незначній кількості. Його наявність
у крові свідчить про розвиток певних видів
пухлин в організмі.
3.8. ДЕТЕРМІНАНТИ СПЕЦИФІЧНОСТІ.
Специфічність антигену — це здатність вибірково
реагувати з індукованими певним антигеном
антитілами або сенсибілізованими лімфоцитами.
Вона визначається активною хімічною групою,
яку називають детермінантою специфічності, або антигенною детермінантою (мал. 27, 28).
Антигенні детермінанти — це ділянки молекули
біополімеру (антигену), які розпізнаються
рецепторною зоною антитіла (його активним
центром) або імунокомпетентних клітин і
зв'язуються з нею. їх ще називають епітопами.
З однією молекулою антигену одночасно може
сполучатися кілька молекул антитіл. Кількість
детермінантних груп на молекулі антигену може
перевищувати кількість молекул антитіл, здатних
з'єднатися з молекулою антигену. Частина
епітопів може виявитися заблокованими
молекулами антитіл унаслідок стеричних
причин, оскільки розміри молекул антитіл
перевищують відстань між детермінантними
групами антигену. Результати вивчення
валентності синтетичних антигенів свідчать, що
білкова молекула має в середньому 5 – 15
детермінантних груп, однак їх кількість може
досягати кількох сотень. У деяких природних
білкових молекулах одна детермінанта припадає
в середньому на поліпептид з молекулярною
масою 5000.
Кількість епітопів у молекулі антигену залежить
від багатьох причин. Якщо в молекулі
біополімеру існує тільки одна детермінантна
група певної будови, то утворення антитіл проти
такої детермінанти не відбувається. Зі
збільшенням у молекулі антигену числа
ідентичних детермінантних груп (епітопна
щільність) імунна відповідь на неї зростає до
певної межі, за якою починає знижуватися.
Зниження імунної відповіді на антигени з
високою епітопною щільністю пов'язане з
механізмами активації В-лімфоцитів.
Різні антигенні детермінанти білкових і поліцукридних антигенів мають неоднакове значення в
індукуванні імунної відповіді та в реакції антиген —антитіло. Ті детермінанти, до яких найбільшою
мірою утворюються і з якими найчастіше зв'язуються молекули антитіл та рецептори
імунокомпетентних клітин, називають імунодомінантними. Як правило, вони локалізовані
поверхнево і розміщені на кінцях амінокислотних та поліцукридних ланцюгів.
Білкові детермінанти. Антигенні детермінанти білків утворені комбінаціями амінокислотних
залишків, що створюють певну просторову конфігурацію. Вони утворені кількома амінокислотними
залишками у певному поєднанні і на певній відстані один від одного. Відповідно тип детермінанти
визначається послідовністю амінокислот у поліпептидному ланцюзі, а також вторинною й
третинною структурою молекули білка.
У молекулі білка вірусу тютюнової мозаїки, що складається із 158 залишків амінокислот, одна
антигенна детермінанта визначається в послідовності 93-112. Не всі амінокислоти однаково
впливають на формування цієї детермінанти. Якщо видалити 12 амінокислотних залишків з N-кінця,
то детермінанта зберігається, але якщо видалити навіть 3 залишки з С-кінця, — вона втрачається.
У молекулах білків антигенні детермінанти можуть розміщуватися як на кінцях, так і всередині
поліпептидного ланцюга. Розподіл епітопів уздовж білкової молекули може бути нерівномірним.
Так, усі три антигенні детермінанти молекули флагеліну зосереджені на одному з чотирьох його
фрагментів, що утворюються при розщепленні бромціаном і мають молекулярну масу 17 000
кожний. Цей фрагмент, на відміну від інших, є відносно резистентним до дії протеолітичних
ферментів. Це підтверджує той факт, що стійкість до протеолізу є фактором, який сприяє прояву
антигенних властивостей біополімерів.
На глобулі білкової молекули епітопи розміщені поверхнево. У глобулярних білках з великим
вмістом альфа-спіральних ділянок антигенні ділянки розміщені в місцях згинів скрученого в спіраль
ланцюга. Ділянки бічних ланцюгів білкових молекул, що виступають за межі компактної структури,
зазвичай містять велику кількість епітопів. У ділянках вгинання ланцюга епітопів мало, оскільки в
них міститься багато молекул води, що ускладнює зв'язок з рецепторами.
В одній молекулі білка можуть міститися детермінанти різної специфічності. Наприклад, у молекулі
БСА міститься 5 різних детермінант, розміщених усередині молекули. П'ять різних антигенних
детермінант, розміщених поверхнево, виявлено в молекулі білка вірусу тютюнової мозаїки. Вони
визначаються послідовностями амінокислот: 1 — 41, 62 — 68, 93 — 112, 135 — 141, 142 — 158.
Декапептид вірусу тютюнової мозаїки ( — Тре — Тре — Ала — Ала — Глу — Лей —Асп —Ала —
Тре —Apг —) у деяких кролів індукує синтез антитіл трьох специфічностей: до С-кінцевої, N-
кінцевої ділянок та до С-кінцевого фрагмента, від якого відщеплено Apг. Якщо молекула антигену
має дві і більше неоднотипні антигенні детермінанти, то одні з них можуть зумовлювати імунітет,
інші — толерантність або сенсибілізацію.
Для ідентифікації антигенних детермінант білків використовують методи обмеженого протеолізу
білкових молекул та дослідження антигенних властивостей фрагментів, що утворилися, а також
хімічної модифікації молекул та їх часткової денатурації з втратою вторинної й третинної структур
нативної молекули. Такі дослідження, як правило, потребують використання наборів антисироваток,
одержаних від різних тварин та в різні терміни імунізації. Сукупність цих підходів та використання
рентгеноструктурного аналізу, комп'ютерного моделювання дають змогу ідентифікувати епітопи
білкових антигенів.
Поліцукридні детермінанти. Імунна специфічність поліцукридних антигенів визначається складом
моноцукридів та типом зв'язку між ними в складі молекули. Детермінантами специфічності в
поліцукридних антигенах можуть бути моно-, ди- і трицукриди або олігоцукриди, що складаються з
5 —6 моноцукридів. Так, специфічність декстранів визначається типом зв'язку між молекулами
глюкози. Наприклад, декстрани альфа-1,6-, альфа-1,4- і альфа-1,3- різняться між собою
серологічною специфічністю.
О. Ейвері та У. Гебел (1936) дослідили, що імунна специфічність дицукридів зумовлюється загалом
структурою молекули, просторовою конфігурацією, хімічною будовою, наявністю кінцевої гексози і
положенням зв'язку між двома моноцукридами. Молекули капсульного поліцукриду стрептокока
пневмонії III типу включають 180 залишків целобіуронової кислоти. Детермінантні групи в цьому
поліцукриді складаються з 2 — 6 залишків целобіуронової кислоти. Цей олігоцукрид досить
інтенсивно пригнічує реакцію антитіл проти капсульного поліцукриду стрептокока пневмонії III.
Целобіуронова кислота входить також до складу поліцукриду VII типу, у зв'язку з чим між
стрептококами пневмонії III і VII типів відбуваються перехресні серологічні реакції.
Відмінності в хімічній будові капсул та в їх антигенності часто характерні для окремих штамів
бактерій. Це, можливо, свідчить про те, що різноманітність серологічних варіантів (сероварів)
патогенних бактерій виникає як наслідок біологічного тиску, що здійснюється через гуморальний
імунітет.
Розміри детермінант. Детермінанти білкових антигенів включають від 7 до 15 (в середньому 8 —
10) залишків амінокислот. Розміри білкової антигенної детермінанти становлять у середньому 1,5 —
4 нм (табл. 18).
Детермінанта поліцукридних антигенів складається з 3 — 6 залишків моноцукридів (олігоцукридна
антигенна детермінанта). Розмір антигенної детермінанти декстрану (як і інших антигенів)
визначається в реакції гальмування преципітації декстрану олігоцукридами, до складу яких входить
різна кількість моноцукридів. Оскільки гальмування реакції зумовлюється глюкозою, це свідчить
про те, що цей моноцукрид може сполучатися з рецепторною групою антитіл. Максимальну
зв'язувальну активність виявляє гексацукрид. Це найбільший з олігоцукридів, здатний вміститися в
порожнині активного центру антидекстранових антитіл. Розрахунки свідчать, що розміри такої
порожнини становлять приблизно 4 нм
3
. У деяких випадках антигенна детермінанта не повністю
заповнює порожнину активного центру.
Чим більші за розмірами детермінанти, тим ефективніші вони в індукції імунної відповіді та в
реакціях антиген —антитіло, оскільки можуть утворювати міцніші зв'язки в активному центрі
антитіл та антигензв'язувальних рецепторах лімфоцитів. Велике значення для індукції імунної
відповіді та прояву серологічної активності антигенів має відстань між окремими детермінантними
групами в їхніх молекулах. Зв'язування антигену з антитілами можливе за певної щільності
детермінант, яка має бути достатньо високою. Мінімальна відстань між детермінантами, що дає
змогу сполучатися з антитілами, має становити 9,2—10,2 нм. Встановлено, що синтетичний
антиген, у якому кінцевими детермінантами є L-тирозин-азобензоларсонат, індукує імунну
відповідь при відстані між детермінантами не менш як 3,1 — 3,2 нм і за наявності в складі його
молекули певної кількості залишків проліну, який зумовлює достатню ригідність ланцюга, а отже, і
стійкість конформації молекули.
3.9. ПОСЛІДОВНІ Й КОНФОРМАЦІЙНІ АНТИГЕННІ ДЕТЕРМІНАНТИ.
Розрізняють секвенційні і конформаційні антигенні детермінанти. Антигенні детермінанти,
специфічність яких визначається послідовністю амінокислот або моноцукридів у поліпетидному чи
поліцукридному ланцюзі, називають секвенційними. Кінцева детермінанта може мати
імунодомінантну групу — амінокислоту або моноцукрид, що визначає серологічну специфічність
антигену. Наприклад, у пептидоглікану — основного структурного компонента клітинної стінки
грампозитивних бактерій — серологічна активність визначається кінцевим олігопептидом —
пентагліцином. Однак імунодомінантність більш характерна для поліцукридних антигенів, зокрема
детермінант у складі О-антигену (молекули ЛПЦ) грамнегативних бактерій. Представники цієї
групи бактерій характеризуються наявністю імунодомінантного дидезоксицукриду: абеквози,
тивелози (у S. typhi), паратози (у S. раrаtyphi), колітози (у Е. соlі).
Антигенні детермінанти, структура яких лежить від просторової конформації поліпетидного або
поліцукридного ланцюга, називають конформаційними. Конформаційні детермінанти — це
структури, які утворюються під час просторового складання молекул. Конформаційні детермінанти
білків утворюються амінокислотами, які віддалені в пептидному ланцюзі, але зближуються і
розміщуються на поверхні молекули в результаті утворення вторинної та третинної структури або ж
при згортанні ланцюга в глобулу. Конформаційні детермінанти можуть утворюватися залишками
амінокислот двох різних ланцюгів молекули білка з четвертинною структурою. Послідовні
антигенні детермінанти реагують з антитілами проти тих самих послідовностей в тих самих чи
інших молекулах або проти подібних послідовностей. Антитіла до конформаційних детермінант не
реагують з молекулами, що мають подібну амінокислотну послідовність, але іншу конформацію.
Так, антитіла до ділянки молекули нативного лізоциму, утвореної амінокислотними залишками з 64-
го по 80-й і замкненої дисульфідними зв'язками в петлю, реагують з ізольованими петлями та з
цілою молекулою лізоциму. Проте вони не реагують з тими самими ділянками петлі після
руйнування дисульфідного зв'язку та зміни її конформації внаслідок редукції й алкілування (мал.
29).
Існування конформаційних антигенних детермінант доведено після проведення досліджень із
синтетичними поліпептидами.

19
У молекулі міоглобіну є п'ять детермінант,
розміщених у ділянках згинів поліпептидного
ланцюга та С-кінцевій його ділянці. Вони
утворені амінокислотними залишками, що
знаходяться в послідовностях 16-23, 56-63, 94-100,
112-120, 146—153 та індукують синтез 5 різних за
специфічністю типів антитіл (мал. 30, табл. 19).
Конформаційні детермінанти можуть
формуватися лише за умови, що ця послідовність
у поліпептиді має певну довжину, яка забезпечує
утворення третинної структури. Якщо зруйнувати
ковалентні зв'язки, що стабілізують вторинну й
третинну структури, або відновити
внутрішньоланцюгові дисульфідні зв'язки, то в
молекулі рибонуклеази також відбувається втрата
цих антигенних детермінант, оскільки
денатурована рибонуклеаза не реагує з антитілами
проти нативної рибонуклеази. Деякі антигенні
детермінанти зникають у гемоглобіні, колагені,
імуноґлобуліні класу G під час дисоціації їхніх
молекул на окремі поліпептидні ланцюги.
Антигенні структури денатурованих білків
відновлюються при відновленні нативної їх конформації. Отже, антигенність білків зумовлюється
як первинною структурою, так і їх конформацією, що утворюється внаслідок просторового
згортання молекули. Антигенні детермінанти білків є
переважно конформаційними.
З конформацією молекули пов'язана серологічна
специфічність поліцукридів. У гетерополімерних
поліцукридах (наприклад, в О-поліцукридах
грамнегативних бактерій) другий в олігоцукридному
ланцюзі моноцукрид може визначати конформацію
кінцевого імунодомінантного дидезоксицукриду,
впливаючи тим самим на специфічність олігоцукридної
детермінанти. Роль загальної конформації молекули
особливо виражена у визначенні специфічності
олігоцукридних детермінант гомополімерних
поліцукридів, наприклад декстранів, які локалізовані в
коротких відгалужених ланцюжках і відрізняються
типом зв'язку між моноцукридними залишками від
основного ланцюга полімеру.
Імунна специфічність антигенів змінюється зі зміною
їхнього хімічного складу та будови. Так, досить
замінити одну-дві амінокислоти в складі
поліпептидного ланцюга молекули білка або кінцеві
амінокислоти, і такі молекули відрізнятимуться в
антигенному відношенні. Інсулін вівці відрізняється від
інсуліну коня, свині й бика лише однією амінокислотою, однак у деяких випадках він зумовлює
індукцію слабкої імунної відповіді у цих тварин.
У разі зміни амінокислотних залишків, введення нової і заміни навіть однієї групи в радикалі
специфічність молекули зникає або з'являється нова специфічність. Антитіла, що утворюються до
білка, модифікованого хімічно, реагують з ним інтенсивніше, ніж з нативним, або взагалі не
реагують з останнім. В усіх випадках зміни імунологічної специфічності модифікованих білків є
наслідком змін їхніх антигенних детермінант. Значення детермінантних груп для визначення
імунної специфічності антигенів було доведено К. Ландштейнером під час вивчення кон'югованих
антигенів.
3.10. КОН'ЮГОВАНІ АНТИГЕНИ.
Розвиток імунології як біологічної дисципліни бере початок від досліджень К. Ландштейнера, що
відкрив групи крові, резус-фактор і розробив метод одержання кон'югованих антигенів, тобто
модифікованих тими чи іншими хімічними групами природних високомолекулярних сполук. Із
використанням цього методу було закладено теоретичні й методичні основи імунохімії — розділу
імунології, що досліджує хімічну, біохімічну та молекулярно-біологічну природу реакцій імунітету.
Поряд із першою теорією імунітету — теорією утворення антитіл, сформульованою відомим
хіміком П. Ерліхом (1903), та першими спробами створення штучних антигенів на основі хімічно
модифікованих білків Е. Піка (1906) дослідження кон'югованих антигенів дало можливість вивчити
імунну відповідь на низькомолекулярні речовини, встановити молекулярні основи антигенності
біополімерів, оцінити надзвичайно широку «інформаційну ємність» імунної системи, з'ясувати роль
детермінантних груп та встановити специфічність активних центрів антитіл (їхні розміри, характер
зв'язків антиген — антитіло). Це сприяло переходу імунології з науки описової в категорію точних
наук. Використовуючи метод кон'югованих антигенів, К. Ландштейнер показав, що імунну
відповідь індукує не складна білкова молекула в цілому, а окремі її угруповання або прості хімічні
групи, кон'юговані з білком. К. Ландштейнер уперше запропонував метод гальмування серологічних
реакцій простими хімічними сполуками, що полегшило вивчення серологічної специфічності таких
сполук, оскільки їх можна було досліджувати без кон'югації з білками.
Приєднання гаптенів. Приєднання до білка за допомогою хімічних зв'язків гаптенових груп та
введення в молекулу білка простих хімічних груп змінює їхні антигенні властивості:
Попередня специфічність при цьому
змінюється або зникає. Введена хімічна
група надає білку нової специфічності. При
цьому кон'юговані антигени індукують
синтез антитіл, здатних реагувати з
введеними хімічними групами, які є
детермінантами специфічності.
К. Ландштейнер уперше розпочав
дослідження хімічних основ специфічності
на штучних антигенних кон'югатах. Він
уперше показав, що антитіла проти
кон'югованого гаптену реагують з ним,
якщо він кон'югований також з іншим
білком. При імунізації тварин гаптеном —
діазобензолсульфоновою кислотою,
кон'югованою з БСА, синтезуються антитіла
як до гаптену, так і до носія. Виявити
антитіла до діазобензолсульфонової кислоти
можна за реакцією преципітації з тест-
антигеном, яким у цьому випадку може бути
кон'югат діазобензолсульфонової кислоти з
яєчним альбуміном.
Для кон'югації антигенів як макромоле-
кулярні носії можна використовувати білки,
синтетичні поліпептиди, глікопротеїни,
поліцукриди. У складі білків міститься
велика кількість функціонально активних
груп, до яких можуть ковалентне
приєднуватися гаптени. Це сульфгідрильні
групи цистеїну, карбоксильні групи
аспарагінової й глутамінової амінокислот,
залишки фенолу в тирозині, бензолу у
фенілаланіні, імідазолу в гістидині, вільна та
С-кінцева аміногрупи в лізині. Гаптени
зв'язуються з носіями через аміно- і
гідроксильні групи амінокислот та через
залишки ароматичних амінокислот, що є
реакційноактивними групами.
Оскільки в низькомолекулярних сполуках,
як правило, немає функціональних груп, що зв'язуються з білком, то їх вводять хімічним шляхом,
перетворюючи низькомолекулярні сполуки на високореакційні похідні, які набувають здатності
утворювати ковалентний зв'язок із залишком амінокислоти в молекулі білка. Такими сполуками є
ангідриди, азиди, імідоефіри, ізоціанати та ізотіоціанати, солі діазонію, альдегіди, кетони.
Використовуючи кон'юговані антигени, К. Ландштейнер виявив, що антигенність визначається
специфікою фізико-хімічної структури молекули. Було доведено, що специфічні антитіла здатні
розрізняти бензольне кільце, яке містить (або не містить) кислотне угруповання, а також бензольні
кільця з різними кислотними групами (табл. 20, 21).
Положення і стереохімічні ознаки детермінанти. Антигенність речовин змінюється зі зміною
просторового розміщення поверхневих груп. Специфічність антитіл виявляється щодо положення
кислотної групи в кільці: сироватка, отримана до гаптену, який містить карбоксильну групу в мета-
положенні, не реагує або слабко реагує з гаптеном, що містить ту саму групу в пара-положенні
(табл. 22).
Антигенна специфічність залежить також від стереохімічних ознак і змінюється зі зміною
просторового розміщення детермінанти щодо атома карбону: право- і лівоположення, альфа- і бета-
ланцюги глікозидів, положення груп -Н і -ОН після інверсії. Так, між азопротеїнами з різними
угрупованнями в тому самому положенні
відбуваються перехресні серологічні реакції, тоді
як між азопротеїнами з тим самим лігандом, але в
різному положенні, перехресних реакцій не
відбувається. Однак між амінофенол-бета-
глікозидом і амінофенол-бета-галактозидом
перехресних реакцій не відбувається, хоча їхні
антигенні детермінанти різняться лише
розміщенням — Н- і — ОН- груп біля четвертого
атома карбону. Отже, положення груп, що
заміщуються в ароматичному кільці, має більше
значення для прояву антигенності, ніж їхня хімічна
природа.
Дослідження кон'югованих антигенів показали, що
роль антигенних детермінант виконують
хіміоспецифічні групи азобілків і що серологічна
специфічність значною мірою визначається
ізомерною формою та жорсткістю детермінантних
груп. При цьому антитіла зв'язуються не з усією
молекулою антигену, а лише з її невеликою
частиною, що розміщена на поверхні і виконує
роль антигенної детермінанти.
Дві різні детермінанти, приєднані до того самого
носія, індукують синтез антитіл різної
специфічності, тобто макромолекулярний антиген
може мати кілька різних детермінант.
Кінцеві угруповання в детермінанті.
Використовуючи азопротеїни, синтезовані з
дипептидів, було доведено, що антигенна
специфічність залежить від того, яка амінокислота
знаходиться на кінці пептидного ланцюга. Однак на
антигенну специфічність може впливати й
передостання амінокислота пептиду.
Важливі як у теоретичному, так і в практичному плані
дані отримано під час вивчення імунної відповіді на
модифіковані антигени, наприклад флагеліни.
Показано, що модифікація антигену істотно змінює
його здатність індукувати імунну відповідь (табл. 23).
Еритроцити барана, ацетоацетильовані й окиснені
перйодатом, втрачають здатність індукувати реакції
клітинного імунітету. Після обробки тим самим
методом клітин асцитної пухлини Еріха підвищується
здатність їх індукувати протипухлинний імунітет і
гальмувати ріст пухлини. Сироваткові білки,
кон'юговані з етоксіетиленфенілазалоном, втрачають
здатність стимулювати синтез антитіл при збереженні
здатності індукувати реакції клітинного імунітету. Цей
напрям досліджень залишається перспективним для
пошуку шляхів підсилення протипухлинного
імунітету.
Носій. У структурному відношенні кон'югований
антиген складається з двох частин:
високомолекулярного носія і низькомолекулярного
детермінантного угруповання. Носієм є білок або
поліцукриди, а детермінантами специфічності — різні
прості угруповання: радикали кислот, олігопептиди,
олігоцукриди та ін. Антиген з невідокремлюваною
від носія детермінантою називають
однокомпонентним, а з відокремлюваною —
двокомпонентним (мал. 31).
Сироватка, отримана імунізацією гаптеном у
комбінації з носієм, реагує з тим самим комплексним
антигеном, а також з гаптеном, відокремленим від
носія, та з гаптеном, зв'язаним з іншим носієм. Однак
в індукції імунної відповіді має значення як
антигенна детермінанта, так і носій, що пов'язано з
участю в індукції клітин, які реагують на носій.
Вільний гаптен блокує вторинну стимуляцію
лімфоїдних клітин гаптен-білковим кон'югатом. В
експерименті на опромінених мишах при перенесенні
імунної пам'яті лімфоцитами сингенних тварин
вторинна стимуляція кон'югатом гаптену з
гетерологічним носієм імунної відповіді не викликає.
У разі імунізації антигеном в ад'юванті також формується ГСТ зі специфічністю до комплексу
гаптен —носій, а не до гаптену, оскільки гаптен у поєднанні з іншими носіями не викликає
вторинну імунну відповідь.
Роль носія не обмежується здатністю індукувати імунну
відповідь до гаптену. Носій бере також участь у реакціях
антиген —антитіло. Доказом цього є необхідність
збільшення дози гаптену в 1000 – 10 000 разів для
виявлення імунних реакцій in vitro при кон'югації того
самого гаптену, але з іншим носієм. Для пригнічення
серологічної реакції потрібна відносно велика кількість
гаптену, оскільки конформація структури детермінанти в
гаптені перебуває, очевидно, в менш активному
стереохімічному положенні, ніж при зв'язуванні з носієм.
Гаптени можуть мати кілька варіантів стереохімічних
положень, однак з носієм вони зв'язуються в одному з цих
варіантів, тобто відбувається відбір просторових структур
носієм.
Роль носія, очевидно, полягає в тому, що він стабілізує
стереохімічну структуру детермінанти в положенні,
найвигіднішому для зв'язування з рецепторною зоною
антитіл.
Для виконання своїх функцій носій повинен мати певні мінімальні розміри, тобто скаладатися з
певної кількості мономерів (амінокислот чи моноцукридів). Так, носій, що складався з 12
амінокислот, забезпечував стимуляцію В-клітин, синтез антитіл і переключення синтезу IgM на IgG,
тоді як носій, до складу якого входило тільки 9 амінокислот, індукував лише клітинну проліферацію
без диференціювання. Ефективність імуногенної дії визначається молекулярною масою носія,
щільністю епітопів на його молекулі та міцністю зв'язку епітопів з носієм.
Підвищення як імуногенної, так і толерогенної дії кон'югатів спостерігається зі збільшенням
кількості гаптенів на одну молекулу-носій. Однак надлишок детермінант зумовлює зниження
імуногенності. У разі дуже високої епітопної щільності з кон'югованими гаптенами діє вже не
імуногенно, а толерогенно.
По суті, поняття гаптену і носія умовне, оскільки та сама структура в багатьох випадках може бути
як гаптеном, так і носієм. До комплексу поліглутамінова кислота—полілізин утворюються антитіла
двох специфічностей: до поліглутамінової кислоти та полілізину. Отже, обидва гомополімери
можуть бути і в ролі носіїв, і в ролі гаптенів.
Слід зазначити, що дані про роль носія крім теоретичного мають ще й велике практичне значення.
Вони відкривають нові можливості для досліджень, наприклад, спрямованих на отримання
детермінант специфічності інфекційних антигенів і на добір оптимальних носіїв при конструюванні
нових вакцин, при розробці нових імунодіагностичних препаратів для виявлення
низькомолекулярних сполук тощо.
3.11. АНТИГЕННІСТЬ СИНТЕТИЧНИХ ПОЛІАМІНОКИСЛОТ.
Полімери і співполімери. Синтетичні полімери отримують співполімеризацією N-карбоксил-L-
ангідридів амінокислот або співполімеризацією олігопептидів. У першому випадку утворюються
послідовні, в другому — конформаційні антигени. Синтетичні полімери в дуже малих дозах в
ад'юванті Фрейнда антигенні для мишей, щурів, гвінейських свинок, мавп і людини.
Гомополімери, лінійні синтетичні співполімери з випадковою послідовністю амінокислот, гаптени,
приєднані до гомополімерного основного ланцюга (наприклад, динітрофенілполілізин,
тринітрофенілполілізин), і розгалужені співполімери широко використовують в імунологічних
дослідженнях.
Гомополімери не антигенні через відсутність у них стійкої просторової структури (табл. 24).
Синтетичні монополіпептиди не антигенні, але політирозин набуває антигенності після сполучення
з діазотованою арсеніловою кислотою. Прояв властивостей гаптену гомополімерами залежить від
кількості залишків амінокислот у поліпептидному ланцюзі. Преципітацію гомополімерів полі-L-
лізину та полі-L-аланіну гомологічними антитілами інтенсивніше гальмують олігомери, що мають
більшу довжину ланцюга. Максимальну ефективність гальмування виявляють пента- і гексамери.
Розміри пентааланінового ланцюга становлять приблизно 2,3х1,1х0,65 нм. Такі самі розміри
повинна мати й антигенна детермінанта пентааланіну.

20
На відміну від гомополімерів співполімери характеризуються антигенністю. Деякі синтетичні
полімери, до складу яких входять дві амінокислоти, антигенні для кроля, гвінейської свинки, але не
для людини й миші. Полімери з трьох амінокислот антигенні для всіх перелічених видів.
Співполімеру глутамінової кислоти й лізину властива слабка антигенність. Вона різко зростає при
введенні до складу цього співполімеру 2 % тирозину та при імунізації тварин цим співполімером з
ад'ювантом.
Значний внесок у дослідження антигенності синтетичних полімерів зробили М. Села та його
співробітники (1966 — 1970). Під час дослідження синтетичних поліпептидів та інших аналогів
природних антигенів ними було вивчено основні закономірності генетичного контролю
антитілогенезу, ГСТ та відкрито перші гени контролю імунної відповіді.
У процесі полімеризації гетерополімерів можуть формуватися як послідовні, так і конформаційні
антигенні детермінанти. Послідовні детермінанти містяться в розгалужених синтетичних
поліпептидах, у яких носієм є співполімер лізину та аланіну, а бічні ланцюги складаються з
трипептиду Тир-Ала-Глу. При імунізації кролів цим поліпептидом синтезуються антитіла до бічних
ланцюжків трипептиду. Якщо з трипептидів Тир-Ала-Глу, що повторюються, синтезувати довгий
ланцюг (ТАГ)n, який здатний утворювати альфа-спіраль, то детермінанти в ньому є
конформаційними і в разі імунізації таким поліпептидом синтезуються антитіла до ланцюжків, що
складаються з кількох блоків (ТАГ). Ці антитіла не реагують із секвенціальними детермінантами,
утвореними бічними трипептидами ТАГ, що свідчить про вплив спіральної структури на
формування антигенних детермінант. У молекулі міоглобіну виявлено п'ять коротких не кінцевих
пептидів, що характеризують антигенність, тобто детермінанти не обов'язково мають кінцеве
положення. Детермінанти є конформаційними, коли їх специфічність визначається вторинною або
третинною структурою.
Вивчення антигенності синтетичних поліамінокислот дало змогу поглибити дані К. Ландштейнера,
отримані в дослідах з кон'югованими антигенами. Було встановлено нові закономірності, важливі
для розуміння процесів формування антигенності білків: відсутність антигенності в гомополімерів,
роль гетерогенності складу співполімерів у встановленні антигенності, здатність гомополімерів
функціонувати як гаптен або як носій, здатність гетерополімерів формувати як послідовні, так і
конформаційні детермінанти.
Важливим завданням прикладного характеру є використання синтетичних аналогів природних
біополімерів з клітин збудників хвороб людини й тварин з метою їх використання для створення
нових діагностичних препаратів та синтетичних вакцин. У зв'язку з цим в останні роки проводяться
інтенсивні дослідження, спрямовані на вивчення фізико-хімічної структури природних антигенів і
хімічний синтез їх аналогів або отримання рекомбінантних білків метедами генної інженерії.
3.12. ЛОКАЛІЗАЦІЯ І ЗМІНИ АНТИГЕНІВ У ТКАНИНАХ.
Проникнення антигенів в організм.
Віруси, бактерії, гриби, найпростіші мають змогу долати фактори природного захисту
макроорганізмів. У процесі еволюції у вищих тварин виник специфічний імунітет, що забезпечує
захист проти будь-якого виду мікроорганізмів. Цей механізм ґрунтується на принципі
комплементарності макромолекулярних біополімерів мікробів і макроорганізму, які взаємодіють,
забезпечуючи продукцію специфічних захисних субстанцій проти сотень тисяч, а, можливо, й
мільйонів чужорідних структур.
Чужорідні субстанції виявляють свої антигенні властивості, як правило, при потраплянні в організм
парентеральним шляхом, оскільки речовина зберігає специфічну чужорідну хімічну структуру лише
тоді, коли вона не зазнає ферментативного руйнування. Надходячи в організм через рот, білки та
поліцукриди зазвичай розщеплюються пепсином, трипсином, амілазою та іншими ферментами
порожнини рота і травного каналу до простих, не антигенних сполук. Однак антигенні властивості
можуть зберігатися за умови швидкого всмоктування речовини до її розщеплення травними
ферментами.
Крізь слизові оболонки травного каналу і верхніх дихальних шляхів у кров проникають бактерії та
інші види мікроорганізмів. У внутрішнє середовище організму мікроби потрапляють, проникаючи в
міжклітинники самостійно, разом із фагоцитами, що їх поглинули, крізь пошкоджений епітелій і
ходи в епітелії. В експериментах на гвінейських свинках показано, що мікробні клітини живого
вакцинного штаму бацили чуми через кілька годин після пероральної імунізації виявляються у
власному шарі слизової оболонки травного каналу, а через чотири — в регіонарних лімфатичних
вузлах. Проникність слизових оболонок для мікробів залежить від фізіологічного стану
макроорганізму і біологічної активності певного виду або штаму мікробів. Крізь слизову оболонку
кишок у деяких випадках у кров можуть також всмоктуватись, не втрачаючи антигенних
властивостей, білки й поліцукриди рослинного походження.
Антигени проникають у клітини завдяки фаго- або піноцитозу ретикулярними клітинами,
макрофагами.
Персистенція антигенів. Застосування специфічних антитіл, пофарбованих флуоресцентними
барвниками, та антитіл, мічених радіоактивними мітками або феритином з наступною
люмінесцентною та електронною мікроскопією і ауторадіографією, дає змогу зробити висновок про
наявність у клітинах і тканинах антигенів. Білкові антигени, кількість яких поступово зменшується,
зберігаються в крові протягом 2 — 3 тижнів, а в тканинах внутрішніх органів — від кількох місяців
до двох років. За допомогою зазначених методів установлено, що введений в організм антиген
зазнає різних змін. Через 5 місяців після ін'єкції кролям міченого
135
І бичачого сироваткового
альбуміну в сироватці крові виявлялось п'ять молекулярних форм альбуміну: 1) інтактний з
характерною специфічною електрорухливістю; 2) відмінний від інтактного за електрофоретичною
рухливістю; 3) інтактний у комплексі з імуноґлобуліном; 4) фраґментований з низькою
молекулярною масою; 5) фраґментований у поєднанні з РНК або олігорибонуклеотидами. Можливо,
всі ці форми альбуміну виявляють свої антигенні властивості на різних етапах проходження через
систему фагоцитарних та імунокомпетентних клітин.
Збереження антигену в організмі залежить від його молекулярної маси, характеру діючих на нього
ферментів, стану макроорганізму. Персистенція антигенів протягом тривалого часу, можливо,
зумовлена зв'язуванням їх у тканинах з речовинами, період напіврозпаду яких становить кількасот
діб. Такою речовиною може бути колаген сполучної тканини. Наприклад, капсульний поліцукрид
стрептокока пневмонії тривалий час зберігається в тканинах експериментальних тварин через
відсутність у тканинах ферментів, що його розщеплюють. У зв'язку з цим імунна відповідь на
поліцукрид не формується і він виявляє толерогенний вплив. При введенні тваринам бактеріального
ферменту, який розщеплює поліцукриди, на нього спостерігається імунна відповідь.
Розчинні білки не поглинаються макрофагами, внаслідок чого вони циркулюють У крові до появи
індукованих ними антитіл. Після появи антитіл між комплексами антиген — антитіло, що
утворилися, відбувається фагоцитоз, внаслідок чого досягається елімінація розчинних білків. В
імунізованому організмі завдяки дії специфічних антитіл антиген швидко руйнується і виводиться.
Мічений радіоактивними мітками білковий антиген і антитіла видаляються повільніше, ніж
комплекс антиген —антитіло.
Локалізація. Розподіл антигену в організмі залежить від місця чи способу його введення. При
внутрішньовенному введенні антиген спочатку потрапляє в легені, де частина його затримується.
Потім з течією крові антиген надходить у серце і розноситься по всьому організму. Найбільша
кількість його накопичується печінці, нирках, кістковому мозку, селезінці, оскільки в цих органах
міститься найбільше макрофагів.
Після підшкірного введення антигени накопичуються в реґіонарних лімфатичних вузлах. Фіксація
парентеральне введеного антигену спостерігається в макрофагах мозкової речовини лімфатичних
вузлів, де він розщеплюється в лізосомах макрофагів. Антиген виявляється в цитоплазмі,
мітохондріях, лізосомах, мікросомах макрофагів. У невеликій кількості антиген може тривалий час
зберігатися в адсорбованому стані на мембранах допоміжних клітин у лімфоїдній системі. У цьому
стані антиген може зв'язуватися з рецепторами на лімфоцитах та індукувати імунні реакції. Такий
механізм може мати значення в регуляції інтенсивності імунної відповіді.
Специфічні антитіла сприяють локалізації антигену в лімфоїдних фолікулах, де він впорядковано
розподіляється у лімфоїдній тканині. У зародкових центpax лімфатичних вузлів і селезінки
локалізуються комплекси антиген — антитіло та агреговані молекули γ-глобуліну. Плазмоцити і
лімфоцити, як правило, вільні від антигену, але його виявляють у цитоплазмі цих клітин при
введенні у великих кількостях. Антиген накопичується у цитоплазматичних відростках
ретикулярних клітин центрів розмноження там, де ці відрості контактують з лімфоцитами. Фіксація
флагелярного антигену відбувається переважно на мембранах довгих відростків ретикулярних
клітин. При введенні імунізованим щурам флагеліну разом з гомологічною сироваткою кількість
фіксованого в лімфовузлах антигену збільшується у 10 разів унаслідок адсорбції на
цитоплазматичних відростках ретикулярних клітин. Це створює умови для тісного контакту
антигену з лімфоцитами.
При внутрішньошкірному введенні антиген надходить у дренуючі реґіонарні лімфовузли. Антигени,
що проникають через травний канал і верхні дихальні шляхи, потрапляють у лімфатичні тканини
слизових оболонок, де індукують синтез IgE і IgA.
Процес елімінації антигену з організму поділяють на три фази.
Перша фаза. Після введення в організм розчинний антиген розподіляється між судинними та
міжтканинними порожнинами лімфоїдної тканини внаслідок дифузії. Корпускулярні антигени в
тканини не дифундують, а поглинаються фагоцитами.
Друга фаза. Катаболізм антигену триває протягом кількох днів і залежить від наявності в організмі
хазяїна ферментативних систем для деструкції цього антигену. Полімери з D-амінокислот та деякі
поліцукридні субстанції зберігаються в організмі протягом тривалого часу.
Третя фаза — імунна елімінація. Після появи антитіл до антигену в крові утворюються комплекси
антиген — антитіло, які фагоцитуються і зазнають катаболізму. Залежно від особливостей антигену,
антитіл та метаболічної активності макроорганізму антиген може перебувати в організмі протягом
тижнів, місяців і навіть років.
Процес дезінтеграції антигенів здійснюється ферментами клітинних лізосом, основною
фізіологічною функцією яких є внутрішньоклітинне травлення часточок, що потрапляють у клітини
внаслідок фаго-або піноцитозу.
3.13. ГРУПОВІ АНТИГЕНИ КРОВІ.
В еритроцитах людини розрізняють три основні різновиди антигенів:
1. Гетерофільні антигени, наприклад антиген Форсмана, поширені у багатьох видів тварин, відсутні
в еритроцитах усіх людей.
2. Неспецифічні, або видові, антигени, які не трапляються у тварин, але представлені в еритроцитах
усіх людей.
3. Специфічні, або групові, антигени — ізоантигени, що містяться в еритроцитах одних особин і
відсутні у інших.
Оліґоцукриди, асоційовані з поверхнею еритроцитів людини, беруть участь у формуванні антигенів,
які визначають як групові речовини крові. За допомогою імунних реакцій ідентифіковано кілька
систем, що об'єднують близько 100 антигенів, які
утворюють унікальну картину груп крові кожної
людини. Е.А. Зотиков (1982) виділяє такі
найбільш вивчені еритроцитарні системи: АВ0,
резус (Rh0), Левіс, МNSs, Р, Келл, Даффі, ІСідд,
Лютеран та ін. (табл. 25). Найважливішими з
практичного погляду серед них є AB0 (H) та Rh
оскільки ці системи насамперед відподальні за
сумісність, а отже, за можливість переливання
крові.
Система АВ0. У 1901 p. K. Ландштейнер виявив
в еритроцитах людини два антигени — А і В, за
якими було визначено наявність трьох груп
крові: А, В і С (остання тепер — 0 (І)). Потім
було з'ясовано, що властивості зразків крові
окремих пацієнтів не відповідали трьом групам,
які запропонував Ландштейнер, і тоді чеський
лікар Ян Янськи, використовуючи реакцію
аглютинації еритроцитів, дійшов висновку про існування ще однієї групи. За деякими даними, IV
групу крові відкрили Декастелано і Стерлі (1902), а Янськи лише започаткував класифікацію груп
крові відповідно до частоти виявлення в популяції та запропонував їх нумерацію: І, II, III, IV.
Уявлення про групи крові ґрунтуються на наявності на еритроцитах групоспецифічних антигенів А,
В, а в сироватці — антитіл, тобто в основі відкриття груп крові системи АВ0 лежить закономірність,
що в сироватці крові людини містяться ізоаглютиніни до всіх ізоаглютиногенів, крім власних.
Індивіди з групою 0 або І не містять на еритроцитах антигенів А і В (аглютиногенів), а в їх
сироватках містяться антитіла (аглютиніни анти-А та анти-В). На еритроцитах групи А (II) наявний
антиген А, а в сироватці — аглютинін анти-В. Особини з групою В (III) мають на еритроцитах
антиген В, а в сироватці крові аглютинін анти-А. У осіб з групою АВ (IV) на еритроцитах
експресовані антигени А і В, натомість у сироватці крові відсутні аглютиніни (табл. 26). Антигени А
і В містяться також у лейкоцитах,
тромбоцитах, різних тканинах, слині, спермі,
сльозах, сечі, однак їх немає в кришталику,
плаценті, шкірі та спинномозковій рідині.
Оскільки речовини А і В індукують синтез
антитіл, що аглютинують еритроцити, їх
називають аглютиніногенами, а антитіла до
групових речовин крові — аглютинінами.
Антитіла, що містяться в певній сироватці і
специфічні до групових антигенів інших
особин, називають ізогемаглютинінами.
Показано, що окремі групоспецифічні
антигени системи АВ0 характеризуються
нерівномірним розподілом як по всій планеті,
так і в окремих її регіонах.
Відомо, що еритроцити всіх груп крові
характеризуються наявністю антигенної
речовини Н. Найбільша її кількість міститься в групі 0 (І), дещо менша — у групі А і ще менша — в
групі В. Завдяки наявності цього антигену деякі сироватки аглютинують еритроцити, які не містять
ні субстанції А, ні субстанції В. У деяких особин типу «Бомбей» Н-антигенів немає. При імунізації
таких осіб еритроцитами групи 0 у високих титрах виробляються анти-Н-антитіла. Н-антиген
гетерогенний, оскільки його виявляють не лише у людини, а й у деяких видів тварин.
З хімічного погляду групові антигени системи АВ0 є глікозаміногліканами, до складу яких входять
амінокислоти, що не беруть участі у формуванні антигенних детермінант групових речовин. Усі три
групові субстанції — А, В і Н — подібні за хімічним складом і різняться між собою лише вмістом
фруктози. Дуже близькі за хімічним складом також системи АВ0 і фактор Левіс (Le
a
). Вони утворені
значною кількістю олігоцукридних ланцюгів, що приєднані до поліпептидного ланцюга, який
виконує функцію скелета. Всі ланцюги складаються з п'яти цукрів: D-ra-лактози, L-фукози, N-
ацетил-D-глюкозаміну, N-ацетилгалактозаміну та сіалової кислоти. Як і у випадку інших
поліцукридів, антигенна специфічність визначається кінцевим моноцукридом і характером його
зв'язку. Якщо кінцевим цукром виступає D-фукоза, утворюється структура, не антигенна для
нормальних індивідів, оскільки всі вони містять на поверхні еритроцитів подібну детермінанту.
Такий антиген дістав назву Н-субстанції.
Встановлено, що субстанція Н є обов'язковим попередником для формування детермінант, які
відповідають А- і В-груповим речовинам. За даними Моргана і Кебота (1960), антигенна
детермінанта речовини А — N-ацетилгалактозамін, речовини В — D-галактоза, тоді як речовин Н та
Le
a
— фукоза залежно від положення зв'язку. На попередник спочатку діє фермент
фукозилтрансфераза, що відповідає за приєднання L-фукози до субтермінального
ацетилгалактозаміну в положенні 1,4-зв'язку і контролюється Le
a
-гeном, відмінним від системи
АВ0-генів. Так утворюється Lе
а
-субстанція. У подальшому під контролем Н-гена синтезується
субстанція Н. У секреторів є додаткова взаємодія Le- та Н-субстанцій, з яких утворюється
субстанція Le
b
. Далі синтезом керують гени 0, А, В. 0-ген аморфний, він не модифікує Н-
субстанцію. N-ацетилгалактозилтрансфераза, що контролюється А-геном, зумовлює приєднання до
D-гaлактозного кінця (1,3) N-ацетил-D-галактозаміну, внаслідок чого утворюється субстанція А, а
галактозилтрансфераза приєднує D-галактозу, що зумовлює утворення субстанції В. У процесі
ацетилування антиген В перетворюється на антиген А. Під дією на речовину А протеаз із
клостридій або зерен кави вона перетворюється на речовину Н. У результаті ферментативного
гідролізу речовини Н утворюється речовина Le
a
. Припускають, що антиген Н є попередником
антигенів А та В і може перетворюватися на них.
Система Rh-антигенів. Rh-антиген відкрили К. Ландштейнер та Вінер у 1940 р. Вони довели, що
сироватка кролів, імунізованих еритроцитами мавпи макаки-резус, аглютинує еритроцити людини.
З цього можна зробити висновок, що еритроцити мавп і людини містять спільний антиген, який
назвали Rh-антигеном. Хімічну структуру Rh-антигену не вивчено. У системі резус відомо шість
основних антигенів. За номенклатурою Фішера—Рейса їх позначають D, С, Е, d, с, е. Гени системи
Rh розміщені трьома зчепленими локусами на першій хромосомі. Пара хромосом кодує алельні гени
D —d, С —с, Е —е. Залежно від кількості локусів гомозиготності особина може містити 6, 5, 4 і 3
антигени системи резус. У комбінації гени системи резус можуть давати близько 30 фенотипів.
Основним у системі резус є антиген Rh (D). Він є в еритроцитах 85 % особин популяції
європейських народів, у решти 15 % його немає. У монголоїдної раси цей антиген буває у 95 %
людей.
У нормі Rh-антитіла в сироватці крові відсутні. Вони утворюються під час імунізації в результаті
переливання крові або під час вагітності. Якщо Rr
–
-особину імунізувати еритроцитами Rh
+
-ocoбини,
що має ті самі антигени АВ0, то синтезуються лише Rh-антитіла. Основна роль належить антигену
D. З цим антигеном системи резус пов'язані імунні конфлікти між організмом резус-негативної
матері, яка не містить антиген D, і резус-позитивного плоду, що має цей антиген, які зумовлюють
гемолітичну хворобу новонароджених.
3.14. АНТИГЕНИ МІКРООРГАНІЗМІВ.
Антигенами мікроорганізмів є речовини, що входять до складу клітин чи вірусних частинок або
виділяються мікроорганізмами у навколишнє середовище. Такими антигенами можуть бути прості й
складні білки, ліпополіцукриди, поліцукриди, біополімери змішаної хімічної природи, які
характеризуються антигенністю.
Антигенна структура мікроорганізмів, тобто кількість і якість окремих антигенів, досить складна і
залежить від будови мікроорганізмів та їх специфічної активності.
Віріони простих вірусів мають, як правило, один або кілька антигенів білкової чи змішаної природи,
які за своєю специфічністю змінюються, що і визначає існування багатьох серогруп, сероварів та
субсероварів у межах одного виду. Віріони складних вірусів складаються з кількох
нуклеокапсидних (С, S) і поверхневих (V) антигенів. Поверхневі антигени мають вищу протективну
активність і варіабельність, ніж нуклеокапсидні. До складу суперкапсидів деяких вірусів входять
також мембранні білки хазяїна, що знижує або деформує імунну відповідь. Це пов'язано з
існуванням так званих гетерофільних антигенів (групових, перехресно реагуючих), які є
результатом антигенної (молекулярної) мімікрії паразитів до хазяїна. Крім того, в інфікованих
вірусом клітинах виявляються додаткові антигени, яких немає ні у віріона, ні у нормальної клітини
хазяїна. Це так звані ранні, або функціональні, білки вірусів. Для антигенів вірусів характерний
високий рівень антигенної мінливості. Серед найвідоміших — часткові зміни антигенної
специфічності вірусних білків, спричинені точковими мутаціями (антигенний дрейф), зміни в
антигенному складі вірусів, спричинені включенням у геном вірусів генетичного матеріалу від
спорідненого вірусу (антигенний зсув), або повна зміна антигенної специфічності вірусних білків,
зумовлена мутаціями або утворенням гібридних геномів (антигенний шифт).
Антигенна структура бактерій надзвичайно складна і гетерогенна за хімічною природою. Залежно
від локалізації у бактерій виділяють кілька груп антигенів. Антигенні речовини капсул або
мікрокапсул називають капсульними, або оболонковими (К-антигени). Вони мають поліцукридну,
білкову, поліпептидну або змішану хімічну природу. Антигенна активність К-антигенів, як правило,
нижча від інших бактеріальних антигенів, а протективна — вища. Антигенність К-антигенів
варіабельна, що використовують для систематики бактерій. При культивуванні на живильних
середовищах бактерії часто втрачають здатність до утворення капсул, а отже, до синтезу К-
антигенів, проте в разі потрапляння в чутливий організм синтез К-антигенів поновлюється. Хімічні
речовини, що входять до складу капсул бактерій, зв'язані з клітинною стінкою не міцно, а тому К-
антигени виявляються не тільки в місці локалізації бактерій, а й легко дифундують по всьому
організму.
