Вершигора А.Ю., Пастер Є.У., Колибо Д.В. Імунологія
Подождите немного. Документ загружается.

71
лімфоцитів. Однак застосування ПкАТ підвищує ризик інфекцій у реципієнта. Можливі й інші
ускладнення, пов'язані з наявністю в препаратах чужорідного білка (алергічні реакції) та антитіл
різної специфічності (тромбоцитопенія). Крім того, ці препарати глобулінів руйнують Т-лімфоцити
незалежно від їх антигенної специфічності, тобто не лише ті, що реагують проти трансплантата.
Ефективнішим є застосування «ґуманізованих» мишачих МкАТ (див. розд. 22) з певною
спрямованою дією, оскільки дає змогу мінімізувати антигенність цих білків для людини. МкАТ
специфічні до певних поверхневих молекул клітин, що беруть участь у процесах розпізнавання
антигену й активації лімфоцитів. Деякі з МкАТ можуть зумовити деструкцію лімфоцитів, інші —
блокування функції своїх білків-мішеней, не руйнуючи клітин, що їх експресують.
У клінічній трансплантації використовують МкАТ миші проти CD3-молекули людини (муромонаб-
СD3), що є частиною Т-клітинного антигенрозпізнавального комплексу. В експерименті для
запобігання відторгненню трансплантата використовують МкАТ проти різних молекул клітинної
поверхні Т-лімфоцитів: CD4 — маркера головної, як вважають, у реакції відторгнення субпопуляції
Т-клітин; CD8 — маркера цитотоксичних Т-лімфоцитів, CD25 (α-ланцюга рецептора ІЛ-2) —
відповідальної за сприйняття сигналу від цитокіну; ІСАМ-1 (CD54) — важливої для адгезії (і
активації) та CD154 (СD40-ліганд), важливої для активації Т-клітин. Досліджуються також МкАТ до
експресованих на АПК костимуляторних молекул В7.1 (CD80) та В7.2 (CD86), взаємодія яких з
їхнім лігандом CD28 на Т-клітинах запускає каскад необхідних для активації сигналів. Інший підхід
полягає у використанні альтернативного до CD28 ліганда костимуляторних молекул — CTLA-4,
зв'язування якого з молекулами В7 призупиняє активацію Т-клітин. Показано, що введення
розчинного CTLA-4 (або CTLA4-Ig) тваринам сприяє тривалому виживанню деяких
трансплантованих тканин. Ефект CTLA-4 зумовлюється блокуванням костимуляції Т-клітин, які
специфічні до антигенів гістосумісності донора, та індукуванням у них стану анергії.
Отже, антитіла, на відміну від широко вживаних лікарських засобів, здатних спричинювати
небажані ефекти на нелімфоїдні тканини, діють спрямовано на певні клітини імунної системи. До
того ж ефективність антитіл можна підвищити, кон'югуючи їх з токсинами. Ще один новий підхід
полягає в кон'югуванні з токсинами цитокінів. Наприклад, кон'югати ІЛ-2 — токсин, зв'язуючись з
ІЛ-2-рецепторами, зумовлюють інактивацію клітин, що несуть ці рецептори. Однак, незважаючи на
всю привабливість, терапія кризу відторгнення за допомогою біологічних аґентів, антитіл і
цитокінів перебуває ще на стадії пошуку. Крім того, біологічні агенти, хоча і діють більш вибірково,
в чому полягає їхня перевага над лікарськими засобами, також характеризуються неспецифічними
імуносупресивними властивостями. В перспективі описані нові підходи будуть вдосконалюватися
так, щоб можна було вибірково елімінувати або блокувати активність тих клонів лімфоцитів, що
специфічні до антигенів трансплантата, не впливаючи на всі інші клони. Це дасть змогу уникати
небажаних побічних ефектів, в тому числі зниження резистентності до інфекцій.
Специфічна імуносупресія. Специфічна імуносупресія, на відміну від неспецифічної, зумовлює
інактивацію лише тих клонів лімфоцитів, що відповідальні за відторгнення трансплантата, не
впливаючи на реактивність імунної системи щодо інших антигенів. Сьогодні для запобігання
відторгненню трансплантата в експерименті використовують такі прийоми, як індукування
толерантності в неонатальний період та активне і пасивне підсилення толерантності.
У гризунів (тварин, які найчастіше використовують в експериментальній трансплантології) Т-
клітини емігрують із тимуса відзразу після народження і толерантність у них можна індукувати,
вводячи їм у цей період клітини, здатні рости і розвиватися й бути постійним джерелом донорських
антигенів. Зазвичай мишам однієї батьківської лінії, наприклад В, вводять клітини кісткового мозку
гібридів (АхВ) F1, що призводить до розвитку у реципієнтів ареактивності до антигенів А, яка
виникає внаслідок пригнічення утворення зрілих алореактивних анти-А Т-клітин. Індукована
толерантність підтримується в дорослому стані, чим і пояснюється тривале виживання у таких
реципієнтів трансплантатів від донорів лінії А (див. розд.13).
Вважають, що основою неонатального індукування толерантності може бути як інактивація
антигеном клонів Т-клітин, так і вибіркова активація певних їх субпопуляцій. Так, підвищення
кількості донорспецифічних Тх2-клітин і утворення ними цитокінів, зокрема ІЛ-10, пригнічує
продукування Тх1-клітинами ІФН-γ та ІЛ-2. Дефіцит донорспецифічних Тх1-клітин, яким належить
вирішальна роль у реакції відторгнення, за підвищеної кількості Тх2-клітин призводить до
пригнічення реакції відторгнення і сприяє виживанню трансплантата. Існує також думка, що
неонатально індукувана толерантність може бути зумовлена активацією супресорних Т-клітин, яка
обґрунтовується можливістю адоптивного перенесення супресії реакції відторгнення інтактному
реципієнту за допомогою Т-лімфоцитів від донора, толерантного до трансплантата. Однак питання
про природу супресорних Т-лімфоцитів остаточно ще не з'ясовано.
У людини виселення Т-клітин з тимуса відбувається через 16 — 20 тижнів внутрішньоутробного
розвитку, тобто наприкінці першої половини вагітності, а тому отримати стан неонатально
індукованої толерантності (як у гризунів) неможливо. Подібний певною мірою стан виникає у
людини після загального опромінення лімфоїдної тканини з екрануванням кісткового мозку і
наступного введення антигену. Однак, як уже зазначалося, застосування загального опромінення
пов'язане з тяжкими побічними ефектами, що унеможливлює широке використання цього методу в
клінічній практиці.
У тварин і людини можна індукувати стан ареактивності до трансплантата та подовжувати його
виживання за допомогою гемотрансфузій. У людини в деяких випадках можна подовжити термін
виживання трансплантата попереднім переливанням крові. Сприятливий вплив на виживання
трансплантата може чинити попередня внутрішньовенна (не інша!) трансфузія реципієнту крові не
лише від донора органа (donor specific transfusion), а й від іншого, не підібраного спеціально,
донора, що зумовлено випадковим збігом деяких антигенів донора крові і донора трансплантата
(органа).
Гемотрансфузійний ефект виникає як наслідок активної імунної відповіді реципієнта на введені
чужорідні антигени донора, тому цей феномен називають активним імунним підсиленням
толерантності, або активним підсиленням виживання трансплантата. Активне підсилення, як
вважають, може опосередковуватися різними механізмами, такими як індукування антигенами крові
анергії чи вибіркова активація певних субпопуляцій Т-клітин (Тх2), утворення «підсилювальних
антитіл», які пригнічують процес розпізнавання та презентації антигенів (блокуючи антигенні
детермінанти трансплантата чи руйнуючи АПК — «лейкоцити-пасажири») або зумовлюють
елімінацію алореактивних клітин. У свій час попереднє переливання реципієнту донорської крові
широко застосовувалося в багатьох центрах трансплантації. Однак ця процедура пов'язана з
ризиком сенсибілізації реципієнтів та можливим інфікуванням їх вірусами. Із запровадженням
ефективних імуносупресивних агентів застосування цього методу
в більшості випадків стало
недоцільним.
В експерименті тривалого виживання трансплантата досягають також уведенням реципієнту під час
трансплантації готових антидонорських антитіл, які зумовлюють пасивне підсилення
толерантності (пасивне підсилення виживання трансплантата). Ефект підсилення може бути
зумовлений регуляцією введеними антитілами імунної відповіді на трансплантат за механізмом
зворотного зв'язку (див розд. 10, 11).
Як індуковані в організмі реципієнта, так і введені готові антитіла пригнічують реакції відторгнення
лише щодо антигенів конкретного донора, що підтверджує імунну специфічність феноменів
активного пасивного підсилення.
Отже, специфічна імуносупресія, ослабляючи імунну відповідь на трансплантат, не знижує
резистентності реципієнта до збудників інфекцій. Однак застосування методів специфічної
імуносупресії в клінічній практиці вірогідно стане можливим лише у майбутньому.
ВИСНОВКИ.
Пересаджування алогенних органів і тканин за відсутності лікування майже завжди
супроводжується відторгненням трансплантата. В основі відторгнення лежить розпізнавання
імунною системою реципієнта чужорідних антигенів гістосумісності, експресованих на клітинах
трансплантата, і розвиток реакцій на них. Найважливіші антигени гістосумісності кодуються генами
комплексу МНС. Т-клітини реципієнта розпізнають безпосередньо алогенні молекули МНС чи
комплексовані з ними пептиди інших алогенних білків на АПК донорського походження
(«лейкоцитах-пасажирах»), а також пептиди алогенних білків в асоціації з власними молекулами
МНС на АПК реципієнта. Головним індуктором реакції відторгнення є пряма активація Т-клітин
алогенними молекулами МНС, експресованими на АПК трансплантата. Активовані алореактивні Т-
клітини здійснюють пряму цитотоксичну дію на клітини трансплантата або секретують цитокіни, за
допомогою яких залучають для його руйнування різні ефекторні механізми, як антигенспецифічні,
так і запальні неспецифічні. Цитокіни стимулюють також експресію антигенів МНС і молекул
адгезії на клітинах трансплантата, сприяючи таким чином реалізації ефекторних механізмів. У
патогенезі гострого відторгнення провідну роль відіграють клітинні реакції, тоді як у хронічному
відторгненні беруть участь також анти-МНС-антитіла. Преформовані антитіла реципієнта до
антигенів МНС донора можуть бути причиною надгострого відторгнення трансплантата. При
пересаджуванні кісткового мозку реципієнтам зі зниженою імунореактивністю розвивається реакція
трансплантат проти хазяїна, яка індукується антигенами гістосумісності реципієнта і може
призвести до його загибелі. Ослабити реакції відторгнення та подовжити виживання трансплантата
можна підбором донора і реципієнта за антигенами МНС. При цьому найбільше значення має
сумісність за антигенами МНС класу II, зокрема HLA-DR, та антигенами HLA-B класу І. Різні
неспецифічні імуносупресивні агенти, які широко використовують у клінічній практиці для
блокування реакцій відторгнення, подовжують виживання трансплантата, однак, зумовлюючи
загальне пригнічення імунної системи, вони здатні знижувати резистентність до інфекцій.
Позбавлені цього побічного ефекту методи специфічної імуносупресії — інактивації лише клонів
лімфоцитів, що відповідають за відторгнення трансплантата, поки що знаходяться на стадії
експериментальної розробки.
Контрольні запитання.
1. У чому полягає суть прямого і непрямого розпізнавання антигенів трансплантата і чим
відрізняються реакції, індуковані в результаті прямої і непрямої активації Т-клітин реципієнта?
2. Які з алотрансплантатів відторгнуться реципієнтом швидше, якщо видалити з них власні
антигенпрезентувальні клітини: а) відмінні за антигенами МНС, але ідентичні за мінорними? б)
відмінні за мінорними антигенами, але ідентичні за МНС?
3. Які ефекторні механізми зумовлюють гостре та хронічне відторгнення алотрансплантатів?
4. Які механізми спричинюють надгостре відторгнення і чим зумовлена більша складність проблеми
відторгнення цього типу при ксенотрансплантаціях порівняно з алотрансплантаціями?
5. Які способи, засоби та методи використовують для ослаблення (блокування) реакції
відторгнення?
6. Що є абсолютним протипоказанням для трансплантації і яку комбінацію лікарських препаратів,
антитіл і антигенів можна вважати оптимальною при пересаджуванні алотрансплантата?
РОЗДІЛ 18. ГІПЕРЧУТЛИВІСТЬ.
Встановлено, що імунна відповідь, особливо в разі повторного потрапляння в організм
специфічного антигену, може не лише здійснювати захисні функції, а й бути причиною виникнення
певних патологічних процесів. Одним із проявів патологічних змін, зумовлених імунною системою,
є гіперчутливість (підвищена чутливість).
Гіперчутливість — це змінена (хвороблива), надмірна або неадекватна імунна відповідь
сенсибілізованого організму на повторну зустріч з антигеном, унаслідок чого індукується масове
продукування різних факторів захисту організму та надмірна активація ефекторних клітин, що
спричинює різні запальні процеси та ушкодження певних клітин, тканин і органів.
Під час з'ясування суті процесів, зумовлених реакціями підвищеної чутливості, їм давали назви
залежно від причин виникнення та проявів вивчених реакцій. Спочатку для характеристики всіх
видів гіперчутливості було введено терміни «алергія» (в перекладі з грец. — інша дія), «алергічні
захворювання». Проте останнім часом термін «алергія» використовують переважно для позначення
гіперчутливості типу І.
Гіперчутливість може бути активною внаслідок прямої сенсибілізації організму певними
антигенами або гаптенами і пасивною, коли гіперчутливість виникає в результаті перенесення із
сенсибілізованих організмів інтактних антитіл, комплексів антиген — антитіло або сенсибілізованих
лімфоцитів.
У формуванні реакцій гіперчутливості головну роль можуть відігравати гуморальні фактори —
антитіла або клітинні фактори — сенсибілізовані Т-лімфоцити. Серед опосередкованих
гуморальними факторами реакцій гіперчутливості виокремлюють три типи: 1) гіперчутливість
першого типу, або гіперчутливість негайного типу (ГНТ), провідним фактором якого є
імуноглобуліни класу Е; 2) гіперчутливість другого типу, індукована антитілами до антигенів
власних клітин, або модифікованих антигенних структур власних клітин, зумовлює цитотоксичний
ефект через активацію комплементу; 3) гіперчутливість третього типу, індукована розчинними
імунними комплексами. Клітинними факторами опосередковується гіперчутливість типу IV, або
гіперчутливість сповільненого типу (ГСТ) (табл. 60).
У розвитку гіперчутливості, зумовленої сенсибілізованими клітинами (реакції негайного або
сповільненого типу) виокремлюють три стадії — індуктивну, активуючу й ефекторну. В
індуктивній стадії відбува ється сенсибілізація організму певними антигенами (алергенами); активні
учасники — антигени (алергени), АПК (розпізнавання, процесинг, презентація антигену) Т-хелпери,
ефекторні клітини, гуморальні фактори, клітини імунної пам'яті. В другій, активуючій, стадії після
повторного введення специфічного антигену активуються клітини пам'яті й ефекторні клітини — ті,
що утворилися при первинному введенні антигену, залучаються й активуються інші
імунокомпетентні та допоміжні клітини, масово продукуються біологічно активні речовини;
активними учасниками є специфічні антигени (гаптени), клітини імунної пам'яті, клітини крові й
тканин. Ефекторна стадія характеризується виникненням порушень функціональної активності та
ушкоджень певних клітин, тканин і органів; активні учасники — активовані ефекторні клітини,
цитоцидні та бактерицидні речовини.
Реакції гіперчутливості, що індукуються імунними комплексами (II і III типів) різняться тим, що
при гіперчутливості другого типу утворюються нерозчинні комплекси антиген — антитіло, які
міцно фіксовані на клітинах і є індукторами розвитку імунно-захисних реакцій (активація
комплементу, приєднання до Fc-R та C3-R ефекторних клітин ); при гіперчутливості третього типу
утворюються розчинні імунні комплекси, які можуть фіксуватися на ендотелії судин різних органів і
тканин, і «запускають» захисні реакції.
У більшості випадків захворювань з виникненням підвищеної чутливості у формуванні
патологічних процесів беруть участь кілька типів гіперчутливості. Окремі ознаки захворювань
можуть бути зумовлені реакціями різних типів підвищеної чутливості. Так, екзема виникає при ГНТ
(алергічний дерматит) і при ГСТ (дерматит, зумовлений контактною гіперчутливістю). Прояви
будь-якої реакції підвищеної чутливості можуть ускладнюватися багатьма неспецифічними
факторами, що супроводжують формування цих реакцій: запаленням, що підвищує проникність
судин, низкою факторів патогенів, які можуть підсилювати або гальмувати прояви реакції
гіперчутливості, а також залучення в цей процес багатьох систем – ендокринної, нервової та ін.
Слід зазначити, що реакції підвищеної чутливості впродовж еволюційного розвитку формувалися як
захисні, і тільки особливі властивості індукторів процесу, стан організму, надзвичайна реакція
деяких компонентів імунної системи та генетична схильність індивідуумів сприяють індукуванню
певних патологічних проявів.
На сьогодні захворювання, пов'язані з виникненням гіперчутливості, посідають провідне місце. Так,
за даними BOOЗ, на ці хвороби страждають від 10 до 30 % жителів планети, а в регіонах з
несприятливими екологічними умовами — до 50%.
18.1. ГІПЕРЧУТЛИВІСТЬТИПУІ (ГІПЕРЧУТЛИВІСТЬ НЕГАЙНОГО ТИПУ).
Прояви реакцій гіперчутливості типу І відомі давно, і для їх характеристики вживали і вживають
різні терміни: алергія, алергічні реакції, реагінові реакції, анафілаксія, реакції негайного типу.
Терміном «алергія» (з грец. alias -інший, ergon - дія) позначали прояви неадекватної реакції
організму на повторну зустріч з певними антигенами (алергенами).
При вивченні реакцій ГНТ було встановлено провідну роль у механізмах їх індукування певних
речовин сироватки крові – реагінів, що, як було встановлено пізніше, є гомоцитотропними
імуноглобулінами класу Е. Ці реакції було названо реагіновими.
Терміном «атонічні», тобто спотворені (a topos), називали реакції негайного типу з високим рівнем
IgE, які генетично зумовлені родинною схильністю до цих реакцій. Атопічні хвороби
характеризуються спазмом гладких м'язів, гіперемією і набряком, зміною секреторної активності
деяких залоз. До атопічних захворювань належать бронхіальна астма, кропив'янка, набряк Квінке,
алергічні дерматит і риніт та ін.
Гострі прояви ГНТ, зумовлені парентеральним уведенням алергенів (чужорідних білків), називають
анафілаксією (з грец. – зворотний захист; аnа – зворотний, philaxis - захист). Анафілактичні реакції
можуть бути місцевими – при підшкірному введенні алергену в сенсибілізований організм — і
системними — після повторного внутрішньовенного введення специфічного антигену в
сенсибілізований організм. Прикладом е анафілактичний шок.
Термін «гіперчутливість (підвищена чутливість) негайного типу» вживають тому, що прояви цієї
реакції настають негайно, впродовж перших 10 — 30 хв.
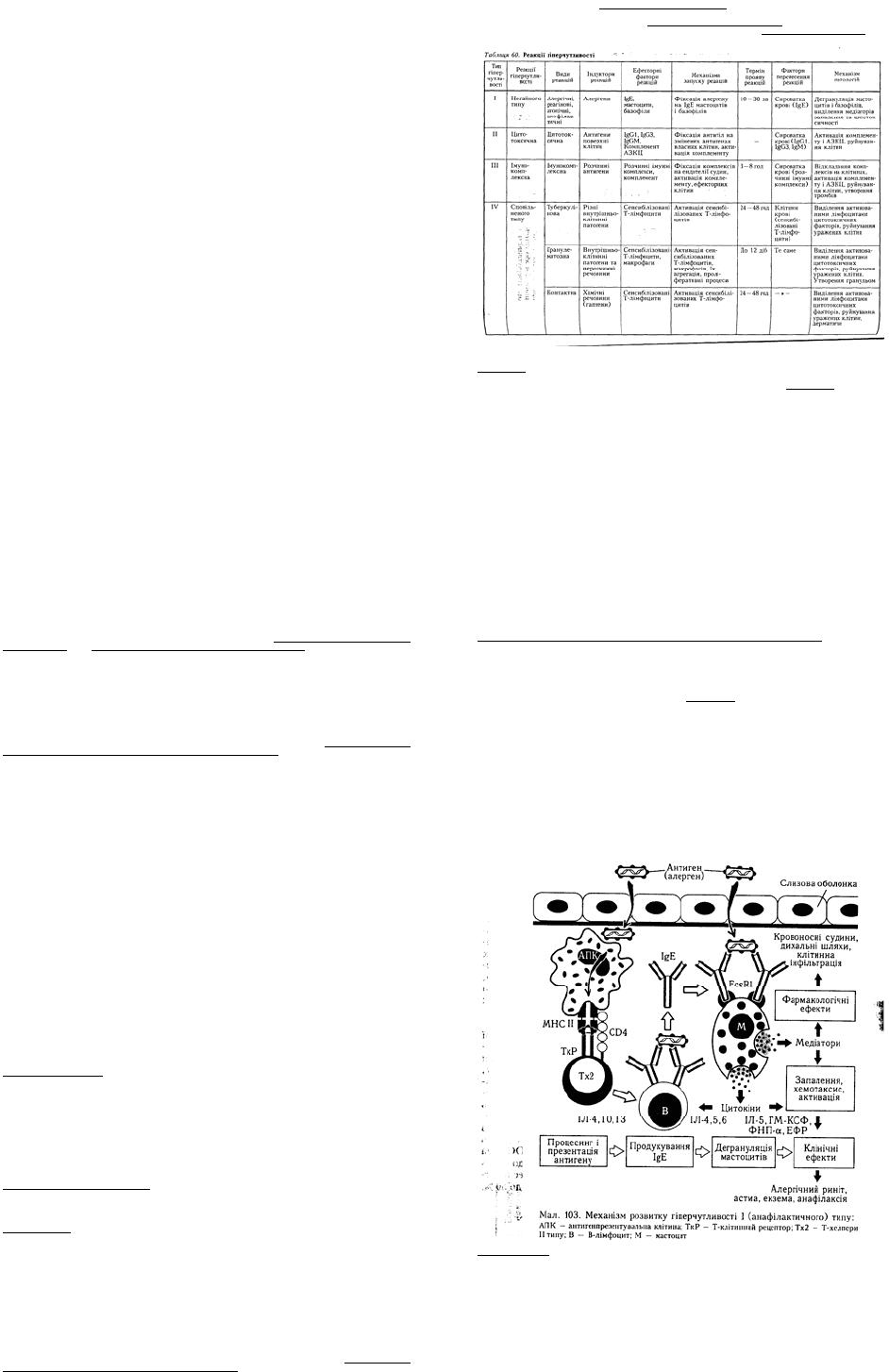
Слід зазначити, що всі відомі прояви ГНТ зумовлені одним механізмом — сенсибілізацією
організму певними алергенами, що індукує синтез антитіл класу Е, і приєднанням останніх до
мастоцитів або базофілів та повторним уведенням специфічного алергену, який приєднується до
фіксованих на мастоцитах і базофілах IgE. Внаслідок цього відбувається деґрануляція цих клітин
(мал. 103). Отже, основними умовами виникнення ГНТ є сенсибілізація організму певними
речовинами — алергенами та повторний контакт організму з ними.
18.1.1. Алергени.
Характерною особливістю алергенів є індукування ними синтезу специфічних гомоцитотропних
антитіл — реагінів — переважно імуноглобулінів класу Е, які здатні фіксуватися на мастоцитах,
базофілах, еозинофілах і запускати імунопатологічні реакції. В основному алергени —
тимусзалежні антигени. До алергенів належить широке коло різноманітних речовин, в основному
низькомолекулярних. Одні з дих мають антигенні властивості й можуть індукувати синтез як
реагінів, так й інших імуноглобулінів, інші (лікарські препарати, низькомолекулярні білки, складні
сполуки небілкової природи, прості хімічні речовини) є гаптенами. В організмі вони зв'язуються з
білками тканин й індукують синтез імуноглобулінів переважно класу Е.
Алергени можуть мати ендогенне або екзогенне походження. Ендогенні алергени — де здебільшого
змінені внаслідок дії хімічних, фізичних та біологічних чинників білки власного організму.
Найпоширенішими є екзогенні алергени рослинного, тваринного, побутового, лікарського,
харчового, промислового, мікробного та іншого походження. З речовин рослинного походження
висока алергенність властива компонентам пилку, спорам, ягодам; тваринного походження —

72
харчовим добавкам, компонентам молока, м'яса, риби, яєць, лупи, пір'я, шерсті. До побутових
алергенів відносять алергени хатнього, бібліотечного та іншого походження. Одним з основних
алергенів домашнього пилу є кліщі та їхні компоненти, секрети багатьох комах. Нерідко
індукторами алергії можуть бути лікарські препарати. До алергенів мікробного походження
належать різні непатогенні мікроорганізми, зокрема гриби, збудники інфекційних та інвазійних
хвороб і продукти їхньої життєдіяльності. У зв'язку з інтенсивним розвитком мікробіологічних
технологій збільшується ризик появи алергенів мікробного походження. Особливу увагу привертає
хімічне забруднення навколишнього середовища як джерело промислових алергенів — металів,
їхніх солей, синтетичних полімерів, пестицидів та інших хімічних речовин.
Алергени потрапляють в організм різними шляхами — через дихальну систему, травний канал,
шкіру, при введенні лікарських речовин, укусах комах, внаслідок інфекційних процесів. Алергени
можуть виявляти свою активність, тобто індукувати алергічні реакції, залежно від властивостей
самого алергену та стану організму. Алергічна реакція індукується речовинами переважно білкової
природи з малою молекулярною масою (до 15 кДа) та низькою дозою. Низька доза сприяє
утворенню Тх2, які індукують синтез IgE. Важливу роль в індукуванні підвищеної чутливості
першого типу відіграє місце проникнення алергену — більш виражена реакція негайного типу
виникає в разі проникнення крізь слизові оболонки. У слизових оболонках міститься значна
кількість мастоцитів, у них можуть формуватися Тх2 і В-лімфоцити, здатні синтезувати IgЕ.
Певну роль відіграє генетично зумовлена родинна спадкова схильність індивідів синтезувати
переважно IgE. Генетичні фактори можуть контролювати специфічність реакції на певний алерген,
загальний рівень IgE та генералізовану гіперчутливість. Встановлено, що продукти генів у плечах
хромосоми 5 у регіоні 5q31.1 (у ділянці кластера генів ІЛ-4, ІЛ-13, ІЛ-5) регулюють загальний
рівень IgE (але не специфічних) та гіперчутливість бронхів; гени хромосоми 11q13 контролюють
астму та атопічну чутливість. Водночас продукування специфічних IgE та шкірні реакції
гіперчутливості негайного типу регулюють зчеплені з НLА гени імунної відповіді, особливо на
антигени з малою молекулярною масою і при низьких дозах алергену.
Крім генетичних факторів в індукуванні алергії певну роль відіграють такі чинники, як рівень
забруднення довкілля, стан харчування, наявність різних патологічних процесів, зокрема
інфекційних.
Основою виникнення ГНТ є індукування синтезу імуноглобулінів класу ІgЕ, фіксація його на
мастоцитах і базофілах, повторне потрапляння алергену, що зумовлює активацію цих клітин і викид
у навколишнє середовище біологічно активних речовин, які спричинюють виникнення різних форм
прояву алергічних реакцій. Характерною особливістю формування ГНТ є індукування
продукування ІgЕ в слизовій оболонці локально, в зоні проникнення алергену, або в регіонарних
лімфовузлах.
18.1.2. Індукування синтезу IgE та сенсибілізація мастоцитів і базофілів.
Для індукування синтезу IgE В-лімфоцити мають отримати два сигнали: від алергену (через BCR) та
від ІЛ-4 або ІЛ-3, а також частково від CD40.
Індукування синтезу IgE складається з кількох етапів — контакт алергену з АПК (переважно з
клітинами Лангерганса в шкірі та з дендритними клітинами в слизових оболонках, які подібні до
клітин Лангерганса), кооперування між АПК, В-лімфоцитами та Тх2, активація АПК і Тх2 та
продукування ними ряду цитокінів, які активують Тх2 і В-лімфоцити, внаслідок чого інтенсивно
продукується IgE.
Як правило, у внутрішнє середовище організму алергени потрапляють крізь слизові оболонки або
через шкіру (внаслідок укусів комах тощо). Слизові оболонки й шкіра багаті на лімфоїдну тканину
та лімфовузли, які дренують ці ділянки. Лімфоїдна тканина слизових, у свою чергу, багата на
дендритні клітини, Тх0, мастоцити та фактори мікрооточення, які сприяють диференціюванню Тх0
в Тх2. Диференціюванню Тх0 в Тх2 сприяє також низка факторів: проміжна доза алергену,
презентування алергену дендритними клітинами та макрофагами, наявність мастоцитів,
позаклітинна інфекція, синтез ІЛ-4 мастоцитами та ТФР-β, що продукується клітинами слизових
оболонок.
У разі первинного проникнення в слизові оболонки та шкіру алергени захоплюються АПК
(переважно дендритними клітинами та клітинами Лангерганса).
Алергени також можуть взаємодіяти безпосередньо з мастоцитами та базофілами й індукувати
синтез ними інтерлейкінів 4, 10, 13, які сприяють диференціюванню Тх0 в Тх2. Так, деякі алергени
рослинного походження містять у своєму складі протеази, здатні індукувати продукування ІЛ-4.
АПК з поглиненим алергеном у лімфовузлах або в лімфоїдній тканині слизових оболонок
активуються і взаємодіють з В-лімфоцитами та Тх2, які при цьому також активуються, в результаті
чого утворюються плазматичні клітини зі здатністю синтезувати IgE. При деяких атонічних
захворюваннях на клітинах Лангерганса шкіри виявляються імуноглобуліни класу Е, що може
сприяти презентуванню алергенів Т-лімфоцитам, що містяться в шкірі, й таким чином індукувати
запальні процеси в шкірі. У шкірі здорових людей IgE-зв'язувальних клітин Лангерганса не
виявлено.
Вирішальну роль у взаємодії В-лімфоцитів з Тх2 відіграє молекула CD40, яка взаємодіє з
відповідним лігандом CD40L на Т-лімфоцитах, у результаті чого запускається проліферація Т-
клітин і синтез цитокінів Т-лімфоцитами.
Одну з найважливіших ролей в індукуванні продукування IgE та запуску алергічних реакцій
відіграють Тх2 й продуковані ними цитокіни ІЛ-4, -5, -9, -10, -13, ТФР-β, які підтримують
антитілоутворення. ІЛ-4 та ІЛ-5 сприяють активації В-лімфоцитів, їх проліферації, утворенню IgE-
позитивних плазматичних клітин, міграції їх у лімфоїдну тканину слизових оболонок та синтезу
IgE, а також активують мастоцити й базофіли. IgE активно продукується у слизових оболонках і
регіонарних лімфовузлах, менше — у шкірі та селезінці. IgE-продукувальні плазматичні клітини
виявлено в слизових дихальних шляхів і травного каналу і не виявлено в легенях, кістковому мозку,
периферичній крові здорових людей. ІЛ-4 та ІЛ-13 індукують переключення синтезу
імуноглобулінів В-лімфоцитами на синтез IgE. ІЛ-5 індукує диференціювання попередників
еозинофілів у зрілі клітини, збільшує експресію високоафінних рецепторів до IgE (FcεRI) на
мастоцитах і базофілах; ІЛ-4 підсилює проліферацію базофілів, збільшує експресію на базофілах
молекул адгезії до епітелію, підвищує їхню міграційну активність, індукує експресію
низькоафінного рецептора до IgE( FcεRII — CD23) на моноцитах, Т- і В-лімфоцитах. Певну роль в
індукуванні утворення Тх2 відіграє ІЛ-10, який інгібує АПК гальмуванням синтезу ІЛ-1, ФНП-α,
ІФН-γ, презентуванням антигену Тх1 і таким чином сприяє розвитку імунної відповіді Тх2-шляхом.
Під впливом медіаторів, що продукуються активованими клітинами, активуються й адгезивні
молекули венул лімфоїдних тканин слизових оболонок, що сприяє збільшенню міграції Тх2 в місця
проникнення алергену. Плазматичні клітини мігрують у лімфоїдну тканину слизових оболонок, де
інтенсивно продукують IgE. Кількість імуноглобулінів Е при алергічних захворюваннях
збільшується в сотні й тисячі разів. Ці імуноглобуліни спочатку сенсибілізують місцево розміщені
мастоцити й базофіли, а потім потрапляють у кров і сенсибілізують базофіли та мастоцити інших
тканин і органів. IgE у крові та тканинній рідині швидко руйнуються різними протеазами – термін
півжиття сироваткового IgE становить 2,5 доби; разом з тим фіксовані на мастоцитах IgE
зберігаються досить довго — до 12 міс. Лімфоцити, що продукують IgE, існують у слизових
оболонках та регіонарних лімфатичних вузлах тривалий час. Певну роль у регуляції синтезу IgE
відіграють низькоафінні рецептори до IgE - FcεRII (CD23), лектин С-типу, які можуть існувати у
фіксованій (переважно на моноцитах, макрофагах, В- і Т-лімфоцитах) та розчинній формі. За
наявності ІЛ-4 розчинний CD23 продукується В-клітинами й моноцитами і може виявляти
аутокринну дію — індукує переключення синтезу імуноглобулінів на синтез IgE, підсилює
проліферацію плазмоцитів та підвищує рівень продукування IgE. Важливу роль у регуляції синтезу
IgE та розвитку алергічних реакцій відіграють ІФН-γ та ІЛ-12, які гальмують розвиток і функцію
Тх2.
Слід зазначити, що високий рівень продукування імуноглобулінів класу Е спостерігається не лише
при алергічних, а й при інвазійних захворюваннях.
18.1.3. Активація мастоцитів і базофілів.
Більшість реакцій ГНТ проявляється місцево, однак трапляється системний їх прояв. Основними
клітинами, що індукують алергічні реакції, є сенсибілізовані IgE мастоцити й базофіли. На цих
клітинах за допомогою високоафінного рецептора FcεRI фіксується IgE через домен Сε3 або
з'єднання Сε2-Сε3. Високоафінний FcRI існує на мастоцитах, базофілах, клітинах Лангерганса,
стовбурових клітинах ((2-3) • 10
5
рецепторів на клітину), а низькоафінний рецептор до IgE — FcεRII
(CD23) виявляється на В- і Т-лімфоцитах, еозинофілах, моноцитах, тромбоцитах. При повторному
потраплянні алергену в організм він проникає в слизові оболонки і зв'язується з фіксованими на
мастоцитах молекулами IgE, a при потраплянні в кров — з молекулами IgE на базофілах і
тканинних мастоцитах. При цьому відбувається перехресне зшивання FcεRI та їх агрегація. В
організмі розрізняють два типи мастоцитів — сполучнотканинні (містять фермент триптазу) і
мастоцити слизових оболонок (містять ферменти хімазу й триптазу).
Високоафінний FcεRI складається з трьох ланцюгів — α, β, γ. α-ланцюг розміщений на поверхні
клітин і відповідає за зв'язування з IgE, a β- і γ-ланцюги — всередині клітини. У мастоцитах і
базофілах з β- й γ-ланцюгами FcεRI зв'язана тирозинкіназа, яка при агрегації цих рецепторів
активується й активує фосфоліпазу С, що зумовлює утворення діацилгліцерину та
інозитолтрифосфату з фосфоінозитидів. Діацилгліцерин активує протеїнкіназу С, внаслідок чого
вона переміщується до мембрани клітини. Фосфоінозитид сприяє виходу кальцію з
внутрішньоклітинного депо та надходженню його з міжклітинного простору. Підвищена
концентрація кальцію за участю кальційзв'язувального білка кальмодуліну активує специфічну
кіназу, яка разом з активованою протеїнкіназою С руйнує комплекс актин — міозин, індукує рух
внутрішньоклітинних гранул до плазматичної мембрани, злиття їх між собою та з плазматичною
мембраною і викид вмісту гранул у міжклітинний простір (процес дегрануляції). Процес
дегрануляції триває кілька секунд. При цьому мастоцити залишаються життєздатними.
Зміна структури клітинної мембрани активує фосфоліпазу А2, яка запускає метаболізм арахідонової
кислоти по ліпооксигеназному або циклооксигеназному шляху з утворенням простагландинів (ПГ),
лейкотрієнів (ЛТ) і тромбоксанів. Ці ліпідні медіатори можуть зумовлювати хемотаксичиий ефект
для клітин крові, індукувати запальний процес (розширювати просвіт судин, активувати
комплемент) та спричинювати спазмогенний ефект на гладких м'язах бронхів, індукувати секрецію
слизу, сліз та інших виділень. Слід зазначити, що цей процес досить складний, у ньому бере участь
велика кількість різних ферментних та регуляторних білків. При цьому утворюються
транскрипційні фактори, що запускають синтез багатьох біологічно активних речовин, зокрема
цитокінів; активується метаболізм арахідонової кислоти.
У результаті активації та дегрануляції мастоцитів у навколишнє середовище потрапляє значна
кількість біологічно активних речовин, дія яких спрямована на ізоляцію і знешкодження чинника
процесу; при цьому можливі й ушкодження власних клітин. У перші 60 секунд із гранул
звільняються гістамін, серотонін, гепарин, фактор активації тромбоцитів (ФАТ), різні ферменти —
триптаза, хімаза, пероксидаза, β-глюкуронідаза, арильсульфатаза та ін. Через 10-45 хв як наслідок
активації арахідонової кислоти у позаклітинному просторі з'являються ейкозаноїди — лейкотрієни
С4, В4, D4, простагландин D2, тромбоксан А2; через 2-12 год активовані мастоцити продукують
інтерлейкіни 3, 4, 5, 8, 9, 10, 13, ГМ-КСФ, деякі хемокіни, ФАТ тощо.
Відомі факти активації мастоцитів без участі IgE. Деякі фактори, такі як ФГА, Кон А (яких багато в
ягодах та інших продуктах рослинного походження), здатні перехресне зв'язувати Fc-фрагменти
через вуглеводні залишки і зумовлювати реакції алергічного характеру. Компоненти комплементу
С3а та С5а, деякі лікарські речовини також можуть безпосередньо активувати мастоцити.
18.1.4. Патологічні прояви реакцій при ГНТ.
У розвитку реакцій ГНТ виділяють дві фази — ранню та пізню. Рання фаза (негайна реакція)
виникає у перші 10 — 20 хв після повторного контакту з алергеном. Продукти дегрануляції
ефекторних клітин взаємодіють з клітинами ендотелію та гладких м'язів судин, з клітинами крові
тромбоцитами і зумовлюють різноманітні ефекти. Найхарактерніші з них — розширення судин
(індуктори — гістамін пізніше ейкозаноїди, кініни); підвищення проникності судин (індуктор —
гістамін); ретракція ендотеліальних клітин (індуктори — лейкотрієни та ФАТ). Усі ці факти
сприяють виходу із кров'яного русла в навколишнє середовище лейкоцитів та рідини і формуванню
набряків, пухирів, еритеми, шкірних висипів, петехій (дрібних крововиливів). При ГНТ виникають
переважно поверхневі серозні запалення, які зумовлені інфільтрацією ПМЯЛ.
Напади бронхіальної астми зумовлюються спазмами гладких м'язів бронхів у результаті дії
лейкотрієнів С4 і D4, ПГ D2, тромбоксану А2, гістаміну. ЛТ індукують гіперпродукцію слизу,
діарею. Важливу роль у розвитку пізньої фази бронхіальної астми відіграють еозинофіли, для яких
ІЛ-5 є хемоатрактантом і активатором. У процесі активації еозинофіли виділяють основні білки
еозинофілів, які активують і руйнують ендотелій дихальних шляхів; при цьому створюються умови
для глибокого проникнення алергену і взаємодії медіаторів з нервовими закінченнями, що
спричинює бронхоспазм. У результаті активації ендотеліальних клітин вони продукують оксид
нітрогену (азоту), який здатний руйнувати не тільки патогени, а й прилеглі клітини.
Нерідко гостра фаза ГНТ може перейти у хронічну форму здебільшого завдяки накопиченню в зоні
процесу ІЛ-4, 5, 10, 13, які продукуються переважно Тх2 і мастоцитами та підтримують ріст і
розвиток мастоцитів, еозинофілів, Тх2 та індукують продукування IgE. Такий перебіг реакції
характерний для бронхіальної астми та інших алергічних захворювань.
Рання фаза реакції ГНТ, як правило, може швидко припинятися — у межах однієї години. Однак
нерідко може розвиватися пізня фаза — через 2 — 6 год після контакту з алергеном. У формуванні
пізньої фази беруть участь еозинофіли, базофіли, макрофаги, тромбоцити, нейтрофіли, які мігрують
у зону алергічного процесу завдяки активації адгезивних молекул, появі ІЛ-8 та інших
хемотаксичних факторів унаслідок дегрануляції мастоцитів і базофілів та активації інших клітин.
Активовані клітини виділяють речовини, які сприяють активації системи комплементу, та багато
інших біологічно активних речовин, функція яких спрямована на ізоляцію та знешкодження
чинника патологічного процесу та відновлення цілісності й функціональної активності ушкоджених
тканин і органів.
Системні алергічні реакції виникають у разі надходження в сенсибілізований організм великої дози
алергену, переважно парентеральне (при введенні лікарських препаратів), разом з харчовими
продуктами, при укусах комах тощо і характеризуються залученням у процес мастоцитів сполучної
тканини. Найвідоміші реакції цього виду — кропив'янка (в шкірі) та анафілактичний шок.
Анафілактичний шок виникає в перші хвилини після повторного введення алергену і виявляється як
гострою формою алергії — висипанням, свербежем, бронхоспазмом, розладом функції травного
каналу, так і ураженням серцево-судинної й дихальної систем — блідістю, слабістю, тахікардією,
зниженням кров'яного тиску, втратою свідомості і навіть загибеллю. Провідну роль у розвитку
анафілактичного шоку відіграє гістамін.
Встановлено, що в організмі існують фактори, здатні гальмувати розвиток алергічних реакцій.
Найвідоміші — це блокуючі специфічні антитіла класу G, які зв'язуються з алергенами і таким
чином перешкоджають взаємодії IgE з алергеном.
Для діагностики алергічних захворювань використовують кілька методів. Hайпростішим і досить
достовірним є шкірні проби — внутрішньошкірне або нашкірне введення алергену: у разі
позитивної реакції виникають негайна гіперемія, свербіж, набряк, утворюються пухирі. Peзультати
цього методу здебільшого збігаються з даними радіоалергосорбентного тесту на
алергеноспецифічний IgE.
Для лікування алергічних захворювань широко використовують десенсибілізацію — поступове
введення наростаючих доз алергену. При цьому спостерігається поява у сироватці
алергоспецифічних Т-клітин, збільшення рівня Тх1 і рівня алергеноспецифічних IgE та IgA.
18.2. ГІПЕРЧУТЛИВІСТЬ ТИПУ.
Однією з основних умов розвитку гіперчутливості типу II є утворення антитіл до нерозчинних
поверхневих структурних антигенів власних клітин або до субстрату позаклітинного матриксу
(ПКМ), або до речовин, які приєднані до власних антигенів. Поверхневі антигени власних клітин
або речовини ПКМ можуть індукувати утворення антитіл унаслідок дії різноманітних факторів, які
можуть тією чи іншою мірою змінювати структуру цих утворів. Це і дія фізичних чинників (різні
випромінювання), інфекції (особливо вірусні), переливання крові й транспланція органів, дія
лікарських препаратів, порушення толерантності до власних антигенів.
При утворенні на поверхні клітин комплексу антиген — антитіло подальший розвиток реакції може
відбуватися двома шляхами: або приєднанням до Fс-фрагмента антитіл клітин, що мають Fc-
рецетори (моноцити, макрофаги, нейтрофіли, еозинофіли, тромбоцити), або фіксацією на комплексі
антиген — антитіло CIq-компонента
комплементу і запуск активації
комплементу класичним шляхом (мал. 104)
Ефекторні клітини можуть приєднуватися
до комплексу не тільки через Fc-R, a й
шляхом взаємодії C3R з компонентами
комплементу С3b, С3bі, С3е, С3d, які
відкладаються на мембрані клітин у процесі
активації комплементу. Приєднання до
клітин хазяїна імуноглобулінів або
компонентів комплементу опсонізує їх і
робить доступними для ефекторних клітин.
При активації комплементу утворюється
значна кількість різноманітних за дією
біологічно активних речовин. Так,
компоненти С3а та С5а мають
хемотаксичну активність відносно
макрофагів та поліморфноядерних
лейкоцитів, активують мастоцити і
базофіли. При активації комплементу
утворюється кілька компонентів С3 — С3b,
С3bі, С3е, С3d, які відкладаються на
мембрані клітин поряд з комплексом
антиген — антитіло й опсонізують ці
клітини. Кінцевим продуктом активації
комплементу є утворення
мембраноатакувального комплексу — [С5b,
6, 7, 8, (9)n], який порушує цілісність
клітинної мембрани, що призводить до
загибелі клітини.
Унаслідок взаємодії з опсонізованими
клітинами активуються ефекторні клітини
(див. розд. 2) і виділяють численні
біологічно активні речовини — цитокіни,
хемокіни, лейкотрієни, простагландини,
лізосомні ферменти, високоактивні
метаболіти кисню й азоту, тобто весь
арсенал хемотаксичних, активувальних,
регулювальних і цитоцидних речовин, які
продукуються для знешкодження чинника
патологічного процесу. Оскільки
фагоцитарні клітини не здатні поглинути
опсонізовані клітини, вони здійснюють так
званий позаклітинний фагоцитоз —
виділяють у навколишнє середовище вміст
лізосом, у тім числі такі високотоксичні
речовини, як метаболіти кисню й азоту,
катіонні білки, різні ферменти, що
призводить до руйнування як клітин-
мішеней, так і прилеглих клітин, тобто
виявляється цитопатичний ефект
гіперчутливості типу II.
Антитіла можуть сприяти приєднанню
природних кілерів до клітин-мішеней
зшиванням Fc-R, у такий спосіб активувати
їх і спричинювати лізис клітин-мішеней за
допомогою цитокінів або екзоцитозу гранул
з ензимами, або індукування апоптозу.
Відомо багато захворювань, основою яких є
цитопатичні реакції гіперчутливості типу II
– посттрансфузійні реакції, гемолітичні
ракції новонароджених, аутоімунні та
гемолітичні анемії, дія цитотоксичних
сироваток. Серед них найвідоміші
захворювання крові, що зумовлені
антиеритроцитарними реакціями (лізисом
еритроцитів, що призводить до анемії). Вони можуть спричинюватися антигенами системи АВ0 в
разі переливання несумісної крові сенсибілізованим реципієнтам, антигенами системи резус,
тепловими протиеритроцитарними аутоантитілами, що утворюються до антигенів системи «резус» і
взаємодіють з еритроцитами за температури 37 °С, які в нормі руйнуються переважно макрофагами
селезінки. Певну роль в індукуванні анемії відіграють холодові протиеритроцитарні аутоантитіла до
антигенів системи крові Іі. Вони взаємодіють з еритроцитами за температури, нижчої ніж 37 °С.
Холодові аутоантитіла належать до IgM і міцно зв'язують комплемент, взаємодіючи з еритроцитами
в капілярах шкіри, де температура взимку може знижуватись до 30 °С. Це може зумовити агрегацію
еритроцитів, що призводить до закупорювання дрібних судин. Слід зазначити, що холодові
гемолітичні анемії найчастіше трапляються у літніх людей.
Реакції гіперчутливості типу II виявлено і при утворенні аутоантитіл до структурних елементів
тканинних антигенів. Так, нерідко при нефритах виявляються IgG до глікопротеїнів базальної
мембрани клубочкових капілярів. Вони можуть зв'язувати комплемент, активувати його, що може
призвести до розвитку патологічних процесів — некрозу клубочків і відкладання фібрину.
Відоме захворювання шкіри та слизових — пухирчатка — зумовлене антитілами класу G до
молекул міжклітинної адгезії, до компонента десмоглеїну-3, що формує контакти між клітинами
епідермісу. Аутоантитіла до десмоглеїну-3 індукують порушення цілісності епідермального шару,
що спричинює утворення пухирів на шкірі та слизових оболонках з тяжким перебігом
захворювання. Встановлено певну роль IgG-аутоантитіл і компонентів комплементу С3і та C3d у
розвитку злоякісної міастенії.
18.3. ГІПЕРЧУТЛИВІСТЬ ТИПУ III (ІМУНОКОМПЛЕКСНА РЕАКЦІЯ).
Основою виникнення гіперчутливості типу III є утворення розчинними антигенами і специфічними
антитілами (за оптимальної їх концентрації) розчинних комп-лексів у крові або тканинах. До
новоутворених комплексів приєднується C1q-компонент і запускається класичний шлях активації
комплементу з утворенням повного пулу активованих компонентів. Мононуклеарні фагоцити за
допомогою Fc-R та CR3-рецепторів поглинають імунні комплекси й утилізують їх. Еритроцити за
допомогою CR1-рецептора до С3b-компонента зв'язують імунні комплекси, транспортують їх до
селезінки та печінки і там утилізують. У печінці й селезінці місцеві тканинні макрофаги вилучають
імунні комплекси, здебільшого разом із CR1, що призводить до зменшення концентрації СR1 на
еритроцитах і, отже, до зниження ефективності розпізнавання й транспортування імунних
комплексів та видалення їх. Це спостерігається при системному червоному вовчаку. Ефективність
видалення комплексів залежить також від класу імуноглобулінів у комплексі: комплекси з IgG
видаляються з крові поступово, а імунні комплекси з IgA – швидко видаляються і відкладаються
переважно в легенях, нирках, мозку. Слід зазначити, що наявність комплексів у крові, як правило,
безпечна для організму, тільки відкладання їх у тканинах індукує патологічні реакції. Відкладанню
імунних комплексів можуть сприяти високий артеріальний тиск, турбулентний потік крові (в місцях
перегинання артерій), афінність антигенів тканини до антигенів комплексу, заряд антигену, ступінь
глікозилювання глікопротеїнових антигенів, розміри імунних комплексів. Певну роль у виведенні
імунних комплексів з організму відіграють нирки та печінка.
За певних умов — надлишку антигену, малого вмісту в крові комплементу або моноядерних
фагоцитів, їхніх дефектів, у разі пошкоджень судинної стінки, зниження функціональної активності
селезінки, утворення імунних комплексів імуноглобулінів, які не можуть взаємодіяти з FcR
макрофагів (IgA), можуть утворюватися великі мало- або зовсім нерозчинні комплекси, здатні

73
осаджуватися на ендотелії судин або в певних тканинах (мал. 105). Утворені внаслідок активації
хемотаксичні компоненти С3а і С5а та комплекс антитіло — антиген залучають у місця фіксації
нейтрофіли, макрофаги, еозинофіли, базофіли, мастоцити, тромбоцити і активують їх. При цьому
виділяється широкий набір цитокінів та інших регуляторних і цитотоксичних речовин. Мастоцити й
базофіли виділяють низку вазоактивних амінів, у тому числі гістамін, 5-гідрокситриптамін, які
зменшують розміри ендотеліальних клітин і в такий спосіб підвищують проникність ендотелію та
сприяють відкладанню імунних комплексів на ендотелії й міграції клітин крові, що сприяє запуску
запального процесу.
Імунні комплекси та продукти активації комплементу індукують агрегацію тромбоцитів, які
фіксуються на оголеній базальній мембрані ендотелію і формують мікротромби. Моноядерні
фагоцити виділяють ряд цитокінів, у тому числі ФНП та ІЛ-1, які відіграють важливу роль в
індукуванні запалення. Фагоцити не здатні поглинути фіксовані на судинній стінці імунні
комплекси і тому виділяють у навколишнє середовище біологічно активні речовини, в тому числі й
цитотоксичні фактори, що сприяє ще більшому ушкодженню прилеглих клітин. Слід зазначити, що
лізосомні ферменти фагоцитів у крові або тканинній рідині швидко інактивуються різними
місцевими інгібіторами та ферментами, а в місцях фіксації імунних комплексів зумолюють ще
більші ушкодження. У місцях агрегації тромбоцитів триває виділення ними амінів, стимулюється
утворення С3 і С5а, продукується ряд факторів росту, які сприяють проліферації деяких клітин, що
має місце при ревматоїдному артриті та гломерулонефриті.
Причиною відкладання імунних комплексів на ендотелії судин може бути ряд патологій,
найвідоміші з них — персистентні інфекції, аутоімунні захворювання та захворювання, зумовлені
ушкодженням легень неінфекційного характеру.
При більшості персистентних (хронічних, «дрімаючих») інфекцій відбувається виділення в кров
бактеріальних або вірусних антигенів і формування слабкої гуморальної відповіді, що зумовлює
постійне утворення імунних комплексів, відкладання їх на стінках ендотелію в певних тканинах і
запуск реакцій імунного комплексу. Це спостерігається при хронічних інфекціях, особливо вірусних
(вірусному гепатиті, геморагічній пропасниці Денге та ін.), бактеріальних (стафілококовому
ендокардиті, проказі), при захворюваннях, спричинюваних найпростішими (малярії).
Для аутоімунних захворювань характерне постійне утворення антитіл до аутоантигенів і
формування імунних комплексів. За певних вад систем, які утилізують імунні комплекси
(моноядерні фагоцити, еритроцити, комплемент, селезінка, печінка, нирки) кількість імунних
комплексів зростає і створюються умови для їх відкладання на ендотелії судин та запуску
імунокомплексного захворювання. Найвідоміші захворювання цієї етіології — системний червоний
вовчак, ревматоїдний артрит, поліміозит, деякі форми нефриту. Серед патологічних процесів,
індукованих імунними комплексами, відомі захворювання легень, зумовлені вдихуваними
антигенами (переважно грибного, рослинного та тваринного походження). Із антигенів грибного
походження в легені найчастіше потрапляють антигени актиноміцетів (із запліснявілого сіна —
«легені фермерів»), з антигенів тваринного походження (білки екскрементів птахів — «легені
голубівників») та ін. При цих патологіях за повторних вдихань в альвеолах утворюються імунні
комплекси, до складу яких входять переважно IgG, і розвивається алергічний альвеоліт із розвитком
фіброзу.
В експериментальних умовах індукується низка моделей хвороб імунних комплексів — феномен
Артюса, сироваткова хвороба у мишей деяких ліній (NZB/ NZW). Так, при постійному введенні
кролям чужорідного білка (найчастіше альбуміну сироватки телят) у них формується
імунокомплексна хвороба, переважно в нирках.
Внутрішньошкірне введення сенсибілізованим тваринам розчинного антигену індукує
імунокомплексне захворювання — реакцію Артюса, що характеризується появою через 4-10 год
набряку з крововиливом; через 48 год реакція згасає.
Для діагностики захворювань гіперчутливості типу III визначають наявність імунних комплексів та
їх склад в уражених тканинах за допомогою імунофлуоресценції зрізів певних тканин, а в крові —
осадженням імунних комплексів поліетиленгліколем, а також за спорідненістю до компонентів
комплементу C1q та С3.
Лікування імунокомплексних захворювань спрямоване на зниження рівня надходження антигену та
на створення умов, які гальмували б утворення нерозчинних комплексів і відкладання їх на
тканинах. Цьому сприяє гемосорбція та наявністі повноцінної системи комплементу. В
експериментальних умовах швидкій солюбілізації комплексів та швидкому їх видаленню сприяє
введення плазми здорових осіб.
18.4. ГІПЕРЧУТЛИВІСТЬ ТИПУ IV (ГІПЕРЧУТЛИВІСТЬ СПОВІЛЬНЕНОГО ТИПУ).
Уперше реакцію гіперчутливості сповільненого типу (ГСТ) виявив Р. Кох при підшкірному введенні
інфікованим туберкульозними бактеріями людям бульйонної культури туберкульозної палички. Це
спричинило появу через 24 — 48 год на місці введення антигену почервоніння, ущільнення шкіри та
інфільтрату, підвищення температури тіла. Причиною виникнення такої реакції Р. Кох вважав
токсичну дію введеної культури бактерій. Пізніше було встановлено, що ця реакція є результатом
прояву реакції гіперчутливості сповільненого типу. Це відкриття почали широко використовувати
для діагностики туберкульозу людини і тварин, а також інших захворювань, що супроводжуються
формуванням реакцій ГСТ.
Реакції ГСТ відрізняються від перших трьох типів реакцій гіперчутливості тим, що їх формування
не залежить від наявності або циркуляції в крові імуноглобулінів, а зумовлене клітинними
факторами — сенсибілізованими Т-лімфоцитамц й макрофагами, і тим, що ця чутливість може бути
перенесена Т-лімфоцитами сенсибілізованих осіб. Унаслідок сенсибілізації утворюються специфічні
Т-клітини пам'яті до цього антигену.
Виникнення ГСТ зумовлене в основному формуванням захисних реакцій на ізоляцію і
нейтралізацію чужорідного агента, особливо при інфекційних, інвазійних захворюваннях та
онкопроцесах. Однак при цьому можуть розвиватися і патологічні процеси — запалення, деструкція
клітин, гранульоми, екземи, аутоімунні захворювання тощо. ГСТ трапляється в усіх видів тварин,
але характер перебігу реакцій у багатьох випадках залежить від виду живих істот, їх віку, статі,
генетичних особливостей, виду антигену, його дози, місця введення тощо. Патологічні процеси при
ГСТ можуть виникати в будь-якому органі або тканині, що зумовлено локалізацією антигену або
місцем утворення антигенів. Однією з умов виникнення ГСТ є нездатність АПК швидко руйнувати
антиген.
ГСТ індукується сенсибілізованими Т-лімфоцитами при повторному введенні специфічного
антигену (мал. 106). Залежно від характеру проявів реакції ГСТ у сенсибілізованих осіб при
повторному нашкірному або внутрішньошкірному введенні антигену виділяють три типи реакцій
ГСТ — туберкулінову, гранулематозну та контактну. Усі ці реакції можуть індукуватися одним і
тим самим антигеном і виявлятися за певних умов одночасно, перекриваючи одна одну при
повторному внутрішньошкірному або нашкірному введенні специфічного антигену.
Класичними індукторами ГСТ є різні мікроорганізми, гриби, гельмінти, найпростіші, особливо
внутрішньоклітинні, та сторонні часточки, що потрапляють у внутрішнє середовище організму.
Живі, а також патогенні організми індукують ГСТ ефективніше порівняно з мертвими та
непатогенними. Найчастіше реакції ГСТ виникають при таких захворюваннях, що індукуються
внутрішньоклітинними патогенами в разі бактеріальних (туберкульоз, проказа, бруцельоз,
індуковані мікобактеріями захворювання) та вірусних (епідемічний паротит) інфекцій, при мікозах
(кандидоз, бластомікоз, кокцидіомікоз, гісиоплазмоз тощо), при гельмінтозах. Певну роль в
індукуванні ГСТ відіграє утворення L-форм мікроорганізмів і тривала персистенція патогенів. ГСТ
можуть спричинюватися й білками, особливо агрегованими. Низка факторів сприяють формуванню
ГСТ до деяких антигенів. Так, введення певних антигенів разом з ад'ювантом Фрейнда або
масляними емульсіями зумовлює формування ГСТ до цих антигенів. Численні хімічні речовини,
лікарські препарати, речовини рослинного походження з властивостями гаптенів здатні при контакті
зі шкірою спричинювати реакції, подібні до ГСТ.
Слід зазначити, що в експериментальних умовах формування ГСТ значною мірою залежить від виду
антигену, дози та місця його введення. Найефективнішим для індукування ГСТ є внутрішньошкірне
введення антигену в невеликих дозах. У разі потрапляння в слизові оболонки або шкіру антигени
захоплюються АПК: у шкірі — дендритними клітинами Лангерганса, у слизових оболонках —
подібними до клітин Лангерганса дендритними клітинами та макрофагами, у тканинах і органах
чужорідні антигени поглинаються макрофагами. Після часткового перетравлювання АПК фіксують
на своїй поверхні пептидні фрагменти антигену разом з молекулами МНС класу II і лімфатичними
судинами мігрують у регіонарні лімфатичні вузли. В процесі поглинання, перетравлення і
презентації антигенних пептидів АПК активуються і виділяють ряд медіаторів, які сприяють
диференціюванню СD4Т-лімфоцитів (Тх0) у Тх1. У лімфовузлах АПК представляють асоційовані з
молекулами МНС класу ІІ антигенні пептиди CD4T-лімфоцитам, які формують популяцію
довгоіснуючих клітин імунної пам'яті.
Активовані АПК секретують цитокіни (ФНП-α, ІФН-γ, ІЛ-12), що активують Тх1 і гальмують
виділення цитокінів Тх2, сприяючи таким чином формуванню Тх1-залежних реакцій (Т-клітинні
реакції). Як правило, антигенспецифічні клітини імунної пам'яті взаємодіють не з самим антигеном,
а з комплексом фрагмент пептиду — молекула МНС класу II на АПК. Ця взаємодія індукує
бласттрансформацію та поділ Т-клітин пам'яті й утворення ефекторних клітин ГСТ. Активовані Т-
лімфоцити виділяють цитокіни ІФН-γ, ФНП-α, ІЛ-3, ГМ-КСФ, які сприяють формуванню зрілих
макрофагів із незрілих, їх активації та знешкодженню внутрішньоклітинних патогенів. Подальший
хід подій залежить від виду реакцій ГСТ.
18.4.1. Сповільнена гіперчутливість туберкулінового типу.
При більшості внутрішньоклітинних інфекцій
в організмі відбувається сенсибілізація Т-
лімфоцитів і утворення специфічних клітин
імунної пам'яті. Після контакту з
асоційованим з АПК специфічним антигеном
Т-клітини імунної пам'яті активуються і
виділяють значну кількість цитокінів.
Секретують цитокіни також активовані АПК
та резидентні макрофаги. Певну роль в
індукуванні ГСТ відіграють мастоцити. Вони
регулюють формування ГСТ через виділення
ФНП-α і СХСL (1 – 3), які є ефективними
хемоатрактантами для нейтрофілів, базофілів,
макрофагів. Крім того, мастоцити можуть
здійснювати процесинг і презентацію
антигену СD4Т-лімфоцитам. Ці цитокіни
сприяють формуванню реакцій ГСТ
туберкулінового типу. В перші 1 – 2 год
виділені активованими клітинами ФНП-α та
ФНП-β індукують на ендотелії судин шкіри
експресію Е-селектину, що сприяє
короткочасній (перші 4 год) міграції
нейтрофілів у зону наявності антигену.
Пізніше (через 12 год) на ендотелії судин
індукується експресія адгезивних молекул
ІСАМ-1 та VCAM-1, які здатні зв'язуватися з
інтегринами LFA-1 та VLA-4 на моноцитах і
лімфоцитах, сприяючи таким чином їх міграції
в дерму та формуванню інфільтрату. Перші
ознаки реакції — почервоніння, інфільтрація,
ущільнення шкіри — з'являються через 4 — 6
год і посилюються впродовж 24 — 48 год.
Інфільтрати досягають максимального розміру
через 48 год і складаються переважно з
макрофагів (80 — 90 %) та Т-лімфоцитів.
Серед Т-лімфоцитів СD4Т-клітин вдвічі
більше, ніж СD8T-клітин. Реакція згасає через
5 — 7діб. Під час реакцій туберкулінового типу нерідко мають місце васкулярно-некротичні
ураження, зумовлені ушкодженням стінок судин. Це спричинено, очевидно, контактом
сенсибілізованих Т-лімфоцитів зі специфічним антигеном у просвіті судин.
18.4.2. Сповільнена гіперчутливість ґранулематозного типу.
У разі неспроможності захисних сил організму знешкодити внутрішньоклітинні патогени або тверді
часточки, наявні у клітинах, виникає персистенція фактора в певних тканинах та постійне виділення
різних медіаторів, що сприяє формуванню гранулематозних утворів. У виникненні гранульом
важливу роль відіграє ФНП; антитіла до ФНП інгібують формування гранульом. Утворенню
гранульом сприяють медіатори, що виділяються активованими клітинами. Серед них
найважливішими є: а) фактори, що сприяють міграції клітин із захисними функціями в зону
наявності антигену; б) фактори, що активують клітини в місці дії чинника процесу; в) фактори, що
гальмують міграцію макрофагів із зони запалення; г) фактори, що індукують агрегацію макрофагів;
д) рістактивувальні фактори, що сприяють росту фібробластів і кровоносних судин. Фактори, що
індукують агрегацію й гальмування міграції макрофагів, створюють навколо запального процесу
ізоляційні зони. У разі тривалої дії антигенних стимулів із макрофагів утворюються епітеліоїдні
клітини, які внаслідок постійної антигенної стимуляції можуть зливатися й утворювати багатоядерні
гігантські клітини. У міру диференціювання макрофагів у гігантські клітини збільшується
продукування ними ФНП. Як правило, в центрі гранульом містяться макрофаги епітеліоїдні клітини
та прилеглі до них лімфоцити. Інколи в центрі гранульом виникають зони некрозу. Активовані
лімфоцити, макрофаги та інші клітини можуть виділяти різні ростові фактори, що сприяють
проліферації навколо гранульом фібробластів та синтезу ними колагену, який відкладається на
поверхні гранульом. За тривалого існування гранулематозних утворів ростові фактори сприяють
утворенню кровоносних судин.
Реакції ґранулематозного типу розвиваються при внутрішньоклітинній, переважно при
внутрішньомакрофагальній, персистенції патогенів (при туберкульозі, проказі, бруцельозі,
шистосоматозах тощо) та непатогенних факторів (при саркоїдозі, хворобі Крона). Під час
гранулематозних реакцій можуть виникати ушкодження певних тканин і органів унаслідок
утворення та вивільнення в навколишнє середовище значної кількості цитоцидних факторів
(високоактивних метаболітів кисню й азоту, катіонних білків та різних ферментів), що можуть
ушкоджувати сусідні клітини й тканини. Крім того, утворення гранульом сприяє зменшенню
кількості специфічних клітин певних органів і тканин, що зумовлює зниження їх функціональної
активності. Так, при локалізації бруцел у кістковій тканині, суглобах, хрящах навколо них можуть
формуватися гранульоми.
18.4.3. Сповільнена гіперчутливість контактного типу.
Особливе місце серед реакцій ГСТ посідає контактна гіперчутливість, за якої на місці взаємодії з
антигеном виникає екзематозна реакція. Контактна гіперчутливість індукується переважно
гаптенами, низькомолекулярними сполуками з молекулярною масою до 1 кД, які не мають
антигенних властивостей. Гаптени проникають через епідерміс та міжклітинний простір у дерму, де
вони взаємодіють з ділками організму і набувають антигенних властивостей. Гаптени зв'язуються з
білками організму різними способами — через NH-групу залишків лізину, окиснення ненасичених
вуглеводних зв'язків гаптенів тощо. Індукувати контактну гіперчутливість здатні певні речовини,
такі як динітрохлорбензол, хром і нікель та їхні похідні, пікрилхлорид, оксазолон, епоксидна смола
та ін. Хром входить до складу різних мастил, барвників, антикорозійних та дубильних речовин.
Новоутворені сполуки гаптен — білок шкіри розпізнаються, поглинаються і частково
перетравлюються дендритними клітинами шкіри — клітинами Лангерганса, які експресують
поверхневий маркер CD1, антигени МНС класу II, рецептори FcR і до комплементу, а в цитоплазмі
містять специфічні бербекові гранули, які беруть участь у поглинанні чужорідних агентів.
Одночасно чужорідні агенти активують кератиноцити, що індукує синтез і виділення ними
імунорегуляторних факторів — ФНП-α, ГМ-КСФ, ІЛ-1, ІЛ-3, ІЛ-6, ІЛ-8, ТФР-α, ТФР-β. Цитокіни,
ІЛ-3, ФНП-α, ГМ-КСФ та інші активують клітини Лангерганса, ІЛ-3 залучає мастоцити та стимулює
секрецію ними ІЛ-10 і ТФР-β, які пригнічують функцію Тх1. Клітини Лангерганса з частково
переробленими і асоційованими з молекулами МНС класу II кон'югатами гаптен — білок мігрують
аферентними лімфатичними судинами в паракортикальну ділянку регіонарних лімфовузлів і
презентують його CD4 Т-клітинам. З цих лімфоцитів формується пул клітин імунної пам'яті. Процес
сенсибілізації у людини триває 10-14 діб. Сенсибілізовані Т-лімфоцити мігрують по всьому
організму; в шкірі вони накопичуються в капілярах.
Після повторного проникнення того самого гаптену клітини Лангерганса презентують комплекс
гаптен — носій у дермі Т-клітинам імунної пам'яті, які активуються і виділяють ІФН. Активуються
також й інші клітини — макрофаги, мастоцити, кератиноцити, які виділяють ряд прозапальних
цитокінів — ІФН-γ, ФНП-α, ГМ-КСФ, ТФР-β, ІЛ-1, ІЛ-3, ІЛ-6, ІЛ-8. Під впливом цих цитокінів на
ендотелії капілярів шкіри та кератиноцитах експресуються ІСАМ-1 й молекули МНС класу II,
залучаються в процес інші клітини — антигеннеспецифічні CD4 Т-лімфоцити, макрофаги,
мастоцити.
Під впливом різних цитокінів та інших медіаторів у місця знаходження комплексу антиген —
антитіло мігрує велика кількість клітин крові і мастоцитів, які активуються. Вияви реакції
спостерігаються через 15 — 20 год у вигляді інфільтрації епідермісу з набряками, утворенням
пухирців. ПМЯЛ, мастоцити, тканинні базофіли, еозинофіли внаслідок активації дегранулюють, і у
навколишнє середовище потрапляє великий набір цитолітичних і бактерицидних речовин,
ферментів тощо. Вони здатні не тільки ізолювати й знешкоджувати чинники процесу, а й руйнувати
власні клітини. Тому нерідко при контактній ГСТ спостерігається деструкція клітинних елементів
шкіри — сполучнотканинних та епітеліальних клітин — і формування екземи.
За сприятливих умов кон'югати гаптен — білок руйнуються біологічно активними речовинами та
клітинними факторами і через 48 — 72 год реакції починають загасати. В процесі активації різні
клітини індукують і гальмівні фактори.
Так, продукований активованими кератиноцитами ІЛ-1 інгібує окисний метаболізм у макрофагах і
гальмує виділення ними прозапальних цитокінів — ІФН-γ, ІЛ-6, ГМ-КСФ. ПГЕ, а також ТФР, що
продукуються активованими мастоцитами, лімфоцитами й кератиноцитами, інгібують запалення та
продукування проліферативних факторів — ІЛ-1, ІЛ-2. ІЛ-10 пригнічує продукування цитокінів Тх1
та експресію молекул МНС класу II, що гальмує розвиток реакцій контактної гіперчутливості.
Гальмуванню контактної гіперчутливості сприяють також руйнування ферментами комплексу
гаптен — білок і зв'язування Т-клітин з кератиноцитами.
Серед захворювань, в основі яких лежить контактна ГСТ, найвідомішим є контактний дерматит.
Реакції гіперчутливості, опосередковані клітинними факторами, можуть зумовлювати як
патологічні, так і захисні ефекти. Одним із важливих елементів позитивного значення реакцій ГСТ є
підтримання сталості внутрішнього середовища організму. Вони відіграють певну роль у захисних
протипухлинних реакціях при формуванні аутоімунних захворювань та стійкості до деяких
патогенів. Клітинні реакції ГСТ є провідним фактором у відторгненні трансплантата.
Для діагностики захворювань, що супроводжуються реакціями ГСТ, використовують в основному
такі тести: in vivo -. шкірна проба, in vitro — реакція бласттрансформації лімфоцитів у культурі
клітин за наявності специфічного антигену і визначення наявності фактора, що гальмує міграцію
макрофагів.
ВИСНОВКИ.
Імунна відповідь здійснює не тільки захисні функції, а й за певних умов може бути причиною
виникнення деяких патологічних процесів. Одним із найпоширеніших проявів патологічних змін,
зумовлених імунною системою, є гіперчутливість.
Виділено чотири типи (І, II, III, IV) гіперчутливості. Провідну роль в індукуванні та формуванні
реакцій гіперчутливості І, II і III типів відіграють розчинні фактори — імуноглобуліни, а реакцій
підвищеної чутливості IV типу — сенсибілізовані Т-лімфоцити та інші клітини.
Патогенез ушкоджень гіперчутливості типу І (алергічні, атонічні, анафілактичні, реагінові)
залежить від продукування антитіл-реагінів — IgE, які фіксуються на рецепторах мастоцитів.
Активація специфічним алергеном мастоцитів, сенсибілізованих IgE, призводить до дегрануляції
мастоцитів і виділення біологічно активних медіаторів.
Найчастіше результатом розвитку подій є локальні алергічні реакції, однак іноді розвиваються
системні алергічні реакції, що призводять до тяжких наслідків — анафілактичного шоку, набряку
Квінке, астматичного статусу. Т-хелпери І типу відіграють ключову роль у регуляції ІgE-відповіді
та формуванні алергічних реакцій. У виникненні реакцій гіперчутливості типу І важливу роль
відіграють генетичні фактори — існує родинна схильність до алергічних захворювань.
Реакції гіперчутливості типу II (цитотоксичні) зумовлені імуноглобулінами класів G і М. Антитіла
продукуються до антигенних детермінант, зосереджених на клітинах організму. Ушкодження
відбувається внаслідок активації комплементу, активації фагоцитозу клітин, вкритих антитілами,
механізмів антитілозалежної клітинної цитотоксичності. Прикладами порушень такого типу є
реакції на переливання несумісної крові, Rh (peзус)-конфлікт матері й дитини, різні типи
аутоімунної патології, деякі форми алергії на лікарські засоби, яка призводить до ураження клітин
крові — гемолітичної анемії, агранулоцитозу, тромбоцитопенічної пурпури.
Гіперчутливість типу III (імунокомплексна) пов'язана з реакціями ушкодження тканин організму, що
спричинюються розчинними імунними комплексами антиген — антитіло. Властивості комплексу
визначаються його складом, класом і підкласом антитіл, співвідношенням молекул антигену і
антитіл. Класичним проявом імунокомплексної патології є феномен Артюса і сироваткова хвороба.
Цей тип є провідним у розвитку екзогенних алергічних альвеолітів, низки аутоалергічних хвороб
(ревматоїдний артрит, системний червоний вовчак, колагенози та ін.).
74
Гіперчутливість типу IV (сповільнена) опосередкована CD4 Т-лімфоцитами. Активовані
антигенспецифічні Т-хелпери типу І мобілізують різні клітини організму за допомогою низки
медіаторів. Відомо три типи реакцій гіперчутливості сповільненого типу: туберкулінова,
гранулетозна та контактна. Реакції сповільненого типу є основою деяких варіантів
інфекційнозалежних форм бронхіальної астми, риніту, аутоалергічних захворювань, інфекційно-
алергічних захворювань (туберкульозу, лепри, бруцельозу, сифілісу та ін.).
Контрольні запитання.
1. Що об'єднує імунні та алергічні реакції і що їх відрізняє?
2. Чим відрізняється антиген від алергену?
3. З чим пов'язане постійне зростання алергічних хвороб серед населення планети?
4. У чому полягає еволюційна роль виникнення імуноґлобулінів класу Е?
5. Які медіатори беруть участь у розвитку реакцій гіперчутливості І, II, III і IV типів?
6. Які фактори зумовлюють персистенцію імунних комплексів в організмі?
7. Які механізми формування гранулематозних реакцій?
РОЗДІЛ 19. АУТОІМУННІ ПРОЦЕСИ ТА АУТОІМУННІ ЗАХВОРЮВАННЯ.
Аутоімунні процеси — це такий стан організму, за якого відбувається продукування антитіл або
сенсибілізованих лімфоцитів до нормальних антигенів власного організму.
Дослідникам ще наприкінці XIX ст. були відомі прояви аутореактивності. Ж. Борде показав
можливість появи ізоантитіл, що аглютинують еритроцити, у морських свинок. У 1900 р.
аутоімунну реакцію було відмічено українським патологом В. К. Ліндеманом у дослідах з
утворенням нефро- та сперматотоксинів у тварин після введення їм гомологічних тканин.
Аналогічні експерименти було відтворено лише в 1933 р. японським дослідником Мазугі, з ім'ям
якого пов'язують розвиток учення про імунопатогенез нефриту. У людини утворення антитіл проти
еритроцитів власного організму виявили Донат і Ландштейнер у 1904 р. Аутоімунне захворювання
вперше описали в 1933 р. Ріверс і Швенткер, яким вдалося відтворити алергічний енцефаліт у мавп
повторним введенням тканин мозку, попередньо оброблених за допомогою автолізу. В наступні
роки було показано, що спричинювати аутоімунні реакції значно легше за допомогою ад'ювантів,
завдяки чому ад'ювант почали широко використовувати не лише в експериментальній, а й у
клінічній імунології.
Здатність організму протистояти розвитку аутоагресивних імунних реакцій формується ще в
процесі онтогенезу. Вирішальну роль при цьому відіграє тимус, який є первинним місцем
диференціювання Т-лімфоцитів і генерації репертуару Т-клітинних рецепторів. Механізми
негативної селекції лімфоїдних клітин у тимусі призводять до програмованої загибелі клітини —
апоптозу Т-лімфоцитів, що здатні розпізнавати аутологічні пептиди в складі молекул МНС. Однак
відомо, що серед Т-клітин, які надходять з тимуса на периферію, трапляються аутореактивні
клітини. Стримування реактивності таких клітин у периферичних лімфоїдних органах реалізуються
за допомогою різних механізмів, одним із яких є індукування анергії, що здійснюється за участю
цитокінів, медіаторів, клітин-супресорів, ідіотип-антиідіотипічних взаємодій, простагландинів,
гормонів тощо.
Негативної селекції в процесі дозрівання зазнають і В-лімфоцити. Вважають, що індукування
аутотолерантності також відбувається як унаслідок загибелі, так і анергії аутореактивних В-клітин.
Це залежить від ефективності зв'язування аутоантигену і В-клітинного рецептора. Якщо зв'язок
міцний, високоефективний, це зумовить елімінацію аутореактивної В-клітини. Слабке перехресне
зв'язування аутоантигену, навпаки, індукує толерантність або анергію В-лімфоцита. Якщо
аутореактивні В-лімфоцити збереглися в процесі диференціювання, то можливість розвитку
аутоімунної відповіді потребує підтримки аутореактивних Т-хелперів. Відсутність костимуляції з
боку Т-хелперів призводить до загибелі аутоспецифічних В-лімфоцитів у зародкових центрах.
Анергія В-клітин пов'язана зі зниженням експресії IgM-рецепторів. Недостатня активність
анергічних В-клітин може бути відновлена під дією цитокінів та поліклональних стимуляторів.
Таким чином, не всі аутореактивні Т- і В-клітини елімінуються в процесі диференціювання, багато
аутореактивних клітин завжди наявні в організмі. Доказом є експериментальні дослідження з
уведенням тваринам аутоантигенів разом з ад'ювантами, що зумовлює розвиток аутореактивності у
здорових тварин. Аутореактивні Т-клітини з крові здорових донорів можна активувати відповідним
аутоантигеном у комплексі з ІЛ-2. За допомогою процедури клонування отримано клони Т-клітин,
які розпізнають аутологічні антигенні пептиди.
19.1. АУТОАНТИГЕНИ.
Аутоантигени — речовини власних нормальних тканин, а також будь-яка тканина організму, що
змінила свої фізико-хімічні властивості. Антитіла, що утворилися до таких антигенів, називаються
аутоантитілами.
За класифікацією А.Д. Адо, аутоантигени названо «ендоантигенами» і розподілено на дві групи:
природні, первинні — антигени «забар'єрних» тканин (кришталик, нервова тканина та ін.); набуті,
вторинні — антигени (патологічні тканини), які, в свою чергу, поділяють на неінфекційні
(утворюються під дією таких фізичних чинників, як високі й низькі температури, йонізуюче
випромінювання, а також хімічних чинників), та інфекційні (виникають у разі дії на тканини
мікробних, вірусних, грибних, паразитарних агентів).
Аутоантигенами є антигени «забар'єрних» тканин (головного мозку, кришталика, яєчок,
щитоподібної залози, сперми), які в ембріональному періоді не контактували з імунокомпетентними
клітинами До таких аутоантигенів імунної толерантності немає, оскільки органи, що їх містять
відділені гістогематологічними бар'єрами, через які лімфоцити не проникають. Якщо екстракт з
тканин мозку чи яєчок парентерально ввести сингенним тваринам, то синтезуються антитіла, а при
парентеральному введенні екстрактів з ад'ювантом виникають аутоімунні ураження.
Найчастіше аутоантитіла утворюються до власних тканинних компонентів, змінених під дією
лікарських речовин, токсинів і ферментів бактерій, антигенів вірусів. Аутоантигени можуть
з'явитися внаслідок денатурації власних білків організму під дією фізичних чинників, таких як
низькі й високі температури, опромінення, а також у разі порушення синтезу білків та утворення
аномальних білків (амілоїдоз). Часто першопричина, що зумовила утворення антитіл, залишається
непоміченою і процес набуває патологічного самопідтримувального характеру.
Аутоантитіла можуть виникати і до власних незмінених тканинних антигенів. При аутоімунному
тиреоїдиті виявляються антитіла, спрямовані проти нормального тиреоглобуліну, а при аутоімунній
гемолітичній анемії — проти нормальних власних еритроцитів.
19.2. АУТОАНТИТІЛА.
Тривалий час аутоімунні процеси пов'язували головним чином з наявністю аутоантитіл, при цьому
виявлення аутоантитіл розглядалося здебільшого як патологічний процес. Однак виявлення
аутоантитіл ще не є показником аутоагресії. Дослідникам вже в 40-х роках ХХ ст. Було відомо, що
аутоантитіла виявляються не тільки при захворюваннях (інфекційних, неінфекційних), а й при
багатьох фізіологічних станах у здорових людей. Нормальні аутоантитіла визначаються навіть у
сироватках крові новонароджених. Для пояснення наявності аутоантитіл в організмі без проявів
патології було вироблено критерії, що визначали аутоімунну природу захворювання:
- у хворих мають визначатися антитіла;
- може бути ідентифікований і виділений антиген, з яким вони реагують;
- показана можливість індукування антитіл до аутоантигену в експериментальних тварин і розвиток
симптоматики, аналогічної тій, що спостерігається при відповідному захворюванні у людини.
Ці критерії були сформульовані Е. Вітебським.
Нормальні аутоантитіла. Аутоімунні процеси відбуваються в організмі за нормальних
фізіологічних умов і тому нормальні аутоантитіла виявлено в сироватці всіх хребетних, що
синтезують антитіла, і майже до всіх органів і тканин. У сироватці крові всіх людей містяться у
невеликих кількостях аутоантитіла, які реагують з ДНК, компонентами цитоскелета, мієліном,
актином, тубуліном, сироватковим альбуміном, тиреоглобуліном, цитохромом с, колагеном,
кардіоліпіном, трансферином, з компонентами клітин серця, нирок, еритроцитами, фібробластами. З
віком титр цих антитіл зростає. Показано, що у людини з віком підвищується сенсибілізація
лімфоцитів до основного протеїну мозку, що корелює з титрами циркулюючих антитіл. Їх наявність,
можливо, індукується внаслідок руйнування клітинних і субклітинних структур, для видалення яких
і призначені утворювані антитіла.
Нормальні аутоантитіла — це переважно низькоафінні IgM, тоді як під час хвороби найчастіше
продукуються високоафінні IgG. Вважають, що СD5В1-лімфоцити, які виробляють «природні»
поліспецифічні IgM антитіла у передімунних тварин, є першою лінією захисту проти патогенних
організмів. У нормі функція аутореативних Т- і В-лімфоцитів не виходить за певні межі (кількість
аутоантіл завжди невелика). Дослідники вважають, що природні аутоантитіла можуть виконувати в
організмі функцію транспортних білків і видаляти продукти клітинного метаболізму та деструкції,
бути факторами регуляції імунного гомеостазу, брати участь у тканинній репарації тощо.
Типовим прикладом фізіологічної й регуляторної ролі аутоантитіл є існування антиідіотипічних
антитіл. Розпізнавання унікальних детермінант варіабельних регіонів В- чи Т-клітинних рецепторів
і паратопів секретованих імуноглобулінів відіграє важливу роль у механізмах імунорегуляції.
Антитіла, що при цьому синтезуються, є фактично аутоантитілами, які регулюють розвиток імунної
відповіді – гуморальної чи клітинної.
Таким чином, аутоімунні процеси в організмі є проявом нормального функціонування імунної
системи. Наявність аутоантитіл є недостатнім для розвитку аутоімунного захворювання. Доказом
цього є наявність, як правило, невеликої кількості аутоантитіл до різних тканинних антигенних
субстанцій у здорових людей, поява їх при деяких патологічних станах, що не належать до
аутоімунних, наприклад інфаркті міокарда, інфекційних хворобах, гострих запальних процесах, де
вона має тимчасовий характер і не є причиною деструктивних явищ. Введення нормальним
тваринам аутологічних білків (без ад'ювантів або підсилювачів імунної відповіді), а також
ушкодження тканин, яке супроводжується вивільненням аутоантигенів у циркуляцію, не
супроводжується розвитком аутоагресії.
Аутоантитіла при патологіях. Аутоантитіла виявляють при багатьох синдромах і захворюваннях.
Вони можуть утворюватися до різних аутоантигенів: антигенів клітинної поверхні і клітинних
рецепторів, цитоплазматичних і ядерних антигенів, стромальних позаклітинних речовин,
імуноглобулінів, розчинних антигенів (фосфоліпіди, міозин, протромбін, тромбопластин) та ін.
Підтвердженням патологічної дії антитіл на тканини можуть слугувати експериментальні
дослідження зі штучного перенесення аутоагресії за допомогою сироватки від хворих або при
пасивному надходженні аутоантитіл від вагітної матері до плоду. Зумовлені аутоантитілами
ушкодження виникають у результаті реакції антиген – антитіло та реалізації відомих механізмів
гіперчутливості – цитотоксичного (при гемолітичній анемії та інших аутоімунних ушкодженнях
клітин крові) та імунокомплексного (наприклад, при системному червоному вовчаку). При деяких
захворюваннях спостерігається стимулювальний чи пригнічувальний вплив антитіл. Наприклад, при
тиреотоксикозі (хвороба Грейвса) аутоантитіла до рецепторів стимулюють вироблення тиреоїдних
гормонів, а при перніціозній анемії перешкоджають всмоктуванню вітаміну В
12
, що зумовлює
розвиток анемії.
Дані про взаємозв'язки титрів аутоантитіл з вираженими патологічними змінами суперечні: є дані як
про пряму, так і про зворотну залежність. Оскільки найчастіше виявляють лише не зв'язані
тканинами надлишкові органні чи тканинні аутоантитіла, то навряд чи титри аутоантитіл у
сироватці крові можуть характеризувати динаміку аутоімунного процесу.
При аутоімунних процесах у сироватці крові виявляють повні й неповні аутоантитіла. Серед
типових аутоантитіл є антитіла класів М і G. Останні часто бувають неповні і можуть проникати
крізь плаценту. До них належать неповні гемаглютиніни — протиеритроцитарні антитіла, які
виявляють при гемолітичних анеміях. Існують теплові (оптимум реагування за температури 37 °С) і
холодові (оптимум близько 4 °С) аутоантитіла. При аутоімунних захворюваннях крові та
інфекційних захворюваннях значно частіше і у вищих титрах трапляються холодові
антиеритроцитарні антитіла, що є повними аглютинінами класу М.
Аутоантитіла виявляють у сироватці крові і в тканинах при всіх аутоімунних захворюваннях. Для
типового аутоімунного захворювання системного червоного вовчака (СЧВ) характерні різні
антитіла, які позначають загальним терміном LE-фактор (від лат. Lupus erythema-todes). Вони
взаємодіють з ДНК та іншими структурами ядерних і цитоплазматичних компонентів клітин. При
СЧВ зазвичай уражуються нирки у зв'язку з наявністю аутоантитіл до базальних мембран ниркових
клубочків. LE-фактор виявляють у реакції флуоресценції у вигляді світіння всього ядра, окремих
плям навколо ядра чи лише ядерець. Антиядерні фактори при СЧВ можуть належати до
імуноглобулінів усіх трьох основних класів. У кістковому мозку та в крові виявляють LE-клітини —
фагоцити, що поглинули ушкоджені ядра клітин.
При ревматоїдному артриті у синовіальній рідині суглобів виявляють нейтрофіли з гранулами у
цитоплазмі, що містять ревматоїдний фактор, який вивільняється при руйнуванні нейтрофілів. Такі
клітини називають RA-клітинами.
В організмі людини часто виявляють аутоантитіла класу М, які, очевидно, утворюються у відповідь
на нестійке ушкодження. При хронічних інфекційних процесах і спонтанних аутоімунних
захворюваннях постійно виявляють аутоантитіла, що належать до класу G. Як при
експериментальних аутоімунних процесах, так і при аутоімунних захворюваннях аутоантитіла
виявляють різними способами: у реакції зв'язування комплементу з тканинними антигенами,
методом імунофлуоресценції зрізів тканин, імуноферментними, радіоімунними методами.
19.3. МЕХАНІЗМИ ВКЛЮЧЕННЯ АУТОІМУННИХ ПРОЦЕСІВ.
Сьогодні існує багато концепцій механізмів розвитку аутоімунних процесів. При цьому всі теорії
розглядають можливі механізми індукування аутоімунних процесів або з погляду порушень
функціонування імунної системи чи її регуляторних механізмів, або відносно змін властивостей
клітин-мішеней, локалізації й властивостей аутоантигенів. Розвиток аутоагресивних імунних
реакцій в організмі найчастіше пов'язаний з реалізацією кількох механізмів індукування
аутоімунітету.
1. Активність «заборонених» клонів лімфоцитів. Аутоімунні процеси в організмі запускаються в
результаті активації «заборонених клонів» лімфоцитів. Гіпотеза ґрунтується на клонально-
селекційній теорії Бернета (1971), який вважав, що подібні клони виникають в організмі в результаті
мутацій у лімфоцитах. Накопичення мутантних клітин призводить до формування аутореактивних
клонів і розвитку імунної відповіді на власні антигени. Згідно із сучасними поглядами, існування
«заборонених» клонів в організмі можливе не тільки завдяки мутаційним процесам, а й у результаті
нормального диференціювання і дозрівання в тимусі та кістковому мозку аутореактивних
лімфоцитів, які не зазнають негативної селекції.
2. Недостатність індукування толерантності до власних антигенів імунною системою.
Формування аутотолерантності зумовлене процесом знищення аутоімунних клонів у процесі
розвитку лімфоцитів, що визначається як негативна селекція. Патологія може бути на рівні
формування аутотолерантності в тимусі або в периферичному відділі імунної системи. Велике
значення для збереження аутотолерантності відіграє тимус, оскільки він є первинним місцем Т-
клітинного диференціювання і генерування репертуару Т-клітинного рецептора. Порушення
процесів апоптозу в тимусі, недостатність дендритних клітин може сприяти надходженню
аутореактивних Т-клітин на периферію. Показано, що у мишей — носіїв чутантних генів Fas-
рецептора та Fas-ліганду формується системна аутоімунна патологія: вовчаковий синдром з
васкулітами, накопиченням аутоантитіл (в тому числі до ДНК), ушкодженням нирок. Паралельно в
периферичній лімфоїдній тканині накопичується багато незвичних Т-лімфоцитів з відсутністю
корецепторів СD4 і CD8 та наявністю маркера В-лімфоцитів В220.
3. Недостатність супресії аутореактивних лімфоцитів. Аутореактивні клони існують в організмі,
однак їхня активність стримується супресивними механізмами. Вважають, що аутоімунні
захворювання виникають через недостатність активних процесів ауторегуляції. Супресія
здійснюється за допомогою різних механізмів, що охоплюють дію супресорних клітин, цитокінів,
гормонів (наприклад, стероїдів), продуктів макрофагів, ідіотип-антиідіотипічної взаємодії,
неспецифічних медіаторів, простагландинів тощо. Для виникнення аутоімунної реакції має бути
порушений не один, а кілька елементів супресорної сітки. В разі недостатності різних факторів
регуляторні механізми порушуються, що призводить до зриву толерантності.
У тканинах людини й тварин на різних стадіях ембріогенезу перебувають клітини із супресорними
властивостями, які підтримують толерантність до власних антигенів. Зниження функції або
кількості супресорних клітин спостерігається при СЧВ, ревматоїдному артриті, множинному
склерозі та інших аутоімунних патологіях. Наприклад, у хворих на системний червоний вовчак
порушене формування супресорних клітин, а також функція антигенспецифічних регуляторних Т-
клітин. Важливу роль відіграють хелперні субпопуляції. Субпопуляція регуляторних клітин CD4
+
,
яка є у молодих здорових мишей лінії NOD, може перешкоджати перенесенню захворювання під
час пересаджування спленоцитів від тварин з діабетом мишам NOD з комбінованим
імунодефіцитом; у дорослих тварин ця субпопуляція регуляторних клітин зникає.
4. Порушення балансу цитокінів. Цитокіни — пептидні гормони, медіатори імунітету, запалення,
клітинного диференціювання, проліферації та ін. В експериментальних дослідженнях показано, що
порушення балансу цитокінів може слугувати причиною аутоімунних реакцій. Так, введення
трансгена гамма-інтерферону в бета-клітини острівців підшлункової залози призводило до
аутоімунної деструкції цих клітин у тварин, а введення трансгена фактора некрозу пухлин мишам
гібридної лінії NZB/NZW знижувало прояви аутоімунного процесу. Дослідниками встановлено, що
при експресії трансгена гамма-інтерферону посилюється експресія молекул МНС класу II на
клітинах острівців підшлункової залози. Експресія цих молекул в органах спостерігається при
інсулінозалежному цукровому діабеті, тиреотоксикозі, аутоімунному гепатиті. В тому випадку, коли
клітини тих чи інших органів починають експресувати молекули МНС класу II, вони стають
потенційною мішенню для власної імунної системи. Експресію молекул МНС класу II може
індукувати гамма-інтерферон. У всіх таких випадках індукується аутоімунний процес клітинного
типу.
5. Зміна фізико-хімічних властивостей аутоантигенів під впливом неінфекційних та
інфекційних агентів. Модифікація власних білків організму може здійснюватися під впливом
різних чинників хімічної та фізичної природи: лікарських препаратів, вільних радикалів, низьких і
високих температур, ультрафіолетового та йонізуючого випромінювань тощо. Аутоантигени
можуть з'явитися внаслідок порушення синтезу білків та утворення аномальних білків (амілоїдоз).
Хімічний чи фізичний агент ушкоджує певну тканину, яка набуває антигенних властивостей і
стимулює продукування антитіл. Останні фіксуються на тій самій тканині й спричинюють її
подальше ушкодження, процес стає самопідтримувальним і циклічним. Іноді взаємодія екзогенного
гаптену з білком організму хазяїна призводить до перехресного розпізнавання нормальних
аутоепітопів та індукування аутоімунних реакцій (F. Mildrom, S. Dubiski, 1957; P. В. Петров, 1976).
Деякі власні тканини можуть набувати антигенних властивостей під дією лікарських засобів, які
зв'язуються з білками клітин, що спричинює продукування антитіл щодо утвореного комплексу
лікарський препарат — тканина. Такий механізм спостерігається при розвитку гемолітичної анемії,
лейкопенії, тромбоцитопенії у відповідь на застосування лікарських засобів.
Найчастіше, очевидно, аутоантитіла утворюються до власних тканинних компонентів, змінених під
дією інфекційних агентів. Наприклад, вірус грипу, що адсорбується на еритроцитах, руйнує
поверхневі поліцукридні субстанції, що призводить до оголення структур, які мають антигенність.
Після перенесеного грипу в сироватці крові іноді з'являються антиеритроцитарні антитіла.
Аутоантигени утворюються в клітинах деяких типів, що інфіковані мікробами, які паразитують
внутрішньоклітинне.
6. Порушення ізоляції «забар'єрних» тканин. Аутоімунні процеси можна спричинити введенням у
кров'яне русло тварини антигенів «забар'єрних» тканин. Імунної толерантності до таких антигенів
немає, і за наявності доступу лімфоїдних клітин до таких антигенів (основний білок мієліну,
тиреоглобулін, кристалів та ін.) розвивається аутоімунна відповідь, що зумовлює ушкодження
відповідних органів. Наприклад, сперматозоони утворюються в організмі вже після дозрівання
імунної системи, у зв'язку з чим вони чужорідні в антигенному відношенні. Однак у нормі проти
них аутоімунна реакція не розвивається, оскільки вони захищені від контакту з
імунокомпетентними клітинами гематотестикулярним бар'єром. У разі порушення його
утворюються аутоантитіла до сперматозоонів, що може призвести до безпліддя чоловіків.
При порушенні ізоляції таких імунопривілейованих органів і тканин — центральної нервової
системи, внутрішнього середовища ока, статевих залоз, фолікулів щитоподібної залози та інших —
розвивається аутоімунна реактивність організму (F. Burnet, 1959).
Особливо це показово при первинному ушкодженні або травмуванні одного з парних органів —
ушкодження здорового ока при розвитку запального процесу в травмованому оці або ушкодження
обох яєчок при аутоімунному орхіті, який ініційований травмуванням одного з них. Еферентна
ланка імунної відповіді (гуморальна) спрацьовує: аутоантитіла ушкоджують парний здоровий орган,
не зустрічаючи бар'єрів.
В усіх розглянутих випадках має місце ситуація, коли для індукування аутоімунного процесу
потрібна імунізація «забар'єрним» антигеном.
7. Наявність перехресне реагуючих антигенів у мікробів і організму хазяїна, перехресна
реактивність антитіл (молекулярна мімікрія). Аутоімунні процеси в організмі можуть бути
зумовлені перехресно реагуючими антигенами мікробів, коли антитіла продукуються і до мікробних
антигенів, і до аутологічних антигенних детермінант. Результатом реакції антитіл не лише з
мікробними антигенами, що спричинюють їх продукування, а й з тканинними, є розвиток
аутоімунного процесу (Т. Kaplan, 1958; І. М. Лямперт і співавт., 1964; Л. Н. Фонталін, Л. А.
Певницький, 1978 та ін.). У людини цей імунний механізм визначає патогенез ревматизму та
хронічного нефриту: детермінанти бета-гемолітичного стрептокока мають антигенну подібність із
тканинними антигенами серця, а 12-й тип стрептокока — з антигенами базальної мембрани
ниркових клубочків, у зв'язку з чим антитіла до названих мікроорганізмів при стрептококових
інфекціях реагують із тканинними антигенами серця чи нирок, зумовлюючи патологію цих органів.
Існують численні приклади подібності антигенів мікроорганізмів та хазяїна: перехресно реагуючі
антигени виявлено у багатьох ентеробактерій, антитіла до пневмококового поліцукриду перехресно
реагують з антигенами серця й нирок людини, антигени ієрсиній — з рецептором тиреотропного
гормону, антигени клебсієл — з ацетилхоліновим рецептором, антигени менінгокока групи В — з
антигенами ЦНС, антигени трипаносом — з нейронним антигеном. Антитіла, які виявляють при
виразковому коліті, взаємодіють з деякими штамами кишкової палички. Спостерігається перехресна
реактивність між молекулами HLA-B27 і компонентами клітин деяких штамів клебсієл, а також при
багатьох патологіях установлено перехресну реактивність між бактеріальними білками теплового
шоку і молекулами DR.
8. Ад'ювантна роль компонентів мікроорганізмів, поліклональна активація лімфоцитів. При
хронічних інфекціях розвиток аутоімунних процесів може бути зумовлений ад'ювантною дією
бактерій внаслідок чого формуються імунні реакції до субстанцій, до яких у нормі існує
толерантність. У патології людини роль ад'ювантів та поліклональних активаторів Т- і В-клітин
можуть відігравати такі компоненти, як ліпополіцукриди, туберкулін, компоненти паличок
коклюшу і бруцельозу. В експерименті після стимуляції В-лімфоцитів мітогенами з'являється
здатність утворювати антитіла до власних еритроцитів. Дією цих механізмів можна пояснити
наявність холодових аутоантитіл до еритроцитів у хворих на сифіліс, аутоантитіл до легеневої
тканини при туберкульозі, холодових аглютинінів при мікоплазмовій пневмонії.
Активацію аутореактивних лімфоцитів можуть спричинити суперантигени бактерій, які активують
велику кількість клонів лімфоцитів незалежно від антигенної специфічності. Суперантигенами
можуть бути токсини деяких бактерій (стафілококові ентеротоксини, стрептококові токсини А, В, С,
D та ін.). Активація клітини здійснюється неспецифічним зв'язуванням молекули суперантигену з
молекулами МНС класу II та специфічного антигензв'язувального рецептора. Суперантигени не
зазнають процесингу в антигенпрезентувальній клітині й безпосередньо формують зв'язок з бета-
ланцюгом Т-клітинного рецептора та молекулою МНС класу II.
19.4. АУТОІМУННІ ЗАХВОРЮВАННЯ.
Якщо аутоімунні процеси спричинюють в організмі порушення структури та функції органів і
тканин, то кінцевим результатом є розвиток аутоімунного захворювання. Захворювання аутоімунної
природи поділяють на органо- та неорганоспецифічні (системні). При органоспецифічних
захворюваннях аутоантитіла індукуються проти одного чи групи компонентів певного органа. До
цієї групи захворювань належать: хвороба Аддісона, перніціозна анемія, тиреоїдит Хашимото,
первинна мікседема (тиреотоксикоз), аутоімунний атрофічний гастрит, інсулінзалежний діабет (тип
І) та ін. При неорганоспецифічних хворобах аутоантитіла реагують з різними тканинами цього або
навіть іншого виду організму. До таких патологічних процесів відносять системний червоний
вовчак, ревматоїдний артрит, дерматоміозит (склеродермію). Так, при СЧВ і ревматоїдному артриті
виявляють аутоантитіла до антигенів багатьох тканин і клітин: сполучної тканини, нирок, серця,
легень. Аутоімунні захворювання супроводжуються типовими клінічними симптомами,
морфологічними ушкодженнями та специфічними імунними проявами. В деяких випадках розвиток
аутоімунного процесу може бути первинним у розвитку захворювання, в інших, особливо при
хронічних довготривалих захворюваннях (наприклад, хронічному пієлонефриті, панкреатиті,
гепатиті, пневмонії, міокардиті та ін.), — вторинним наслідком захворювання, який дуже ускладнює
перебіг хвороби. Морфологічні зміни визначаються або депонуванням у тканинах імунних
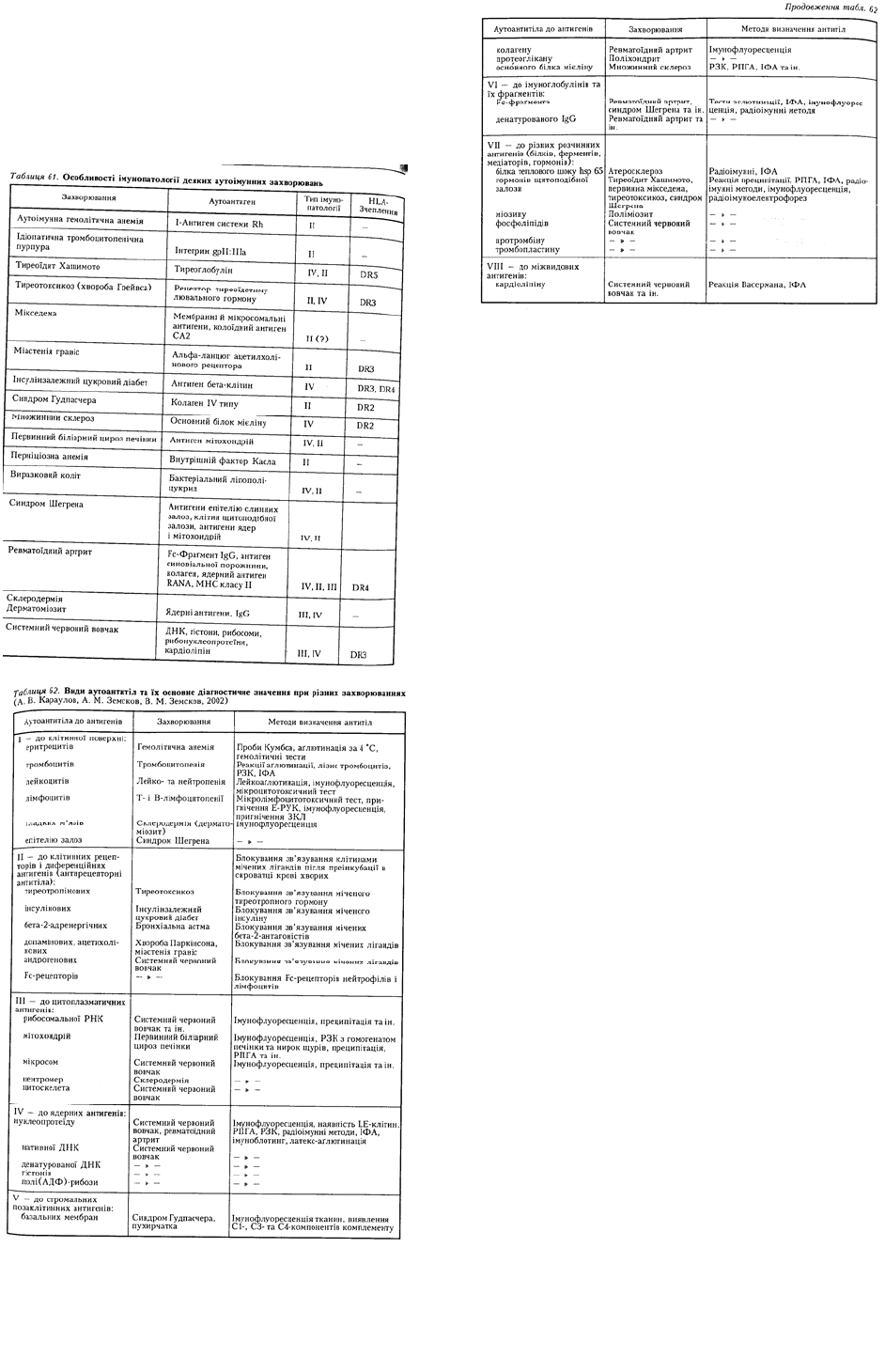
75
комплексів з включенням системи комплементу, що спричинює лізис клітин, або запальною
реакцією чи деструкцією тканин під впливом цитотоксичної дії кілерних клітин і макрофагів.
Клітинні та молекулярні механізми запального процесу аналогічні тим, що супроводжують й інші
форми імунної реактивності. За механізмами імунних процесів, залучених у розвиток аутоімунних
патологій, їх можна розподілити на такі групи:
- захворювання, зумовлені патогенною дією аутоантитіл до антигенів клітин або міжклітинного
матриксу;
- захворювання, зумовлені патогенною дією імунних комплексів;
- захворювання, спричинені патогенною дією аутоспецифічних Т-лімфоцитів.
Клітинні механізми аутоімунної відповіді залежать від того, який тип ефекторних Т-клітин
активується. Активація CD8-кілерів призводить до реалізації цитотоксичного механізму
ушкодження, який зумовлює більш локалізований і менш деструктивний тип ушкодження
(наприклад, при інсулінзалежному цукровому діабеті). Активація СD4-хелперів типу І спричинює
розвиток гіперчутливості сповільненого типу. Процеси, які супроводжуються розвитком ГСТ,
мають виражені ознаки ушкодження тканин у результаті активації клітин запалення, передусім
макрофагів. З активністю реакцій клітинного імунітету (IV тип гіперчутливості) пов'язані
захворювання на ревматоїдний артрит, експериментальний аутоімунний енцефаломієліт,
множинний склероз.
Можливі типи імунопатології при різних аутоімунних хворобах наведено в табл. 61.
Отримано багато даних, які свідчать про патогенетичну роль аутоантитіл у розвитку аутоімунних
захворювань у людини. При аутоімунних захворюваннях виявляють різні аутоантитіла (табл. 62).
Одним із найтиповіших аутоімунних захворювань, зумовлених патогенною дією антитіл, є
аутоімунна гемолітична анемія та інші аутоімунні патології клітин крові (ідіопатична
тромбоцитопенічна пурпура, ідіопатична лейкопенія та ін.).
У 1904 р. Донат і Ландштейнер виявили у хворих на пароксизмальну холодову гемоглобінурію
аутоантитіла, які зв'язувалися з еритроцитами за низьких температур. За низької температури
антитіла активували комплемент і спричинювали лізис еритроцитів. Це було першим
спостереженням захворювання людини з наявністю аутоантитіл. У результаті адсорбції аутоантитіл
на поверхні еритроцитів відбувається руйнування цих клітин — основи аутоімунної набутої
гемолітичної анемії. Антиеритроцитарні аутоантитіла належать до двох груп: активних за
температури тіла та за низьких температур (4-10 °С). Багато антитіл специфічні щодо різних Rh-
антигенів. Аутоантитіла до антигенів клітин крові або безпосередньо лізують клітини за наявності
комплементу, або комплекс клітина —антитіло захоплюється і пошкоджується фагоцитарними
клітинами. Пошкодження ядровмісних клітин розвивається також унаслідок механізму
антитілозалежного клітинного цитолізу.
Аутоімунні захворювання з наявністю патогенних аутоантитіл до позаклітинних аутоантигенів
матриксу трапляються рідко, але мають несприятливий перебіг і прогноз. До цієї групи захворювань
віднесено такі захворювання, як пухирчатка, синдром Гудпасчера, поліхондрит, ревматоїдний
артрит та ін.
При синдромі Гудпасчера формуються аутоантитіла до колагену IV типу. Розвивається системний
капілярит з ушкодженням мембрани ниркових клубочків, легень та судин. Захворювання
починається гостро, швидко прогресує і закінчується смертю хворого. В дослідах з пасивним
перенесенням антитіл було продемонстровано патогенетичну дію цих антитіл. Антитіла, отримані
елюцією з нирки хворого на синдром Гудпасчера, вводили приматам і спостерігали розвиток
типової картини гломерулонефриту, що призводив до загибелі тварин.
Певну групу становлять захворювання, при яких аутоантитіла продукуються до клітинних
рецепторів або подібних структур. Такі аутоантитіла здатні посилювати активність клітини-мішені
або перешкоджати її нормальному функціонуванню. Наприклад, при аутоімунному тиреоїдиті
(хвороба Грейвса) утворюються антитіла до рецептора для тиреоїдстимулювального гормону на
клітинах щитоподібної залози. Аутоантитіла, що взаємодіють з рецептором до
тиреоїдстимулювального гормону, стимулюють продукування цього гормону. В результаті
порушення рівноваги підвищується продукування тиреоїдних гормонів і виникає гіпертиреоз.
Аутоантитіла належать до класу IgG, вони проникають крізь плаценту і зумовлюють феномен
неонатального тиреотоксикозу в дітей, які народилися від хворих на тиреотоксикоз матерів. Ця
природна модель пасивного перенесення антитіл також свідчить про патогенетичну роль
аутоантитіл. Через деякий час після розпаду антитіл дитина видужує.
При міастенії ґравіс аутоантитіла продукуються до нейром'язових рецепторів, а саме до альфа-
ланцюга ацетилхолінового рецептора. В результаті взаємодії аутоантитіл з рецептором порушується
проходження імпульсу від нейрона до м'яза. Спостерігається слабкість м'язів, особливо шиї й
голови. Найчастіше захворювання трапляється у дівчаток і жінок віком до 40 років. З віком
розвивається гіперплазія тимуса, у ньому виявляються лімфоїдні фолікули й зародкові центри, а
іноді й злоякісні новоутворення. Видалення тимуса в деяких випадках сприяє тимчасовому
поліпшенню. Антитіла проти рецепторів ацетилхоліну індукують появу симптомів міастенії у
тварин. У хворих на міастенію виявляють ГСТ до нервової тканини. Феномен, аналогічний
тиреотоксикозу, відмічений у матерів, хворих на міастенію. У новонароджених дітей материнські
антитіла зумовлюють симптоми м'язової слабкості.
Інші рецепторні хвороби трапляються значно рідше. Наприклад, описано випадки з наявності
аутоантитіл до рецепторів інсуліну або до самого інсуліну. Сироватка хворих із синдромом
Ламберта — Ітона містить антитіла до пресинаптичних кальцієвих каналів, введення її тваринам
спричинює нейром'язові порушення. При синдромі Гійєна—Барре в сироватці містяться
аутоантитіла до натрієвих каналів.
Перніціозна анемія — захворювання, що характеризується порушенням еритропоезу, розвитком
анемії. Перніціозній анемії часто передує атрофічний гастрит. В основі захворювання лежить
утворення аутоантитіл проти парієтальних клітин шлунка і внутрішнього фактора Касла, який бере
участь у транспортуванні вітаміну В
12
крізь слизову оболонку кишок. Сироватка хворих на
перніціозну анемію перешкоджає всмоктуванню вітаміну у здорових людей, якщо вона потрапляє в
шлунок разом з комплексом вітамін — внутрішній фактор. Показано, що у хворих на перніціозну
анемію антитіла продукуються плазматичними клітинами шлунка і виділяються в шлункову
порожнину.
Ще одним прикладом аутоімунних захворювань є випадки чоловічого безпліддя. Аутоантитіла до
сперматозоонів зумовлюють їх інактивацію.
Особлива форма аутоімунних ушкоджень пов'язана з утворенням імунних комплексів. Прикладом
найбільш гострої патології в цього випадку може слугувати системний червоний вовчак —
найтиповіший і найтяжчий прояв системної аутоімунної патології. Захворювання виявляється
ураженням практично всіх внутрішніх органів, нервової системи, залоз внутрішньої секреції.
Клінічна симптоматика надзвичайно поліморфна і варіабельна. Гістологічно захворювання
характеризується дезорганізацією, деполімеризацією основної речовини сполучної тканини,
розвитком фіброзів, лімфоцитарно-плазмоцитарною інфільтрацією і відкладанням імунних
комплексів. У сироватці хворих завжди міститься значна кількість антитіл до широкого спектра
власних тканинних антигенів. Це насамперед антиядерні антитіла, що реагують ДНК та РНК,
антиклітинні — до лімфоцитів, еритроцитів, тромбоцитів, нейтрофілів, антитканинні — до тканин
серця, мозку, м'язів, колагену. Імунні комплекси депонуються в шкірі, слизових оболонках, стінках
судин, нирках, синовіальних оболонках, легенях, серці. При цьому характерне зниження кількості
Т-лімфоцитів, зокрема супресорів.
На системний червоний вовчак люди хворіють найчастіше в молодому віці. Найхарактернішим для
захворювання є рецидивний поліартрит. Існують експериментальні моделі СЧВ. У гібридів мишей
ліній новозеландська чорна (NZB) та возеландська біла (NZW) спонтанно розвивається СЧВ.
Пригнічення імунних реакцій (уведення сироватки до CD4) значно полегшує симптоми
захворювання.
Тиреоїдит Хашимото характеризується функціональною неповноцінністю щитоподібної залози. В
експерименті на кролях захворювання індукується парентеральним уведенням екстракту
щитоподібної залози в ад'юванті Фрейнда і характеризується лімфоцитарною інфільтрацією тканини
залоз та наявністю циркулюючих антитіл до тиреоглобуліну. У людини аутоімунний тиреоїдит
Хашимото спостерігається як симптом гіпотиреоїдизму. Залоза при цьому збільшена, інфільтрована
лімфоцитами. Патологія розвивається найчастіше у жінок. При цьому виявляють гістопатологічні
зміни в тканині залози, у сироватці крові містяться аутоантитіла до тиреоглобуліну та
цитоплазматичного антигену, який є ферментом — тиреоїдною пероксидазою. За допомогою
моделювання цього захворювання у курей лінії OS було встановлено, що в патогенезі захворювання
важливу роль відіграють не тільки аутоантитіла, а й Т-клітини, яким належить центральна роль у
регуляції патологічного процесу.
Прикладом цитотоксичної дії Т-клітин можуть бути процеси при інсулінзалежному цукровому
діабеті. Це захворювання гістологічно характеризується різким зниженням маси острівців
підшлункової залози внаслідок запальної реакції. Уражені острівці інфільтровані лімфоцитами й
моноцитами, останні дуже сильно атрофовані. Природу аутоантигенів остаточно не з'ясовано,
«кандидатами» можуть бути внутрішньоклітинна декарбоксилаза глутамінової кислоти і білок р40.
Показано, що деструкція бета-клітин панкреатичних острівців, які продукують інсулін,
здійснюється специфічними цитотоксичними CD8T-клітинами. Трансплантація хворим на діабет
фрагмента залози від ідентичного двійника не дає терапевтичного ефекту. Трансплантат
інфільтрується CD8 Т-клітинами хазяїна, які знищують перенесені клітини. При цьому в сироватці
крові хворих містяться аутоантитіла до підшлункової залози та інших тканин. Захворювання можна
індукувати в експериментальних тварин уведенням тканин підшлункової залози.
Ревматоїдний артрит — системне аутоімунне захворювання, у розвитку якого беруть участь
аутоантитіла та активовані СD4-клітини типу Т-хелперів 1. Т-лімфоцити, сенсибілізовані до
антигенів суглобів, секретують цитокіни, що сприяють надходженню в зону реакції нейтрофілів,
макрофагів, які ушкоджують хрящову тканину суглоба. Медіатори макрофагів і синовіальних
клітин відіграють провідну роль у формуванні локального запалення, в тому числі гіперплазії
синовіальної оболонки та ушкодженні хряща Спочатку уражуються синовіальні оболонки суглобів,
де виникає інфільтрація лімфоцитами й моноцитами, іноді з утворенням вузлових форм.
Захворювання трапляється втричі частіше у жінок, ніж у чоловіків. Найхарактерніша імунна ознака
захворювання — наявність у синовіальній рідині та сироватці ревматоїдного фактора, який
ідентифікований як антитіла класу М, що реагують з Fc-фрагментами IgG, утворюючи імунні
комплекси. Встановлено, що при ревматоїдному артриті порушено глікозилювання IgG (відсутні
кінцеві залишки D-галактози), що зумовлює зміну конформації молекули. Виявляються також інші
аутоантитіла — до колагену, ДНК, антигенів цитоскелета та ін. Патогенез захворювання пов'язаний
також із формуванням і відкладанням імунних комплексів.
Алергічний енцефаломієліт (АЕМ) індукується в експерименті повторним уведенням екстракту
мозкової тканини мавп гвінейським свинкам, кролям, щурам або птахам. Добавляння до екстракту
мозкової тканини ад'юванту Фрейнда значно збільшує частоту захворювання та скорочує час його
розвитку з 6—12 міс. до 10 — 30 діб. Специфічний антиген — основний білок мієлінової оболонки
білої речовини. Основні морфологічні зміни — демієлінізація та запальна інфільтрація нервової
тканини. Алергічний енцефаломієліт — це Т-клітинозалежне захворювання. Ушкодження
зумовлюють СD4-клітини типу Т-хелперів 1. У тимектомованих тварин він не розвивається, однак
може бути викликаний у бурсектомованих курчат; пасивно передається Т-клітинами. В патології
людини гістологічні порушення, що спостерігаються при енцефаломієліті, виявляють під час
76
множинного склерозу — демієлінізуючому захворюванні з різноманітною неврологічною
симптоматикою (можлива вірусна етіологія). Відмічено зв'язок з певними алелями HLA класу II.
Гістологічні зміни, подібні до таких при АЕМ, спостерігаються також при гострому дисемінованому
енцефаломієліті. Первинне ушкодження тканин при цьому захворюванні, очевидно, зумовлюється
вірусами, оскільки воно трапляється як ускладнення різних інфекцій: кору, вітряної віспи,
епідемічного паротиту та ін.
19.5. РОЛЬ СПАДКОВОСТІ В РОЗВИТКУ АУТОІМУННИХ ЗАХВОРЮВАНЬ.
У виникненні аутоімунних хвороб значна роль належить генетичним факторам. Відомі види тварин,
наприклад курчата лінії Obese, миші новозеландської чорної лінії (NZB), миші лінії NOD та ін., в
яких дуже висока частота спонтанних аутоімунних хвороб. У людей простежується також
спадковий характер аутоімунних процесів. Про це свідчать дані родинного аналізу.
Аутоімунні реакції регулюються генами імунної відповіді, які зчеплені з антигенами головного
комплексу гістосумісності. Аутоімунні хвороби часто асоційовані з наявністю певних алелів HLA.
Найчастіше це алелі HLA-A, HLA-B та DR. У багатьох хворих на органоспецифічні аутоімунні
захворювання виявляють HLA-B8-гаплотип. Це узгоджується з існуючою думкою про первинну
етіологічну роль інфекції у виникненні аутоімунного захворювання: певний алель зумовлює низьку
реактивність, яка сприяє персистуванню інфекційного агента в організмі. Це, в свою чергу, індукує
патологічну чи неадекватну імунну відповідь, що не забезпечує елімінацію мікроорганізму, а
навпаки, призводить до розвитку патології. При багатьох аутоімунних патологіях спостерігається
асоціація з певними локусами DR. Встановлено, що певні послідовності DR локусів (DR3, DR2,
DR4), які кодують амінокислотні послідовності антигензв'язувальних рецепторів, часто асоційовані
з багатьма аутоімунними патологіями. Антигенами в цьому випадку можуть бути білки теплового
шоку різних бактерій та антигени вірусів. Це, безперечно, свідчить про участь перехресне
реагуючих антигенів в індукуванні аутоімунної патології.
У розвитку спонтанних аутоімунних реакцій можуть брати участь фактори, не пов'язані з
поліморфізмом генів системи МНС. Аутоімунні захворювання частіше спостерігаються у жінок, ніж
у чоловіків. З віком частота аутоімунних захворювань збільшується. Все це підтверджує уявлення
про участь кількох генетичних факторів у розвитку аутоімунних захворювань.
19.6. ЕКСПЕРИМЕНТАЛЬНІ МОДЕЛІ АУТОІМУННИХ ЗАХВОРЮВАНЬ.
Експериментальні моделі аутоімунних захворювань у тварин є дуже важливими з погляду вивчення
механізмів їх формування і розвитку. Аутоімунні реакції можуть бути індуковані у тварин у
результаті цілеспрямованих впливів на організм (наприклад, у результаті імунізації
аутоантигенами), однак у тварин деяких ліній можуть виникати спонтанно.
Розвиток аутоімунних реакцій можна індукувати в експериментальних тварин уведенням
аутоантигенів з ад'ювантами. Утворення специфічних антитіл до власного тиреоглобуліну у кролів
можна індукувати імунізацією тиреоглобуліном у комплексі з ад'ювантом Фрейнда, а алергічний
енцефаломієліт (АЕМ) викликають в експерименті введенням основного білка мієліну з ад'ювантом
Фрейнда гвінейським свинкам, кролям, щурам або птахам.
Як модель утоімунних захворювань із зазначенням факторів, що їх спричинили, використовують
мишей лінії новозеландська чорна NZB та гібридів лінії новозеландська чорна й біла (NZB x NZW)
F1. У мишей цих ліній (найчастіше у самок) спонтанно виникають синдроми аутоімунних
захворювань, подібних до аутоімунної гемолітичної анемії та системного червоного вовчака у
людини. У віці 2 — 4 міс. з'являються антиеритроцитарні антитіла, збільшується кількість Т- і В-
клітин, здатних зв'язувати різні аутоантигени й розвивати імунну відповідь на них. Крім того,
знижується здатність проліферувати у відповідь на Т-мітогени, здійснювати РТПХ та відторгати
шкірні трансплантати. Крім появи антиеритроцитарних антитіл у більшості мишей лінії NZB віком
7 — 15 міс. спостерігається ураження нирок на зразок вовчакового гломерулонефриту і виявляються
антинуклеарні антитіла та аутоантитіла інших специфічностей. Для вивчення вовчакового синдрому
найчастіше використовують гібриди (NZB x NZW) F1. Кастрація молодих самців (препубертатних)
спричинює виникнення аутоімунних процесів у більш ранньому віці й тяжчий їх перебіг.
Крім мишей існують й інші види тварин, у яких розвиваються спонтанні аутоімунні патології. У
курей лінії Obese спонтанно з'являються антитиреоїдні антитіла, а щитоподібна залоза зазнає
прогресивної деструкції внаслідок хронічного запалення. У сироватці цих птахів містяться
аутоантитіла до тиреоґлобуліну. На цій моделі вивчають розвиток патології, яка аналогічна
тиреоїдиту Хашимото у людини. Якщо після вилуплення у курчат видалити фабрицієву сумку, то
тяжкість тиреоїдиту значно зменшується. Разом з тим видалення тимуса призводить до більщ
тяжкого перебігу хвороби. Введення дорослим птахам антисироватки до Т-клітин повністю блокує
продукування аутоантитіл і ушкодження щитоподібної залози. Саме тимусу і Т-клітинам належить
важлива стримувальна роль у регуляції патологічного процесу при цьому захворюванні.
Експериментальний тиреоїдит можна викликати також у мишей, мавп, гвінейських свинок
уведенням тиреоґлобуліну з ад'ювантом.
Моделлю для вивчення цитотоксичної дії аутоантитіл є моношар епітеліальних клітин щитоподібної
залози, фібробластів, клітин HeLa, які культивують in vitro. Додавання до епітеліальних клітин
щитоподібної залози in vitro сироватки хворих на хворобу Хашимото, що містить аутоантитіла до
тканинних антигенів залози, припиняє їх поділ і моношар клітин не утворюється. Добавляння
сироватки до вже утвореного моношару через кілька хвилин спричинює комплементзалежний лізис
клітин. Можна припустити, що патологічна дія антитіл виявляється також in vivo.
19.7. ДІАГНОСТИКА ТА ЗАГАЛЬНІ ПРИНЦИПИ ТЕРАПІЇ.
Загальним принципом діагностики аутоімунних захворювань є виявлення аутоантитіл або
сенсибілізованих лімфоцитів (див. табл. 62). Проте, як було зазначено вище, наявність цих факторів
спостерігається і в здорових, і в пацієнтів з аутоімунними розладами без клінічних проявів. Саме
тому діагностика таких хвороб є досить складною.
У лікуванні аутоімунних хвороб сьогодні існує три підходи. По-перше, протизапальна терапія, що
може зменшити ушкодження тканин, зумовлені аутоімунною відповіддю; по-друге,
імуносупресивна терапія, яка має знизити аутоімунну відповідь; по-третє, терапія має бути
спрямована саме на ту систему органів, яка уражена захворюванням, наприклад, діабет, що
спричинюється імунною атакою клітин підшлункової залози і лікується інсуліном. Протизапальна
терапія аутоімунних хвороб полягає у застосуванні антицитокінових антитіл; анти-ФНП-α, антитіла
зумовлюють значну тимчасову ремісію при ревматоїдному артриті. Антитіла можна також
застосувати для блокування міграції клітин до ділянок запалення, наприклад, анти-CD 18-антитіла
запобігають щільній адгезії лейкоцитів до судинного ендотелію та знижують ефект запалення У
дослідах на тваринних моделях хвороби. Кінцева мета імунотерапії аутоімунних захворювань —
специфічне втручання з метою відновлення толерантності до аутоантигенів. Існує два
експериментальних підходи до цього питання, які нині перебувають на стадії розроблення. Перший
підхід полягає у блокуванні специфічної відповіді на аутоантигени. Один із шляхів досягти цього —
ідентифікувати специфічні рецептори Т-клітин або молекули імуноглобулінів, що їх несуть на собі
лімфоцити, які спричинюють захворювання, а потім зробити на них мітку антитілами,
спрямованими проти ідіотипічних детермінант на Т-клітинах або імуноґлобулінах. Другий шлях
полягає в ідентифікації певних молекул МНС першого чи другого класу, що здатні презентувати
білки аутоантигенів, та інгібувати їх антигенпрезентувальну функцію вибірково з антитілами або
блокувальними білками. Цей підхід був успішним при застосуванні на деяких тваринних моделях
аутоімунних захворювань, наприклад експериментального аутоімунного енцефаломієліту (ЕАЕ).
Припускають, що при цьому захворюванні обмежена кількість клонів Т-клітин реагують на
сигнальний пептид, який спричинює захворювання. Хоча аутоімунні хвороби людини і більшість
тваринних моделей перебувають під контролем поліклональної відповіді на аутоатигени Т- і В-
лімфоцитів. Саме тому імунотерапія, що ґрунтується на ідентифікації специфічних рецепторів, які
несуть на собі патогенні лімфоцити, очевидно, буде малоефективною. Імунотерапія, що спирається
на ідентифікацію певних молекул МНС, які керують аутоімунною відповіддю, має бути більш
ефективною, але така терапія все-таки пригнічуватиме захисну функцію імунної системи.
Другий підхід до лікування аутоімунних захворювань — це спроба обернути патологічну
аутоімунну відповідь на нешкідливу. Цей підхід є експериментальним, оскільки толерантність до
тканинних антигенів не завжди залежить від відсутності реакції Т-клітин; навпаки, вона може
активно підтримуватися цитокінами, що їх секретують Т-клітини, супресуючи шкідливу, запальну
Т-клітинну відповідь. Набір цитокінів, експресованих Т-лімфоцитами, є критичним у визначенні
стану збереження толерантності та проявів аутоімунних хвороб, але маніпулювання експресією
цитокінів відкриває шлях до їх контролю. Існує багато методів, відомих під назвою «імунна
модуляція», здатних змінити експресію цитокінів Т-лімфоцитами. Вони включають маніпуляцію
цитокіновим оточенням, у якому спостерігається активація Т-клітин, або маніпуляцію
презентування антигену, оскільки досліджено вплив цих факторів на диференціювання та
цитокінсекреторну функцію активованих Т-клітин.
Останні дослідження показали, що набір цитокінів, які синтезуються Т-лімфоцитами, дуже
складний; поділ Т-лімфоцитів на Тх1 і Тх2 субпопуляції є занадто спрощеним. Так, наприклад,
клітини CD4 були ідентифіковані у середовищі, багатому на IL-10, і, у свою чергу, секретували
високий рівень IL-10 та малу кількість IL-2 і IL-4. Такий набір секретованих цитокінів є свідченням
того, що на ці клітини впливають інші Т-клітини і супресують антигеніндуковану активацію інших
СD4-лімфоцитів. Ці клітини були умовно названі Тr1-клітинами (Т-регуляторними клітинами 1).
Додатковою проблемою є труднощі у модуляції імунної відповіді, що вже розвинулася. В
експериментах на тваринах показано, що антицитокінові антитіла (або введені антитіла проти
рекомбінантних цитокінів), які існують вже на час імунізації аутоантигеном, можуть інколи
відвертати патологічну імунну відповідь. На противагу цьому, при модифікації вже розвиненої
імунної відповіді значно складніше досягти успіху цим методом, хоча є кілька прикладів вдалих
експериментів. Значний інтерес становить використання синтетичних пептидних антигенів для
супресії патологічної відповіді при аутоімунних хворобах, пов'язаних з Т-клітинами. Відповідь CD4
Т-клітин, індукована пептидом, залежить від шляху, яким останній буде презентовано імунній
системі. Наприклад, введені орально білки переважно схильні до активації Тх2, які продукують IL-
4, -5, -10, або Тх3, які синтезують ТФР-β (без активації Тх1), або індукування великої кількості
антитіл. Зазначені імунні реакції у слизових оболонках мають відносно низький патогенний
потенціал. Зокрема, експерименти на тваринних моделях показали, що вони можуть протидіяти
індукованій аутоімунній хворобі. Експериментальний аутоімунний енцефаломієліт, індукований
ін'єкцією мієлінового основного білка в повному ад'юванті Фрейнда, був подібний до множинного
склерозу, тоді як колагеновий артрит індукували лише ін'єкцією колагену типу II і його прояви були
подібні до ревматоїдного артриту. Оральне введення мієлінового основного білка чи колагену типу
II інгібувало розвиток захворювання у тварин і мало певні позитивні наслідки при редукуванні
активності на попередній стадії хвороби. Спроби використати цей підхід на пацієнтах із множинним
склерозом та ревматоїдним артритом дали граничний терапевтичний ефект. Внутрішньовенне
введення білків також може пригнічувати запальну відповідь, що стимулюється тим самим
пептидом, презентованим в іншому вигляді. Коли розчинний пептид уводиться внутрішньовенно,
він приєднується переважно до молекул МНС класу II на В-клітинах, що перебувають у стані
спокою і схильні індукувати анергію у Тн1-клітин. Отже, ретельний підбір дози та структури
антигену або шляху його введення дасть змогу контролювати тип відповіді, що формується, тому ці
підходи можуть бути ефективними у маніпуляції сформованою імунною відповіддю, допомагаючи
людині позбавитися аутоімунних хвороб.
ВИСНОВКИ.
Розрізняють аутоімунні процеси і аутоімунні захворювання, в основі яких лежить взаємодія
компонентів імунної системи з антигенами власного організму. Аутоімунні процеси
спостерігаються в нормі у здорових осіб, а також при багатьох патологіях. У першому випадку вони
виконують гомеостатичні, регуляторні, захисні функції. В другому випадку аутоімунні процеси
відіграють значну роль у патогенезі різних хвороб. Аутоімунними називають захворювання,
основою патогенезу яких є розвиток самопідтримувальної імунної відповіді на власні антигени
організму, що призводить до ушкодження клітин і тканин, які мають цей аутоантиген. Вони
виникають внаслідок порушення механізмів аутотолерантності, зміни антигенних властивостей
білків організму під дією різних факторів інфекційного та неінфекційного походження, порушення
фізіологічної ізоляції «забар'єрних» тканин, імунізації перехресно реагуючими антигенами,
порушення регуляторних механізмів в імунній системі тощо. Аутоімунні захворювання є
хронічними. Основою ушкоджень при аутоімунних захворюваннях слугують Тх1-залежні клітинні
або Тх2-залежні гуморальні імунні процеси. У виникненні аутоімунних хвороб значна роль
належить генетичним факторам.
Контрольні запитання.
1. Яку роль в організмі відіграють нормальні аутоантитіла?
2. Що зумовлює схильність організму до розвитку аутоімунного захворювання?
3. Які імунні механізми беруть участь у реалізації аутоагресії?
4. Як індукувати аутоімунні реакції в експериментальних тварин?
5. Які існують підходи для лікування аутоімунних захворювань?
РОЗДІЛ 20. ІМУНОДЕФІЦИТИ.
Цілісність імунної системи є обов'язковою умовою забезпечення захисту організму від інфекційних
агентів та їх токсичних продуктів і, як наслідок, для виживання індивідів. Дефекти різних
компонентів імунної системи можуть призвести до серйозних і часто смертельних порушень, які
мають загальну назву імунодефіцитні захворювання. Ці хвороби поділяють на дві групи.
Первинні (природжені) імунодефіцити — це захворювання, зумовлені генетичними дефектами, які
призводять до збільшення чутливості до інфекцій. Ці патології часто виявляються вже в дитинстві,
але клінічно реєструються пізніше.
Вторинні (набуті) імунодефіцити — це патологічні стани, що розвиваються внаслідок
недостатнього харчування, хімічного отруєння, радіаційного опромінення, поширення в організмі
інфекційного або онкологічного процесу, лікування імуносупресивними препаратами чи
безпосереднього ураження клітин імунної системи, наприклад при інфікуванні вірусом
імунодефіциту людини.
Використання технології нокаутів певних генів у мишей дало змогу штучно створити різноманітні
імунодефіцитні стани і з'ясувати роль окремих молекул у нормальному функціонуванні імунної
системи. Зрозуміло, що модельні експерименти на тваринах не завжди є адекватними і не
відображають повною мірою особливості патологічних процесів в організмі людини. Тому для
клініцистів і дослідників великий інтерес становлять хворі на певні форми імунодефіциту.
Імунодефіцити можуть бути зумовлені дефектами як ланок адаптивного, так і природного імунітету.
Причинами імунодефіцитів можуть бути порушення розвитку та функцій Т- та В-лімфоцитів, вади
фагоцитарних клітин, системи комплементу, цитокінів і цитокінових рецепторів тощо.
Принциповим наслідком розвитку імунодефіцитів є підвищена чутливість до інфекції. Природа
інфекції у певного пацієнта залежить переважно від компонента імунної системи, який є дефектним.
Недостатня гуморальна імунна відповідь зазвичай призводить до підвищеної чутливості до інфекції
гноєтворними (піогенними) бактеріями, тоді як наслідком дефектів клітиноопосередкованого
імунітету є інфікування вірусами і внутрішньоклітинними мікробами. Комбіновані дефіцити
гуморальної та клітиноопосередкованої ланки імунітету призводять до інфекції всіма типами
патогенів.
Пацієнти з імунодефіцитами є також чутливими до певних типів онкологічних захворювань. Багато
з цих захворювань можуть бути спричинені онкогенними вірусами, такими, як вірус Епштейн-Барр,
вірус папіломи людини тощо. Підвищена захворюваність на рак досить часто спостерігається при Т-
клітинних імунодефіцитах, оскільки Т-клітини відіграють важливу роль в імунному нагляді за
виникненням пухлин.
Імунодефіцитні захворювання гетерогенні за патологією та клінікою. Це відбувається частково
тому, що різні захворювання виникають на основі порушень різних компонентів імунної системи.
20.1. ПЕРВИННІ ІМУНОДЕФІЦИТИ.
Генетичні дефекти можуть відбутися у будь-якій молекулі, залученій в імунну відповідь. Ці
дефекти, які є причиною розвитку певних імунодефіцитних захворювань, надають корисну
інформацію щодо розвитку і функціонування імунної системи у нормальних осіб. Імунодефіцити,
що успадковуються, ілюструють собою важливу роль адаптивної імунної відповіді і особливо Т-
клітин у клітиноопосередкованій і гуморальній імунній відповіді. Зони надають інформацію про
окрему роль В-лімфоцитів у гуморальній імунній відповіді і Т-лімфоцитів у
клітиноопосередкованому імунітеті, про важливість фагоцитів і комплементу в природному
імунітеті, про специфічні функції окремих поверхневих чи сигнальних молекул у адаптивній
імунній відповіді. Проте є деякі ладкові імунодефіцити, причини яких ще незрозумілі. Подальше
дослідження цих захворювань, без сумніву, допоможе глибше зрозуміти механізми функціонування
мунної системи і розробити нові імунорегуляторні препарати.
Залежно від рівня порушення і локалізації дефекту розрізняють переважно гуморальні, клітинні та
комбіновані імунодефіцити, а також дефекти в системі природного імунітету.
20.1.1. Гуморальні імунодефіцити.
Гуморальні імунодефіцити характеризуються недостатністю синтезу антитіл певного класу.
Розрізняють три типи недостатності антитіл: фізіологічна, спадкова та набута.
Фізіологічна недостатність антитіл спостерігається у новонароджених дітей. Немовлята мають
сироваткові рівні антитіл, подібні до матері, завдяки трансплацентарному транспорту IgG. Коли
перенесені IgG катаболізуються, рівні антитіл поступово знижуються доти, доки у новонародженого
не починають синтезуватися власні IgG у віці приблизно 6 міс. Отже, рівні IgG достатньо низькі у
віці від 3 міс. до 1 року. У деяких немовлят це може призводити до підвищеної чутливості до
інфекції. Це особливо стосується «недоношених» дітей, що мають нижчі рівні материнських IgG і
досягають стану імунокомпетентності пізніше після народження.
Уперше спадковий гуморальний імунодефіцит описав у 1952 р. О. Брутон, що спостерігав
захворювання хлопчика, в якого не виявлялося синтезу антитіл. Цей дефект був зчеплений із Х-
хромосомою і характеризувався відсутністю імуноґлобулінів у сироватці крові хворого. Його
назвали зчеплена з Х-хромосомою агаммаґлобулінемія Брутона (Bruton's Х-linked
agammaglobulinemia (XLA)). Відомо, що ген, порушення якого відбувається при XLA, кодує
протеїнкіназу, яка є членом нещодавно описаної родини Тес-кіназ і названа Btk (B-cell tyrosine
kinase). Ймовірно, що Btk потрібна для передавання сигналів від пре-В-клітинного рецептора до
ядра, що призводить до росту і диференціювання пре-В-клітин. Однак в осіб з порушенням функції
Btk деякі В-клітини дозрівають, незважаючи на дефекти цієї сигнальної кінази.
Ген, що відповідає за розвиток XLA, знаходиться в Х-хромосомі. Пацієнти з агаммаґлобулінемією,
пов'язаною з Х-хромосомою, зазвичай мають низькі рівні імуноґлобулінів у сироватці крові,
знижену кількість чи відсутність В-клітин у периферичній крові й лімфоїдних тканинах, відсутність
зародкових центрів у лімфатичних вузлах та відсутність плазматичних клітин у тканинах.
Дозрівання, кількість і функції Т-клітин у таких хворих зазвичай нормальні.
Найбільш частою формою спадкових дефіцитів імуноґлобулінів є селективний імунодефіцит IgA.
Дефіцит IgA, як правило, виникає спонтанно, але відомі також родинні випадки з аутосомно-
домінантним або рецесивним типом спадкування. Клінічні прояви захворювання різноманітні. У
пацієнтів із дефіцитом IgA найчастіше спостерігаються хронічні захворювання легенів, діарея.
Зрідка пацієнти мають тяжкі рецидивні інфекції, що супроводжуються аутоімунними порушеннями,
які призводять до хронічного ураження травного каналу та дихальних шляхів. Дефіцит IgA
характеризується низькими рівнями IgA (зазвичай нижче, ніж 50 мкг/мл, за норми 2 — 4 мг/мл) із
нормальними чи збільшеними рівнями IgM та IgG. В основі захворювання у цих пацієнтів лежить
блокування диференціювання В-клітин у плазматичні клітини, що секретують антитіла IgA-ізотипу.
Гени важких α-ланцюгів та експресія мембраноасоційованих IgA перебувають у нормі.
Нині ще не з'ясовано, чим саме зумовлене блокування диференціювання В-клітин. Причинами цього
можуть бути внутрішні дефекти В-клітин, недостатня хелперна активність Т-клітин, а саме
продукування цитокінів, що підсилюють секрецію IgA (наприклад, ТФР-β та ІЛ-5), чи порушення
відповіді В-клітин на ці цитокіни. Ніяких серйозних порушень у кількості, фенотипі та
функціональних відповідях Т-клітин у пацієнтів з таким типом імунодефіциту виявлено не було.
Селективні імунодефіцити певних підкласів IgG визначають тоді, коли загальний рівень
сироваткового IgG є нормальним, але концентрації одного чи більше підкласів нижчі від норми. У
дорослих найчастіше трапляється дефіцит IgG3, а в дітей — дефіцит IgG2 у поєднанні з дефіцитом
IgA. Деякі особи з такими дефіцитами мають рецидивні бактеріальні інфекції, але багато з уражених
людей не мають жодних клінічних проявів захворювання. Причиною виникнення селективних
імунодефіцитів певних підкласів імуноґлобулінів є аномалії диференціювання В-клітин.
Існує синдром, що називається загальним варіабельним імунодефіцитом, за якого спостерігається
дефіцит як імуноґлобулінів класу G, так і імуноґлобулінів класу А.
Загальні варіабельні імунодефіцити — група гетерогенних порушень, що виявляються у
гіпогаммаґлобулінемії, порушенні гуморальної імунної відповіді на інфекційні агенти. Прояви та
патогенез захворювання, як свідчить назва, дуже варіабельні. Основними складовими цих порушень
є агаммаґлобулінемія та гіперчутливість до інфікування піогенними мікроорганізмами. Розглянуті
порушення можуть бути діагностовані вже у ранньому дитинстві. Спостерігаються як родинні, так і
спорадичні випадки захворювання. Успадкування відбувається за аутосомно-домінантним та
рецесивним типами. У таких осіб наявні зрілі В-лімфоцити, але в лімфоїдних органах відсутні
плазматичні клітини. Це наводить на думку, що в основі захворювання є блокування
диференціювання В-клітин на антитілопродукувальні клітини. Аномальне продукування антитіл є
ознакою різних порушень, зокрема внутрішніх дефектів В-клітин та недостатньої хелперної
активності Т-клітин. Молекулярні основи цього захворювання нині невідомі, але вважають, що
генетичне цей дефект картується у ділянці генів МНС.
Особи з порушеннями В-клітинної ланки імунітету можуть успішно протистояти багатьом
патогенам. Проте ефективний захист організму-хазяїна проти зовнішньоклітинних піогенних
бактерій, зокрема стафілококів і стрептококів, порушений, оскільки потребує опсонізації цих
бактерій специфічними антитілами.
20.1.2. Т-Клітинні імунодефіцити.
Вади Т-клітинної ланки імунітету можуть також спричинювати низькі рівні антитіл у сироватці
крові.
Зчеплений із Х-хромосомою гіпер-IgM-синдром — рідкісне захворювання, пов'язане з
порушенням здатності В-клітин переключати синтез ізотипів імуноґлобулінів з IgM на ізотипи IgG
або IgA. Тому антитіла класів IgG та IgA знаходяться в сироватці крові хворих лише в слідових
кількостях, але одночасно спостерігається компенсаторне зростання рівнів IgM. Розвиток В-клітин у
таких хворих відбувається нормально. Молекулярний дефект при цьому захворюванні —
порушення здатності CD40L, що експресується Т-клітинами, зв'язуватися з CD40 на В-клітинах і
передавати відповідні сиґнали. Сигнали через CD40L —CD40 потрібні для Т-клітинозалежної
активації проліферації В-клітин, а також індукування переключення синтезу імуноґлобулінів і
формування зародкових центрів. При цьому захворюванні спостерігаються також порушення
клітиноопосередкованого імунітету в хворих, оскільки їхні Т-клітини не здатні надавати сигнали
для активації макрофагам через систему CD40L—CD40. Такі хворі зазвичай страждають від
інфекцій, що спостерігаються при інших гіпогаммаґлобулінеміях. Особи з гіперпродукцією ІgМ
мають порушення клітиноопосередкованого імунітету з підвищеною чутливістю до інфекцій з
таким внутрішньоклітинним мікробом, як Pneumocystis carinii.
Вчеплений з Х-хромосомою лімфопроліферативний синдром може бути асоційований зі
смертельною інфекцією — вірусом Епштейн-Барр (ВЕБ) та розвитком лімфом. ВЕБ — це вірус
родини герпес-вірусів, яким інфіковано багато людей. Він може тривало перебувати у латентну
стані в В-клітинах після первинного інфікування. Інфікування В-лімфоцитів ВЕБ може призвести до
злоякісної трансформації цих клітин (і тому навіть використовується для технології імморталізації
клонів В-клітин у лабораторії). За нормальних умов ВЕБ-інфекція в організмі людини активно
контролюється і підтримується у латентній стадії цитотоксичними Т-клітинами, специфічними до
В-клітин, що експресують антигени ВЕБ. У разі імунодефіциту Т-клітинної ланки механізми
контролю інфекції порушуються, що може призвести до розвитку смертельної B-клітинної лімфоми.
Зчеплений з Х-хромосомою лімфопроліферативний синдром розвивається внаслідок мутації в гені,
що кодує білок SH2D1A (SH2-domain containing gene 1A). У хлопчиків з таким порушенням
розвивається поширена ВЕБ-інфекція ще у дитинстві, а іноді розвиваються лімфоми. ВЕБ-інфекція
за таких умов, як правило, фатальна і супроводжується некрозом печінки. Отже, білок SH2D1A має
велике значення для контролю ВЕБ-інфекції.
Процес дозрівання лімфоцитів зі стовбурових клітин до функціонально компетентних зрілих
лімфоцитів охоплює проліферацію клітин, зміни в активності різних генів, експресію антигенних
рецепторів, селекцію клітин певної специфічності. Кожний із зазначених етапів може бути
порушений унаслідок певних генетичних дефектів, що й було доведено на моделях
експериментальних тварин та в результаті дослідження матеріалу хворих на певні імунодефіцити.
Велике значення для дослідження дозрівання лімфоцитів відіграли експерименти з використанням
стратегії спрямованого порушення генів, що кодують різні молекули, у тому числі ферменти та
фактори транскрипції.
Порушення дозрівання Т-клітин. Синдром Ді Джорджі. Цей селективний Т-клітинний
імунодефіцит походить від природженої виродливості, що призводить до дефективного розвитку
77
тимуса та прищитоподібної залози, а також інших структур, що розвиваються з третьої та четвертої
глоткових кишень під час ембріонального розвитку. Природжений дефект виражений у гіпоплазії
(недорозвиненні) тимуса (призводить до недостатнього дозрівання Т-клітин), відсутності
прищитоподібної залози (спричинює порушення гомеостазу кальцію і, як наслідок, —
гіпокальціємічні корчі м'язів та спазми), аномальному розвитку великих судин, деформуванні
обличчя. Механізм розвитку цих порушень невідомий. У хворих відмічають значне зменшення
кількості чи відсутність Т-лімфоцитів периферичної крові. Крім того, Т-клітини не відповідають на
поліклональні Т-клітинні активатори чи у реакції змішаної культури лімфоцитів. Сироваткові рівні
антитіл зазвичай у межах норми, але можуть бути зменшені у разі тяжкого перебігу захворювання.
Як і при інших Т-клітинних розладах, хворі на синдром Ді Джорджі чутливі до мікобактеріальних,
вірусних і грибних захворювань.
Імунодефіцити, асоційовані з синдромом Ді Джорджі, можуть бути відкориговані при
трансплантації ембріонального тимуса чи ідентичного за антигенами HLA кісткового мозку.
Часто з віком відбувається відновлення функцій Т-клітин. Це, можливо, відбувається через
наявність деякої частини нормальної тканини тимуса чи внаслідок того, що деякі ділянки
лімфоїдної тканини поза тимусом забезпечують дозрівання Т-лімфоцитів. Можливо, у таких
пацієнтів типові тканини тимуса розвиваються у невідповідному місці.
Моделлю подібного Т-клітинного імунодефіциту на тваринах є «голі» (безтимусні) миші. Вони
мають спадкову ваду в епітеліальних клітинах шкіри, що призводить до випадання волосся, та
дефект у вистиланні третьої і четвертої глоткових кишень, унаслідок чого відбувається гіпоплазія
тимуса. В основі дефекту лежить мутація гена, що кодує фактор транскрипції, який, як вважають, є
необхідним для нормального розвитку певних типів епідермальних клітин. Уражені миші мають
рудиментарні тимуси, в яких дозрівання Т-лімфоцитів не відбувається. В результаті у периферичних
лімфоїдних тканинах Т-клітини відсутні або містяться у малій кількості, а реакції
клітиноопосередкованого імунітету не спостерігаються.
20.1.3. Комбіновані імунодефіцити.
Розлади імунної системи, що відбуваються внаслідок порушення функціонування Т- та В-клітинної
ланок з наступними вадами гуморального та клітиноопосередкованого імунітету, називають
тяжкими комбінованими імунодефіцитами (ТКІД). Діти з ТКІД зазвичай уже мають інфекції
впродовж першого року життя і можуть загинути від них, якщо їх вчасно не лікувати.
ТКІД, пов'язаний із Х-хромосомою та спричинений мутаціями загального γ-ланцюга
рецепторів цитокінів. Приблизно 50 % тяжких комбінованих імунодефіцитів пов'язані з Х-
хромосомою та походять від мутацій гена, що кодує загальний γ-ланцюг, який входить до складу
рецепторів інтерлейкінів -2, -4, -7, -9, -15. Ці мутації рецесивні, тому не виявляються у
гетерозиготному організмі. Жінки з двома хромосомами зазвичай є фенотипово нормальними
носіями, тоді як чоловіки, що успадковують Х-хромосому з відповідними мутаціями, мають усі
ознаки захворювання.
ТКІД, пов'язаний із Х-хромосомою, характеризується порушеним дозріванням Т-клітин і
зменшеною кількістю зрілих Т-клітин. Тому кількість В-клітин, як правило, залишається
нормальною або дещо підвищеною. Гуморальний імунодефіцит при цьому захворюванні
виражається у недостатній хелперній активності Т-клітин, необхідній для продукування антитіл.
Вважають, що цей імунодефіцит виникає внаслідок нездатності рецептора цитокіну ІЛ-7, до складу
якого входить γ-ланцюг, проводити сиґнали стимуляції росту незрілих тимоцитів. Експериментальні
миші-нокаути, дефектні за цитокінзв'язувальним ланцюгом рецептора ІЛ-7 або асоційованою з
рецептором кіназою JAK-3, мають подібні фенотипові прояви захворювання, хоча у мишей
дозрівання В-лімфоцитів порушене більше, ніж у людей.
Тяжкий комбінований імунодефіцит, зумовлений дефектом аденозиндезамінази. Близько 50 %
пацієнтів з ТКІД мають аутосомно-рецесивний механізм успадкування захворювання і приблизно
половина з цих випадків походить від дефекту ферменту, що називається аденозиндезаміназа
(АДА). АДА функціонує у місцях утилізації (деградації пуринів) і каталізує відповідно незворотне
дезамінування аденозину та 2-дезоксіаденозину до інозину та 2-дезоксіінозину. Порушення
активності ферменту призводить до акумулювання дезоксіаденозину та його попередників: S-
аденозилгомоцистеїну та дезоксіаденозинтрифосфату (дАТФ). Ці проміжні продукти мають багато
токсичних ефектів, включаючи інгібування синтезу ДНК. Хоча АДА наявна у більшості клітин,
лімфоцити під час розвитку є менш ефективними у деградації дАТФ у 2-дезоксіаденозин, ніж решта
типів клітин, і тому дозрівання лімфоцитів є особливо чутливим до недостатньої функції АДА.
Недостатня активність АДА призводить до зменшення загальної кількості Т- та В-клітин. Кількість
лімфоцитів зазвичай є нормальною при народженні, але різко зменшується вже під час першого
року життя. Деякі пацієнти можуть мати близькі до нормального рівня кількості Т-клітин, але ці
клітини не проліферують у відповідь на антигенну стимуляцію. Рідкісні аутосомно-рецесивні форми
ТКІД виникають на основі порушення активності іншого ферменту — пуриннуклеотидфосфорилази
(ПНФ), що також включена у катаболізм пуринів. ПНФ каталізує конверсію інозину на гіпоксантин,
а гуанозину — на гуанін. Недостатня активність ПНФ призводить до акумулювання
дезоксигуанозину та дезоксигуанозинтрифосфату, що токсично впливають на незрілі лімфоцити,
переважно Т-клітини.
Недостатність експресії МНС II класу, синдром «оголених» лімфоцитів. Дефіцит експресії
молекул МНС класу II, який називають синдромом «оголених» лімфоцитів, є рідкісною
гетерогенною групою аутосомно-рецесивних спадкових хвороб. Захворювання характеризується
низькими рівнями експресії чи взагалі нездатністю експресувати HLA-DP, HLA-DQ та НLА-DR на
В-лімфоцитах, макрофагах і дендритних клітинах у нормі та у відповідь на дію ІФН-γ. У хворих
виявляють нормальні або дещо зменшені рівні експресії молекул МНС І та β2-мікроґлобуліну.
Дефіцит МНС II може бути спричинений мутаціями генів, що кодують фактори транскрипції,
необхідні для експресії МНС ІІ. Такі аномалії призводять до зменшеної транскрипції генів МНС II і,
як наслідок, нездатності презентувати антиген СD4 Т-лімфоцитам. Недостатня презентація антигену
призводить до дефектної позитивної селекції Т-клітин у тимусі зі зменшенням кількості зрілих CD4
Т-клітин та/чи порушеної активації клітин на периферії. В уражених осіб спостерігають
недостатність розвитку гіперчутливості сповільненого типу та гуморальної імунної відповіді на Т-
залежні білкові антигени. Недостатність експресії МНС класу II виявляється вже впродовж першого
року життя і має фатальні наслідки, якщо не застосовувати лікування методом трансплантації
кісткового мозку.
Порушення експресії молекул МНС І. Аутосомно-рецесивні дефіцити молекул МНС І
характеризуються зменшеною кількістю та порушенням функції CD8 Т-клітин. У деяких випадках
нездатність експресувати молекули МНС І спричинена мутаціями генів, що кодують ТАРІ- чи
ТАР2-субодиниці ТАР-комплексу, який за нормальних умов транспортує пептиди в
ендоплазматичний ретикулум, що потрібно для збирання комплексу МНС І.
Пацієнти з порушеннями експресії МНС І страждають переважно від бактеріальних інфекцій
дихальних шляхів, але не від вірусних інфекцій, що є трохи дивним, оскільки принципова функція
CD8 Т-клітин полягає у захисті проти вірусів.
20.1.4. Імунодефіцити, асоційовані з іншими спадковими хворобами.
Т- і В-клітинні імунодефіцити різного ступеня тяжкості трапляються за певних захворювань
неімунного походження. Ці захворювання охоплюють широкий спектр порушень різних систем і
органів. Однією з таких хвороб є пов'язаний із Х-хромосомою синдром Віскотта— Олдріча.
Хвороба характеризується екземою, тромбоцитопенією та підвищеною чутливістю до бактеріальних
інфекцій. На початкових стадіях захворювання кількість лімфоцитів нормальна, принциповий
дефект полягає у нездатності продукувати антитіла у відповідь на Т-клітинонезалежні поліцукридні
антигени. Тому хворі є особливо чутливими до інфікування інкапсульованими піогенними
бактеріями. Рівні лімфоцитів і тромбоцитів часто знижені порівняно з нормою. Зі збільшенням віку
у пацієнтів спостерігають прогресуюче зменшення кількості лімфоцитів і тяжчий перебіг
імунодефіциту. При синдромі Віскотта — Олдріча відбувається пошкодження гена, що кодує
цитозольний білок, який взаємодіє як з адаптерною молекулою Grb2, так і з малими G-білками
родини Rho, що регулюють актиновий цитоскелет. Ця молекула експресується виключно клітинами
кісткового мозку. У хворих на сидром Віскотта —Олдріча також зменшена експресія багатьох
клітинних поверхневих глікопротеїнів, включаючи багатий на залишки сіалової кислоти
глікопротеїн сіалофорин (CD43), який у нормі експресований на поверхні лімфоцитів, макрофагів,
нейтрофілів, тромбоцитів. Ці зміни клітинної поверхні можуть порушувати процеси міграції
лейкоцитів у сайти запалення.
Захворювання, асоційоване з імунодефіцитом, — це атаксія-телеангіектазія, аутосомно-рецесивне
захворювання, що характеризується порушенням руху (атаксія) та васкулярними дефектами
(телеангіектазія), нейрогенною недостатністю, збільшеною частотою виникнення пухлин та
імунодефіцитом. Імунологічні порушення при цьому захворюванні бувають різного ступеня
тяжкості та можуть включати Т- і В-клітинні функції. Найпоширенішими є дефекти гуморального
імунітету, які включають недостатність імуноґлобулінів класу А та G2. Т-клітинні порушення, що
зазвичай менш виражені, асоційовані з гіпоплазією тимуса. У хворих спостерігаються бактеріальні
інфекції верхніх і нижніх дихальних шляхів, множинні аутоімунні феномени та збільшена з віком
частота захворювання на рак. Ген, що відповідає за виникнення цієї хвороби, було ідентифіковано
на хромосомі 11, він кодує білок ATM (ataxia teleangiectasia mutated). Встановлено, що білок ATM
бере участь у виявленні пошкодження ДНК і запуску сигнальних каскадів, спрямованих на їх
ліквідацію.
Порушення механізмів природного імунітету. Природний імунітет є первинною лінією захисту
проти інфекційних організмів. Двома важливими складовими природного імунітету є фагоцити та
комплемент, що також беруть участь у ефекторній фазі адаптивного імунітету. Тому природжені
порушення функції фагоцитів та системи комплементу призводять до рецидивних інфекцій різного
ступеня тяжкості.
Порушення мікробоцидної активності фагоцитів призводить до розвитку хронічної
гранулематозної хвороби. Хронічна гранулематозна хвороба є рідкісним захворюванням. Дві
третини випадків мають рецесивний тип успадкування, що пов'язаний із Х-хромосомою, інша
третина — аутосомно-рецесивний тип успадкування. Хвороба характеризується рецидивними
внутрішньоклітинними бактеріальними та грибними інфекціями, що трапляються вже у ранньому
дитинстві. Оскільки інфекція не контролюється фагоцитами, вона стимулює хронічні
клітиноопосередковані імунні відповіді, що призводять до Т-клітиноопосередкованої активації
макрофагів і формування гранульом, які містять активовані макрофаги. Хвороба часто закінчується
летально, навіть за умов антибіотичної терапії.
Хронічна гранулематозна хвороба опосередкована мутаціями в компоненті оксидази фагоцитів,
мембранному протеїні — цитохромі b558, який також відомий як фокс (фагоцитарна оксидаза). Ця
мутація призводить до порушення продукування супероксидного аніона — реактивної кисневої
сполуки, що бере участь в основному мікробоцидному механізмі фагоцитів. Дефектна продукція
реактивних кисневих посередників призводить до нездатності вбивати фагоцитовані
мікроорганізми. Для лікування хронічної гранулематозної хвороби, пов'язаної з Х-хромосомою,
використовують ІФН-γ.
Порушення адгезії лейкоцитів. Порушення адгезії лейкоцитів є аутосомним захворюванням, що
характеризується рецидивними бактеріальними і грибними інфекціями та порушеним загоюванням
ран. У пацієнтів більшість функцій лейкоцитів, що залежать від адгезії, — дефектні. Ці функції
включають прикріплення лейкоцитів до ендотелію, агрегацію нейтрофілів та хемотаксис, фагоцитоз
і цитотоксичність, опосередковані нейтрофілами, натуральними кілерами (НК) та Т-лімфоцитами.
Молекулярною основою цих дефектів є відсутність чи недостатня експресія β-інтегринів чи
глікопротеїнів родини CD11/CD18, що включають LFA-1 (CD11a/CD18), Мас-1 (CD11b/CD18) та
p50/95 (CD11c/CD18). Ці білки беруть участь в адгезії лімфоцитів до інших клітин. Як правило,
принциповий дефект зводиться до дефекту β-ланцюга (CD 18). Ген, що кодує цей ланцюг, може
утримувати мутацію і тому продукувати неправильний транскрипт, або рівень його транскрипції
може бути зменшеним.
Порушення адгезії лейкоцитів другого типу є іншою хворобою, що описана у дуже невеликої
кількості пацієнтів. Ця хвороба спричинюється відсутністю вуглеводневого ліганду нейтрофілів,
сіаліл-Lewis Х, необхідного для зв'язування з Е- та Р-селектинами на активованому цитокінами
ендотелії. Причиною цього дефекту є мутації гена, що кодує фермент фукозилтрансферазу, який
включений у синтез компонентів сіаліл-Lewis Х.
Порушення активності натуральних кілерів та інших лейкоцитів: синдром Чедак—Хігаші.
Синдром Чедак —Хігаші є рідкісним аутосомно-рецесивним захворюванням, що характеризується
рецидивною інфекцією піогенними бактеріями, частковим альбінізмом шкіри навколо очей.
Перші дослідження цього синдрому виявили у нейтрофілах, моноцитах та лімфоцитах хворих
великі цитоплазматичні гранули. Вважають, що хвороба походить з таких аномалій клітин, які
призводять до підвищеної здатності внутрішньоклітинних гранул до злиття. Цей феномен злиття
характерний для лізосом нейтрофілів і макрофагів (призводить до зниженої стійкості до інфекції),
гранул меланоцитів (зумовлює альбінізм), клітин нервової системи (спричинює дефекти розвитку
нервів) та тромбоцитів (порушується згортання крові). Ген, що відповідає за це порушення,
знаходиться у хромосомі 1. Під час дозрівання нейтрофілів з мієлоїдних попередників у клітинах
утворюються гігантські лізосоми. Деякі з цих попередників передчасно гинуть і спричинюють
помірну лейкопенію. Нейтрофіли, що виживають, можуть мати менші кількості лізосомальних
ензимів, необхідних для їх бактерицидної активності. Ці клітини є також дефектними за
хемотаксисом та фагоцитозом, що також призводить до дефекту мікробоцидної активності. Дефекти
у лізосомах дендритних клітин і макрофагів можуть порушувати процесинг та процес презентації
антигену. Функції НК-клітин у цих пацієнтів також дефектні, можливо, через аномалії
цитоплазматичних гранул, що запасають білки, потрібні для цитолізу клітин-мішеней. Слід
зазначити, що ЦТЛ-залежне вбивство клітин-мішеней відбувається нормально.
Порушення системи комплементу. Класична система комплементу складається з дев'яти
компонентів (С1 – С9) та регуляторних білків (С1-інгібітора, С4-зв'язувального білка, пропердину,
факторів І і Н та ін.). На різних етапах активації комплементу відбуваються різні біологічні реакції,
важливі для розвитку запальної відповіді та захисту організму від інфекції (див. розд. 2).
Генетичні дефекти описані для всіх компонентів системи комплементу людини. У всіх випадках
дефекти успадковуються за аутосомно-рецесивним типом. Описано стани з нефункціональним C1q-
компонентом. Дефіцит С8-компонента трапляється дуже рідко. Особливістю будови С8-компонента
є нековалентне сполучення β-ланцюга з α- та γ-ланцюгами. За дефіциту С8-компонента в
європеоїдів відсутній β-ланцюг, а за подібного дефекту у негроїдів відсутні α- та β-ланцюги. В обох
випадках сироватка містить нефункціональні, неповні молекули С8. Дефіцит С9-компонента з
більшою частотою трапляється серед японців. Дефіцит пропердину успадковується зчеплено з Х-
хромосомою.
Описано також генетичні дефекти трьох інгібіторів системи комплементу: С1-інгібітора, факторів І
та Н. Дефіцит С1-інгібітора успадковується за аутосомно-домінантним типом. Цей дефіцит
призводить до розвитку спадкового ангіоневротичного набряку чи хвороби Квінке. У 15 %
уражених родичів у сироватці крові відмічають нормальний або підвищений рівень
нефункціонального білка в результаті точкових мутацій у гені С1-інгібітора в ділянці екзону, що
кодує активну ділянку молекули.
Імунодефіцити, асоційовані із захворюваннями, зумовленими генетичними дефектами
метаболізму. Нині виділяють багато захворювань, що супроводжуються розвитком імунодефіцитів,
пов'язаних з патологією хромосом.
Трисомія за 21-ю парою хромосом (синдром Дауна) супроводжується рецидивними інфекціями.
Спостерігається прогресуюче зменшення сироваткових рівнів IgM. Може відбуватися дисплазія
тимуса та порушення активності НК-клітин. Є також дані про порушення гіперчутливості
сповільненого типу, недостатнє продукування антитіл і цитокінів у хворих. Відомо, що 21-ша
хромосома містить ген, що кодує рецептор інтерферону. Тому лімфоцити з трисомією за 21-ю
хромосомою чутливіші до дії інтерферону, ніж нормальні.
Хворі на синдром Тернера також страждають на часті інфекції, аутоімунні захворювання, злоякісні
пухлини. У половини хворих виявляють імунодефіцит зі зниженням сироваткових рівнів IgM та
IgG.
Існує велика група захворювань, пов'язаних з природженими порушеннями метаболізму. Деякі
спадкові дефекти метаболізму можуть впливати на імунну функцію. Наприклад, за дефіциту
транскобаламіну 2, транспортного білка вітаміну В
12
відбувається загальне порушення гемопоезу та
проліферації лімфоцитів. Спостерігається також порушення функції гранулоцитів та імунодефіцит,
що переважно впливає на функцію В-лімфоцитів. У разі біотинзалежної недостатності карбоксилази
також спостерігають підвищену чутливість до інфекційних захворювань. Відомі випадки дефіциту
IgA та зниження кількості Т- і В-клітин у периферичній крові.
20.1.5. Терапевтичні підходи для лікування первинних імунодефіцитів.
У теорії стратегією терапії природжених порушень лімфоцитів є заміна дефектного гена в клітинах-
попередниках, що поновлюються. Заміна генів залишається віддаленою метою лікування більшості
імунодефіцитів людини. Основною перешкодою для генної терапії нині є труднощі у виділенні та
очищенні стовбурових клітин, що поновлюються, які є ідеальною мішенню для введення чи заміни
гена. Другою причиною є відсутність методу для введення генів у клітини та досягнення стабільної
й тривалої експресії на високому рівні. Сьогодні лікування імунодефіцитів має дві мети: зменшити
та контролювати інфекцію і замінити дефектні або відсутні компоненти імунної системи за
допомогою адоптивного трансферу та/чи трансплантації. Пасивна імунізація пулом гаммаглобулінів
дуже важлива для хворих на агаммаґлобулінемію і вже зберегла життя багатьом пацієнтам з
пов'язаною з Х-хромосомою агаммаґлобулінемією. Трансплантацію кісткового мозку нині також
широко використовують для лікування різних імунодефіцитів. Цей метод успішно застосовують для
лікування ТКІД з дефіцитом АДА, синдрому Віскотта—Олдріча, синдрому «оголених» лімфоцитів
та дефіциту адгезії лімфоцитів. Цей метод високоефективний, коли вилучають Т-клітини з
кісткового мозку і знаходять донорів, сумісних за HLA-антигенами, щоб уникнути розвитку
хвороби трансплантат проти хазяїна.
Терапія із заміною ферментів АДА та ПНФ за їх дефіциту також випробовувалася з використанням
трансфузій еритроцитів як джерела цих ферментів. Цей підхід надає тимчасове клінічне поліпшення
у деяких хворих на ТКІД. Ін'єкції кон'югованого з поліетиленгликолем бичачого АДА, щоб
подовжити тривалість напівжиття ферменту в сироватці, у деяких випадках також були
позитивними.
20.2. ВТОРИННІ ІМУНОДЕФІЦИТИ.
Імунодефіцит називають вторинним, якщо він виникає внаслідок захворювання неімунної природи
або дії на організм певного агента — радіації, лікарських препаратів тощо.
У світі найпоширенішою причиною вторинних імунодефіцитів є недостатнє і неправильне
харчування. У розвинених країнах причиною вторинних імунодефіцитів можуть бути лікарські
препарати, які використовують у протипухлинній терапії, та імуносупресанти, що їх застосовують
при трансплантації органів та аутоімунних захворюваннях. Виникнення вторинних імунодефіцитів
часто спостерігається як наслідок розвитку аутоімунних захворювань, при тяжких бактеріальних і
вірусних інфекціях.
Імунодефіцити, зумовлені нестачею харчування. Нестача білків та енергетична недостатність їжі
часто спостерігаються у країнах, що розвиваються, й асоціюються з порушенням клітинного і
гуморального імунітету у відповідь на мікроорганізми. Основною причиною захворюваності та
смертності людей, що недостатньо харчуються, є інфекційні захворювання. Причини цих
імунодефіцитів ще точно не встановлено, але припускають, що серйозні порушення метаболізму в
уражених осіб, опосередковані ненормальним надходженням білків, жирів, вітамінів і мінералів,
впливають на дозрівання та функції клітин імунної системи.
Однією з ознак недостатнього харчування є атрофія лімфоїдної тканини. У виснажених дітей часто
розвивається так звана «харчова тимектомія», що характеризується порушенням структури тимуса,
загальним зменшенням кількості лімфоцитів у ньому та атрофією тимусзалежних періартеріолярних
ділянок селезінки та паракортикальних ділянок лімфатичних вузлів.
За недостатнього забезпечення харчування білками та вживання малоенергетичної їжі часто
спостерігають пригнічення клітинного імунітету, про що свідчить зниження кількості CD4 Т-
лімфоцитів. Лімфоцити мають знижену здатність відповідати проліферацією на мітогени. Такі зміни
кількості й функції Т-клітин можуть бути зумовлені зниженням активності гормонів тимуса.
Недостатнє забезпечення їжі білками та енергією у виснажених осіб призводить до змін у
фагоцитарній функції макрофагів, тобто до порушення здатності цих клітин руйнувати поглинені
мікроби. Спостерігається зниження рівнів компонентів комплементу С3, С5 та фактора В,
зменшення продукування цитокінів ІЛ-2, ФНП, ІФН.
Імунодефіцити, індуковані дією карських препаратів. Імуномодулювальнії лікарські препарати
можуть істотно пригнічувати функції імунної системи.
Глюкокортикоїди є досить сильними природними модуляторами імунної відповіді. По-перше, вони
впливають на склад лейкоцитів, що циркулюють. Дія глюкокортикоїдів індукує лімфоцитопенію,
причому СD4Т-клітини є найчутливішими, і їхня кількість зменшується більшою мірою, ніж Т-
лімфоцитів інших субпопуляцій. Крім того, у крові людини спостерігається зменшення кількості
моноцитів, еозинофілів та базофілів. Уведення стероїдних препаратів одночасно призводить до
нейтрофілії внаслідок виходу зрілих клітин із кісткового мозку і затримки їх у циркуляції.
Стероїдні препарати впливають також на певні функції клітин імунної системи. Доведено, що
стероїди гальмують активацію та проліферацію Т-клітин та інгібують продукування ФНП та ІЛ-1
моноцитами. Помічено, що після введення стероїдних препаратів знижується продукування цілого
ряду цитокінів: ІФН-γ, ІЛ-1, ІЛ-2, ІЛ-6, ІЛ-10.
Формування імунодефіцитних станів можуть спричинити препарати, що використовуються для
імуносупресії при алотрансплантації. Наприклад, циклоспорин А та його аналог такролімус, що
гальмують проведення активаційних сигналів від рецепторів цитокінів, супресивно діють не лише
на лімфоїдні клітини, а й на клітини нелімфоїдного походження, оскільки молекулярні мішені цих
препаратів широко представлені в різних тканинах. Препарати типу сіролімусу і еверолімусу
порушують проведення активаційного сигналу від костимуляторних молекул і рецепторів цитокінів.
Вони гальмують синтез нуклеїнових кислот у стимульованих клітинах. Побічні ефекти цих
лікарських засобів спостерігаються у різних типах клітин. Крім того, у пацієнтів, яких лікують цими
препаратами, спостерігають підвищення частоти виникнення пневмонії. У пацієнтів, які отримують
преднізолон, виявляють супресію дозрівання клітин кісткового мозку, порушення функції травного
каналу та ускладнені інфекції, спричинювані грибами.
Різні препарати, які використовують у протипухлинній терапії, можуть значно пригнічувати функції
імунної системи. Супресію імунної відповіді можуть спричинити такі антиметаболіти, як азатіоприн
і меркаптопурин, що порушують синтез РНК та ДНК унаслідок гальмування інозинової кислоти —
попередника синтезу аденіну та гуаніну. Метотрексат — аналог фолієвої кислоти, блокує
метаболічні процеси, що відбуваються за її участю та необхідні для синтезу ДНК. Після
застосування метотрексату спостерігається тривале зниження в крові рівнів імуноґлобулінів усіх
класів. Хлорамбуцил та циклофосфамід алкілують ДНК, і спочатку їх застосовували для лікування
онкохворих. Однак дослідження їх цитотоксичної дії на лімфоцити зумовили використання цих
препаратів як імуносупресивних терапевтичних агентів.
Інфекційні імунодефіцити. До розвитку імуносупресії можуть призводити різні види інфекцій.
Один із найвідоміших вірусів, який безпосередньо уражує клітини імунної системи, — вірус
імунодефіциту людини (ВІЛ).
Синдром набутого імунодефіциту (СНІД) спричинюється ВІЛ і характеризується різними
клінічними проявами, в тому числі глибокою імуносупресією, асоційованою з низкою
опортуністичних інфекцій і пухлин, та порушеннями нервової системи.
Вірус імунодефіциту людини було описано у 1983 р. одночасно французькими та американськими
вченими. Вірус належить до ретровірусів, у яких генетичний матеріал знаходиться у вигляді РНК і
перетворюється на ДНК за допомогою зворотної транскриптази.
Існують два типи ВІЛ —ВІЛ 1 та ВІЛ2. Вони подібні на 40 — 60 % на рівні геному, але ВІЛ2 є менш
контагіозним і патогенним, ніж ВІЛ1.
Вірусні частинки, які ініціюють інфікування, можуть знаходитися у різних рідинах організму,
включаючи кров, сім'яну рідину, і потрапляють в організм іншої особи під час статевого контакту
або медичних маніпуляцій (переливання крові, використання нестерильних голок). Досліджено, що
75% уражень ВІЛ1 відбувається унаслідок гетеросексуальних стосунків.
Частинка вірусу складається з двох ідентичних ланцюгів вірусної РНК, кожна завдовжки 9,2 kb,
упаковані в корові білки вірусу й оточені біліпідним шаром плазматичної мембрани клітини хазяїна.
На поверхні мембрани розміщені вірусні глікопротеїди, необхідні для адсорбції вірусної частинки
на чутливих клітинах і потрапляння всередину останніх.
Геном ВІЛ має характерну для ретровірусів структуру. Довгі кінцеві повтори (Long terminal repeats
— LTR) потрібні для інтеграції в геном хазяїна та реплікації вірусних генів. Ділянка геному gag
кодує корові структурні білки, a env — поверхневі глікопротеїди gp120 та gp41. Послідовність роl
кодує зворотну транскриптазу, протеазу та інтегразу — білки, необхідні для реплікації вірусу.
Геном вірусу містить також ряд регуляторних генів rev, tat, vif, nef, vpr та vpu, продукти яких
регулюють утворення вірусних частинок.

78
Адсорбція вірусу на чутливих клітинах відбувається внаслідок взаємодії поверхневого
глікопротеїдного комплексу віріону gp120/gp41 із комплементарними структурами CD4 та G-
білокзв'язувальним рецептором (GCR) або, як його ще називають, корецептором, на поверхні
чутливих клітин хазяїна. Процес проникнення вірусу HIV у клітину ще до кінця не вивчений.
Взаємодія gp120 з CD4 індукує конформаційні зміни в gp120, що призводить до експозиції раніше
прихованих доменів, які взаємодіють з корецепторами. При цьому утворюється потрійний комплекс
gp120-CD4-корецептор. Утворення потрійного комплексу gp120-CD4-корецептор призводить до
додаткових конформаційних змін у gp120, що передаються до вірусного трансмембранного
глікопротеїду gp41 та індукують зміни структури останнього. Внаслідок цього N-кінцева fusion
послідовність gp41 спрямовується до клітинної мембрани, де вона входить у біліпідний шар та
ініціює злиття вірусної й клітинної мембран.
Більшість GCR, що використовуються ВІЛ для потрапляння в клітину, є рецепторами для хемокінів.
Перший ідентифікований корецептор, CXCR4, використовують Т-клітинотронні,
синцитіуміндукувальні (SI) штами ВІЛ. Інший корецептор, CCR5, використовують віруси, тропні до
макрофагів, що не утворюють синцитіуми (NSI). Припускають, що ці два типи корецепторів
найчастіше використовуються вірусом і тому відіграють основну роль для підтримання інфекції ВІЛ
in vivo. Існують також інші GCR, як було показано in vitro, що сприяють ураженню клітини певними
штамами ВІЛ: CCR2b, CCR3, CCR8, CCR9, CX3CR1 та ін. Наприклад, CCR3 сприяє інфікуванню
макрофагів та мікроглії. Первинною мішенню інфікування у такому випадку є нервова система.
Після проникнення вірусу в клітину корові білки віріона порушуються і РНК-геном ВІЛ за
допомогою зворотної транскриптази перетворюється на форму подвійнонитчастої ДНК, яка
надходить у ядро інфікованої клітини. Вірусна інтеграза сприяє включенню вірусної ДНК в геном
клітини хазяїна. У такому транскрипційно неактивному стані вірус може існувати впродовж місяців,
а то й років. За таких умов відбувається слабке продукування вірусних білків. Цей період інфекції
називають латентним.
Експресію певних генів ВІЛ можна поділити на два періоди. Впродовж раннього періоду
експресуються ранні регуляторні гени nef, tat та rev. Пізні гени включають роl, gag та env, продукти
яких є структурними компонентами вірусної частинки. мРНК, яка кодує різні білки ВІЛ,
отримується внаслідок альтернативного сплайсингу загального транскрипту повного вірусного
геному. Деякі білки вірусу утворюються внаслідок розщеплення загального білкового попередника
клітинними протеазами. Наприклад, продукт гена env загальний попередник gp160 розщеплюється
на два компоненти — gp120 та gp41, які нековалентно сполучені й утворюють комплекс у
плазматичній мембрані клітини. Складання вірусних частинок починається з упаковки РНК-
транскриптів вірусу в нуклеопротеїдний комплекс із корових білків та ензимів, необхідних для
наступного циклу інтеграції вірусу. Нуклеопротеїдний комплекс потім обволікується плазматичною
мембраною клітини з експресованими на ній вірусними білками gp120/gp41 та відбруньковується
від клітини. Цей процес набуває стихійного характеру, і клітина-мішень гине.
Сайти знаходження вірусу в організмі можна поділити на клітинні та анатомічні. Лімфатичні вузли
є найактивнішими анатомічними сайтами реплікації вірусу. Основні клітини, які уражуються при
інфекції ВІЛ, є СD4-позитивні клітини, якими насамперед є Т-хелпери, що містять близько 99 %
реплікувального вірусу в організмі хазяїна. Активність вірусу виснажує популяцію Т-хелперів, що
призводить до порушення гомеостазу всієї імунної системи. CD4-антиген несуть також макрофаги,
дендритні клітини, певна популяція активованих CD8 Т-лімфоцитів. Нині ще існує невизначеність
щодо того, які саме клітини є найважливішими мішенями за первинного інфікування ВІЛ.
Інфіковані макрофаги, які становлять менше 1 % усіх інфікованих клітин, є найважливішими для
поширення вірусу в організмі. Кількість інфікованих макрофагів невелика, але макрофаги
резистентні до цитопатичного ефекту ВІЛ і живуть відносно довго, виділяючи вірусні частинки
впродовж цього часу. Клітини Лангерганса та дендритні клітини слизових є важливими мішенями
ВІЛ за статевого способу передавання інфекції. Нещодавно було показано, що рецептор дендритних
клітин (DC-SIGN) залучений до ефективного зв'язування ВІЛ та передавання вірусу Т-лімфоцитам.
DC-SIGN — гомолог — DC-SIGNR — експресований на ендотеліальних клітинах синусоїдів
печінки, клітинах ендотелію лімфатичних вузлів і мікроворсинках плаценти, що може відігравати
певну роль у передаванні ВІЛ клітинам лімфовузлів або у вертикальному передаванні вірусу.
Перебіг СНІД визначають за кількістю вірусних частинок у плазмі крові та за кількістю CD4
+
Т-
лімфоцитів. Через кілька діб після потрапляння вірусу в організм розвивається віремія. Інтенсивна
реплікація вірусу спостерігається у лімфатичних вузлах. Вважають, що саме уражені дендритні
клітини, які не чутливі до цитопатичного ефекту вірусу, транспортують вірус у лімфатичні вузли і
сприяють ураженню лімфоцитів через прямі міжклітинні контакти. Віремія сприяє поширенню
вірусу по всьому організму та інфікуванню Т-клітин, макрофагів і дендритних клітин периферичних
лімфоїдних органів. Імунна система, яка на цей час уже розпізнала вірусні антигени, починає
реагувати на них підсиленням гуморальної та клітиноопосередкованої імунної відповіді. Імунна
система на цьому етапі частково контролює інфекцію і продукування вірусу. Такий контроль
виявляється у зменшенні кількості вірусних частинок у крові до низьких рівнів упродовж приблизно
12 міс. Під час цієї фази захворювання імунна система залишається компетентною і вправно
знешкоджує інфекційні агенти іншої природи. Жодних клінічних проявів ураження ВІЛ не
реєструється. В сироватці крові спостерігають незначну кількість віріонів, але більшість СD4Т-
лімфоцитів периферичної крові вільні від вірусу. Однак порушення СD4Т-лімфоцитів у лімфоїдних
тканинах поступово прогресує, а кількість СD4Т-лімфоцитів на периферії невпинно знижується,
незважаючи на те, що ця популяція лімфоцитів постійно поновлюється.
Під час прогресування СНІДу імунна відповідь пацієнта на інші інфекційні агенти може
стимулювати поширення вірусу та ураження ним лімфоїдної тканини. Активація транскрипції генів
ВІЛ у лімфоцитах може відбутися у відповідь на активаційні цитокіни. СНІД набуває своєї
останньої фази, коли спостерігається значне зниження CD4 Т-лімфоцитів периферичної крові і
уражуються лімфоїдні тканини. Кількість вірусних частинок у крові знову зростає. Уражені люди
страждають на різні опортуністичні інфекції та неоплазми, оскільки активність CD4 Т-лімфоцитів,
необхідна для клітиноопосередкованої та гуморальної імунної відповіді, різко знижена. У пацієнтів
спостерігаються порушення роботи нирок і нервової системи.
Відомо, що інші віруси крім ВІЛ порушують імунні реакції і призводять до розвитку інфекцій,
ускладнених іншими мікроорганізмами. Прикладом є Т-клітинний лімфотропний вірус людини
першого типу (HTLV-1). Подібно до ВІЛ, HTLV-1 є ретровірусом, що характеризується тропізмом
до CD4 Т-лімфоцитів, але замість убивства цих клітин вірус трансформує їх в агресивні Т-клітинні
пухлини, що називаються гострими Т-клітинними лейкозами (ГТЛ). Хворі на ГТЛ, як правило,
мають тяжкі імуносупресивні стани з множинними опортуністичними інфекціями.
Хронічні інфекції Mycobacterium tuberculosis та різні ураження, спричинювані грибами, часто
призводять до анергії на різні антигени. Хронічні паразитарні інфекції можуть також призводити до
імуносупресії. Наприклад, діти в Африці з хронічною малярійною інфекцією мають пригнічені
функції Т-клітин, що може зумовити розвиток у них пухлин, індукованих вірусом Епштейн-Барр.
Радіаційний імунодефіцит. Пострадіаційне зниження стійкості організму до інфекцій є прямим
результатом імунодефіцитного стану. Опромінення знижує стійкість організму практично до всіх
типів інфекцій. Це підтверджено багатьма дослідами зі збудниками мікробного та вірусного
походження. Після дії радіації часто спостерігають, атрофію тимуса, що прогресує, зміни в інших
органах імунної системи та порушення проліферації В- і Т-клітин.
Друга форма імунної недостатності — пострадіаційний канцерогенез, один із найчастіших і
найнебезпечніших проявів віддаленої патології, що розвивається після дії йонізуючих
випромінювань.
У кожному конкретному випадку майже неможливо точно визначити, завдяки поєднанню яких
факторів утворюються так звані спонтанні порушення ДНК, що нерідко в похилому віці призводять
до розвитку пухлин. Показано, що при дії радіації найчастіше пухлини спостерігаються після
опромінення дозою 2 —2,5 Гр. Однак шкала радіаційних доз, що мають канцерогенний ризик,
значно ширша. Є повідомлення, що канцерогенними виявляються навіть деякі малі (техногенні)
дози, які раніше вважалися безпечними. Можливо, це пов'язано з поєднанням дії радіації з іншими
факторами. Встановлено, що ймовірність виникнення онкологічного процесу (у віддаленому
пострадіаційному періоді) здебільшого підвищується після дози 1 Гр і вище. В статистичному
відношенні ймовірність захворіти на рак зростає прямо пропорційно дозі. За подвійної дози ризик
подвоюється. Для людини характерно те, що канцерогенний ризик після 30 років подвоюється
кожні 9 — 10 років.
Канцерогенний процес виникає на молекулярному рівні у вигляді генних мутацій, але подальший
розвиток цих перероджених клітин залежить від того, чи пройдуть вони імунний нагляд лімфоцитів.
Можливою причиною уникнення пухлинних клітин імунного нагляду, а отже, і росту пухлини може
бути специфічна супресія опосередкованої ЦТЛ імунної відповіді, зумовлена порушенням балансу
Тх1/Тх2 у бік останніх (див. розд. 16), що спостерігається у більш віддалені терміни після дії
радіації.
Третій тип змін імунної реактивності в опроміненому організмі, який виникає на фоні
імунодефіцитних станів, — це аутоімунні захворювання. Початкова причина виникнення цих
захворювань у пострадіаційному періоді і при старінні залежить від змін в антигенній структурі
клітин організму та від порушень, що виникають у клітинах самої імунної системи, коли
з'являються аутореактивні клони лімфоцитів. Отже, розвиток аутоімунних конфліктів у цих
випадках відбувається в результаті порушення механізмів розпізнавання «свого» та «чужого».
У період старіння, зумовленого опроміненням, можуть спрацьовувати обидва механізми, внаслідок
чого розвиваються різні аутоімунні конфлікти, особливо часто спрямовані проти залозистих
ендокринних органів (щитоподібної залози, острівцевого апарату підшлункової залози та ін.). До
цих органів належить також тимус. Розвиток аутоімунного тиміту спричинює наступні імунні
порушення, зокрема послаблення імуносупресії, що, в свою чергу, сприяє прогресії аутоімунних
процесів. Наслідки «променевого» старіння тимуса можуть бути небезпечнішими, ніж тимектомія.
Порушення йонізуючою радіацією функціонування цитокінової сітки значно впливає на ряд
важливих процесів, у тому числі інтегративних. Дія радіації на синтез цитокінів істотно залежить
від природи клітин-продуцентів. Так, утворення лімфокінів in vitro пригнічується у зв'язку з
масовою загибеллю лімфоцитів, що їх утворюють, після дії йонізуючого випромінювання, хоча сам
механізм продукування цитокіну може стимулюватися опроміненням, як це відбувається у випадку
з інтерлейкіном-2 (ІЛ-2). Стимулювальна дія йонізуючої радіації на синтез ІЛ-1, ІЛ-6 та фактора
некрозу пухлин (ФНП) макрофагами, стромальними та епітеліальними клітинами показана на рівні
експресії мРНК та секреції цитокінів (зокрема, в тимусі). Не виключено, що ця дія опромінення
реалізується за участю продуктів кисневого метаболізму, що утворюються як під впливом
йонізуючої радіації, так і в нормі в процесі активації клітин. Різні дози випромінювання по-різному
впливають на синтез та продукування цитокінів. Так, після опромінення клітин периферичної крові
людини встановлено зміни рівня поверхневих (мембранних) та внутрішньоклітинних форм
цитокінів ІЛ-1β, ІЛ-4, ІЛ-6, ФНП, ІФН-α. Опромінення у дозі 1,25 Гр призводить до зниження
продукування ІЛ-1β, активації синтезу ІЛ-6 та ФНП. За дози 0,25 Гр спостерігається активація
продукування ІЛ-1β, ФНП, ІФН-α та значне зростання синтезу ІЛ-4. Доза 0,5 Гр стимулює синтез
ІЛ-1β. Вважають, що ці зміни в продукуванні цитокінів ініціюють подальші апоптичні процеси в
імунній системі.
Стимуляція опроміненням синтезу ряду цитокінів становить значний інтерес, оскільки, наприклад,
ІЛ-1 та ФНП мають радіопротективну дію, яка реалізується за участю ІЛ-6; в поєднанні з ІЛ-1
радіозахисну дію мають також гранулоцитарний та гранулоцитарно-макрофагальний
колонієстимулювальний фактори. Отже, ці явища можна віднести до групи феноменів, які свідчать
про те, що деякі ефекти радіації спрямовані на послаблення або ліквідацію спричинених нею
наслідків.
Під впливом опромінення порушується баланс Тх1 та Тх2, який визначає співвідношення
клітиноопосередкованої та гуморальної складових імунної відповіді, що зумовлює виникнення
імунопатологічних станів. Більшість дослідників вважає, що опромінення ушкоджує переважно
Тх2-, ніж Тх1-клітини, але існують також дані протилежного характеру. Встановлено, що у більш
віддалені терміни чіткіше виявляється дефіцит Тх1. Ці дані свідчать про те, що радіація значно
змінює функціональну структуру імунної системи, зсуваючи баланс Тх1/Тх2 спочатку в бік Тх1, а
потім у бік Тх2. Можливо, наслідком цього є те, що в ранні терміни після дії опромінення
здебільшого спостерігається пригнічення антибактеріального захисту та інших форм гуморального
імунітету, а згодом відбувається послаблення протипухлинної та противірусної резистентності.
Проявами послаблення Тх1-залежної ланки імунної системи можуть бути зниження захисту проти
збудників туберкульозу, лепри, деяких паразитарних інфекцій, підвищення схильності до
алергічних процесів.
Встановлено, що опромінення порушує «хомінг» лімфоцитів, впливаючи на специфічність міграції
лімфоцитів, що рециркулюють у лімфатичні вузли (в їх проникненні в селезінку змін не
відбувається, оскільки цей процес не залежить від механізму «хомінгу»). Цей дефект не усувається
впродовж тривалого часу після дії опромінення. Це стосується більше Т-, ніж В-лімфоцитів.
Наслідком цього є формування певного дисбалансу: вираженість реакції гуморальної імунної
відповіді у лімфатичних вузлах послаблюється порівняно із селезінкою.
Зв'язок цих порушень з особливостями експресії конкретних молекул адгезії остаточно ще не
з'ясований. Однак відомо, що експресія деяких адгезивних молекул контролюється цитокінами. Так,
ІЛ-1 та ФНП підсилюють експресію Е-селектину, молекул ІСАМ-1 та VCAM-1 (рецепторів
інтегринів); ІФН вибірково підсилює експресію ІСАМ-1; ІЛ-3 — Е-селектину; ІЛ-4 — VCAM-1.
Отже, пострадіаційні зміни синтезу цитокінів Т-хелперами типів Тх1 (а також
моноцитами/макрофагами) і Тх2 мають позначатися на експресії молекул адгезії, що, в свою чергу,
може вплинути на процеси рециркуляції лімфоцитів та їх міграції в тканини.
Імунодефіцити, пов'язані з оперативним видаленням органів імунної системи. Одна з форм
набутого імунодефіциту, яку також слід згадати, виникає внаслідок хірургічного видалення
селезінки після травмування органа, а також з терапевтичною метою для лікування певних
гематологічних захворювань чи порушень при серпоподібноклітинній анемії. Особи, позбавлені
селезінки, є чутливішими до інфікування деякими мікроорганізмами, особливо інкапсульованими
бактеріями, наприклад Streptococcus pneumoniae. Збільшена чутливість до мікроорганізмів є
наслідком відсутності такої важливої функції селезінки, як очищення крові від опсонізованих
мікробів у результаті їх фагоцитозу.
ВИСНОВКИ.
Імунодефіцитні захворювання поділяють на дві основні групи: природжені (первинні) та набуті
(вторинні). Первинні імунодефіцити спричинені мутаціями генів, що кодують важливі для роботи
імунної системи молекули – рецепторів, корецепторів, цитокінів, молекули МНС, ферментів
метаболізму, компонентів системи комплементу тощо. Завдяки таким своєрідним «експериментам
природи», як імунодефіцити, можна встановити роль певних молекул у функціонуванні імунної
системи та організму людини в цілому. Первинні імунодефіцити, як правило, виявляються у людей
невдовзі після народження.
Вторинні імунодефіцити розвиваються внаслідок дії на організм шкідливих чинників
навколишнього середовища (недостатність харчування, вживання цитотоксичних хімічних речовин,
опромінення, інфекційні агенти). Вторинні імунодефіцити розвиваються після реалізації ефекту
ушкодження екзогенними чинниками імунної системи. Загальними проявами імунодефіцитів є
підвищення чутливості до інфекцій різного походження та підвищення ризику виникнення
злоякісних пухлин.
Контрольні запитання.
1. У чому полягає основна відмінність між первинними і вторинними імунодефіцитами?
2. Які скарги пацієнта можуть викликати у лікаря підозру щодо наявності у нього імунодефіциту?
3. За якими ознаками можна виділити гуморальні, клітинні та комбіновані імунодефіцити?
4. За яким механізмом вірусу імунодефіциту людини вдається нокаутувати імунну систему
організму хазяїна?
5. Які підходи використовують для терапії імунодефіцитів?
РОЗДІЛ 21. ІМУНОДІАГНОСТИКА ТА ІМУНОКОРЕКЦІЯ.
У сучасній практиці клініко-імунологічних досліджень актуальними є завдання оцінювання стану
імунної системи та способів імунокорекції. Виділяють три основні групи патології імунної системи
(Б. В. Пінегін, 1997): імунодефіцитний стан, спричинений кількісною або функціональною
недостатністю певної ланки імунітету; порушення в розпізнаванні антигенів імунної системи, що
призводить до розвитку аутоімунних процесів; гіперреактивна або «змінена» імунна відповідь, що
виявляється розвитком алергічних за хворювань.
21.1. ПРИНЦИПИ І МЕТОДИ ІМУНОДІАГНОСТИКИ.
Традиційно методи лабораторних імунологічних досліджень поділяють на методи оцінювання
природного та клітинного і гуморального антигенспецифічного імунітету. Розрізняють різні рівні
імунологічного обстеження. Визначення кількісних показників і функціональної активності імунної
системи в нормі та при патології згідно з рекомендаціями НДІ імунології (Р. В. Петров та співавт.)
проводять за двохетапним принципом оцінювання імунного статусу. На першому етапі виявляють
первинні дефекти імунітету за допомогою орієнтовних тестів, до яких належать:
визначення Т- і В-лімфоцитів у крові; дослідження концентрації сироваткових імуноґлобулінів A, G,
М;
оцінювання фагоцитарної активності клітин.
На другому етапі застосовують аналітичні тести. До них належать усі тести, що дають змогу
оцінити функціональну активність Т- і В-лімфоцитів, НК-клітин, фагоцитів. Існують інші
класифікації методів оцінювання імунного статусу. Методи імунодіагностики поділяють на
орієнтовні та уточнювальні. Перші використовують для фіксування порушень в імунній системі,
другі — для визначення механізмів їх реалізації з метою подальшої імунокорекції. Для оцінювання
імунного статусу визначають загальне число лімфоцитів, їх популяцій, досліджують
функціональний стан Т- і В-клітинних ланок імунітету та системи фагоцитів.
Оцінювання функціональної активності Т-клітинної ланки імунітету. Oрієнтовні методи:
визначення відсоткового та абсолютного числа зрілих Т-лімфоцитів — CD3 і двох основних
субпопуляцій — хелперів CD4 та кілерів/супресорів CD8; дослідження відповіді Т-лімфоцитів на
ФГА, Кон А, мітоген лаконосу в реакції бластної трансформації лімфоцитів (РБТЛ).
Уточнювальні методи: визначення активаційних маркерів CD25 та HLА ІІ на Т-лімфоцитах;
дослідження продукування цитокінів — γ-інтерферону, фактора некрозу пухлин, інтерлейкіну-1, -2,
-4, -5, -6 та інших in vivo або in vitro; вивчення проліферативної відповіді в РБТЛ на специфічний
антиген; дослідження інтенсивності апоптозу Т-лімфоцитів методом визначення числа CD95;
визначення супресорної активності лімфоцитів: спонтанної та Кон А-індукованої.
Оцінювання функціональної активності В-клітинної ланки імунітету. Орієнтовні методи:
встановлення відсоткової та абсолютної кількості В-лімфоцитів CD20 або CD19, CD22; визначення
рівня продукування імуноґлобулінів А, М, G, Е у сироватці крові; визначення циркулюючих у крові
імунних комплексів; дослідження відповіді в РБТЛ на В-клітинний мітоген (ЛПЦ Е. соlі чи S.
typhimurium).
Уточнювальні методи: визначення рівня продукування специфічних імуноглобулінів; визначення
продукування ІЛ-6 in vivo, in vitro; визначення концентрації секреторного імуноґлобуліну.
Оцінювання функціональної активності системи фагоцитів. Орієнтовні методи: визначення
абсоютного числа нейтрофілів, моноцитів; дослідження інтенсивності фагоцитозу, фагоцитарного
числа та індексу; дослідження бактерицидної активності фагоцитів.
Уточнювальні тести: дослідження ітенсивності хемотаксису (міграції) фагоцитів (спонтанного й
індукованого); визначення кількості (у відсотках) фагоцитарних клітин та середньої здатності
фагоцитів до поглинання, дослідження розпластування макрофагів та агрегування, адгезійної
здатності нейтрофілів до пластику та оцінювання числа клітин з адгезійними молекулами
CD11/CD18 на мембрані.
Існує кілька методів, що дають змогу виділити лімфоцити або їх окремі субпопуляції з
досліджуваного зразка: центрифугування в градієнті щільності, розеткоутворення, пенінг
(«просіювання» крізь основу) та магнітне розділення.
Визначення кількості Т-лімфоцитів. Дослідження проводять за допомогою проточної
цитофлуорометрії, імунофлуоресценції, імуногістохімічних методів, а також лімфоцитотоксичного
тесту. Для цього потрібні МкАТ до диференціювальних антигенів Т-лімфоцитів. За поверхневими
антигенними маркерами визначають популяцію та субпопуляцію клітин, стадію їх диференціювання
й активації. Специфічними антигенними детермінантами для Т-лімфоцитів є: CD3, CD4 (маркер Т-
хелперів), CD8 (маркер Т-кілерів) та ін. Визначають також «наївні» Т-клітини й клітини пам'яті
(відповідно CD45RA і CD45RO). Іноді досліджують субпопуляції хелперних клітин — індукторів
хелперів (CD4 CD29) та індукторів регуляторних клітин (CD4 CD45RO) і субпопуляції CD8-клітин
— прекілерів (CD8 CD11b) та попередників (CD8 Leu7).
Визначення кількості В-лімфоцитів. Методи основані на наявності на поверхні В-лімфоцитів
рецепторів для Fc-фрагмента імуноґлобулінів, для третього компонента (С3), для мишачих
еритроцитів та імуноглобулінових детермінант. Найважливішими поверхневими маркерами В-
лімфоцитів є МкАТ-рецептори CD19, CD20, CD22, які визначають за допомогою МкАТ методом
проточної цитометрії. Визначення В-клітин та ступеня їх зрілості є важливим при первинних
гуморальних імунодефіцитах, коли потрібно розрізнити агаммаґлобулінемію з В-клітинами та без
них.
Визначення кількості нульових лімфоцитів. У периферичній крові містяться так звані нульові
лімфоцити — клітини, які не належать до Т- та В-лімфоцитів, оскільки не мають антигенних
рецепторів або мають блоковані рецептори. Можливо, це незрілі лімфоцити чи старі клітини, які
втратили рецептори, або клітини, ушкоджені токсинами, імунодепресантами. Слід зазначити, що
70% людей мають 8 — 25 % нульових лімфоцитів. При багатьох захворюваннях число таких клітин
зростає внаслідок пошкодження клітин або циркуляції незрілих чи дефектних клітин. Визначення їх
кількості проводять, підраховуючи частку Т- та В-лімфоцитів у загальному вмісті лімфоцитів.
Кількісне визначення імуноґлобулінів. Найбільшого поширення набув метод Manchini et al.
(1965), основою якого є принцип радіальної імунодифузії в гелі, що містить моноспецифічну
сироватку проти імуноґлобулінів. Твердофазний імуноферментний аналіз, який також є
широковживаним унаслідок високої чутливості, використовується для визначення в сироватці
мінорних імуноґлобулінів IgD та IgE, а також класів і субкласів інших імуноґлобулінів.
Визначення рівня циркулюючих імунних комплексів (ЦІК) у сироватці. ЦІК є результатом
компенсаторної реакції антитілоутворення, спрямованої на елімінацію антигенів, і може
провокувати деякі патології: ревматизм, системний червоний вовчак, артрит та ін. Визначення
комплексів проводять методом спектрофотометрії сироватки крові, обробленої поліетиленгліколем
(М = 6000).
Методи оцінювання фагоцитарної активності клітин. Досліджують нейтрофіли периферичної
крові, бронхоальвеолярні та перитонеальні макрофаги. Проводять комплексне дослідження
функціональної активності фагоцитарних клітин, що дає змогу тестувати параметри, зміна яких
може свідчити про порушення толерантності до інфекції. За адгезію фагоцитів до об'єкта
фагоцитозу відповідають поверхневі рецептори — селектини та інтегрини (CD18, CD11a, CD11b,
СD11c, CD62L, CD62E), які визначають за допомогою МкАТ методом імунофлуоресценції.
Поглинальну здатність клітин оцінюють за фагоцитарною активністю та фагоцитарним індексом.
Вона порушується при деяких гострих і хронічних інфекційних захворюваннях, аутоімунних
процесах, імунодефіцитних станах.
Визначення бактерицидної активності фагоцитарних клітин. Тест відновлення нітросинього
тетразолію (НСТ-тест) відображає ступінь активації кисневозалежних механізмів бактерицидної
активності фагоцитарних клітин, в основі яких лежить активація НАДФ-Н
2
-оксидази і
гексозомонофосфатного шунта. Внаслідок реакції окиснення утворюються активні форми кисню,
які мають високу мікробоцидну активність; поява певної форми є показником функціональної
активності фагоцитарних клітин. Метод грунтується на відновленні поглинутого фагоцитом
розчинного барвника нітросинього тетразолію до нерозчинного диформазану під впливом
супероксиданіона, який утворюється в НАДФ-Н-оксидазній реакції. Іншим методом оцінювання
респіраторного вибуху у фагоцитах є вимірювання спонтанної та індукованої хемілюмінесценції.
НСТ-тест може бути також виміряний за допомогою проточного цитометра.
Визначення активності природних кілерів (НК) здійснюють різними методами. Кілерну
активність НК-клітин визначають колориметричним методом (Н.А. Кузнецова, 1991) за їх здатністю
лізувати клітини-мішені фібробластів мишей лінії L929, оброблених нейтральним червоним.
Активність НК-клітин можна також оцінювати, використовуючи клітини-мішені з радіоактивною
міткою, і за допомогою капілярного тесту, інформативність якого зростає за одночасного
підраховування кількості лімфоцитів з CD16-маркером. У першому випадку функціональну
активність НК-клітин визначають за клітиноопосередкованим цитолізом за виходом
51
Сr. Принцип
капілярного тесту полягає у поєднаному культивуванні клітин, що досліджуються, та клітин-
мішеней у плоскому капілярі з трипановим синім. Після інкубації підраховують забарвлені клітини-
мішені, їхня кількість відповідає відсотку спонтанної цитотоксичності. Активність природних
кілерів у донорів становить 10 — 25 %.

79
Для виявлення НК-клітин застосовують цитофлуорометричний метод визначення СD56-клітин і
експресії CD56 і CD3, CD56 і CD57, CD56 і CD16. Класичний фенотип НК-клітин – CD56CD57. До
фракції природних кілерів, які водночас мають активність К-кілерів (ефекторів антитілозалежної
клітинної цитотоксичності), входять клітини з фенотипом CD56CD16. Клітини з мембранним
фенотипом CD3 і CD16/56 належать до різновиду Т-лімфоцитів з активністю неспецифічних кілерів
(НК-клітини).
Визначення активності системи комплементу. Загальне її оцінювання здійснюється, як правило,
методом імунного гемолізу. Визначають С3-компонент комплементу за допомогою стандартної
преципітувальної моноспецифічної антисироватки. Нині різні компоненти та індивідуальні фактори
комплементу визначають імуноферментним методом за допомогою моноклональних антитіл.
Визначення HLA-антигенів лімфоцитів. Продукти головного комплексу гістосумісності (МНС) у
людей належать до системи лейкоцитарних антигенів HLA. Визначають HLA-антигени за
допомогою МкАТ методом проточної цитометрії або імунофлуоресценції, полімеразної ланцюгової
реакції (ПЛР), яка дає змогу виявити особливості, недоступні при традиційному серотипуванні.
Важливим є зв'язок між антигенними маркерами людини і розвитком тих чи інших захворювань.
Наприклад, здорові особини, які мають HLA-антиген DR3, відрізняються зниженою активністю
клітин макрофагальної системи, зниженою здатністю продукувати ІЛ-1, сповільненою деградацією
антигенів, сповільненим виведенням з організму комплексів антиген – антитіло, зниженням
здатності лімфоцитів до стимуляції мітогенами.
Полімеразна ланцюгова реакція (ПЛР) використовується для визначення малих кількостей
вірусних та мікробних інфекційних агентів, її модифікації застосовують для імунологічного аналізу
і при аналізі варіабельності генів Т- і В-клітинних рецепторів, а також для типування генів HLA.
ПЛР – це цикли синтезу (ампліфікації) специфічної ділянки ДНК-мішені за наявності
термостабільної ДНК-полімерази, дезоксинуклеозидтрифосфатів (дНТФ), відповідного сольового
буфера та олігонуклеотидних праймеірів, що визначають межі ділянки, яка ампліфікується. За 25 —
40 циклів отримують фрагмент ДНК, обмежений парою обраних праймерів, достатній для його
визначення за допомогою електрофорезу.
Для функціонального тестування Т- і В-лімфоцитів зазвичай використовують реакцію бластної
трансформації та міграції клітин, визначають кількість антитіл і цитокінів.
Реакція бласттрансформації лімфоцитів (РБТЛ) дає можливість визначити здатність клітин до
активації синтезу ДНК за наявності мітогенів. Бласти, що утворюються, здатні до подальшої
проліферації та диференціювання. Під час мітогенного стимулювання за допомогою мікроскопії
реєструються бласти або радіометричне оцінюється проліферативна здатність клітин за включенням
одного з попередників ДНК —
3
Н-тимідину. Як Т-клітинні мітогени використовують
фітогемаглютинін (ФГА) або конконавалін А (Кон А), а як В-клітинний мітоген — бактеріальний
ліпополіцукрид Е. соїі чи S. thyphimurium. Модель індукування тимусзалежної гуморальної
відповіді, яка здійснюється В-лімфоцитами за участю Т-хелперів, можна тестувати за здатністю до
відповіді на мітоген лаконосу.
Реакція гальмування міграції лейкоцитів (РГМЛ) характеризує функціональний стан Т-системи
імунітету. Метод ґрунтується на здатності сенсибілізованих Т-лімфоцитів у реакціях з антигенами
або мітогенами виділяти лімфокіни, що спричинюють гальмування міграції лейкоцитів. Для
виявлення цитокінів застосовують також імуноферментний, радіоімунний та інші методи.
Реакцію бляшкоутворення, або метод локального гемолізу в гелі, застосовують для визначення
В-клітин, що продукують IgM- та IgG-антитіла. Методом прямого локального гемолізу визначають
антигенспецифічні IgM-антитіла, а непрямим методом — IgG-антитіла, підсилюючи слабку
гемолітичну дію IgG-антитіл IgM-антисироваткою до IgG.
Визначення продукування цитокінів. Розчинні медіатори, або цитокіни, визначають як множину
різних біологічно активних молекул, що секретуються клітинами. Активність ІЛ-1 визначають
традиційними методами через посилення проліферації в культурах клітин за наявності мітогену.
Для цього використовують методи імуноферментного визначення цитокінів у сироватці крові та в
інших біологічних рідинах. За допомогою цих методів можна визначити рівень продукування
цитокінів та здатність клітин виробляти їх, крім того, вони дають можливість зіставляти активність
двох типів хелперів — Тх1 і Тх2, що сприяє вибору тактики імуномодулювальних впливів.
Оцінювання продукування інтерферону здійснюють за захистом клітин від дії вірусу мікрометодом,
використовуючи як клітини-мішені фібробласти мишей лінії L929 (Ф.І. Єршов, 1996). Рівень
фактора некрозу пухлин (ФНП) у сироватці визначають калориметричним методом (Е.А. Панютич і
співавт., 1992), оцінюючи тумороцидну дію ФНП на клітини-мішені — фібробласти мишей лінії
L929. Перерахунок цитотоксичного індексу (ЦІ), вираженого у відсотках, у міжнародні одиниці
(МО) здійснюють, визначаючи ЦІ стандартного розчину рифналіну з умістом ФНП 100 МО/мл.
Оцінювання антигенспецифічної імунної відповіді. Імунологічні методи, що ґрунтуються на
взаємодії антигену з антитілом (серологічні реакції, імунохімічний аналіз), широко застосовують
для діагностики. Використовуючи ці реакції, можна визначити наявність антитіл до певних
інфекційних агентів у сироватці чи виявити мікроорганізми в патологічному матеріалі. Висока
специфічність антитіл дає змогу ідентифікувати, виділяти чи кількісно визначати досліджуваний
антиген. Існує багато методів оцінювання антигенспецифічної імунної відповіді. Взаємодія антигену
з антитілом спричинює різні наслідки, а саме — преципітацію розчинних антигенів, аглютинацію
корпускулярних антигенів, нейтралізацію токсинів і вірусів, активацію комплементу.
Імунограма дає змогу точніше оцінити функціональний стан і характер патологічних змін імунної
системи. Одночасно оцінюють показники гемо- та імунограми. Кількісна характеристика клітин, що
випливає з імунограми, разом з функціональними показниками надає інформацію щодо
можливостей імунної реакції організму.
Для оцінювання стану Т-клітинного ланцюга імунітету використовують дані про наявність
відносного чи абсолютного Т-клітинного ІДС хелперного або цитотоксичного/регуляторного типу.
Кожний з них може мати гіпо- чи гіперваріант. Наприклад, у разі зниження загальної кількості Т-
лімфоцитів за рахунок CD4-за нормальної абсолютної кількості CD8-лімфоцитів роблять висновок
про наявність Т-клітинного ІДС хелперного типу відносного гіперцитотоксичного/регуляторного
варіанта. Це характерно для багатьох хронічних і рецидивних інфекцій. Вторинний Т-клітинний ІДС
цитотоксичного/регуляторного (зниження числа СD8-лімфоцитів) типу абсолютного (чи
відносного) гіперхелперного варіанта характерний для багатьох алергічних та аутоімунних
захворювань, особливо в поєднанні з ознаками активації В-клітинного ланцюга імунітету
(збільшення числа СD22-лімфоцитів, гіпергаммаґлобулінемія, підвищення рівня ЦІКів). При
абсолютному лімфоцитозі, зумовленому Т- і В-клітинами, роблять висновок про змішаний Т-
клітинний ІДС.
Для оцінювання В-клітинного (гуморального) ланцюга імунітету найчастіше визначають кількість
імуноґлобулінії основних класів.
Функціональну активність гуморального ланцюга імунітету визначають за рівнем сироваткових
антитіл після імунізації. Дані щодо рівнів циркулюючих імунних комплексів (ЦІК) мають велике
значення (особливо збільшення кількості ЦІКів середніх і малих розмірів) при захворюваннях з
аутоімунним компонентом і використавуються для передбачення їх рецидивів та загострень, а
також для показань до використання ефективних методів терапії.
Особливого значення набуває досліження функціональної та мікробоцидної ктивності фагоцитарних
клітин за наявості гнійних інфекцій з рецидивами. Визначення загальної гемолітичної активності
комплементу часто потрібне для виявлення природжених імунодефіцитів як скринінговий метод з
наступним вивченням окремих компонентів комплементу.
За даними аналізу імунограми визначають вид і тип ІД: Т-клітинний — хелперний,
цитотоксично/регуляторний з відносними чи абсолютними гіпо- та гіперваріантами; В-клітинний,
гранулоцитарний, моноцитарний, комплементарний, змішаний. З урахуванням наявності чи
відсутності клінічних ознак розрізняють ІД: компенсований, субкомпенсований або
декомпенсований. Проведення таких досліджень дає можливість вирішити питання про види та
методи імунокорекції.
21.2 ПРИНЦИПИ І ЗАСОБИ ІМУНОКОРЕКЦІЇ.
Імунокорекція, або імунотерапія, — це комплекс заходів, які передбачають активний вплив на
імунну реактивність організму за допомогою імунотропних засобів. Можливі три варіанти
імунокорекції: замісний, стимулювальний і пригнічувальний.
Характер корекції визначається конкретною метою. Наприклад, для профілактики інфекційних
захворювань призначають вакцини, сироватки, гаммаглобулін, тобто засоби замісної терапії. У
процесі лікування інфекційних захворювань крім хіміотерапевтичних засобів рекомендують
препарати, які стимулюють імунну систему. Імунокорекція, спрямована на пригнічення імунної
реактивності, застосовується при пересаджуванні органів і тканин.
При аутоімунних процесах, а також при деяких онкозахворюваннях підвищення ефективності
основних лікувальних заходів досягається завдяки комбінованій імунокорекції, тобто спільному або
альтернативному призначенню імунодепресантів та імуностимуляторів. До імунотропних методів
впливу крім медикаментозних належать йонізуюче випромінювання, УФО, лазерне та
короткохвильове електромагнітне випромінювання, видалення або трансплантація лімфоїдної
тканини, видалення імунних комплексів за допомогою гемосорбції або плазмоцитоферезу тощо.
Під час застосування імуноактивних репаратів потрібна індивідуалізація корекції, що зумовлено
об'єктивними передумовами, структурною організацією імунної системи, ступенем її ураження і
типологічною відмінністю порушень імунної системи при різних захворюваннях. Під типом
імунних розладів розуміють індивідуальні, генетично детерміновані або набуті особливості
імунного статусу, що визначаються відповідними методами імунологічного обстеження. Слід також
враховувати генетичну детермінованість метаболізму імуностимуляторів та імуносупресорів і
особливості фармакодинаміки препаратів, оскільки практично жоден із засобів не виявляє
вибіркової дії на неспецифічні фактори захисту та клітини, що беруть участь в імунній відповіді.
21.2.1. Імуномодулятори.
Імуномодулятори застосовують у медичній практиці для корекції природжених та набутих аномалій
імунітету, первинних і вторинних імунодефіцитів. До імуномодуляторів, або імунокорегувальних
засобів, належать засоби хімічної чи біологічної природи, здатні модулювати (стимулювати або
пригнічувати) реакції імунітету, впливаючи на імунокомпетентні клітини, процеси їх міграції або на
взаємодію таких клітин чи їхніх продуктів (лімфокінів, антитіл) з відповідними мішенями.
Нині через відсутність загальноприйнятої класифікації імуномодуляторів їх можна згрупувати за
принципом походження препарату.
Імуномодулятори бактеріального походження. Мішенню для препаратів мікробного походження
(рибомуніл, БЦЖ, пірогенал, продигіозан, паспат, ІРС 19, біостин та ін.) є клітини моноцитарно-
макрофагальної системи, природною функцією яких є елімінація мікроорганізмів. Препарати
зазвичай підсилюють функціональну активність цих клітин, стимулюючи фагоцитоз та
мікробоцидність, активують цитотоксичну функцію макрофагів, що виявляється у їхній здатності
руйнувати in vitro сингенні та алогенні пухлинні клітини. Як правило, активовані моноцити і
макрофаги починають синтезувати низку цитокінів: ІЛ-1, ІЛ-3, ФНП, колонієстимулювальні
фактори та ін. Наслідком цього є активація як гуморальної, так і клітинної ланок імунітету.
Імуномодулятори рослинного походження. Нині широко застосовують препарати елеутерококу,
лимоннику, женьшеню, родіоли рожевої, ехінацеї, зостерину, тонзилгону. Вони мають адаптогенну
дію на організм, підвищують резистентність до різних впливів хімічної та фізичної природи, а також
до деяких мікроорганізмів, знижують захворюваність на гострі респіраторні інфекції й грип.
Встановлено їх антистресорну дію. В експерименті адаптогени запобігають розвитку променевої
хвороби та знижують токсичність цитостатичних препаратів. Усі адаптогени малотоксичні і тому
можуть використовуватися тривалий час.
Імуномодулятори ендогенного походження. Ендогенні імуномодулятори — це велика група
олігопептидів, які можуть активізувати імунну систему через підсилення проліферації та функції
імунокомпетентних клітин. Результатом дії цих молекул є стимуляція природженого чи набутого
імунітету. В першому випадку мішенню для імуномодуляторів є клітини кісткового мозку,
попередники лімфоцитів і мононуклеарних фагоцитів. Ендогенні імуномодулятори представлені
цитокінами (молграмостин, або лейкомакс, реаферон, віферон, реальдирон, інтрон А, бетаферон,
ребіф, авонекс, беталейкін, ронколейкін), імуномодуляторами кістковомозкового (мієлопіди) і
тимусного (тактивін, тималін, тимонтин, тимостимулін, тимактид, вілозен) походження,
пептидними біорегуляторами з імунотропними властивостями — цитомединами (спленін,
берлопентин, кортексин, епітеламін, простатилен) та іншими біологічно активними речовинами
(табл. 63).
Аналіз наведених у табл. 63 даних свідчить, що ендогенні імуномодулятори впливають практично
на всі етапи імуногенезу, включаючи представлення антигену, проліферацію Т- і В-лімфоцитів,
утворення антитіл та цитотоксичних клітин, активацію макрофагів.
Імунотерапія з використанням сильнодіючих ендогенних імуномодуляторів, особливо інтерферонів
та інтерлейкінів, потребує постійного контролю стану хворого та моніторингу динаміки показників
імунітету. Багато імуномодуляторів діють опосередковано, через індукування або інгібування інших
імуномодуляторів, які на кінцевому етапі змінюють імунний статус людини.
Цитокіни. Інтерферони мають різну біологічну активність, що виявляється в їх противірусній,
протипухлинній та імуностимулювальній дії. Вони підвищують фагоцитарну здатність макрофагів,
стимулюють дію природних кілерів, посилюють активність поверхневих антигенів гістосумісності,
гальмують дозрівання моноцитів і макрофагів. Описано три типи інтерферонів (ІФН-α, β, γ) різного
походження, що різняться між собою за структурою, молекулярною масою і біологічною
активністю. Інтерферони α і β мають сильнішу противірусну активність, ніж інтерферон γ, але в
інтерферону γ більш виражена імуномодулювальна активність. Ці відмінності пов'язані з тим, що α і
β-інтерферони при противірусній дії активують фермент олігоаденілатсинтетазу, який сприяє
деградації мРНК під час реплікації вірусу. ІФН-γ не активує цей фермент, що, очевидно, і
послаблює противірусну активність. Порівняно з іишими інтерферонами ІФН-γ є сильним
імуностимулятором та індуктором неспецифічного захисту організму.
Інтерферон-альфа має властивість активувати Т-хелпери та макрофаги, завдяки чому його
використовують для імунокорекції у разі інфекційних захворювань та імунодефіцитів. При всіх
клінічних проявах ІФН-γ активує специфічний клітинний імунітет і стимулює природні кілери та
цитотоксичність макрофагів, підвищуючи неспецифічну резистентність організму. ІФН-γ є
протипухлинним засобом, який активує цитотоксичні клітини, стимулює кілерну активність
макрофагів, посилює експресію молекул гістосумісності І класу на пухлинних клітинах і сприяє
підсиленню розпізнавання пухлинних клітин лімфоцитами та представлення пухлинних антигенів
мононуклеарними фагоцитами. Необхідність такої активації лімфоцитів зумовлена пригніченням
їхньої функції метаболітами злоякісних клітин.
Індукторами інтерферону можуть бути різні речовини. Найважливішою властивістю індукторів
ІФН є їх універсальний діапазон противірусної активності, вони мають неспецифічну дію, що
полягає в інгібуванні росту клітин, модуляції їх диференціювання та утворенні рецепторів мембран.
Індуктори ІФН можуть модулювати специфічну імунну відповідь організму. Непряма їх дія на
клітини-мішені полягає в активації макрофагів, цитотоксичних Т-лімфоцитів,
антитілоутворювальних В-клітин та природних кілерів. Індуктори ІФН формують стійку
неспецифічну резистентність організму впродовж тривалого періоду після їх уведення. Індукована
резистентність пояснюється не тільки дією ендогенного ІФН, синтезованого у відповідь на введення
індуктора, оскільки він швидко виводиться з організму. Резистентність, очевидно, є наслідком
безпосереднього впливу індуктора ІФН на клітинний і гуморальний імунітет.
Динаміка синтезу індукованих ІФН та їх антигенний склад залежать також від хімічної структури
індуктора, способу його застосування та популяції стимульованих клітин-мішеней. Індуктори ІФН
органічно доповнюють препарати ІФН. Ендогенна інтерферонізація має переваги над уведенням
препаратів екзогенного ІФН, оскільки при цьому виробляється власний ІФН, який на відміну від
рекомбінантних ІФН, не має антигенної активності. ІФН стимулює неспецифічну цитотоксичність і
зумовлює експресію молекул МНС у тих популяціях клітин, які, як правило, не експресують ці
антигени, що може стати причиною посилення аутоімунної відповіді організму. Після введення
індукторів ІФН такої небезпеки немає, синтез ІФН збалансований і піддається контролю
механізмами, які забезпечують захист від перенасичення ІФН.
За хімічним складом розрізняють індуктори ІФН природного і синтетичного походження, які
стимулюють утворення альфа-, бета-, гамма-типів інтерферонів, збільшують продукування
імуноґлобулінів М, A, G, відновлюють співвідношення субпопуляцій Т-лімфоцитів. Серед речовин
синтетичного походження є низькомолекулярні сполуки (флуоренони, акридони) та полімери
(полінуклеотиди), які мають такі комерційні назви: аміксин, камедон (циклоферон, неовір),
ампліген, полудан, полігуацил. Природні сполуки, такі як низькомолекулярні поліфеноли
рослинного походження (похідні госиполу) та полімери (двоспіральні РНК), мають назви мегасин,
кагоцил, саврал, рагосин, гозалідон, ларифан, радостин.
До індукторів ІФН належать також колонієстимулювальні фактори (КСФ). Кровотворення
відбувається за рахунок окремих клітин, що утворюють клони і мають певний напрям
диференціювання. Є кілька типів колонієстимулювальних факторів: мультиКСФ (ІЛ-3),
гранулоцитарний КСФ (Г-КСФ), моноцитарний (М-КСФ) і гранулоцитарно-моноцитарний (ГМ-
КСФ). Основна функція КСФ — підтримання росту клітин — попередників макрофагів і
гранулоцитів. КСФ продукуються клітинами кістковомозкового оточення (ендотеліоцитами,
фібробластами), а також активованими Т-лімфоцитами, макрофагами та клітинами мікроглії. За
хімічним складом КСФ є глікопротеїнами. їх синтез відбувається під дією індукторів — цитокінів,
мікроорганізмів — і продуктів їхньої життєдіяльності та багатьох лікарських препаратів.
Використання КСФ у клінічній практиці грунтується на їхній здатності підтримувати проліферацію
клітин-попередників. Інтерлейкіни -1, -4, -6, -7 та ФНП можуть потенціювати їх дію. Він активує
метаболізм гранулоцитів і макрофагів, сприяючи посиленню імунних та запальних реакцій, тобто
підвищує резистентність організму до чинників навколишнього середовища. Серед них —
рекомбінантний людський гранулоцитарний КСФ (Г-КСФ), відомий ще під назвою граноцит
(ленограстим), нейпоген (філграстим), гранулоцитарно-моноцитарний КСФ, молграмостим
(лейкомакс).
Фактор перенесення (ФЯ) клітинного імунітету є індуктором продукування інтерферону та інших
цитокінів. Одним з актуальних і перспективних завдань сучасної імунології є пошук ефективних
імуномодуляторів, здатних за короткий проміжок часу підсилити антигенспецифічну імунну
відповідь і безпосередньо вплинути на Т-клітинну ланку імунної відповіді, не спричинюючи при
цьому негативних системних реакцій, пов'язаних з антигенними властивостями чужорідних
субстанцій. У країнах Заходу фактор перенесення клітинної імунної реактивності (трансфер-фактор)
застосовують як терапевтичний препарат для лікування багатьох захворювань, які супроводжуються
або спричинені пригніченням функцій імунної системи, таких як імунодефіцити, хронічні інфекції,
злоякісні пухлини та ін.
Вивчено вплив ФП на основні ланки імунної відповіді — клітинну, гуморальну імунну відповідь,
фактори неспецифічної резистентності та встановлено його фізико-хімічні властивості (А.Ю.
Вершигора зі співавт., 1996; Luybchenko et аl., 2003). Досліджено фармакологічні властивості
отриманих препаратів. Препарати ФП імунної реактивності значно посилюють фагоцитарну й
бактерицидну активність макрофагів, ПМЯЛ, природних кілерів, продукування антитіл,
стимулюють проліферативну активність СКК, активують лімфоцити, індукують продукування ІФН,
ФНП, ІЛ-1 та ІЛ-2. ФП здатний індукувати активний імунітет в імунодефіцитних реципієнтів.
Доведено можливість перенесення за короткий термін антигенспецифічного
клітиноопосередкованого імунітету за допомогою фактора перенесення. Така сенсибілізація не
спричинює побічні реакції. Завдяки відсутності міжвидових бар'єрів можна застосовувати фактор
перенесення, отриманий від імунізованих відповідним антигеном тварин або синтезований in vitrо
клітинною лінією лімфоцитів-продуцентів.
Інтерлейкіни. До імуномодуляторів ендогенного походження належать також інтерлейкіни, що
стимулюють проліферацію і диференціювання лімфоцитів та мононуклеарних фагоцитів. Вони
необхідні для кооперації клітин імунної системи в реалізації етапів імунної відповіді. На основі
цитокінів розроблено кілька препаратів для терапії злоякісних пухлин та впливу на кровотворення.
Інтерлейкін-ІЛ3 (беталейкін). Основною властивістю цього препарату є здатність відновлювати
кровотворення. Механізм дії беталейкіну на реконституцію кісткового мозку відрізняється від КСФ
тим, що він активує не лише пізні попередники кровотворення, а й стимулює проліферацію
стовбурових клітин та експресію рецепторів. Крім того, беталейкін стимулює продукування всіх
типів колонієстимулювальних факторів різними клітинами організму, зокрема клітинами
мікрооточення кісткового мозку, фібробластами та макрофагами.
Інтерлейкін-2 (ронколейкін) застосовують в онкологічній практиці для стимулювання
протипухлинного імунітету і в терапії імунодефіцитних станів. ІЛ-2 — активатор Т-лімфоцитів, для
яких він є основним фактором проліферації та диференціювання. За певних умов ІЛ-2 активує
моноцити, макрофаги, В-лімфоцити та природні кілери, а також лімфокінактивовані кілери, що
беруть участь у контролі виникнення злоякісних клітин та їх знищенні.
Інтерлейкін-3. ІЛ-3 є мульти-КСФ, дає значний клінічний ефект при лікуванні вторинної
недостатності кістковомозкового кровотворення, спричиненої хіміо- та радіотерапією, поширеної
мієломи, неходжкінської лімфоми, тератоми та при пухлинних процесах.
Інтерлейкін-10 відомий як фактор, що інгібує продукування практично всіх протизапальних
цитокінів — ІЛ-1, ІЛ-2, ІЛ-6, ІЛ-8 та ФНП. Тому його основні біологічні властивості пов'язані з
імунодепресією. ІЛ-10 пригнічує функцію Т-клітин, інгібує фізіологічну активність макрофагів.
Водночас він активує В-клітини, підсилюючи їх проліферацію та секрецію імуноґлобулінів, і
збільшує функціональну активність природних кілерів. Перспективними для застосування є й інші
інтерлейкіни — ІЛ-4, ІЛ-5, ІЛ-6, ІЛ-11, ІЛ-12, ІЛ-16.
Імуномодулятори кістковомозкового походження. Мієлопід належить до класу мієлопептидів —
імунорегуляторів кістковомозкового походження, отриманий екстракцією з культури клітин
кісткового мозку ссавців, знижує рівень продукування ІЛ-2 та активує Т-супресорні/цитотоксичні
клітини. При імунодефіцитних станах відновлює кількісні й функціональні показники Т- і В-систем
імунітету, стимулює функціональну активність фагоцитів. У складі препарату виявлено пептиди з

80
опіоїдною активністю, що свідчить про його можливу участь у регулюванні взаємодії нервової та
імунної систем.
Імуномодулятори тимусного походження. Новий клас біологічно активних сполук — це тимічні
пептидні гормони. Природні гормони Т-системи імунітету представлені родиною тимозинів,
тимопоетинів та сироватковим тимічним фактором (тимуліном). Ці гормони продукуються
клітинами загруднинної залози і забезпечують гуморально-регуляторний зв'язок центральної та
периферичної складових імунної системи. Регуляторні тимічні пептиди, або гормони тимуса,
секретуються у кров і здійснюють дистанційне керування клітинами периферичної імунної системи,
спричинюючи стимуляцію їх диференціювання та дозрівання, активацією лімфоїдних клітин
продукування цитокінів. Дія препаратів та активація лімфоїдних клітин пептидними гормонами
тимуса, як і дія інших регуляторних пептидів, здійснюється універсальним способом — утворенням
у цитоплазмі вторинних месенджерів: цАМФ та йонів кальцію, інозилтрифосфату, діацилгліцеролу
з наступним передаванням сиґналу різним індукторам. Низка пептидних гормонів тимуса, такі як
тимозин-альфа-1 та тимопоетин, крім зміни продукування цАМФ спричинюють стимуляцію синтезу
вторинних медіаторів — простагландинів групи Е, дія яких реалізується, ймовірно, через цГМФ.
На фоні порушених функцій імунної системи організму введення поліпептидів тимуса (тималіну,
тимактиду і Т-активіну) сприяє відновленню субпопуляцій Т-лімфоцитів та їх функціональній
активності.
Імуноґлобуліни. Октагам містить людський нормальний імуноґлобулін G та імуноґлобуліни А і
М. Імуноґлобуліни мають широкий спектр специфічних антитіл до багатьох мікроорганізмів.
Показанням до застосування є замісна та імуномодулювальна терапія.
Сандоґлобулін — полівалентний імуноґлобулін (до 95 % IgG) людини, який застосовують у разі
порушення функції імунного захисту, при тяжких бактеріальних та вірусних інфекціях, для
профілактики і лікування інфекцій, при терапії цитостатиками та імунодепресантами, при
синдромах імунодефіциту.
Пентаглобін містить протеїни плазми людини (імуноґлобуліну понад 95 %), IgM – 6 мг, IgA – 6,
IgG – 38 мг. Має широкий спектр опсонізуючих та нейтралізуючих антитіл.
Синтетичні препарати. Лікопід — аналог мінімального компонента клітинної стінки бактерій —
речовина, з якою пов'язаний імуностимулювальний ефект БЦЖ. У низьких дозах лікопід підсилює
поглинання бактерій фагоцитами, утворення ними активних форм кисню, бактерицидну та
протипухлинну дію in vitro, стимулює синтез ІЛ-1 та ФНП. Останні активують Т- і В-лімфоцити,
наслідком чого є підсилення антитілоутворення та реакцій клітинного імунітету.
Імунофан — гексапептид, синтетична похідна гормону тимопоетину. Фармакологічна дія препарату
ґрунтується на корекції імунної та окисно-антиокисної системи організму. Дія препарату
виявляється через 2 — 3 год (швидка фаза) і триває до 4 міс. (середня та повільна фази).
Тимоген здійснює регулювальний вплив на клітинний і гуморальний імунітет, стимулює процеси
регенерації, поліпшує процеси клітинного метаболізму, підсилює процеси диференціювання
лімфоїдних клітин, індукуючи експресію диференціювальних антигенів на лімфоцитах, нормалізує
кількість субпопуляцій Т-лімфоцитів та їх співвідношення у хворих з різними імунодефіцитними
станами, є складовою препарату цитовір.
Левамізол (декарис) стимулює функцію Т-лімфоцитів і фагоцитарних клітин. Застосовують при
інфекційних захворюваннях, затяжних вірусних гепатитах, імунодефіцитних і аутоімунних
захворюваннях, злоякісних пухлинах, лімфогранулематозі та лейкозах.
Дибазол діє на організм по-різному. Має судинорозширювальну та спазмолітичну дію, стимулює
функції деяких відділів центральної нервової системи, виявляє властивості адаптогену, підвищуючи
резистентність організму, стимулює продукування поствакцинальних антитіл, підсилює
фагоцитарну активність лейкоцитів, підвищує бактерицидні властивості, стимулює утворення ІФН у
клітинах. Застосовують для комплексного лікування вірусних інфекцій.
Ізопринозин (ізоніплекс) містить інозин і параацетобензоат. Ефективність цього комплексу
визначається інозином, другий компонент забезпечує його доступ до лейкоцитів. Ізопринозин
інгібує реплікацію як ДНК-, так і РНК-вірусів, збільшує кількість Т-лімфоцитів та ІЛ-2, природних
кілерів. Препарат змінює співвідношення субпопуляцій Т-лімфоцитів, стимулює хемотоксичну та
фагоцитарну активність моноцитів, макрофагів (продукування ІЛ-1); підсилює синтез РНК і
рибосомального білка, одночасно перешкоджає використанню рибосомальної РНК для
розмноження вірусу. Застосовують при вірусних захворюваннях та зниженій резистентності
організму.
Копаксон — суміш синтетичних поліпептидів, утворених амінокислотами, що входять до складу
основного білка мієліну. Конкурує з основним білком мієліну та олігодендроцитарним
глікопротеїном мієліну, протеоліпідним білком за зв'язування з молекулами МНС класу II на
поверхні клітин. Застосовують для лікування розсіяного склерозу.
Ферментні препарати. Вобензим, флогензим, мулсат та ін. – стабільні суміші ензимів рослинного
й тваринниго походження. Вобензим і мулсат, які додатково містять рутин, збільшують кількість Т-
лімфоцитів, функціональну та цитотоксичну активність макрофагів і ПКК, ліквідують імунні
комплекси, сприяють утворенню ФНП-α, ІЛ-1 та ІЛ-б. Препарати використовуються при
аутоімунних, імунокомплексних та вірусних захворюваннях, мають фібринолітичну активність.
Наведений перелік вітчизняних і зарубіжних препаратів не вичерпує весь набір імуностимуляторів.
Лікарські засоби мають імунотропну активність. Наприклад, вітаміни та інші засоби
загальнозміцнювальної терапії, деякі антибіотики в малих дозах виявляють імуностимулювальні
властивості.
21.2.2. Ад'юванти.
Ад'юванти — речовини, які неспецифічно посилюють імунну відповідь на антигени. Відомо, що за
високого ступеня очищення антигену його імуногенність зменшується.
На відміну від імуномодуляторів, які застосовують для нормалізації зміненої імунної реактивності,
ад'юванти використовують для посилення імунної відповіді у здоровому організмі, для вакцинації
та у лабораторній практиці для імунізації тварин. Вони формують депо, яке знижує розсмоктування
і пролонгує вплив антигену на клітини імунної системи. Стимулювальні властивості виявляються за
умови одночасного їх уведення з антигеном або незадовго до його введення. За походженням
ад'юванти поділяють на: мінеральні (мінеральні колоїди, розчинні речовини, кристалоїди), органічні
речовини рослинного і тваринного походження (олії, жири, вуглеводи, сапоніни), мікробні
(корпускулярні та субодиничні структури, мембранні й рибосомальні фракції, білки, нуклеїнові
кислоти, ліпіди, вуглеводи, ЛПЦ-білкові комплекси), цитокіни (природні цитокіни, пептиди),
синтетичні речовини (полінуклеотиди, пептиди, глікопептиди, олігопептиди, поліелектроліти),
препарати тимусного (Т-активін, тималін, тимопоетин, тимактид, тимостимулін, вілозен) і
кістковомозкового походження (мієлопід і його пептиди), складні штучні ад'ювантні системи
(мікросоми, мікрокапсули тощо).
Дія ад'ювантів залежить від вихідного імунного статусу. Найсильніші ад'юванти містять
мікроорганізми або їхні субстанції, які активують макрофаги та АПК. Залежно від властивостей
ад'юванти стимулюють гуморальний чи клітинний імунітет або водночас обидва види імунітету.
Так, мінеральні сорбенти і неповний ад'ювант Фрейнда спричинюють утворення антитіл, імовірно,
активуючи диференціювання Тх2-хелперів. Повний ад'ювант Фрейнда (ПАФ), основним
компонентом якого є вакцина БЦЖ, активує Тх1-клітини і стимулює переважно розвиток
клітиноопосередкованого імунітету типу ГСТ. ПАФ через можливі побічні ефекти використовують
лише для експериментальних досліджень. Механізм дії ад'ювантів полягає у створенні «депо»
антигену, затриманні його всмоктування, виникненні запальної реакції, посиленні реакції з боку
лімфатичних вузлів, зміні фізико-хімічних властивостей антигену, стимуляції синтезу білків,
активації системи комплементу, посиленні процесингу, презентації антигену Т-клітинам і функції
допоміжних клітин, прискоренні транспортування антигену до імунокомпетентних клітин,
стимуляції проліферації, диференціювання та функціональної активності Т- і В-клітин, їх взаємодії,
утворення цитокінів.
Є два основних способи дії ад'ювантів: через зміну властивостей антигену і через стимуляцію
функцій імунної системи організму. Вплив ад'ювантів на властивості антигену здійснюється через
зміну його структури, молекулярної маси, полімерності, розчинності та інших фізико-хімічних
параметрів. Імуногенність вакцин перебуває у прямій залежності від розміру і полімерності молекул
антигену, а імуногенність низькомолекулярних антигенів (гаптенів) — від їх епітопної щільності.
Гаптени мають слабкі антигенні та імуногенні властивості й потребують носіїв, що є
високомолекулярними субстанціями. Утворений з носієм комплекс має специфічності для гаптену,
носія і для ділянок взаємодії гаптену з носієм. Носій сприяє транспортуванню кон'югату
допоміжним клітинам, що беруть участь у процесингу і взаємодії з Т-хелперами, специфічними для
гаптену. Носії перетворюють Т-незалежну імунну відповідь на Т-залежну.
Пептидні, рекомбінантні й високоочищені вакцини є низькомолекулярними сполуками і потребують
носіїв. Для цього використовують синтетичні великомолекулярні речовини, продукти мікробного
походження, наприклад правцевий і дифтерійний анатоксини, та ендогенні білки. Особливо
перспективними сполуками такого класу є людські імуноґлобуліни та їхні фрагменти, що не
спричинюють імунної реакції організму. Тафтсин — тетрапептид, виділений із шарнірної частини
Fc-району імуноглобулінів, застосовується не тільки як самостійний модулятор, а й як носій для
чужорідних пептидів.
21.2.3. Імуносупресори.
1муносупресори (імунодепресанти) — препарати, які пригнічують реакцію імунітету внаслідок
зниження функції клітин імунної системи. До них належать: стероїди (кортизон, гідрокортизон та
ін.), антиметаболіти — антагоністи пурину (меркаптопурин, азатіоприн) та антагоністи фолієвої
кислоти (метотрексат), алкілувальні сполуки (циклофосфан, циклофосфамід, мілеран, хлорбутин),
алкалоїди (вінкристин), антибіотики (актиноміцин-С, -D, хлорамфенікол, циклоспорин А).
Імунодепресивну дію мають також нестероїдні протизапальні засоби, гепарин, препарати золота,
пеніциламін, похідні 4-амінохіноліну та інші лікарські препарати. Проте імунодепресивний ефект у
них виражений слабко і розвивається дуже повільно, тому їх нерідко називають «малими»
імунодепресантами. Показанням для призначення імуносупресивної терапії є трансплантація
органів або клітин, аутоімунні захворювання, що супроводжуються системними та
органоспецифічними порушеннями. При лікуванні запальної патології значне місце посідає терапія
протизапальними засобами. Тяжкі форми перебігу чи короткі ремісії є показанням для призначення
імуносупресивної терапії. Для деяких лікарських засобів неможливо розмежувати протизапальну
дію та імуносупресивний ефект (глюкокортикоїди, метотрексат). Оскільки в імунній реакції з усіх
наявних лімфоцитів бере участь мала кількість специфічних клонів, ідеальним вирішенням
терапевтичного завдання було б виключення таких клонів. Однак цього неможливо досягти через
велику кількість різних рецепторів (приблизно 10
8
на клітинній мембрані одного лімфоцита).
Імуносупресивна терапія дає змогу лише неспецифічно впливати на лімфоцити. Деякі препарати за
меншого дозування можуть стимулювати окремі ланцюги імунної системи і замість
імуносупресорної дії здійснювати імуностимулювальний вплив. Імуностимуляцію відмічають при
використанні азатіоприну, 6-меркаптопурину, 5-бромурацилу, 5-фторурацилу, 5-
бромдезоксіуридину, колхіцину, актиноміцину-D, циклофосфаміду та інших антимітотичних
препаратів.
Глюкокортикостероїди. Імуносупресивний ефект глюкокортикостероїдів зумовлений зміною
синтезу цитокінів, насамперед ІЛ-1 та ІЛ-2, які беруть участь в активації лімфоцитів.
Глюкокортикоїди знижують синтез або активність таких речовин, як інтерферони, субстанції, що
стимулюють природні кілери, простагландини, лейкотрієни, брадикініни, фактор активації
тромбоцитів, гістамін та нейтральні протеази.
Використання глюкокортикоїдів гальмує активацію Т-лімфоцитів та клітинні імунні реакції. Синтез
антитіл не порушується або обмежується за високих доз препарату. Глюкокортикоїди також
зменшують надходження лімфоцитів у ділянку клітиноопосередкованих імунних реакцій. Крім того,
зменшується активність макрофагів, що частково пов'язано зі зниженням продукування лімфокінів,
а також їх чутливості до дії лімфокінів. Ці препарати поряд із сильною імунодепресивною
виявляють швидку протизапальну дію.
Протизапальний ефект кортикостероїдів характеризується пригніченням усіх фаз запалення
переважно завдяки стабілізації лізосомальних мембран та гальмуванню поділу фібробластів.
Найважливішими з них є преднізолон, метилпреднізолон, дексаметазон, бетаметазон.
Антиметаболіти. Азатіоприн (6-меркаптопурин). Антагоніст пурину. Гальмує синтез пуринових
нуклеотидів, вбудовуючись у ДНК, порушує їх функцію. Клітини гинуть. Азатіоприн сильніше
уражує Т-лімфоцити, ніж В-лімфоцити, тому насамперед впливає на клітинні імунні реакції.
Застосовують при трансплантації органів і тканин, аутоімунних захворюваннях.
Метотрексат. Антагоніст фолієвої кислоти. Гальмує активність дигідрофолатредуктази, внаслідок
чого зменшується утворення тетрагідрофолієвої кислоти, яка бере участь у перенесенні метилових
груп, знижується утворення тимідину і пуринових основ, що призводить до порушення
функціонування та загибелі клітини. В-лімфоцити чутливіші до дії метотрексату, ніж Т-лімфоцити,
тому здебільшого відмічається порушення антитілоутворення, ніж клітинних імунних реакцій.
Застосовують при онкологічних захворюваннях і лейкозах.
Алкілувальні сполуки. Циклофосфамід. Алкілувальний цитостатик, який використовують при
онкологічних захворюваннях, трансплантації, аутоімунних захворюваннях. Має анти-ДНК-
активність, гальмує реплікацію клітин, що діляться. Лімфоцити дуже чутливі до циклофосфаміду.
Після застосування препарату число Т- і В-лімфоцитів зменшується, тому відповідно ушкоджується
гуморальний (продукування антитіл) та клітинний імунітет. При малому дозуванні гальмуються
переважно клітинні реакції. У дозах, менших ніж 1 мг/кг на добу, можуть підсилитися імунні
процеси, оскільки регуляторні Т-лімфоцити особливо чутливі до дії циклофосфаміду.
Імунодепресанти першого покоління невибірково ушкоджують усі клітини, що діляться або беруть
участь в імунній відповіді, а також злоякісні клітини. Неспецифічність дії призводить до порушень
гемопоезу та оновлення тканин, пригнічення всіх форм імунної відповіді, в тому числі й захисту від
інфекції. Останнім часом створено новий препарат, в якому враховано недоліки імунодепресантів
першого покоління, — циклоспорин.
Антибіотики. Циклоспорин (санд-імун, неорал). Циклічний поліпептид. Продукується грибом
Tolypocladium іпflatum і синтезується хімічно. Пригнічує утворення ІЛ-2 та інших цитокінів.
Циклоспорин гальмує переважно активацію Т-лімфоцитів, внаслідок чого здебільшого блокуються
клітинні реакції імунітету. На відміну від інших цитостатичних агентів, він не пригнічує гемопоез і
не впливає на функцію фагоцитів. Застосовують при трансплантації органів і тканин, аутоімунних
захворюваннях.
Із Streptornyces tsukabaensis виділено речовину FK 506 з іншою хімічною структурою, але подібним
механізмом дії. При цьому було відкрито новий клас біологічно активних молекул — імунофілінів.
Потрапляючи в клітину, циклоспорин А і FK 506 взаємодіють кожний зі своїм рецептором —
імунофіліном. У процесі зв'язування утвореного комплексу з кальциневрином блокується ланцюжок
процесів, зокрема експресія гена ІЛ-2. Отже, циклоспорин А і FK 506 блокують активацію Т-
лімфоцитів та утворення ІЛ-2, не вбиваючи клітини.
Інший вплив здійснює рапаміцин, який виділено зі Streptornyces hygroscopicus. У цьому разі
зв'язування рапаміцину з рецептором впливає не на кальциневрин, а інактивує одну з протеїнкіназ,
яка бере участь в активації гена рецептора ІЛ-2. Блокується сприйняття сигналу ІЛ-2, через що
активовані Т-клітини не ушкоджуються.
Алкалоїди. Вінкристин, вінбластин блокують мітоз клітин у метафазі, пригнічують синтез білків і
ДНК, гліколіз. У практиці імунодепресивної терапії застосовують алкалоїди барвінку рожевого —
вінкристин і вінбластин. Вінкристин активніший, ніж вінбластин, переважно впливає на лімфоцити і
має порівняно з вінбластином менш виражену мієлодепресивну дію. Показаннями для застосування
є пухлинні процеси, гемолітична анемія, трансплантація.
Практичне значення імунодепресивної терапії полягає насамперед у тому, що вона дає змогу
успішно здійснювати пересаджування органів і тканин. Проте застосування імунодепресантів для
лікування аутоімунних захворювань виявилося недостатньо ефективним, що зумовлено
неспецифічною активністю та високою токсичністю цих препаратів. Ускладнення, які
спричинюються імунодепресантами, є надзвичайно небезпечними, і їх слід враховувати щоразу при
вирішенні питання щодо доцільності проведення імунодепресивної терапії.
ВИСНОВКИ.
Спектр імунологічних методів постійно розширюється. Ті, що найбільше використовуються,
описані в цьому розділі. В основу імунодіагностики покладено методи оцінювання стану клітинного
і гуморального імунітету, факторів природної резистентності та специфічного імунітету з
використанням серологічних, імунофлуоресцентних та імуноферментних методів, клітинного
аналізу, що ґрунтується на проточній цитометрії й застосуванні імунодіагностичних реагентів,
новітніх технологій та приладів. Моноклональні антитіла, рекомбінантні продукти та біосенсори є
важливими імунодіагностичними реагентами.
Імунорегуляція ґрунтується на контролі та регуляції імунної відповіді. Імунокорекція та
імунотерапія передбачає вплив на перебіг активності імунологічних процесів за допомогою
імуностимуляторів, імуномодуляторів або імунодепресантів. Імунокоригувальні засоби широко
використовуються для терапії імунодефіцитних станів різної етіології, аутоімунних процесів, при
трансплантації тканин і органів. Відомі та інтенсивно розробляються методи впливу на специфічні
імунні процеси.
Створення нових імуномоделювальних засобів є результатом пізнання певних ланок імунних
процесів. Спостерігається значне розширення спектра препаратів на основі цитокінів. Ймовірно, що
перевагу віддаватимуть адоптивній цитокінотерапії з широким використанням перенесення клітин,
трансфекованих різними генами або оброблених на генному рівні.
Контрольні запитання.
1. Схарактеризуйте методи оцінювання функціональної активності Т-клітинної та В-клітинної ланок
імунітету.
2. Які методи застосовують для визначення функціональної активності фагоцитарних клітин?
3. Як проводять дослідження функціонального стану і характеру патологічних змін імунної
системи?
4. Імуномодулятори, класифікація за походженням та біологічною активністю.
5. Біологічна активність імуномодуляторів ендогенного походження.
6. Імуномодулювальна дія цитокінів.
7. Імуносупресори, їх імуномодулювальна дія, застосування.
РОЗДІЛ 22. ІМУНОБІОТЕХНОЛОГІЯ.
Сучасну імунологію можна розглядати у двох взаємопов'язаних аспектах: по-перше, як науку, що
вивчає механізми функціонування імунної системи і використання отриманих даних для
діагностики, профілактики й лікування багатьох хвороб, пов'язаних із функціонуванням цієї
системи: інфекцій, аутоімунних процесів, алергій, раку тощо; по-друге, як наукову основу однієї з
галузей біотехнології – імунобіотехнології, що здатна забезпечити виробництво речовин, потрібних
не тільки для впливу на саму імунну систему і для медицини взагалі, а й конче необхідних для
багатьох наукових і прикладних галузей, в яких потрібна індикація біоорганічних субстанцій,
вірусів, бактерій. Основою такого застосування є надзвичайна точність і чутливість імунологічних
методів. Великі перспективи має також використання антитіл, наприклад, для виділення
біоорганічних сполук у чистому вигляді імуносорбентними методами, у спрямованому транспорті
лікарських препаратів тощо.
Біотехнологія — галузь прикладної діяльності людини, що ґрунтується на знаннях і методах
біохімії, мікробіології, генетики, імунології, хімічної технології і дає змогу отримувати користь із
властивостей мікроорганізмів і культур клітин у промислових процесах. Біотехнологію розглядають
як промислове використання біологічних процесів та агентів на основі отриманих
високоефективних форм мікроорганізмів, культур клітин, тканин рослин і тварин із заданими
властивостями, метаболізм та біосинтетичні можливості яких забезпечують продукування
специфічних речовин, що використовуються людиною. У промисловому масштабі біотехнологія
перетворюється на біоіндустрію.
Розвиток біотехнології невіддільний від стрімкого пізнання життєвих процесів, а результати
фундаментальних досліджень життєвих явищ на клітинному та молекулярному рівнях, у свою
чергу, тісно пов'язані з технічним прогресом і технологічними нововведеннями. Особливого
поштовху розвитку й становленню сучасної біотехнології взагалі та імунобіотехнології зокрема
надали фундаментальні відкриття в молекулярній біології, що сталися в другій половині XX ст.
До імунобіотехнологічних відносять усі процеси, пов'язані з отриманням та використанням у
практиці речовин і сполук, які впливають на функціонування імунної системи людини.
Традиційними процесами, що належать до імунобіотехнології, можна вважати культивування
мікроорганізмів у технічних масштабах для виготовлення діагностичних препаратів і вакцин,
отримання антитіл із сироватки крові імунізованих тварин для створення діагностикумів та для
терапевтичного використання специфічних гаммаґлобулінів у лікуванні багатьох інфекційних
хвороб тощо.
22.1. ОТРИМАННЯ СУЧАСНИХ ДІАГНОСТИЧНИХ ПРЕПАРАТІВ.
Медицина здавна успішно використовує досягнення природничих наук, а також інтенсивно
застосовує нові технології для діагностики й лікування захворювань. Профілактику та лікування
будь-якого інфекційного захворювання значно полегшує рання і точна ідентифікація патогенного
мікроорганізму (бактерій, вірусів, мікроскопічних грибів, найпростіших), що його спричинив. Для
проведення діагностики традиційно потрібно спочатку виростити культуру потенційно патогенного
мікроорганізму і лише потім проаналізувати його властивості. Хоча подібні тести дуже ефективні і
мають досить високу специфічність, вони часто займають багато часу і є високовартісними. Крім
того, можливість виявлення патогенних мікроорганізмів, які важко виростити в культурі або які
взагалі не піддаються культивуванню, дуже обмежена.
Будь-який метод виявлення патогенних мікроорганізмів має бути досить простим і
високоспецифічним та чутливим. Специфічний діагностичний тест повинен давати позитивну
відповідь тільки на мікроорганізм або молекулу-мішень і виявляти дуже малі кількості такої мішені
навіть на фоні інших мікроорганізмів чи молекул, що забруднюють зразок. Простота методу
передбачає, що він є досить продуктивним, ефективним і недорогим для рутинного застосування.
Останнім часом традиційні мікробіологічні та імунологічні методи лабораторної діагностики
інфекційних захворювань поповнилися новими, заснованими на використанні молекулярно-
генетичних технологій (табл. 64).
Синтетичні антигени. Традиційні процедури діагностики збудників інфекції спираються або на
набір характеристик патогенного мікроорганізму, або, що важливіше, на одну унікальну, легко
